Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 1, стр. 14-22
ФАЗОВАЯ ВРЕМЕННАЯ ЗАДЕРЖКА МЕЖДУ РИТМАМИ ЭЭГ ЧЕЛОВЕКА В УСЛОВИЯХ ВЫБОРА ПОВЕДЕНИЯ, СВЯЗАННОГО С РИСКОМ
А. В. Залешин 1, Г. Х. Мержанова 1, *
1 Федеральное государственное бюджетное учреждение науки
Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: merzhan@ihna.ru
Поступила в редакцию 03.07.2017
После доработки 23.01.2018
Принята к публикации 05.03.2018
Аннотация
У людей с разной склонностью к риску исследовались фазовая синхронность ритмов и фазовая временная задержка момента достижения нулевой фазы одним ритмом относительно момента достижения нулевой фазы другим ритмом в диапазонах тета, альфа, бета для выявления особенностей ЭЭГ. Было сделано предположение, что большие временные задержки между ритмами обусловлены совокупной нейронной активностью анатомически раздельных, независимых (по активации/торможению) ансамблей. В работе были выявлены особенности ритмов ЭЭГ, характерные для разных групп испытуемых, с использованием детализированного анализа фазово-фазовых соотношений и времен задержки для отдельных наборов ритмов (альфа и бета, тета и бета). Обнаружено, что доли ритмов альфа- и бета-диапазонов, в случае фазовой задержки между этими ритмическими составляющими ЭЭГ, различаются у испытуемых со “склонностью к риску” и у испытуемых, “избегающих риска” или осторожных.
В настоящее время обучение и принятие решений при вероятностном вознаграждении у людей со склонностью к риску и у людей, избегающих риска, рассматриваются с разных точек зрения и с использованием разных подходов в изучении вопроса. Выполняются исследования, позволяющие выявить структуры мозга, отвечающие за принятие связанных с риском решений, и определить характеристики мозговой активности при разных особенностях поведения испытуемых.
Корковые и подкорковые структуры, ответственные за поведение при принятии связанных с риском решений были обнаружены в ряде исследований. В работах [Cohen, Ranganath, 2005; Daw et al., 2006; Donnelly et al., 2015] указано на большую роль в процессе принятия решений, связанных с риском, медиальной префронтальной и теменной коры, миндалины, вентрального стриатума, прилежащего ядра.
Анализ ритмов ЭЭГ при принятии решений в экспериментах с вероятностным вознаграждением позволяет выявить связи между мозговой активностью и особенностями поведения испытуемых. При рассмотрении амплитуды и фазы тета-, бета-, и гамма-диапазонов частот в обучающей задаче с денежным вознаграждением [De Pascalis et al., 2012] тета-ритм оказался наиболее реактивным. Установлено, что увеличение амплитуд альфа- и бета-ритмов [Leicht et al., 2013] происходит у испытуемых при наличии острых ощущений, связанных с риском. Анализ ЭЭГ показал участие коры задней части поясной извилины при принятии рискованных решений [Polezzi et al., 2010].
При изучении мозговой активности широко используются методы анализа фаз ритмов ЭЭГ. Фазовые диаграммы для ритмов альфа и тета, бета и тета, бета и альфа при различных значениях фаз, в частности при фазе 0 радиан, рассчитаны для задачи принятия решений в работе [Cohen et al., 2009]. Авторы рассмотрели активность в медиальной лобной коре испытуемых при принятии игровых решений и обнаружили, что мощность в альфа- и бета-частотных диапазонах модулировалась фазой дельта- и тета-колебаний. Фазовые соотношения ритмов исследовались при восприятии зрительной информации в гамма-диапазоне частот, а также между гамма- и низкочастотными диапазонами [Schanze, Eckhorn, 1997]. В модели хронического стресса у крыс [Xu et al., 2016] изучались фазовые отношения тета- и гамма-ритмов между вентральным гиппокампом и медиальной префронтальной корой.
Однако существующие методы анализа фазово-фазовых взаимоотношений ритмов при исследовании разных характеристик поведения человека в настоящее время нуждаются в дальнейшей разработке.
Целью настоящей работы является выявление характерных фазово-фазовых взаимоотношений ритмов ЭЭГ у людей, принадлежащих к разным группам по склонности к риску, во время принятия решения в ситуации выбора между маловероятным ценным либо гарантированным малоценным вознаграждением и определение характерных временных задержек между фазами различных ритмов с применением нового подхода в анализе фазово-фазовых отношений.
МЕТОДИКА
Испытуемые. В работе приняли участие 33 здоровых испытуемых: 18 женщин и 15 мужчин в возрасте 24 ± 4 лет (студенты, аспиранты, служащие). Перед исследованием у испытуемых было получено письменное согласие на участие в исследованиях, одобренное этическим комитетом ИВНД и НФ РАН.
Стимулы. Процедура предъявления стимулов испытуемым состояла из следующих этапов:
Первоначально на экране монитора 17″, находившегося на расстоянии 50 см от испытуемого, на темно-сером фоне на 5 с появлялись расположенные по горизонтали два серых круга, диаметром 12 см каждый (угловые размеры одного круга – 13°40′). После того, как 5 с истекали, круги сменялись цветными – красным и зеленым (зеленый – слева, красный – справа), имеющими те же размеры и расположение, что и серые круги. Красный и зеленый круги являлись стимулами, определяющими получение вознаграждения, и предъявлялись так же в течение 5 с. По истечении времени, предоставленного на выбор цветного круга, снова на 5 с включались серые круги, далее смена кругов продолжалась. После появления двух цветных кругов человеку предоставлялась альтернатива: выбрать зеленый круг и получить 1 балл со 100%-ной вероятностью или выбрать красный круг и получить 6 баллов с фиксированной, но разной (0, 10, 25, 50, 75, 100%) вероятностью. Таким образом, красный круг давал возможность получить большее суммарное число баллов при большей вероятности получения 6 баллов и меньшее суммарное число баллов при меньшей вероятности получения 6 баллов. При этом о значении вероятности для красного круга испытуемый не был информирован. Вероятность получения 6 баллов менялась каждый раз в тот момент, когда начиналась следующая сессия. Общая схема эксперимента показана на рис. 1. Каждый эксперимент проводился с одним из испытуемых и состоял из 6 сессий. Этот же алгоритм предъявления стимулов при исследовании выбора с вероятностным вознаграждением использовался в опубликованной ранее статье [Мержанова и др., 2011].
Рис. 1.
Схема экрана монитора с представленными на нем изображениями, которые предъявляются испытуемому в течение 5 с. Серые круги (C) появляются в начале сессии с выбором либо при смене вероятности вознаграждения, также в одной сессии они предъявляются во время интервалов между цветными кругами (стимулами). Круги зеленого (З) и красного (К) цветов обозначают альтернативный выбор. Вероятность вознаграждения при выборе зеленого круга (З) всегда составляет 100% – при ценности в 1 балл, при выборе красного круга (К) вероятность вознаграждения от 0 до 100% – при ценности в 6 баллов. Вероятность получения 6 баллов при выборе красного круга неизвестна испытуемому; 200 – число попыток. Каждый испытуемый принимает участие в шести сессиях, с 0%, 10%, 25%, 50%, 75%, и 100% вероятностью получения 6 баллов при выборе красного круга. В качестве примера на рисунке показаны две сессии с вероятностью 75% и 50%.
Fig. 1. Diagram of images presentation on the screen of the monitor for participant during 5 seconds. Gray circles (C) indicate start of the series of choices or a change in the probability of the reward; they are also presented in one session during the intervals between the colored circles (stimuli). Green circles (З) and red circles (К) show the alternative choices. The reward probability on choosing of the green circle (З) was always 100% with a value of 1 point; the reward probability on choosing of the red circle (К) ranged from 0% to 100% with a value of 6 points. The probability of receiving 6 points on choosing of the red circle was unknown to the participant; 200 is the number of trials. Each participant takes part in six sessions, with 0%, 10%, 25%, 50%, 75%, and 100% probabilities of receiving 6 points on choosing the red circle. As an example, the figure shows two sessions with 75% and 50% probabilities.
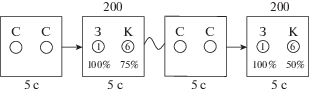
Задачей испытуемого в эксперименте было набрать наибольшее число баллов, за что он получал дополнительное вознаграждение. Выбор осуществлялся с помощью левой кнопки мыши для зеленого и правой – для красного кругов. Сумма накопленных баллов отображалась на экране монитора после нажатия левой или правой кнопок мыши. В течение одной сессии эксперимента – с заданной вероятностью получения вознаграждения при выборе красного круга – зеленый и красный круги для альтернативного выбора предъявляли 200 раз. Всего сессий, проводимых с одним человеком, было 6: с 0, 10, 25, 50, 75, 100%-ной вероятностью получения 6 баллов при выборе красного круга. Интервал между стимулами в одной сессии составлял 5 с. Испытуемый мог отвечать непосредственно во время предъявления стимула.
Запись ЭЭГ. В ходе каждой сессии эксперимента проводили регистрацию ЭЭГ по системе “10-20”. Испытуемые во время записи ЭЭГ сидели в кресле в затемненной, относительно звукоизолированной, экранированной камере. Запись ЭЭГ осуществляли монополярно по отношению к спаренным ушным электродам в 16 отведениях: Fр1, Fр2, FЗ, F4, F7, F8, СЗ, С4, О1, О2, TЗ, Т4, T5, T6, РЗ, Р4. После предусилителя и увеличения сигналов на 16-канальном усилителе фирмы МБН (Москва, Россия) с полосой пропускания до 70 Гц, с подавлением сетевой наводки 50 Гц, с нижней границей частотного фильтра 1 Гц и с частотой опроса аналого-цифрового преобразователя 1 кГц, ЭЭГ записывали в память компьютера для последующей обработки. Из анализа исключали участки с двигательными артефактами. В анализ брали отрезки ЭЭГ между 1 с до и 1 с после стимула (т.е. относительно времени появления на мониторе красного или зеленого кругов). ЭЭГ исследовалась в процессе принятия решения испытуемым, для каждой проведенной сессии.
Анализ ЭЭГ. С помощью цифрового фильтра (Баттерворта четвертого порядка) ритмы ЭЭГ в каждом из 16 отведений записи каждой сессии эксперимента разделяли по следующим диапазонам: тета (4–8 Гц), альфа (8–13 Гц) и бета (13–30 Гц). Фильтр Баттерворта использовали, так как его фазовая частотная характеристика является линейной для низких частот и, следовательно, фильтр не вносит фазового искажения в сигнал низкой частоты [Ifeachor, Jervis, 2002]. Затем у ритмов всех диапазонов определяли моменты времени начала каждой осцилляции, в которых осцилляция переходит от отрицательной величины к положительной (нулевые маркеры) (рис. 2). Принималось во внимание, что знак зарегистрированной осцилляции зависит и от выбора системы размещения электродов.
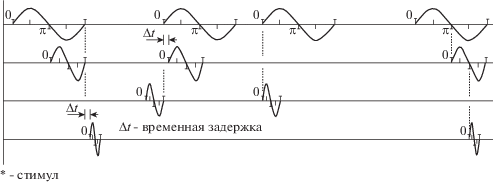
Рис. 2.
Схематическое представление ЭЭГ для наборов ритмов. Каждое колебание на рисунке схематически показывает отдельные ритмы в моменты достижения нулевой фазы. Сопоставляется момент достижения нулевой фазы одним ритмом относительно момента достижения нулевой фазы другим ритмом. Время сопоставления показано пунктиром для отдельных колебаний. Представлены различные варианты временной задержки между нулевыми фазами ритмов. * – обозначается момент предъявления стимула.
Fig. 2. Schema illustrates the sets of EEG rhythms. Each oscillation schematically shows the record of one distinct rhythm at the moments of zero-crossing. The moments of zero-crossing with one rhythm relative to the moment of zero-crossing by another rhythm are compared. The times for comparing pairs of rhythms are shown in dotted lines for distinct oscillations. Different variants of time lags between moments of zero-crossing are presented. * – indicates the moment when the stimulus is presented.
Для дальнейшего анализа использовали возможности программного пакета Spike 2 (Cambridge Electronic Design, Великобритания) [Wen et al., 2013; Dupont et al., 2006] для построения интервальных и кросскорреляционных гистограмм для каждого отведения отдельно. Интервальная гистограмма строилась для пар альфа и бета по временным интервалам между нулевыми маркерами ритмов альфа и бета (аналогично строилась и для других пар ритмов из разных диапазонов ЭЭГ). Предложенный алгоритм ранее использовался в статье [Sreenivas, Niederjohn, 1992], где также исследовались статистические свойства интервалов между моментами пересечения сигналом нуля.
Применительно к участкам записи ЭЭГ рассматривались моменты достижения нулевой фазы одним ритмом относительно такого же момента в другом ритме, и для двух сравниваемых последовательностей моментов достижения нулевой фазы строили кросскорреляционные гистограммы (ККГ) с эпохой анализа от –1 до 1 с. Триггером в ККГ были поочередно ритмы альфа-, бета-, тета-диапазонов. Временная задержка между нулевыми маркерами ритмов из разных диапазонов ЭЭГ, использованная для построения ККГ, оценивалась с бином 10 мс.
По всем вероятностям вознаграждений для каждой из проведенных сессий (состоящих из 200 предъявлений красного и зеленого кругов) у каждого испытуемого определялись временные задержки между фазами ритмов ЭЭГ, и строились по 96 гистограмм (и интервальных, и кросскорреляционных) по 16 отведениям и по 3 ритмам. По каждому отведению отдельно были построены и интервальные, и кросскорреляционные гистограммы между ритмами диапазонов альфа и бета, тета и альфа, тета и бета. Анализ фазовой временной задержки пары ритмов из разных диапазонов ЭЭГ проводился по каждому отведению электродов, и впоследствии проводилось суммирование вкладов по всем отведениям ЭЭГ. Вычисляли среднее арифметическое по 16 интервальным гистограммам отдельно для каждых двух ритмов различающихся диапазонов (тета, альфа и бета) для каждой вероятности получения 6 баллов при выборе красного круга. Также вычисляли среднее арифметическое по 16 кросскорреляционным гистограммам для каждой попарной комбинации из трех ритмов (альфа-бета, альфа-тета, тета-бета, бета-альфа, тета-альфа и бета-тета) в случае синхронности и в случае временной задержки (от 0.08 до 0.1 с) между ними для каждой вероятности, а также вычисляли среднее значение для каждой гистограммы, полученной суммированием. Выявляли встречаемость пиков на ККГ, превышающих три стандартных отклонения (3 сигмы) от среднего значения по всем проанализированным гистограммам. Достоверные пики на ККГ свидетельствовали о наличии взаимного проявления ритмов двух диапазонов. Каждый достоверный пик на ККГ увеличивал на единицу число пар ритмов с соответствующей временной задержкой между ними. После проведения всех экспериментов испытуемые разделились на две группы по поведению при осуществлении выбора: “склонных к риску” и “осторожных”. Принцип разделения на группы в зависимости от выбранной стратегии поведения описан в разделе “Результаты исследований”.
Доля ритмов определялась как отношение числа пар ритмов альфа и бета (соответственно тета и бета) с определенной временной задержкой между ними к общему числу пар ритмов альфа и бета (соответственно тета и бета), выраженное в процентах. Доли ритмов альфа и бета, а также тета и бета сравнивались по критерию Фишера у испытуемых обеих групп.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Поведение испытуемого в одной сессии можно условно разделить на два этапа: первые 10 попыток выбора, в которых формировалась стратегия выбора данного индивидуума, и остальные 190 попыток, в которых проявлялись индивидуальные параметры при обучении стратегии набора максимального числа баллов для заданной вероятности получения 6 баллов при выборе красного круга.
В ходе экспериментов с вероятностями получения ценного вознаграждения (0, 10, 25, 50, 75, 100%) у каждого человека проявлялась устойчивая стратегия поведения.
В статье [Мержанова и др., 2011] показано, что при 25% вероятности получения 6 баллов в качестве вознаграждения наблюдается наиболее четкое, наиболее заметное разделение на группы: если испытуемый набирал более 75% от потенциально набираемых баллов для этой вероятности вознаграждения, то его относили к одной группе (“склонных к риску”), менее 75% – к другой группе (“осторожных”).
Разделение по такому же принципу было проведено и в настоящем исследовании. На основании выбранной стратегии поведения испытуемые были отнесены к однотипным группам (“склонные к риску” – 14 человек, “избегающие риска” – 19). По опросам испытуемых оказалось, что они стремились в ходе эксперимента набрать наибольшее число баллов, но, за редким исключением, испытуемые не смогли объяснить оптимальную стратегию набора наибольшего числа баллов.
На рис. 2 изображено схематическое представление колебаний ЭЭГ для наборов ритмов. Показаны возможные варианты временных задержек между фазами колебаний. Каждое колебание на рисунке схематически показывает отдельные ритмы в моменты достижения нулевой фазы. Сопоставляется момент достижения нулевой фазы одним ритмом относительно момента достижения нулевой фазы другим ритмом. Время сопоставления показано пунктиром для колебаний ЭЭГ отдельных ритмов. * – обозначается момент предъявления стимула.
На рис. 3 представлены доли ритмов, выраженные в процентах, в случае синхронности (рассматриваемой в пределах 0.02 с временной задержки) и в случае относительно большой временной задержки в пределах от 0.08 до 0.1 с между ритмами альфа- и бета- и тета- и бета-диапазонов у испытуемых групп “склонных к риску” и “избегающих риска”, выделенных при условии 25%-ной вероятности ценного вознаграждения. Также на рисунке показаны достоверные различия в долях ритмов (%), рассчитанные по критерию Фишера.
Рис. 3.
На рисунке показаны доли синхронных пар альфа- и бета-ритмов ЭЭГ (а), доли синхронных пар тета- и бета- ритмов (б), доли пар альфа- и бета- ритмов с временной задержкой (от 0.08 до 0.1 с) между ритмами (в), доли пар тета- и бета- ритмов с временной задержкой (от 0.08 до 0.1 с) между ритмами (г) при условии 25%-ной вероятности ценного вознаграждения для испытуемых групп: “склонных к риску” и “избегающих риска”. По горизонтали представлены варианты пар ритмов альфа- и бета-, а также тета- и бета- диапазонов для испытуемых групп, а по вертикали показаны доли пар ритмов (%) в случае синхронности ритмов (а, б) и при временной задержке (от 0.08 до 0.1 с) между ними (в, г); доли ритмов, выраженные в процентах, для “склонных к риску” испытуемых показаны белыми столбиками, для “осторожных” испытуемых показаны черными столбиками для всех случаев. * – p < 0.05 – показатель достоверности различий.
Fig. 3. The figure shows the percentage ratio in synchronization between pairs of alpha and beta rhythms of EEG (а), the percentage ratio in synchronization between pairs of theta and beta rhythms (б), the percentage ratio in pairs of alpha and beta rhythms with a time lag (from 0.08 to 0.1 s) between rhythms (в), the percentage ratio in pairs theta and beta rhythms with a time lag (from 0.08 to 0.1 s) between the rhythms (г) with 25% probability of receiving the valuable reward for subjects of “risk-inclined” and “risk-averse” groups. The horizontal axis shows variants of pairs of rhythms: (alpha and beta) and (theta and beta), for both groups. The vertical axis shows the percentage ratio in pairs of rhythms (%) for the case of rhythms’ synchronicity (а, б) and for the case of time lag (from 0.08 to 0.1 s) between rhythms (в, г). Percentage ratios for “risk-inclined” subjects are shown in white columns, for “risk-averse” subjects in black columns, for all cases. * – p < 0.05 (statistically significant).
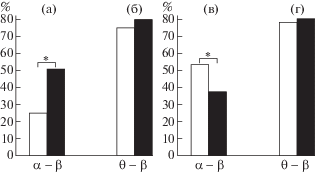
Видно, что доля ритмов в случае синхронности альфа- и бета- диапазонов ЭЭГ у испытуемых, “склонных к риску”, достоверно меньше, чем у “осторожных”. При том, что доля ритмов в случае временной задержки (от 0.08 до 0.1 с) между ритмами альфа- и бета-диапазонов у испытуемых, “склонных к риску”, достоверно больше, чем у осторожных. Доля ритмов как в случае синхронности, так и при временной задержке от 0.08 до 0.1 с между ритмами тета- и бета-диапазонов ритмов не имела значимых различий для испытуемых обеих групп.
Таким образом, при сопоставлении вышеизложенных результатов можно отметить различие по испытуемым, полученное при фазовых временных задержках менее 0.02 с и временных задержках в пределах от 0.08 до 0.1 с для пар альфа- и бета-ритмов.
На рис. 4 представлены усредненные интервальные гистограммы между фазами альфа- и бета-ритмами и тета- и бета-ритмов ЭЭГ. На гистограмме видно, что по интервалам между фазами альфа- и бета-ритмов представлены две моды, одна из них лежит в области синхронности альфа- и бета-ритмов, другая – в области больших временных задержек. На гистограмме по интервалам между фазами тета- и бета-ритмов выраженных мод не представлено.
Рис. 4.
Усредненные интервальные гистограммы между альфа- и бета- ритмами и между тета- и бета- ритмами при условии 25%-ной вероятности ценного вознаграждения у испытуемых обеих групп. По горизонтали – временные интервалы, выраженные в секундах, между парами ритмов альфа и бета, а также тета и бета. По вертикали – число интервалов; “склонные к риску” испытуемые – белые, “осторожные” – черные столбики. Серым цветом отмечены диапазоны, по которым расчет ККГ не проводился; в этом случае усредненные данные представлены по всем испытуемым.
Fig. 4. Averaged interval histograms between alpha and beta rhythms and between theta and beta rhythms, for 25% probability of receiving the valuable reward for subjects of both groups. The abscissa shows time intervals between pairs of rhythms: (alpha and beta) and (theta and beta), sec; the ordinate shows the number of intervals; white columns show the “risk-inclined” group and the black columns show the “risk-averse” group. Gray columns indicate ranges for which the calculation of the CCHs was not performed; in this case, the average data are presented for all subjects.

Наличие двух мод в гистограмме для интервалов между фазами альфа- и бета-ритмов можно объяснить наличием гармоники альфа- в бета-диапазоне. Существуют работы, представляющие бета-ритм как гармонику альфа-ритма. В статье [Jones et al., 2009] для соматосенсорной системы на модели кортикальных колонок показано, что те же нейронные сети могут создавать как альфа-, так и бета-ритмы. Но при этом пики мощности по альфа- и бета-ритмам часто возникают в разные моменты времени, указывая на то, что эти ритмы не являются только лишь гармониками друг друга и могут иметь различные источники. В статье [Fransen et al., 2016] авторы проводили исследования в альфа- и бета-диапазонах частот в соматосенсорной коре мозга крыс с использованием эпидуральной электрокортикографии. Они показали, что лишь часть бета-осцилляций является второй гармоникой альфа-ритма.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Принятие рискованных решений включает в себя оценку ценности вознаграждения и уровня риска. Для изучения процессов принятия рискованных решений применяются различные методы анализа ЭЭГ, в том числе с использованием фаз ритмов отдельных диапазонов.
Результаты проведенной работы свидетельствуют о том, что разница между ЭЭГ у “склонных к риску” людей и у “избегающих риска” людей существует, и ее можно выявить как статистически достоверную путем анализа записей ЭЭГ по соответствующим группам испытуемых.
Полученные в настоящей работе результаты сопоставимы с рядом работ, показывающих отличия проявлений в мозговой активности при поведении, связанном с риском. Показано [Massar et al., 2014], что увеличение мощности тета- и бета-ритмов ЭЭГ в состоянии покоя было связано с рискованным, невыгодным принятием решений. Выявлено [Helfinstein et al., 2014] пространственное распределение бета- и тета-мощности и их соотношение по фМРТ испытуемых. Авторы использовали данные, предшествующие рискованному или безопасному выбору, и определяли, какие регионы мозга кодируют информацию, предсказывающую решение.
В настоящей работе с помощью нового подхода к оценке фазово-фазовых взаимоотношений ритмов ЭЭГ обнаружены отличия временных задержек между ритмами альфа- и бета-диапазонов ЭЭГ, которые соответствуют проявлениям “склонности к риску”/осторожности. Существуют работы, исследующие физиологические механизмы возникновения временной задержки как для ритмов, так и для нейронных ансамблей. Но при этом многие исследования нередко ограничиваются изучением временных задержек, связанных с разницей в топологической локализации электродов.
По значениям фаз и по временным соотношениям фаз у ритмов ЭЭГ, предположительно, можно судить о работе нейронных ансамблей и выявлять особенности взаимодействия ансамблей. С другой стороны, согласованная нейронная спайковая активность может соответствовать фазам ритма.
В ряде исследований была показана связь характеристик ритмов с активностью нейронных ансамблей. Канолти и соавт. [Canolty et al., 2012] сопоставляли амплитуду и фазу бета-ритма мозга обезьян, а также спайковую активность нейронного ансамбля. Показано, что спайковая активность отдельных нейронов сочетается по нескольким параметрам с моторным бета- ритмом (10–45 Гц). Характерные особенности синхронизации и межчастотные соотношения с использованием фаз ритмов на различных сегментах ЭЭГ испытуемых были выявлены в статье [Koutsoukos et al., 2015]. Авторы полагают, что синхронность в функционировании мозга описывает режим, отражающий коллективное поведение нейронных ансамблей. По мнению [Fries, 2015] синхронизация влияет на коммуникацию между нейронными группами. Автор рассмотрел функцию зависимости вероятности спайка от фазы гамма-ритма. Кроме того, автор предположил наличие у ритмов иерархического влияния “снизу-вверх”, например, влияние альфа- и бета-ритмов на характеристики гамма-ритма. Таким образом, по мнению автора, несколько ритмов совместно устанавливают эффективные, точные и селективные взаимодействия между нейронами. Авторы перечисленных выше статей рассматривают различные характеристики нейронных ансамблей, применимые как к ритмам, так и к отдельным нейронам.
Помимо синхронизации, возникающей при коллективной работе нейронных ансамблей, ансамбли участвуют в компенсаторной подстройке, механизмом которой, видимо, может быть или компенсаторная (за счет регуляции возбуждения и торможения в нейронных ансамблях), или переменная, или спонтанная фазовая задержка, или, в некоторых случаях, постоянная фазовая задержка (синхронность с ненулевым фазовым сдвигом). Так, компенсаторная подстройка, как правило, дает большой разброс по времени фазовой временной задержки при сопоставлении нейронных ансамблей.
Вопросы синхронизации ритмов различного частотного диапазона были исследованы в работе [Maex, De Schutter, 2003]. По утверждению авторов статьи ритмы мозга возникают благодаря синхронизации нейронов и их подстройке к паттерну активности, и в этом процессе часто участвуют сети взаимно связанных тормозных нейронов. Время взаимодействия между как близко, так и удаленно находящимися друг от друга популяциями нейронов различных областей мозга исследовано в [Borardi et al., 2014]. Полученные ими результаты говорят о наличии синхронизации спайковой активности нейронов с нулевой задержкой, хотя с учетом запаздывания время взаимодействия между недалеко находящимися нейронами предположительно составляет несколько миллисекунд, а между различными областями может занять до десятков миллисекунд. Авторы считают, что наличие синхронизации с нулевой задержкой (zero-lag synchrony) позволяет обеспечить максимальную передачу информации.
Сеть, состоящая из независимых, но не обязательно пространственно разделенных нейронных ансамблей, для которых при анализе временных соотношений между их активностью выявляется либо редкая или кратковременная синхронность, либо задержка по времени с большим временным разбросом, может обусловливать селективные взаимодействия иных нейронных ансамблей вне сети. Для нейронов субталамического ядра человека [Priori et al., 2004] авторы предположили существование сети функционально независимых, но не обязательно пространственно разделенных подсистем, работающих на разных частотах. По кросс-корреляции активности [Stanford, 2003] были выявлены нейронные пары с некоррелированной активностью или с активностью с переменной фазовой задержкой для нейронов бледного шара, действующих как независимые осцилляторы. Независимые по корреляции активности близко расположенные нейронные ансамбли для пирамидных клеток гиппокампа крыс были рассмотрены в [Redish et al., 2001]. Авторы делают вывод, что независимость свойств кодирования соседних нейронов повышает способность гиппокампа хранить произвольные ассоциации и увеличивает емкость хранения.
Проявленное в нашей работе внимание к анализу временных задержек фазово-фазовых взаимоотношений исследованных ритмов ЭЭГ дало результаты в оценке таких сложных процессов в головном мозге, как выбор при принятии связанных с риском решений. С другой стороны, полученные нами экспериментальные данные дают основание для разработки вопросов взаимной синхронизации в работе нейронных ансамблей с различными временными задержками при регистрации ритмов ЭЭГ, что применимо и к исследованиям на человеке, а не только на животных.
Совокупность нейронных ансамблей, организованных не за счет взаимной синхронизации, а за счет воспроизводимой во времени временной задержки между моментами достижения нулевой фазы ритмами разной частоты, может по-иному отражать проявления “склонности к риску”/“осторожности” испытуемых, что и было показано.
ВЫВОДЫ
1. Показана синхронность ритмов альфа- и бета-диапазонов у людей “склонных к риску”, по сравнению с “избегающими риска” в ситуации выбора между маловероятным ценным, либо гарантированным малоценным вознаграждением. Доля пар ритмов в случае синхронности ритмов альфа- и бета-диапазонов у испытуемых “склонных к риску” достоверно меньше, чем у “осторожных”.
2. При временной задержке между ритмами альфа- и бета-диапазонов ЭЭГ в пределах от 0.08 до 0.1 с доля пар ритмов достоверно больше у испытуемых “склонных к риску” по сравнению с “избегающими риска”.
3. Выявлено различие в проявлении “склонности к риску”/“осторожности” по характеристикам временных задержек между ритмами альфа- и бета-диапазонов ЭЭГ.
Список литературы
Мержанова Г.Х., Залешин А.В., Ашкинази М.Л., Шергин И.Н. Индивидуально-типологические различия в поведении человека при выборе вознаграждения, связанного с риском. Журн. высш. нерв. деят. 2011. 61 (3): 281–292.
Barardi A., Sancristobal B., Garcia-Ojalvo J. Phase-coherence transitions and communication in the gamma range between delay-coupled neuronal populations. PLoS Comput. Biol. 2014. 10 (7): e1003723.
Canolty R.T., Ganguly K., Carmena J.M. Task-dependent changes in cross-level coupling between single neurons and oscillatory activity in multiscale networks. PLoS Comput Biol. 2012. 8 (12): e1002809.
Cohen M.X., Ranganath C. Behavioral and neural predictors of upcoming decisions. Cogn. Affect Behav. Neurosci. 2005. 5 (2): 117–126.
Cohen M.X., Elger C.E., Fell J. Oscillatory activity and phase-amplitude coupling in the human medial frontal cortex during decision making. J. Cogn. Neurosci. 2009. 21 (2): 390–402.
Daw N.D., Doya K. The computational neurobiology of learning and reward. Current Opinion in Neurobiology 2006. 16: 199–204.
De Pascalis V., Varriale V., Rotonda M. EEG oscillatory activity associated to monetary gain and loss signals in a learning task: effects of attentional impulsivity and learning ability. Int. J. Psychophysiol. 2012. 85 (1): 68–78.
Donnelly N.A., Paulsen O., Robbins T.W., Dalley J.W. Ramping single unit activity in the medial prefrontal cortex and ventral striatum reflects the onset of waiting but not imminent impulsive actions. Eur. J. Neurosci. 2015. 41 (12): 1524–1537.
Dupont E., Hanganu I.L., Kilb W., Hirsch S., Luhmann H.J. Rapid developmental switch in the mechanisms driving early cortical columnar networks. Nature. 2006. 439 (7072): 79–83.
Fransen A.M., Dimitriadis G., van Ede F., Maris E. Distinct alpha- and beta-band rhythms over rat somatosensory cortex with similar properties as in humans. J. Neurophysiol. 2016. 115 (6): 3030–3044.
Fries P. Rhythms for cognition: communication through coherence. Neuron. 2015. 88 (1): 220–235.
Helfinstein S.M., Schonberg T., Congdon E., Karlsgodt K.H., Mumford J.A., Sabb F.W., et al. Predicting risky choices from brain activity patterns. Proceedings of the National Academy of Sciences. 2014. 111 (7): 2470–2475.
Ifeachor E.C., Jervis B.W. Digital signal processing : a practical approach (2nd ed.). 2002. Prentice Hall.
Jones S.R., Pritchett D.L., Sikora M.A., Stufflebeam S.M., Hämäläinen M., Moore C.I. Quantitative analysis and biophysically realistic neural modeling of the MEG mu rhythm: rhythmogenesis and modulation of sensory-evoked responses. J Neurophysiol. 2009. 102 (6): 3554–3572.
Koutsoukos E., Maillis A., Papageorgiou C., Gatzonis S., Stefanis C., Angelopoulos E. The persistent and broadly distributed EEG synchronization might inhibit the normal processing capability of the human brain. Neurosci Lett. 2015. 609: 137–141.
Leicht G., Troschutz S., Andreou C., Karamatskos E., Ertl M., Naber D., Mulert C. Relationship between oscillatory neuronal activity during reward processing and trait impulsivity and sensation seeking. PLoS One. 2013. 8 (12): e83414.
Maex R., De Schutter E. Resonant synchronization in heterogeneous networks of inhibitory neurons. J. Neurosci. 2003. 23 (33): 10503–10514.
Massar S.A., Kenemans J.L., Schutter D.J. Resting-state EEG theta activity and risk learning: sensitivity to reward or punishment? Int J Psychophysiol. 2014. 91 (3): 172–177.
Polezzi D., Sartori G., Rumiati R., Vidotto G., Daum I. Brain correlates of risky decision-making. Neuroimage. 2010. 49 (2): 1886–1894.
Priori A., Foffani G., Pesenti A., Tamma F., Bianchi A.M., Pellegrini M., Locatelli M., et al. Rhythm-specific pharmacological modulation of subthalamic activity in Parkinson’s disease. Exp Neurol. 2004. 189 (2): 369–379.
Redish A.D., Battaglia F.P., Chawla M.K., Ekstrom A.D., Gerrard J.L., Lipa P., et al. Independence of firing correlates of anatomically proximate hippocampal pyramidal cells. J. Neurosci. 2001. 21 (5): RC134.
Schanze T., Eckhorn R. Phase correlation among rhythms present at different frequencies: spectral methods, application to microelectrode recordings from visual cortex and functional implications. Int. J. Psychophysiol. 1997. 26 (1–3): 171–189.
Sreenivas T.V., Niederjohn R.J. Zero-crossing based spectral analysis and SVD spectral analysis for formant frequency estimation in noise. 1992. IEEE Transactions on Signal Processing. 40 (2): 282–293.
Stanford I.M. Independent neuronal oscillators of the rat globus pallidus. J. Neurophysiol. 2003. 89 (3): 1713–1717.
Wen D., Peng C., Ou-yang G., Henderson Z., Li X., Lu C. Effects of nicotine stimulation on spikes, theta frequency oscillations, and spike-theta oscillation relationship in rat medial septum diagonal band Broca slices. Acta Pharmacologica Sinica. 2013. 34: 464–472.
Xu X., Zheng C., An L., Wang R., Zhang T. Effects of Dopamine and Serotonin Systems on Modulating Neural Oscillations in Hippocampus-Prefrontal Cortex Pathway in Rats. Brain Topogr. 2016. 29 (4): 539–551.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


