Журнал высшей нервной деятельности им. И.П. Павлова, 2019, T. 69, № 1, стр. 3-13
ТРИ МОДАЛЬНОСТИ СИНАПТИЧЕСКОГО ВЫБРОСА НЕЙРОМЕДИАТОРА: БЫСТРЫЙ СИНХРОННЫЙ, МУЛЬТИВЕЗИКУЛЯРНЫЙ И АСИНХРОННЫЙ. СХОДСТВА И РАЗЛИЧИЯ В МЕХАНИЗМАХ
Ф. Ф. Валиуллина-Рахматуллина 1, *, А. П. Большаков 2, 3, А. В. Розов 1, 4
1 НИЛ нейробиологии, Казанский федеральный университет
Казань, Россия
2 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
3 НИЛ электрофизиологии, Российский национальный исследовательский медицинский университет
им. Н.И. Пирогова
Москва, Россия
4 Институт физиологии и патофизиологии
Гейдельберг, Германия
* E-mail: fliza8080@mail.ru
Поступила в редакцию 21.08.2018
После доработки 12.09.2018
Принята к публикации 24.09.2018
Аннотация
В центральной нервной системе существует несколько модальностей выброса нейромедиаторов: фазовый (синхронный), асинхронный и мультивезикулярный. В обзоре суммированы результаты исследований последних лет, демонстрирующие участие различных кальциевых сенсоров в запуске синхронного и асинхронного выброса нейромедиатора. Кроме того, подробно рассмотрены возможные источники пресинаптического Са2+, запускающие асинхронный выброс нейромедиаторов, а также возможные механизмы мультивезикулярного выброса нейромедиатора.
ВВЕДЕНИЕ
Хорошо известно, что передача сигналов между нейронами опосредована синаптической передачей. В классическом случае, когда происходит фазический или синхронный выброс нейромедиатора, потенциал действия (ПД), приходящий в пресинаптическое окончание, приводит к открыванию потенциал-зависимых Са2+-каналов, повышению Са2+ в терминали, активации Са2+-зависимых сигнальных путей, слиянию синаптических везикул с пресинаптической мембраной и выбросу нейромедиатора. Кроме фазического выброса медиатора, также существует асинхронное выделение нейромедиатора, когда выброс нейромедиатора не привязан по времени к моменту возникновения потенциала действия в пресинаптической терминали и возникает обычно после пачки ПД в пресинаптическом нейроне. На рис. 1(а) обе модальности выброса нейромедиатора показаны на примере выделения ГАМК в синапсах, сформированных двумя типами интернейронов на пирамидных нейронах зоны СА1 гиппокампа. Если физиологическая роль синхронного выброса медиатора понятна – быстрая передача сигнала от одного нейрона к другому, то физиологическая роль асинхронного выброса неясна. Продолжительный асинхронный выброс нейромедиатора наблюдается лишь в некоторых нейрональных субпопуляциях, наиболее исследованной из которых является субпопуляция ГАМКергических холецистокинин(ХЦК)-экспрессирующих интернейронов зоны СА1 гиппокампа. Данные, опубликованные Клаусбергером и соавт. [Klausberger et al., 2005], указывают на важное значение этих интернейронов в генерации гиппокампального тета-ритма. Важнейшей чертой этих клеток является задержанное асинхронное синаптическое выделение ГАМК в ответ на пачку потенциалов действия [Hefft, Jonas, 2005; Ali, Todorova, 2010]. Средняя длительность такого асинхронного выхода ГАМК составляет 50–150 мс, что соответствует частоте тета-ритма у грызунов (5–10 Гц). Возможно, длительное асинхронное выделение ГАМК из синапсов, сформированных холецистокинин-позитивными интернейронами, может играть ключевую роль в генерации медленных волн торможения, определяющих ритмические осцилляции в тета-диапазоне.
Рис. 1.
(а) Синхронное и асинхронное выделение медиатора в тормозных синапсах зоны СА1 гиппокампа. На левой панели показана схема локализации нейронов и их связей в гиппокампе. На правой панели показаны электрофизиологические записи активности нейронов, указанных на схеме сверху. Пачка ПД в парвальбумин (ПВ)-экспрессирующем интернейроне гиппокампа вызывает серию синхронных тормозных постсинаптических токов (ТПСТ) (помечены пунктирными линиями) в постсинаптическом пирамидном нейроне. Точно такая же пачка ПД в холецистокинин (ХЦК)-экспрессирующем нейроне также вызывает серию синхронных ТПСТ, за которыми следует последовательность асинхронных ТПСТ (помечены звездочками). (б) Динамика уровня Са2+ в пресинаптической терминали в разных модальностях синаптического выброса нейромедиатора. Схематическое изображение динамики уровня Са2+ после единичного потенциала действия. Пунктирными линиями обозначены окна для синхронного (СВМ) и мультивезикулярного (МВМ) выброса медиатора (слева) и для асинхронного (АВМ) выброса (справа). (в) Схематическое изображение временных окон вовлечения двух типов сенсоров, отвечающих за синхронный и асинхронный выброс медиатора: низкоаффинных сенсоров Syt1/Syt2, отвечающих за синхронный выброс медиатора, и Syt7, вовлеченного в асинхронный выброс. (г) Та же схема, что и на (в); зеленым обозначен гипотетический вход Са2+ из альтернативных источников, способных генерировать асинхронный выброс нейромедиатора (TRPV1и P2X2 каналы, рианодиновые рецепторы). Серым цветом показано гипотетическое изменение в динамике Са2+ при развороте Na+/Ca2+-обменника после пачки ПД, приводящей к росту Na+ внутри терминали.
Fig. 1. (a) Synchronous and asynchronous mediator release in the inhibitory synapses of the hippocampal CA1 area. The left panel shows the localization of neurons and their connections in the hippocampus. The right panel shows the electrophysiological recordings of activity of neurons shown on the scheme above. A burst of APs in parvalbumin (PV)-expressing hippocampal interneuron evokes a series of synchronous inhibitory postsynaptic currents (IPSCs) in postsynaptic pyramidal neuron. The same burst of APs in a cholecystokinin (CCK) -expressing neuron also causes a series of synchronous IPSCs followed by a barrage of asynchronous IPSCs (marked by asterisks). (б) Dynamics of Ca2+ level in presynaptic terminal during different modes of the synaptic neurotransmitter release. Schematic representation of the Ca2+ dynamics after a single action potential. The dashed lines indicate the windows for the synchronous (SR) and multi-vesicular (MVR) release (on the left) and for the asynchronous (AR) release (on the right). (в) Schematic representation of time windows involving two types of sensors responsible for the synchronous and asynchronous mediator release: low-affinity sensors Syt1/Syt2, which are responsible for the synchronous mediator release, and Syt7, which used during the asynchronous release. (г) The same scheme as in (в); green marks hypothetical Ca2+ input from alternative sources that can trigger asynchronous neurotransmitter spike (TRPV1 and P2X2 channels, ryanodine receptors). The gray color shows hypothetical changes in the Ca2+ dynamics when the Na+/Ca2+ exchanger is reversed after a burst of APs, leading to an increase in Na+ inside the terminal.
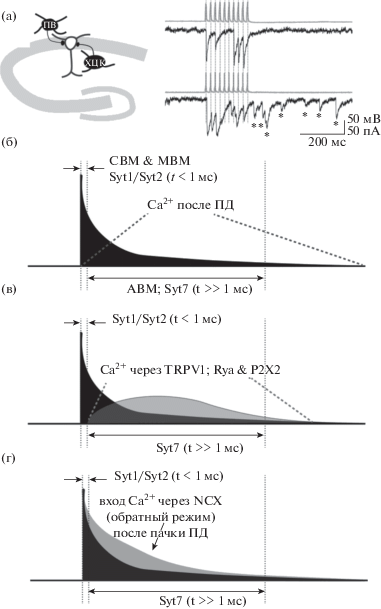
Процессы синхронного и асинхронного выброса нейромедиатора интенсивно изучались в последние десятилетия [Ali,Todorova, 2010; Chen et al., 2017; Daw et al., 2009; Hefft, Jonas, 2005; Jappy et al., 2016; Li et al., 2017; Luo, Südhof, 2017; Turecek, Regehr, 2018; Wen et al., 2010]. Результаты исследований показывают, что механизмы этих процессов имеют много общего. В частности, слияние везикул происходит по общему сценарию с участием белков SNARE комплекса как при синхронном, так и при асинхронном выбросе нейромедиатора. Синаптическая передача обеих модальностей запускается входом кальция (Са2+), вызванным одиночным потенциалом действия (ПД) или пачкой ПД [Kaeser, Regehr, 2014]. Несмотря на кажущееся сходство, зависимость процессов синхронного и асинхронного выброса нейромедиатора от концентрации Са2+ различна. Высокая синхронизация постсинаптических ответов с пресинаптическим ПД обеспечивается за счет того, что концентрация Са2+, необходимая для запуска выброса нейромедиатора, достигается в активной зоне на очень короткое время и в очень малом объеме, благодаря открытию потенциал-зависимых Са2+-каналов. В течение нескольких микросекунд уровень Са2+ вблизи активной зоны резко снижается за счет диффузии, связывания Са2+ с внутриклеточными хелаторами и вывода Са2+ кальциевыми насосами. Таким образом, концентрация Са2+, доступная для генерации асинхронного выброса, длящегося в течение десятков миллисекунд после последнего ПД в пачке, во много раз ниже пиковых значений Са2+ в микродомене во время ПД (рис. 1(б)). Вышеизложенное предполагает различную аффинность Са2+-сенсоров, ответственных за синхронную и асинхронную модальности выброса нейромедиатора, и/или альтернативный источник входа Са2+, сохраняющий активность в течение десятков миллисекунд после пачки ПД. В настоящем обзоре мы обсудим данные существующей литературы о различных Са2+-сенсорах, отвечающих за две модальности выброса нейромедиатора, а также рассмотрим пресинаптическую кальциевую динамику, отвечающую за асинхронный выброс нейромедиатора. Помимо вышеупомянутых модальностей синаптической передачи, сильно отличающихся друг от друга по временной задержке постсинаптических ответов относительно пресинаптических ПД, существует третий механизм выброса нейромедиатора, а именно мультивезикулярный выброс. В этом случае одиночный ПД в состоянии запускать слияние более чем одной везикулы в одной активной зоне с временной задержкой менее 1 мс между двумя событиями экзоцитоза. Несмотря на то что механизм мультивезикулярного выброса нейромедиатора недостаточно изучен, мы обсудим возможный вариант взаимодействия молекулярных систем, обеспечивающих синхронный и асинхронный выброс нейромедиатора для генерации мультивезикулярного слияния везикул.
СА2+-СЕНСОРЫ, УЧАСТВУЮЩИЕ В СИНХРОННОМ И АСИНХРОННОМ ВЫБРОСЕ НЕЙРОМЕДИАТОРА
В настоящее время принято считать, что роль везикулярного Са2+-сенсора, отвечающего за экзоцитоз во время синаптической передачи, выполняют белки семейства синаптотагминов. Это семейство насчитывает 17 идентифицированных членов Syt1-Syt17, которые отличаются по паттерну экспрессии в нейронах, а также по аффинности к Са2+ [Bhalla et al., 2008; Craxton, 2010; Gustavsson, Han, 2009; Moghadam, Jackson, 2013]. Фазовый (или синхронный) выброс нейромедиатора, являющийся основой правильного функционирования мозга, скорее всего, запускается при участии Syt1. Об этом свидетельствует высокая постнатальная смертность мышей вследствие дефицита Syt1, у которых сильно снижен уровень фазового выброса нейромедиатора [Geppert et al., 1994].
Когда потенциал действия (ПД) достигает пресинаптического нервного окончания, открываются потенциал-чувствительные Ca2+ каналы, что приводит к резкому локальному подъему внутриклеточной концентрации Ca2+, созданию так называемого Ca2+ домена и активации Ca2+-сенсора [Borst, Sakmann, 1996; Katz, Miledi, 1965; Llinás et al., 1976; Sabatini, Regehr, 1996]. Высокая степень синхронизации обеспечивается Ca2+-каналами, которые находятся вблизи активной зоны и открываются лишь на очень короткое время [Bischofberger et al., 2002; Llinás et al., 1976]. Тесное пространственное сопряжение Ca2+-источника с Ca2+-сенсором чрезвычайно важно для обеспечения высокой вероятности выброса нейромедиатора. Например, удвоение дистанции между Са2+-каналом и везикулой от 25 до 50 нм втрое уменьшает вероятность секреции [Bennett et al., 2000; Rozov et al., 2001]. Внутри Ca2+-домена концентрация Ca2+ быстро коллапсирует ниже концентрации, необходимой для запуска экзоцитоза синаптических везикул. Задержка между входом Са2+ и экзоцитозом составляет 0.2 мс [Stanley, 1997]. Все вышеизложенное говорит о том, что аффинность к Ca2+ синаптотагмина, отвечающего за фазовую компоненту синаптической передачи, относительно низкая. Sugita и соавт. показали, что аффинности Syt1 и Syt2 (ЕС50 = 10–20 мкМ) в 10 раз меньше, чем у Syt7 (ЕС50 = 1–2 мкМ) [Sugita et al., 2002]. Роль Syt1 как основного сенсора для поддержания фазового выброса нейромедиатора подтверждается в экспериментах на животных (дрозофилла, мышь, черви C. Elegans), где ген, кодирующий Syt1, был нокаутирован [Broadie et al., 1994; Geppert et al., 1994; Littleton et al., 1993; Nonet et al., 1993]. В частности, в гиппокампальных диссоциированных культурах нокаутирование Syt1 приводило к исчезновению фазовой компоненты и сдвигу модальности выброса нейромедиатора к асинхронному [Geppert et al., 1994]. Более того, незначительные мутации в Syt1, изменяющие Са2+-зависимое фосфолипидное связывание, также имели значительное влияние на фазовый выброс нейромедиатора [Fernández-Chacón et al., 2001; Pang et al., 2006].
В случае асинхронного выброса нейромедиатора требования, предъявляемые к Са2+-сенсору, кардинально отличаются от свойств сенсоров, отвечающих за синхронный выброс. Поскольку ожидаемая Са2+ концентрация в активной зоне в интервале от нескольких мс до десятков мс после ПД существенно ниже пиковых значений [Са2+]i в микродомене, то и аффинность Са2+-сенсора должна быть намного выше аффинности Syt1 и Syt2. Для фазового выброса константа связывания и константа диссоциации Са2+ у сенсора должны быть высоки, что позволит быстро реагировать на изменения [Са2+]i. В случае асинхронного выброса сенсор с медленной константой скорости диссоциации позволяет поддерживать выброс нейромедиатора в течение более длительного периода времени. С этой точки зрения идеальным претендентом на роль Са2+-сенсора для асинхронного выброса может являться Syt7. Аффинность этой изоформы синаптотагмина к Са2+ на порядок выше аффинностей Syt1 и Syt2, и последние исследования показывают, что Syt7 обладает наиболее медленной константой скорости диссоциации с фосфолипидами мембраны синаптических везикул [Hui et al., 2005; MacDougall et al., 2018]. Было показано, что Syt7 может опосредовать асинхронные синаптические события при устранении быстрых изоформ синаптотагмина [Bacaj et al., 2013] и при длительной стимуляции нервно-мышечного соединения рыб Данио-рерио. Нокдаун Syt7 почти полностью отменяет асинхронный выброс нейромедиатора, не оказывая существенного влияния на синхронную компоненту синаптического ответа [Wen et al., 2010]. Недавно существенная роль Syt7 в генерации асинхронного выброса нейромедиатора была подтверждена в тормозных синапсах гиппокампа [Li et al., 2017], ГАМКергических [Chen et al., 2017] и глутаматергических [Turecek and Regehr, 2018] синапсах и в возбуждающих синапсах чашечек Хельда (Сalyx of Held) [Luo, Südhof, 2017]. Как и в экспериментах с Данио-рерио, нокаут Syt7 существенно снижал вклад асинхронного выброса нейромедиатора в синаптический ответ в вышеупомянутых центральных синапсах. Таким образом, в настоящее время предполагается, что фазовый, синхронный выброс нейромедиатора запускается через связывание Са2+ с низкоаффинными изоформами синаптотагминов (Syt1 и Syt2), тогда как задержанный продолжительный асинхронный выброс вызывается при участии высокоаффинного синаптотагмина Syt7 с медленными константами скорости связывания и диссоциации (рис. 1(в)) [Hui et al., 2005; Li et al., 2017; Sugita et al., 2001].
ИСТОЧНИКИ СА2+ ДЛЯ СИНХРОННОГО И АСИНХРОННОГО ВЫБРОСА НЕЙРОМЕДИАТОРА
В случае с фазовым синхронным выбросом нейромедиатора хорошо установлено, что основным источником входа Са2+ являются потенциал-зависимые Са2+-каналы трех типов: P, Q и/или N [Hefft, Jonas, 2005; Poncer et al., 1997; Wilson et al., 2001]. Однако вероятность выброса нейромедиатора и степень его синхронизации с ПД в случае фазового выброса зависят не столько от типа Са2+-канала, сколько от ультраструктурной организации активной зоны. Пиковое значение [Са2+]i внутри Са2+ микродомена может достигать от 20 до 300 мкМ. Однако эта концентрация достигается в непосредственной близости от внутреннего вестибюля открытого канала. По мере удаления от канала [Са2+]i существенно снижается. Таким образом, концентрация Са2+, доступная для генерации выброса нейромедиатора, обратно пропорциональна расстоянию между Са2+-каналами и Са2+-сенсором. Во многих случаях это расстояние определяет начальную вероятность (р) выброса нейромедиатора, а также тип кратковременной пластичности в разных типах синапсах. Так, например, синапсы с большим диффузионным расстоянием между Са2+-каналами и Са2+-сенсором обычно имеют низкую вероятность выброса в ответ на одиночный ПД, но в ответ на пачку ПД значение р резко вырастает, приводя к кратковременному облегчению выброса нейромедиатора. В синапсах, где источник Са2+ и Са2+-сенсор пространственно тесно связаны, начальное значение р близко к 1, но в ответ на высокочастотную стимуляцию в этих синапсах зачастую наблюдается кратковременная депрессия, вероятно, за счет истощения везикулярного пула [Reyes et al., 1998].
В случае асинхронного выброса нейромедиатора ситуация намного сложнее, так как синаптические события возникают спустя десятки мс после ПД. В конкретном случае кратковременные и локальные кластеры с высокой концентрацией Са2+ более не существуют, а Са2+, вошедший во время ПД, наиболее вероятно распространен равномерно по всему объему пресинаптического нервного окончания. Поэтому для генерации асинхронного выброса нейромедиатора необходимы дополнительные источники Са2+. Можно было бы предположить, что высокая аффинность и медленная константа скорости диссоциации Syt7 позволяют поддерживать выброс нейромедиатора за счет низких концентраций остаточного Са2+, но тогда с учетом широкой экспрессии данного типа синаптотагмина асинхронный выброс должен был бы наблюдаться в большинстве синапсов. В реальности долгоживущий асинхронный выброс нейромедиатора является характерной чертой достаточно небольшой фракции изученных синапсов. Вышеизложенное позволяет предположить, что наряду с особым типом Са2+-сенсора асинхронный выброс нейромедиатора нуждается в альтернативной подпитке Са2+, отличной от входа Са2+ через потенциал-зависимые Са2+-каналы. В качестве таких альтернативных источников в последние пару десятилетий были предложены кальций-проницаемые рецепторы для АТФ (P2X2), ванилоидные рецепторы первого типа (TRPV1) и Са2+-индуцированный выход Са2+ из внутриклеточных депо (рис. 1(г)). Участие ванилоидных рецепторов в генерации асинхронного выброса было предложено Peters и соавт. [Peters et al., 2010]. Они показали, что возбуждающие входы на нейроны ядра одиночного пути имеют характерный асинхронный выброс нейромедиатора. Вклад указанной модальности мог быть селективно заблокирован специфичным антагонистом TRPV1 рецепторов; кроме того, вклад асинхронного выброса нейромедиатора увеличивался при поднятии температуры во время эксперимента. Однако в последующих работах этого научного коллектива было показано, что нокаут TRPV1 рецепторов снижает вклад асинхронного выброса нейромедиатора в изучаемых нейронах лишь на 50%. Роль TRPV1 рецепторов как основного источника Са2+ для асинхронного выброса нейромедиатора в других синапсах представляется крайне сомнительной также в силу того, что экспрессия этих рецепторов в нейронах ЦНС до сих пор не была адекватно подтверждена [Földy et al., 2016; Zeisel et al., 2015].
В качестве альтернативного источника кальция для генерации асинхронного выброса нейромедиатора были предложены кальций-проницаемые рецепторы для АТФ (P2X2). В качестве доказательств приводится влияние антагониста (P2X2) на асинхронный выброс нейромедиатора в интернейронах гиппокампа СА1 области. В 50% случаев блокада (P2X2) рецепторов приводила к снижению частоты асинхронного выброса нейромедиатора, наблюдаемого в этих клетках, однако в другой половине экспериментов блокада рецепторов не влияла на характеристики асинхронного выброса нейромедиатора.
Идея об участии внутриклеточных депо и Са2+-зависимого Са2+-выхода в генерации асинхронного выброса нейромедиатора была предложена Narita и соавт. для объяснения асинхронного выброса нейромедиатора в нервно-мышечном синапсе лягушки [Narita et al., 2000; 1998]. В двух опубликованных статьях авторы показывают, что Са2+ вход через потенциал-зависимые Са2+-каналы способен запускать массивный выброс Са2+ из внутриклеточных депо, который, в свою очередь, инициирует асинхронный выброс нейромедиатора. В качестве доказательства авторы приводят данные о том, что опустошение внутриклеточных депо обработкой тапсигаргином приводило к существенному снижению амплитуд и длительности пресинаптических Са2+-сигналов, измеренных фотометрическими методами. Тем не менее такой механизм не может быть признан общим для синапсов с выраженным асинхронным выбросом нейромедиатора, так как зачастую снижение входа Са2+ через потенциал-зависимые Са2+-каналы приводит к усилению асинхронной компоненты, что находится в прямом противоречии с гипотезой Са2+-зависимого выхода Са2+ из внутриклеточных депо. В частности, в синапсах, сформированных СВ1-положительными интернейронами гиппокампа на телах пирамидных нейронов, частичная активация СВ1 рецепторов приводит к угнетению потенциал-зависимых Са2+-каналов, и, как результат, к снижению фазового выброса нейромедиатора, но при этом асинхронный выброс нейромедиатора усиливается. Таким образом, не будет преувеличением сказать, что источники Са2+ для асинхронного выброса нейромедиатора в настоящий момент не идентифицированы, и вышеперечисленные рецепторы, и сигнальные системы (P2X2, TRPV1 и Са2+-зависимый выброс Са2+ из внутриклеточных депо) могут модулировать длительность и амплитуду асинхронного выброса нейромедиатора, но не являются основными источниками Са2+ для генерации данного феномена.
АЛЬТЕРНАТИВНЫЕ ИСТОЧНИКИ Сa2+ ДЛЯ ГЕНЕРАЦИИ И ПОДДЕРЖАНИЯ АСИНХРОННОГО ВЫБРОСА НЕЙРОМЕДИАТОРА
Доступный в литературе материал говорит о том, что большинство исследований асинхронного выброса нейромедиатора концентрировались либо на идентификации особого Са2+ сенсора, обладающего высокой аффинностью к Са2+ и медленной кинетикой диссоциации с Са2+ и фосфолипидами мембраны, либо на поисках рецепторных систем, активация которых может приводить к дополнительному входу Са2+ в терминаль. Однако обычное синаптическое событие, вызванное даже одиночным ПД, способно вызвать синаптический выброс нейромедиатора, после чего Са2+ из терминаля должен быть быстро удален именно для того, чтобы обеспечить высокую синхронизацию и заблокировать дальнейший выброс нейромедиатора. Таким образом, правильная работа белков плазматической мембраны, транспортирующих Са2+, определяет временное окно, в течение которого возможен Са2+-зависимый экзоцитоз синаптических везикул. Соответственно, замедление либо блокада Са2+-транспортирующих белков плазматической мембраны может приводить к асинхронному выбросу нейромедиатора. В большинстве синапсов вывод Са2+ из пресинатических терминалей осуществляется Na+/Са2+-обменником и Са2+-АТФазой плазматической мембраны [Carafoli et al., 2001]. Са2+-АТФаза плазматической мембраны имеет высокую аффинность к ионам кальция, но относительно низкую скорость работы, а Na+/Са2+-обменник, наоборот, имеет низкую аффинность, но высокую скорость переноса Са2+ (до 5000 ионов Са2+ в секунду) [Carafoli et al., 2001]. Поэтому синергическая работа этих двух систем дополняет друг друга: при высоких концентрациях кальция внутри клетки ([Са2+]i) Na+/Са2+-обменник способен быстро выводить Са2+ из нервного окончания, снижая [Са2+]i до микромолей, а Са2+-АТФаза доводит [Са2+]i до физиологичной нормы (сотни наномоль). В нормальных условиях Na+/Са2+-обменник плазматической мембраны транспортирует Na+ в клетку, а Са2+ – из клетки. Однако в некоторых случаях, например, когда внутриклеточная концентрация Na+ значительно увеличивается, обменник может работать в противоположном направлении, транспортируя Са2+ в клетку, а Na+ из клетки [DiPolo, Beaugé, 1987; Mullins, 1977]. Таким образом, после пачки потенциалов действия, которая значительно увеличивает концентрацию Na+ в пресинаптическом нервном окончании, Na+/Са2+-обменник может значительно замедлять свою работу, а в определенных состояниях закачивать кальций в клетку, вызывая асинхронный выброс нейромедиатора (рис. 1 (г)). Вклад входа кальция через обменник будет более выражен при недостаточном функционировании Са2+-АТФазы. Более того, имеются данные, показывающие, что экспрессия Са2+-АТФазы может быть снижена в ССК+/СВ1+ синапсах с выраженным асинхронным выбросом медиатора [Jensen et al. 2007]. Поэтому вероятность обратной работы обменника в этих синапсах в ответ на высокочастотную стимуляцию достаточно высока и заслуживает детального изучения. Тем не менее в настоящее время имеются данные, косвенно подтверждающие гипотезу разворота Na+/Са2+-обменника при высоких внутритерминальных концентрациях Са2+. В частности, на нервно-мышечном соединении рыб Данио-рерио было показано, что высокочастотная стимуляция нервного окончания в присутствии блокаторов потенциал-зависимых Са2+ каналов приводила к задержанному, но быстрому увеличению внутриклеточного Са2+ [Wen et al., 2013]. Можно предположить, что высокочастотная стимуляция в предложенных условиях (Са2+ вход заблокирован блокадой Са2+ каналов) приводила исключительно к повышению внутритерминальной концентрации натрия, что в свою очередь приводило к развороту обменника, и соответственно к задержанному входу Са2+ через обменник. Роль Са2+-транспортирующих белков плазматической мембраны в генерации асинхронного выброса нейромедиатора и модуляции фазовой компоненты в настоящее время мало изучена.
МУЛЬТВЕЗИКУЛЯРНЫЙ ВЫБРОС НЕЙРОМЕДИАТОРА
В течение длительного времени существовала точка зрения, что ПД в состоянии вызвать слияние не более одной везикулы в одной активной зоне, что привело к распространенной точке зрения о том, что максимальная вероятность выброса нейромедиатора не может быть больше единицы. Тем не менее, наблюдения последних лет показывают, что при определенных условиях в определенных синапсах ПД в состоянии запускать почти одновременное слияние более одной везикулы в одной и той же активной зоне [Christie, 2006; Higley et al., 2009; Oertner et al., 2002; Singer, 2007; Tong, Jahr, 1994; Watanabe et al., 2005]. В отличие от асинхронного выброса нейромедиатора, который в свою очередь тоже может быть рассмотрен как задержанный выброс нейромедиатора нескольких везикул, постсинаптические ответы во время мультивезикулярного выброса нейромедиатора высокосинхронизированы. Поэтому сам факт выброса нескольких квантов нейромедиатора за одно синаптическое событие в одной активной зоне может быть установлен лишь с применением фармакологических инструментов (низкоаффинных блокаторов постсинаптических лиганд-зависимых рецепторов), либо с использованием сложных аналитических подходов. Функционально мультивезикулярный выброс нейромедиатора позволяет, во-первых, повысить насыщение постсинаптических рецепторов, во-вторых, подобно асинхронному выбросу нейромедиатора вовлекать экстрасинаптические рецепторы за счет вытекания медиатора из синаптической щели. В настоящий момент мультивезикулярный выброс нейромедиатора был показан для большого числа синапсов гиппокампа, мозжечка и ствола мозга, но, несмотря на интенсивные исследования данного феномена, однозначной картины механизма, приводящего к одновременному слиянию двух или более квантов нейромедиатора, не было предложено. Существует две точки зрения о том, каким образом одиночный ПД может запускать слияние нескольких везикул. Согласно первой точке зрения, увеличение плотности Са2+-каналов повышает Са2+-концентрацию внутри домена и соответственно может увеличивать окно, доступное для фазового выброса нейромедиатора, что в свою очередь может приводить к почти синхронному выбросу нейромедиатора в одной активной зоне [Sheng et al., 2012]. В качестве альтернативной, но идеологически сходной гипотезы, можно рассматривать идею о плотной упаковке Са2+-каналов внутри активной зоны и вблизи везикулярных Са2+-сенсоров. В качестве посредников, обеспечивающих данную плотную упаковку Са2+-источников и Са2+-сенсоров, были предложены белки семейства RIM [Kaeser et al., 2011; Mittelstaedt et al., 2010]. Вторая гипотеза была предложена для объяснения мультивезикулярного выброса нейромедиатора, наблюдаемого в возбуждающих синапсах гиппокампа, образованных между мшистыми волокнами и пирамидными клетками поля СА3 [Chamberland et al., 2014]. Chamberland и соавт. предложили, что высокие концентрации Са2+, необходимые для мультивезикулярного выброса нейромедиатора, обеспечиваются за счет Са2+-зависимого выхода Са2+ из внутриклеточных депо, что в свою очередь может приводить не только к увеличению вероятности выброса нейромедиатора в одной активной зоне, но и к рекрутированию дополнительных активных зон в той же терминали.
В свете последних данных, говорящих о том, что существенное отличие аффинности синаптотагминов к Са2+, обеспечивающих слияние синаптических везикул, представляется интересной гипотеза о том, что мультивезикулярный выброс нейромедиатора подобно асинхронному выбросу нейромедиатора опосредуется разными Са2+ сенсорами. В частности, Syt7 мог бы запускать выброс нейромедиатора при концентрациях Са2+, недостаточных для Syt1-опосредованного экзоцитоза. В случае одиночного ПД быстрый спад внутриклеточного Са2+ (или Са2+ внутри микродомена) за счет вышеупомянутых механизмов может обеспечивать достаточный уровень синхронизации Syt1-Syt7-опосредованных событий. Однако возможность функционирования данного механизма требует дальнейших исследований, возможно, с применением генетически модифицированных животных (мышей, нокаутных по Syt7) или других молекулярно-биологических подходов.
Список литературы
Ali A.B., Todorova M. Asynchronous release of GABA via tonic cannabinoid receptor activation at identified interneuron synapses in rat CA1. Eur. J. Neurosci. 2010. 31 (7): 1196–1207.
Bacaj T., Wu D., Yang X., Morishita W., Zhou P., Xu W., et al. Synaptotagmin-1 and Synaptotagmin-7 Trigger Synchronous and Asynchronous Phases of Neurotransmitter Release. Neuron. 2013. 80 (4): 947–959.
Bennett M.R., Farnell L., Gibson W.G. The probability of quantal secretion near a single calcium channel of an active zone. Biophys. J. 2000. 78 (5): 2201–2221.
Bhalla A., Chicka M.C., Chapman E.R. Analysis of the synaptotagmin family during reconstituted membrane fusion: Uncovering a class of inhibitory isoforms. J. Biol. Chem. 2008. 283 (31): 21799–21807.
Bischofberger J., Geiger J.R.P., Jonas P. Timing and efficacy of Ca2+ channel activation in hippocampal mossy fiber boutons. J. Neurosci. 2002. 22 (24): 10593–10602.
Borst J.G.G., Sakmann B. Calcium influx and transmitter release in a fast CNS synapse. Nature. 1996. 383 (6599): 431–434.
Broadie K., Bellen H.J., DiAntonio A., Littleton J.T., Schwarz T.L. Absence of synaptotagmin disrupts excitation-secretion coupling during synaptic transmission. Proc. Natl. Acad. Sci. U. S. A. 1994. 91 (22): 10727–10731.
Carafoli E., Santella L., Branca D., Brini M. Generation, control, and processing of cellular calcium signals. Crit. Rev. Biochem. Mol. Biol. 2001. 36 (2): 107–260.
Chamberland S., Evstratova A., Toth K. Interplay between Synchronization of Multivesicular Release and Recruitment of Additional Release Sites Support Short-Term Facilitation at Hippocampal Mossy Fiber to CA3 Pyramidal Cells Synapses. J. Neurosci. 2014. 34 (33): 11032–11047.
Chen C., Satterfield R., Young S.M., Jonas P. Triple Function of Synaptotagmin 7 Ensures Efficiency of High-Frequency Transmission at Central GABAergic Synapses. Cell Rep. 2017. 21 (8): 2082–2089.
Christie J.M. Multivesicular Release at Schaffer Collateral-CA1 Hippocampal Synapses. J. Neurosci. 2006. 26 (1): 210–216.
Craxton M. A manual collection of Syt, Esyt, Rph3a, Rph3al, Doc2, and Dblc2 genes from 46 metazoan genomes – an open access resource for neuroscience and evolutionary biology. BMC Genomics. 2010. 11 (1): 1–21.
Daw M.I., Tricoire L., Erdelyi F., Szabo G., McBain C.J. Asynchronous Transmitter Release from Cholecystokinin-Containing Inhibitory Interneurons Is Widespread and Target-Cell Independent. J. Neurosci. 2009. 29 (36): 11112–11122.
DiPolo R., Beaugé L. Characterization of the reverse Na/Ca exchange in squid axons and its modulation by Cai and ATP. Cai-dependent Nai/Cao and Nai/Nao exchange modes. J. Gen. Physiol. 1987. 90: 505–525.
Fernández-Chacón R., Königstorfer A., Gerber S.H., García J., Matos M.F., Stevens C.F., et al. Synaptotagmin I functions as a calcium regulator of release probability. Nature. 2001. 410 (6824): 41–49.
Földy C., Darmanis S., Aoto J., Malenka R.C., Quake S.R., Südhof T.C. Single-cell RNAseq reveals cell adhesion molecule profiles in electrophysiologically defined neurons. Proc. Natl. Acad. Sci. 2016. 113 (35): 5222–5231.
Geppert M., Goda Y., Hammer R.E., Li C., Rosahl T.W., Stevens C.F., et al. Synaptotagmin I: A major Ca2+sensor for transmitter release at a central synapse. Cell. 1994. 79 (4): 717–727.
Gustavsson N., Han W. Calcium-sensing beyond neurotransmitters: functions of synaptotagmins in neuroendocrine and endocrine secretion. Biosci. Rep. 2009. 29 (4): 245.
Hefft S., Jonas P. Asynchronous GABA release generates long-lasting inhibition at a hippocampal interneuron-principal neuron synapse. Nat. Neurosci. 2005. 8 (10): 1319–1328.
Higley M.J., Soler-Llavina G.J., Sabatini B.L. Cholinergic modulation of multivesicular release regulates striatal synaptic potency and integration. Nat. Neurosci. 2009. 12 (9): 1121–1128.
Hui E., Bai J., Wang P., Sugimori M., Llinas R.R., Chapman E.R. Three distinct kinetic groupings of the synaptotagmin family: candidate sensors for rapid and delayed exocytosis. Proc. Natl. Acad. Sci. U. S. A. 2005. 102 (14): 5210–5214.
Jappy D., Valiullina F., Draguhn A., Rozov A. GABABR-Dependent Long-Term Depression at Hippocampal Synapses between CB1-Positive Interneurons and CA1 Pyramidal Cells. Front. Cell. Neurosci. 2016. 10.
Jensen T.P., Filoteo A.G., Knopfel T., Empson R.M. Presynaptic plasma membrane Ca2+ ATPase isoform 2a regulates excitatory synaptic transmission in rat hippocampal CA3. J. Physiol. 2007. 579 (Pt 1): 85–99.
Kaeser P.S., Deng L., Wang Y., Dulubova I., Liu X., Rizo J., et al. RIM proteins tether Ca2+channels to presynaptic active zones via a direct PDZ-domain interaction. Cell. 2011. 144 (2): 282–295.
Kaeser P.S., Regehr W.G. Molecular Mechanisms for Synchronous, Asynchronous, and Spontaneous Neurotransmitter Release. Annu. Rev. Physiol. 2014. 76 (1): 333–363.
Katz B., Miledi R. The Measurement of Synaptic Delay, and the Time Course of Acetylcholine Release at the Neuromuscular Junction. Proc. R. Soc. B Biol. Sci. 1965. 161 (985): 483–495.
Klausberger T., Marton L.F., O’Neill J., Huck J.H., Dalezios Y., Fuentealba P., et al. Complementary roles of cholecystokinin- and parvalbumin-expressing GABAergic neurons in hippocampal network oscillations. J. Neurosci. 2005 25(42): 9782–9793.
Li Y.C., Chanaday N.L., Xu W., Kavalali E.T. Synaptotagmin-1- and Synaptotagmin-7-Dependent Fusion Mechanisms Target Synaptic Vesicles to Kinetically Distinct Endocytic Pathways. Neuron. 2017. 93 (3): 616–631.e3.
Littleton J.T., Stern M., Schulze K., Perin M., Bellen H.J. Mutational analysis of Drosophila synaptotagmin demonstrates its essential role in Ca2+-activated neurotransmitter release. Cell. 1993. 74 (6).
Llinás R., Steinberg I.Z., Walton K. Presynaptic calcium currents and their relation to synaptic transmission: voltage clamp study in squid giant synapse and theoretical model for the calcium gate. Proc. Natl. Acad. Sci. U. S. A. 1976. 73 (8): 2918–2922.
Luo F., Südhof T.C. Synaptotagmin-7-Mediated Asynchronous Release Boosts High-Fidelity Synchronous Transmission at a Central Synapse. Neuron. 2017. 94 (4): 826–839.e3.
MacDougall D.D., Lin Z., Chon N.L., Jackman S.L., Lin H., Knight J.D., et al. The high-affinity calcium sensor synaptotagmin-7 serves multiple roles in regulated exocytosis. J. Gen. Physiol. 2018. 150: 783–807.
Mittelstaedt T., Alvaréz-Baron E., Schoch S. RIM proteins and their role in synapse function. Biol. Chem. 2010. P. 599–606.
Moghadam P.K., Jackson M.B. The functional significance of synaptotagmin diversity in neuroendocrine secretion. Front. Endocrinol. (Lausanne). 2013.
Mullins L.J. No TitleA mechanism for Na/Ca transport. J Gen Physiol. 1977. 70 (6): 681–695.
Narita K., Akita T., Hachisuka J., Huang S., Ochi K., Kuba K. Functional coupling of Ca(2+) channels to ryanodine receptors at presynaptic terminals. Amplification of exocytosis and plasticity. J. Gen. Physiol. 2000. 115 (4): 519–532.
Narita K., Akita T., Osanai M., Shirasaki T., Kijima H., Kuba K. A Ca2+-induced Ca2+ release mechanism involved in asynchronous exocytosis at frog motor nerve terminals. J. Gen. Physiol. 1998. 112 (5): 593–609.
Nonet M.L., Grundahl K., Meyer B.J., Rand J.B. Synaptic function is impaired but not eliminated in C. elegans mutants lacking synaptotagmin. Cell. 1993. 73 (7): 1291–1305.
Oertner T.G., Sabatini B.L., Nimchinsky E.A., Svoboda K. Facilitation at single synapses probed with optical quantal analysis. Nat. Neurosci. 2002. 5 (7): 657–664.
Pang Z.P., Shin O.-H., Meyer A.C., Rosenmund C., Sudhof T.C. A Gain-of-Function Mutation in Synaptotagmin-1 Reveals a Critical Role of Ca2+-Dependent Soluble N-Ethylmaleimide-Sensitive Factor Attachment Protein Receptor Complex Binding in Synaptic Exocytosis. J. Neurosci. 2006. 26 (48): 12556–12565.
Peters J.H., McDougall S.J., Fawley J.A., Smith S.M., Andresen M.C. Primary Afferent Activation of Thermosensitive TRPV1 Triggers Asynchronous Glutamate Release at Central Neurons. Neuron. 2010. 65 (5): 657–669.
Poncer J.C., McKinney R.A., Gähwiler B.H., Thompson S.M. Either N- or P-type calcium channels mediate GABA release at distinct hippocampal inhibitory synapses. Neuron. 1997. 18 (3): 463–472.
Reyes A., Lujan R., Rozov A., Burnashev N., Somogyi P., Sakmann B. Target-cell-specific facilitation and depression in neocortical circuits. Nat. Neurosci. 1998. 1 (4): 279–285.
Rozov A., Burnashev N., Sakmann B., Neher E. Transmitter release modulation by intracellular Ca2+buffers in facilitating and depressing nerve terminals of pyramidal cells in layer 2/3 of the rat neocortex indicates a target cell-specific difference in presynaptic calcium dynamics. J. Physiol. 2001. 531 (3): 807–826.
Sabatini B.L., Regehr W.G. Timing of neurotransmission at fast synapses in the mammalian brain. Nature. 1996. 384 (6605): 170–172.
Sheng J., He L., Zheng H., Xue L., Luo F., Shin W., et al. Calcium-channel number critically influences synaptic strength and plasticity at the active zone. Nat. Neurosci. 2012. 15 (7): 998–1006.
Singer J.H. Multivesicular release and saturation of glutamatergic signalling at retinal ribbon synapses. J. Physiol. 2007. P. 23–29.
Stanley E.F. The calcium channel and the organization of the presynaptic transmitter release face. Trends Neurosci. 1997. P. 404–409.
Sugita S., Han W., Butz S., Liu X., Fernandez-Chacon R., Lao Y., et al. Synaptotagmin VII as a plasma membrane Ca(2+) sensor in exocytosis. Neuron. 2001. 30 (2): 459–473.
Sugita S., Shin O.H., Han W., Lao Y., Sudhof T.C. Synaptotagmins form a hierarchy of exocytotic Ca(2+) sensors with distinct Ca(2+) affinities. Embo J. 2002. 21 (3): 270–280.
Tong G., Jahr C.E. Multivesicular release from excitatory synapses of cultured hippocampal neurons. Neuron. 1994. 12 (1): 51–59.
Turecek J., Regehr W.G. Synaptotagmin 7 Mediates Both Facilitation and Asynchronous Release at Granule Cell Synapses. J. Neurosci. 2018. 38 (13): 3240–3251.
Watanabe J., A R., LP. W. Target-Specific Regulation of Synaptic Amplitudes in the Neocortex. J. Neurosci. 2005. 25 (4): 1024–1033.
Wen H., Hubbard J.M., Rakela B., Linhoff M.W., Mandel G., Brehm P. Synchronous and asynchronous modes of synaptic transmission utilize different calcium sources. Elife. 2013. 2013 (2).
Wen H., Linhoff M.W., McGinley M.J., Li G.-L., Corson G.M., Mandel G., et al. Distinct roles for two synaptotagmin isoforms in synchronous and asynchronous transmitter release at zebrafish neuromuscular junction. Proc. Natl. Acad. Sci. 2010. 107 (31): 13906–13911.
Wilson R.I., Kunos G., Nicoll R.A. Presynaptic specificity of endocannabinoid signaling in the hippocampus. Neuron. 2001. 31 (3): 453–462.
Zeisel A., Muñoz-Manchado A.B., Codeluppi S., Lönnerberg P., La Manno G., Juréus A., et al. Brain structure. Cell types in the mouse cortex and hippocampus revealed by single-cell RNA-seq. Science. 2015. 347 (6226): 1138–1142.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


