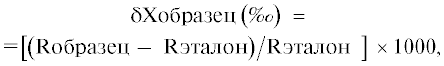Известия РАН. Серия географическая, 2022, T. 86, № 5, стр. 715-730
Изотопный состав углерода и азота компонентов подземных карстовых геосистем на примере экскурсионных пещер Предуралья и Кавказа
С. М. Турчинская a, *, А. А. Семиколенных b, С. Е. Мазина c, d, e, Э. П. Зазовская a
a Институт географии РАН
Москва, Россия
b Московский государственный университет имени М.В. Ломоносова, факультет почвоведения
Москва, Россия
c Научно-технический центр радиационно-химической безопасности и гигиены
Федерального медико-биологического агентства
Москва, Россия
d Российский университет дружбы народов
Москва, Россия
e Государственный университет по землеустройству
Москва, Россия
* E-mail: turchinskaya@igras.ru
Поступила в редакцию 02.06.2021
После доработки 01.07.2022
Принята к публикации 12.07.2022
- EDN: DCOROS
- DOI: 10.31857/S2587556622050132
Аннотация
Обобщены результаты исследований изотопного состава (δ13С и δ15N) фототрофных сообществ фотических зон и ламповой флоры пещер разных физико-географических областей: горной таежной (Предуралье, пещера Кунгурская Ледяная) и горной влажно-субтропической лесной (Западный Кавказ, пещеры Ахштырская или Большая Казчебродская, Новоафонская им. Г.Ш. Смыр). Изучены основные закономерности фракционирования изотопов углерода и азота в сообществах фототрофных организмов, а также особенности формирования почвоподобных тел (солоидов) в экстремальных условиях пещер. Показано, что изотопный состав фитомассы подземных фототрофных сообществ заметно отличался в сравнении с наземными фототрофами сходных систематических и экологических групп накоплением в них изотопов 12С и 14N. Увеличение доли легких изотопов углерода и азота отмечено и для солоидов пещер в сравнении с почвами на дневной поверхности. Для подземных экосистем соотношение стабильных изотопов углерода варьирует от –47.3 до –32.4‰, для контрольных образцов (наземные) от –35.5 до –26.8‰. Изотопный состав азота показывает меньшее варьирование от –8 до –1.8‰ – в подземных местообитаниях, и от –3.5 до +2.0‰ – на дневной поверхности. Выдвинута гипотеза, что наблюдаемый эффект связан с ограниченностью газообмена подземных полостей с атмосферой и проявлением внутренних факторов формирования газового состава атмосферы пещер. По мере удаления от входа вглубь пещеры выявлена тенденция к смещению изотопных соотношений в сторону уменьшения содержания тяжелого изотопа углерода и накоплению легкого в ламповой флоре и солоидах дальних залов пещер. Сделано предположение о наличии географического тренда фракционирования изотопов углерода пещерных сообществ разных природных зон (бореальной и горно-лесной субтропической).
ВВЕДЕНИЕ
В подземных пространствах (пещерах, шахтах и др.) формируются специфические условия обитания живых организмов. Набор экологических факторов, влияющих на функционирование подземных экосистем, отличен от действующих на поверхности Земли: частичная изоляция в пространстве, лимитированное количество источников вещества и энергии; ограниченный газообмен с атмосферой, частичное или полное отсутствие солнечного света, высокая влажность и относительно стабильные микроклиматические параметры (Falasco et al., 2014; Lamprinou et al., 2012; Prous et al., 2015). Специфика экологических факторов позволяет рассматривать пещеры в качестве природных частично автономных модельных систем для изучения биогеохимических циклов элементов и первичного педогенеза.
В подземных экосистемах обитает специфическая биота, представленная бактериями, цианобактериями, грибами, водорослями, высшими растениями и животными. Большинство подземных сообществ используют органическое вещество, поступающее с инфильтрационными, инфлюационными и паводковыми водами, с воздушными потоками, рассеянное органическое вещество горных пород, а также вещество, привнесенное биогенным или антропогенным путями и др. Существует ряд автохемотрофных сообществ, использующих для поддержания жизненного цикла неорганические соединения (серы, марганца, железа, водорода и других) (Barton et al., 2004; Chen et al., 2009). Однако отдельное место занимают фототрофные сообщества обрастаний, развитие которых лимитировано интенсивностью освещения (Шарипова, Абдуллин, 2006; Albertano, 2012; Roldán and Hernandez-Marine, 2009). Фототрофные сообщества формируются в привходовых зонах подземных полостей в условиях естественного освещения, а видовой состав в сообществах меняется в соответствии с градиентом освещенности: от доминирования папоротников и мохообразных до водорослей и цианобактерий (Fry, 2006; Mulec, 2015). Другим вариантом развития фотосинтезирующих видов на удаленных от входной зоны участках пещер является ламповая флора – сообщества, заселяющие освещенные искусственным светом пространства вокруг стационарно установленных ламп при оборудовании пещер для экскурсионных целей (Мазина, 2016; Mulec, 2015; Wang et al., 2015). Ламповая флора может занимать значительные площади, колонизируя различные субстраты, в том числе вторичные минеральные отложения, такие как кальцитовые натеки (Mulec, 2019). Особенности освещения (Cigna, 2011; Popkova et al., 2019; Roldán and Hernandez-Marine, 2009) и микроклиматических параметров (Albertano, 2012; Smith and Olson, 2007), пути поступления зачатков фототрофов, специфика их переноса внутри пещеры (Culver and Pipan, 2009; Mulec, 2019), а также характеристики грунтов (Trinh et al., 2018) определяют видовой состав и структуру сообществ, в которых доминируют теневыносливые виды (Cigna, 2019; Mulec, 2015), а водоросли и цианобактерии часто формируют биопленки (Figueroa et al., 2017; Hoffmann, 2002; Lamprinou et al., 2012). Сообщества с доминированием фотоавтотрофов включают и гетеротрофную компоненту: грибы, бактерии, и могут рассматриваться как консорции (Albertano, 2012; Kozlova et al., 2019; Trinh et al., 2018).
Оборудование пещер искусственными источниками света, изменение параметров температуры и влажности, развитие обильной биомассы фотосинтезирующих организмов и формирование сложных биопленок сопровождается изменением функционирования всей экосистемы пещеры (Engel, 2015). В результате многообразных процессов взаимодействия между исходным субстратом и биотой происходит растворение и трансформация поверхностных слоев материнской породы (Hoffmann, 2002; Jones et al., 2008), образование первичных биокосных почвоподобных объектов (Мазина, Семиколенных, 2015; Семиколенных, Таргульян, 2010).
Почвоподобные тела пещер (в дальнейшем, будем применять к ним термин “солоиды” (soloids)) (Горячкин и др., 2019) – это примитивные почвы, “образования на стенах, полу и потолке, формирующиеся в результате последовательной трансформации минерального субстрата in situ под прямым или косвенным воздействием микроклимата пещеры и микроорганизмов”, обладающие почвоподобной структурой и функционально выполняющие роль почв на дневной поверхности (Семиколенных, 2002).
Специфика экологических факторов позволяет нам отнести солоиды пещер к объектам экстремального почвообразования (Горячкин и др., 2019). В зависимости от геологических и геохимических обстановок первичное почвообразование в пещерах может быть связано и с деятельностью хемолитотрофных организмов: процессами окисления рудных минералов, химических соединений железа, серы, водорода и некоторых других элементов (Семиколенных, 2002; Engel, 2015). Кроме того, влияют процессы, связанные с рассеянным веществом горных пород или метаном (Hutchens et al., 2004).
В мировой литературе имеется множество работ, посвященных изучению ущерба (физического, химического, биологического, эстетического), наносимого экосистемам пещер фототрофными сообществами обрастаний (Mulec, 2015), мерам борьбы с ламповой флорой (Albertano et al., 2005; Cigna, 2019; Trinh et al., 2018) и изучению антропогенной нагрузки, вызванной эксплуатацией музеефицированных пещер (Falasco et al., 2014; Hoffmann, 2002; Mulec, 2015). Однако вопросы трансформации субстрата и почвообразования в условиях подземной среды все еще остаются слабоизученными.
В последнее десятилетие одним из ведущих инструментальных методов для изучения процессов саморегуляции систем, органоминеральных взаимодействий, трансформации веществ в экстремальных условиях стал анализ стабильных изотопов. Формирование и трофический статус фототрофных сообществ подземных местообитаний изучались с помощью изотопного анализа углерода и азота. Метод позволяет получать информацию об источниках вещества и энергии, их движении через биологические системы, а также позволяет оценивать вовлеченность элементов (С, N) в процессы фотосинтеза, дыхания, питания и т.д. (Тиунов, 2007; Fry, 2006; Robinson, 2001; Scrimgeour and Robinson, 2003).
Целью данной работы было исследование изотопного состава углерода и азота фототрофных сообществ и солоидов подземных местообитаний на примере пещер, расположенных в разных физико-географических областях.
ОБЪЕКТЫ ИССЛЕДОВАНИЯ
Объектами нашего исследования стали три пещеры, расположенные в горной таежной (Предуралье, пещера Кунгурская Ледяная, Пермский край) и горной влажно-субтропической лесной (Западный Кавказ, пещеры Ахштырская или Большая Казчебродская, Краснодарский край, и Новоафонская им. Г.Ш. Смыр, Республика Абхазия) областях (Атлас …, 2019). Исследование проведено в подземных карстовых геосистемах, сложенных известняками и гипсами, и характеризующихся разным уровнем антропогенной нагрузки. У всех исследуемых пещер распространение фототрофов не ограничивается привходовой зоной подземного пространства, освещенной солнечным светом. В экскурсионных целях пещеры оборудованы искусственными источниками освещения. В табл. 1 представлены общие характеристики объектов исследования. Информация о протяженности, температуре, дате оборудования пещер взята из литературных источников (Андрейчук, Дрофеев, 1995; Горбунова и др., 1992; Мавлюдов и др., 2018; Popkova et al., 2019).
Таблица 1.
Характеристика объектов исследования
| Объект | Спелео-страна (Атлас …, 2019) | Природная зона | Координаты | Дата обору-дования (освети- тельные приборы) | Порода | Средняя температура воздуха пещеры, °C | Относи-тельная влажность воздуха, % | Протя-женность, м |
|---|---|---|---|---|---|---|---|---|
| Кунгурская Ледяная (Пермский край) | Восточно-Европейская | Южная тайга | 57°26′25″ с.ш. 57°00′26″ в.д. |
1947 г. | Гипс | –2…+5 | 90–100 | ~5700 |
| Ахштырская (Краснодарский край) | Крымско-Кавказская | Субтропические лиственные леса | 43°31′10″ с.ш. 39°59′38″ в.д. |
2000 г. | Известняк | +9–18 | 60–80 | ~270 |
| Новоафонская им. Г.Ш. Смыр (Республика Абхазия) | Крымско-Кавказская | Субтропические лиственные леса | 43°06′02″ с.ш. 40°47′26″ в.д. |
1975 г. | Известняк/гипс | +12.5–15 | 90–100 | ~3285 |
Понятие подземной полости (пространства, ландшафта) гетерогенно, и при наличии некоторых общих черт разные объекты могут существенно различаться. Размер и обособленность пространства влияют на динамику атмосферного обмена с поверхностью и микроклиматические показатели экосистем. Пещера Ахштырская Адлерского района г. Сочи имеет небольшую протяженность, температура в пещере непостоянна и может колебаться в различные сезоны (Popkova et al., 2019). Пещеры Новоафонская и Кунгурская Ледяная представляют собой частично изолированные системы, имеющие бо́льшие площади и стабильные физико-химические параметры среды в удаленных от входа залах (Мазина и др., 2015; Мазина, Семиколенных, 2015; Persoiu and Lauritzen, 2018). Такие подземные геосистемы устойчивы к динамическим поверхностным изменениям, но остаются зависимыми от них за счет экзогенного привноса аллохтонного вещества с водными и воздушными потоками (Семиколенных, 2002).
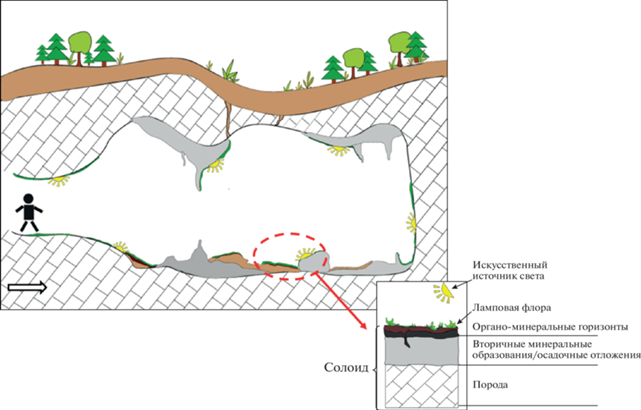
Были исследованы биомасса фототрофных сообществ обрастаний и образующиеся под этими сообществами солоиды – трансформированный субстрат. Изучены сообщества на полу и сводах стен карстовых полостей с различными доминирующими группами видов: цианобактериальные биопленки, сообщества зеленых водорослей, ассоциации мохообразных, обрастания чехлообразующих цианобактерий, сообщества с доминированием папоротников или их заростков (рис. 1). Сообщества располагались в фотических зонах пещер и на искусственно освещенных участках вокруг ламп – ламповая флора. Схематичное изображение локализации фототрофных сообществ ламповой флоры и солоидов представлено на рис. 2.
Рис. 1.
Фотографии объектов исследования: (а) фототрофное сообщество ламповой флоры с доминированием мхов рода Fissidens; (б) фототрофные сообщества ламповой флоры с доминированием чехлообразующих цианобактерий; (в), (г) солоиды пещер под сообществами ламповой флоры с доминированием водорослей и мхов.

МЕТОДЫ
Отбор проб в пределах одного подземного пространства осуществляли по трансекте от входа вглубь пещеры (к дальним залам). Материал с каждого исследованного светового пятна отбирали и анализировали отдельно. В качестве контрольных (поверхностных) проб для сравнения были взяты органо-аккумулятивные горизонты почв, сформированных на поверхности рядом с исследуемыми пещерами, и биомасса основных доминирующих фототрофных организмов (мхи, папоротники), аналогичные сообществам фототрофов пещерных местообитаний.
Определение изотопного состава углерода органического вещества и азота проводили после предварительной подготовки образцов к анализу. Подготовка включала разделение пробы на биомассу и солоид. В данном исследовании в каждой конкретной точке отбора пробы анализировали вещество солоида, без деления на горизонты. Биомассу вручную разделяли по доминирующим группам видов: цианобактерии, водоросли, мохообразные, папоротники и их заростки, и многокомпонентные биопленки. Для каждого из типов сообществ были определены роды-доминанты, встречавшиеся в исследованных пещерах. Определение видового состава фототрофов не входило в задачи данной работы, при наличии явных доминантов в сообществах они указывались.
Отделенную биомассу промывали, чтобы очистить образцы от минеральной составляющей (пыли и остатков пещерного грунта). Образцы материала солоидов, цианобактериальных и водорослевых биопленок (соскобы с породы) обрабатывали 1 М раствором HCl для удаления карбонатов (минерального углерода), а затем промывали до нейтральной реакции среды (Wang et al., 2015). Все пробы были высушены и гомогенизированы до состояния тонкой пыли. Масса навески для материала пещерных солоидов составляла ≈3500–4000 мкг, масса навески для фототрофов ≈1500–1600 мкг. Каждый образец анализировали в двукратной повторности.
Измерение соотношений стабильных изотопов углерода и азота проводили на комплексе оборудования ЦКП “Инструментальные методы в экологии” ИПЭЭ РАН: элементном анализаторе Thermo Flash 1112 и изотопном масс-спектрометре Thermo Delta V Plus. Изотопный состав углерода и азота выражали в тысячных долях отклонения от международного эталона (vPDB и атмосферного N2), δ:
где Х – это элемент (С или N), а R – молярное соотношение тяжелого и легкого изотопов в анализируемом образце и эталоне. В эталонах, по определению, δ13С и δ15N равны нулю.Образцы были проанализированы относительно референтных газов (N2 и CO2), откалиброванных по стандартным материалам МАГАТЭ (глутаминовая кислота USGS 40, USGS 41 и целлюлоза IAEA-CH3). В качестве рабочего лабораторного стандарта использовали люцерну (для фитомассы) и хитин (для солоидов). Образцы рабочего стандарта анализировали после каждой 10-й пробы. Кроме того, в каждую серию образцов (около 100 измерений) включали 6 проб стандарта казеина массой ≈100–200 мкг для калибровки прибора. Аналитическая погрешность определения изотопного состава углерода и азота была в пределах ±0.2‰. Вместе с определением изотопного состава, во всех пробах было определено общее содержание углерода и азота органического вещества (%C и %N) и их атомное соотношение (C/Natm).
Общая проанализированная выборка составила 105 образцов, из них 49 образцов – биомасса фототрофных сообществ:
• 44 образца из пещеры Кунгурская Ледяная, из них 14 – фототрофные сообщества и биопленки;
• 43 образца из пещеры Новоафонская, из них 24 – образцы биоты;
• 18 проб из пещеры Ахштырская, из которых 11 – фототрофные сообщества.
Отбор проб биомассы и солоидов проводили в весенне-летние периоды (май–июнь) 2016–2018 гг.
Выполняли сравнение образцов биоты из подземных местообитаний с фитомассой растений наземных местообитаний, произрастающих вблизи исследуемых пещер, а также солоидов пещер − с образцами органо-аккумулятивных горизонтов почв на дневной поверхности.
Замеры концентрации диоксида углерода проводили в Новоафонской пещере (Республика Абхазия) с помощью недиспергирующего инфракрасного анализатор CO2 фирмы Spectrum (США). Диапазон измерений прибора: 0–4000 мг/м3. Точность измерения ± 5% или 50 мг/м3 CO2. В течение 2018 г. было выполнено три цикла мониторинга содержания углекислого газа в воздухе (28 января, 27 мая и 28 июня) на экскурсионном маршруте пещеры.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изученные пещеры отличались друг от друга по ряду свойств: географическому положению, климатическими параметрами среды, степени антропогенной нагрузки, количеству источников искусственного освещения внутри подземного пространства и периоду их установки (см. табл. 1). Кроме того, пещеры отличались друг от друга и от наземных экосистем видовым составом сообществ обрастаний. Выделены виды (роды), которые встречались на большинстве исследованных участков (подземных и наземных): мхи Fissidens bryoides Hedw. и Marshantia polymorpha L., папоротники Asplenium trichomanes L. и Adiantum capillus-veneris L.
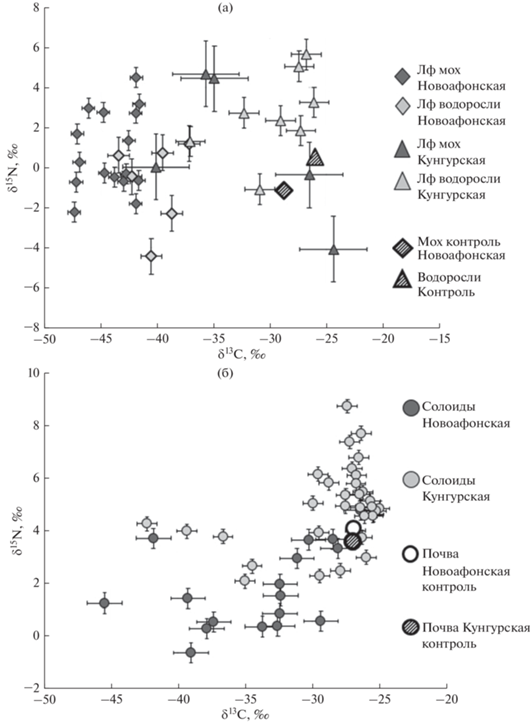
Сопоставление данных по соотношениям стабильных изотопов углерода и азота в биомассе наземных фототрофных организмов с образцами ламповой флоры из пещер Новоафонская, Кунгурская Ледяная и Ахштырская позволило выявить их отличие. Диапазон значений δ15N находится в пределах от –8.0 до –1.8‰ – для сообществ ламповой флоры пещер, и от –3.5 до +2.0‰ – для наземных фототрофов. Уменьшение доли тяжелых изотопов азота 15N отмечено и для солоидов пещер (диапазон значений от +0.3 до +2.0‰) в сравнении с почвами на дневной поверхности (диапазон значений от +3.6 до +4.1‰). Достоверность отличий проверялась с помощью критерия Манна−Уитни. Сравнение средних значений δ15N двух выборок (внутри и снаружи пещер) показало, что различия значимы (р = 0.031). Для изотопных соотношений углерода прослеживалась четкая тенденция сдвига δ13С в подземных местообитаниях в сторону уменьшения содержания тяжелого изотопа углерода 13С за счет аккумуляции легкого изотопа 12С (рис. 3). Сравнение средних значений δ13C двух выборок (внутри и снаружи пещер) по критерию Манна−Уитни также показало, что различия статистически значимы (р = 0.0001). Диапазон значений δ13С находится в пределах от –46.7 до –37.5‰ – для сообществ ламповой флоры пещер и от –35.5 до –26.0‰ – для наземных фототрофов. Для солоидов пещер этот диапазон находится в пределах от –37.9 до –32.4‰, а для почв на дневной поверхности от –29.0 до ‒26.9‰. Можно предположить, что наблюдаемый эффект связан с ограниченностью газообмена полостей с атмосферой и проявлением внутренних факторов формирования газового состава атмосферы пещер. Так, снижение содержания изотопа 13С в ламповой флоре может объясняться многократным оборотом углерода в пределах экосистемы пещеры (“перефиксация углерода”). Происходит фиксация обедненного тяжелым изотопом 13C углекислого газа, выделяемого при дыхании фототрофных организмов и при разложении органического вещества. Кроме того, дискриминация тяжелого изотопа углерода в сообществах ламповой флоры может происходить из-за так называемого “эффекта лесного полога” (“canopy effect”) – накопления легкого изотопа низкорослыми растениями или нижними ветвями деревьев вследствие увеличения степени фракционирования изотопов 13С/12С при теневом фотосинтезе (Brooks et al., 1997). В случае подземных экосистем влияние лесного полога отсутствует, но из-за особенностей режима освещения пещер, имеет место сам механизм, при котором происходит дискриминация тяжелых изотопов углерода в процессе фотосинтеза.
Рис. 3.
Сравнение изотопного состава сообществ ламповой флоры пещер и поверхностных (наземные сообщества фототрофов).
Примечания. *1лф – образцы ламповой флоры пещеры (например: “лф мох” – образец ламповой флоры мха); *2контроль – пробы с поверхности вблизи пещер.
Описываемое выше отличие параметров среды (ограниченная циркуляция воздуха, многократная ассимиляция углекислого газа и аккумуляция биогенного СО2 в воздухе) подземных экосистем аналогичным образом влияет на изотопный состав их компонентов по мере удаления от входа вглубь пещеры. При сопоставлении величин δ13С в пробах ламповой флоры и солоидах, отобранных от входа по трансекте вглубь пещеры, выявлена тенденция к смещению изотопных соотношений в сторону уменьшения содержания в них тяжелого изотопа углерода и накоплению легкого в дальних залах пещер. Для двух объектов с максимальными выборками данных, пещер Кунгурская и Новоафонская, были построены диаграммы распределения δ13С в пределах каждой из них (рис. 4). Отмечена тенденция к накоплению легкого изотопа углерода 12С сообществами ламповой флоры удаленных от входа залов пещеры по сравнению с образцами из залов, расположенных вблизи входовых пространств (см. рис. 4а, б). Для оценки достоверности обнаруженной тенденции был выбран регрессионный анализ (парная линейная регрессия). Параметры оценены методом наименьших квадратов. Статистическая значимость уравнений проверена с помощью коэффициентов детерминации и критерия Фишера. Установлено, что в пещере Новоафонская 72.65% общей вариабельности δ13С фототрофных сообществ объясняется изменением расстояния (в метрах) от выхода (см. рис. 4а). Аналогично рассчитаны показатели для пещеры Кунгурская Ледяная: в 83.84% случаев изменение расстояния от входа в глубь пещеры приводят к изменению соотношения δ13С в ламповой флоре (см. рис. 4б). Точность подбора уравнений регрессии высокая, параметры моделей при α = 0.05 статистически значимы. Эта тенденция сохраняется и в почвоподобных телах, формирующихся под фототрофными сообществами: качество уравнений регрессий высокое, коэффициент детерминации для исследуемой ситуации в солоидах Новоафонской пещеры равен 0.9219, для Кунгурской Ледяной пещеры – 0.7228 (см. рис. 4в, г).
Рис. 4.
Закономерности изотопных соотношений δ13С ламповой флоры и солоидов в пределах подземного пространства: (а), (в) изотопный состав углерода ламповой флоры (представленной сообществами с доминированием мохообразных) и солоидов Новоафонской пещеры по трансекте от входа к дальним залам вдоль экскурсионного маршрута; (б), (г) изотопный состав углерода ламповой флоры (представленной сообществами водорослевых обрастаний) и солоидов Кунгурской Ледяной пещеры по трансекте от входа к дальним залам. Примечание. *1лф – ламповая флора пещерных местообитаний.
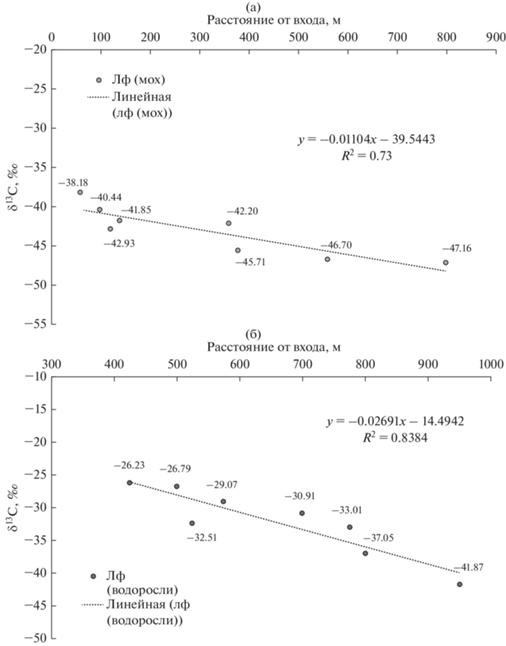
Рис. 4.
Окончание. Закономерности изотопных соотношений δ13С ламповой флоры и солоидов в пределах подземного пространства: (а), (в) изотопный состав углерода ламповой флоры (представленной сообществами с доминированием мохообразных) и солоидов Новоафонской пещеры по трансекте от входа к дальним залам вдоль экскурсионного маршрута; (б), (г) изотопный состав углерода ламповой флоры (представленной сообществами водорослевых обрастаний) и солоидов Кунгурской Ледяной пещеры по трансекте от входа к дальним залам. Примечание. *1лф – ламповая флора пещерных местообитаний.
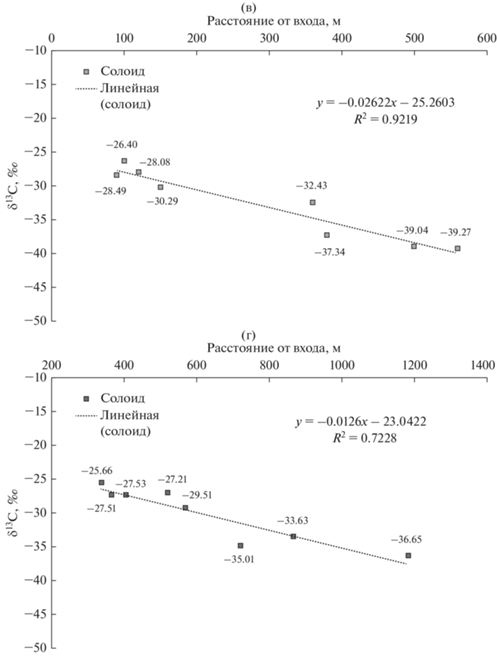
Кроме того, тенденцию к повышению концентрации СО2 в глубинных зонах пещер позволили выявить замеры диоксида углерода, проведенные в зимний и летний сезоны на разных участках пещеры Новоафонская (рис. 5). Особенно это проявилось в теплое время года (летний цикл). Ранее описаны два варианта накопления СО2 в воздухе пещер: нисходящая циркуляция (от верхнего входа) и восходящая циркуляция воздуха (к нижнему входу) (Мавлюдов, 1994). Таким образом, в зависимости от топологии пещеры, температуры воздуха и атмосферного давления на поверхности, максимальная концентрация диоксида углерода может достигаться как в удаленной от входа части подземного объекта, так и наоборот, – в его привходовой части. Замеры концентраций СО2 в пещере Новоафонская показали незначительное накопление диоксида углерода (см. рис. 5). В целом, можно сделать вывод о нисходящей циркуляции воздуха от верхнего входа вглубь подземного пространства. Однако, на газообмен сильно влияют водоотливные шахты в середине пещеры (через которые происходит обмен воздушными массами), а также туристический режим (с открыванием и закрыванием ворот-створов на входе в пещеру). Были зафиксированы значения порядка ~1800 ppm (зал Апсны) в сравнении с ~750 ppm на входе на маршрут (зал Анакопия), и с контролем воздуха на поверхности ~350 ppm.
Рис. 5.
Концентрация СО2 в воздухе пещеры Новоафонская по трансекте от входа к дальнему залу пещеры по данным полевых измерений.
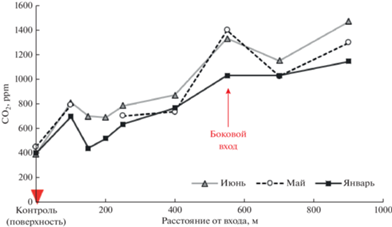
На примере пещер Новоафонская и Кунгурская Ледяная показано, что при образовании солоидов под фототрофными сообществами пещер происходит смещение в сторону увеличения содержания в них тяжелых изотопов 13С органического вещества относительно ламповой флоры (рис. 6). Подобные изотопные вариации описаны ранее при трансформации наземной биомассы почвенными процессами. Утяжеление углерода почвенного органического вещества связывают, в основном, с фракционированием изотопов в процессах микробного дыхания (эмиссия СО2) и минерализацией вещества (Моргун и др., 2008; Тиунов и др., 2011).
Рис. 6.
Изменение изотопных соотношений при депонировании фитомассы фототрофных сообществ в солоиды пещер: (а) Новоафонская пещера; (б) Кунгурская Ледяная пещера. Примечание. *1лф – ламповая флора пещеры.
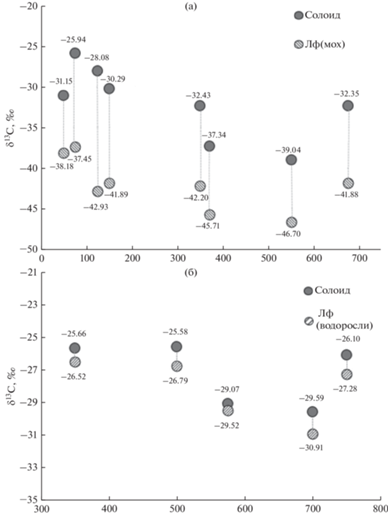
Показано, что наибольшее смещение δ13С (разница) между вегетирующей фитомассой и органическим веществом солоидов под сообществами ламповой флоры с доминированием мхов наблюдается в пещере Новоафонская (Δ ≈ 10.0‰) (см. рис. 6а). Достоверность отличий для флоры и солоида оценивалась с помощью критерия Манна−Уитни. Сравнение средних значений δ13С двух выборок показало статистическую значимость этих отличий (р < 0.001). В пещере Кунгурская Ледяная, где сообщества преимущественно представлены водорослевыми матами, смещение изотопных соотношений менее выражено (Δ ≈ 1.0‰), по критерию Манна−Уитни различия статистически незначимы (р = 0.31) (см. рис. 6б). Данное явление может быть связано как с особенностями биологического фракционирования в различных систематических группах организмов, так и с сукцессионной стадией колонизации субстрата. В стадии первичной колонизации скальных поверхностей и плотных субстратов (гипс, известняк, кальцит) с воздушно-капельным увлажнением преобладают одноклеточные зеленые водоросли (Chlorella vulgaris, Mychonastes homosphaera, Chlorococcum minutum) и цианобактерии (Gloeocapsa rupestris, Gloeothece rupestris, Nostoc punctiforme, Oscillatoria limnetica). На рыхлых и трещиноватых субстратах в кавернах, заполненных глинистыми отложениями, а также на плотных субстратах с маломощными глинистыми отложениями, помимо зеленых водорослей и цианобактерий начинают развиваться мхи Fissidens gracilifolius, протонема мхов, заростки папоротников и папоротники Phyllitis scolopendrium. На глинистых отложениях в зависимости от освещенности и возраста сообществ могут доминировать протонема мхов и мхи рода Fissidens и Sciurohypnum, заростки папоротников и ювенильные папоротники родов Asplenium и Phyllitis. Чем выше процент сосудистых растений в структуре фототрофных сообществ, тем выше доля углерода в веществе солоида, тем активнее идет процесс трансформации органического вещества и фракционирования изотопов. При сравнении соотношений изотопов азота большой разброс значений δ15N не позволяет на данном этапе исследования охарактеризовать закономерности фракционирования изотопов при формировании солоидов под фототрофными сообществами пещер.
Были проанализированы несколько групп образцов из пещеры Ахштырская для исследования трансформации органического вещества, однако мы обнаружили существенную разницу в соотношениях δ13С между вегетирующей фитомассой и солоидами (Δ ≈ 25.0‰). Данные процентного содержания углерода и азота в образцах и соотношение С/Natm свидетельствуют о возможном остаточном загрязнении проб карбонатами. Это требует дальнейшего исследования.
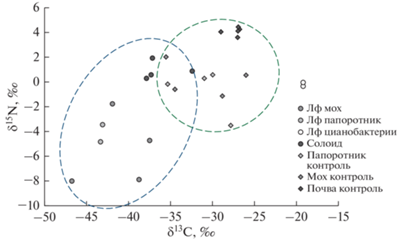
Сравнение диапазонов значений изотопных соотношений углерода и азота для объектов из бореальной таежной зоны (пещера Кунгурская Ледяная) и горно-лесной субтропической (пещера Новоафонская) позволило выявить их отличие. В пещере, расположенной южнее, отклонение по соотношениям изотопов углерода δ13С в сторону накопления легкого изотопа 12С в фототрофных сообществах (рис. 7а) и солоидах (рис. 7б) имело более выраженный характер. По соотношениям δ15N в фототрофных сообществах пещер выраженной тенденции не обнаружено.
ВЫВОДЫ
На основе анализа полученных данных для пещер Ахштырская, Новоафонская и Кунгурская Ледяная сделаны следующие выводы:
1. Изотопный состав (δ13С, δ15N) фототрофных сообществ ламповой флоры заметно отличается от образцов наземных фототрофов сходных систематических и экологических групп в сторону уменьшения в них доли тяжелых изотопов 13С и 15N.
2. Обеднение биомассы фототрофов изотопом 13С позволяет выдвинуть гипотезу о влиянии специфического газового состава подземной среды, формируемого в результате многократного оборота углерода в цикле фототрофного анаболизма и аккумуляции биогенного СО2 в воздухе пещеры на фоне ограниченного газообмена между подземным пространством и дневной поверхностью. В количественном отношении данный процесс характеризуется соотношениями стабильных изотопов углерода в диапазоне от –47.3 до –32.4‰ для подземных, и от –35.5 до –26.8‰ для наземных местообитаний (контроль). Для азота изотопные соотношения характеризуются менее значимым варьированием. Диапазон значений δ15N составляет от –8 до –1.8‰ – в подземных местообитаниях и от –3.5 до +2.0‰ – на дневной поверхности.
3. Уменьшение доли тяжелого изотопа углерода в компонентах экосистем по мере удаления от входа вглубь пещеры происходит за счет проявления внутренних факторов формирования газового состава атмосферы пещер.
4. Солоиды, формирующиеся под фототрофными сообществами, характеризуются накоплением более тяжелых изотопов углерода (13С) и азота (15N) по сравнению с вегетирующей фитомассой ламповой флоры.
5. Сукцессионная стадия колонизации субстрата и доля сосудистых растений в составе сообщества может оказывать влияние на разницу значений δ13С между органическим веществом солоида и вегетирующей фитомассой. Под ламповой флорой с доминированием мхов разница в значениях δ13С составила около 10.0‰. Под сообществами, представленными преимущественно водорослевыми матами, смещение изотопных соотношений менее выражено и равно 1.0‰.
6. Сравнение изотопного состава углерода пещер двух разных географических зон позволяет выявить их отличие и предположить наличие географического тренда – фракционирование изотопов углерода в Кунгурской Ледяной пещере, расположенной в бореальной таежной зоне, существенно слабее по сравнению с экосистемами пещер горно-лесной субтропической зоны (Новоафонская, Ахштырская пещеры). Подтверждение этой тенденции требуeт увеличения числа исследуемых объектов из разных природных зон.
Список литературы
Андрейчук В.Н., Дрофеев Е.П. Антропогенный фактор и Кунгурская пещера // Кунгурская Ледяная пещера / ред. И.А. Лавров, Н.Г. Максимович, С.М. Блинов. М.: Пермь, 1995. Вып. 1. С. 85–99.
Атлас пещер России / ред. А.Л. Шелепин, Б.А. Вахрушев, А.А. Гунько, А.С. Гусев, А.И. Прохоренко, Г.В. Самохин, А.Г. Филиппов, Е.А. Цурихин. М.: РГО, РСС, 2019. С. 681–695.
Горбунова К.А., Андрейчук В.Н., Костарев В.П., Максимович Н.Г. Карст и пещеры Пермской области. П.: Изд-во ПГУ, 1992. 200 с.
Горячкин С.В., Мергелов Н.С., Таргульян В.О. Генезис и география почв экстремальных условий: элементы теории и методические подходы // Почвоведение. 2019. № 1. С. 5–19.
Мавлюдов Б.Р. Климатические системы пещер // Вопросы физической спелеологии. М.: МФТИ, 1994. С. 6–24.
Мавлюдов Б.Р., Кудерина Т.М., Грабено Е.А., Медведев А.А., Экба Я.А. Климат Новоафонской пещеры // Спелеология и карстоведение / отв. ред. В.М. Котляков, Б.Р. Мавлюдов. Вопросы географии. Русское географическое общество. М.: Изд. дом Кодекс, 2018. Т. 147. С. 218–243.
Мазина С.Е. Мохообразные и папоротники в составе ламповой флоры пещер // Юг России: экология, развитие. 2016. Т. 11. № 3. С. 140–150.
Мазина С.Е., Концевова А.А., Юзбеков А.К. Фотосинтезирующие виды пещеры Новоафонская, развивающиеся в условиях искусственного освещения // Естественные и технические науки. 2015.
Мазина С.Е., Семиколенных А.А. Формирование почвоподобных тел на участках искусственного освещения в пещерах: Сб. материалов Международ. науч. конф. “Роль почв в биосфере и жизни человека”, посвященной 100-летию со дня рождения академика Г.В. Добровольского. Москва, МГУ имени М.В. Ломоносова, 5–7 октября 2015 г. С. 205–206.
Моргун Е.Г., Ковда И.В., Рысков Я.Г., Олейник С.А. Возможности и проблемы использования методов геохимии стабильных изотопов углерода в почвенных исследованиях // Почвоведение. 2008. № 3. С. 299–310.
Семиколенных А.А. Микробиология пещер: история вопроса; задачи; типология пещерных местообитаний и микробных сообществ; ключевые проблемы: Материалы 1-й Общерос. науч.-практ. конф. “Проблемы экологии и охраны пещер: теоретические и прикладные аспекты”: Сб. науч. тр. Красноярск, 2002. С. 30–40.
Семиколенных А.А., Таргульян В.О. Почвоподобные тела автохемолитотрофных экосистем пещер хребта Кугитангтау (Восточный Туркменистан) // Почвоведение. М.: Изд-во Наука, 2010. № 6. С. 658–672.
Тиунов А.В. Стабильные изотопы углерода и азота в почвенно-экологических исследованиях // Изв. РАН. Сер. Биологическая. 2007. № 4. С. 475–489.
Тиунов А.В., Семенина Е.Э., Александрова А.В. Изотопный состав (13C/12С и 15N/14N) почвы, растительности, растительных остатков и сапротрофных подстилочных грибов. Структура и функции почвенного населения тропического муссонного леса (национальный парк Кат Тьен, Южный Вьетнам) / ред. А.В. Тиунов. М.: Тов-во научных изданий КМК, 2011. 277 с.
Шарипова М.Ю., Абдуллин Ш.Р. Альгофлора пещеры Шульган-Таш // Ботанич. журн. 2006. Т. 91. № 4. С. 546–555.
Albertano P. Cyanobacterial biofilms in monuments and caves. In Ecology of Cyanobacteria II: Their diversity in Space and Time / B.A. Whitton (Ed.). Springer, Dor-drecht, 2012. P. 317–343. https://doi.org/10.1007/978-94-007-3855-3_11
Albertano P., Bruno L., Bellezza S. New strategies for the monitoring and control of cyanobacterial films on valuable lithic faces // Plant Biosys. 2005. Vol. 139. № 3. November. P. 311–322. https://doi.org/10.1080/11263500500342256
Barton H.A., Taylor M.R., Pace N.R. Molecular phylogenetic analysis of a bacterial community in an oligotrophic cave environment // Geomicrobiol. J. 2004. Vol. 21:1. P. 11–20. https://doi.org/10.1080/01490450490253428
Brooks J.R., Flanagan L.B., Buchmann N., Ehleringer J.R. Carbon isotope composition of boreal plants: functional grouping of life forms // Oecologia. 1997. Vol. 110. № 3. P. 301–311.
Chen Y., Wu L., Boden R., Hillebrand A., Kumaresan D., Moussard H., Baciu M., Lu Y., Murrell J.C. Life without light: microbial diversity and evidence of sulfur- and ammonium-based chemolithotrophy in Movile cave // ISME J. 2009. 3 (9). P. 1093–1104. https://doi.org/10.1038/ismej.2009.57
Cigna A.A. Show caves. In Encyclopedia of caves. Academic Press, 2019. P. 909–921. https://doi.org/10.1016/B978-0-12-814124-3.00108-4
Cigna A.A. The problem of lampenflora in showcaves. In Proceedings of the 6th ISCA Congress, SNC of Slovak Republic, Slovak Caves Administration / P. Bella, P. Gazik (Eds.). 2011. P. 201–205.
Culver D.C., Pipan T. The Biology of Caves and Other Subterranean Habitats. Oxford: Oxford Univ. Press, 2009, 254 p.
Engel A.S. Microbial Life of Cave Systems. Life in Extreme Environments. Berlin, Boston: De Gruyter, 2015. Vol. 3. 321 p. https://doi.org/10.1515/9783110339888
Falasco E., Ector L., Isaia M., Wetzel C.E., Hoffmann L., Bona F. Diatom flora in subterranean ecosystems: a review // Int. J. of Speleol. 2014. 43 (3). P. 231–251. https://doi.org/10.5038/1827-806X.43.3.1
Figueroa F.L., Álvarez-Gómez F., del Rosal Y., Celis-Plá P.S.M., González G., Hernández M., Korbee N. In situ photosynthetic yields of cave photoautotrophic biofilms using two different Pulse Amplitude Modulated fluorometers Algal Research 22, 2017. P. 104–115. https://doi.org/10.1016/j.algal.2016.12.012
Fry B. Stable Isotope Ecology. NY: Springer, 2006. https://doi.org/10.1007/0-387-33745-8
Hoffmann L. Caves and other low-light environments:aerophitic photoautotrophic microorganisms. In Encyclopedia of Environmental Microbiology / G. Bitton (Ed.). NY: John Wiley & Sons, 2002. P. 835–843. https://doi.org/10.1002/0471263397.env247
Hutchens E., Radajewski S., Dumont M.G., McDonald I.R., Murrell J.C. Analysis of methanotrophic bacteria in Movile Cave by stable isotope probing // Environ. Microbiol. 2004. 6 (2). P. 111–120. https://doi.org/10.1046/j.1462-2920.2003.00543.x
Jones D., Lyon E., Macalady J. Geomicrobiology of biovermiculations from the Frasassi cave system // Italy. J. Cave Karst Stud. 2008. 70 (2). P. 76–93.
Kozlova E.V., Mazina S.E., Vladimir P. Biodiversity of phototrophs in illuminated entrance zones of seven caves in Montenegro // Ecologica Montenegrina. 2019. Vol. 20. P. 24–39. https://doi.org/10.37828/em.2019.20.3
Lamprinou V., Danielidis D., Economou-Amilli A., Pantazidou A. Distribution survey of Cyanobacteria in three Greek caves of Peloponnese // Int. J. of Speleol. 2012. Vol. 41. № 2. 12 p. https://doi.org/10.5038/1827-806X.41.2.12
Lavoie K., Northup D., Boston P. Sight Unseen: Microbes in Caves. NSS News (March). 2000. P. 68–69.
Mulec J. The diversity and ecology of microbes associated with lampenflora in cave and karst settings. Microbial Life of Cave Systems. In Life in Extreme Environments / A.S. Engel (Ed.). Berlin, Boston: De Gruyter, 2015. Vol. 3. P. 263–278.
Mulec J. Lampenflora. Encyclopedia of caves. Academic Press, 2019. P. 635–641. https://doi.org/10.1016/B978-0-12-814124-3.00075-3
Persoiu A., Lauritzen S.E. Ice caves. Amsterdam, Netherlands: Elsevier, 2018. 729 p.
Pfendler S., Karimi B., Maron P.A., Ciadamidaro L., Valot B., Bousta F., Alaoui-Sosse L., Alaoui-Sosse B., Aleya L. Biofilm biodiversity in French and Swiss show caves using the metabarcoding approach: first data // Sci. Total Environ. 2018. P. 1207–1217. https://doi.org/10.1016/j.scitotenv.2017.10.054
Popkova A., Mazina S., Lashenova T. Phototrophic communities of Ahshtyrskaya cave in the condition of artificial light // Ecologica Montenegrina. 2019. Vol. 23. P. 8–19. https://doi.org/10.37828/em.2019.23.2
Prous X., Lopes Ferreira R., Jacobi C.M. The entrance as a complex ecotone in a Neotropical cave // Int. J. of Speleol. 2015. 44 (2). P. 177–189. https://doi.org/10.5038/1827-806X.44.2.7
Robinson D. δ15N as an integrator of the nitrogen cycle // Trends Ecol. Evol. 2001. Vol. 16. P. 153–162.
Roldán M., Hernández-Mariné M. Exploring the secrets of the three-dimensional architecture of phototrophic biofilms in caves // Int. J. of Speleol. 2009. 38. P. 41–53. https://doi.org/10.5038/1827-806X.38.1.5
Scrimgeour C.M., Robinson D. Stable isotope analysis and applications // Soil and Environ. Analysis. CRC Press, 2003. P. 389–439.
Smith T., Olson R. A taxonomic survey of lamp flora (algae and cyanobacteria) in electrically lit passages within Mammoth Cave National Park, Kentucky // Int. J. of Speleol. 2007. 36. P. 105–114. https://doi.org/10.5038/1827-806X.36.2.6
Trinh D.A., Trinh Q.H., Tran N., Guinea J.G., Mattey D. Eco-friendly Remediation of Lampenflora on Speleothems in Tropical Karst Caves // J. of Cave and Karst Stud. 2018. Vol. 80. № 1. P. 1–12. https://doi.org/10.4311/2017ES0101
Wang G., Jia Y., Li W. Effects of environmental and biotic factors on carbon isotopic fractionation during decomposition of soil organic matter // Sci. Reports 5, 2015. P. 11 043. https://doi.org/10.1038/srep11043
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия географическая