Физиология растений, 2021, T. 68, № 2, стр. 206-224
О качественном составе липидов мембран растительных клеток
a Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
Москва, Россия
* E-mail: Zhukov_anatoly@list.ru
Поступила в редакцию 29.05.2020
После доработки 05.06.2020
Принята к публикации 08.06.2020
Аннотация
Обсуждаются литературные данные о качественном составе классов полярных липидов, составляющих мембраны растительных клеток. Приведен целый ряд классов фосфо-, глико- и других липидов, а также гидрофобных соединений, не содержащих ацильных групп. Рассматривается жирнокислотный состав полярных липидов, состав аминоспиртов, входящих в гликосфинголипиды, и оксикислот, которыми богаты цереброзиды. Отмечена определяющая роль насыщенных жирных кислот в создании такого физического состояния мембран, которое является оптимальным для нормального их функционирования. Акцентирована необходимость и возможность построения трехмерных моделей биомембран. Предложен логический подход, посвященный наилучшему пониманию роли качественного многообразия состава липидов в устройстве биомембран. Приведены материалы, свидетельствующие о возможности химической и биологической трансформации липидов в растениях. Рассмотрены некоторые вопросы структуры мембран, в том числе микродомены, ремоделирование бислоя и везикулярный трафик.
ВВЕДЕНИЕ
Необходимыми компонентами клеточных мембран являются полярные липиды (ПЛ). ПЛ существуют в оводненных клетках в виде обширных бимолекулярных слоев, имеющих гидрофильную внешнюю поверхность и гидрофобное внутреннее пространство. Вместе с пронизывающими бислой белковыми молекулами (интегральными белками) они образуют основу жидкой мозаичной структуры биологических мембран и определяют их функцию [1, 2]. Отдельные области мембран образуют микродомены, включающие специфические белки [3].
Известно, что биологические мембраны являются латерально неоднородными и включают отделы (субкомпартменты), различающиеся по своим биофизическим свойствам и составу. В последние годы множество работ посвящено разгадке основы этой гетерогенности. Для формализации физико-химического принципа, подтверждающего такую латеральную мембранную неоднородность, была предложена гипотеза мембранного (или липидного) плота (“raft”). Эта гипотеза основана на факте возникновения в определенных участках липидного бислоя преимущественных ассоциаций между окружающими ПЛ и холестерином, сфингогликолипидами, гликозилфосфатидилинозит (ГФИ)-связанными белками, интегральными белками, протеолипидами, содержащими С14-16 жирные кислоты (ЖК) или некоторыми классами липидов, содержащими повышенную долю насыщенных ЖК. Эти участки, образующие четкие, значительно более упорядоченные домены, образование которых обусловлено липид-липидными и липид-белковыми взаимодействиями, было предложено называть мембранными плотами. Эти плоты имеют размер 10–200 нм и чередуются с менее организованными и более текучими участками бислоя [4].
Можно предполагать, что индивидуальные ПЛ, стерины, интегральные и периферические белки и некоторые другие соединения содержатся в биомембранах в определенных молярных соотношениях. Поэтому один из возможных путей исследования структуры этих образований может состоять в установлении такого соотношения, т. е. в достоверном и точном определении молярного содержания каждого класса ПЛ и всех других компонентов какой-либо индивидуальной мембраны и построении на основе полученных данных ее теоретической модели. Несмотря на очевидный прогресс в биофизике модельных систем, которая используется для изучения биологических мембран, в настоящее время возникают значительные проблемы, связанные с нехваткой данных, касающихся полного анализа состава липидов в каждой отдельной органелле или конкретном участке двуслойной мембраны. Выполнение этого анализа иногда затруднено из-за значительной сложности качественного состава липидов в клетках растений [5].
Таким образом, для понимания строения мембран необходимо прежде всего располагать достоверными сведениями о качественном составе всех классов ПЛ в изучаемом объекте и, далее, о их молярном содержании. В имеющихся обзорах на указанную тему круг обсуждаемых классов ПЛ мембран часто ограничен и, кроме того, они иногда включает запасные липиды, не свойственные мембранам, или ПЛ животного происхождения и микроорганизмов [6–10]. Иногда имеющийся обзор посвящен лишь некоторой части многообразного мира высших растений и водорослей [11] или, наоборот, охватывает весь огромный раздел обмена липидов в растениях [12].
Полярные липиды – это различные производные ЖК, иначе называемые ацилсодержащими липидами. Эти соединения представляют собой амфифильные молекулы, состоящие из гидрофильной функциональной группы (иногда заряженной) и гидрофобных жирнокислотных хвостов. Это свойство позволяет им образовывать сдвоенные слои, в которых направленные друг к другу углеводородные хвосты контактируют между собой благодаря гидрофобным взаимодействиям, а гидрофильные головки направлены в разные стороны и обращены к водной фазе. Так формируется основная структура биологической мембраны [2, 13].
Следует пояснить, что в нашей работе термин “полярные липиды” охватывает все природные вещества, которые содержат остатки высших ЖК, соединенные сложноэфирными или амидными связями с полярными радикалами молекулы, и уступают триацилглицеринам (ТАГ) по величине подвижности при адсорбционной хроматографии, т. е. превышают по величине полярности ТАГ. Столь широкое применение данного термина является необычным, поскольку чаще всего его используют только для обозначения совокупности фосфо- и гликолипидов (ФЛ и ГЛ), называемых также “сложными липидами”. Однако сейчас хорошо известно, что такие представители “простых” липидов, как моно- и диацилглицерины (МАГ и ДАГ) также служат интегральными компонентами мембран многих растений. Поэтому было бы неправильным не учитывать данные соединения, наряду со сложными липидами, в работах по количественному изучению мембранных липидов растительных тканей.
Таким образом, у ФЛ или ГЛ в качестве гидрофильных головок могут выступать либо фосфат и его эфиры, либо гексозы, либо аминогруппа, к которой иногда присоединена глюкоза или фосфат. При гидролизе ПЛ образуются три или более первичных продукта [14, 15]. Химические формулы перечисленных ПЛ приведены в обзорах [6–10, 15, 16], а их полные химические наименования – в работах Кейтса [17] и Сristie [18].
Большинство классов ПЛ растительных тканей можно сгруппировать в разделы ФЛ и ГЛ; группа сфинголипидов растений почти полностью входит в раздел ГЛ (это гликосфинголипиды).
ФОСФОЛИПИДЫ РАСТИТЕЛЬНЫХ МЕМБРАН
ФЛ, именуемые также глицерофосфолипидами обычно состоят из глицерина, этерифицированного двумя молекулами ЖК, тогда как к третьей ОН-группе присоединен фосфат, который этерифицирован разными азотистыми основаниями (холином, этаноламином или серином), а также глицерином или инозитом [6–9, 15, 16]. Таким образом, к глицерофосфолипидам относятся производные фосфатидных кислот (ФК; 1,2-диацил-sn-глицеро-3-фосфата). ФК – глицерофосфолипиды, не этерифицированные веществами с упомянутыми азотистыми основаниями – содержатся в мембранах в ничтожно малом количестве, но играют важную роль как вторичные мессенджеры в сигнальных путях [16, 19]. В отличие от ФК, фосфатидилхолины (ФХ) в большинстве растительных объектов являются главным классом среди ПЛ, составляющих матрикс мембран [6, 7].
Фосфатидилэтаноламины (ФЭ), как известно, также широко встречаются в мембранах растительных клеток. Информации о физиологической функции ФЭ в растениях получено в настоящее время довольно мало. Известно, что ФЭ являются донорами остатка фосфоэтаноламина, необходимого для удерживания (заякоривания) белков на наружной поверхности мембран молекулами фосфатидилинозитгликанов (ФИ-гликаны; они же ГФИ) [20]. Помимо ФЭ, могут встречаться фосфатидил-N-метилэтаноламин и фосфатидил-N,N-диметилэтаноламин [17]. ФЭ часто образует форму N-ацетата ФЭ (N-АФЭ), которая также несет важную физиологическую роль в жизни растений. Активация метаболизма этого соединения связана с клеточными стрессами и, в частности, с патогенным стрессом. При этом N-АФЭ гидролизуется фосфолипазой D, и насыщенные N-ацетилэтаноламины действуют как липидные медиаторы для регулирования ионного потока, активируя экспрессию генов защиты [21]. Иногда N-АФЭ могут содержать при атоме азота ацетат вместо остатков высших ЖК.
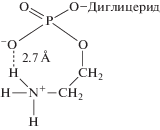
Структуру и функции ФЛ-матрикса клеточных мембран во многом определяют химические свойства полярной головной группы (ПГГ) ФЭ, как одних из главных составляющих мембраны. Свойства ПГГ зависят от входящих в ее состав химических связей и, прежде всего, от сложноэфирной Р-О-С-связи между остатками фосфорной кислоты и этаноламином. Химическое расщепление этой связи достигается лишь в весьма жестких условиях, путем кипячения в сильном (0.4 N) растворе щелочи [22]. Нами предположено, что высокая устойчивость Р-О-С-связи обусловлена тем, что фосфоэтаноламмониевая полярная головная группа ФЭ представляет собой прочную семичленную кольцевую структуру с нейтральным или слабоотрицательным зарядом (рис. 1). Образование кольцевой ПГГ вызвано внутримолекулярным электростатическим притяжением противоположно заряженных групп, а также присутствием водородной связи. Благодаря внутримолекулярному взаимодействию в кольцевой ПГГ ее атом азота располагается на близком расстоянии (2.7 Å) от кислородных атомов фосфата, а из-за отсутствия в этой кольцевой группе ФЭ свободных доноров/акцепторов водородных связей она очень слабо гидратирована.
Устранение внутримолекулярного взаимодействия в кольцевой группе ФЭ достигается ацетилированием остатка этаноламина этого соединения по атому азота уксусным ангидридом. При этом внутримолекулярная водородная связь разрывается, а полученный таким путем N-ацетамид ФЭ содержит практически нейтральную NH-группу и имеет отрицательный заряд, локализованный на атомах кислорода фосфатной группы. Способность ПГГ N-ацетамида ФЭ к гидратации как по остатку фосфата, так и NH-группировки резко возрастает, и потому устойчивость Р-О-С-связи к гидролизу значительно снижается. Таким образом, нами обнаружено, что кольцевая группа ФЭ является прочной негидратируемой кольцевой структурой, которая, вероятно, играет особую роль в функционировании мембран [22].
Фосфатидилглицерины (ФГ) всегда содержатся в хлоропластах, являясь необходимым компонентом реакционного центра фотосистемы II, их тилакоидов. Внешний слой мембран хлоропластов также состоит преимущественно из ФГ и галактолипидов [13]. Представляет значительный интерес, что ЖК клеток хлореллы включают транс-3-гексадеценовую кислоту (до 3.5% от суммы ЖК). При этом она почти исключительно сосредоточена в sn-2-положении ФГ.
В случае дифосфатидилглицеринов (ДФГ; другое название – кардиолипины) к молекуле ФГ присоединяется еще один диацилглицерофосфат, так, что образуется молекула ФЛ, включающая 4 ЖК, 2 фосфата и 3 глицерина. Кардиолипины – это липиды с уникальными свойствами и обнаруживаются они исключительно в мембранах, генерирующих электрический потенциал. Эти липиды имеют тенденцию к образованию неламеллярных структур, уменьшающих механическую устойчивость бислоя. Тем самым ДФГ инициируют изменения в мембранах (ремоделирование их двуслойной структуры) и делают их более проницаемыми [23]. Кардиолипины являются специфическим компонентом внутренней мембраны митохондрий у растений и у животных, синтезируются ферментами этой мембраны и составляют около 22% от суммы всех ее ФЛ [12, 24]. Помимо ФГ и ДФГ, возможно существование фосфатидилглицерофосфатов и фосфатидил-О-аминоацилглицеринов, где аминоацильная группировка R'' представлена остатком лизина, аргинина или аланина [17].
Фосфатидилсерины (ФС) – кислые ФЛ мембран – являются одной из составляющих ферментативного комплекса протеинкиназы С, формирующей ряд специфических ферментов. Связывание протеинкиназы С с ионами кальция позволяет ферменту вступать в кальций-опосредованное взаимодействие с молекулами ФС. Диацилглицерины, занимая специфические центры в протеинкиназе С, еще более увеличивают ее сродство с ионами кальция [22, 24].
Помимо азотистых оснований, глицерофосфолипиды могут включать и миоинозит, образуя фосфатидилинозиты (ФИ) [17, 18, 25]. Кроме ФИ, в растениях могут встречаться и ди-, и трифосфоинозитиды (ФИ(4)-фосфат и ФИ(4,5)-дифосфат; табл. 1). В листьях гороха (Pinus sativum) и суспензии одноклеточной зеленой водоросли Chlamidomonas eugametos были найдены лишь соединения ФИ(4)-фосфат и ФИ(4,5)-дифосфат [26]; эти же классы ПЛ были найдены и в Arabidopsis thaliana [44] и в Dunaliella salina [45]. Однако дифосфоинозитиды могут встречаться, помимо главного изомера (ФИ(4)-фосфат), также в виде ФИ(3)-фосфата или ФИ(5)-фосфата, как это было обнаружено в Chlamydomonas [27], а трифосфоинозитиды могут образовывать, помимо изомера ФИ(4,5)-дифосфат, ФИ(3,4)-дифосфат и ФИ(3,5)-дифосфат [28, 29]. ФИ можно извлечь из ткани только после добавления в экстрагент небольшого количества минеральной кислоты, причем сдвиг рН не может быть заменен увеличением ионной силы экстрагента. По-видимому, кислота необходима для разрыва прочных ионных связей между сильно полярными группировками липидных молекул и нерастворимыми полимерами клетки.
Таблица 1.
Некоторые необычные классы ПЛ, встречающиеся в составе мембран растительных клеток*
| № | Наименование | Объект | Ссылка |
|---|---|---|---|
| 1. | Фосфатидилметил- и фосфатидил-N,N-диметил-этаноламины | Эукариоты | [7, 9, 17] |
| 2. | N-ацетаты ФЭ | Высшие растения | [21] |
| 3. | Фосфатидилглицерофосфаты | Эукариоты | [17] |
| 4. | Фосфатидил-О-аминоацилглицерины | Эукариоты | [17] |
| 5. | ФИ(4)-, ФИ(3)- и ФИ(5)-фосфаты | Pinus sativum, Arabidopsis thaliana, Chlamidomonas | [7, 9, 26, 27] |
| 6. | ФИ(4,5)-, ФИ(3,5)-дифосфаты | P. sativum, A. thaliana, Dunaliella salina | [7, 9, 26, 28, 29] |
| 7. | ФИ-гликаны, ковалентно связанные с белками | Рис, A. thaliana, Spirodela oligorrhiza | [20, 24, 30] |
| 8. | Моноацилмоноалкилфосфатиды (из ФЭ или ФХ) | Эукариоты | [17] |
| 9. | Диалкилфосфатиды (из ФГ или фосфатидилглицерофосфата) | Эукариоты | [17] |
| 10. | Три- и тетра-галактозилдиацилглицерины | Клубни картофеля, листья шпината | [6, 10, 14] |
| 11. | Ацилгалактопиранозилэтандиолы | Корни кукурузы | [10, 18] |
| 12. | Гексадецилрамнопиранозилглицерины | Бобы Phaseolus mungo L. | [10, 18] |
| 13. | Моно-, ди- и all-β-ди-галактозилмоноглицериды | Высшие растения | [10, 18] |
| 14. | Ацилированные формы МГДГ, ДГДГ и моногалактозилмоноглицеридов | Пшеница, шпинат | [14] |
| 15. | Пальмитоил-β-D-глюкозид β- ситостерина | Высшие растения | [17] |
| 16. | 1,2,3-три-О-капроил- α -D-глюкопираноза | Высшие растения | [18] |
| 17. | D-глюко- и β-D-манно-пиранозил-N-ацилфитосфингозины | Высшие растения | [17] |
| 18. | Ди- и тригексозиды церамидов и тригексозид-N-ацетил-галактозамин церамидов | Эукариоты | [15, 17] |
| 19. | N-aцилфитосфингозил-фосфорилинозиты (ФГЛ) | Корни кукурузы, листья табака | [17, 18, 31, 32] |
| 20. | Инозитфосфорилцерамиды | Кукуруза, табак | [18, 33–36] |
| 21. | Диацилглицеротриметилгомосерины | Dunaliella salina | [28, 37, 38] |
| 22. | Диацилглицерогидроксиметил-триметилаланин | Chlamydomonas reinhardtii | [37–40] |
| 23. | 3-Ацетил-1.2-диацилглицерины | Euonimus | [41] |
| 24. | Моно-, ди- и триацильные производные гликозида этиленгликоля | Семена пшеницы | [42] |
| 25. | Ацильные производные 1-О- β-D-глюкопиранозилэтиленгликоля | Семена пшеницы | [43] |
К ФИ через посредство олигосахарида могут присоединяться специфические белки наружной поверхности мембраны. ФИ с присоединенным к одной из гидроксильных групп инозита олигосахаридом (гликаном) называют фосфатидилинозитгликанами. Связь белков с этими молекулами осуществляется через фосфоэтаноламин. ФИ-гликаны могут выполнять в мембране “якорную” функцию и отсюда их другое название – ГФИ-заякоренные белки. Считается, что при этом белок может образовывать ковалентную связь с ФИ-гликаном (например – щелочная фосфатаза), а отделение белка от поверхности мембраны происходит под действием фосфолипазы С [24]. Эти соединения найдены в арабидопсисе, рисе и многокореннике (Spirodela oligorrhiza; род травянистых растений из подсем. Рясковые или Lemnoideae) [30]. Cтановится все более очевидным, что некоторые ПЛ, помимо обеспечения среды для работы мембранных белков, во многих случаях способны влиять на их структуру и функции. Особенно это касается высокополярных заряженных ФЛ, каковыми являются ФИ и ФС, которые могут оказывать подобное влияние [46].
Возможно существование других вариантов структуры глицерофосфолипидов: лизоформ ряда ФЛ (таких, как ФЭ, ФХ, ФС и ФК), в которых молекула содержит лишь один остаток ЖК, а также моноацилмоноалкилфосфатидов (образующихся из ФЭ или ФХ) и диалкилфосфатидов (образующихся из ФГ или фосфатидилглицерофосфата) [17]. Такие ФЛ, как плазмалогены, у которых в первом положении глицерина находится не ЖК, а остаток спирта с длинной алифатической цепью, связанный простой эфирной связью, до настоящего времени в растениях не найдены. Также не найдены в растительных объектах фосфосфинголипиды, в которых сфингомиелин связан с фосфохолином в качестве полярной головной группы.
ФЛ участвуют в построении всех видов клеточных мембран; в основном состоят из ФЛ мембраны эндоплазматического ретикулума (ЭР) и митохондрий. Даже олеосомы – сферические масляные тела, формируемые в ЭР и состоящие из ТАГ, окружены монослоем из фосфолипидов, который содержит особые интегральные белки олеозины, а также и ряд других белков [13].
ГЛИКОЛИПИДЫ И ДРУГИЕ ЛИПИДЫ МЕМБРАН
Специфичной особенностью растений является наличие в их мембранах, помимо ФЛ, также и гликолипидов, которые являются липидными производными сахаров [6, 10, 30, 31, 47]. В данном разделе речь пойдет о таких пяти группах гликолипидов, как гликозилдиацилглицерины, сульфохиновозилдиацилглицерины (СХДГ), эфиры гликозидов стеринов (ЭГС), эфиры глюкозы и сахарозы и, наконец, гликосфинголипиды.
В молекулах группы 1 ГЛ – гликозилдиацилглицеринов – к гидроксильной группе диацилглицерина гликозидной связью присоединяются моно-, ди- или трисахариды. Это моно-, ди- и тригалактозилдиацилглицерины (МГДГ, ДГДГ и ТГДГ). Кроме того, что в растительных объектах найдены ТГДГ (табл. 1), найдены также и 6-О-ацил-МГДГ или 6-О-ацил-ДГДГ [14]. Хлоропласты содержат ГЛ, которые являются основными компонентами тилакоидных мембран, но встречаются также и во внешней мембране. ГЛ не формируют истинный бислой, однако присутствие их клиновидных молекул важно для образования изгибов мембран и формирования тилакоидов. Форма молекул ГЛ способствует также встраиванию белков в липидный слой мембраны [13].
Последовательное добавление к МГДГ (β-D-гал-ДАГ) остатков α-D-галактопиранозила в положении С6 галактозы приводит к образованию не только ДГДГ (α-D-гал(1,6)-β-D-гал-ДАГ), но и три- (две формы) и тетрагалактозилдиацилглицеринов (также две формы) [18]. Добавление остатков β-D-галактопиранозила приводит к получению еще и all-β-дигалактозил-, all-β-тригалактозил- и all-β-тетрагалактозилдиацилглицеринов. Однако не ясно, содержатся ли все эти компоненты в мембранах клеток растений, в частности, мембранах пластид. Кроме того, из корней кукурузы выделен ацилгалактопиранозилэтандиол. А в прорастающих бобах мунг (Phaseolus mungo L.) найден рамнозилированный тригалактолипид (гексадецилрамнопиранозилглицерин, включающий три галактопиранозильных остатка) [18].
В результате воздействия ферментов при повреждениях клеток возможно образование некоторых производных МГДГ и ДГДГ. Уменьшение количества ацильных групп приводит к возникновению моногалактозилмоноглицеридов, дигалактозилмоноглицеридов и all-β-дигалактозилмоноглицеридов. Присоединение ацильных групп к положению С6 терминала галактозы приводит к получению ацилированных форм моногалактозилмоноглицеридов, МГДГ и ДГДГ. Следует иметь в виду, что МГДГ и ДГДГ при гомогенизации клеток могут подвергаться действию ферментов ацилтрансферазы и гидролазы ацилов эфиров. Возможно также образование оксилипинов одной или обеих полиненасыщенных ацильных групп в составе МГДГ и ДГДГ; не установлено, задействован ли при этом ферментативный катализ [18].
Помимо гликозилдиацилглицеринов, важными компонентами мембран растительных клеток, в первую очередь мембранных систем хлоропластов и других форм пластид являются СХДГ (группа 2 ГЛ), в которых к гидроксильной группе диацилглицерина гликозидной связью присоединен сульфохиновопиранозил. СХДГ являются единственными растительными сульфолипидами [10, 18, 48–50]. СХДГ содержат остаток глюкозы, к которой присоединена группа сульфоновой кислоты; эта часть молекулы липида служит полярной головкой. СХДГ относятся к кислым полярным липидам и найдены только у растений, составляя около 10% от общего содержания липидов мембран. СХДГ сосредоточены главным образом во внутреннем слое мембран хлоропластов. СХДГ вместе с ФЛ определяют поверхностный заряд мембран, а также влияют на функциональную активность белковых комплексов тилакоидных мембран [13].
В раздел ГЛ многие авторы включают также класс гликозидов стеринов [51], которые не содержат остатков ЖК, и потому, по нашей градации, не являются липидами (см. выше). В то же время существуют и сложные эфиры гликозидов стеринов с ЖК (ЭГС), которые, таким образом, уже несомненно являются ПЛ и относятся к ГЛ (группа 3) [6]. ЭГС представляют собой широко распространенный класс гликолипидов растений. Из стеринов в них, как правило, встречается стигмастерин. ЭГС могут образовывать дисахаридные производные, из которых только целлобиозиды (β-1,4) и гентиобиозиды (β-1,6) в дальнейшем могут удлиняться до три-, тетра- и пентасахаридных цепей [18]. В растениях встречаются глюкопиранозиды стеринов, преимущественно ситостерина и стигмастерина, а также 6-пальмитоил-β-D-глюкозид β-ситостерина [17]. Эти модифицированные стероиды широко встречаются у растений, однако не все исследователи признают, что они вместе с остальными ГЛ являются компонентами мембран.
К гликолипидам (группа 4) относятся также эфиры глюкозы и сахарозы с коротко- (до С12) и, возможно, среднецепочечными ЖК, которые могут иногда составлять более 80% эпикутикулярных экссудатов (экстрацеллюларный материал эпидермальных поверхностей) некоторых растений – сем. Solanaceae, томатов, табака. Эти соединения могут включать до трех остатков каприловой кислоты, как, например, в 1,2,3-три-О-капроил-α-D-глюкопиранозе [18]. К ГЛ (группа 5) относится и группа гликосфинголипидов [52, 53]. Необходимо отметить, что, помимо этой группы, существует исходный вид простых сфинголипидов, которые не содержат в своем составе остатков сахаров и имеют название церамиды (N-ацилсфингозины или сфингенины). Гликосфинголипиды являются производными церамидов и включают: 1- цереброзиды (они же глюкозилцерамиды, церамидгексозиды или глюкозиды N-ацилсфингозинов), 2 – ди- и полигексозиды церамидов и 3 – фитогликолипиды (ФГЛ), которые иногда называют инозитфосфорилцерамидами (см. ниже) [17, 32, 54].
Цереброзиды образуются при взаимодействии церамидов через гидроксильные группы с другими радикалами, в частности, с углеводами [15, 17, 55, 56]. Растительные цереброзиды содержат от одного до четырех остатков сахаров (глюкозы и маннозы) в цепи. Примером таких соединений может служить 1-О-β-D-глюкопиранозил-N-ацилфитосфингозин, где R – 2-окси-(пальмитоил, стеароил, бегеноил или лигноцерил) [17]. Исходными можно считать два моноглюкозилцерамида, содержащих остатки либо β-D-глюкопиранозила, либо β‑D-маннопиранозила, из которых первый преобладает в фотосинтезирующих тканях. Глюкопиранозилцерамиды могут дополнительно присоединять по одному остатку маннозы или глюкозы, образуя диглюкозилцерамиды. Те из последних, которые содержат остаток маннозы на терминальном конце, могут присоединять еще остатки маннозы или глюкозы, образуя два три- и два тетраглюкозилцерамида с разным соотношением остатков двух сахаров [18]. Примером дигексозидов церамидов могут служить церамидлактозиды (1-О-β-D-галактопиранозил-О-β-D глюкопиранозил-N-ацилсфингозины) [17]. Показано существование еще и тригексозидцерамид-N-ацетилгалактозамина [20]. Следует иметь в виду, что каждый из моно-, ди- и тригексозидов церамидов образуют при адсорбционной хроматографии по две хроматографических зоны, содержащие соединения либо с нормальными ЖК, либо с гидроксиЖК [15]. В полигексозидах церамидов, как правило, гликозидная часть представляет собой олигосахаридную цепь, содержащую от двух до шести моносахаридов.
Помимо цереброзидов и полигексозидов церамидов, группа гликосфинголипидов включает ФГЛ, которые представляют собой N-ацилфитосфингозилфосфорилинозиты, связанные гликозидной связью с остатками ряда моносахаридов или полисахаридных групп [17, 18, 30, 33]; структура их установлена лишь в общих чертах [32, 34, 57]. Кроме инозита, фосфора и сфингозиновых оснований, содержащихся в молекуле ФГЛ, там могут присутствовать еще до десяти различных компонентов, включающих, возможно, до 16 и даже более остатков моносахаридов [17, 18, 30, 33, 58]. В ФГЛ церамид-1-фосфат связан с глюкозилированным инозитом фосфодиэфирной связью [18]. Центральной частью (ядром) молекулы ФГЛ являются инозитфосфорилцерамиды (ИФЦ), которые, возможно, могут встречаться в растительных тканях и в свободном состоянии. В других работах предполагается, что ИФЦ (другое их обозначение – фосфорилсфинголипиды) могут содержать в своем составе различные полисахаридные остатки и представляют собой разнообразную группу сфинголипидов, присутствующих в высших растениях и грибах; здесь, вероятно, обозначение ИФЦ приравнивается к ФГЛ [32]. Известна лишь предполагаемая структура ядра для главных разновидностей ИФЦ из кукурузы и табака [32–34, 37, 35 ]. Присутствие в молекулах ФГЛ различных полисахаридных групп препятствует возврату этих соединений в органическую фазу из водной при очистке экстракта, приводя к недооценке их содержания в растительных тканях [32, 34].
Первые данные о существовании ФГЛ в корнях кукурузы и их структуре получены Сarter с соавт. [33]. Позднее, ссылаясь на эту работу, некоторые авторы приводят возможные формулы этих веществ [17, 18, 30, 32]. Кроме того, ФГЛ обнаружены в листьях табака Hsieh с соавт. [34] и Kaul с соавт. [35], на которых также ссылаются в упомянутых более поздних работах [18, 32]. Присутствие ИФЦ показано, по крайней мере, в 7 различных растениях [32]. Церамидная часть ИФЦ обычно состоит из гидроксисфинганина или гидроксисфингенина и С24-гидроксиЖК. В свою очередь, в фосфорилсфинголипидах гидроксильная группа этерифицирована фосфатом или фосфохолином [32]. Функции ИФЦ в растениях изучены еще недостаточно; известно, что они могут служить, аналогично ГФИ, как якорь для удерживания белков.
Гликосфинголипиды, также как все упомянутые выше ПЛ, активно участвуют в создании структуры мембран, и, кроме того, являются метаболическими посредниками ряда клеточных процессов, таких как развитие пыльцы, передача сигнала трансдукции нa абсцизовую кислоту и ответная реакция растений на гипоксию и атаку патогенов. Гликосфинголипиды, включая ФГЛ, входят в состав ЭР и плазмалеммы [59].
Основа гликосфинголипидов – церамиды – это амиды ЖК с высшими аминоспиртами [17, 25, 30]; последние иногда называют длинноцепочечными ди- или тригидроксиоснованиями, или сфингооснованиями [15]. Наименования этих соединений, встречающиеся в литературе, к сожалению, часто довольно сильно различаются у разных авторов. Высшие аминоспирты в сфинголипидах обычно могут варьировать по длине цепи между С16 и С20 и подвергаться гидроксилированию и/или десатурации. Двойная связь в Δ8-положении может находиться как в цис-, так и транс-конфигурации, и соотношение этих изомеров варьирует в разных объектах. Двойная связь в Δ4-положении обычно присутствует в транс-конфигурации [50].
Высшие аминоспирты представлены, как правило, производными или гомологами насыщенного С18-аминодиола сфинганина (дигидросфингозина; 2-D-аминооктадекандиол-1,3-D). В этот класс веществ входят С18- и С20-аминоспирты, которые могут быть диолами или триолами, а также быть насыщенными или мононенасыщенными. К С18-аминоспиртам, помимо дигидросфингозина, относятся сфингозин, фитосфингозин и дегидрофитосфингозин, из которых первые два – диолы, а вторые два – триолы. Двойная связь имеется в сфингозине и дегидросфингозине. Из С20-аминоспиртов наиболее известны насыщенные С20-дигидросфингозин и С20-фитосфингозин [12]. По другим данным, из длинноцепочечных оснований наиболее часто встречаются 4-гидроксисфинганин (триол; t18:0; он же фитосфингозин), 4-гидрокси-8-сфингенин (t18:18), дигидросфингозин (диол; d18:0; он же сфинганин), 8-сфингенин (d18:18), 4-сфингенин (d18:14, известный как сфингазин) и 4,8-сфингадиенин (d18:24,8) [50].
Таким образом, сфинголипиды содержат в молекуле высший аминоспирт, включающий гидроксильные группы и аминогруппу, благодаря которой эти липиды имеют слабощелочные свойства. К аминогруппе аминоспиртов амидной связью (значительно более прочной, чем сложноэфирная) присоединена ЖК, которая содержит не более двух двойных связей. Гидролиз амидной связи для получения свободных оснований и ЖК из сфинголипидов обычно выполняют кипячением в 1М метанольном растворе NаОН в течение 18 ч [13, 22] или в 2N водно-метанольном растворе HCl в течение 5 или 18 ч [17].
В свободных церамидах из высших аминоспиртов преобладают производные триола фитосфингозина, например, триолы с добавлением или без добавления цис/транс-двойных связей при С8. В фитогликолипидах также преобладают триолы. В цереброзидах диолы и триолы встречаются в равных пропорциях с преобладанием 8-сфингенина, 4,8-сфингадиенина и 4-гидроксисфинганина (фитосфингозина) [10, 18, 60]. Только четыре высших аминоспирта найдены в цереброзидах арабидопсиса: 4-гидрокси-8-цис-сфингенин, 4‑гидрокси-8-транс-сфингенин, 8-транс-сфингенин и 8-цис-сфингенин. Из них главным компонентом является 4-гидрокси-8-цис-сфингенин, сопровождаемый преимущественно 2-оксинервоновой кислотой (С24:1-оксикислота) [61]. Помимо высших аминоспиртов, цереброзиды включают жирные кислоты с очень длинной цепью (ЖКОДЦ; до 78% от суммы всех ЖК). Кроме того, в цереброзидах могут содержаться до 14 видов оксикислот (см. ниже).
Обычно ПЛ сопутствуют в мембранах стерины и гликозиды стеринов, которые по нашей градации не входят в состав липидов, поскольку не содержат ЖК. Так, в плазмалемме есть ситостерин, стигмастерин и кампестерин и лишь следы холестерина. Кроме того, растительные ткани (особенно семена) содержат сложные эфиры стеринов и ЖК, которые из-за их большой хроматографической подвижности относятся не к ПЛ, а к нейтральным липидам. Стерины также амфифильны: гидроксильные группы образуют гидрофильную головку, а циклопентанпергидрофенантрен с боковыми заместителями играет роль гидрофобного хвоста. Стерины содержатся в наружной мембране митохондрий, ЭР и плазмалемме. Известно, что обогащение отдельных участков мембран стеринами необходимо, в частности, для стабилизации активной конформации молекул НАДФ·Н-оксидазы в этих участках.
Среди ПЛ одноклеточной водоросли Dunaliella salina, обитающей преимущественно в соленых морях, обнаружено значительное количество (8% от общих липидов плазматической мембраны) диацилглицеротриметилгомосерина, количество которого возрастает в 1.7 раза (в отличие от других ПЛ) при увеличении засоления среды выращивания в два раза [28]. Это соединение найдено и в водоросли Chlamydomonas reinhardtii [36, 37]. Кроме того, в водорослях обнаружен диацилглицерогидроксиметилтриметилаланин. Эти два соединения представляют собой N-метилированные гидроксиаминокислоты и называются бетаин липидами [38, 39].
Помимо ПЛ и стеринов, в составе внутренних мембран митохондрий и в тилакоидных мембранах важными функциональными компонентами служат изопреноиды и их производные, в частности каротиноиды и их эфиры с ЖК, убихиноны и пластохиноны. Каротиноиды представляют собой тетратерпены и являются углеводородами, содержащими несколько ненасыщенных связей. Эта группа включает в себя до 70 пигментов, содержащихся в разных растениях и грибах. Каротиноиды обычно рассматривают как производные ликопина, который обнаружен в плодах томатов и других растений.
В природных соединениях часто встречаются моно- и диацильные производные алкен-1-иловых эфиров глицерина, а также ацилалкиловые эфиры глицерина (моно- и диацильные производные алкилглицеринов) [17]. В созревающих семенах пшеницы найдены гликозилдиглицериды, а также диольные гликолипиды, которые представляют собой ацильные производные 1-О-β-D-глюкопиранозилэтиленгликоля [42]. Этими же авторами в созревающих семенах кукурузы найден аналогичный класс диольных гликолипидов – ацильное производное 1-О-β-D-галактопиранозилэтиленгликоля. Предполагается, что в семенах пшеницы содержатся моно-, ди- и триацильные производные гликозида этиленгликоля. При этом моноацильные производные по величине Rf близки к МГДГ, а ди- и триацильные не отделяются от свободных стеринов и ДАГ соответственно [41].
Нами обнаружиены новые, не отмеченные в них ранее липидные компоненты в зрелых семенах сои [62]. Так, наряду с ДАГ и МАГ, обнаружены неидентифицированные липиды, близкие к этим глицеридам по Rf; некоторые из них сохраняются и после омыления. Возможно, что эти зоны включают высшие алифатические спирты и/или О-диалкиловые эфиры глицерина, а также 1-О-моноалкиловые эфиры глицерина [22]. Помимо спиртов и простых эфиров, во фракциях малополярных липидов могут содержаться терпены и токоферолы, которые были предположительно идентифицированы в незрелых семенах сои [63]. Кроме того, в семенах сои могут содержаться эфиры каротиноидов и терпенов с ЖК, а также ацилированные гликозиды этиленгликоля, которые найдены в семенах кукурузы и пшеницы [64]. Помимо обычных ДАГ, в семенах и присемянниках бересклета (Euonymus L.) и ряда других растений содержатся ацетилДАГ (3-ацетил-1,2-диацил-sn-глицерины). В этих оптически активных соединениях две ОН-группы остатка глицерина этерифицированы высшими ЖК, а одна – уксусной кислотой [40].
В растительных объектах найдены также и протеолипиды. Они представляют собой интегральные гидрофобные белки биомембран и могут быть выделены из этих мембран только в виде комплексов с липидами. В растительных объектах протеолипиды обнаруженыв семенах сои [65], злаков [66] и Guizotia abissinica Cass. [67], в соевом масле [68] и в протопластах листьев гороха [69]. Ранее, после применения исчерпывающей экстракции липидов, нами показано присутствие в зрелых семенах сои около 20 неизвестных компонентов ПЛ [62].
ЖИРНОКИСЛОТНЫЙ СОСТАВ ЛИПИДОВ МЕМБРАН
В отличие от ТАГ, полярные, или конституционные, липиды растительных тканей характеризуются более разнообразным набором ЖК за счет многочисленных минорных компонентов и продуктов удлинения цепей кислот. Эти особенности обусловливают богатство структурных модификаций мембранных липидов, связанное с их функциональным многообразием.
Полярные липиды в основном содержат ЖК с 14–18 атомами углерода. Большинство этих ЖК является ненасыщенными и имеют 1–3 двойные связи, как правило, не сопряженные. Эти двойные связи всегда находятся в цис-конфигурации и крайне редко – в транс-положении. Последние имеются в транс-гексадецен-3-овой, элаидиновой (транс-октадецен-9-овой), брассидиновой (транс-докозен-13-овой), элеостеариновой (цис, транс, транс-октадекатриен-9,11,13-овой) ЖК, а также в высших Δ4-транс или Δ8-транс-аминоспиртах сфинголипидов. Нами приняты следующие сокращенные обозначения индивидуальных ЖК (на примере α-линоленовой кислоты: 18:3Δ9,12,15, где указано количество атомов С в цепи, число двойных связей и номера атомов, от которых отходит двойная связь, считая от карбоксильной группы (знак Δ). Эту кислоту можно обозначить как ω3-ЖК, поскольку последняя двойная связь расположена в ней в положении С-3 от метильного конца ЖК. Аналогично, ЖК 18:2Δ9,12 (линолевая), а также и 18:3Δ6,9,12 (γ-линоленовая) могут быть обозначены как ω6-ЖК.
α-Линоленовая кислота имеет особое, уникальное значение среди других ЖК в жизни растений. Независимо от генотипа растения α-линолеат всегда доминирует в липидах хлоропластов, где его уровень в галактолипидах тилакоидов может достигать 95%. Исходя из этого рассчитано, что во всей совокупности ЖК, содержащихся в живом веществе биосферы, доля α-линоленовой кислоты превышает 90%. Преобладание этой ЖК в хлоропластах, где она играет как структурную, так и метаболическую роль связаны с особенностями ее строения: СН3СН3СН=СНСН2СН= СНСН2СН=СН(СН2)7СООН.
На метильном конце цепи α-линоленовой кислоты расположена незаряженная система из трех двойных связей, отделенных от метильной группы 3, 6 и 9 атомами С, соответственно. Интересно, что аналогичная система двойных связей содержится и в цепи структурного аналога α-линолеата – гексадекатриеновой кислоты (16:3Δ7,10,13), которая встречается только в хлоропластах.
Значение данной ω-3,6,9-системы двойных связей состоит в том, что она способна принимать спиралевидную конформацию, которая образует тесную ассоциацию со спиральными цепями мембранных белков пластидных ламелл благодаря гидрофобному взаимодействию этой системы с π-орбиталями остатков ароматических аминокислот. При построении фотосинтетических субъединиц хлоропласта наиболее плотная упаковка галактолипидов, включая указанные ЖК, осуществляется не только с белками, но и с пигментами и, главным образом, с хлорофиллом. При этом обеспечивается оптимальная пространственная ориентация гидрофильных фоторецепторных порфириновых структур хлоропласта на поверхности липопротеиновых мембран и возможность быстрого переноса электронов в безводной среде с низкой диэлектрической постоянной [70].
В составе полиненасыщенных ЖК можно выделить две группы этих соединений. В первой группе биосинтез происходит по пути образования ЖК с регулярным положением цис-двойных связей в углеводородной цепи с участием мембранных ω6- и ω3-ацил-липидных десатураз, а во второй – с последующим образованием Δ5-ЖК при участии фронтальной Δ5-ацил-липидной десатуразы [71]. Наличие таких Δ5-ЖК, как таксолеиновая (18:2Δ5,9), эфедриновая (18:2Δ5,11), пиноленовая (18:3Δ5,9,12), конифероновая (18:4Δ5,9,12,15), скиадоновая (20:3Δ5,11,14), юнифероновая (20:4Δ5,11,14,17) и кислота 20:2Δ5,11 является отличительным признаком фотосинтезирующих и не фотосинтезирующих тканей голосеменных (Pinophyta) [72, 73], в том числе и сем. Саговниковых (Cycadaceae) [74]. Δ5-ЖК присутствуют в липидах семян сем. Лютиковых (Ranunculaceae), тканей мхов, лишайников, грибов и микроводорослей [71]. При этом содержание Δ5-ЖК может составлять до 30% от суммы ЖК и более. Фронтальная Δ5-десатураза принимает участие и в образовании таких важных для человека Δ5-ЖК, как арахидоновая (20:4Δ5,8,11,14) и эйкозапентаеновая (20:5Δ5,8,11,14,17), которые также характерны для наиболее древних в эволюционном отношении семейств растений. При этом синтез 20:4Δ5,8,11,14 и 20:5Δ5,8,11,14,17 осуществляется из дигомо-γ-линоленовой (20:3Δ8,11,14) и эйкозатетраеновой (20:4Δ8,11,14,17) кислот соответственно [75]. Можно видеть, что из перечисленных Δ5-ЖК 18:4 и 20:4, также как и эйкозапентаеновая кислота (20:5), являются ω3-ЖК; 18:3 и 20:3, также как и арахидоновая кислота (20:4), представляют собой ω6-ЖК; 18:2 и 20:2 относятся к ω9-ЖК, а эфедриновую кислоту можно считать ω7-ЖК.
Ранее нами показано, что наиболее прочно удерживаемые липиды мембран, как правило, бывают обогащены насыщенными ЖК и, в частности, пальмитиновой кислотой (16:0). С увеличением полярности в ряду отдельных фракций, полученных из суммарных липидов, возрастает содержание 16:0 в сумме ЖК данной фракции [76, 77]. Учитывая, что выделенные нами высокополярные липиды (ВПЛ), представляющие собой “аннулярные липиды” или липиды микроокружения ферментов, как раз и являются наиболее важными в составе мембран, можно говорить о физиологическом значении этой закономерности. Как известно, насыщенность алифатических остатков ПЛ определенного класса обратно пропорциональна текучести (fluidity) последних [78]. Следовательно, существование отмеченной нами обратной корреляции указывает на то, что диацилглицериновые радикалы мембранных ПЛ значительно уступают ТАГ тех же растений по величине текучести. Весьма вероятно, что в мембранах высших растений и водорослей содержание пальмитиновой кислоты не может снижаться ниже определенного уровня. Полученные данные позволяют заключить, что для создания жидкокристаллической структуры клеточных мембран высших растений и водорослей требуются ацильные остатки с менее высокой текучестью, чем те, которые необходимы для ферментативной мобилизации запасных масел при возобновлении роста [76]. Известно, что насыщенные липиды способствуют образованию относительно упорядоченных мембранных доменов, которые избирательно включают определенные липиды и белки [4]. Помимо обычных насыщенных ЖК в рстениях могут встречаться аналогичные ЖК с разветвленной цепью; так, в липидах голосеменных найдены три насыщенные ЖК с разветвленной цепью – антеизо-13:0, антеизо-15:0 и антеизо-17:0 [72, 74].
ВПЛ, состоящие главным образом из ФИ, ФС, ФГЛ и протеолипидов, как правило, бывают обогащены С20-26-ЖК, способными, благодаря своей длине, входить одновременно в обе половины бислоя мембраны, дополнительно скрепляя ее [75]. Установлено, что синтез ЖКОДЦ в эпидермисе имеет важное значение для контроля пролиферации клеток и, тем самым, для регуляции роста растений. Этот контроль может осуществляться путем воздействия на биосинтез цитокининов в сосудистой системе и изменение активности деления клеток при ростовых процессах [79].
В течение последних десятилетий показано, что в растительных тканях широко распространены оксилипины, которые представляют собой продукты перекисного окисления ацильных остатков ди- и триненасыщенных ЖК в полярных и нейтральных липидах под действием реактивных форм кислорода или липоксигеназных ферментов [80].
Уже упоминалось, что цереброзиды содержат значительное количество оксикислот; главным образом это насыщенные α-оксикислоты. α‑Оксикислоты образуют гомологический ряд с четным числом атомов С общей формулы СН3(СН2)nСН(ОН)СООН (n – нечетное число, от 7 до 21) [17]. Примером таких оксикислот может служить 2-оксипальмитиновая (16:0h), а преобладают среди них 16:0h, 20:0h и 24:0h [10, 16, 60]. Здесь буква h обозначает “hydroxy”. В дрожжах и грамотрицательных бактериях встречаются β-оксикислоты; примером насыщенных β-оксикислот является 3-оксипальмитиновая кислота. 3-Оксикислоты D-ряда являются промежуточными продуктами биосинтеза ЖК, а 3-оксикислоты L-ряда – промежуточными продуктами β-окисления. К ненасыщенным оксикислотам относится, например, 12-оксиолеиновая (рицинолевая) кислота, которая, однако, в цереброзидах практически не встречается, а также 2-окси-цис-тетракозен-15-овая (2-оксинервоновая; 24h:1) кислота [17].
Таким образом, связанные амидной связью ЖК или ЖКОДЦ могут подвергаться модификациям, варьируя по длине цепи от 14 до 30 атомов С и могут быть гидроксилированы в С2 положении и десатурированы в ω-9 положении, приводя к возникновению разнообразных изоформ сфинголипидов [54].
В свободных церамидах и гликозидах церамидов из всех исследованных источников преобладает 2-оксилигноцериновая кислота (или цереброновая кислота; С24:0-оксикислота или 24h:0); то же относится к фитогликолипидам. Часто гликоцереброзиды из листьев содержат много 2-оксипальмитиновой кислоты (16:0h); в руте, а также в корнях овса (в гликозилцерамидах плазматической мембраны) найдено высокое содержание 2-оксинервоновой кислоты (см. выше) [18].
В составе ЖК цереброзидов корней и листьев арабидопсиса (Arabidopsis thaliana) найдены как насыщенные С16-26-2-оксикислоты, так и мононенасыщенные (20h:1, 22h:1, 24h:1 и 26h:1), и даже кислоты с нечетным числом атомов углерода (23h:1и 25h:1). Главные из них – 2-оксинервоновая кислота (24h:1; 37–47%), 24h:0, 16h:0, 22h:0, 26h:0 и 26h:1. Существенно, что С16 и С18 моноеновые 2-оксикислоты отсутствуют в изучаемых объектах [18].
В различных тканях обнаружена тенденция комбинирования диольных аминоспиртов с короткоцепочечными (С16:0) оксикислотами, тогда как триольные аминоспирты обычно сопровождаются очень длинноцепочечными (С24:0) оксикислотами [18]. Известно, что гликозилцерамиды семян обычно обогащены диольными аминоспиртами и С16-20 насыщенными оксикислотами, в то время как в листьях эти липиды обогащены триольными аминоспиртами и насыщенными, очень длинными ацильными цепями (С20-26) [32, 81].
ФУНКЦИОНИРОВАНИЕ МЕМБРАН РАСТИТЕЛЬНЫХ КЛЕТОК И УЧАСТИЕ В ЭТОМ ПРОЦЕССЕ ПОЛЯРНЫХ ЛИПИДОВ
Разнообразие качественного и видового состава липидов мембран неразрывно связано с той многогранной ролью, которую последние выполняют в органах растений [82]. Клетки всех эукариотических организмов, в том числе и растений, помимо того, что сами ограничены мембраной, разделены на различные области или компартменты, также окруженные мембранами; эти образования называются органеллами. Таким образом, мембраны представляют собой одну из главных составляющих, “основу основ” растительных клеток – их мягкий скелет. Кроме того, именно на мембранах протекают многие важнейшие метаболические процессы, поскольку вторая главная составляющая всех эукариотических клеток – ферменты – большей частью базируются на мембранах и часто не способны выполнять свои функции вне этих мембран. Наконец, еще одна важнейшая составляющая растительных клеток – фотоактивные пигменты и реакционные центры, где эти пигменты функционируют (фотосистемы I и II), – требует жестких условий структурной организации. Эти реакционные центры локализованы, как известно, в мембранах стромальных и гранальных тилакоидов [83]. Известно, что толщина всей мембраны составляет 7–8 нм, а соответствующая величина для ее внутреннего гидрофобного слоя иногда принимается равной лишь 3 нм [5]. Биомембраны (в частности, плазмалемма), помимо липидов, белков, стеринов включают значительное количество углеводов, большая часть которых, однако, не являются самостоятельной составляющей биомембран, а входят в состав ГЛ [1, 12, 13].
Как известно, функции мембран очень разнообразны. 1. Барьерная. Избирательная проницаемость обеспечивает отделение клетки и клеточных компартментов от окружающей среды и снабжение их необходимыми веществами и защиту от опасных для клетки веществ. 2. Транспортная. Пассивный и активный транспорт через мембраны обеспечивает доставку питательных веществ, удаление конечных продуктов обмена веществ, секрецию различных веществ, создание ионных градиентов, поддержание в клетке оптимального рН и концентрации ионов, которые нужны для работы клеточных ферментов. Так, транспортную функцию ПЛ можно наблюдать, если в нижнюю часть U-образной трубки поместить хлороформ, в левое колено – раствор меченой сахарозы, а в правое колено – воду. При этом сахароза не должна переходить в правое колено. Если же в слой хлороформа вносится ФХ, сахароза быстро распределяется в обоих коленах [84]. Аналогичное солюбилизирующее действие оказывают ФЛ и на нелипидные компоненты биологических тканей. Так, при количественной экстракции липидов из семян сои в экстракт переходит до 56% массы семян, тогда как на долю самих ПЛ в сухом остатке полученного экстракта приходится менее 5% [85].
3. Матричная. Обеспечивает определенное взаиморасположение и ориентацию мембранных белков, их оптимальное взаимодействие. 4. Механическая. Обеспечивает автономность клетки, ее внутриклеточных структур, а также соединение с другими клетками в тканях. 5. Энергетическая. При фотосинтезе в хлоропластах и клеточном дыхании в митохондриях в их мембранах действуют системы переноса энергии, в которых участвуют как липиды, так и белки. 6. Рецепторная. Некоторые белки, содержащиеся в мембране, являются рецепторами, при помощи которых клетка воспринимает те или иные сигналы. 7. Ферментативная. Мембранные белки нередко являются ферментами. 8. Маркировка клетки. На мембране имеются антигены, действующие как маркеры, позволяющие опознать клетку. Это гликопротеины с разветвленными олигосахаридными боковыми цепями, играющие роль “антенн”. С помощью маркеров клетки могут распознавать другие клетки и действовать согласованно с ними, например, при формировании органов и тканей, а также определять чужеродные антигены [13, 77].
Считается, что белки отвечают, в основном, за фунционирование клеточных мембран, а ПЛ – за их структуру. В действительности и липиды могут выполнять в мембранах разнообразные функции. При рассмотрении перечисленных функций мембран можно видеть, что участие и роль ПЛ в одних случаях больше, в других меньше, в третьих – их роль еще мало изучена, но ясно, что все эти функции осуществимы только при наличии и участии липидов этих мембран (табл. 2). В последнее время при описании макроструктуры, динамики и функционирования мембран подтверждается важность специализированных доменов, таких как липидные плоты и белково-гликопротеиновые комплексы [4, 86]. Липидные плоты действуют как буферы физических свойств мембран, противодействуя изменениям в окружающей среде путем коррекции своего состава. При этом в жидкой фазе бислоя распределяются липиды либо с большей, либо с меньшей температурой плавления, т. е. насыщенные или ненасыщенные [87].
Таблица 2.
Главные классы ПЛ, участвующие в функционировании мембран растительных клеток*
| № | Функции мембран | Класс липидов | Ссылка |
|---|---|---|---|
| 1. | Барьерная | Главные ФЛ и ГЛ, бетаин-липиды, эфиры глюкозы и сахарозы с ЖК | [18, 37] |
| 2. | Транспортная | ФЭ, ФХ, ФГ, N-АФЭ и ГЛ | [21, 84] |
| 3. | Матричная | Аннулярные липиды | [76] |
| 4. | Механическая | ФХ, ФЭ, ФИ и ГЛ | [7, 15, 16] |
| 5. | Энергетическая а) в хлоропластах б) в митохондриях |
а) МГДГ, ДГДГ, СХДГ, ФГ б) ДФГ |
а) [10, 13, 18, 31, 32] б) [12, 24] |
| 6. | Рецепторная | ФК, ДАГ, ФИ, ФГЛ, ЖКОДЦ | [16, 17, 19, 31, 33, 59, 85] |
| 7. | Ферментативная | ФИ, ФС, ФГ, ФЭ, ФХ | [17, 18, 22, 24, 26, 28] |
| 8. | Маркировка клетки | Цереброзиды, ЖКОДЦ | [15, 55, 75] |
Понятие липидных плотов имеет как широкое распространение, так и большую противоречивость. Главное затруднение в исследовании мембранных плотов сводится к отсутствию прямого микроскопического обнаружения этих областей в невозмущенном состоянии живой клетки, а также в определении их размеров, продолжительности жизни и частоты встречаемости в бислоях. Необходимо учитывать, что живые мембраны чрезвычайно сложны и разнообразны и могут содержать множество различных типов мембранных плотов, которые способны существовать лишь в определенных пространственных и временных масштабах [4].
Относительно рецепторной функции мембран необходимо отметить, что многие компоненты плазмалеммы после восприятия сигналов служат источником вторичных мессенджеров, которые передают сигнал по эстафете и усиливают его. Такими вторичными мессенджерами служат инозит-1,4,5-трифосфат (ИФ3), ДАГ, ФК и продукты перекисного окисления липидов. Все эти соединения образуются из липидов плазмалеммы в результате воздействия сигнала на рецепторы [16, 86, 88].
Некоторые ПЛ являются предшественниками и участниками системы передачи гормонального сигнала. Так, известна фосфатидилинозитная система вторичных мессенджеров, работающая с рецепторами, расположенными на внешней стороне плазмалеммы. При связывании с гормоном белок-рецептор передает сигнал на G-белок, который связывает и удерживает гуанозинтрифосфат, при этом активируется до 10 молекул фосфолипазы С, входящей в состав мембранных белков. Затем происходит гидролиз гуанозинтрифосфата, гуанозиндифосфата, и фосфат освобождается. Активация фосфолипазы С приводит к гидролизу фосфатидилинозитдифосфата (ФИ(4,5)-дифосфата); именно этот процесс дал название всему каскаду вторичных мессенджеров. При этом в мембране остается остаток ДАГ, а в цитоплазму поступают ИФ3 и активатор протеинкиназы С [89]. Эти реакции происходят уже через 10–15 с после получения сигнала, достигая максимума через 60 с. ИФ3 может взаимодействовать с Са2+-каналами на мембране, и кальций начинает поступать в клетку [89]. Чтобы избежать избытка Са2+ и автолиза клетки, происходит дополнительное фосфорилирование ИФ3, а инозиттетрафосфат уже не взаимодействует с Са2+-каналами; при необходимости из него может быть получена новая порция ИФ3. После достижения максимума ИФ3 поэтапно гидролизуется до инозита, который включается в ФИ и только в составе мембраны фосфорилируется до ФИ(4,5)-дифосфата и используется еще раз [13, 86, 90]. Таким образом, плазматическая мембрана является местом не только рецепции сигналов, но и их усиления и дифференцирования.
Важнейшая функция растительной клетки – фотосинтез, в осуществлении которого мембраны принимают активное участие. Эффективное поглощение света и преобразование его энергии хлорофиллом основывается на высокой степени организации внутренних мембранных структур хлоропластов, наиболее важными моментами которой можно считать перечисленные ниже. 1. Необходимая ориентация пигментов в мембране. 2. Наличие соответствующих структур, в которых фотовозбужденный пигмент и химический акцептор жестко ориентированы относительно друг друга. 3. Определенная последовательность и строгая ориентация переносчиков электронов и протонов в мембране. 4. Организованная система мембран в хлоропластах, обеспечивающая сопряжение транспорта электронов и синтеза АТФ [13].
Известно, что клеточные мембраны часто асимметричны, то есть слои различаются по составу липидов. Так, в наружном слое могут содержаться преимущественно ФХ, ГЛ, сфинголипиды и ФИ, тогда как во внутреннем – ФЭ, ФС и ФИ. Важную часть мембран составляют интегральные белки, пронизывающие их и отвечающие за их разнообразные свойства. Рядом с этими мембранными белками находятся аннулярные липиды, которые более упорядочены, менее подвижны, имеют в составе более насыщенные ЖК и выделяются из мембран вместе с белками. Без аннулярных липидов большинство мембранных белков не функционируют [13, 76].
Все органеллы клетки могут быть одномембранными, как ЭР, аппарат Гольджи, лизосомы, вакуоли и пероксисомы, либо двумембранные, как ядро, митохондрии и пластиды. Внутренняя мембрана оболочки хлоропластов участвует в формировании внутренней мембранной системы этих органелл. Внутренние мембраны (ламеллы) образуют тилакоиды, которые уложены в стопки или граны (тилакоиды гран) или пронизывают строму (матрикс хлоропластов), соединяя граны между собой (тилакоиды стромы). Соответственно, образующие их мембраны называют мембранами (ламеллами) гран, либо стромы. Тилакоиды гран могут быть пронизаны одной или несколькими тилакоидами стромы.
Химический анализ внутренних мембран хлоропластов показывает, что соотношение липидов и белков по массе близко к 1 : 1, а их молярное соотношение составляет 500 : 1; к липидам здесь причислены хлорофиллы, каротиноиды и пласто- и филлохиноны, которые составляют около 65% липидов мембран хлоропластов. Кроме того, в мембранах хлоропластов содержится много α‑токоферола, который повышает их устойчивость к свободнорадикальным процессам. Стерины придают мембранам жесткость, занимая свободное пространство между гидрофобными хвостами липидов и упорядочивая их расположение [13, 47].
Особенностью мембран хлоропластов является высокое содержание в них ГЛ, в отличие от других мембран клетки, где преобладают ФЛ. В мембранах тилакоидов хлоропластов ГЛ составляют 75% всех липидов мембран. Основными представителями ФЛ в мембранах хлоропластов являются ФГ (11% от общего содержания в них липидов). В ФГ этих мембран входит специфичная для них ЖК – транс-3-гексадеценовая (16:3Δ7,10,13). Ее присутствие необходимо для сборки светособирающих комплексов хлоропластов [70].
Особого внимания заслуживают мембраны ЭР, поскольку они не только сами состоят из ПЛ, но и являются местом синтеза как ПЛ, так и входящих в них ЖК. Как и прочие органеллы, ЭР имеет полость, которая отделена от цитозоля лишь одинарной мембраной; эта полость занимает не менее 10% от общего объема клетки. Мембрана ЭР имеет многочисленные складки и изгибы и образует непрерывную поверхность, ограничивающую единое внутреннее пространство, которое и является полостью ЭР. Таким образом, ЭР представляет собой непрерывную сеть канальцев, которые состоят из пластинчатых и трубчатых цистерн, пронизывают всю цитоплазму и соединяются с ядерной оболочкой. На мембраны этих канальцев приходится более половины общего количества всех мембран клетки [13]. Следует отметить, что при фракционировании органелл разрушенных клеток с помощью центрифугирования фрагменты ЭР обнаруживаются в микросомальной фракции.
ЭР характеризуется практически неподвижным, фиксированным расположением спиралеобразных участков сети и канальцев со слепыми окончаниями. Исходной структурой ЭР являются трубчатые канальцы, характерные для гладкого ЭР. Шероховатый ЭР отличается от гладкого наличием закрепленных на его мембранах рибосом. Одна из основных функций мембран гладкого ЭР – синтез молекул липидов, поэтому они обогащены различными ферментами биосинтеза как глицеролипидов, так и других близких к ним соединений [13].
Дальнейшее понимание биохимических (и биофизических, в случае фотосинтеза) процессов, происходящих в растительной клетке, затруднено без изучения физического и химического состояния мембран и, что очень важно, строения мембран на молекулярном уровне. Важно строить и изучать трехмерные модели каждой отдельной мембраны с учетом молярного содержания в ней каждого из классов ПЛ, а также всех стеринов, каждого из белков и всех остальных соединений, контактирующих с мембраной в данный момент. Приводимый многими авторами состав ПЛ в отдельных мембранах, как правило, почти не привлекается для продолжения изучения строения и функционирования этой мембраны. Для преодоления технических и концептуальных барьеров, с которыми сталкивается дальнейшее изучение строения биологических мембран, необходим междисциплинарный подход, предполагающий совместную работу биохимиков, физхимиков, математиков и специалистов в области компьютерных технологий [5]. В настоящее время возможности компьютерной и вычислительной техники позволят, вероятно, строить пространственные, трехмерные модели мембран, и с учетом достижений физической химии и стереохимии изучать липид-белковые взаимодействия, контакты стеринов с окружающими их липидами и другими соединениями, взаимодействие ферментов с их липидным микроокружением, плотную упаковку хлорофилла и других порфиринов в липидных бислоях. Методы компьютерного моделирования уже успешно применяются при изучении мембран Sulfolobus acidocaldarius, состоящих как из ди-, так и тетраэфирных ФЛ [91].
Очевидно, что роль мембранных липидов при выполнении мембранами перечисленных функций достаточно велика. Можно представить, насколько продвинется вперед познание всех этих процессов, когда будут построены трехмерные стереохимические и физико-химические модели всех характерных мембран или их определяющих участков. Дополнительные трудности в моделировании участков бислоя создает отсутствие единой концепции в определении общего силового электрического поля, который образуется суммой заряженных ПЛ [46]. Липидный бислой мембран может быть связан с сопутствующими белками тремя различными способами. Интегральные белки расположены непосредственно в бислое, тогда как периферийные ассоциированы либо с интегральными белками, либо с бислоем за счет водородных связей, слабых электростатических взаимодействий, либо ионных связей [92]. В отличие от остальных, интегральные белки не растворимы в воде и не могут быть удалены из мембраны без ее разрушения, поскольку часть этого белка встроена в гидрофобную часть бислоя мембраны. Наконец, роль мембранного удерживающего фактора (“якоря”) могут выполнять ковалентно связанные с белком остатки насыщенных ЖК 14:0 и 16:0, некоторые изопреноиды или ФИ. Белки, ковалентно связанные с ЖК, локализованы в основном на внутренней поверхности плазматической мембраны. Кислота 14:0 присоединяется к Ν-концевой (терминальной) группе глицина с образованием амидной связи [93]. Кислота 16:0 образует тиоэфирную связь с цистеинами в С-конце полипептидной цепи или сложноэфирную связь с остатками серина и треонина [2, 15].
ГФИ-заякоренные белки [59, 94] присоединяются к внешней (экстрацеллюлярной) стороне мембраны следующим образом: глицерин – Р – инозит – глюкозамин – (манноза + галактоза) – манноза – манноза – Р – этаноламин – белок. Присоединение белков к липидам мембран осуществляется также с помощью предварительного пренилирования этих белков, которое включает в себя присоединение к ним таких гидрофобных молекул, как пренильные группы (3-метилбут-2-ен-1-ил), что облегчает дальнейшее присоединение их к липидным мембранам, аналогично якорным белкам. При пренилировании происходит присоединение либо фарнезила (С15), либо остатка геранилгеранила (С20), встроенных в бислой, к С-терминалу цистеина белка-мишени с помощью фарнезилтрансферазы и геранилгеранилтрансферазы [95–97].
О МЕХАНИЗМАХ РЕГУЛИРОВАНИЯ СТРУКТУРЫ МЕМБРАН
Полиморфные переходы цепей ЖК под действием температуры (термотрофный мезоморфизм) и процессы гидратации полярных радикалов (лиотропный мезоморфизм) служат теми рычагами, с помощью которых клетка может регулировать структуру мембран. Существуют разные динамические характеристики липидного бислоя, такие как латеральная диффузия молекул, молекулярная подвижность, вращение цепей ЖК и др. Для характеристики степени неупорядоченности или молекулярной подвижности внутренней части липидного бислоя используется термин “текучесть” мембран (fluidity), т.е. способность липидов (а также и белков) к латеральной диффузии. Скорость перемещения молекул при этом зависит от микровязкости мембран, которая, в свою очередь, определяется относительным содержанием насыщенных и ненасыщенных ЖК в составе липидов. Текучесть мембран больше, если в составе липидов преобладают ненасыщенные ЖК и меньше при высоком содержании насыщенных кислот.
Насыщенные ЖК образуют в мембране участки с плотной упаковкой и регулярной структурой. В участках с ненасыщенными кислотами плотная упаковка нарушается изгибами углеводородной цепи, возникающими за счет двойных связей в цис-конфигурации, что препятствуют слишком плотной упаковке молекул в липидном бислое, ведет к разрыхлению и увеличению текучести последнего. На текучесть мембран также влияют размеры углеводородных хвостов ЖК, с увеличением длины которых мембрана становится более текучей [24]. В этом случае, например, миристиновая кислота может уменьшать текучесть мембран и за счет того, что она насыщенная, и за счет своей короткой цепи. Известно, что при снижении температуры окружающей среды текучесть мембран снижается. В настоящее время текучесть мембран может быть оценена различными физическими методами: измерением анизотропии поляризации флюоресценции дифенилгексатриенов, внедряемых в мембраны, с помощью электронного парамагнитного резонанса и инфракрасной спектроскопии Фурье.
В последнем методе более высокие значения частот колебаний групп СН2 соответствуют более неупорядоченным структурам ЖК-цепей липидов мембран и, следовательно, большей текучести. Способом установления текучести мембран является и ГЖХ-анализ ЖК-состава этих мембран с последующим определением соотношения насыщенных и ненасыщенных ЖК. В этом случае, вероятно, не будут обнаружены различия, вызванные быстрым изменением температуры роста до температур низкотемпературного и теплового шока; для нахождения различий в ЖК-составе потребуется более длительное время, необходимое для синтеза и включения в мембрану новых кислот.
От соотношения ненасыщенных и насыщенных ЖК в ПЛ, составляющих мембрану, зависит ее текучесть. Считается, что у растений, выращиваемых при низких температурах, степень ненасыщенности ЖК в составе мембран растет для того, чтобы компенсировать снижение текучести, вызываемое охлаждением.
Установлено, что при снижении температуры происходит уменьшение текучести мембран, которое воспринимается сенсором – мембранной гистидинкиназой Hik 33. Эта киназа передает сигнал регуляторным молекулам, которые взаимодействуют с промоторами генов и вызывают их индукцию. В результате синтезируются десатуразы ЖК, осуществляется десатурация, и текучесть мембран восстанавливается до оптимального уровня, физиологически эквивалентного уровню текучести при нормальной температуре [98].
В опытах по изучению мембран их текучесть можно изменить и без снижения температуры, с помощью метода каталитического гидрирования ЖК мембранных липидов (плазмалеммы клеток) с использованием платино-палладиевого катализатора, который позволяет контролировать насыщение двойных связей в цепях ЖК [96]. Такое гидрирование осуществлялось в течение краткого времени (1–4 мин) и контролировалось по наличию фотосинтетической активности клеток (скорости выделения кислорода).
Регуляция физических свойств мембран для температурной компенсации может зависеть от распределения ЖК в положениях sn-1 и sn-2 в различных молекулярных формах некоторых фосфоглицеридов [24]. Так, в состав трифосфоинозитидов по первому положению глицерина входят в основном ацильные остатки насыщенных (С16 и С18) ЖК. Наличие в мембранах стеринов уменьшает подвижность ЖК, снижает латеральную диффузию липидов и белков, и поэтому также может влиять на функцию мембранных белков. Молекулы стеринов состоят из жесткого гидрофобного ядра и гибкой углеводородной цепи, а полярной головкой является единственная гидроксильная группа, которая контактирует с гидрофильными головками других ПЛ. Эти молекулы располагаются в липидном слое мембраны параллельно алифатическим цепям молекул ПЛ [24].
Не следует забывать о трансмембранной (поперечной) асимметрии, когда ПЛ с более объемными полярными головками стремятся находиться в наружном монослое, так как там больше площадь поверхности, приходящаяся на одну полярную головку. Так, ФХ и гликосфинголипиды локализованы преимущественно в наружном слое, а ФЭ и ФС, в основном, во внутреннем. Специфическим ФЛ внутренней мембраны митохондрий является кардиолипин; он синтезируется ферментами внутренней мембраны митохондрий и составляет более 20% от всех ФЛ этой мембраны [8]. Известно, что липиды в некоторых мембранах могут мигрировать с одной стороны мембраны на другую, т.е. совершают “флип-флоп” перескоки. Такое перемещение липидных молекул затрудняют их полярные головки, поэтому ПЛ, находящиеся на внутренней стороне мембраны, имеют в этом отношении преимущество и имеют относительно высокую скорость трансмембранной миграции.
Помимо участия в формировании липидного бислоя, ФЛ и ГЛ выполняют ряд других важных функций. Липиды формируют среду для функционирования мембранных белков, принимающих в ней нативную конформацию. Уже говорилось, что выделенные из мембран ферменты, лишенные липидного окружения (аннулярных липидов), как правило, не проявляют каталитической активности. C другой стороны, есть данные, что белки, даже после многочасового выдерживания их при 72°C, способны после контакта их с ФЛ восстанавливать свою биологическую активность [99]. В регулировании внутриклеточного транспорта широкого спектра молекул играют важную роль различные модификации белков липидами или родственными им производными.
В настоящее время молекулярный механизм транслокации белков через мембраны остается недостаточно изученным. До сих пор непонятно, проходит ли белок через заполненные водой поры в мембране или проникает через сам липидный бислой. Возможно, белки (особенно заряженные положительно) проходят через внутреннюю, гидрофобную часть мембраны внутри “вывернутых” липосом, у которых наружный слой образован гидрофобными хвостами ЖК, а полярные головки находятся внутри и охватывают молекулу белка [79]. Такая липосома может формироваться при электростатическом взаимодействии молекулы белка с отрицательно заряженными кислыми ФЛ наружного слоя мембраны; участок внешнего слоя мембраны при этом отрывается, охватывает белок, и образовавшаяся липосома преодолевает оставшуюся часть пути. При этом особенно велика роль такого отрицательно заряженного фосфолипида, как ДФГ, который, в отличие от остальных кислых ПЛ (ФИ, ФГ, ФС и СХДГ), имеет не одну, как обычно, а две кислотные группы.
Показано, что присутствие ДФГ в составе искусственных липосом приводит к 8-кратному увеличению включения белка рибонуклеазы в эти липосомы по сравнению с аналогичными липосомами с ФХ [100]. Это увеличение обусловлено, очевидно, тем, что рибонуклеаза, подобно другим растворимым, положительно заряженным белкам (апоцитохрому С и др.), взаимодействует с кислыми ФЛ в большей степени, чем с нейтральными. Показано также, что ДФГ вызывает структурные изменения в биомембранах, увеличивает текучесть бислоя и его пропускную способность. Присутствие ДФГ в бислое мембран приводит к образованию в нем замкнутых со всех сторон 4-слойных участков, аналогичных митохондриальным контактным площадкам. Эти неламеллярные образования играют, вероятно, ключевую роль в структуре и функциях мембран [23].
Все полученные экспериментальные данные свидетельствуют о важной роли физического состояния биологических мембран, определяемого степенью ненасыщенности ЖК липидов этих мембран. Очевидно, что изменения в физических свойствах мембран связаны с изменением состава и строения ПЛ, составляющих эти мембраны. С другой стороны, эти изменения играют важную роль в регуляции стрессовых ответов у различных растительных организмов. Мембраны растительных клеток могут быть первичным сенсором изменений параметров внешней среды. Эти изменения воспринимаются с помощью мембранных сенсорных белков, которые переносят сигнал от внешнего раздражителя внутрь клетки, запуская регуляторные процессы, связанные с передачей сигнала и экспрессией определенных групп генов, необходимых для приспособления организма к новым условиям. Изменение состава и строения ПЛ также может напрямую влиять на активность мембранносвязанных ферментов, таких, как переносчики молекул, ионные каналы, рецепторные протеинкиназы, а также и на другие сенсорные белки.
ЗАКЛЮЧЕНИЕ
Итак, согласованное функционирование мембранных систем – бислоя ПЛ, рецепторов, ферментов, транспортных механизмов помогает поддерживать гомеостаз клетки и, в то же время, быстро реагировать на изменения внешней среды. Приведенные данные показывают, насколько может быть разнообразен качественный состав ПЛ бислоя мембран. Кроме того, отдельные классы ПЛ, помимо ряда обычных ЖК и ЖКОДЦ, обогащены оксикислотами или содержат высшие аминоспирты. В настоящее время роль многих минорных компонентов мембран еще мало изучена по отношению участия их как в построении бислоя, так и в целом ряде физиологических процессов в клетке. Так называемый “вычислительный микроскоп” – моделирование молекулярной динамики ПЛ – послужит, вероятно, важным инструментом для изучения их воздействия на структуру и функции белков биомембран.
Если наиболее распространенные в количественном отношении полярные липиды – ФХ и ФЭ, по-видимому, составляют основу биомембран (матрицу), то ряд классов липидов, относящихся либо к заряженным (ДФГ, ФГ), либо к высокополярным (ФГЛ), либо совмещающим эти два свойства (ФИ, ФС и СХДГ) соединениям, несомненно, входят в состав липидных плотов, изучение которых находится еще в самом начале. Известные несколько ранее аннулярные липиды, сопутствующие ферментам, базирующимся в биомембранах, по своему качественному составу практически совпадают с липидами плотов. Эти классы липидов, как правило, бывают обогащены насыщенными ЖК и, в первую очередь, пальмитиновой кислотой.
Наши данные свидетельствуют о том, что регулярную структуру мембран, необходимую для поддержания жизнедеятельности клеток, можно создать лишь в том случае, если насыщенность ацильных компонентов липидов этих мембран не будет ниже определенного уровня. В зависимости от гено- и фенотипа растения, а также от качественного состава классов липидов этот уровень может быть различным.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Автор заявляет об отсутствии конфликта интересов.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации (Проект № 0106-2019-0008).
Список литературы
Геннис Р. Биомембраны. Молекулярная структура и функции. Москва: Мир, 1997. 624 с.
Dowhan W., Bogdanov M., Mileykovskaya E. Functional roles of lipids in membranes // Biochemistry of Lipids, Lipoproteins and Membranes / Eds. Vance D.E., Vance J.E. Elsevier, 2008. P. 2.
Watson H. Biological membranes // Essays Biochem. 2015. V. 59. P. 43. https://doi.org/10.1042/BSE0590043
Sezgin E., Levental I., Mayor S., Eggeling C. The mystery of membrane organization: composition, regulation and roles of lipid rafts // Mol. Cell Biol. 2017. V. 18. P. 361. https://doi.org/10.1038/nrm.2017.16
van Meer G., Voelker D.R., Feigenson G.W. Membrane lipids: Where They Are and How They Behave // Mol. Cell Biol. 2008. V. 9. P. 112. https://doi.org/10.1038/nrm2330
Harwood J.L. Plant acyl lipids: structure, distribution, and analysis // The Biochemistry of Plants. V. 4. Lipids: Structure and Function / Ed. by Stumpf P.K. N.Y.: Academic Press, 1980. P. 1.
Ansell G.V., Hawthorne J.N., Dawson R.M.C. Form and function of phospholipids. Amsterdam: Elsevier Scientific Publisching Company, 1973. P. 494.
Hsieh T.C.-Y., Lester R.L., Laine R.A. Glycophosphoceramides from plants. Purification and characterization of a novel tetrasaccaride derived from tobacco leaf Glycolipids // J. Biol. Chem. 1981. V. 256. P. 7747.
Mudd J.B. Phospholipid biosynthesis // The Biochemistry of plants. V. 4. Lipids: Structure and Function / Ed. by Stumpf P.K. N.Y.: Academic Press, 1980. P. 250.
Heinz E. Plant glycoliplds: structure, isolation and analysis // Advances in Lipid Methodology – Three V. 7. /Ed. by Christie W.W. Dundee: The Only Press, 1996. P. 211.
Li-Beisson Y., Thelen J.J., Fedosejevs E., Harwood J.L. The lipid biochemistry of eukaryotic algae // Progress in Lipid Res. 2019. V. 74. P. 31. https://doi.org/10.1016/j.plipres.2019.01.003
Schmid K.M., Ohlrogge J.B. Lipid metabolism in plants // Biochemistry of lipids, lipoproteins and membranes / Eds. Vance D.E., Vance J.E. Elsewier, 2008. P. 98.
Физиология растений / Под ред. Ермакова И.П. Москва: Академия, 2007. 635 с.
Douce R., Joyard J. Plant galactolipid // The Biochemistry of Plants. V. 4. Lipids: Structure and Function / Ed. Stumpf P.K. N.Y.: Acad. Press, 1980. P. 321.
Christie W.W. Lipid Analysis. Isolation, separation, identification and structural analysis of lipids. Oxford, N.Y., Toronto: Pergamon Press, 1973. P. 338.
Хелдт Г.-В. Биохимия растений. Москва: БИНОМ. Лаборатория знаний, 2011. 471 с.
Kейтс М. Техника липидологии. Выделение, анализ и идентификация липидов. Москва: Мир, 1975. 322 с.
Christie W.W. Separation of phospholipid classes by high-performance liquid chromatography // Advances in Lipid Methodology – Three / Ed. by W.W. Christie. Dundee: The Oily Press, 1996. P. 77.
Choudhury S.R., Pandey S. Phosphatidic acid binding inhibits RGS1 activity to affect specific signaling pathways in Arabidopsis // Plant J. 2017. V. 90. P. 466.
Menon A.K., Stevens V.L. Phosphatidylethanolamine is the donor of the ethanolamine residue linking a glycosylphosphatidylinositol anchor to protein // J. Biol. Chem. 1992. V. 267. P. 15277.
Chapman K.D. Emerging physiological role for N‑acylphosphatidylethanolamine metabolism in plants: signal transduction and membrane protection // Chem. Phys. Lipids. 2000. V. 108. P. 221.
Zhukov A.V., Vereshchagin A.G. Mild nonenzymatic hydrolysis of an ester bond between the orthophosphoric acid and ethanolamine residues in phosphatidylethanolamines // Chemistry and Physics of Lipids. 1996. V. 82. P. 1.
Unsay J.D., Cosentino K., Subburaj Y., García-Sáez A.J. Cardiolipin Effects on Membrane Structure and Dynamics // Am. Chem. Soc. 2013. V. 29. P. 15878. https://doi.org/10.1021/la402669z
Северин Е.С. Биохимия. Москва: ГЭОТАР-Медиа, 2011. 759 с.
Cote G.G., Crain R.C. Biochemistry of phosphoinositides // Plant Physiol. and Plant Molecular Biol. 1993. V. 44. P. 333.
Irvine R.F., Letcher A.J., Lander D.J., Drobak B.K., Dawson A.P., Musgrave A. Phosphatidylinositol (4,5) bisphosphate and phosphatidylinositol (4) phosphate in plant tissues // Plant Physiol. 1989. V. 89. P. 888. https://doi.org/10.1104/pp.89.03.888
Furt F., Simon-Plas F., Mongrand S. Lipids of the plant plasma membrane // The Plant Plasma Membrane. Plant Cell Monographs / Eds. Murphy A.S. et al. Berlin, Heidelberg: Springer-Verlag, 2011. P. 3.
Michell R.H. The cellular function of phosphoinositides // Advances in Plant Lipid Research / Eds. Sánchez J. et al. Spain: Universidad de Sevilla, 1998. P. 389.
Carpaneto A., Boccaccio A., Lagostena L., Di Zanni E., Scholz-Starke J. The signaling lipid phosphatidylinositol-3,5-bisphosphate targets plant CLC-a anion/H+ exchange activity // Embo Reports. 2017. V. 18. P. 1100. https://doi.org/10.15252/embr.201643814
Okamoto T., Dariania L., Nishikoori M., Nakazato H., Okuyama H., Thompson, Jr. G.A. Studies of Glycosylphosphatidylinositol-anchored proteins in Spirodela oligorrhiza, Arabidopsis thaliana, and Oryza sativa // Advances in Plant Lipid Research / Eds. Sánchez J. et al. Sevilla: Univer. de Sevilla, 1998. P. 410.
Gurr M.I., James A.T. Lipid Biochemistry: an Introduction. London: Chapman and Hall Ltd., 1971. P. 231.
Siegenthaler P.A. Molecular organization of acyl lipids in photosynthetic membranes of hygher plants // Lipids in Photosynthesis: Structure, Function and Genetics / Eds. Sigenthaler P.A., Murata N. V. 6. Dordrecht: Kluwer Academic Publishers, 1998. P. 119.
Lynch D.V., Bromley P.E. The structure and synthesis of inositolphosphorylceramides in plants // Advances in Plant Lipid Research / Eds. Sánchez J. et al. Sevilla: Univer. de Sevilla, 1998. P. 406.
Carter H.E., Strobach D.R., Hawthorne J.N. Biochemistry of the sphingolipids. XVIII. Complete structure of tetrasaccharide glycolipid // Biochemistry. 1969. V. 8. P. 383.
Hsieh T.C., Kaul K., Laine R.A., Lester R.L. Structure of a major glycophosphoceramide from tobacco leaves, PSL-1 // Biochemistry. 1978. V. 17. P. 3575.
Kaul K., Lester R.L. Isolation of six novel phosphoinositol-containing sphingolipids from tobacco leaves // Biochemistry. 1978. V. 17. P. 3569.
Du Z., Chen Z., Moorse Jr. T.S. Biosynthesis of diacylglyceroltrimethylhomoserine in Chlamydomonas reinhardtii. Compartmentalization and general characteristics // Advances in Plant Lipid Research / Eds. Sánchez E. et al. Sevilla: Univer. de Sevilla, 1998. P. 240.
Lee J.-W., Shin S.-Y., Kim H.-S., Jin E.S., Lee H.-G., Oh H.-M. Lipid turnover between membrane lipids and neutral lipids via inhibition of diacylglyceryl N, N, N-trimethylhomoserine synthesis in Chlamydomonas reinhardtii // Algal Research. 2017. V. 27. P. 162. https://doi.org/10.1016/j.algal.2017.09.001
Eichenberger W. Identification of new plant lipids: structure of a second betaine lipid from algae // Plant Lipid Biochemistry, Structure and Utilization / Eds. Quinn P.J., Harwood J.L. London: Portland Press Limited, 1990. P. 9.
Vogel G., Eichenberger W. Biosynthesis and metabolism of betaine lipids in Ochromonas danica (Chrysophyceae) // Plant Lipid Biochemistry, Structure and Utilization / Eds. Quinn P.J., Harwood J.L. London: Portland Press Limited, 1990. P. 235.
Sidorov R.A., Zhukov A.V., Pchelkin V.P., Vereshchagin A.G., Tsydendambaev V.D. Content and fatty acid composition of neutral acylglycerols in Eunymus fruits // Amer. Oil Chem. Soc. 2014. V. 91. P. 805.
Scholfield C.R. Composition of soybean lecithin // J. Amer. Oil Chem. Soc. 1981. V. 58. P. 889.
Вавер В.А., Стоянова В.Г., Гейко Н.С., Нечаев А.П., Тодрия К.Г., Бергельсон Л.Д. Диольные липиды. Ацильные производные 1-О-β-D-глюкозилэтиленгликоля в созревающих семенах пшеницы // Биоорганич. химия. 1976. Т. 2. С. 530.
Stanislas T., Platre M.P., Liu M., Rambaud-Lavigne L.E.S., Jaillais Y., Hamant O. A phosphoinositide map at the shoot apical meristem in Arabidopsis thaliana // BMC Biology. 2018. https://doi.org/10.1186/s12915-018-0490-y
Peeler T.C., Stephenson M.B., Einspahr K.J. Lipid characterization of an enriched plasma membrane fraction of Dunaliella salina grown in media of varying salinity // Plant Physiol. 1989. V. 89. P. 970.
Pöyry S., Vattulainen I. Role of charged lipids in membrane structures — Insight given by simulations // Biochim. Biophys. Acta. 2016. V. 1858. P. 2322. https://doi.org/10.1016/j.bbamen.2016.03.016
Rawyler A., Meylan M., Siegenthaler P.-A. Galactolipid synthesis in intact spinach chloroplasts and its relations with lipid asymmetry in thylacoid membranes // Plant Lipid Biochemistry, Structure and Utilization / Eds. Quinn P.J., Harwood J.L. London: Portland Press Limited, 1990. P. 84.
Harwood J.L. Sulfolipid // The Biochemistry of Plants. V. 4. Lipids: Structure and Function / Ed. by Stumpf P.K. N.Y.: Academic Press, 1980. P. 301.
Joyard J., Block M.A., Malherbe A., Marechal E., Douce R. Origin and synthesis of galactolipid and sulfolipid head-groups // Lipid Metabolism in Plants / Ed. by T.S. Moore Jr. Boca Raton, Florida: CRC Press, 1993. P. 231.
Michaelson L.V., Napier J.A., Molino D., Faure J.-D. Plant sphingolipids: Their importance in cellular organization and adaption // Biochem. Biophys. Acta. 2016. V. 1861. P. 1329.
Hou C.T., Umemura Y., Nakamura M., Funahashi S. Enzymatic synthesis of steryl glucoside by a particulate preparation from immature soybean seeds // J. Biochem. 1968. V. 63. P. 351.
Lester R.L., Dickson R.C. Sphingolipids with inositolphosphate-containing head group // Adv. Lipid Res. 1993. V. 26. P. 253.
Lynch D.V. Sphingolipids // Lipid Metabolism in Plants / Ed. by T.S. Moore Jr. Boca Raton, Florida: CRC Press, 1993. P. 285.
Murata N., Sato N., Takahashi N. Very-long-chain saturated fatty acids in phosphatidylserine from higher plant tissues // Biochim. Biophys. Acta. 1984. V. 795. P. 147.
Imai H., Ohnishi M., Kojima M., Ito S. Cerebrosides in seed-plant leaves: composition of fatty acids and sphingoid bases // Physiology, Biochemistry and Molecular Biology of Plant Lipids / Eds. Williams J.P. et al. Dordrecht: Klumer Academic Publishers, 1997. P. 224.
Sperling P., Franke S., Luthje S., Heinz E. Are glucocerebrosides the predominant sphingolipids in plant plasma membranes? // Plant Physiol. Biochem. 2005. V. 43. P. 1031.
Imre Z. Phytoglycolipids in the seeds of Pistacia vera L. // Z. Naturforschung. 1974. V. 29. P. 195.
Fang L., Ishikawa T., Rennie E.A., Murawska G.H., Lao J., Yan J., Tsai A. Y-L., Baidoo E.E.K., Xu J., Keasling J.D., Demura T., Kawai-Yamada M., Scheller H.V., Mortimer J.C. Loss of inositol phosphorylceramide sphingolipid mannosylation induced plant immune responses and reduces cellulose content in Arabidopsis // Plant Cell. 2016. V. 28. P. 2991. https://doi.org/10/1105/tpc.16.00186
Morita N., Nakazato H., Okuyama H., Kim Y., Thompson Jr. G.A. Evidence for a glycosylinositolphospholipid-anchored alkaline phosphatase in the aquatic plant Spirodela oligorrhiza // Biochim. Biophys. Acta. 1996. V. 21. P. 53. https://doi.org/10.1016/0304-4165(95)00185-9
Bohn M., Heinz E., Lüthje S. Lipid composition of plasma membranes isolated from corn (Zea mays L.) roots // Arch. Biochem. Biophys. 2001. V. 387. P. 35.
Imai H. Glucocerebrosides containing unsaturated hydroxy fatty acids in Arabidopsis thaliana // Advances in Plant Lipid Research / Eds. Sánchez E. et al. Sevilla: Univer. de Sevilla, 1998. P. 38.
Жуков А.В., Стефанов К.Л., Верещагин А.Г. О качественном составе отдельных классов полярных липидов из семян сои // Физиология растений. 1987. Т. 34. С. 518.
Privett O.S., Dougherty K.A., Erdahl W. E., Stolyhwo A. Studies on the lipid composition of developing soybeans // J. Amer. Oil Chem. Soc. 1973. V. 50. P. 516.
Harwood V.L. Lipid synthesis by germinating soya bean // Phytochemistry. 1975. V. 14. P. 1985.
Singh H., Privett O.S. Studies on the glycolipids and phospholipids of immature soybeans // Lipids. 1970. V. 5. P. 692.
Rohrlich M., Niederauer Th. Untersuchungen über Fett-Eiweiss-Komplexe in Cerealien. II. Über die Zusammensetsung der Protein- und der Lipoidkomponente // Fette, Seifen, Anstrichmitt. 1968. V. 70. P. 58.
Eklund A. Preparation and chemical analyses of a lipoprotein concentrate from Niger Seed (Guisotia abyssinica Cass.) // Acta Chemica Scandinavica. 1971. V. 25. P. 2225.
Kito M., Nakayama Y., Kanamoto K., Sato K. Occurrence of a protein-phospholipid complex in soybean oil // Agric. Biol. Chem. 1979. V. 43. P. 2219.
Doherty A., Gray J.C. Synthesis of a dicyclohexylcarbodiimide-binding proteolipids by isolated pea chloroplasts // Eur. Biochem. 1980. V. 108. P. 131.
Верещагин А.Г. Липиды в жизни растений. 66-е Тимирязевское чтение. Москва: Наука, 2007. 78 с.
Макаренко С.Л., Коненкина Т.А., Путилина Т.Е., Донская Л.И., Музалевская О.В. Жирнокислотный состав липидов эндосперма и зародыша семян Pinus sibirica и P. silvestris // Физиология растений. 2008. Т. 55. С. 535.
Mongrand S., Badoc A., Patouille B., Lacomblez Ch., Chavent M., Cassagne C., Bessoule J.-J. Taxonomy of gymnospermae: multivariate analyses of leaf fatty acid composition // Phytochemistry. 2001. V. 58. P. 101.
Wolff R.L., Pedrono F., Pasquier E., Marpeau A.M. General characteristics of Pinus spp. seed fatty acid compositions, and importance of Δ5-olefinic acids in the taxonomy and phylogeny of the genus // Lipids. 2000. V. 35. P. 1.
Жуков А.В., Кузнецова Э.И., Сидоров Р.А., Пчелкин В.П., Цыдендамбаев В.Д. Жирнокислотный состав липидов листьев и стробилов саговника поникающего (Cycas revolutа) // Физиология растений. 2018. Т. 65. С. 18.
Жуков А.В. Жирные кислоты с очень длинной цепью в составе мембранных липидов растений // Физиология растений. 2018. Т. 65. С. 418.
Жуков А.В. Пальмитиновая кислота и ее роль в строении и функциях мембран растительной клетки // Физиология растений. 2015. Т. 62. С. 751.
Жуков А.В., Верещагин А.Г. Характеристика состава отдельных фракций полярных липидов семян сои // Физиология растений. 1980. Т. 27. С. 390.
Sandermann H. Regulation of membrane ensymes by lipids // Biochim. Biophys. Acta. 1978. V. 515. P. 209.
Nobusawa T., Okushima Y., Nagata N., Kojima M., Sakakibara H., Umeda M. Synthesis of very-long-chain fatty acids in the epidermis controls plant organ growth by restricting cell proliferation // PLoS Biol. 2013. V. 11. https://doi.org/10.1371/journal.pbio.1001531
Bocttcher C., Weiler E.W. Cyclo-oxylipin-galactolipids in plants: occurrence and dynamics // Planta. 2007. V. 226. P. 629.
Bach L., Faure J.-D. Role of very-long-chain fatty acids in plant development, when chain length does matter // Comptes Rendus Biologies. 2010. V. 333. P. 361.
Epand R.M. Introduction to Membrane Lipids. Methods in Membrane Lipids. Methods in Molecular Biology / Ed. by Owen D.M. V. 1232. N.Y.: Springer Science + Business Media, 2015. https://doi.org/10.1007/978-1-4939-1762-6
Higashi S., Fujimura Y., Murata N. Analysis of lipids in spinach photosystem 2 // Plant Lipid Biochemistry, Structure and Utilization / Eds. Quinn P.J., Harwood J.L. London: Portland Press Limited, 1990. P. 87.
Bailey J.M. Specificity of sugar-phospholipid interactions //Arch. Biochem. Biophys. 1973. V. 158. P. 586.
Zhukov A.V., Vereshchagin A.G. Current techniques of extraction, purification and preliminary fractionation of polar lipids of natural origin // Advans. Lipid Res. N.-Y.: Academic Press, 1981. V. 18. P. 247.
Heilmann I., Perera I.Y., Stevenson J.M., Ransom W.D., Gross W., Boss W.F. Inositol lipid signaling: what can we learn from plants? // Advances in Plant Lipid Research / Eds. Sevilla: Univer. de Sevilla, 1998. P. 394.
Nicolson G.L. The Fluid – Mosaic Model of Membrane Structure: Still relevant to understanding the structure, function and dynamics of biological membranes after more than 40 years // Bioch. Biophys. Acta. 2014. V. 1838. P. 1451. https://doi.org/10.1016/j.bhamem2013.10.019
Nickels J.D., Smith M.D., Alsop R. J., Himbert S., Yahya A., Cordner D., Zolnierczuk P., Stanley C.B., Katsaras J, Cheng X., Rheinstädter M.C. Lipid Rafts: Buffers of Cell Membrane Physical Properties // J. Phys Chem. 2019. V. 123. P. 2050. https://doi.org/10.1021/acs.jpcb.8b12126
Berridge M.J. Inositol trisphosphate and diacylglycerol as second messengers // Biochem. J. 1984. V. 220. P. 345.
Schumaker K.S., Sze H. Inositol 1,4,5-trisphosphate releases Ca2+ from vacuolar membrane vesicles of oat roots // J. Biol. Chem. 1987. V. 262. P. 3944.
De Castro L.F.P, Dopson M., Friedman R. Biological Membranes in Extreme Conditions: Anionic Tetraether Lipid Membranes and Their Interactions with Sodium and Potassium // J. Phys Chem. 2016. V. 120. P. 10628. https://doi.org/10.1021/acs.jpch.6b06296
Леви А., Сикевиц Ф. Структура и функции клетки. Москва: Мир, 1971. 583 с.
Resh M.D. Trafficking and signaling by fatty-acylated and prenilated proteins // Nature Chemical Biology. 2006. V. 2. P. 584. https://doi.org/10.1038/nchembio834
Kinoshita T., Fujita M. Biosynthesis of GPI-anchored proteins: special emphasis on GPI lipid remodeling // J. Lipid Res. 2016. V. 57. P. 6. https://doi.org/10.1194/jlr.R063313
Cassey P.J., Seabre M.C. Protein prenyltransferases // J. Biol. Chem. 1996. V. 271. P. 5289. https://doi.org/10.1074/jbc.271.10.5282
Novelli G., D’Apice M.R. Protein farnesylation and disease // J. Inherited Metabolic Disease. 2012. V. 35. P. 917. https://doi.org/10.1007/s10545-011-9445-y
Lane K.T., Beese L.S. Thematic revive series: lipid posttranslational modifications. Structural biology of protein farnesyltransferase and geranylgeranyltransferase type 1 // J. Lipid Res. 2006. V. 47. P. 681. https://doi.org/10.1194/jlr.R600002-JLR200
Murata N., Los D.A. Membrane fluidity and temperature perception // Plant Physiol. 1997. V. 115. P. 875.
Кутюрин В.М., Шутилова Н.И. Электронно-донорные свойства пигмент-белково-липидного комплекса хлоропластов // Биохимия. 1974. Т. 39. С. 102.
Янопольская Н.Д., Деборин Г.А. Исследование транслокации рибонуклеазы через мембраны липосом различного липидного состава // Биохимия. 1988. Т. 53. С. 781.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений