Физиология растений, 2021, T. 68, № 2, стр. 187-193
Роль эпигенетических механизмов в регуляции активности 2-ОГДГ и МДГ в листьях кукурузы (Zea mays L.) при гипоксии
А. Т. Епринцев a, *, Д. Н. Федорин a, Г. Б. Анохина a, М. О. Гатауллина a
a Федеральное государственное бюджетное образовательное учреждение высшего образования
“Воронежский государственный университет”
Воронеж, Россия
* E-mail: bc366@bio.vsu.ru
Поступила в редакцию 21.02.2020
После доработки 15.06.2020
Принята к публикации 17.06.2020
Аннотация
Исследовали молекулярные и эпигенетические способы регуляции активности ключевых ферментов ЦТК, 2-оксоглутаратдегидрогеназы (2-ОГДГ) и малатдегидрогеназы (МДГ) в листьях кукурузы в гипоксических условиях. Показано, что регуляция скорости функционирования энзимов в стрессовых условиях обусловлена не конформационными трансформациями белковых молекул, а изменением транскрипционной активности их генов. Анализ уровня транскриптов генов, кодирующих 2-ОГДГ и МДГ, выявил корреляцию с изменениями общей ферментативной активности. При инкубации растений в гипоксических условиях наблюдалось снижение экспрессии генов 2-ОГДГ и МДГ. Установлено, что колебание содержания транскриптов генов ogdh-1 и ogdh-3 сопряжено с изменением метильного статуса CG-динуклеотидов в их промоторах. Увеличение экспрессии этих генов сопряжено со снижением степени метилирования их промоторов. И наоборот, уменьшение относительного уровня транскриптов вызвано ростом количества метилированных CG-динуклеотидов. Делается вывод о регуляции функционирования 2-оксоглутаратдегидрогеназы и малатдегидрогеназы в условиях низких концентраций кислорода посредством эпигенетического механизма, то есть путем изменения метильного статуса промоторов их генов.
ВВЕДЕНИЕ
Естественная среда обитания многих растений нередко подвержена затоплению, которое приводит к недостатку кислорода в почвенном покрове – гипоксии, что вызывает значительные изменения в функционировании как всего организма в целом, так и отдельных его ферментных систем [1–3]. Трансформация дыхательных путей возможна разными способами. При аноксии происходит увеличение доли гликолиза и пентозофосфатного пути [4], а также использование альтернативных путей окисления восстановленных коферментов [5, 6]. Согласно некоторым литературным данным, при снижении уровня концентрации внутриклеточного АТФ на 15–20% наблюдается угнетение ведущих энергозависимых функционально-метаболических процессов [7]. В условиях гипоксии дыхательная цепь митохондрий участвует в формировании системы ответа организма на дефицит кислорода, таким образом, обеспечивая адаптивную реакцию [8–10].
2-оксоглутаратдегидрогеназный комплекс (2‑ОГДК, КФ 1.2.4.2) – сложная мультиферментная система, включающая в свой состав три независимых фермента, которые обеспечивают окислительное декарбоксилирование 2-оксоглутарата (2ОГ) с образованием сукцинил-СоА: 2-оксоглутаратдегидрогеназу (2-ОГДГ, Е1, КФ 1.2.4.2.); дигидролипоамидсукцинилтрансферазу (ДЛСТ, Е2, КФ 2.3.1.61) и дегидролипоамиддегидрогеназу (ДЛД, Е3, КФ 1.8.1.4.). Известно, что у гетеротрофных организмов наблюдается изменение активности 2-ОГДК в условиях гипоксии [11]. Для растений с С3-типом метаболизма показано ингибирующее действие низких концентраций кислорода на функционирование 2-ОГДК [4, 12]. Первый компонент 2-ОГДК – 2-оксоглутаратдегидрогеназа кукурузы (Zea mays L.) – кодируется тремя генами, расположенными в разных хромосомах. Первый ген ogdh-1 локализован во 2 хромосоме (LOC100383579, Gene ID: 100383579) и состоит из 10 экзонов. Второй ген ogdh-2, ранее аннотированный как кодирующий 2-ОГДГ, в настоящее время признан псевдо-геном, расположенным в 9 хромосоме (LOC103639200, Gene ID: 103639200), он представлен 15 экзонами. Третий ген ogdh-3 кодирует 2-ОГДГ-подобный белок и расположен в 10 хромосоме (TIDP3354, Gene ID: 100383847), состоит из 9 экзонов. Имеются данные, согласно которым 2-ОГДК, помимо митохондриальной, имеет и ядерную локализацию, обеспечивая процесс сукцинилирования за счет связывания с лизин-ацетилтрансферазой 2А (KAT2A) из промоторных областей генов, что говорит о роли данного мультиферментного комплекса в эпигенетической регуляции работы генома [13].
Малатдегидрогеназная система повсеместно распространена в растительной клетке. Малатдегидрогеназа (МДГ, КФ 1.1.1.37) – фермент, катализирующий обратимое окисление малата до оксалоацетата. Анализ международной базы данных GenBank и литературы позволил обнаружить 10 генов НАД+-зависимой малатдегидрогеназы, локализованных в разных хромосомах [14, 15]. При этом, митохондриальные формы энзима кодируются двумя генами, локализованными в разных хромосомах: ген mMdh (Gene ID: 100274264) в 6 хромосоме и ген mMdh-2 (Gene ID: 100273428) в 8 хромосоме, которые содержат 7 экзонов.
Митохондриальная МДГ участвует в цикле Кребса, при этом в качестве кофермента использует НАД+. Существует МДГ (малик энзим, КФ 1.1.1.39), которая катализирует реакцию декарбоксилирования, участвуя как в выработке НАДН, так и в регуляции уровня диоксида углерода внутри клеток. Известно, что гипоксия оказывает значительное влияние на активность малатдегидрогеназ. Длительное пребывание растений в гипоксических условиях приводит к увеличению активности НАДН-МДГ в корнях и листьях пшеницы, что говорит о смещении равновесия реакции в сторону образования малата [16].
Имеется множество свидетельств того, что в условиях действия гипоксии в растительном организме происходит увеличение уровня внутриклеточного сукцината за счет активизации дополнительных метаболических путей: активации ГАМК-шунта, включения механизма превращения 2-оксоглутарата в обход 2-ОГДК через активацию 2-оксоглутаратоксигеназы (2ОГО, КФ 1.14.11), а также в результате работы аланинаминотрансферазы (АлАТ, КФ 2.6.1.2) [4, 12, 17].
Таким образом, важными точками в механизме стресс-индуцированного ответа растительного организма на гипоксию являются такие ферментные системы как 2-оксоглутаратдегидрогеназный комплекс и малатдегидрогеназная система. Ранее нами было показано, что функционирование сукцинатдегидрогеназы в кукурузе в условиях гипоксии регулируется за счет изменения статуса метилирования отдельных CG-динуклеотидов промоторов генов [18].
Цель работы – исследование статуса метилирования CpG-островков промоторов генов в регуляции функционирования ферментов 2-ОГДК и МДГ в листьях кукурузы в условиях низких концентраций кислорода.
МАТЕРИАЛЫ И МЕТОДЫ
Использовались листья 10−12 дневной кукурузы сорта Воронежская-76, выращенные гидропонно при 10-часовом световом дне и интенсивности света 25 Вт/м2 в климатической камере (“LabTech”, Южная Корея). Действие низких концентраций кислорода в среде осуществлялось путем помещения растений с предварительно удаленной корневой системой на 24 ч в вакуум-эксикатор, в который подавался азот. В качестве контрольной группы использовались растения с предварительно удаленной корневой системой, помещенные в вакуум-эксикатор в условиях нормальной аэрации. Для исключения влияния фотосинтетической системы обе группы растений предварительно экспонировались в темноте в течение 24 ч до проведения эксперимента. На протяжении всего эксперимента растения также находились в условиях отсутствия источников света.
Для выделения митохондриальной фракции навеску (5 г) листьев кукурузы растирали в фарфоровой ступке со средой выделения: 0.15 М калий-фосфатный буфер (pH 7.4), 0.4 М сахароза, 2.5 мМ ЭДТА, 1 мМ хлорид калия, 4 мМ хлорид магния, 0.05% Тритон Х-100 в соотношении 1 : 10. Гомогенат фильтровали и центрифугировали 3 мин при 3000 g на центрифуге Еppendorf 5804R (“Еppendorf”, Германия). Супернатант центрифугировали 10 мин при 18 000 g. Выделенную фракцию митохондрий разрушали осмотическим шоком в среде, содержащей 0.15 М калий-фосфатный буфер (pH 7.4). Степень разрушения митохондрий была более 90%, что контролировали методом микроскопии на Olympus CX41RF (“Olympus”, Япония). Полученную фракцию митохондрий использовали для определения активности 2-ОГДГ и МДГ. Все манипуляции проводили при температуре +4°С.
Активность 2-ОГДГ определяли спектрофотометрически на СФ-2000 (ЗАО “ОКБ Спектр”, Россия) по скорости образования НАДН в реакционной смеси следующего состава: 0.1 М калий – фосфатный буфер (pH 7.5), 0.05% Тритон X-100, 0.5 мМ MgCl2, 2 мМ НАД+, 0.12 мМ литий-CoA, 0.2 мМ тиаминдифосфат, 2.5 мМ Cys-HCl, 1 мМ AMФ, 1 мМ 2-оксоглутарат калия, 5Е липоамиддегидрогеназы (“Sigma”, США) [19]. В контроле использовали среду без 2-оксоглутарата калия.
Активность МДГ определяли спектрофотометрически при длине волны 340 нм (поглощение восстановленного НАДН), в среде спектрофотометрирования следующего состава: 100мМ трис-HCl, рН–8.0, 1мМ оксалоацетат, 0.2 мМ НАДН, 10 мМ MgCl2 [20].
РНК из растений выделяли методом фенол-хлороформной экстракции [21].
Обратную транскрипцию мРНК проводили с использованием обратной транскриптазы M-MuLV (“Евроген”, Россия). Подбор праймеров осуществляли на основе нуклеотидных последовательностей из GenBank с помощью программы Primer-BLAST (Supplementary, Table 1, 2 ). Полимеразную цепную реакцию в реальном времени проводили на приборе LightCycler96 (“Roche”, Швеция) с красителем SybrGreen I (“Евроген”, Россия). Количество матрицы контролировали с помощью параллельной амплификации фактора элонгации ef-1α [22]. В качестве отрицательного контроля использовали суммарную РНК без этапа обратной транскрипции. Относительный уровень экспрессии исследуемых генов определяли с применением 2–ΔΔCt-метода [23].
ДНК выделяли с помощью набора ПРОБА – ГС (“ДНК-Tехнология”, Россия) согласно рекомендациям производителя. Для исследования изменения статуса метилирования CpG-динуклеотидов промоторов генов ogdh-1, ogdh-2, ogdh-3 2-оксоглутаратдегидрогеназы и промотора гена mMdh малатдегидрогеназы была проведена бисульфитная модификация образцов ДНК [24]. Анализ промоторов исследуемых генов на наличие CpG-островков и подбор праймеров для МС-ПЦР осуществляли с помощью программы MethPrimer. Последовательности праймеров для проведения МС-ПЦР представлены в Supplementary (Table 3, 4 ).
Опыты проводили в 3–4-кратной повторностях, аналитические определения для каждой пробы осуществляли в трех повторностях. Предварительная оценка характера распределения проводилась по асимметрии и эксцессу (Excel, Microsoft Office), а также с помощью критерия Колмогорова-Смирнова. Полученные значения позволили оценить характер распределения как нормальный. Критерий Стьюдента использовался с применением поправки на множественные сравнения (поправка Бонферрони) [25]. Дополнительно применяли однофакторный дисперсионный анализ ANOVA, который показал, что исследуемый в работе фактор действительно оказывал влияние (влияние фактора достоверно при P < 0.05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проведенное исследование показало, что в первые часы инкубации растений в среде с низким содержанием кислорода наблюдалось сильное снижение активности 2-ОГДК, начиная с первого часа эксперимента (рис. 1). Группа контрольных растений не демонстрировала значительных изменений общей ферментативной активности (изменения в пределах колебаний). Анализ динамики активности митохондриальной формы МДГ также показал уменьшение ферментативной активности в первые часы эксперимента – количество ферментативных единиц снизилось почти в 3.5 раза в сравнении с контрольной группой растений (рис. 2).
Рис. 1.
Динамика ферментативной активности 2-оксоглутаратдегидрогеназы в листьях кукурузы в условиях гипоксии. 1 – контрольная группа растений; 2 – опытная группа растений.

Рис. 2.
Динамика ферментативной активности митохондриальной малатдегидрогеназы в листьях кукурузы в условиях гипоксии. 1 – контрольная группа растений; 2 – опытная группа растений.

Регуляция скорости функционирования энзимов в стрессовых условиях может быть связана как с конформационными трансформациями белковых молекул, так и с изменением транскрипционной активности генов исследуемых ферментов. В связи с этим нами было проведено исследование уровня транскриптов генов 2-ОГДГ и МДГ в условиях различного газового состава.
Проведенный анализ уровня транскриптов генов, кодирующих ферменты 2-ОГДГ, выявил корреляцию с изменениями общей ферментативной активности. В группе растений, инкубация которых осуществлялась в среде с низким содержанием кислорода, наблюдалось снижение экспрессии генов 2-ОГДГ ogdh-1, ogdh-2, ogdh-3 в 7.4, 3.3 и 1.7 раз, соответственно (рис. 3–5). Постепенное снижение относительного уровня транскриптов в условиях гипоксии было характерно и для гена митохондриальной формы МДГ (mMdh). К 24 часу эксперимента уровень транскриптов исследуемого гена начал снижаться (рис. 6). Полученные данные свидетельствуют о регуляции работы генов 2-ОГДГ и МДГ на уровне генома в листьях кукурузы при гипоксии.
Рис. 3.
Динамика изменения относительного уровня транскриптов гена ogdh-1 и степени метилирования CG-динуклеотидов промотора в листьях кукурузы в условиях гипоксии.

Рис. 4.
Динамика изменения относительного уровня транскриптов гена ogdh-2 и степени метилирования CG-динуклеотидов промотора в листьях кукурузы в условиях гипоксии.
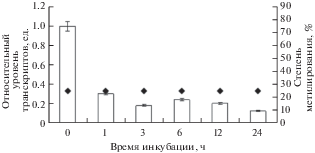
Рис. 5.
Динамика изменения относительного уровня транскриптов гена ogdh-3 и степени метилирования CG-динуклеотидов промотора в листьях кукурузы в условиях гипоксии.

Рис. 6.
Динамика изменения относительного уровня транскриптов гена mMdh и степени метилирования CG-динуклеотидов промотора в листьях кукурузы в условиях гипоксии.

Ранее уже упоминалось, что работа некоторых митохондриальных ферментов (сукцинатдегидрогеназы, фумаратгидратазы, АТФ-цитратлиазы) регулируется эпигенетически, за счет изменения метильного статуса отдельных CG-динуклеотидов промоторов их генов [18, 26, 27]. В связи с этим нами был проведен анализ промоторных областей генов, кодирующих 2-ОГДГ и МДГ. Анализ промотора гена ogdh-1, кодирующего 2-оксоглутаратдегидрогеназу на наличие CpG-островков, показал, что в промоторной области данный ген не содержит ни одного CpG-островка (рис. 7а). Анализ гена ogdh-2 позволил выявить в промоторной области наличие трех CpG-островков с размерами 118, 120 и 180 п.н. (рис. 7б). Промотор гена ogdh-3 содержал два CpG-островка с размерами 116 и 591 п.н., соответственно (рис. 7в).
Рис. 7.
Анализ промоторов исследуемых генов Z. mays на наличие CpG-островков: а) гена ogdh-1 2-оксоглутаратдегидрогеназы; б) гена ogdh-2 2-оксоглутаратдегидрогеназы; в) гена ogdh-3 2-оксоглутаратдегидрогеназы; г) гена mMdh митохондриальной формы малатдегидрогеназы. Вертикальными линиями указаны положения CG-динуклеотидов.

Исследование гена mMdh, кодирующего митохондриальную форму малатдегидрогеназы, показало, что в составе его промотора присутствуют два островка с высоким содержанием CG-динуклеотидов, размеры которых составляют 110 и 157 п.н. (рис. 7г). Наличие CpG-островков в промоторной области может говорить о возможном механизме регуляции работы исследуемых генов посредством изменения степени метилирования [28, 29].
В результате проведенного исследования по влиянию газового состава на степень метилирования CG-динуклеотидов, входящих в состав промотора гена ogdh-1 в геноме кукурузы, было установлено, что гипоксия вызывает значительные изменения в метильном статусе исследуемых CG-динуклеотидов. При этом установлено, что снижение уровня транскриптов исследуемого гена сопровождалось постепенным увеличением степени метилирования отдельных CG-динуклеотидов с 25 до 75% (рис. 3).
Для гена ogdh-2 было установлено, что гипоксия не вызывает изменений метильного статуса исследуемых CG-динуклеотидов. На протяжении всего времени эксперимента степень метилированных динуклеотидов составляла 25% в группе растений, инкубация которых осуществлялась в газовой среде с низким содержанием кислорода. Контрольная группа растений, на протяжении всего эксперимента находящаяся в условиях нормальной газовой среды, демонстрировала сходные результаты (25% исследуемых CpG-динуклеотидов были метилированы).
В результате проведенного исследования степени метилирования гена ogdh-3 показано, что низкие концентрации кислорода вызывают изменение величины метильного статуса CG-динуклеотидов. В начале эксперимента степень метилированных динуклеотидов составляла 50%. Снижение значений относительного уровня транскриптов данного гена сопровождалось увеличением количества метилированных цитозинов. Спустя 24 ч от начала эксперимента степень метилирования промотора составляла 75%. На протяжении всего опыта в контрольной группе растений, находящейся в нормаксических условиях, изменения степени метилирования CG-динуклеотидов не наблюдалось (50% всех исследованных цитозинов были метилированы). Ген, кодирующий митохондриальную форму МДГ, также демонстрировал корреляцию между содержанием транскрипта исследуемого гена и изменением его метильного статуса. Количество метилированных цитозинов в промоторе гена за всё время эксперимента увеличивалось с 25 до 75%.
Таким образом, изменение активности митохондриальных ферментов 2-ОГДГ и МДГ в листьях кукурузы в гипоксических условиях обусловлено состоянием генетического аппарата клетки. Установлено, что колебания содержания транскриптов генов ogdh-1 и ogdh-3 сопряжено с изменением метильного статуса CG-динуклеотидов в их промоторах. Увеличение экспрессии генов связано со снижением степени метилирования их промоторов, в то время как уменьшение значений относительного уровня транскриптов было вызвано увеличением количества метилированных CG-динуклеотидов. Следовательно, регуляция функционирования 2‑оксоглутаратдегидрогеназы и малатдегидрогеназы в условиях низких концентраций кислорода осуществляется на эпигенетическом уровне посредством изменения метильного статуса промоторов их генов.
Работа выполнена при финансовой поддержке гранта Российского фонда фундаментальных исследований № 20-04-00296.
Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов. Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Devin A., Rigoulet M. Mechanisms of mitochondrial response to variations in energy demand in eukaryotic cells // Am. J. Physiol. Cell Physiol. 2007. V. 292. P. 52.
Duchen M., Surin A., Jacobson J. Imaging mitochondrial function in intact cells // Meth. Enzymol. 2003. V. 361. P. 353.
Лукьянова Л.Д., Кирова Ю.И., Сукоян Г.В. Новое о сигнальных механизмах адаптации к гипоксии и их роли в системной регуляции // Патогенез. 2011. Т. 9. С. 4.
Narsai R., Rocha M., Geigenberger P., Whelan J., van Dongen J.T. Comparative analysis between plant species of transcriptional and metabolic responses to hypoxia. New Phytol. 2011. V. 190. P. 472.
Кузнецов В.В., Дмитриева Г.А. Физиология растений. М.: Высш. шк., 2006. 743 с.
Медведев С.С. Физиология растений. М.: Высш. шк., 2004. 335 с.
Лукьянова Л.Д. Дудченко А.М., Цыбина Т.А. Германова Э.Л., Ткачук Е.Н., Эренбург И.В. Действие интервальной нормобарической гипоксии на кинетические свойства митохондриальных ферментов // Бюл. эксп. биол. и мед. 2007. Т. 12. С. 644.
Lukyanova L.D. Mitochondria signaling in adaptation to hypoxia // Int. J. Phys. Pathophys. 2014. V. 5. P. 1.
Michiels C. Physiological and pathological responses to hypoxia // Am. J. Pathol. 2004. V.164. P. 1875.
Seppet E., Gruno M., Peetsalu A., Gizatullina Z., Nguyen H.P., Vielhaber S., Wussling M.H., Trumbeckaite S., Arandarcikaite O., Jerzembeck D., Sonnabend M., Jegorov K., Zierz S., Striggow F., Gellerich F.N. Mitochondria and energetic depression in cell pathophysiology // Int. J. Mol. Sci. 2009. V. 10. P. 2252.
Machado A., Nuñez de Castro I., Mayor F. Isocitrate dehydrogenases and oxoglutarate dehydrogenase activities of baker’s yeast grown in a variety of hypoxic conditions // Mol. Cell Biochem. 1975. V. 6. P. 93.
Pucciariello C., Parlanti S., Banti V., Novi G., Perata P. Reactive oxygen species-driven transcription in Arabidopsis under oxygen deprivation // Plant Physiol. 2012. V. 159. P. 184.
Wang Y., Guo Y.R., Liu K., Yin Z., Liu R., Xia Y., Tan L., Yang P., Lee J.H., Li X.J., Hawke D., Zheng Y., Qian X., Lyu J., He J., Xing D., Tao Y.J., Lu Z. KAT2A coupled with the alpha-KGDH complex acts as a histone H3 succinyltransferase // Nature. 2017. V. 552. P. 273.
Yudina R.S. Malate dehydrogenase in plants: Its genetics, structure, localization and use as a marker // Adv. Biosci. Biotechnol. 2012. V. 3. P. 370.
Alexandrov N.N., Brover V.V., Freidin S., Troukhan M.E., Tatarinova T.V., Zhang H., Swaller T.J., Lu Y.P., Bouck J., Flavell R.B., Feldmann K.A. Insights into corn genes derived from large-scale cDNA sequencing // Plant Mol. Biol. 2009. V. 69. P. 179.
Войцековская С.А., Астафурова Т.П., Агеев Б.Г., Сапожникова В.А. Особенности биохимических механизмов адаптации к гипобарической гипоксии растений, различающихся по устойчивости // Вестник ТГПУ. Сер. Естественные и точные науки. 2003. В 4. С. 112.
Blokhina O., Törönen P., Fagerstedt K.V. Oxidative stress components explored in anoxic and hypoxic global gene expression data // Low oxygen stress in plants. Plant Cell Monographs. Wien: Springer-Verlag, 2014. V. 21. P. 19.
Eprintsev A.T., Fedorin D.N., Dobychina M.A., Igamberdiev A.U. Expression and promoter methylation of succinate dehydrogenase and fumarase genes in maize under anoxic conditions// J. Plant Physiol. 2017. V. 216. P. 197.
Araujo W.L., Nunes-Nesi A., Trenkamp S., Bunik V.I., Fernie A.R. Inhibition of 2-oxoglutarate dehydrogenase in potato tuber suggests the enzyme is limiting for respiration and confirms its importance in nitrogen assimilation // Plant Physiol. 2008. V. 148. P. 1782.
Епринцев А.Т., Гатауллина М.О., Лященко М.С. Получение гомогенных препаратов изоформ НАД+-зависимой малатдегидрогеназы из мезофилла листьев кукурузы и изучение их физико-химических и каталитических свойств // Прикладная биохимия и микробиология. 2016. Т. 52. С. 365.
Chomczynski P., Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction // Anal. Biochem. 1987. V. 162. P. 156.
Nicot N., Hausman J.F., Hoffmann L., Evers D. Housekeeping gene selection for real-time RT-PCR normalization in potato during biotic and abiotic stress // J. Exp. Bot. 2005. V. 56. P. 2907.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method // Methods. 2001. V. 25. P. 402.
Hsieh C.L. Evidence that protein binding specifies sites of DNA demethylation // Mol. Cell Biol. 1999. V. 19. P. 46.
Лакин Г.Ф. Биометрия. М.: Высш. шк., 1990. 351 с.
Eprintsev A.T., Fedorin D.N., Karabutova L.A., Igamberdiev A.U. Expression of genes encoding subunits A and B of succinate dehydrogenase in germinating maize seeds is regulated by methylation of their promoters // Journal of Plant Physiology. 2016. V. 205. P. 33.
Eprintsev A.T., Fedorin D.N., Dobychina M.A. The role of methylation of CpG islands of the csy3 gene promotor in the light regulation of ATP-citrate lyase activity in maize leaves // Russ. J. Plant Physl. 2019. V. 66. P. 259.
Vanyushin B.F., Ashapkin V.V. DNA methylation in higher plants: Past, present and future// BBA. 2011. V. 1809. P. 360.
Eprintsev A.T., Fedorin D.N., Selivanova N. V., Wu T., Makhmud A., Popov V. N. The role of promoter methylation in the regulation of genes encoding succinate dehydrogenase in maize seedlings. //. Russ. J. Plant Physl. 2012. V. 59. P. 299.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений


