Физиология растений, 2020, T. 67, № 2, стр. 214-224
Особенности мутантов Anabaena PCC 7120ΔHUP с аминокислотными заменами в нитрогеназе
А. И. Романова a, Т. В. Лауринавичене a, А. А. Цыганков a, *
a Институт фундаментальных проблем биологии Российской академии наук – обособленное подразделение Федеральный исследовательский центр “Пущинский научный центр биологических исследований
Российской академии наук”
Пущино, Россия
* E-mail: ttt-00@mail.ru
Поступила в редакцию 24.01.2019
После доработки 27.02.2019
Принята к публикации 04.03.2019
Аннотация
Мутанты филаментной цианобактерии Anabaena PCC 7120 ΔHup (dc-Q193S и dc-R284H) с аминокислотными заменами, расположенными вблизи от FeMo-кофактора нитрогеназы, имели нитрогеназную активность по выделению водорода около 18 мкмоль Н2/(мг ч), что на ~30% ниже, чем у родительского штамма ΔHup. Фотосинтетическая активность у мутантов также понижена. Мутант d-c-Q193S, в отличие от родительского штамма ΔHup, продемонстрировал более низкий температурный оптимум для выделения Н2. Эти различия, видимо, обусловлены пониженной прочностью филаментов (их фрагментацией). При этом выделение водорода у мутантов мало отличалось от родительского штамма по энергии активации, по константам насыщения светом (41–62 мкмоль квантов/(м2 с)) и по ингибированию ацетиленом. Однако в отличие от родительского штамма выделение водорода у них не ингибировалось молекулярным азотом, т.е. аминокислотные замены вызвали существенные изменения в реакции, требующей 8 электронов (фиксация N2). Возможность использования азота или воздуха вместо аргона при получении водорода перспективна с практической точки зрения, но пониженная активность и повышенная хрупкость филаментов у изученных мутантов ограничивает возможности их практического использования.
ВВЕДЕНИЕ
Для устойчивого развития человечество нуждается в энергии. Традиционное использование ископаемых источников энергии приводит к нарастающим проблемам загрязнения окружающей среды, повышению содержания углекислоты в атмосфере и средней температуры поверхности Земли. Этим обусловлена ориентация на использование альтернативных источников энергии и, в частности, солнечной энергии. Одним из способов ее запасания может быть образование водорода биологическим путем. Водород – экологически чистый энергоноситель, поскольку продуктом его окисления является вода.
Фотобиологическое выделение водорода цианобактериями считается идеальным процессом получения возобновляемой энергии, потому что вода в качестве электронного донора и свет как источник энергии легко доступны и находятся в изобилии [1–3]. Группа гетероцистных цианобактерий наиболее исследована как с точки зрения физиологии, так и молекулярной биологии. Выделение водорода у них катализируется нитрогеназой и/или Hox-гидрогеназой, причем оба фермента чувствительны к кислороду. Однако нитрогеназа, в отличие от гидрогеназы, катализирует необратимый процесс, что считается более перспективным.
В качестве продуцента водорода наиболее изучены виды Anabaena и Nostoc. Помимо видовых характеристик цианобактерий, на выделение водорода нитрогеназой могут влиять различные факторы: состав среды (особенно источники связанного азота), рН, состав газовой фазы, температура, интенсивность света и другие особенности проведения процесса [4–6]. При оценке перспективности получения водорода с помощью цианобактерий важна и скорость процесса, и его продолжительность, и эффективность преобразования энергии света. Высокая эффективность преобразования световой энергии (2.5%) получена с использованием цианобактерий, иммобилизованных в тонких пленках Ca2+ альгинатного геля, при низкой освещенности [7]. Продолжительное выделение водорода на протяжении нескольких месяцев продемонстрировано в аэробных условиях при периодическом (естественном) освещении [8]. Однако добиться максимальной скорости выделения Н2, продолжительности и эффективности в одних и тех же условиях практически невозможно. Предполагается, что выделение водорода у природных штаммов цианобактерий уже близко к теоретическому максимуму и оптимальные условия процесса в целом выявлены [3]. Поэтому для улучшения характеристик процесса выделения водорода созданы и охарактеризованы разнообразные мутанты.
Поскольку нитрогеназа у гетероцистных цианобактерий синтезируется в гетероцистах, увеличение их числа должно способствовать возрастанию нитрогеназной активности. Обычно частота гетероцист составляет 5–10% от числа вегетативных клеток [9]. Получены мутанты Anabaena sp. с частотой гетероцист 13–18%. У них выделение водорода при высокой концентрации хлорофилла (Хл) возрастало в 1.7 раза по сравнению с родительским штаммом [10].
Известно, что нитрогеназа цианобактерий чувствительна к кислороду, поэтому для фотовыделения водорода необходимы анаэробные условия [2, 3]. Однако помимо прямой инактивации нитрогеназы существует возможность поглощения выделившегося водорода в присутствии О2 как акцептора электронов, что существенно снижает выход водорода [11]. Поскольку поглощение водорода катализируется поглощающей Hup-гидрогеназой, были предприняты попытки получения мутантов с нарушенным синтезом этого фермента. Для инактивации гена, кодирующего поглощающую гидрогеназу у разных цианобактерий, использовались разные приемы (химический ненаправленный мутагенез с последующим отбором перспективных мутантов, мутанты ΔhupL, ΔhupS, ΔhupSL, ΔhupW, ΔxisC). Во всех случаях наблюдали существенное повышение выделения Н2 [12–17] Показана и повышенная эффективность преобразования световой энергии в водород (4%) у таких мутантов [17]. В то же время отсутствие Hup-гидрогеназы может уменьшать продолжительность процесса, особенно у иммобилизованных культур, т.к. предполагается, что этот фермент защищает фотосинтетический аппарат вегетативных клеток от фотоингибирования, особенно в условиях стресса [18].
Для создания анаэробных условий при выделении водорода обычно используется проток аргона в качестве газовой фазы, что существенно удорожает процесс. Оптимальным было бы проведение процесса под азотом или воздухом, однако в этом случае нитрогеназная активность максимальна лишь в течение короткого времени: аммоний, образуемый в процессе фиксации молекулярного азота, подавляет синтез нитрогеназы [2]. Именно поэтому были сконструированы мутанты штамма Anabaena PCC 7120 без Hup-гидрогеназы с аминокислотными заменами dc-Q193S и dc-R284H, расположенными в непосредственной близости от FeMo-кофактора нитрогеназы [19]. Эти модификации в нитрогеназе привели к увеличению выделения H2 при длительном культивировании под N2, т.к. выделение водорода не снижалось в присутствии высоких концентраций азота в газовой фазе, в отличие от родительского штамма ΔHup, который требовал низких концентраций азота для продолжительного выделения водорода [19].
Такие мутанты представляют несомненный интерес в биотехнологическом получении водорода, для чего необходимо выяснение их ранее неизученных свойств, в частности, определение максимальных скоростей и констант насыщения светом для фотосинтетической и нитрогеназной активности, а также температурной зависимости выделения водорода. Эта информация существенна при проведении экспериментов на открытом воздухе при невозможности поддержания оптимальных условий. В теоретическом аспекте сравнение констант ингибирования ацетиленом у разных мутантов может быть полезным для выяснения влияния аминокислотных замен на функционирование активного центра нитрогеназы.
Цель работы – оценка перспективности использования мутантов Anabaena sp. PCC 7120 ΔHup (dc-Q193S и dc-R284H) для получения водорода на открытом воздухе при сопоставлении влияния интенсивности света и температуры на их фотосинтетическую и нитрогеназную активность, а также стабильность.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты и условия культивирования. Объектом исследования являлись родительский штамм цианобактерий Anabaena sp. PCC 7120 ΔHup, не синтезирующий водород-поглощающую Hup-гидрогеназу, и мутанты dc-Q193S и dc-R284H, любезно предоставленные профессором Sakurai H., университет Канагава, Япония. Мутанты были сконструированы проф. Masukawa с соавт. [19], они отличались аминокислотными заменами глутамина на серин в 193 положении (dc-Q193S) и аргинина на гистидин в 284 положении(dc-R284H), причем обе замены расположены в непосредственной близости от FeMo-кофактора нитрогеназы.
Все штаммы (посевной материал) выращивали фотоавтотрофно в 300 мл колбах Эрленмейера на жидкой среде Алена-Арнона, разбавленной в 8 раз (АА/8) [19] с добавлением 2.5 мМ (NH4)2SO4 (АА/8 + N) и 5 мМ TES-KOH буфера (рН = 8.2). Выращивание проводили при 27°С на свету (30 мкмоль квантов/(м2 с)), в атмосфере воздуха при перемешивании 95 об./мин, с добавлением в среду антибиотиков стрептомицина и спектиномицина (по 2 мкг/мл).
Для определения фотосинтетической и нитрогеназной (водород-выделяющей) активности культуры выращивали без антибиотиков при 27°С на свету (30–50 мкмоль квантов/(м2 с)). Посевной материал вносили в сосуд со стеклянным барботером в количестве 10% от рабочего объема (250–270 мл). Использовали постоянную продувку воздухом с 1% СО2 через автоклавируемые мембранные фильтры с размером пор 0.2 мкм (“Pall”, США). Предварительно были подобраны условия центрифугирования и перемешивания культур цианобактерий, чтобы максимально сохранить целостность филаментов. В дальнейшем центрифугирование проводили при 1200–2300 об./мин, в зависимости от объема осаждаемой культуры, а перемешивание в ячейке – при 100–200 об./мин. Фотосинтетическую активность определяли у культур, выросших на среде со связанным азотом (см. выше).
Для изучения выделения водорода родительский штамм Anabaena sp. PCC 7120 ΔHup выращивали на среде без связанного азота в течение 5 дней при продувании воздухом с 1% СО2. Поскольку мутанты dc-Q193S и dc-R284H характеризуются слабой способностью к диазотрофному росту или даже ее отсутствием [19], а при использовании связанного азота не образуют гетероцист (как и другие цианобактерии), их выращивали на среде АА/8 + N до полного исчерпания связанного азота или с промежуточным отмыванием клеток от связанного азота. Во втором случае через 3 дня (наращивание биомассы) клетки осаждали центрифугированием (2300 об./мин, 3 мин), дважды отмывали от азота средой без азота (АА/8 – N), центрифугировали, ресуспендировали в этой среде и культивировали в колбах Эрленмейера с постоянной продувкой (как указано выше). На 5 день выращивания (2 дня без азота) рН среды доводили до 8.2 используя 1М NaHCO3 (конечная концентрация ~10 мМ). В обоих случаях нитрогеназная активность появлялась на 5 день. Большинство экспериментов проводилось на 6 день с использованием второго подхода. Использование первого подхода и варьирование времени выращивания отражено в подписях к рисункам.
Измерение фотосинтетической активности полярографическим методом. Фотосинтетическое выделение кислорода измеряли при помощи электрода Кларка: в ячейку (“Hansatech”, Англия) объемом 4 мл вносили 4 мл культуры цианобактерий с концентрацией 6.0–8.5 мг Хл/л. Выделение кислорода измеряли после 2-минутной адаптации в темноте при добавлении 80 мкл 0.5М NaHCO3, используя разную интенсивность света (10–1700 мкмоль квантов/(м2 с)) и разные температуры (16–35°С). Источником света служил диапроектор ЛЭТИ-60 (Россия), у которого удаляли держатель слайдов и инфракрасный светофильтр, а на пути светового луча устанавливали кювету с 1% CuSO4 (длина оптического пути 4.5 см). Скорость фотосинтеза рассчитывали как алгебраическую разность скоростей выделения кислорода на свету и поглощения в темноте после 4 минут освещения и выражали в расчете на 1 мг Хл (мкмоль О2/мг ч). Электрод калибровали при температуре планируемого эксперимента, добавляя 4 мл дистиллированной воды, насыщенной воздухом.
Измерение нитрогеназной активности полярографическим методом. В день анализа необходимый объем культуры переносили в колбу с ватно-марлевой пробкой и инкубировали при 27°С на свету (50 мкмоль квантов/(м2 с)) на качалке ELMI S-3L (“Sky Line”, Латвия) при перемешивании 95 об./мин. В течение дня из этой колбы отбирали культуру для измерений, концентрировали центрифугированием (1200 об./мин, 3 мин) до 20 мг Хл/л, помещали в сосуды с герметично закручивающимися пробками объемом 9 мл и заменяли газовую фазу на аргон. В расчетах учитывали коэффициент падения активности в ходе инкубации.
Выделение водорода измеряли при помощи электрода Кларка в ячейке объемом 1 мл (“Hansatech”, Англия) при непрерывном перемешивании 100 об/мин. Ячейку перед каждым измерением продували аргоном, и культуру из сосудов с аргоном (1 мл) вносили анаэробно в потоке аргона. После 2‑минутной адаптации культуры в темноте включали свет и регистрировали выделение водорода в зависимости от целей эксперимента при постоянной температуре 27°С и разной интенсивности света (10–2800 мкмоль квантов/(м2 с)) или при разных температурах (15–45°С), но постоянной насыщающей интенсивности света 500 мкмоль квантов/(м2 с). Скорость фотовыделения водорода рассчитывали как алгебраическую разность скоростей выделения водорода на свету и в темноте и выражали в расчете на 1 мг Хл (мкмоль Н2/(мг ч)). Электрод калибровали при температуре планируемого эксперимента, добавляя в ячейку 0.1 мл дистиллированной воды, насыщенной водородом. Содержание водорода рассчитывали, используя табличные данные для растворимости в зависимости от температуры. Результаты для каждой температуры (5 измерений) усредняли и рассчитывали калибровочные коэффициенты.
Измерение нитрогеназной активности газохроматографическим методом. В экспериментах по изучению влияния азота и ацетилена на нитрогеназную активность концентрацию водорода определяли газохроматографически (“ЛХМ80”, Россия) [20]. Культуры, подготовленные, как описано выше (но не концентрированные), порциями по 3.5 мл (10 мг Хл/л) помещали в 16 мл пробирки Хангейта с плотно закручивающимися пробками. Газовую фазу заменяли на аргон, затем добавляли 4.8–100% N2 или 2.3–20% C2H2, что соответствовало 27–570 мкМ растворенного N2 и 0.9–7.7 мкМ растворенного C2H2. Пробирки инкубировали на свету (70 мкмоль квантов/(м2 с)) при температуре 27°С и перемешивании 95 об./мин. После 1.5–2 часов инкубации и затем через каждые 2 часа измеряли концентрацию водорода и рассчитывали скорость выделения на 1 мг Хл (мкмоль Н2/мг ч). Для мутанта dc-Q193S скорость выделения водорода в первые два часа была низкой, но далее увеличивалась, поэтому принимали в расчет результаты после 4 и 6 часов инкубации.
Аналитические методы. Концентрацию Хл измеряли спектрофотометрически при 664 нм (UV-VIS 1240 Mini, “Shimadzu”, Япония) после экстракции 85% метанолом. Концентрацию аммония в среде измеряли микродиффузионным методом с реактивом Несслера [21]. Плотность потока ФАР измеряли квантометром QMSW-SS (“Apogee Instruments”, США).
Микроскопирование. Наличие гетероцист в филаментах цианобактерий исследовали методом световой микроскопии ЛОМО МИКМЕД-2 (“Ломо”, Россия). Количество гетероцист определяли путем подсчета 300–500 клеток в каждом образце. Фотографии были получены с помощью камеры SCOPETEK DCM-900 (“Scopetek”, Китай), закрепленной на окуляре микроскопа.
Статистическая обработка данных. Для количественного анализа экспериментальные данные по влиянию интенсивности света аппроксимировали по уравнению Михаэлиса-Ментен:
(1)
$V = {{{{V}_{{\max }}}I} \mathord{\left/ {\vphantom {{{{V}_{{\max }}}I} {({{K}_{s}} + I)}}} \right. \kern-0em} {({{K}_{s}} + I)}},$Энергию активации рассчитывали из уравнения Аррениуса:
(2)
${{Е}_{а}} = {{(R{{T}_{1}}{{T}_{2}}\ln ({{{{k}_{{{{T}_{2}}}}}} \mathord{\left/ {\vphantom {{{{k}_{{{{T}_{2}}}}}} {{{k}_{{{{T}_{1}}}}}}}} \right. \kern-0em} {{{k}_{{{{T}_{1}}}}}}})} \mathord{\left/ {\vphantom {{(R{{T}_{1}}{{T}_{2}}\ln ({{{{k}_{{{{T}_{2}}}}}} \mathord{\left/ {\vphantom {{{{k}_{{{{T}_{2}}}}}} {{{k}_{{{{T}_{1}}}}}}}} \right. \kern-0em} {{{k}_{{{{T}_{1}}}}}}})} {({{T}_{2}} - {{T}_{1}})}}} \right. \kern-0em} {({{T}_{2}} - {{T}_{1}})}},$Температурный коэффициент был рассчитан из уравнения:
(3)
${{Q}_{{10}}} = {{({{{{V}_{2}}} \mathord{\left/ {\vphantom {{{{V}_{2}}} {{{V}_{1}}}}} \right. \kern-0em} {{{V}_{1}}}})}^{{{{10} \mathord{\left/ {\vphantom {{10} {({{T}_{2}} - {{T}_{1}})}}} \right. \kern-0em} {({{T}_{2}} - {{T}_{1}})}}}}},$Статистическая обработка данных была выполнена в программе SigmaPlot 11.0 Все эксперименты были выполнены в 3–5 биологических повторностях (2–3 аналитических). На рисунках, содержащих по одной кривой, приведены средние результаты опытов при 95% доверительном интервале. На рисунках, содержащих по 2–3 кривые, доверительный интервал не указан, поскольку он не превышал 20% от среднего значения.
РЕЗУЛЬТАТЫ
Влияние интенсивности света на скорость фотосинтеза у родительского штамма ΔHup и dc-Q193S, dc-R284H при разных температурах
Скорость выделения кислорода родительским штаммом ΔHup и мутантами dc-Q193S, dc-R284H увеличивалась с повышением интенсивности света (рис. 1). Сходный характер зависимости наблюдали при разных температурах: 16, 20, 27, 35°С, за исключением родительского штамма ΔHup при 16°С, где, видимо, имело место фотоингибирование. Максимальная скорость выделения кислорода у всех штаммов была при 35°С, хотя оптимальная температура для роста 27–30°С. В одинаковых условиях (температура, интенсивность света) скорость выделения кислорода у родительского штамма была выше по сравнению с мутантами (рис 1).
Рис. 1.
Фотосинтетическое выделение кислорода родительским штаммом ΔHup (а) и мутантами dc-Q193S (б), d-c‑R284H (в) в зависимости от интенсивности света при разных температурах (1 – 16°С; 2 – 20°С; 3 – 27°С; 4 – 35°С). Точки представляют собой экспериментальные данные, а кривые (за исключением (а), 1 – 16°С) описывают результаты аппроксимации.

Для количественного анализа экспериментальные данные по влиянию интенсивности света аппроксимировали по уравнению Михаэлиса-Ментен (табл. 1). Все значения удовлетворительно описываются данным уравнением, коэффициент корреляции R > 0.91. Максимальная расчетная скорость фотосинтеза (как и полученная экспериментально) у всех штаммов была выше при 35°С, причем при каждой из проверенных температур она была выше у родительского штамма ΔHup.
Таблица 1.
Результаты аппроксимации зависимости скорости выделения кислорода мутантами от интенсивности света при разных температурах (рис. 1)
| Штамм | Температура, °C | R | Vmax | Ks |
|---|---|---|---|---|
| ΔHup | 16 | – | – | – |
| 20 | 0.97 | 263 | 108 | |
| 27 | 0.97 | 310 | 153 | |
| 35 | 0.99 | 607 | 258 | |
| dc-Q193S | 16 | 0.91 | 69 | 23 |
| 20 | 0.97 | 117 | 35 | |
| 27 | 0.98 | 175 | 52 | |
| 35 | 0.99 | 264 | 79 | |
| dc-R284H | 16 | 0.95 | 95 | 33 |
| 20 | 0.97 | 100 | 55 | |
| 27 | 0.94 | 201 | 76 | |
| 35 | 0.99 | 309 | 100 |
Константы насыщения светом при всех температурах также были ниже у dc-Q193S и dc-R284H, т.е. они достигали насыщения фотосинтеза при более низкой плотности потока ФАР, чем родительский штамм ΔHup.
Выделение водорода родительским штаммом ΔHup и мутантом dc-Q193S на разных фазах роста культур
В этой серии экспериментов выделение Н2 измеряли полярографическим методом с электродом Кларка. На 3–4 день выращивания активности по выделению водорода еще не наблюдали, хотя при микроскопировании обнаруживались гетероцисты в небольшом количестве. Активность появлялась на пятый день роста и у родительского штамма ΔHup (рис. 2а), и у мутанта dc-Q193S (рис. 2б). При этом культура мутанта dc-Q193S на пятый день находилась в состоянии голодания по азоту, поскольку содержание аммония в среде было меньше 0.4 мкг/мл. В это же время число гетероцист увеличивалось. На шестой день активность была максимальной (что совпадало с началом или серединой стационарной фазы), а затем снижалась.
Рис. 2.
Накопление биомассы (1 – Хл, 2 – ОП700, 0,1 см кювета) и скорость выделения водорода (3) при росте родительского штамма ΔHup (а) и мутанта dc-Q193S (б). Родительский штамм ΔHup выращивался в азотфиксирующих условиях, мутант dc-Q193S – на среде со связанным азотом до его исчерпания, без дополнительного отмывания.

Как видно из рис. 2, скорость роста мутанта была выше, чем родительского штамма (0.04 и 0.02 1/ч, соответственно). Следует иметь в виду, что в этом случае родительский штамм выращивали в условиях азотфиксации, а мутант – на среде со связанным азотом. Если же родительский штамм выращивали в присутствии связанного азота, скорость увеличивалась до 0.04 1/ч (данные не приведены). Более низкая конечная концентрация биомассы у мутанта объясняется исчерпанием аммония и невозможностью использовать молекулярный азот.
Влияние интенсивности света на выделение водорода родительским штаммом ΔHup и мутантом dc-Q193S
В этой серии экспериментов выделение Н2 измеряли полярографическим методом. Скорость выделения водорода родительским штаммом ΔHup и мутантом dc-Q193S увеличивалась с увеличением интенсивности света от 10 мкмоль квантов/(м2 с) до ~500 мкмоль квантов/(м2 с) и не изменялась при дальнейшем увеличении интенсивности до 2820 мкмоль квантов/(м2 с) (рис. 3). При этом более высокая скорость была у родительского штамма ΔHup.
Рис. 3.
Влияние интенсивности света на скорость выделения водорода родительским штаммом ΔHup (а) и мутантом dc-Q193S (б) на разных стадиях роста (1 – 5 день; 2 – 6 день; 3 – 7 день). Точки представляют собой экспериментальные данные, а кривые описывают результаты аппроксимации.

Аппроксимация экспериментальных данных показала, что расчетная максимальная скорость выделения водорода у родительского штамма ΔHup была выше, чем у мутанта dc-Q193S почти в 7 раз, при этом константа насыщения ниже в 1.5 раза (табл. 2). В дальнейших экспериментах использовали интенсивность света 500 мкмоль квантов/(м2 с) для всех штаммов.
Таблица 2.
Результаты аппроксимации зависимости скорости выделения водорода от интенсивности света (рис. 3а, б).
| Штамм | День культивирования | R | Vmax | Ks |
|---|---|---|---|---|
| ΔHup | 6 | 0.97 | 20.8 ± 2.2 | 41.1 |
| dc-Q193S | 6 | 0.96 | 3.0 ± 0.3 | 62.2 |
Влияние температуры на выделение водорода родительским штаммом и мутантом
В этой серии экспериментов выделение Н2 измеряли полярографическим методом. Скорость выделения водорода родительским штаммом ΔHup возрастала при повышении температуры до 45°С, однако выше 34°С зависимость была нелинейной (рис. 4а). Выделение водорода мутантом dc-Q193S возрастало при увеличении температуры до 30–34°С, а при дальнейшем увеличении температуры снижалось (рис. 4б).
Рис. 4.
Влияние температуры на скорость выделения водорода родительским штаммом ΔHup (а) и мутантом dc-Q193S (б). 100% активность для родительского штамма ΔHup – 22 мкмоль Н2/(мг ч) и для dc-Q193S – 3 мкмоль Н2/(мг ч).

Энергия активации для родительского штамма составила 43.3 кДж/моль, а для мутанта dc-Q193S – 61.3 кДж/моль. Для количественной оценки температурных эффектов рассчитывали также температурный коэффициент Q10. Для родительского штамма Q10 оказался равным 1.9, а для мутанта – 2.4.
Для объяснения пониженной активности мутанта dc-Q193S при температурах >30°С было проверено физиологическое состояние (морфология) цианобактерий в этих условиях. Установлено, что при повышении температуры от 27 до 45°С, а также при понижении до 15°С (и перемешивании) целостность филаментов у мутанта dc-Q193S, в отличие от родительского типа, сильно нарушалась: наблюдали разрыв нитей и свободноплавающие гетероцисты (рис. 5б, в – для мутанта; для родительского штамма не показано). При 27°С доля свободных гетероцист от всего количества клеток составляла 1.2%, а при 45 и 15°С – 11.4 и 8.6%, соответственно. У родительского штамма при 27°С доля свободных гетероцист составляла 0.4%, а при 45 и 15°С – 1 и 2%, соответственно.
Влияние молекулярного азота на выделение водорода родительским штаммом и мутантами
В этой серии экспериментов выделение Н2 измеряли методом ГХ. Метод ГХ позволяет использовать более широкий диапазон концентрации молекулярного азота, который в этом случае вводился в газовую фазу, а не в культуру непосредственно, как в полярографическом методе. При добавлении >57 мкМ N2 скорость выделения водорода у родительского штамма заметно снижалась, при 300 мкМ наблюдали 50% ингибирование. Однако даже при 570 мкМ сохранялось около 40% от исходной активности. В отличие от этого выделение водорода у мутантов не ингибировалось даже при 570 мкМ N2 (рис. 6).
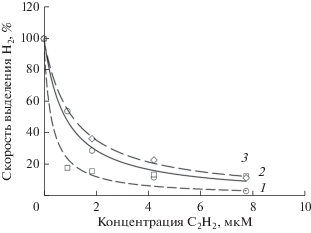
Влияние ацетилена на выделение водорода родительским штаммом и мутантами
В этой серии экспериментов выделение водорода измеряли методом ГХ. Выделение водорода у всех трех штаммов цианобактерий падало в 2–5 раз уже при 0.9 мкМ ацетилена и продолжало снижаться с увеличением концентрации ацетилена до 7.7 мкМ (рис. 7). При 0.9 мкМ ацетилена наиболее сильно снижалась активность у мутанта dc-Q193S, а при 7.7 мкМ ацетилена наименьшая активность была у родительского штамма ΔHup (рис. 7). Однако с учетом повышенного разброса данных в этих экспериментах различия вряд ли можно признать достоверными. В среднем 50% ингибирование у всех штаммов достигалось при концентрации ацетилена 0.4–1.1 мкМ.
ОБСУЖДЕНИЕ
Использование цианобактерий для получения биоводорода прежде всего требует, чтобы скорость выделения Н2 была достаточно высокой. Генно-инженерные методы позволяют получить штаммы цианобактерий с повышенной скоростью выделения водорода, в том числе штаммы азотфиксирующих гетероцистных цианобактерий, лишенных водород-поглощающей гидрогеназы [22]. Согласно литературным данным [13, 15], наиболее перспективные штаммы – это Anabaena variabilis ATCC 29413 ΔHupSL и Nostoc PCC 7422 ΔHupL, которые выделяли >100 мкмоль Н2/(мг ч). При этом использовались культуры с лимитированием связанным азотом и соблюдались анаэробные условия (100% Ar или Ar + 5% CO2). Поддержание анаэробных условий в фотобиореакторах является затратным, поэтому предпочтительно использование воздуха или молекулярного азота в качестве газовой фазы. В отличие от связанного азота, молекулярный азот не репрессирует синтез нитрогеназы, однако при диазотрофном росте цианобактерий нитрогеназная активность (измеренная под аргоном) сохраняется на высоком уровне лишь в течение 1–2 дней, а затем быстро падает вследствие накопления продукта азотфиксации – аммония [9]. Поэтому высокая скорость выделения водорода в таких условиях поддерживается непродолжительно. С другой стороны, в атмосфере аргона также невозможно длительное выделение водорода, т.к. при азотном голодании останавливается синтез ферментов. Поэтому периодическое добавление воздуха (как источника азота) в газовую фазу может быть полезным в некоторых случаях, что в частности показано для иммобилизованных культур [18]. Недостаток углерода также негативно сказывается на выделении водорода. В то же время сочетание избытка СО2 и недостатка азота может привести к нарушению соотношения C/N и далее к ингибированию фотосинтетической активности вегетативных клеток, что неизбежно отражается на выделении Н2 гетероцистами [18].
Другой подход предполагает получение мутантов, у которых активность длительно сохраняется в присутствии N2. Masukawa с соавт. [19] сконструировали мутанты Anabaena PCC 7120 без Hup-гидрогеназы с аминокислотными заменами dc-Q193S и dc-R284H, расположенными в непосредственной близости от FeMo-кофактора нитрогеназы. Эти модификации в нитрогеназе привели к суммарному увеличению выделения H2 при длительном культивировании под N2, т.к. выделение водорода не снижалось так резко в отличие от родительского штамма ΔHup. Чтобы выяснить возможности использования этих штаммов для получения водорода на открытом воздухе, мы детально изучили влияние внешних факторов (свет, температура).
По уровню фотосинтетической активности родительский штамм превосходил мутанты, он имел и более высокую константу насыщения светом Ks – 153 мкмоль квантов/(м2 с), по сравнению с 52 и 76 мкмоль квантов/(м2 с) для мутантов (рис. 1, табл. 1). Фотоингибирование имело место только при низкой температуре (рис. 1а). Для нитрогеназной активности (выделение водорода) константы насыщения светом Ks практически не отличались у родительского штамма и мутанта dc-Q193S (41 и 62 мкмоль квантов/(м2 с)) (рис. 3, табл. 2). Это заведомо ниже максимальной дневной интенсивности света на открытом воздухе. Ингибирования выделения водорода при высокой интенсивности света, близкой к естественному дневному освещению, в наших кратковременных экспериментах не наблюдалось.
Температурная зависимость выделения водорода в области 15–30°С также оказалась практически одинаковой у родительского штамма и мутанта dc-Q193S. Однако активность мутанта dc-Q193S уменьшалась при температуре выше 30°С (рис. 4), что, вероятно, связано с пониженной прочностью его филаментов и их фрагментацией (рис. 5).
Скорость выделения водорода у родительского штамма ΔHup была близкой, а у мутантов – ниже по сравнению с опубликованным ранее [19]. Это опять же может объясняться его высокой чувствительностью к механическим воздействиям в процессе подготовки культуры и самого анализа (имеется в виду центрифугирование, суспендирование и перемешивание культуры). Детали этих процедур могут быть разными в двух лабораториях. Но даже при одинаковых процедурах подготовки, исходное физиологическое состояние культур родительского штамма и мутанта могло различаться. Родительский штамм выращивался без связанного азота под воздухом за счет азотфиксации, тогда как мутанты выращивались с использованием связанного азота (до его исчерпания или с отмыванием клеток), а затем без связанного азота под воздухом, как и описано в работе [19]. В отличие от родительского штамма, способность мутантов к азотфиксации крайне ограничена, вследствие этого они могли находиться в состоянии азотного голодания. Известно, что лимитирование связанным азотом способствует образованию гетероцист. Однако при высокой степени лимитирования в составе филаментов Anabaena cylindrica уменьшалось количество вегетативных клеток, заключенных между двумя гетероцистами, при этом падала фотосинтетическая активность вегетативных клеток, т.е. нарушалось и обеспечение гетероцист метаболитами [23]. Фрагментация филаментов (вплоть до распада на отдельные клетки) была обнаружена ранее при голодании по азоту у короткоцепочечных мутантов Anabaena sp. PCC 7120 [24]. К понижению механической прочности филаментов приводили мутации в генах, кодирующих компоненты клеточной оболочки [25]. Установлено, что для целостности филаментов, как и для межклеточной коммуникации, важны белки Fra и SepJ, и мутанты fraH имели склонность к фрагментации и высвобождению гетероцист [26]. В свою очередь, инактивация амидазы АmiC1 влияет на локализацию SepJ и предотвращает фрагментацию, свойственную sepJ или fraC fraD мутантам [27]. Что касается наших экспериментов, остается неясным, могли ли мутации вблизи активного центра нитрогеназы повлиять на прочность филаментов. Скорее всего, это неспецифический эффект, связанный с азотным голоданием.
Молекулярный азот ингибировал выделение водорода лишь у родительского штамма, причем 50% ингибирование достигалось при 300 мкМ N2 (рис. 6). Эта величина сопоставима с данными, полученными для пурпурных бактерий Rhodobacter capsulatus, где 50% ингибирование наблюдалось при 114 мкМ [28]. Однако у пурпурной бактерии 40% N2 ингибировало выделение водорода почти полностью, тогда как в наших экспериментах у Anabaena PCC 7120 ΔHup даже при 100% N2 сохранялось около 40% водород-выделяющей активности. По-видимому, это связано с отсутствием потребления водорода на синтез азотсодержащих соединений в отсутствие Hup-гидрогеназы. В пользу этого свидетельствует тот факт, что очищенная нитрогеназа Azotobacter vinelandii сохраняет активность даже при 5000 кПа N2 [29]. В отличие от родительского штамма ΔHup, у мутанта dc-Q193S молекулярный азот не ингибировал выделение водорода даже при концентрации 100% в газовой фазе (рис. 6), что подтверждает данные Masukawa с соавт. [19]. Ингибирование выделения водорода ацетиленом наблюдалось и у родительского штамма, и у мутантов dc-Q193S и dc-R284H (рис. 7), однако различия между ними недостоверны.
Известно, что для выделения молекулы водорода, как и восстановления ацетилена до этилена, требуется, наряду с АТФ, два электрона от ферредоксина, тогда как для восстановления молекулярного азота – восемь. Поскольку молекулярный азот не ингибирует выделение водорода и не используется для роста у мутанта dc-Q193S, можно полагать, что данная точечная мутация приводит к потере способности нитрогеназы к накоплению 8 электронов, в то время как способность принять 2 электрона и передать их молекуле субстрата практически не нарушена.
С точки зрения получения биоводорода в присутствии молекулярного азота использование направленного мутагенеза нитрогеназы цианобактерий перспективно. Можно уточнить критерий для выбора мутантов такого рода. Известно, что наибольшей скоростью длительного выделения водорода обладали цианобактерии в присутствии 5% молекулярного азота [30]. Следовательно, повышение константы ингибирования в 10–20 раз (78% : 5%) позволит использовать атмосферную концентрацию азота как лимитирующую и длительное время поддерживать высокую нитрогеназную активность цианобактерий в выделении водорода. Однако для масштабированного получения водорода в природных условиях важны и другие свойства цианобактерий. С точки зрения реакции на факторы внешней среды, существенных различий между тремя штаммами не обнаружено, т.е. они в равной степени пригодны для этой цели. Но пониженная активность, и особенно повышенная хрупкость филаментов у данных мутантов с модифицированной нитрогеназой, ограничивает возможности их использования.
Отработка методик и предварительные экспериментальные данные были получены в рамках гранта Российского фонда фундаментальных исследований № 15-5450032. Уточнение данных, их анализ и подготовка публикации поддержано грантом Российского научного фонда № 19-14-00255.
Авторы заявляют об отсутствии конфликта интересов. Настоящая статья не содержит каких-либо исследований с участием людей и животных в качестве объектов исследования.
Список литературы
Prince R.C., Kheshgi H.S. The photobiological production of hydrogen: Potential efficiency and effectiveness as a renewable fuel // Crit. Rev. Microbiol. 2005. V. 31. P. 19.
Tamagnini P., Leitão E., Oliveira P., Ferreira D., Pinto F., Harris D.J., Lindblad P. Cyanobacterial hydrogenases: diversity, regulation and applications // FEMS Microbiol. Rev. 2007. V. 31. P. 692.
Bothe H., Schmitz O., Yates M.G., Newton W.E. Nitrogen Fixation and Hydrogen Metabolism in Cyanobacteria // Microbiol. Mol. Biol. R. 2010. V. 74. P. 529.
Dutta D., De D., Chaudhuri S., Bhattacharya S. Hydrogen production by cyanobacteria // Microb. Cell Fact. 2005. V. 4. P. 1.
Allahverdiyeva Y., Leino H., Saari L., Fewer D.P., Shunmugam S., Sivonen K., Aro E.M. Screening for biohydrogen production by cyanobacteria isolated from the Baltic Sea and Finnish lakes // Int. J. Hydrogen Energy. 2010. V. 35. P. 1117.
Dasgupta C.N., Jose Gilbert J., Lindblad P., Heidorn T., Borgvang S.A., Skjanes K., Das D. Recent trends on the development of photobiological processes and photobioreactors for the improvement of hydrogen production // Int. J. Hydrogen Energy. 2010. V. 35. P. 10218.
Kosourov S., Murukesan G., Seibert M., Allahverdiyeva Y. Evaluation of light energy to H2 energy conversion efficiency in thin films of cyanobacteria and green alga under photoautotrophic conditions // Algal Res. 2017. V. 28. P. 253.
Tsygankov A.A., Fedorov A.S., Kosourov S.N., Rao K.K. Hydrogen production by cyanobacteria in an automated outdoor photobioreactor under aerobic conditions // Biotechnol. Bioeng. 2002. V. 80. P. 777.
Wolk P. Heterocyst formation // Ann. Rev. Genet. 1996. V. 30. P. 59.
Masukawa H., Sakurai H., Hausinger R.P., Inoue K. Increased heterocyst frequency by patN disruption in Anabaena leads to enhanced photobiological hydrogen production at high light intensity and high cell density // Appl. Microbiol. Biotechnol. 2017. V. 101. P. 2177.
Tsygankov A., Serebryakova L., Rao K., Hall D. Acetylene reduction and hydrogen photoproduction by wild type and mutant strains of Anabaena at different CO2 and O2 concentrations // FEMS Microbiol. Lett. 1998. V. 167. P. 13.
Mikheeva L.E., Schmitzh O., Shestakov S.V., Bothe H. Mutants of the cyanobacterium Anabaena variabilis altered in hydrogenase activities // Z. Naturforsch C. 1995. V. 50. P. 505.
Happe T., Schutz K., Bohme H. Transcriptional and mutational analysis of the uptake hydrogenase of the filamentous cyanobacterium Anabaena variabilis ATCC 29413 // J. Bacteriol. 2000. V. 182. P. 1624.
Lindberg P. A hydrogen-producing, hydrogenase-free mutant strain of Nostoc punctiforme ATCC 29133 // Int. J. Hydrogen Energy. 2002. V. 27. P. 1291.
Yoshino F., Ikeda H., Masukawa H., Sakurai H. High photobiological hydrogen production activity of a Nostoc sp. PCC 7422 uptake hydrogenase-deficient mutant with high nitrogenase activity // Mar. Biotechnol. 2007. V. 9. P. 101.
Khetkorn W., Lindblad P., Incharoensakdi A. Inactivation of uptake hydrogenase leads to enhanced and sustained hydrogen production with high nitrogenase activity under high light exposure in the cyanobacterium Anabaena siamensis TISTR 8012 // J. Biol. Eng. 2012. V. 6. P. 1.
Nyberg M., Heidorn T., Lindblad P. Hydrogen production by the engineered cyanobacterial strain Nostoc PCC 7120 ΔhupW examined in a flat panel photobioreactor system // J. Biotechnol. 2015. V. 215. P. 35.
Kosourov S., Leino H., Murukesan G., Lynch F., Sivonen K., Tsygankov A.A., Allahverdiyeva Y. Hydrogen photoproduction by immobilized N2-fixing cyanobacteria: understanding the role of the uptake hydrogenase in the long-term process // Appl. Environ. Microbiol. 2014. V. 80. P. 5807.
Masukawa H., Sakurai H., Hausinger R.P., Inoue K. Sustained photobiological hydrogen production in the presence of N2 by nitrogenase mutants of the heterocyst-forming cyanobacterium Anabaena // Int. J. Hydrogen Energy. 2014. V. 39. P. 19444.
Laurinavichene T., Tekucheva D., Laurinavichius K., Ghirardi M., Seibert M., Tsygankov A. Towards the integration of dark and photo fermentative waste treatment. 1. Hydrogen photoproduction by purple bacterium Rhodobacter capsulatus using potential products of starch fermentation // Int. J. Hydrogen Energy. 2008. V. 33. P. 7020.
Любимов В.И., Львов Н.П., Христин Б.И. Модификация микродиффузионного метода определения аммония // Прикл. Биохим. Микробиол. 1968. Т. 4. С. 120.
Шестаков С.В., Михеева Л.Е. Генетический контроль водородного метаболизма цианобактерий // Генетика. 2006. Т. 42. С. 1512.
Silverman S.N., Kopf S.H., Bebout B.M., Gordon R., Som S.M. Morphological and isotopic changes of heterocystous cyanobacteria in response to N2 partial pressure // Geobiology. 2018. V. 17. P. 60.
Bauer C.C., Buikema W.J., Black K., Haselkorn R. A short-filament mutant of Anabaena sp. strain PCC 7120 that fragments in nitrogen-deficient medium // J. Bacteriol. 1995. V. 177. P. 1520.
Burnat M., Herrero A., Flores E. Compartmentalized cyanophycin metabolism in the diazotrophic filaments of a heterocyst-forming cyanobacterium // Proc. Natl. Acad. Sci. U. S. A. 2014. V. 111. P. 3823.
Herrero A., Stavans J., Flores E. The multicellular nature of filamentous heterocyst-forming cyanobacteria // FEMS Microbiol. Rev. 2016. V. 40. P. 831.
Bornikoel J., Carrión A., Fan Q., Flores E., Forchhammer K., Mariscal V., Mullineaux C.W., Pezer R., Silber N., Wolk C.P., Maldener I. Role of two cell wall amidases in septal junction and nanopore formation in the multicellular cyanobacterium Anabaena sp. PCC 7120 // Front. Cell. Infect. Microbiol. 2017. V. 7. P. 366.
Лауринавичене Т.В., Цыганков А.А., Гоготов И.Н. Сходства и различия альтернативной и Мо-содержащей нитрогеназ в клетках Rhodobacter capsulatus // Прикл. Биохим. Микробиол. 1994. Т. 30. С. 389.
Liang J., Burris R.H. Interactions among nitrogen, nitrous oxide, and acetylene as substrates and inhibitors of nitrogenase from Azotobacter vinelandii // Biochemistry. 1988. V. 27. P. 6726.
Lichtl R.R., Bazin M.J., Hall D.O. The biotechnology of hydrogen production by Nostoc flagelliforme grown under chemostat conditions // Appl. Microbiol. Biotechnol. 1997. V. 47. P. 701.
Дополнительные материалы отсутствуют.
Инструменты
Физиология растений