Журнал эволюционной биохимии и физиологии, 2023, T. 59, № 1, стр. 3-19
ЛИМФОДРЕНАЖНАЯ СИСТЕМА МОЗГА: НОВЫЙ ИГРОК В НЕЙРОНАУКЕ
О. В. Семячкина-Глушковская 1, *, Д. Э. Постнов 1, А. П. Хороводов 1, Н. А. Наволокин 1, Ю. Г. Г. Куртц 1, 2, 3
1 Саратовский национальный исследовательский государственный университет
им. Н.Г. Чернышевского
Саратов, Россия
2 Берлинский университет Гумбольдта
Берлин, Германия
3 Потсдамский институт изучения климатических изменений
Потсдам, Германия
* E-mail: glushkovskaya@mail.ru
Поступила в редакцию 29.07.2022
После доработки 27.11.2022
Принята к публикации 29.11.2022
- EDN: GXTLSK
- DOI: 10.31857/S0044452923010084
Аннотация
Лимфатическая система играет важную роль в дренаже тканей, выведении из них ненужных метаболитов и токсинов, а также это ключевая площадка, где разворачиваются сценарии иммунных реакций, защищая организм от бактерий и вирусов. В центральной нервной системе (ЦНС) дренажные процессы протекают с такой же интенсивностью, что и в периферических тканях. Мозг активно обменивается с кровью питательными соединениями и выделяет ненужные метаболиты, используя дренажные пути, которые тесно связаны с периферической лимфатической системой. Эти же пути являются “воротами” для трафика иммунных клеток и антител в ЦНС, которые могут осуществлять “центральный” иммунитет. За двухвековую историю изучения дренажных процессов мозга накоплено множество фактов, косвенно свидетельствующих о существовании лимфатических сосудов в ЦНС. Однако даже с появлением высоких технологий визуализации структур мозга и переломного события в нейронауке, когда пере-открыли менингеальные лимфатические сосуды (МЛС), ученые не продвинулась дальше подтверждения уже существующего факта о присутствии лимфатической сети исключительно в оболочках мозга, но не в его тканях. Отметим, что переоткрытие МЛС американскими учеными не явилось поистине новым для науки, поскольку их впервые описал итальянский анатом Масканьи еще 2 века назад и его результаты были подтверждены во многих других исследованиях, выполненных на оболочках мозга человека, макак, грызунов, собак, кроликов и Zebrafish. Поэтому в научной общественности “забытые” МЛС не были признаны как новое открытие. Данный обзор освещает переломные изменения в нейронауке, когда на сцену выходит новый игрок, расставляющий на свои логичные места двухвековые усилия ученых объяснить, как выводятся из мозга ненужные молекулы и токсины, а также как осуществляются дренаж и иммунитет в ЦНС. Это важная информативная платформа как для принципиально новых фундаментальных знаний о лимфатической системе оболочек мозга, так и для развития инновационных технологий нейрореабилитации на основе управления лимфодренажными процессами выведения токсинов и ненужных молекул из ЦНС.
ЧАСТЬ 1. ЛИМФАТИЧЕСКИЕ И ВЕНОЗНЫЕ ПУТИ ДРЕНАЖА ТКАНЕЙ ГОЛОВНОГО И СПИННОГО МОЗГА
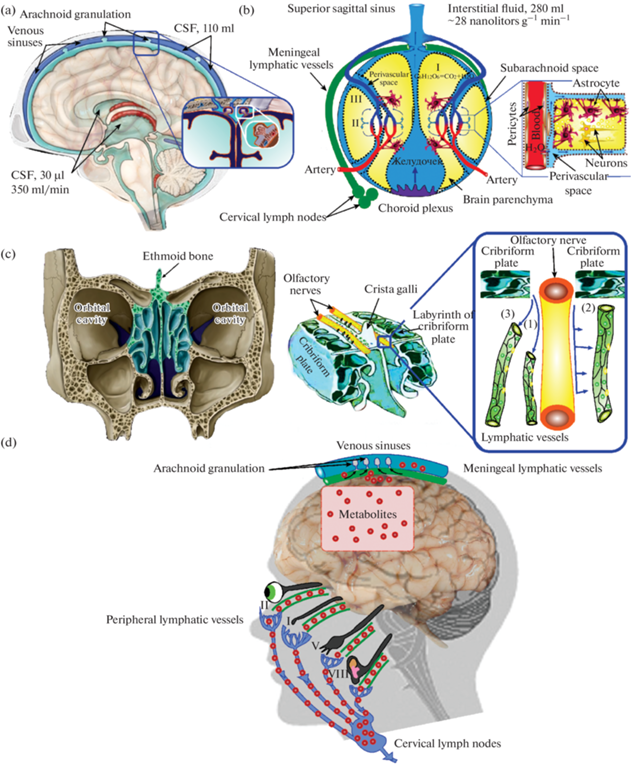
С точки зрения анатомии своеобразие мозга проявляется в том, что он заключен в полости ригидного черепа объемом, в среднем, 1900 мл. При этом в мозге постоянно образуются жидкости – спинномозговая (СМЖ) и интерстициальная (ИСЖ). СМЖ генерируется в системе желудочков головного мозга со скоростью 350 мкл/мин (у человека) [1]. Всего в мозге у человека 140 мл СМЖ (30 мл в желудочках, 110 мл в подпаутинном пространстве) [2] и 280 мл в ИСЖ [2], которая образуется как путем прохождения жидкостей через гематоэнцефалический барьер (ГЭБ) в периваскулярные пространства (ПВП) и частичного проникновения туда СМЖ, так и за счет метаболизма нервных клеток [3, 4], что, однако, составляет всего 10% от общего объема ИСЖ (~28 нл г–1 мин–1) [4] (рис. 1а и 1b). Таким образом, для мозга, который находится в лимитированном костном пространстве, накопление жидкостей внутри черепа является критичным и дренаж его тканей лежит в основе сохранения гомеостаза ЦНС.
Рис. 1.
Образование и циркуляция спинномозговой (СМЖ на рис. CSF) и интерстициальной (ИСЖ) жидкостей в тканях мозга человека: (а) – образование СМЖ в системе желудочков мозга со скоростью 350 мкл/мин и распределение СМЖ в подпаутинном пространстве головного и спинного мозга, а также частично в периваскулярные пространства (ПСП); (b) – модели образования ИСЖ в тканях мозга, где (I) отражает образование ИСЖ за счет метаболизма тканей мозга, что составляет 10% от общего объема ИСЖ (280 мл), (II) отражает образование ИСЖ за счет движения жидкостей через ГЭБ и (III) за счет стекания СМЖ из подпаутинного пространства в ПВП. Стрелками показано движение жидкостей через ГЭБ в ПВС с последующей диффузией вдоль пограничных “пустых” зон с глией и астроцитами, так называемых “специальных маршрутов” с наименьшим гидростатическим сопротивлением [3]; (c) – схематичное изображение решетчатой кости и дренажа СМЖ по лимфатическим сосудам тремя механизмами: 1) лимфососуды плотно прилегают к обонятельным нервам, образуя лимфатический “воротник” и непосредственно контактируют с подпаутинным и субдуральным пространствами, тем самым имея прямую связь с СМЖ; 2) второй сценарий повторяет первый, но отличается тем, что сеть лимфососудов не плотно прилегает к обонятельным нервам и СМЖ может стекать в пространства решетчатой кости, откуда она поступает в лимфососуды путем простой диффузии; 3) третий сценарий предполагает, что лимфососуды не связаны непосредственно с решетчатой костью и оболочками мозга, они располагаются в обонятельном эндотелии, где осуществляют дренаж пассивно стекающей СМЖ; (d) – альтернативные пути дренажа тканей ЦНС через периневральные пространства: I – обонятельного; II – зрительного; V – тройничного; VIII – преддверно-улиткового нервов.
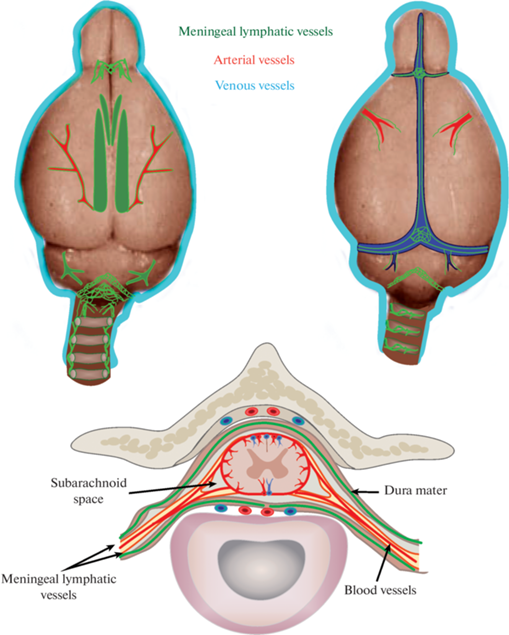
Дренаж тканей мозга осуществляется двумя механизмами, лимфатическими и венозными. Научная концепция лимфатического дренажа была заложена более чем 100 лет назад. Первая работа в этой области была опубликована в 1869 г. Schwalbe, который ввел краситель Berlin Blue в подпаутинное пространство собак и наблюдал его лимфатическое выведение, минуя венозный путь [5]. Позже в 1872 г. Quincke создал концепцию о лимфатическом выведении СМЖ через пути выхода черепно-мозговых нервов [6], что через 3 года было подтверждено в работе Key и Retzius [7] (рис. 1 d). В 1966 г. Földi впервые в экспериментах на собаках описал менингеальные лимфатические сосуды (МЛС) на фоне блокады лимфатического оттока СМЖ в глубокие шейные лимфатические узлы [8]. В 1951 г. Simmonds исследовал лимфатическое выведение радиоактивного альбумина из подпаутинного пространства овец и показал, что около 30% его абсорбируется в глубоких шейных лимфоузлах [9, 10]. При совершенствовании методов количественного анализа содержания радиоактивного трейсера в тканях было доказано, что 50% радиоактивного альбумина выводится по лимфатическому пути [11]. При повышении давления в жидкостях мозга, доля выведения СМЖ по лимфатическому пути существенно возрастает [12–16].
Впоследствии в этом направлении было выполнено множество подобных работ, доказывающих вовлечение периферической лимфатической системы в процессы дренажа тканей головного мозга мышей, крыс, кроликов, морских свинок, овец, собак, макак и человека.
В отношении человека также существуют клинические результаты, указывающие на лимфатические пути дренажа СМЖ. Smith и соавт. [17] показали, что клетки опухолей мозга могут метастазировать в глубокие шейные лимфатические узлы. McComb [18] наблюдал развитие гидроцефалии у детей при обструкции решетчатой кости.
Ключевую роль в лимфатическом выведении СМЖ отводят решетчатой кости [19] (рис. 1). Этот путь дренажа впервые был описан Schwalbe и впоследствии подтвержден во многих других исследованиях [5, 19–21]. Jackson в 1979 г. обнаружил, что блокада лимфатического оттока из ЦНС за счет обструкции носовых ходов способствует ретроградному проникновению вирусов в ткани мозга [20]. Si и соавт. в опытах на крысах выявили, что блокада лимфатического оттока СМЖ сопровождается развитием более тяжелой формы инсульта у крыс с формированием периваскулярного отека и повышением внутричерепного давления [21]. Удаление глубоких шейных лимфоузлов, первой анатомической станции сбора СМЖ, стекающей из ЦНС с растворенными в ней ненужными соединениями, приводит к развитию когнитивного дефицита у мышей [22] и некрозу нейронов у кроликов [23].
Неизвестно, как именно СМЖ выводится из ЦНС на периферию через решетчатую кость. Рисунок 1c схематично отражает гипотезу [19], согласно которой СМЖ может выводиться из решетчатой кости по лимфатическим сосудам тремя механизмами: 1) лимфососуды плотно прилегают к обонятельным нервам, образуя лимфатический “воротник” и непосредственно контактируют с подпаутинным и субдуральным пространствами, тем самым имея прямую связь с СМЖ; 2) второй сценарий повторяет первый, но отличается тем, что сеть лимфососудов не плотно прилегает к обонятельным нервам и СМЖ может стекать в пространства решетчатой кости, откуда она поступает в лимфососуды путем простой диффузии; 3) третий сценарий предполагает, что лимфососуды не связаны непосредственно с решетчатой костью и оболочками мозга, они располагаются в обонятельном эндотелии, где осуществляют дренаж пассивно стекающей СМЖ.
Помимо решетчатой кости, обсуждаются и другие анатомические пути лимфатического вывода СМЖ, включая лимфатические сосуды, идущие вдоль черепно-мозговых нервов [19, 24, 25] (рис. 1d). В некоторых экспериментах сообщается, что такой путь выведения радиоактивных белков из мозга кроликов может составлять 90% [26]. Существуют данные, указывающие на лимфатическое выведение СМЖ через зрительные и слуховой тракты [27].
Пахионовы грануляции представляют собой небольшие (до 300 мкм в диаметре) выпуклые образования паутинной оболочки головного мозга, выпячивающиеся через твердую оболочку. Большая часть грануляций сосредоточена в верхнем сагиттальном синусе, однако они встречаются во всех синусах, связанных с твердой мозговой оболочкой. Через грануляции СМЖ выходит из-под подпаутинного пространства в венозную систему с помощью пиноцитоза [28] и путем пассивной диффузии через 100 мкм каналы между грануляциями паутинной оболочки [29]. На разных видах животных установлено, что в условиях нормы вклад лимфатических и венозных процессов дренажа в ЦНС примерно равен [11]. Однако существуют основания полагать, что в силу анатомической и функциональной недоразвитости Пахионовых грануляций у новорожденных, для них лимфатические процессы дренажа могут быть основными [30, 31].
Более детально с результатами различных международных научных групп, освещающих механизмы дренажа тканей головного и спинного мозга, можно познакомиться в следующих ключевых обзорах [20, 32–39].
ЧАСТЬ 2. ГЛИМФАТИЧЕСКАЯ ГИПОТЕЗА: БОЛЬШЕ ВОПРОСОВ, ЧЕМ ОТВЕТОВ
Вплоть до сегодняшнего дня базовый пласт знаний о лимфатических процессах дренажа тканей мозга был построен на тех фактах, что в экспериментах вводили различные соединения в ткани мозга или непосредственно в СМЖ и наблюдали их выведение/накопление в лимфатических узлах шеи (см. часть 1). С переоткрытием МЛС стали появляться сведения об их вовлеченности в выведение исследуемых трейсеров (красителей [40], бета-амилоида [41], клеток глиобластомы и меланомы [42], эритроцитов [43, 44]) из тканей мозга грызунов и человека в периферическую лимфатическую систему. Однако оставалось неясным, как жидкости, метаболиты и ненужные соединения из паренхимы мозга достигают путей, лимфатических или венозных, для их выведения на периферию.
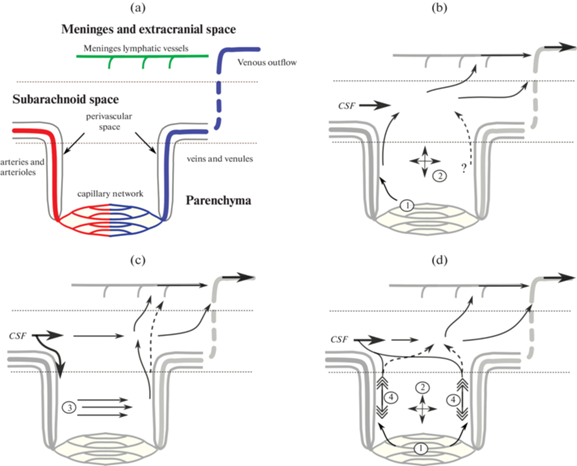
Десять лет назад была предложена “глимфатическая” (по аналогии со словом “лимфатическая”) гипотеза, предлагающая определенные механизмы и сценарий движения жидкостей мозга в ходе его самоочищения [45, 46]. Данная научная концепция построена на данных двухфотонной микроскопии о том, что введение красителей в большую цистерну сопровождается их диффузией вдоль ПВП проникающих мозговых артерий с последующим появлением вдоль мозговых вен. На основе данных результатов была построена гипотеза, объясняющая движение красителей, а в последующем и бета-амилоида, через глию, которой отдали функцию лимфатической системы, отсюда название глимфатическая система. Согласно данной гипотезе движение жидкостей мозга и растворенных в них молекул осуществляется от ПВП артерий к венам через ткани паренхимы [45, 46]. Отметим, что глимфатическая гипотеза построена сугубо на результатах поверхностных изображений, полученных методом двухфотонной микроскопии (глубина не более 300 мкм). При этом движение молекул через ткани мозга, а также четкой идентификации их перемещения вдоль мозговых вен не было. Hladky обсуждает, что в мире вообще никто не видел движение молекул от артерий к венам в паренхиме мозга [38]. Возникло множество фундаментальных работ, вскрывающих физиологические ошибки и даже несостоятельность глимфатической гипотезы [32, 38, 36, 47 ]. Ниже мы обсуждаем мировую тенденцию в современной интерпретации данной гипотезы, включая российские работы [48, 49]. Эволюция представлений о путях движения мозговых жидкостей проиллюстрирована на рис. 2.
Рис. 2.
Эволюция представлений о путях движения мозговых жидкостей (CSF): (a) – строение рассматриваемой области (схематично); (b) – “классическая” гипотеза Cserr and Bradbury [50]; (c) – глимфатическая гипотеза; (d) – современные представления по Hladky and Barrand [38]. Цифрами обозначены: 1 – приток жидкости через ГЭБ, 2 – диффузия веществ в межклеточной жидкости паренхимы с переносом по градиенту их концентраций, 3 – перенос веществ в паренхиме направленным потоком межклеточной жидкости, 4 – пульсирующий и меняющий свое направление поток жидкости в периваскулярных пространствах.
Глимфатическая гипотеза появилась не на пустом месте. К 2012 г. имелось согласованное мнение специалистов о том, что в особых условиях жидкости головного мозга могут проникать вглубь паренхимы [51, 52], а также потом попадать в кровь [53]. Однако все эти данные были получены ex vivo и не было ясности, возможно ли это в условиях нормального функционирования организма.
В частности, было показано, что при неблагоприятных условиях имеет место течение жидкости из паренхимы мозга через “предпочтительные маршруты”, которыми служат ПВП вдоль глии и астроцитов (см. рис. 1b) и субэпендимальные пространства [1, 18, 54, 55].
Движущей силой этого движения считалось небольшое гидростатическое давление, создаваемое секрецией жидкости через ГЭБ [12–16, 54] или движениями стенок артерий [56]. Rennels и соавт. после инъекции пероксидазы хрена в боковые желудочки кошки наблюдали появление трейсера в коре больших полушарий через 6 мин, что приблизительно равно времени, необходимому для движения СМЖ из желудочков в подпаутинное пространство [57]. Это означает, что проникновение трейсера из подпаутинного пространства в паренхиму происходит практически мгновенно!
Таким образом, было известно, что движение жидкостей и приносимых ими веществ в паренхиму мозга в определенных ситуациях может происходить быстро. Однако не было ясно, как это может обеспечить дренаж тканей.
Авторы глимфатической гипотезы представили новые экспериментальные данные и на их основе предложили понятную и, как казалось вначале, непротиворечивую картину.
Их эксперименты in vivo [45, 58–60] показали, что:
– при введении декстранов с малой (3 кДа) и высокой (2000 кДа) молекулярной массой в большую цистерну мышей было выявлено, что проникновение декстрана 2000 кДа было ограничено ПВП проникающих артерий, в то время как декстран 3 кДа проникал непосредственно в паренхиму мозга. При этом флуоресценция декстрана 3 кДа обнаруживалась сначала в периваскулярных пространствах (ПВС) проникающих артерий и затем в ПВС крупных мозговых вен [45];
– в МРТ-исследовании был доказан периартериальный путь распространения контрастных веществ (GdDTPA, 1 кДа и гадоспин, 200 кДа) из большой цистерны в паренхиму мозга мышей [59];
– блокада аквапориновых каналов (AQP4) снижала распространение изучаемых маркеров по ПВП [45].
На основе этих новых данных была предложена объясняющая их глимфатическая гипотеза, согласно которой СМЖ попадает в ткани мозга через ПВП артериальных сосудов за счет их пульсаций, наподобие перистальтического насоса. Созданный этим насосом градиент давления продавливает СМЖ сквозь клеточные структуры паренхимы в направлении венул. Далее СМЖ движется через перивенозное пространство в направлении крупных вен и лимфатических сосудов оболочек мозга.
Предложенная в глимфатической теории [45] совокупность путей и механизмов дренажа тканей мозга образовали цельную картину, однако не все ее элементы имели на тот момент надежное экспериментальное подтверждение. В первые годы существования глимфатической гипотезы ожидалось, что вот-вот будут доказаны все ее существенные компоненты. Однако этого не произошло. С одной стороны, появились критические публикации по работоспособности предложенных физических механизмов [32, 36, 38, 47, 54]. С другой стороны, новые экспериментальные оценки характера движения жидкости в паренхиме оказались противоречивыми и только усилили сомнения.
В недавнем обзоре [38] проведен анализ текущей ситуации и сформулирован список проблемных пунктов. В частности, до сих пор не подтверждено, что отток жидкости из паренхимы мозга происходит через ПВС мозговых вен. Также оценки градиента давления, который способен создать артериальные пульсации, показывают, что он явно недостаточен для обеспечения направленного тока жидкости сквозь паренхиму. Неясной остается и роль водных каналов AQP4 на астроцитарных ножках, выстилающих периартериальные и перивенозные пути. Ниже кратко обсуждаются как подтвержденные, так и наиболее проблемные элементы глимфатической гипотезы с точки зрения их доказанности и реализуемости.
Периваскулярные пространства служат “каналами” для направленного тока СМЖ
Этот компонент глимфатической гипотезы на данный момент надежно подтвержден результатами экспериментов с микросферами, добавленными в цистерну магна.
В работе [61] показано, что микросферы перемещаются преимущественно в ПВП церебральных артерий, но не в ПВП церебральных вен. Периваскулярный поток был пульсирующим и в среднем – антеградным, т.е. однонаправленным. В работах [62, 63] также приведены видеозаписи потоков, из которых однозначно видно наличие пульсирующего и направленного движения микрочастиц, что интерпретируется авторами как доказательство наличия тока жидкости, переносящего растворенные в них соединения. Ранее аналогичные результаты были получены с использованием других маркеров, таких как тушь [27], контрастные вещества на основе гадолиния [64, 65] и флуоресцентные молекулы [45, 51]. Следует, однако, помнить, что эти результаты относятся к сосудам оболочек мозга и не доказывают, что такой же направленный ток имеется в его паренхиме. В частности, в работе [61] выдвинуто предположение, что направленный ток в ПВП оболочек имеет выход вовсе не в паренхиму, а в места выхода СМЖ из мозга, например, к решетчатой кости.
Артериальные пульсации как механизм продвижения жидкостей мозга
Iliff и соавт. в своей работе [60] показали, что наличие артериальных пульсаций ускоряет распространение флуоресцентного маркера и на этой основе предположили, что они играют роль перистальтического насоса, накачивающего СМЖ из подпаутинного пространства вглубь паренхимы мозга. Такое представление позднее подверглось критике в работах других исследователей [54, 66, 67], так как расчеты показывают, что такой механизм не способен обеспечить нужного градиента давления. Нельзя отрицать, однако, что мозговые пульсации вовлечены во все обсуждаемые процессы и играют важную, хотя и не до конца понятную роль. Например, в работе [68] сообщалось, что поток СМЖ в Сильвиевом водопроводе может менять направление за сердечный цикл. В работе [69] изучались пульсации на микроуровне, где показано отставание по фазе в одиночной пульсовой волне в венозном сосуде по отношению к артериальному. В работе [70] методом спекл-флоуметрии построена карта относительных мощностей пульсаций в артериях, венах и паренхиме мозга мыши. В отличие от предыдущей работы не было обнаружено значительного фазового сдвига от артерий к венам. Кроме того, было показано, что пульсации в паренхиме мозга пространственно однородны. Этот результат в очередной раз заставляет критически отнестись к глимфатической гипотезе в части пульсаций как насоса.
Дыхательный ритм фиксируется по всему телу, причем его мощность сильно уступает мощности сердечного ритма. Однако для мозга ситуация иная. Так, в работе [71] показано, что спектральная мощность дыхательного ритма в сигнале сверхбыстрого МРТ не уступает мощности сердечных пульсаций. В работе [72] дана оценка вкладу сердечного и дыхательного ритмов в движение жидкостей мозга. Показано, что сердечный ритм создает градиент давления в Сильвиевом водопроводе, почти в 3 раза превышающий эффект дыхательного ритма, однако вызванный этим поток СМЖ слабее, чем вызванный дыхательным ритмом. Этот эффект можно объяснить на основе инерции, благодаря которой движение жидкости гораздо более чувствительно к медленным изменениям градиента давления. Иными словами, чем медленнее ритм, тем более слабая его амплитуда может вызывать измеримые пульсации потока СМЖ. Этот вывод был недавно подтвержден в работе [73], согласно которой дыхательный по сравнению с ультрамедленным сердечным ритмом оказывает эффекты примерно в 3 раза меньше на интенсивность потока СМЖ.
В работе [38] приводится четыре основных аргумента в пользу того, что транспорт веществ в паренхиму мозга не может быть обусловлен избыточным давлением, созданным пульсациями:
1) имеет место не только приток в ПВП, но и отток растворенных веществ;
2) высокомолекулярные соединения способны проникать в ПВП церебральных артерий, но не могут проникать в паренхиму мозга. Это означает, что, если существует только однонаправленный поток в ПВП, эти соединения бы накапливались там, не имея выхода. Brierley [74] наблюдал движение крупных частиц туши из субарахноидального пространства в течение как минимум 24 ч и не нашел такого накопления. Таким образом, транспорт растворенных веществ в ПВП имеет двунаправленный характер;
3) сообщалось, что отсутствие AQP4 способно примерно вдвое сократить перенос растворенных веществ из большой цистерны к паренхиме мозга [45]. В глимфатической гипотезе это сокращение транспорта интерпретируется как вызванное уменьшением скорости притока СМЖ в ПВП мозговых артерий. Однако в том же исследовании скорость переноса больших молекул в ПВП церебральных артерий существенно не снижается. Это означает, что либо отсутствие AQP4 не изменяет поток СМЖ в ПВП, как показано в работе Smith [75], либо направленный поток не является основным механизмом движения растворенных веществ внутри ПВП;
4) имеются теоретические работы, где изучалось, может ли малое изменение диаметра проникающих артерий обеспечить направленный периартериальный поток жидкостей в мозге, достаточный для переноса веществ. В то время как ранние оценки дали положительный ответ [76], последующие исследования в целом пришли к противоположному выводу [66, 67]. В работе [77] утверждается, что пульсация артерий может быть движущей силой продвижения жидкостей в ПВП только в случае нереалистичного большого их размера, что, однако, возможно исключительно при патологии. Результаты ряда теоретических работ по этому вопросу [78–80] не дают согласованной картины. Валидацию различных модельных подходов сдерживает скудость экспериментальных данных по размерам ПВП и о том, как они изменяются при различных физиологических состояниях.
Альтернативные пути переноса веществ с потоком жидкостей мозга
Bradbury и соавт. [50] предположили, что расширение проникающих артерий во время систолы способно выталкивать из паренхимы мозга содержимое ПВП проникающих артериол. На сегодня наиболее непротиворечивым и вероятным представляется механизм, в рамках которого пульсации любой природы способствуют перемешиванию жидкости и, таким образом, существенно ускоряют транспорт веществ посредством диффузии. Такой взгляд предложен, обоснован и подкреплен расчетами во многих работах [32, 54, 67, 81]. Однако в других исследованиях [82, 83] утверждается, что такой механизм даст слишком малый поток растворенного вещества.
Еще одна альтернатива заключается в предположении, что пути притока и оттока растворенных веществ в ПВП различны, в частности, отток происходит через интрамуральные пространства (внутри сосудистой стенки) [39]. Однако в теоретическом исследовании [66] пришли к выводу, что артериальная пульсация не способна поддержать такой отток. В целом, механизм доставки веществ от оболочек мозга в его паренхиму окончательно не ясен и требует дальнейших исследований.
Роль аквапоринов в дренаже тканей мозга
Аквапорины (AQP4) – это белки, образующие проницаемые для воды поры на ножках астроцитов, выстилающих ПВП. Экспериментально было установлено, что у линии мышей с отсутствующими AQP4 движение флуоресцентных красителей в паренхиму мозга из цистерны магна существенно затруднено. В работе [45] на этом основании сделан вывод, что AQP4 обеспечивают прохождение существенной части жидкости по тканям мозга и, таким образом, являются частью дренажного пути. Это утверждение подверглось критике по целому ряду причин. Во-первых, имеющиеся просветы между конечными отростками астроцитов сами по себе достаточны, чтобы обеспечить протекание основной части жидкости [84]. Во-вторых, пропуск воды AQP4 привел бы к накоплению переносимых веществ в ПВП и, таким образом, замедлил бы их транспорт, вместо того, чтобы ускорить [47], тогда как в экспериментах наблюдается противоположный эффект [45, 85]. Имеется существенное противоречие между экспериментальными результатами различных научных групп, часть из которых [75, 86, 87] отрицает эффект AQP4 в дренаже тканей мозга, в то время как другие этот факт подтверждают [45, 85].
Весьма вероятно, что экспериментально установленная связь между отсутствием AQP4 и замедлением дренажа паренхимы мозга имеет более сложную природу и вклад AQP4 в эти процессы остается недостаточно ясным.
По вопросу направленного тока жидкости сквозь паренхиму мозга прежде всего отметим, что на момент написания данного обзора не имеется экспериментальных доказательств его наличия в нормальных физиологических условиях [86].
Теоретические оценки показывают, что гидродинамическое сопротивление паренхимы мозга настолько велико, что потоки, создаваемые достижимыми перепадами гидростатического давления, будут незначительны по сравнению с эффектом диффузии [86, 87]. В целом ряде работ [54, 67, 86–88] поддерживается тезис о том, что диффузия является основным и достаточным механизмом доставки веществ в паренхиме.
Перивенозные пространства как основной путь оттока жидкости из паренхимы
Как утверждается авторами глимфатической гипотезы [45], основным путем выведения ненужных метаболитов из паренхимы мозга является их перенос потоком жидкости из ПВП мозговых артерий в ПВП мозговых вен. Однако нет экспериментальных свидетельств того, что перед этим маркеры прошли через ткани паренхимы мозга [38]. Имеется относительно немного работ, где оценивается возможность переноса веществ именно по перивенозным пространствам мозга [55, 59, 89]. Если принять как основную гипотезу возможность двунаправленного потока веществ по ПВП, то однозначный вывод о роли перивенозных пространств как основного пути оттока жидкости из мозга сделать затруднительно.
В качестве итога данной части обзора приведем перевод фрагмента работы [38], которая, на взгляд авторов данного обзора, хорошо отражает текущее состояние вопроса:
“Глимфатическая гипотеза не может адекватно объяснить, каким образом осуществляются дренаж и очищение тканей мозга от ненужных соединений. Однако следует отметить, что научная дискуссия вокруг глимфатической гипотезы несомненно способствовала накоплению знаний и лучшему пониманию процессов транспорта веществ в паренхиме мозга”.
ЧАСТЬ 3. ЦЕРЕБРАЛЬНЫЕ ЛИМФАТИЧЕСКИЕ СОСУДЫ: НЕДОСТАЮЩИЙ ПАЗЛ В НАУЧНОЙ КАРТИНЕ ДРЕНАЖА ТКАНЕЙ МОЗГА
Предположение существования лимфатических сосудов в тканях ЦНС возникло во многих работах как поиск недостающего пазла в общей научной картине дренажа и очищения тканей мозга от ненужных соединений. Oberstainer и Bruce и Dawson впервые высказали гипотезу о существовании лимфатических путей для дренажа, а также трафика иммунных клеток в ЦНС [90, 91]. Согласно данной гипотезе лимфатические пути находятся в ПВП паренхимы мозга и соединяются с подпаутинным пространством. В 1979 г. Prineas обнаружил лимфатические капилляры в ПВП спинного мозга 5 пациентов, умерших от различных заболеваний мозга [92]. Используя электронную микроскопию, он описал лимфоидные структуры, подобные по своему строению периферическим лимфатическим капиллярам и содержащие иммунные клетки. Однако поскольку результаты были получены без применения специфических антител к лимфатическому эндотелию, они не получили широкого признания. Prineas осторожно сделал выводы о том, что по его данным пока еще рано говорить существовании лимфатических сосудов в ЦНС, но, тем не менее, эти результаты свидетельствуют о том, что их дальнейшие поиски небезнадежны и нуждаются в детальном изучении.
Существует немало работ, где обнаружены лимфоидные структуры, образующиеся в мозге в виде третичных лимфоидных органов во время его воспаления [93, 94]. Эти органы представляют собой белковые образования из специфических для лимфатического эндотелия белков. Однако для третичных лимфоидных органов характерно наличие лимфатических сосудов, что не было описано ни в одной из указанных работ. Лимфатические элементы, но не сосуды, описаны также недавно в здоровом мозге человека [95].
Weller и соавт. построили гипотезу о существовании специальных структур вдоль базальной мембраны артерий, которые обеспечивают направленный поток ИСЖ, а также растворенных в ней соединений, в том числе бета-амилоида [39]. Позже Morris и соавт. подтвердили экспериментально идею вывода из тканей мозга бета-амилоида по структурам вдоль базальной мембраны [96]. Ма показал, что 80% ИСЖ поступает в лимфатическую систему [25]. Приводятся факты о разнонаправленных и независимых потоках для СМЖ и ИСЖ [39]. Существуют экспериментальные данные, свидетельствующие о том, что крупные молекулы и клетки выводятся из мозга в периферическую лимфатическую систему очень быстро, минуя решетчатую кость или венозную систему [38, 39], это возможно только при наличии специальных структур, которые могли бы обеспечить такой быстрый целенаправленный поток. Еще в 1998 г. в своем обзоре Chikly высказывал предположения на основе экспериментальных и клинических наблюдений о существовании лимфо-подобных структур в мозге человека, по которым должны выводиться белки, крупные молекулы и кровь в случае развития внутричерепных кровоизлияний, а также которые должны обеспечить быструю коммуникацию иммунных клеток в ПВС [97].
Таким образом, гипотеза “необходимости” присутствия лимфатических сосудов в тканях мозга возникла на основе целого ряда фактов, свидетельствующих о целенаправленных потоках жидкостей в тканях мозга, которые обеспечивают как его дренаж, так и очищение от ненужных молекул и клеток.
ЧАСТЬ 4. СОЗРЕВАНИЕ ДРЕНАЖНОЙ СИСТЕМЫ МОЗГА В ОНТОГЕНЕЗЕ
Рассмотрим созревание лимфатической системы в оболочках мозга и на периферии на примере мышей как наиболее изученном объекте. Периферическая лимфатическая система у мышей закладывается еще в эмбриогенезе, начиная с 9-го дня развития, когда группа клеток эндотелия кардинальных вен приобретает способность экспрессировать белок, являющийся гомеобоксным транскрипционным фактором, который участвует в развитии лимфатической системы (PROX-1 - prospero homeobox protein 1) [98, 99]. После 10-го дня эмбриогенеза васкулярный эндотелиальный фактор роста С (the vascular endothelial grow factor, VEGF-C) паракринным путем активирует прорастание лимфатических сосудов за счет влияния на рецептор III типа фактора роста эндотелия сосудов (VEGFR3), формируя лимфатические сплетения по всему организму [100, 101]. В онтотогенезе прорастание лимфатических сосудов в ткани происходит из лимфатического эндотелия и называется лимфангиогенез. Физиология лимфатической системы образована тремя типами сосудов, включающими лимфатические капилляры, преколлекторы и коллекторы (рис. 3).
Рис. 3.
Структурная организация лимфатических сосудов, включающих капилляры (а), преколлекторы (b) и коллекторы (c) с клапанами с указанием экспрессии маркеров лимфатического эндотелия в зависимости от типа лимфососудов. Рисунок адаптирован с [102], подробное описание маркеров лимфатического эндотелия представлено в [32]: LYVE-1 – Lymphatic vessel endothelial hyaluronan receptor 1 (эндотелиальный рецептор гиалуронана 1 лимфатического сосуда. Функциональная роль LYVE-1 до сих пор является предметом споров, но есть свидетельства того, что LYVE-1 играет важную роль в транспорте гиалуроновой кислоты и миграции CD44+ лейкоцитов и опухолевых клеток по лимфатической системе); PROX-1 – Prospero homeobox protein 1 (белок, являющийся гомеобоксным транскрипционным фактором, который участвует в развитии лимфатической системы); CCL21-Chemokine (C-C motif ligand 21) – хемокин ССL-21 (экспрессируется в лимфатическом эндотелии и участвует в активации движения Т-лимфоцитов, миграции лимфоцитов в другие органы и дендритных клеток в лимфатические узлы), VEGFR3–Vascular endothelial growth factor receptor 3 (васкулярный эндотелиальный фактор роста 3, рецептор, запускающий лимфангиогенез, т.е. образование новых лимфатических сосудов); интегрин альфа-9 и FoxC2 – Forkhead box c2 (белки, экспрессирующиеся в клапанах лимфатических сосудов ); подопланин – интегральный мембранный белок, отвечающий за нормальное развитие сети лимфатических сосудов, обеспечивающих отток межклеточной жидкости. Если нарушается его синтез, формируется лимфедема.
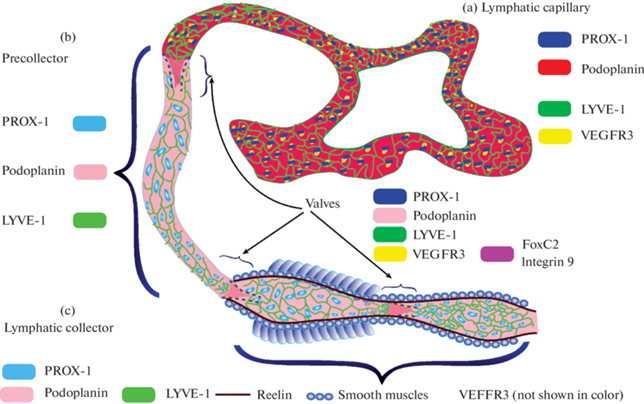
Лимфатические капилляры не имеют базальной мембраны и организованы по типу дубового листа за счет особого неплотного соединения белков плотных контактов, что обеспечивает высокую проницаемость лимфатического эндотелия и дренажную функцию лимфатической системы (рис. 3а). Вода входит в лимфатические капилляры за счет градиента давления, в то время как клетки и крупные молекулы (метаболиты, ненужные соединения) делают это через активное взаимодействие с регуляторными белками на лимфатическом эндотелии [103]. Преколлекторы и коллекторы имеют клапаны и выполняют направляющую роль в движении лимфы из тканей в венозную систему (рис. 3b и 3c). В коллекторах появляется гладкомышечный слой, обеспечивающий спонтанные сокращения этой части лимфососудов. Наиболее изученным механизмом, лежащим в основе сокращения лимфатических коллекторов и движения клапанов на “открытие–закрытие”, является пристеночный стресс за счет растяжения стенок лимфатических сосудов путем поступления жидкостей в их просвет с образованием оксида азота как фактора вазодилатации. При достижении критического уровня растяжения эндотелиальных клеток оксид азота через циклический гуанозинмонофосфат и образование протеинкиназы G запускает открытие Са2+-зависимых каналов, что стимулирует процесс сокращения лимфососудов [104, 105]. Существуют другие механизмы, с помощью которых оксид азота может контролировать лимфатический тонус и сократимость: 1) активация железо-регуляторных белков в макрофагах [106] и в тканях, таких как рибонуклеотидредуктаза [107] и аконитаза [108]; 2) стимуляция АДФ-рибозилирования глицеральдегид-3-фосфатдегидрогеназы [109] и нитрозилирования протеин-сульфгидрильной группы [110]; гемоглобин как побочный продукт распада крови может стимулировать образование оксида азота [111].
Менингеальная лимфатическая система мышей, как и периферическая лимфатическая система, начинает закладываться еще в эмбриогенезе и продолжает созревать до 28-го дня онтогенеза. Antila и соавт. представили первую основательную работу в этом направлении [98]. Рисунок 4 схематично отражает созревание менингеальной лимфатической системы и направление роста лимфатических сосудов.
Рис. 4.
Постнатальное созревание менингеальной лимфатической системы мышей: P – период онтогенеза, цифрами обозначены дни развития. Менингеальные лимфососуды обозначены зеленым цветом, артериальные и венозные сосуды – красным и синим цветами соответственно. Стрелками указано направление роста лимфососудов. Рисунок адаптирован с [98].
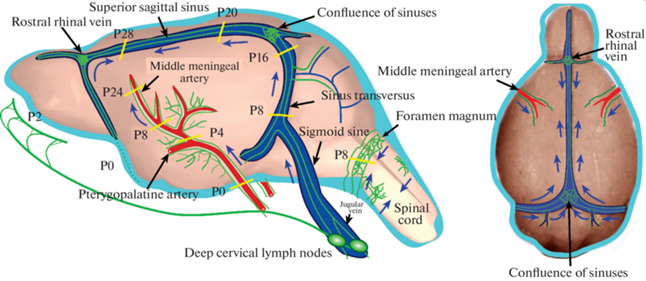
В этой работе показано, что МЛС закладываются с первого дня эмбриогенеза вокруг крыловидно-небной артерии и большого затылочного отверстия. Однако к моменту рождения лимфатическая система остается недоразвитой. К 2-му дню постнатального развития лимфатические сосуды обильно прорастают к решетчатой кости. С 4-го и по 24-й день онтогенеза лимфатические сосуды появляются вдоль средней менингеальной артерии, формируя клапаны. К 28-му дню лимфатическая сеть прорастает к главным венозным синусам в двух направлениях, от яремной вены и центральной вены сетчатки по направлению к верхнему сагиттальному синусу, захватывая районы поперечного (8-й день) и сигмовидного (16-й день) синусов. В этот же период часть лимфососудов от поперечного синуса прорастают в оболочки мозжечка.
По физиологической организации МЛС до сих пор не существует единого мнения. В первых работах из группы Kipnis и соавт. было показано, что МЛС являются примитивными в виде лимфатических капилляров без базальной мембраны и клапанов [40]. Позже в работе Ahn [112] было предложено выделять два типа МЛС: базальные, включающие лимфокапилляры и преколлекторы в области основания черепа, которые имеют клапаны и выполняют непосредственно дренажную функцию, и дорзальные, имеющие меньшие размеры, локализующиеся вдоль верхнего сагиттального синуса и играющие роль только в выведении лимфы на периферию.
Лимфатическая система также представлена в оболочках спинного мозга, где она начинает развиваться с 4-го дня после рождения вдоль выходов черепно-мозговых нервов, прорастая до большой цистерны к 16-му дню онтогенеза [98] (рис. 5).
Одним из широко применяемых объектов изучения развития МЛС стала рыбка Данио в силу ее быстрого развития и привлекательности с позиции оптического прижизненного мониторинга флуоресцентных лимфососудов [113].
В отношении человека пока не существует сведений об эмбриональном формировании и последующем развитии МЛС. Однако приводятся данные, где обсуждается, что венозный компонент дренажа тканей мозга в виде Пахионовых грануляций является неразвитым в первые дни после рождения и, возможно, в это время лимфатическая система выполняет основную функцию по выведению СМЖ из ЦНС [30, 32]. В двух исследованиях на 18-недельных человеческих эмбрионах [114] и 56-дневном ребенке [115] не было обнаружено Пахионовых грануляций. К моменту рождения они только начинают формироваться, но остаются недоразвитыми на протяжении нескольких месяцев [30, 116].
ЗАКЛЮЧЕНИЕ
Признание научной общественностью присутствия лимфатических сосудов в оболочках мозга открыло новые научные и многообещающие направления в нейробиологии как по изучению функций МЛС, так и методов управления лимфодренажными и лимфовыводящими процессами [38–44, 118–128]. Пересмотрены традиционные научные концепции, объясняющие механизмы дренажа и освобождения тканей мозга от метаболитов и ненужных соединений [38, 41–44, 118–123]. Лимфатическая система дренажа тканей мозга может явиться единственным путем вывода жидкостей и токсинов из тканей мозга новорожденных детей, у которых венозный компонент остается недоразвитым в течение нескольких месяцев после рождения [30, 31]. Интригующим направлением является дальнейший поиск лимфососудов непосредственно в тканях мозга человека и животных с целью восстановления цельной картины выведения жидкостей, метаболитов и токсинов из ЦНС, а также взаимодействия церебральной, менингеальной и периферической лимфатической систем [92, 117]. Перспективным вектором новых научных исследований является развитие методов стимуляции функций МЛС и управления лимфодренажными и лимфовыводящими процессами мозга для повышения его регенеративных свойств [118, 129–131]. Дальнейшее изучение лимфатической системы как “окна” в ЦНС может явиться инновационным шагом в развитии новых методов доставки лекарственных препаратов в мозг, минуя ГЭБ [129, 130]. Важным шагом является развитие новых образовательных программ, освещающих революционные шаги в нейробиологии по изучению лимфатической системы мозга [132].
Список литературы
Davson D, Welch K, Segal MB (1987) Physiology and Pathophysiology of the Cerebrospinal Fluid. Churchill Livingstone. Edinburgh.
Bergsteiner M (2001) Evolving concepts of cerebrospinal fluid. Neurosurg Clin N Am 36: 631–638.
Abbott NJ (2004) Evidence for bulk flow of brain interstitial fluid: significance for physiology and pathology. Neurochem Int 45: 545–552. https://doi.org/10.1016/j.neuint.2003.11.006
Rapoport S (1976) Blood–brain Barrier in Physiology and Medicine. Raven Press. New York.
Schwalbe G (1869) Der Arachnoidalraum ein Lymphraum und sein Zusammenhang mit dem Perichorioidalraum. Zentralbl Med Wiss 7: 465–467.
Quincke H (1872) Zur physiologie der cerebrospinal flussigkeit. Arch Anat Physiol. Leipzig.
Key A, Retzius G (1875) Studien In DerAnatomie Des Nervensystems Und Des Bindegewebes I and II. Stockholm. Samson & Wallin 1.
Foldi M, Gellert A, Kozma M, Poberai M, Zoltan OT, Csanda E (1966) New contributions to the anatomical connections of the brain and the lymphatic system. Acta Anat (Basel) 64: 498–505.
Courtice FC, Simmonds WJ (1951) The removal of protein from the subarachnoid space. Aust J Exp Biol Med Sci 29: 255–263. https://doi.org/10.1038/icb.1951.30
Simmonds WJ (1953) The Absorption of Labeled Erythrocytes from the Subarachnoid Space in Rabbits. Autral J Exp Biol Med Sci 31: 77. https://doi.org/10.1038/icb.1953.10
Brinker T, Baer M, Foldi M (1994) Manual Lymphatic Drainage of the Head and the Neck for Treatment of Increase Intracranial Pressure. Progress In Lymphol XIV, Witte MN, Witte CL (eds). Lymphology 27 (Suppl): 614–617.
Caversaccio M, Peschel O, Arnold W (1996) The Drainage of the Cerebrospinal Fluid into the Lymphatic System Neck in Humans:' ORL 58: 164–166. https://doi.org/10.1159/000276818
McComb GJ, Hyman S, Weiss MH (1984) Lymphatic drainage of cerebrospinal fluid in the cat. In: Hydrocephalus, New York. Raven Press. 83–97.
Hasuo M, Asano Y, Teraoka M, Ikeyama A, Kageyama N (1981) Cerebrospinal fluid absorption into lymphatic system in condition of increased intracranial pressure. No To Shinkei 33: 673–678.
McComb JG, Davson H, Hyman S, Weiss MH (1982) Cerebrospinal fluid drainage as influenced by ventricular pressure in the rabbit. J Neurosurg 56: 790–797. https://doi.org/10.3171/jns.1982.56.6.0790
Naruse I, Ueta E (2002) Hydrocephalus manifestation in the genetic polydactyly/ arhinencephaly mouse (Pdn/Pdn). Congenit Anom (Kyoto) 42: 27–31. https://doi.org/10.1111/j.1741-4520.2002.tb00851.x
Smith DR, Hardman JM, Earle KM (1969) Metastasizing Neuroectodermal Tumors of the Central Nervous System. Neurosurgery 31: 50–58.
McComb JG (1983) Recent Research into the Nature of Cerebrospinal Fluid Formation and Absorption. J Neurosurg 59: 369–383. https://doi.org/10.3171/jns.1983.59.3.0369
Koh L, Zakharov A, Johnston M (2005) Integration of the subarachnoid space and lymphatics: Is it time to embrace a new concept of cerebrospinal fluid absorption? Cerebrospin Fluid Res 2: 6. https://doi.org/10.1186/1743-8454-2-6
Jackson RT, Tigges J, Arnold W (1979) Subarachnoid Space of the CNS, Nasal Mucosa and Lymphatic System. Arch Otolaryngol 105: 180–184. https://doi.org/10.1001/archotol.1979.00790160014003
Si J, Chen L, Xia Z (2006) Effects of cervical-lymphatic blockade on brain edema and infarction volume in cerebral ischemic rats. Chin J Physiol 49: 258–265.
Radjavi A, Smirnov I, Derecki N, Kipnis J (2014) Dynamics of the meningeal CD4+ T-cell repertoire are defined by the cervical lymph nodes and facilitate cognitive task performance in mice. Mol Psychiatry 19: 531–532. https://doi.org/10.1038/mp.2013.79
Xing C, Lu X, Wei S, Wang J, Xiang D (1994) The effect of blocking the cervical lymphatic drainage of rabbit on its cerebral structure and function in the acute lymphostasis stage. In: Progress in Lymphology XIV. Int Soc Lymphol. Zurich. Switzerland 742–746.
Lohrberg M, Wilting J (2016) The lymphatic vascular system of the mouse head. Cell Tissue Res 366: 667–677. https://doi.org/10.1007/s00441-016-2493-8
Ma Q, Ineichen BV, Detmar M, Proulx ST (2017) Outflow of cerebrospinal fluid is predominantly through lymphatic vessels and is reduced in aged mice. Nat Commun 8 (1): 1434. https://doi.org/10.1038/s41467-017-01484-6
Cserr HF (1984) Convection of Brain Interstitial Fluid Hydrocephalus. NY. Raven Press.
Kida S, Pantazis A, Weller R (1993) CSF drains directly from the subarachnoid space into lymphatics in the rat brain. Anatomy, histology and immunological significance. Neuropathol Appl Neurobiol 18: 480–488. https://doi.org/10.1111/j.1365-2990.1993.tb00476.x
Butler A (1984) Correlated Physiologic and Structural Studies of CSF Absorption Hydrocephalus. NY. Raven Press.
Brinker T, Ludemann W, Berens von Rautenfeld D, Samii M (1997) Dynamic Properties of Lymphatic Pathways for the Absorption of Cerebrospinal Fluid. Acta Neuropathol 94: 493–498. https://doi.org/10.1007/s004010050738
Johnson M, Papaiconomou C (2002) Cerebrospinal fluid transport: a lymphatic perspective. News Physiol Sci 17: 227–230. https://doi.org/10.1152/nips.01400.2002
Papaiconomou C, Bozanovic-Sosic R, Zakharov A, Johmson M (2002) Does neonatal cerebrospinal fluid occur via arachnoid projections or extrancranial lymphatics? Am J Physiol Integr Comp Physiol 283: R869–R876. https://doi.org/10.1152/ajpregu.00173.2002
Semyachkina-Glushkovskaya O, Postnov D, Kurths J (2018) Blood−Brain Barrier, Lymphatic Clearance, and Recovery: Ariadne’s Thread in Labyrinths of Hypotheses. Int J Mol Sci 19 (12): 3818. https://doi.org/10.3390/ijms19123818
Sokołowski W, Barszcz K, Kupczyńska M, Czubaj N, Skibniewski M, Purzyc H (2018) Lymphatic drainage of cerebrospinal fluid in mammals - are arachnoid granulations the main route of cerebrospinal fluid outflow? Biologia (Bratisl) 73 (6): 563–568. https://doi.org/10.2478/s11756-018-0074-x
Proulx ST (2021) Cerebrospinal fluid outflow: a review of the historical and contemporary evidence for arachnoid villi, perineural routes, and dural lymphatics. Cell Mol Life Sci 78 (6): 2429–2457. https://doi.org/10.1007/s00018-020-03706-5
Bakker ENTP, Naessens DMP, VanBavel EB (2019) Paravascular spaces: entry to or exit from the brain? Exp Physiol 104 (7): 1013–1017. https://doi.org/10.1113/EP087424
Dupont G, Schmidt C, Yilmaz E, Oskouian RJ, Macchi V, de Caro R, Tubbs RS (2019) Our current understanding of the lymphatics of the brain and spinal cord. Clin Anat 32 (1): 117–121. https://doi.org/10.1002/ca.23308
Da Mesquita S, Fu Z, Kipnis J (2018) The Meningeal Lymphatic System: A New Player in Neurophysiology. Neuron 100 (2): 375–388. https://doi.org/10.1016/j.neuron.2018.09.022
Hladky SB, Barrand MA (2022) The glymphatic hypothesis: the theory and the evidence. Fluids Barriers CNS 19: 9. https://doi.org/10.1186/s12987-021-00282-z
Weller RO, Galea I, Carare RO, Minagar A (2010) Pathophysiology of the lymphatic drainage of the central nervous system: Implications for pathogenesis and therapy of multiple sclerosis. Pathophysiology 17: 295–306. https://doi.org/10.1016/j.pathophys.2009.10.007
Louveau A, Smirnov I, Keyes T, Eccles JD, Rouhani SJ, Peske JD, Derecki NC, Castle D, Mandell JW, Lee KS, Harris TH, Kipnis J (2015) Structural and functional features of central nervous system lymphatic vessels. Nature 523: 337–341. https://doi.org/10.1038/nature14432
Da Mesquita S, Louveau, A, Vaccari A, Smirnov I, Cornelison CR, Kingsmore KM, Contarino C, Onengut-Gumuscu S, Farber E, Raper D, Viar KE, Powell RD, Baker W, Dabhi N, Bai R, Cao R, Hu S, Rich SS, Munson JM, Lopes MB, Overall CC, Acton ST, Kipnis J (2018) Functional aspects of meningeal lymphatics in ageing and Alzheimer’s disease. Nature 560: 185–191. https://doi.org/10.1038/s41586-018-0368-8
Hu X, Deng Q, Ma L, Li Q, Chen Y, Liao Y, Zhou F, Zhang C, Shao L, Feng J, He T, Ning W, Kong Y, Huo Y, He A, Liu B, Zhang J, Adams R, He Y, Tang F, Bian X, Luo J (2020) Meningeal lymphatic vessels regulate brain tumor drainage and immunity. Cell Res 30 (3): 229–243. https://doi.org/10.1038/s41422-020-0287-8
Chen J, Wang L, Xu H, Xing L, Zhuang Z, Zheng Y, Li X, Wang C, Chen S, Guo Z, Liang Q, Wang Y (2020) Meningeal lymphatics clear erythrocytes that arise from subarachnoid hemorrhage. Nat Commun 11: 3159. https://doi.org/10.1038/s41467-020-16851-z
Liu X, Gao C, Yuan, J. Xiang T, Gong Z, Luo H, Jiang W, Song Y, Huang J, Quan W, Wang D, Tian Y, Ge X, Lei P, Zhang J, Jiang R (2020) Subdural haematomas drain into the extracranial lymphatic system through the meningeal lymphatic vessels. Acta Neuropathol Commun 8: 16. https://doi.org/10.1186/s40478-020-0888-y
Iliff JJ, Wang M, Liao Y, Plogg BA, Peng W, Gundersen GA, Benveniste H, Vates GE, Deane R, Goldman SA, Nagelhus EA, Nedergaard M (2012) A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β. Sci Transl Med 4 (147): 147ra111. https://doi.org/10.1126/scitranslmed.3003748
Jessen NA, Munk AS, Lundgaard I, Nedergaard M (2015) The Glymphatic System: A Beginner’s Guide. Neurochem Res 40 (12): 2583–2599. https://doi.org/10.1007/s11064-015-1581-6
Smith AJ, Jin BJ, Verkman AS (2015) Muddying the water in brain edema? Trends Neurosci 38 (6): 331–332. https://doi.org/10.1016/j.tins.2015.04.006
Nikolenko VN, Oganesyan MV, Yakhno NN, Orlov EA, Porubaeva EE, Popova EYu (2018) Glymphatic system of the brain: functional anatomy and clinical perspectives. Neurol Neuropsych Psychosomat 10 (4): 94–100.
Nikolenko VN, Nikitina AT, Sozonova EA, Pavliv MP, Oganesyan MV, Rizaeva NA (2021) Morphology, mechanisms of regulation and the role of the drainage systems of the CNS in the metabolism of brain tissues. In: Lymphology: from basic research to medical technology. Proc XIV Int Sci Pract Confer. Novosibirsk 20–25.
Bradbury MW, Cserr HF, Westrop RJ (1981) Drainage of cerebral interstitial fluid into deep cervical lymph of the rabbit. Am J Physiol 240: F329–F336. https://doi.org/10.1152/ajprenal.1981.240.4.F329
Ma Q, Ries M, Decker Y, Müller A, Riner C, Bücker A, Fassbender K, Detmar M, Proulx ST (2019) Rapid lymphatic efflux limits cerebrospinal fluid flow to the brain. Acta Neuropathol 137: 151–165.https://doi.org/10.1007/s00401-018-1916-x
Min Rivas F, Liu J, Martell BC, Du T, Mestre H, Nedergaard M, Tithof J, Thomas JH, Kelley DH (2020) Surface periarterial spaces of the mouse brain are open, not porous. J R Soc Interface 17 (172): 20200593. https://doi.org/10.1098/rsif.2020.0593
Cserr HF, Depasquale M, Patlak CS (1987) Regulation of brain water and electrolytes during acute hyperosmolality in rats. Am J Physiol 253: F522–F529. https://doi.org/10.1152/ajprenal.1987.253.3.F522
Abbott NJ, Pizzo ME, Preston JE, Janigro D, Thorne RG (2018) The role of brain barriers in fluid movement in the CNS: is there a “glymphatic” system? Acta Neuropathol 135 (3): 387–407. https://doi.org/10.1007/s00401-018-1812-4
Rasmussen MK, Mestre H, Nedergaard M (2021) Fluid transport in the brain. Physiol Rev 3: 66. https://doi.org/10.1152/physrev.00031.2020
Schley D, Carare-Nnadi R, Please CP, Perry VH, Weller RO (2006) Mechanisms to explain the reverse perivascular transport of solutes out of the brain. J Theoret Biol 238: 962–974. https://doi.org/10.1016/j.jtbi.2005.07.005
Rennels ML, Blaumanis OR, Grady PA (1990) Rapid solute transport throughout the brain via paravascular fuid pathways. Adv Neurol 52:431–439.
Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, O’Donnell J, Christensen DJ, Nicholson C, Ilif JJ, Takano A, Deane R, Nedergaard M (2013) Sleep drives metabolite clearance from the adult brain. Science 342: 373–377. https://doi.org/10.1126/science.1241224
Iliff JJ, Lee H, Yu M, Feng T, Logan J, Nedergaard M, Benveniste H (2013) Brain-wide pathway for waste clearance captured by contrast-enhanced MRI. J Clin Invest 123 (3): 1299–1309. https://doi.org/10.1172/JCI67677
Iliff JJ, Wang M, Zeppenfeld DM, Venkataraman A, Plog BA, Liao Y, Deane R, Nedergaard M (2013) Cerebral arterial pulsation drives paravascular CSF-interstitial fluid exchange in the murine brain. J Neurosci 33 (46): 18190–18199. https://doi.org/10.1523/JNEUROSCI.1592-13.2013
Bedussi B, Almasian M, de Vos J, VanBavel E, Bak- ker ENTP (2018) Paravascular spaces at the brain surface: Low resistance pathways for cerebrospinal fuid fow. J Cereb Blood Flow Metab 38: 719–726. https://doi.org/10.1177/0271678X17737984
Mestre H, Tithof J, Du T, Song W, Peng W, Sweeney AM, Olveda G, Thomas JH, Nedergaard M, Kelley DH (2018) Flow of cerebrospinal fuid is driven by arterial pulsations and is reduced in hypertension. Nat Commun 9: 4878. https://doi.org/10.1038/s41467-018-07318-3
Raghunandan A, Ladrón-de-Guevara A, Tithof J, Mestre H, Nedergaard M, Thomas JH, Kelley DH (2020) Bulk fow of cerebrospinal fuid observed in periarterial spaces is not an artifact of injection. Elife 10: e65958. https://doi.org/10.7554/eLife.65958
Koundal S, Elkin R, Nadeem S, Xue Y, Constantinou S, Sanggaard S, Liu X, Monte B, Xu F, Van Nostrand W, Nedergaard M, Lee H, Wardlaw J, Benveniste H, Tannenbaum A (2020) Optimal mass transport with Lagrangian workfow reveals advective and difusion driven solute transport in the glymphatic system. Sci Rep 10 (1): 1–18. https://doi.org/10.1038/s41598-020-59045-9
Xue Y, Liu X, Koundal S, Constantinou S, Dai F, Santambrogio L, Lee H, Benveniste H (2020) In vivo T1 mapping for quantifying glymphatic system transport and cervical lymph node drainage. Sci Rep 10: 14592. https://doi.org/10.1038/s41598-020-71582-x
Diem AK, Sharp MM, Gatherer M, Bresslof NW, Carare RO, Richardson G (2017) Arterial pulsations cannot drive intramural periarterial drainage: Signifcance for Aβ drainage. Front Neurosci 11: 475. https://doi.org/10.3389/fnins.2017.00475
Asgari M, de Zélicourt DA, Kurtcuoglu V (2016) Glymphatic solute transport does not require bulk fow. Sci Rep 6: 38635. https://doi.org/10.1038/srep38635
Wagshul ME, Eide PK, Madsen JR (2011) The pulsating brain: a review of experimental and clinical studies of intracranial pulsatility. Fluids and Barriers CNS 8 (1): 1–23. https://doi.org/10.1186/2045-8118-8-5
Butler WE (2017) Wavelet brain angiography suggests arteriovenous pulse wave phase locking. PloS One 12 (11): e0187014. https://doi.org/10.1371/journal.pone.0187014
Postnov D, Erdener SE, Kilic K, Boas DA (2018) Cardiac pulsatility mapping and vessel type identification using laser speckle contrast imaging. Biomed Optics Express 9 (12): 6388–6397. https://doi.org/10.1364/BOE.9.006388
Kiviniemi V, Wang X, Korhonen V, Keinanen T, Tuovinen T, Autio J, LeVan P, Keilholz S, Zang Y-F, Hennig J, Nedergaard M (2016) Ultra-fast magnetic resonance encephalography of physiological brain activity – Glymphatic pulsation mechanisms? J Cereb Blood Flow Metab 36: 1033–1045. https://doi.org/10.1177/0271678X15622047
Vinje V, Ringstad G, Lindstrøm EK, Valnes LM, Rognes ME, Eide PK, Mardal KA (2019) Respiratory influence on cerebrospinal fluid flow–a computational study based on long-term intracranial pressure measurements. Scient Rep 9 (1): 1–13. https://doi.org/10.1038/s41598-019-46055-5
Fultz NE, Bonmassar G, Setsompop K, Stickgold RA, Rosen BR, Polimeni JR, Lewis LD (2019) Coupled electrophysiological, hemodynamic, and cerebrospinal fluid oscillations in human sleep. Science 366 (6465): 628–631. https://doi.org/10.1126/science.aax5440
Brierley JB (1950) The penetration of particulate matter from the cerebrospinal fuid into the spinal ganglia, peripheral nerves, and perivascular spaces of the central nervous system. J Neurol Neurosurg Psychiatry 13: 203–215. https://doi.org/10.1136/jnnp.13.3.203
Smith A, Akdemir G, Wadhwa M, Song D, Verkman A (2021) Application of fluorescent dextrans to the brain surface under constant pressure reveals AQP4-independent solute uptake. J Gen Physiol 153: e202112898. https://doi.org/10.1085/jgp.202112898
Wang P, Olbricht WL (2011) Fluid mechanics in the perivascular space. J Theoret Biol 274: 52–57. https://doi.org/10.1016/j.jtbi.2011.01.014
Kedarasetti RT, Drew PJ, Costanzo F (2020) Arterial pulsations drive oscillatory flow of CSF but not directional pumping. Sci Rep 10: 10102. https://doi.org/10.1038/s41598-020-66887-w
Thomas J (2019) Fluid dynamics of cerebrospinal fluid flow in perivascular spaces. J R Soc Interface 16: 20190572. https://doi.org/10.1098/rsif.2019.0572
Martinac AD, Bilston LE (2019) Computational modelling of fluid and solute transport in the brain. Biomech Modeling Mechanobiol 19: 781–800. https://doi.org/10.1007/s10237-019-01253-y
Faghih MM, Keith SM (2021) Mechanisms of tracer transport in cerebral perivascular spaces. J Biomech 118: 110278. https://doi.org/10.1016/j.jbiomech.2021.110278
Postnov DE, Postnikov EB, Karavaev AS, Glushkovskaya-Semyachkina OV (2018) On trans-parenchymal transport after blood brain barrier opening: pump-diffuse-pump hypothesis. Saratov Fall Meeting 2017: Laser Physics and Photonics XVIII. Computational Biophysics and Analysis of Biomedical Data IV. Int Soc Optics and Photonics 10717: 107171W. https://doi.org/10.1117/12.2315196
Sharp MK, Carare RO, Martin BA (2019) Dispersion in porous media in oscillatory flow between flat plates: applications to intrathecal, periarterial and paraarterial solute transport in the central nervous system. Fluids Barriers CNS 16: 13. https://doi.org/10.1186/s12987-019-0132-y
Troyetsky DE, Tithof J, Thomas JH, Kelley DH (2021) Dispersion as a waste-clearance mechanism in flow through penetrating perivascular spaces in the brain. Sci Rep 11: 4595. https://doi.org/10.1038/s41598-021-83951-1
Wang MX, Ray L, Tanaka KF, Iliff JJ, Heys J (2021) Varying perivascular astroglial endfoot dimensions along the vascular tree maintain perivascular-interstitial flux through the cortical mantle. Glia 69: 715–728. https://doi.org/10.1002/glia.23923
Mestre H, Hablitz LM, Xavier AL, Feng W, Zou W, Pu T, Monai H, Murlidharan G, Castellanos Rivera RM, Simon MJ, Pike MM, Plá V, Du T, Kress BT, Wang X, Plog BA, Thrane AS, Lundgaard I, Abe Y, Yasui M, Thomas JH, Xiao M, Hirase H, Asokan A, Iliff JJ, Nedergaard M (2018) Aquaporin-4-dependent glymphatic solute transport in the rodent brain. ELife 7: e40070. https://doi.org/10.7554/eLife.40070
Smith AJ, Yao X, Dix JA, Jin B-J, Verkman AS (2017) Test of the ‘glymphatic’ hypothesis demonstrates diffusive and aquaporin-4-independent solute transport in rodent brain parenchyma. ELife 6: e27679. https://doi.org/10.7554/eLife.27679
Smith AJ, Verkman AS (2018) The “glymphatic” mechanism for solute clearance in Alzheimer’s disease: game changer or unproven speculation? FASEB J 32: 543–551. https://doi.org/10.1096/fj.201700999
Smith AJ, Verkman AS (2019) Cross Talk opposing view: Going against the flow: interstitial solute transport in brain is diffusive and aquaporin-4 independent. J Physiol (Lond) 597: 4421–4424. https://doi.org/10.1113/JP277636
Ray LA, Heys JJ (2019) Fluid flow and mass transport in brain tissue. Fluids 4: 196–233. https://doi.org/10.3390/fluids4040196
Obersteiner H (1900) The Anatomy of the Central Nervous Organs in Health and Disease. 2nd Ed. London. Charles Griffin and Company Ltd. 174–175.
Bruce A, Dawson JW (1911) On the relations of the lymphatics of the spinal cord. J Pathol Bacteriol 15: 169–178. https://doi.org/10.1002/path.1700150204
Prineas JW (1979) Multiple sclerosis: Presence of lymphatic capillaries and lymphoid tissue in the brain and spinal cord. Science 203: 1123–1125. https://doi.org/10.1126/science.424741
Chaitanya GV, Omura S, Sato F, Martinez NE, Minagar A, Ramanathan M, Guttman BW, Zivadinov R, Tsunoda I, Alexander JS (2013) Inflammation induces neuro-lymphatic protein expression in multiple sclerosis brain neurovasculature. J Neuroinflammat 14 (10): 125. https://doi.org/10.1186/1742-2094-10-125
Kuerten S, Schickel A, Kerkloh C, Recks MS, Addicks K, Ruddle NH, Lehmann PV (2012) Tertiary lymphoid organ development coincides with determinant spreading of the myelin-specific T cell response. Acta Neuropathol 124: 861–873. https://doi.org/10.1007/s00401-012-1023-3
Mezey E, Szalayova I, Hogden CT, Brady A, Dosa A, Sotonui P, Palkovits M (2021) An immunohistochemical study of lymphatic elements in the human brain. PNAS 118 (3): 1–12. https://doi.org/10.1073/pnas.2002574118
Morris AW, Carare RO, Schreiber S, Hawkes CA (2014) The Cerebrovascular Basement Membrane: Role in the Clearance of β-amyloid and Cerebral Amyloid Angiopathy. Front Aging Neurosci 19 (6): 251. https://doi.org/10.3389/fnagi.2014.00251
Chikly B (1998) Is Human Cerebrospinal Fluid Reabsorbed by Lymph? LDT and Manual drainage of the CNS. J Am Acad Osteopathy (JAAO) 8 (2): 28–34.
Antila S, Karaman S, Nurmi H, Airavaara M, Voutilainen MH, Mathivet T, Chilov D, Li Z, Koppinen T, Park JH, Fang S, Aspelund A, Saarma M, Eichmann A, Thomas JL, Alitalo K (2017) Development and plasticity of meningeal lymphatic vessels. J Exp Med 214 (12): 3645–3667. https://doi.org/10.1084/jem.20170391
Wigle JT, Oliver G (1999) Prox1 function is required for the development of the murine lymphatic system. Cell 98: 769–778. https://doi.org /10.1016/S0092 -8674(00)81511-1
Escobedo N, Oliver G (2016) Lymphangiogenesis: Ori gin, Specification, and Cell Fate Determination. Annu Rev Cell Dev Biol 32: 677–691. https://doi.org/10.1146/annurev-cellbio-111315-124944
Karkkainen MJ, Haiko P, Sainio K, Partanen J, Taipale J, Petrova TV, Jeltsch M, Jackson DG, Talikka M, Rauvala H, Betsholtz C, Alitalo K (2004) Vascular endothelial growth factor C is required for sprouting of the first lymphatic vessels from embryonic veins. Nat Immunol 5: 74–80. https://doi.org /10.1038 /ni1013
Breslin JW, Yang Y, Scallan JP, Sweat RS, Adderley SP, Murfee WL (2018) Lymphatic Vessel Network Structure and Physiology. Compr Physiol 9 (1): 207–299. https://doi.org/10.1002/cphy.c180015
Hägerling R, Pollmann C, Andreas M, Schmidt C, Nurmi H, Adams RH, Alitalo K, Andresen V, Schulte-Merker S, Kiefer F (2013) A novel multistep mechanism for initial lymphangiogenesis in mouse embryos based on ultramicroscopy. EMBO J 32: 629–644. https://doi.org/10.1038 /emboj .2012.340
Kunert C, Baish JW, Liao S, Padera TP, Munn LL (2015) Mechanobiological oscillators control lymph flow. Proc Natl Acad Sci U S A 112 (35): 10938–10943. https://doi.org/10.1073/pnas.1508330112
Scallan JP, Zawieja SD, Castorena-Gonzalez JA, Davis MJ (2016) Lymphatic pumping: mechanics, mechanisms and malfunction. J Physiol 594 (20): 5749–5768. PMID: https://doi.org/10.1113/jp27208827219461
Drapier JC, Hirling H, Wietzerbin J, Kaldy P, Kühn LC (1993) Biosynthesis of nitric oxide activates iron regulatory factor in macrophages. EMBO J 21: 3643–3649. https://doi.org/10.1002/j.1460-2075.1993.tb06038.x
Lepoivre M, Fieschi F, Coves J, Thelander L, Fontecav M (1991) Inactivation of ribonucleotide reductase by nitric oxide. Biochem Biophys Res Commun 179: 442–448. https://doi.org/10.1016/0006-291X(91)91390-X
Drapier JC, Hibbs Jr B (1996) Aconitases: a class of metalloproteins highly sensitive to nitric oxide synthesis. Methods Enzymol 269: 26–36. https://doi.org/10.1016/S0076-6879(96)69006-5
Dimmeler S, Lottspeich F, Brüne B (1992) Nitric oxide causes ADP-ribosylation and inhibition of glyceraldehyde-3-phosphate dehydrogenase. J Biol Chem 267: 16771–16774. https://doi.org/10.1016/S0021-9258(18)41847-9
Stamler JS, Simon DI, Osborne JA, Mullins ME, Jaraki O, Michel T, Singel DJ, Loscalzoet J (1992) S-nitrosylation of proteins with nitric oxide: synthesis and characterization of biologically active compounds. Proc Natl Acad Sci U S A 89: 444–448. https://doi.org/10.1073/pnas.89.1.444
Helms C, Kim-Shapiro DB (2013) Hemoglobin-mediated nitric oxide signaling. Free Radic Biol Med 61: 464–472. https://doi.org/10.1016/j.freeradbiomed.2013.04.028
Ahn JH, Cho H, Kim JH, Kim SH, Ham JS, Park I, Suh SH, Hong SP, Song JH, Hong YK, Jeong Y, Park SH, Koh GY (2019) Meningeal lymphatic vessels at the skull base drain cerebrospinal fluid. Nature 572: 62–66. https://doi.org/10.1038/s41586-019-1419-5
Lessen MV, Shibata-Germanos S, Impel AV, Hawkins TA, Rihel J, Schulte-Merker S (2017) Intracellular uptake of macromolecules by brain lymphatic endothelial cells during zebrafish embryonic development. eLife 6: e25932. https://doi.org/10.7554/eLife.25932
Fox RJ, Walji AH, Mielke B, Petruk KC, Aronyk KE (1996) Anatomic details of intradural channels in the parasagittal dura: a possible pathway for flow of cerebrospinal fluid. Neurosurgery 39: 84–91. https://doi.org/10.1097/00006123-199607000-00017
Osaka K, Handa H, Matsumoto S, Yasuda M (1980) Development of the cerebrospinal fluid pathway in the normal and abnormal human embryos. Child’s Brain 6: 26–38. https://doi.org/10.1159/000119881
Jayatilaka ADP (1969) Arachnoid Granulations and Arachnoid Villi in Mammals. C B Y I O N J Med Sci 18:1.
Semyachkina-Glushkovskaya O, Fedosov I, Navolokin N, Shirokov A, Maslyakova G, Bucharskaya A, Blokhina I, Terskov A, Khorovodov A, Postnov D, Kurths J (2021) Pilot identification of the Live-1/Prox-1 expressing lymphatic vessels and lymphatic elements in the unaffected and affected human brain. bioRxiv 2021.09.05.458990. https://doi.org/10.1101/2021.09.05.458990
Semyachkina-Glushkovskaya O, Penzel T, Blokhina I, Khorovodov A, Fedosov I, Yu T, Karandin G, Evsukova A, Elovenko D, Adushkina V, Shirokov A, Dubrovskii A, Terskov A, Navolokin N, Tzoy M, Ageev V, Agranovich I, Telnova V, Tsven A, Kurths J (2021) Night Photostimulation of Clearance of Beta-Amyloid from Mouse Brain: New Strategies in Preventing Alzheimer’s Disease. Cells 10: 3289. https://doi.org/10.3390/cells10123289
Aspelund A, Antila S, Proulx ST, Karlsen TV, Karaman S, Detmar M, Wiig H, Alitalo K (2015) A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules. J Exp Med 212 (7): 991–999. https://doi.org/10.1084/jem.20142290
Bolte AC, Dutta AB, Hurt ME, Igor Smirnov I, Kovacs MA, McKee CA, Hannah Ennerfelt E, Shapiro D, Nguyen BH, Frost EL, Lammert CR, Kipnis J, Lukens JR (2020) Meningeal lymphatic dysfunction exacerbates traumatic brain injury pathogenesis. Nat Commun 11: 4524. https://doi.org/10.1038/s41467-020-18113-4
Semyachkina-Glushkovskaya O, Esmat A, Bragin D, Bragina O, Shirokov AA, Navolokin N, Yang Y, Abdurashitov A, Khorovodov A, Terskov A, Klimova M, Mamedova A, Fedosov I, Tuchin V, Kurths J (2020) Phenomenon of music-induced opening of the blood-brain barrier in healthy mice. Proc R Soc B 287: 20202337. https://doi.org/10.1098/rspb.2020.2337
Song E, Mao T, Dong H, Boisserand LSB, Antila S, Bosenberg M, Alitalo K, Thomas JL, Iwasaki A (2020) VEGF-C-driven lymphatic drainage enables immunosurveillance of brain tumours. Nature 577 (7792): 689–694. https://doi.org/10.1038/s41586-019-1912-x
Graham MS, Mellinghoff IK (2021) Meningeal lymphatics prime tumor immunity in glioblastoma. Cancer Cell 39 (3): 304–306. https://doi.org/10.1016/j.ccell.2021.02.012
Mascagni P, Bellini GB (1816) Presso Euse bio Pacinie Figlio: Florence.
Mascagni P (1787) De lymphaticis profundis capitis et colli. Vasorum lymphaticorum corporis humani historia et ichnographia. Pars Prima Section VII, Art. VI. Siena: Pazzini Carli.
Lecco V (1953) Di una probabile modificazione delle fissure linfatiche della della parte dei seni venosi della dura madre. Arch Ital Otol Rinol Laringol 64: 287–296.
Absinta M, Ha SK, Nair G, Sati P, Luciano NJ, Palisoc M, Louveau A, Zaghloul KA, Pittaluga S, Kipnis J, Reich DS (2017) Human and nonhuman primate meninges harbor lymphatic vessels that can be visualized noninvasively by MRI. Elife 6: e29738. https://doi.org/10.7554/eLife.29738
Mezey É, Palkovits M (2015) Forgotten findings of brain lymphatics. Nature 524: 415. https://doi.org/10.1038/524415b
Semyachkina-Glushkovskaya O, Postnov D, Lavrova A, Fedosov I, Borisova E, Nikolenko V, Penzel T, Kurths J, Tuchin V (2021) Biophotonic Strategies of Measurement and Stimulation of the Cranial and the Extracranial Lymphatic Drainage Function. IEEE J Selected Topics in Quantum Electron 27 (4): 1–13. https://doi.org/10.1109/JSTQE.2020.3045834
Semyachkina-Glushkovskaya O, Fedosov I, Shirokov A, Vodovozov E, Alekseev A, Khorovodov A, Blokhina I, Terskov A, Mamedova A, Klimova M, Dubrovsky A, Ageev V, Agranovich I, Vinnik V, Tsven A, Sokolovski S, Rafailov E, Penzel T, Jürgen Kurths J (2021) Photomodulation of lymphatic delivery of liposomes to the brain bypassing the blood-brain barrier: new perspectives for glioma therapy. Nanophotonics 10 (12): 3215–3227. https://doi.org/10.1515/nanoph-2021-0212
Salehpour F, Khademi M, Bragin DE, DiDuro JO (2022) Photobiomodulation Therapy and the Glymphatic System: Promising Applications for Au gmenting the Brain Lymphatic Drainage System. Int J Mol Sci 23 (6): 2975. https://doi.org/10.3390/ijms23062975
https://lymphalessons.com
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии