Журнал эволюционной биохимии и физиологии, 2023, T. 59, № 1, стр. 43-53
УМЕНЬШЕНИЕ АУТОФАГИЧЕСКОЙ И АПОПТОТИЧЕСКОЙ ГИБЕЛИ НЕЙРОНОВ В СА1 РАЙОНЕ ГИППОКАМПА И ЛОБНОЙ КОРЕ МОЗГА КРЫС ВВЕДЕННЫМ ИНТРАНАЗАЛЬНО ИНСУЛИНОМ ПРИ ИШЕМИИ И РЕПЕРФУЗИИ ПЕРЕДНЕГО МОЗГА
Е. А. Фокина 1, И. О. Захарова 1, Л. В. Баюнова 1, Д. К. Аврова 1, И. О. Илясов 1, Н. Ф. Аврова 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: avrova@iephb.ru
Поступила в редакцию 14.10.2022
После доработки 21.11.2022
Принята к публикации 23.11.2022
- EDN: GXGJDY
- DOI: 10.31857/S0044452923010047
Аннотация
Для разработки подходов к лечению ишемических поражений мозга важно понимание механизмов регуляции апоптотической и аутофагической гибели нейронов. При сильно выраженном ишемическом (или другом патологическом) воздействии нейроны могут гибнуть от активации и апоптоза, и аутофагии. Целью работы является оценка вклада активации аутофагии и апоптоза в гибель нейронов CA1 района гиппокампа и лобной коры мозга крыс при двухсосудистой ишемии переднего мозга и гипотензии и последующей длительной реперфузии, а также изучение способности инсулина, введенного интраназально, предотвращать аутофагическую и апоптотическую гибель нейронов. Ингибитор аутофагии 3-метиладенин или ингибитор апоптоза Ac-DEVD-CHO или фосфатный буфер вводили крысам интрацеребровентрикулярно до ишемии и реперфузии. Для подсчета количества живых нейронов срезы мозга окрашивали по Нисслю. При ишемии и реперфузии число живых нейронов в CA1 районе гиппокампа снижалось до 58.3 ± 1.5% от их содержания у ложнооперированных крыс (контроль, принятый за 100%). Введение крысам ингибитора аутофагии или апоптоза увеличивало число живых нейронов в районе CA1 гиппокампа c 58.3 ± 1.5% до 90.4 ± 2.2% (p < 0.001) и 71.6 ± 1.8% (p < 0.001) от контроля соответственно. Введение крысам 0.5 МЕ инсулина (до ишемии и ежедневно в течение 7 дней при реперфузии) нормализовало число живых нейронов в CA1 районе гиппокампа до 100.2 ± 1.9% от контроля. В лобной коре мозга также наблюдалось снижение жизнеспособности нейронов при ишемии и реперфузии и ее повышение при введении ингибиторов аутофагии и апоптоза и в большей степени при введении инсулина. Отличие заключалось в меньшей чувствительности нейронов коры мозга, чем нейронов гиппокампа, к ишемии и реперфузии. Полученные данные свидетельствуют о способности инсулина, введенного интраназально, уменьшать гибель нейронов мозга, вызванную активацией аутофагии и апоптоза, при ишемии мозга и реперфузии.
В последние годы появились убедительные свидетельства того, что без понимания механизмов аутофагической гибели нейронов и их взаимосвязи с механизмами апоптотической гибели этих клеток невозможно достичь серьезных успехов в разработке подходов к лечению ишемических поражений мозга, в том числе инсультов. Основными причинами гибели нейронов при ишемическом поражении мозга являются апоптоз, аутофагия и некроз. При этом аутофагии принадлежит ключевая роль в поддержании клеточного гомеостаза. Но в настоящее время представления об исключительно защитной роли аутофагии пересмотрены. Четко прослеживается участие аутофагических процессов в гибели нейронов, прежде всего нейронов гиппокампа, что продемонстрировано, в частности, при ишемии и реперфузии мозга. Так, показана способность многих нейропротекторов повышать жизнеспособность нейронов и других клеток мозга благодаря ингибированию аутофагии при ишемии мозга и его реперфузии. К ним относятся флавоноиды, ганглиозид GM1, финголимод (аналог сфингозин-1-фосфата), N-ацетил-серотонин (предшественник мелатонина), ресвератрол и другие соединения [1–7].
При этом в научной литературе можно встретить и работы, в которых найдено, что активация аутофагии в мозге при некоторых видах ишемического воздействия на него может носить защитный характер. Так, активация аутофагии до ишемического поражения мозга может обладать эффектом прекондиционирования [8]. Активатор аутофагии рапамицин способен уменьшать размер поражения мозга и улучшать неврологические показатели у животных при фокальной ишемии [9, 10]. Есть и другие примеры благоприятного эффекта активации аутофагии на состояние животных при ишемии и реперфузии мозга [11, 12].
Но создается впечатление, что при достаточной силе ишемического воздействия на мозг в его острую фазу активация аутофагии приводит к гибели нейронов мозга. В этой связи актуальным является исследование способности перспективных нейропротекторов, которые могут найти себе применение в клинической практике при лечении инсультов и других патологических состояний, связанных с ишемией мозга, предотвращать аутофагическую гибель нейронов и других клеток мозга при этих патологиях, что будет способствовать более глубокому пониманию механизма их защитного действия.
По данным Всемирной организации здравоохранения от цереброваскулярных заболеваний в мире ежегодно умирает около 5 млн человек. Из общего числа этих болезней 80–85% приходится на инсульт мозга [13]. Инсульт мозга является одной из главных причин смерти людей в мире. Он уносит больше жизней в развивающихся странах, чем в развитых государствах [14]. При этом в развитых странах, например в США, инсульт относится к основным причинам длительной и тяжелой инвалидности людей [15].
Долгое время считали, что для понимания действия нейропротекторов достаточно расшифровать механизмы их антиапоптотического и антинекротического действия. Но сейчас стало совершенно ясно, что невозможно достичь понимания нарушений в мозге при ишемии и реперфузии и оценить действие на них нейропротекторов без исследования аутофагической гибели нейронов. По-видимому, сигнальные молекулы и внутриклеточные каскады, ответственные за регуляцию аутофагии, могут стать одной из важнейших терапевтических мишеней при лечении инсульта головного мозга и других форм его ишемического поражения [5, 16, 17].
Инсулин является одним из наиболее перспективных нейропротекторов. Это в значительной мере обусловлено возможностью его интраназального введения, при котором он попадает непосредственно в мозг, минуя гематоэнцефалический барьер [18, 19]. Проведены многочисленные и в целом успешные клинические испытания инсулина при болезни Альцгеймера [20, 21], начаты испытания при болезни Паркинсона [22], им предшествовали исследования нейропротекторной роли инсулина, введенного животным с нейродегенеративными заболеваниями. Но, как ни странно, работы по изучению способности инсулина, введенного интраназально, предовращать гибель нейронов мозга при его ишемическом поражении и последующей реперфузии практически отсутствуют, за исключением нескольких работ нашей лаборатории, посвященных его способности нормализовать уровень продуктов перекисного окисления липидов и другие метаболические нарушения в мозгу молодых и старых крыс [23, 24]. Эффект инсулина на аутофагическую гибель нейронов мозга при ишемических воздействиях остается пока неизученным. И это, несмотря на большой интерес в современных научных исследованиях к той роли, которую играет аутофагия в гибели нейронов при различных патологических процессах.
Целью настоящей работы является оценка вклада аутофагии и апоптоза в гибель нейронов CA1 района гиппокампа и лобной коры мозга крыс при двухсосудистой ишемии переднего мозга с гипотензией и последующей реперфузией, а также изучение способности инсулина, введенного интраназально, предотвращать гибель нейронов, вызванную активацией этих процессов.
МЕТОДЫ ИССЛЕДОВАНИЯ
Реактивы и материалы. Для интраназальных введений использовался бычий инсулин (I5500, Sigma, США), для интрацеребровентрикулярных введений – ингибитор аутофагии 3-метиладенин (M9281, Sigma, США), ингибитор каспаз Ac-DEVD-CHO (BD Pharmigen, BD Biosciences, США). Животных наркотизировали хлоралгидратом (#15307, Sigma-Aldrich, США). Для катетеризации бедренной артерии применялся катетер (1.0 × × 0.6 × 210 мм, 23G) от компании SciCat (Россия). Материал шовный хирургический стерильный (нерассасывающиеся лавсановые нити МР1,5 USP4-0, ООО “Линтекс”, Россия) накладывался для скрепления мягких тканей в области бедра и шеи. Кожа сшивалась с помощью одноразового стерильного степлера (Appose ULC auto suture, Covidien, США).
Интраназальное введение инсулина. Опыты проводили на самцах крыс линии Вистар массой 270–330 г. Инсулин (Sigma, США) в дозе 0.5 МЕ на крысу вводили интраназально за 1 ч до окклюзии каротидных артерий и гипотензии, а затем ежедневно в течение 7 дней на стадии реперфузии. Для этого в каждую ноздрю животного вводили по 10 мкл раствора, содержащего 1 мг инсулина в 1 мл цитратного буфера, что соответствует 0.5 МЕ инсулина. Цитратный буфер готовили как смесь равных объемов растворов 100 мМ лимонной кислоты и 100 мМ цитрата натрия, pH 4.4.
Операция по введению ингибиторов апоптоза и аутофагии в боковой (I) желудочек мозга крыс. Для того, чтобы определить, как влияет активация процессов аутофагии и апоптоза на жизнеспособность нейронов при двухсосудистой ишемии переднего мозга с гипотензией и последующей реперфузией крысам интрацеребровентрикулярно вводили ингибиторы аутофагии и апоптоза. Для того, чтобы уровнять возможные последствия такого введения, всем остальным группам животных вводили интрацеребровентрикулярно стерильный фосфатный буфер, использовавшийся для растворения ингибиторов.
После наркотизации крыс хлоралгидратом, вводимым внутримышечно в дозе 400 мг/кг веса крыс, животных помещали в стереотаксис. Для трепанации черепа использовался стоматологический бор в области, расположенной над I желудочком мозга (координаты: AP = –0.92 мм, L = 1.5 мм, V = 3.5 мм относительно брегмы) в соответствии со стереотаксическим атласом [25]. Крысам вводили интрацеребровентрикулярно 20 мкг 3-метиладенина (3-МА) или 10 мкг Ac-DEVD-CHO, в виде растворов в фосфатном буфере объемом 4.5 мкл или аналогичный объем фосфатного буфера за 30 мин до ишемического воздействия с помощью шприца (Hamilton, США).
Двухсосудистая ишемия переднего мозга крыс с гипотензией и последующей реперфузией. Двухсосудистую ишемию переднего мозга вызывали у наркотизированных хлоралгидратом крыс путем пережатия на 10 мин каротидных артерий в сочетании с гипотензией – снижением артериального давления до 40 мм ртутного столба путем отбора крови в шприц с гепарином, как это описано ранее [26]. Реперфузию переднего мозга проводили, разжимая каротидные артерии и возвращая в кровяное русло кровь с гепарином, отобранную шприцом на стадии ишемии [26]. В качестве контрольных животных использовали ложнооперированных крыс. Животным после завершения ишемии обрабатывали раны стрептоцидом и накладывали швы. Послеоперационный уход за животными осуществлялся в течение 7 дней при содержании на стандартном рационе.
Определение числа живых нейронов в CA1 районе гиппокампа и лобной коре мозга. Через 7 сут после начала реперфузии проводили определение числа живых нейронов в CA1 районе гиппокампа и лобной коре мозга крыс. Наркотизированных хлоралгидратом животных декапитировали, извлекали мозг, промывали охлажденным физиологическим раствором и помещали на 7 дней в раствор 4%-ного параформальдегида в 0.1 М фосфатном буфере (+4°С). Для криопротекции мозг выдерживали в растворе 30%-ной сахарозы 7 дней при +4°С, после этого его замораживали в изопентане и далее хранили при –80°С. Из области лобной коры мозга и CA1 района и гиппокампа получали чередующиеся серии фронтальных срезов (10 мкм) с помощью криостата (Leika, Германия). Каждый 10-й срез монтировали на покрытые желатином стекла (БиоВитрум, Россия). Для оценки количества живых нейронов проводили окрашивание толуидиновым синим по модифицированному методу Ниссля [27]. Каждая группа животных включала по 3 крысы. Снимки (n = 15–20 с каждого среза) получали с помощью микроскопа “Сarl Ziess Axio A1” (“Ziess”, Германия) со встроенной телевизионной камерой “AxioCam 712 color” (“Ziess”, Германия) и программы ZEN 3.4 (Zen pro). С помощью программы Image J (США) оценивали количество живых клеток в СА1 области гиппокампа на участке длиной 300 мкм, а в коре – в квадрате со стороной 300 мкм.
Статистическая обработка данных. Данные приведены как среднее ± SEM. Статистическую достоверность различий в связи с тем, что речь идет о более чем трех группах данных, определяли методом однофакторного дисперсионного анализа (ANOVA) с применением Tukey’s теста для множественных сравнений, используя Prizm. Достоверными различия считали при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Одной из основных задач исследования было определение общей жизнеспособности нейронов в CA1 районе гиппокампа и в лобной коре мозга и вклада аутофагии и апоптоза в их гибель при двухсосудистой ишемии переднего мозга в сочетании с гипотензией и последующей его реперфузией. Окрашивание толуидиновым синим по модифицированному методу Ниссля выявило значительное (почти в два раза) снижение числа живых нейронов в районе CA1 гиппокампа при этом воздействии на мозг (рис. 1a). При этом введение ингибиторов аутофагии и апоптоза и в еще большей мере инсулина крысам с ишемией и реперфузией мозга, увеличивало число живых нейронов в CA1 районе гиппокампа (рис. 1a).
Рис. 1.
Эффект инсулина и ингибиторов аутофагии (3-метиладенина) и апоптоза (Ac-DEVD-CHO) на жизнеспособность нейронов в районе CA1 гиппокампа при двухсосудистой ишемии и гипотензии переднего мозга крыс и последующей реперфузии.
(a) – Фотографии срезов района CA1 гиппокампа крыс, окрашенных по модифицированному методу Ниссля для выявления числа живых нейронов. Масштаб 200 мкм. (b) – Результаты приведены как среднее ± SEM из данных, полученных при определении числа живых нейронов в районе CA1 гиппокампа крыс (число определений не менее 150 в каждой группе животных). Сокращения на рисунке: ShO – ложнооперированные крысы, Isch – крысы, подвергнутые двухсосудистой ишемии в сочетании с гипотензией в течение 10 мин, а затем реперфузии в течение 7 сут, Ins – инсулин, 3-MA – 3‑метиладенин. Введениe инсулина (0.5 МЕ/крысу, интраназально) проводили за 1 ч до ишемического воздействия и затем ежедневно в течение 7 дней реперфузионного периода. 20 мкг 3-метиладенина или 10 мкг Ac-DEVD-CHO или фосфатный буфер вводили интрацеребровентрикулярно за 30 мин до ишемии. Различия достоверны согласно методу однофакторного дисперсионного анализа (ANOVA) с использованием Tukey’s теста для множественных сравнений по сравнению: * и **– с ложнооперированными крысами, * – p < 0.05, ** – p < 0.001, x – c крысами с ишемией и реперфузией, p < 0.001, # – c крысами с ишемией и реперфузией, получавшими Ac-DEVD-CHO, p < 0.001.
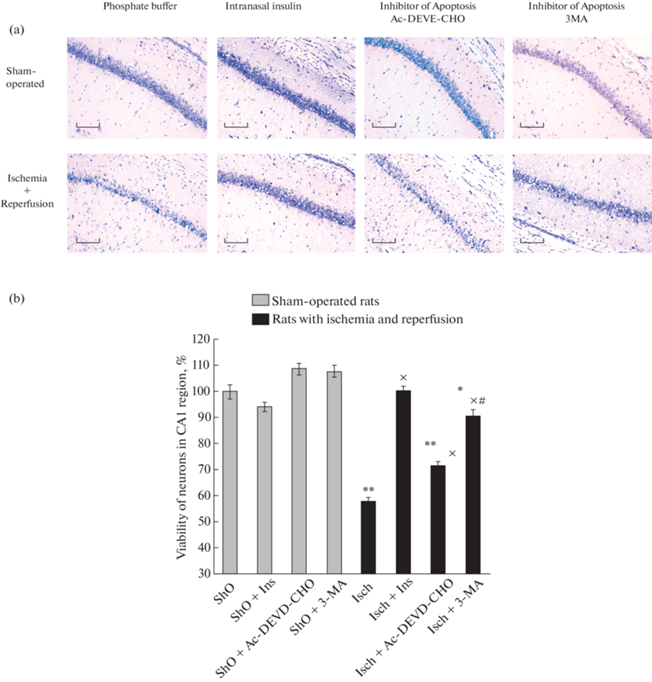
Количество живых нейронов у ложнооперированных крыс принимали за 100%, это контрольные значения. При глобальной ишемии переднего мозга и последующей реперфузии их число в CA1 районе гиппокампа снижалось в наших опытах до 58.3 ± 1.5% от контроля (рис. 1b). Чтобы избежать гибели подопытных животных, мы применяли ишемическое воздействие в течение 10 мин. При более жестком пятнадцатиминутном воздействии, как правило, наблюдается гибель большей части нейронов в CA1 районе гиппокампа – до 90% от их числа у ложнооперированных животных [см., например 28]. Наши результаты согласуются с данными других авторов, также применявших 10-минутную двухсосудистую ишемию с гипотензией и последующей реперфузией и также показавших, что при этом живыми остается значительно большая часть нейронов в СА1 районе гиппокампа, чем при пятнадцатиминутной ишемии [29].
Для того, чтобы определить, какой вклад в гибель нейронов гиппокампа вносят аутофагические и апоптотические процессы, мы использовали интрацеребровентрикулярное введение ингибитора аутофагии 3-МА и ингибитора апоптотических процессов Ac-DEVD-CHO, подавляющего активность различных каспаз, прежде всего касапазы-3 и каспазы-7.
Как видно из данных на рис. 1b, введение инсулина ложнооперированным крысам не оказывало достоверного воздействия на число выживших нейронов, как и введение ингибиторов аутофагии и апоптоза (3-МА и Ac-DEVD-CHO соответственно). В то же время влияние введения ингибиторов аутофагии и апоптоза крысам, подвергнутым воздействию глобальной ишемии и реперфузии переднего мозга, было хорошо выражено. Так, интрацеребровентрикулярное введение крысам ингибитора аутофагии 3-МА увеличивает число живых нейронов в районе CA1 гиппокампа c 58.3 ± 1.5% до 90.4 ± 2.2% (p < 0.001) от их уровня этом районе мозга у ложнооперированных крыс (рис. 1b). На основании этих данных нетрудно рассчитать, что при введении крысам с ишемией и реперфузией мозга 3-МА гибель нейронов в CA1 районе гиппокампа уменьшается более, чем на 70%. Полученные данные свидетельствуют о том, что активация аутофагии является, по-видимому, основной причиной гибели нейронов в CA1 районе гиппокампа при использовании нашей модели глобальной ишемии переднего мозга. Наши данные в этом отношении согласуются с данными Cui и соавт. [28], которые применяли сходную модель двухсосудистой ишемии переднего мозга. Аутофагия является одной из основных причин гибели нейронов в CA1 районе гиппокампа мозга и при использовании других моделей ишемического и реперфузионного воздействия [см., например, 30].
Полученные нами данные свидетельствуют также о существенном вкладе апоптотических процессов в общую гибель нейронов при ишемии и последующей реперфузии. Так, интрацеребровентрикулярное введение крысам ингибитора апоптотических процессов Ac-DEVD-CHO увеличивает число выживших при ишемии и реперфузии нейронов в CA1 районе гиппокампа с 58.3 ± 1.5% до 71.6 ± 1.8% (p < 0.001) от числа живых нейронов в контроле (рис. 1b). Расчеты показывают, что при введении крысам ингибитора апоптоза число нейронов, погибших в CA1 районе гиппокампа от воздействия ишемии и реперфузии, уменьшается примерно на 30%, что примерно соответствует доле нейронов, погибших при этом воздействии от апоптоза. Интересно отметить, что количество нейронов, выживших при ишемии и реперфузии в присутствии ингибитора аутофагии 3-МА (90.4 ± 2.2%) достоверно выше (p < 0.001), чем их число, выжившее в присутствии ингибитора апоптоза (71.6 ± ±1.8%). Это подтверждает важную роль активации аутофагии в гибели нейронов гиппокампа при ишемии и реперфузии. При этом апоптоз, наряду с аутофагией, относится к основным причинам гибели нейронов в CA1 районе гиппокампа при двухсосудистой ишемии с гипотензией и последующей реперфузией переднего мозга.
В наших опытах инсулин полностью нормализовал жизнеспособность нейронов в CA1 района гиппокампа при его интраназальном введении крысам в дозе 0.5 МЕ за час до ишемического воздействия, а затем ежедневно в течение 7 дней в период реперфузии. Число живых нейронов в этом районе мозга у крыс с ишемией и реперфузией, получавших инсулин, составляло 100.2 ± 1.9% от их количества у ложнооперированных крыс (рис. 1b). Эти данные показывают, что инсулин способен предотвращать как аутофагическую, так и апоптитическую гибель нейронов в CA1 районе гиппокампа при двухсосудистой ишемии переднего мозга в сочетании с гипотензией и последующей реперфузией.
Мы проводили также определение влияния ишемии переднего мозга и последующей реперфузии на жизнеспособность нейронов лобной коры мозга (рис. 2). Согласно нашим данным, нейроны коры мозга являются менее чувствительными к такому воздействию, чем нейроны СA1 района гиппокампа (рис. 1 и 2). Так, в лобной коре мозга в тех же условиях ишемии и реперфузии живыми оставались 74.2 ± 1.4% нейронов от их числа у ложнооперированных крыс (рис. 2b), а не 58.3 ± 1.5%, как в CA1 районе гиппокампа, различия обладают высокой степенью достоверности (p < 0.001).
Рис. 2.
Эффект инсулина и ингибиторов аутофагии (3-метиладенина) и апоптоза (Ac-DEVD-CHO) на жизнеспособность нейронов в лобной коре мозга при двухсосудистой ишемии и гипотензии переднего мозга и последующей реперфузии.
(a) – Фотографии срезов лобной коры мозга, окрашенных по модифицированному методу Ниссля для выявления числа живых нейронов. Масштаб 200 мкм. (b) – Результаты приведены как среднее ± SEM из данных, полученных при определении числа живых нейронов в лобной коре мозга крыс (число определений не менее 150 в каждой группе животных). Расшифровка сокращений и описание условий опытов, как на на рис. 1. Различия достоверны согласно методу однофакторного дисперсионного анализа (ANOVA) с использованием Tukey’s теста для множественных сравнений по сравнению: * и **– с ложнооперированными крысами, * – p < 0.001, ** – p < 0.01, x – c крысами с ишемией и реперфузией, p < 0.001, # – c крысами, с ишемией и реперфузией, получавшими Ac-DEVD-CHO, p < 0.05.
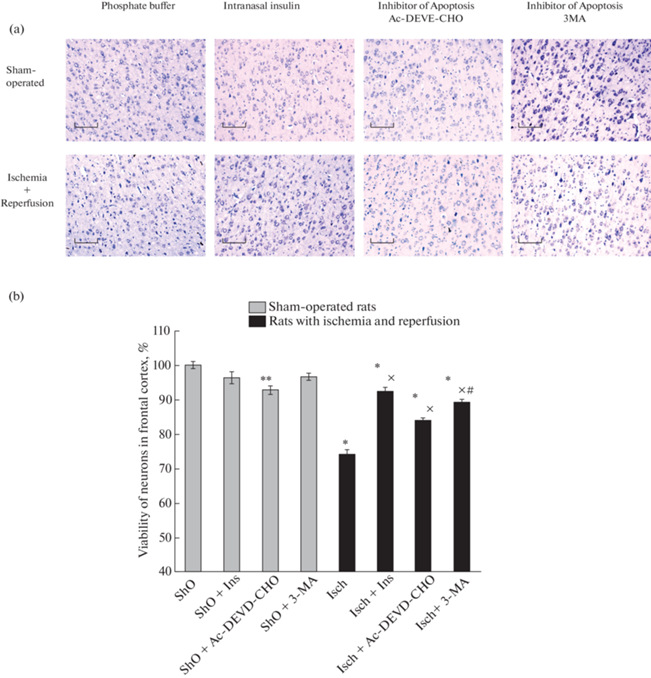
При введении ингибиторов аутофагии 3-МА и апоптоза Ac-DEVD-CHO число выживших нейронов в лобной коре мозга крыс, подвергнутых ишемии и реперфузии, повышалось с 74.2 ± 1.4 до 89.2 ± 1.2 и до 83.8 ± 1.1% соответственно (рис. 2b). Большее повышение жизнеспособности нейронов под влиянием ингибитора аутофагии, чем апоптоза (p < 0.05), говорит, очевидно, о том, что аутофагия является основной причиной гибели нейронов при ишемии и реперфузии и в коре мозга, а не только в гиппокампе, хотя и апоптоз вносит свой вклад в обоих случаях. Эти данные позволяют предполагать, что при этом воздействии гибель нейронов мозга от аутофагии превышает их гибель от апоптоза в разных районах мозга.
В обеих структурах интраназальное введение инсулина крысам значительно повышало число выживших при ишемии и реперфузии нейронов. В лобной коре мозга живыми оставались 92.5 ± 1.3% нейронов от их числа в контроле, причем различия с данными по мозгу ложнооперированных животных были достоверными (p < 0.01). Введение крысам инсулина существенно превышает способность каждого из ингибиторов уменьшать гибель нейронов при ишемии и реперфузии мозга (рис. 2). Так, несложно рассчитать, что введение инсулина крысам предотвращает гибель 70.9% нейронов, а введение ингибиторов апоптоза и аутофазии гибель 37.3% и 58.4% нейронов при ишемии и реперфузии мозга соответственно. Эти данные показывают, что инсулин снижает гибель нейронов в лобной коре мозга как от аутофагии, так и апоптоза, хотя и не предотвращает ее, как в CA1 районе гиппокампа.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Аутофагии принадлежит важная роль в поддержании клеточного гомеостаза, основанном на тонкой регуляции баланса между биосинтезом и деградацией белков и других макромолекул. Аутофагия представляет собой катаболический путь, с помощью которого долгоживущие белки, не вовлеченные в выполнение важных функций, поврежденные клеточные органеллы и неправильно свернутые белки подвергаются деградации и вновь используются для поддержания гомеостаза клеток и их нормального функционирования. Однако многие ранее сформировавшиеся представления требуют значительного пересмотра. Так, по данным последних лет четко прослеживается участие аутофагических процессов в гибели нервных клеток, прежде всего нейронов гиппокампа и коры мозга при разных патологических процессах, это показано, в частности, при ишемии и реперфузии головного мозга. Защитные свойства многих нейропротекторов при этой патологии зависят от ингибирования ими аутофагических процессов [1–7]. При этом активация аутофагии в мозге при некоторых видах ишемического воздействия на него может носить защитный характер [8–12]. Но при достаточной силе ишемического и последующего реперфузионного воздействия на мозг активация аутофагии в острую фазу воздействия, очевидно, приводит к гибели нейронов мозга. Это не исключает возможности того, что на поздних сроках после ишемического воздействия аутофагия может способствовать сохранению жизнеспособности нейронов.
В настоящее время считается, что без понимания роли не только апоптотоза, но и аутофагии в гибели нервных клеток мозга и регуляции этих процессов нельзя достичь серьезных успехов в разработке подходов к лечению ишемических поражений мозга, в том числе инсультов [5, 16, 17].
Инсулин при его интраназальном введении является одним из наиболее перспективных нейропротекторов, однако в литературе нам не встретилось данных о его влиянии на аутофагическую гибель нейронов мозга при каких-либо формах ишемии и реперфузии. В нашей работе впервые показано, что интраназальное введение инсулина крысам в дозе 0.5 МЕ перед ишемическим воздействием и затем ежедневно в течение 7 дней реперфузии практически полностью предотвращает как аутофагическую, так и апоптотическую гибель нейронов в CA1 районе гиппокампа при глобальной ишемии переднего мозга и его последующей реперфузии. В лобной коре мозга нами отмечено снижение аутофагической и апоптотической гибели нейронов под влиянием интраназального введения 0.5 МЕ инсулина.
По нашим данным нейроны CA1 района гиппокампа значительно более чувствительны к воздействию ишемии и реперфузии, чем нейроны лобной коры мозга. Так, в настоящей работе найдено, что при 10-минутной двухсосудистой ишемии переднего мозга в сочетании с гипотензией и последующей реперфузией в течение 7 сут в CA1 районе гиппокампа выживает 58.3 ± 1.5% нейронов, а в лобной коре мозга – 74.2 ± 1.4%, различия достоверны, p < 0.001. Полученные нами данные согласуются с литературными. Бóльшая чувствительность к ишемическому и реперфузионному воздействию нейронов CA1 района гиппокампа, чем коры мозга была показана ранее в ряде работ (см., например, [31, 32]).
Как уже упоминалось в начале статьи, наиболее адекватным и перспективным способом введения инсулина является его интраназальное введение, при котором инсулин попадает непосредственно в мозг и практически только в мозг [18, 19]. При этом, как ни странно, нам не встретилось в литературе публикаций, кроме работ нашей лаборатории [23, 24], в которых бы исследовали эффекты интраназального введения инсулина животным, подвергнутым ишемии мозга и последующей реперфузии. Но есть немало работ, в которых животным с ишемией и реперфузией вводили интраназально инсулиноподобный фактор роста 1 (IGF-1) (см., например, [33–36]. В одной из этих работ [36] показана способность IGF-1 ингибировать активацию аутофагии при ишемии и реперфузии мозга. В этой работе [36] исследовалось действие активатора плазминогена (PLAT/tPA), вызывающего тромболизис при тромбоэмболическом инсульте у мышей. Было показано, что PLAT/tPA обладает способностью отщеплять связывающий IGF-1 белок-3 и таким образом высвобождать IGF-1, обладающий нейропротекторным эффектом благодаря способности взаимодействовать со своими рецепторами и ингибировать чрезмерную активацию аутофагии при экспериментальном ишемическом поражении мозга мышей.
В силу каких-то причин [37] нейропротекторные эффекты интраназального введения инсулина интенсивно изучают при болезни Альйгеймера и других нейродегенеративных болезнях, наряду с опытами на животных проводятся многочисленные клинические испытания [20–22]. Но при ишемии и реперфузии мозга изучают преимущественно защитные эффекты IGF-1. При этом инсулин может оказаться более перспективным нейропротектором для его возможного применения в клинической практике при ишемическом поражении мозга, чем IGF-1 [37].
Наша работа впервые показала, что инсулин способен уменьшать или даже предотвращать, если речь идет о нейронах CA1 района гиппокампа, не только апоптотическую, но и аутофагическую гибель нейронов при ишемии и реперфузии мозга. Это согласуется с данными о том, что инсулин способен ингибировать процессы аутофагии в экстраневральных органах и тканях – в скелетных мышцах здоровых людей [38], в хондроцитах [39], в сердце мышей с экспериментальным диабетом [40].
Наши данные об уменьшении инсулином апоптотической гибели нейронов мозга при ишемии и реперфузии согласуются с результатами Russo и соавт. [41]. Эти авторы, изучая воздействие интрацеребровентрикулярного введения инсулина крысам, показали, что этот протектор увеличивает общую жизнеспособность нейронов мозга, особенно в районе CA3 гиппокампа и предотвращает их апоптотическую гибель.
Большой интерес представляет выяснение вопроса о механизме предотвращения или уменьшения инсулином при его интраназальном введении аутофагической гибели нейронов мозга при ишемии и реперфузии этого органа. По-видимому, его эффект связан прежде всего с его способностью ингибировать АМФ-активируемую протеинкиназу (AMPK) и активировать протеинкиназу B (Akt) и mTOR. Так, нами было найдено, что инсулин ингибирует активность AMPK в культуре нейронов коры мозга [42]. А активация этой протеинкиназы, как известно, является триггером процессов аутофагии [43]. Наши результаты об ингибировании инсулином активности AMPK в нейронах коры мозга [42] согласуются с данными об ингибировании инсулином AMPK в гипоталамусе крыс [44] и в экстраневральных клетках и тканях (см., например, [45]). Кроме того, инсулин активирует протеинкиназы Akt1 и mTOR [42, 46]. А эти протеинкиназы ингибируют процессы аутофагии [7, 43]. По-видимому, модуляция инсулином активности протеинкиназ AMPK, Akt и mTOR играет важную роль в его способности предотвращать аутофагическую гибель нейронов при ишемии и реперфузии мозга.
Настоящая работа является начальным этапом изучения влияния инсулина на аутофагические процессы в ткани мозга при ишемии и реперфузии. Она показала, что такого рода исследования перспективны и актуальны, что способность инсулина при его интраназальном введении снижать или даже предотвращать аутофагическую гибель нейронов при этой патологии вносит большой вклад в его нейропротекторный эффект.
Список литературы
Zhou H, Wang J, Jiang J, Stavrovskaya IG, Li M, Li W, Wu Q, Zhang X, Luo C, Zhou S, Sirianni AC, Sarkar S, Kristal BS, Friedlander RM, Wang X (2014) N-acetyl-serotonin offers neuroprotection through inhibiting mitochondrial death pathways and autophagic activation in experimental models of ischemic injury. J Neurosci 34: 2967–2978. https://doi.org/10.1523/JNEUROSCI.1948-13.2014
Wang M, Li Y.-J, Ding Y, Zhang H-N, Sun T, Zhang K, Yang L, Guo Y-Y, Liu S-B, Zhao M-G, Qu Y-M (2016) Silibinin prevents autophagic cell death upon oxidative stress in cortical neurons and cerebral ischemia-reperfusion injury. Mol Neurobiol 53: 932–943. https://doi.org/10.1007/s12035-014-9062-5
Li L, Tian J, Long MK-W, Chen Y, Lu J, Zhou C, Wang T (2016) Protection against experimental stroke by ganglioside GM1 is associated with the inhibition of autophagy. PLoS One 11: e0144219. https://doi.org/10.1371/journal.pone.0144219
Li X, Wang M, Qin C, Fan W-H, Tian D-S, Liu J-L (2017) Fingolimod suppresses neuronal autophagy through the mTOR/p70S6K pathway and alleviates ischemic brain damage in mice. PloS One 12: e0188748. https://doi.org/10.1371/journal.pone.0188748
Nabavi, SF, Sureda A, Sanches-Silva A, Pandima DK, Ahmed T, Shahid M (2019) Novel therapeutic strategies for stroke: the role of autophagy. Critical Rev Clin Lab Sci 56 (3): 182–199. https://doi.org/10.1080/10408363.2019.1575333
Hu Y, Zhou H, Zhang H, Sui Y, Zhang Z, Zou Y, Li K, Zhao Y, Xie J, Zhang L (2022) The neuroprotective effect of dexmedetomidine and its mechanism. Front Pharmacol 13: 965661. eCollection 2022. https://doi.org/10.3389/fphar.2022.965661
Zhang H, Wang X, Chen W, Yang Y, Wang Y, Wan H, Zhu Z (2023) Danhong injection alleviates cerebral ischemia-reperfusion injury by inhibiting autophagy through miRNA-132-3p/ATG12 signal axis. J Ethnopharmacol 300:115724. https://doi.org/10.1016/j.jep.2022.115724
Carloni S, Balduini W (2020) Simvastatin preconditioning confers neuroprotection against hypoxia-ischemia induced brain damage in neonatal rats via autophagy and silent information regulator 1 (SIRT1) activation. Exp Neurol 324: 113117. https://doi.org/10.1016/j.expneurol.2019.113117
Li Q, Zhang T, Wang J, Zhang Z, Yu Zhai Y, Sun X (2014) Rapamycin attenuates mitochondrial dysfunction via activation of mitophagy in experimental ischemic stroke. Biochem Biophys Res Commun 4 (2): 182–188. https://doi.org/10.1016/j.bbrc.2014.01.032
Buckley KM, Hess DL, Sazonova IY, Periyasamy-Thandavan S, John R, Barrett JR, Kirks R, Grace H, Kondrikova G, Johnson MH, Hess DC, Schoenlein PV, Hoda MN, Hill WD (2014) Rapamycin up-regulation of autophagy reduces infarct size and improves outcomes in both permanent MCAL, and embolic MCAO, murine models of stroke. Exp Transl Stroke Med 6: 8. eCollection. https://doi.org/10.1186/2040-7378-6-8
Liu X, Tian F, Wang S, Wang F, Xiong L (2018) Astrocyte Autophagy Flux Protects Neurons Against Oxygen-Glucose Deprivation and Ischemic/Reperfusion Injury. Rejuvenation Res 215: 405–415. https://doi.org/10.1089/rej.2017.1999
Pineda-Ramírez N, Alquisiras-Burgos I, Ortiz-Plata A, Ruiz-Tachiquín M-E, Espinoza-Rojo M, Aguilera P (2020) Resveratrol activates neuronal autophagy ttrough AMPK in the ischemic brain. Mol Neurobiol 57 (2): 1055–1069. https://doi.org/10.1007/s12035-019-01803-6
Луговая АВ, Эмануэль ВС, Артемова АВ, Митрейкин ВФ (2020) Современные подходы к оценке биологических маркеров аутофагии и апоптоза при остром ишемическом инсульте. Соврем пробл науки и обр 4: 159–174. [Lugovaya AV, Emanuel VS, Artemova AV, Mitreikin VF (2020) Modern approaches to the assessment of biological markers of autophagy and apoptosis in acute ischemic stroke. Sovrem probl nauki i obr 4: 159–174. (In Russ)].https://doi.org/10.17513/spno.30017
Kuriakose D, Xiao Z (2020) Pathophysiology and treatment of stroke: Present status and future perspectives. Int J Mol Sci 21 (20): 7609. https://doi.org/10.3390/ijms21207609
Barthels D, Das H (2020) Current advances in ischemic stroke research and therapies. Biochim Biophys Acta. Mol Basis Dis 1866 (4): 165260. https://doi.org/10.1016/j.bbadis.2018.09.012
Campbell BCV, Khatri P (2020) Stroke. Lancet 396 (10244): 149–142. https://doi.org/10.1016/S0140-6736(20)31179-X
He C, Xu Y, Sun J, Li L, Zhang JH, Wang Y (2022) Autphagy and apoptosis in acute brain injuries: From mechanism to treatment. Antioxid Redox Signal. https://doi.org/10.1089/ars.2021.0094
Fan LW, Carter K, Beatt A, Pang Y (2019) Rapid transport of insulin to the brain following intranasal administration in rats. Neural Regen Res 14: 1046–1051. https://doi.org/10.4103/1673-5374.250624
Tashima T (2020) Shortcut approaches to substance delivery into the brain based on intranasal administration using nanodelivery strategies for insulin. Molecules 25 (21): 5188. https://doi.org/10.3390/molecules25215188
Craft S, Claxton A, Baker LD, Hanson AJ, Collerton B, Trittschuh EH, Dahl D, Caulder E, Neth B, Montine TJ, Jung Y, Maldjian J, Whitlow C, Friedman S (2017) Effects of regular and long-acting insulin on cognition and Alzheimer’s disease biomarkers: A pilot clinical trial. J Alzheimers Dis 57: 1325–1334. https://doi.org/10.3233/JAD-161256
Avgerinos KI, Kalaitzidis G, Malli A, Kalaitzoglou D, Myserlis PG, Lioutas VA (2018) Intranasal insulin in Alzheimer’s dementia or mild cognitive impairment. A systematic review. J Neurol 265: 1497–1510. https://doi.org/10.1007/s00415-018-8768-0
Novak P, Maldonado DAP, Novak V (2019) Safety and preliminary efficacy of intranasal insulin for cognitive impairment in Parkinson disease and multiple system atrophy: A double-blinded placebo-controlled pilot study. PLoS One 14: e0214364. https://doi.org/10.1371/journal.pone.0214364
Zorina II, Zakharova IO, Bayunova LV, Avrova NF (2018) Insulin Administration Prevents Accumulation of Conjugated Dienes and Trienes and Inactivation of Na+, K+-ATPase in the Rat Cerebral Cortex during Two-Vessel Forebrain Ischemia and Reperfusion. J Evol Biochem Phys 54:246–249. https://doi.org/10.1134/S0022093018030109
Зорина ИИ, Фокина ЕА, Захарова ИО, Баюнова ЛВ, Шпаков АО (2019) Особенности изменений перекисного окисления липидов и активности Na+, K+-АТФазы у старых крыс в условиях двухсосудистой церебральной ишемии/реперфузии. Успехи геронтологии 32 (6): 941–947. [Zorina II, Fokina EA, Zakharova IO, Bayunova LV, Shpakov AO (2019) Features of the changes in lipid peroxidation and activity of Na+/K+-ATPase in the brain of the aged rats in the conditions of two-vessel cerebral ischemia/reperfusion Adv Gerontol 32 (6):941–947. (In Russ)].
Paxinos G, Watson C (1998) The rat brain in stereotaxic coordinates. Fourth Edition. Acad. Press. San Diego, Calif. USA.
Molchanova SM, Moskvin AN, Zakharova IYu, Yurlova LA, Nosova IYu, Avrova NF (2005) effects of two-vessel forebrain ischemia and of administration of indomethacin and quinacrine on NA+, K+-ATpase activity in various rat brain areas. J Evol Biochem Physiol 41 (1): 39–46.
Sanderson TH, Wider JM (2013) 2-Vessel occlusion/hypotension: A rat model of global brain ischemia. J Vis Exp 76: e50173. https://doi.org/10.3791/50173
Luo T, Liu G, Ma H, Lu B, Xu H, Wang Y, Wu J, Ge P, Liang J (2014) Inhibition of autophagy via activation of PI3K/Akt pathway contributes to the protection of ginsenoside Rb1 against meuronal death caused by ischemic insults. Int J Mol Sci 15 (9): 15426–15442.https://doi.org/10.3390/ijms150915426
Cui D, Wang L, Qi A, Zhou Q, Zhang X, Jiang W. Propofol prevents autophagic cell death following oxygen and glucose deprivation in PC12 cells and cerebral ischemia-reperfusion injury in rats. PLoS One. 2012. 7 (4): e35324. https://doi.org/10.1371/journal.pone.00353241
Wen Y-D, Sheng R, Zhang L-S, Han R, Zhang X, Zhang X-D, Han F, Fukunaga K, Qin Z-H (2008) Neuronal injury in rat model of permanent focal cerebral ischemia is associated with activation of autophagic and lysosomal pathways Autophagy 4 (6): 762–769.https://doi.org/10.4161/auto.6412
Pylova SI, Majkowska J, Hilgier W, Kapuściński A (1989) Rapid decrease of high affinity ouabain binding sites in hippocampal CA1 region following short-term global cerebral ischemia in rat. Albrecht J Brain Res 490 (1): 170–173. https://doi.org/10.1016/0006-8993(89)90446-0
Zhu H, Yoshimoto T, Imajo-Ohmi S, Dazortsava M, Mathivanan A, Yamashima T (2012) Why are hippocampal CA1 neurons vulnerable but motor cortex neurons resistant to transient ischemia? J Neurochem 120 (4): 574–585. https://doi.org/10.1111/j.1471-4159.2011.07550.x
Gong P, Zou Y, Zhang W, Tian Q, Han S, Xu Z, Chen Q, Wang X, Li M (2021) The neuroprotective effects of insulin-like growth factor 1 via the Hippo/YAP signaling pathway are mediated by the PI3K/AKT cascade following cerebral ischemia/reperfusion injury. Brain Res Bul 177: 373–387. https://doi.org/10.1016/j.brainresbull.2021.10.017
Shen H, Gu X, Wei ZZ, Wu A, Liu X, Wei L (2021) Combinatorial intranasal delivery of bone marrow mesenchymal stem cells and insulin-like growth factor-1 improves neurovascularization and functional outcomes following focal cerebral ischemia in mice. Exp Neurol 337: 113542. https://doi.org/10.1016/j.expneurol.2020.113542
Zhang D, Yuan Y, Zhu J, Zhu D, Li C, Cui W, Wang L, Ma S, Duan S, Liu B (2021) Insulin-like growth factor 1 promotes neurological functional recovery after spinal cord injury through inhibition of autophagy via the PI3K/Akt/mTOR signaling pathway. Exp Ther Med 22 (5): 1265. https://doi.org/10.3892/etm.2021.10700
Thiebaut AM, Buendia I, Ginet V, Lemarchand E, Boudjadja MB, Hommet Y, Lebouvier L, Lechevallier C, Maillasson M, Hedou E, Déglon N, Oury F, Rubio M, Montaner J, Puyal J, Vivien D, Roussel BD (2022) Thrombolysis by PLAT/tPA increases serum free IGF1 leading to a decrease of deleterious autophagy following brain ischemia. Autophagy 18 (6): 1297–1317. https://doi.org/10.1080/15548627.2021.1973339
Lioutas VA, Alfaro-Martinez F, Bedoya F, Chung CC, Pimentel DA, Novak V (2015) Intranasal insulin and insulin-like growth factor 1 as neuroprotectants in acute ischemic stroke. Transl Stroke Res 6 (4): 264–275. https://doi.org/10.1007/s12975-015-0409-7
Moller AB, Voss TS, Vendelbo MH, Pedersen SB, Moller N, Jessen N (2018) Insulin inhibits autophagy signaling independent of counter-regulatory hormone levels, but does not affect the effects of exercise. J Appl Physiol 125: 1204–1209. https://doi.org/10.1152/japplphysiol.00490.2018
Ribeiro M, López de Figueroa P, Blanco FJ, Mendes AF, Caramés B (2016) Insulin decreases autophagy and leads to cartilage degradation. Osteoarthritis Cartilage 24: 731–739. https://doi.org/10.1016/j.joca.2015.10.017
Pires KM, Torres NS, Buffolo M, Gunville R, Schaaf C, Davis K, Selzman CH, Gottlieb RA, Boudina S (2019) Suppression of cardiac autophagy by hyperinsulinemia in insulin receptor-deficient hearts is mediated by insulin-like growth factor receptor signaling. Antioxid Redox Signal 31 (6): 444–457. https://doi.org/10.1089/ars.2018.7640
Russo V, Candeloro P, Malara N, Perozziello G, Iannone M, Scicchitano M, Mollace R, Musolino V, Gliozzi M, Carresi C (2019) Key role of cytochrome C for apoptosis detection using Raman microimaging in an animal model of brain ischemia with insulin treatment. Appl Spectrosc 73 (10): 1208–1217. https://doi.org/10.1177/0003702819858671
Zakharova IO, Sokolova TV, Bayunova LV, Zorina II, Rychkova MP, Shpakov AO, Avrova NF (2019) The protective effect of insulin on rat cortical neurons in oxidative stress and its dependence on the modulation of Akt, GSK-3beta, ERK1/2, and AMPK activities. Int J Mol Sci 20 (15): E3702. https://doi.org/10.3390/ijms20153702
Saikia R, Joseph J (2021) AMPK: a key regulator of energy stress and calcium-induced autophagy. J Mol Med (Berl) 99 (11): 1539–1551. https://doi.org/10.1007/s00109-021-02125-8
Minokoshi Y, Alquier T, Furukawa N, Kim YB, Lee A, Xue B, Mu., Foufelle F, Ferré P, Birnbaum MJ, Stuck BJ, Kahn. B. 2004. AMP-kinase regulates food intake by responding to hormonal and nutrient signals in the hypothalamus. Nature 428 (6982): 569–574. https://doi.org/10.1038/nature02440
Valentine RT, Coughlan KA, Ruderman NB, Saha AK (2014) Insulin inhibits AMPK activity and phodphorylatesAMPK Ser 485/491 through Akt in hepatocytes, myotubes and incubated rat skeletal muscle. Arch Biochem Biophys 562: 62–69. https://doi.org/10.1016/j.abb.2014.08.013
Han J, Wang B, Xiao Z, Gao Y, Zhao Y, Zhang J, Chen B, Wang X, Dai J (2008) Mammalian target of rapamycin (mTOR) is involved in the neuronal differentiation of neural progenitors induced by insulin. Mol Cell Neurosci 39 (1): 118–124. https://doi.org/10.1016/j.mcn.2008.06.003
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


