Журнал эволюционной биохимии и физиологии, 2022, T. 58, № 1, стр. 43-50
ВЛИЯНИЕ КРАТКОСРОЧНОЙ РАНЖИРОВАННОЙ ГИПОКСИИ НА ФУНКЦИОНАЛЬНЫЕ И МОРФОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ ГЕМОЦИТОВ ТИХООКЕАНСКОЙ УСТРИЦЫ CRASSOSTREA GIGAS (THUNBERG, 1793)
Е. С. Кладченко 1, *, А. Ю. Андреева 1, Т. А. Кухарева 1
1 Институт биологии южных морей им. А.О. Ковалевского РАН
Севастополь, Россия
* E-mail: kladchenko_ekaterina@bk.ru
Поступила в редакцию 28.05.2021
После доработки 27.09.2021
Принята к публикации 20.10.2021
- EDN: ACGGEM
- DOI: 10.31857/S004445292201003X
Аннотация
При помощи методов проточной цитометрии и световой микроскопии исследовано влияние краткосрочной (24 ч) ранжированной гипоксии на морфофункциональные показатели гемоцитов тихоокеанской устрицы (Crassostrea gigas). Контрольная группа содержалась при 100% уровне насыщения воды кислородом, экспериментальные животные – при умеренной (30% насыщение кислородом) и глубокой гипоксической нагрузке (3% насыщение кислородом). Показано, что гипоксия не оказывала влияния на морфометрические характеристики гемоцитов, однако, индуцировала существенные изменения в функциональных параметрах клеток и приводила к сдвигам клеточного состава гемолимфы. У устриц, содержащихся в условиях умеренного дефицита кислорода, зафиксировано развитие компенсаторного ответа на гипоксию: увеличение числа гранулоцитов на 20%, усиление спонтанной продукции активных форм кислорода (АФК) агранулоцитов (на 40%) и гранулоцитов (на 90%). Глубокая кратковременная гипоксия достоверно ингибировала способность гемоцитов к генерации окислительного взрыва и индуцировала снижение относительного числа гранулярных клеток (процент от общего числа клеток в гемолимфе), что свидетельствует о неспособности устриц поддерживать нормальное функциональное состояние при 3% уровне насыщения воды кислородом.
Дефицит кислорода является одним из наиболее значимых факторов окружающей среды, оказывающих влияние на жизнедеятельность гидробионтов [1]. В литоральных и сублиторальных зонах гипоксия может формироваться в результате естественных циклов колебания уровня растворенного кислорода или эвтрофикации [2]. Длительность гипоксического воздействия в естественных условиях может варьировать от нескольких часов до нескольких месяцев. Устойчивая гипоксия считается основной причиной снижения биоразнообразия водной среды обитания [3]. Краткосрочная гипоксия, в свою очередь, может негативно влиять на функциональное состояние гидробионтов. Воздействию гипоксии в особенности подвержены бентосные и малоподвижные виды гидробионтов, в том числе и двустворчатые моллюски [4]. Стоит отметить, что многие виды двустворчатых моллюсков интенсивно выращиваются по всему миру, приобретая не только биологическую, но и экономическую значимость [5]. Тихоокеанская устрица (Crassostrea gigas, Thunberg 1973) считается одним из основных мировых объектов марикультуры, что объясняется ее высокой скоростью роста, эвригалинностью, широким адаптивным потенциалом к дефициту кислорода и колебанию температуры [6]. Оптимальными условиями кислородного режима для гидробионтов и для двустворчатых моллюсков, в частности, является концентрация растворенного кислорода в воде на уровне 7.5–9 мг О2 л–1. Однако C. gigas зачастую населяют мелководные прибрежные зоны, для которых характерны эвтрофикация и плохое перемешивание воды, вследствие чего такие зоны могут становиться гипоксичными [7–9]. Отмечено, что при снижении концентрации кислорода ниже 3 мг О2 л–1 в организме устриц наблюдались различные физиологические нарушения, низкая сопротивляемость бактериальным патогенам, снижение скорости роста и уровня выживаемости отдельных особей [10–14].
В Черном море тихоокеанская устрица культивируется более 40 лет [15]. Для выращиваемых видов большое значение имеет понимание механизмов и последствий воздействия естественных факторов среды на иммунную систему. Последнее обусловливает высокий интерес к изучению вопросов влияния стрессовых факторов окружающей среды на способность иммунитета противостоять инфекционным агентам [16]. Гемоциты, циркулирующие в гемолимфе моллюсков, считаются основным типом клеток, отражающим физиологический статус организма, вследствие своей обширной функциональной роли, состоящей в участии в процессах восстановления раковины, пищеварения, транспорта питательных веществ и внутренних защитных иммунных реакций [16–19].
Клеточный иммунный ответ моллюсков включает в себя фагоцитоз, инкапсуляцию, ферментативную деструкцию патогенов, а также выброс активных форм кислорода (АФК) [20]. В основе гуморального компонента иммунной системы двустворчатых моллюсков лежит продукция лектинов С-типа, антимикробных и пептидогликан-распознающих белков и некоторых других соединений [21–23]. Влиянию гипоксии на функциональное состояние гемоцитов и их способности к иммунному ответу посвящено множество работ. Так, инкубация Perna viridis в условиях дефицита кислорода индуцирует снижение продукции АФК [23, 24], с другой стороны у Mytilus galloprovincialis, Mytilus coruscus, Chlamys farreri краткосрочная гипоксия приводит к увеличению данного показателя [25–27]. Известно, что дефицит кислорода приводит к снижению общего числа гемоцитов [24, 25, 28, 29] и изменению их соотношения в гемолимфе [25, 26]. Соотношение типов гемоцитов рассматривают как показатель эффективности клеточного иммунного статуса организма, поскольку гранулярные гемоциты в большей степени способны к иммунному ответу в сравнении с агранулярными [30]. Вместе с тем, доля гранулярных клеток у Mytilus coruscus снижалась после инкубации при 2 мг О2 л–1 [25], а у Mytilus galloprovincialis после суточной экспозиции при 0.3 мг О2 л–1 данный показатель увеличился [26]. Основываясь на представленных данных, можно предположить, что гипоксическое воздействие в зависимости от степени и длительности может оказывать как стимулирующий, так и угнетающий эффект на клеточный иммунный компонент моллюсков. Границы адаптивного потенциала к недостатку кислорода особенно важно оценивать для объектов массовой марикультуры, поскольку в производственном цикле на ферме во время транспортировки, сортировки и перераспределения по садкам, моллюски часто сталкиваются с краткосрочным дефицитом кислорода, продолжительностью до 24 ч. Вместе с тем, непродолжительное, но глубокое гипоксическое воздействие может выходить за границы адаптивного потенциала объектов культивирования.
Цель настоящей работы – исследовать влияние краткосрочной гипоксии различной степени на морфофункциональные характеристики клеток гемолимфы у массового объекта марикультуры – двустворчатого моллюска Crassostrea gigas (Thunberg, 1793).
МАТЕРИАЛЫ И МЕТОДЫ
Тихоокеанских устриц (C. gigas, n = 30, массой 8.6 ± 0.4 г, длина раковины 25.4 ± 1.4 мм) получили с устрично-мидийной фермы (Севастопольская бухта, г. Севастополь). Для адаптации к лабораторным условиям и снятия стресса после транспортировки устриц содержали в течение недели в емкостях с проточной морской водой (содержание кислорода – 7.9 мг/л (100% насыщения воды кислородом); температура 22°С, соленость 19.5‰, pH 8.1 ± 0.01). В период акклиматизации моллюсков кормили смесью микроводорослей (5–10 мл смеси на каждые 50 л аквариумной воды, концентрация клеток 2–3 × 106 на мл). Контрольную группу моллюсков (n = 10) содержали при концентрации кислорода 7.9 мг/л. Гипоксию in vivo создавали путем продувания морской воды газообразным азотом в течение 1.5–2 ч до достижения концентрации растворенного кислорода 30% (концентрация кислорода – 2.4 мг/л) (n = 10) и 3% (концентрация кислорода – 0.2 мг/л) (n = 10) от контрольного уровня. После достижения желаемого уровня гипоксического воздействия моллюсков содержали в воде с дефицитом кислорода в течение суток. Концентрацию растворенного кислорода в экспериментальных и контрольных аквариумах контролировали при помощи кислородомера Ohaus Starter 300 D (США), оборудованного температурным датчиком. Постоянство концентрации растворенного кислорода в экспериментальных аквариумах достигалось за счет периодической аэрации воды. Соленость и рН контролировали при помощи солемера ST20S (Ohaus, США) и рН-метра ST2100-F (Ohaus, США). Уровень рН морской воды, соленость и температура были идентичны у контрольной и экспериментальных групп и соответствовали периоду акклимации.
По окончании 24 ч воздействия гипоксии проводили отбор гемолимфы. Образцы гемолимфы (0.5–1 мл) отбирали из сердца стерильным шприцем, трижды отмывали в стерильной фильтрованной морской воде (300 g, 5 мин). В анализе проводили индивидуальный анализ проб, полученных от одного моллюска. Для оценки морфометрических характеристик клеток из осажденных гемоцитов готовили мазки и окрашивали по методу Паппенгейма [31]. На каждом мазке анализировали не менее 1000 клеток. У каждого гемоцита оценивали морфологические показатели и измеряли наибольший диаметр ядра и клетки (без учета псевдоподий). Ядерно-плазматическое отношение рассчитывали как отношение диаметра ядра к диаметру клетки [32, 33]. Функциональные характеристики гемоцитов анализировали методом проточной цитометрии (цитометр FC500, Beckman Coulter) при помощи программы Flowing Software 5.2. Для оценки содержания ДНК и пролиферативной активности в клетках гемоциты окрашивали красителем SYBR Green I (Sigma Aldrich) по методике, описанной ранее [34]. Идентификацию типов гемоцитов и определение их процентного содержания относительно общего числа клеток в суспензии проводили на двухпараметрических цитограммах на основании распределения SYBR Green-позитивных частиц по относительному размеру (прямое рассеяние, FS) и гранулярности (боковое рассеяние, SS). Уровень смертности гемоцитов определяли с использованием флуоресцентного красителя йодистого пропидия (PI, Sigma Aldrich) [32]. Способность клеток гемолимфы к спонтанной продукции активных форм кислорода оценивали по флуоресценции красителя 2–7-дихлорфлуоресцеин-диацетат (DCF-DA; Merck, Германия) по стандартному протоколу окрашивания [32].
Статистическую обработку результатов исследования проводили в программе RStudio V. 4.0.5. Тест Колмогорова–Смирнова показал, что распределение размерных характеристик гемоцитов не подчиняется закону нормального распределения. Для анализа значимости гипотезы о наличии различий между выборками результатов микроскопических исследований применяли U-критерий Манна–Уитни. Результаты цитометрических исследований анализировались при помощи дисперсионного анализа (One way ANOVA) и теста Тьюки (Tukey). Критический уровень значимости был принят за 0.05. Результаты представлены в виде ${{\bar {x}}}$ ± SE (средняя и ошибка среднего).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Методом световой микроскопии в гемолимфе устриц идентифицировали 3 типа клеток – агранулоциты, гиалиноциты и гранулоциты (рис. 1a–c). Агранулоциты – клетки наименьшего размера диаметром 8.9 ± 0.4 мкм. Морфологическими особенностями агранулоцитов были следующие: преимущественно округлая форма, высокое ядерно-плазматическое отношение (0.6 ± 0.03 у.е.), отсутствие гранулярных включений в цитоплазме и псевдоподий.
Рис. 1.
Морфологическая характеристика гемоцитов Тихоокеанской устрицы (Crassostrea gigas) в условиях нормоксии и гипоксии. (a) Нормоксия. (b) Морфология клеток гемолимфы в условиях 30%-ного насыщения воды кислородом. (с) Морфология клеток гемолимфы при 3%-ном насыщении воды кислородом. 1 – агранулоциты, 2 – гиалиноциты, 3 – гранулоциты. Окраска мазков проводилась по комбинированному методу Паппенгейма. Мазки анализировались при помощи светового микроскопа (Biomed PR-2 Lum), оборудованного камерой (Levenhuk C NG Series). Шкала – 10 мкм.
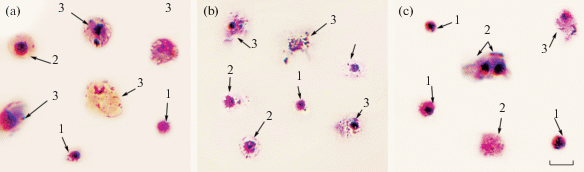
Клетки с наибольшим диаметром – гранулоциты, имели низкое ядерно-плазматическое отношение (0.4 ± 0.04 у.е.), цитоплазма содержала базофильные и эозинофильные гранулярные включения, а ядро располагалось преимущественно ацентрично. Кроме этого, гранулярные клетки формировали псевдоподии. Диаметр гиалиноцитов составлял 10.2 ± 0.8 мкм, диаметр ядра 5.7 ± ± 0.4 мкм. Гиалиноциты, как и гранулоциты, имели псевдоподии, но в цитоплазме гранулярные включения отсутствовали, а ядро располагалось преимущественно в центре клетки. Пик флуоресценции ДНК-специфического красителя SYBR Green I для контрольной и экспериментальных групп соответствовал диплоидному набору хромосом без признаков деления (рис. 2a). Методом проточной цитометрии, на основании распределения частиц по прямому (FS) и боковому (SS) рассеянию, было установлено наличие 3 субпопуляций клеток с различным относительным размером и уровнем гранулярности (рис. 2b). В гемолимфе устриц преобладали агранулярные клетки – агранулоциты (37.5 ± 14.2%) и гиалиноциты (58.8 ± 15.7%). Относительное число гранулоцитов контрольной пробы составило 8.8 ± 4.6%. Подробнее классификация типов гемоцитов описана в нашей предыдущей работе [35].
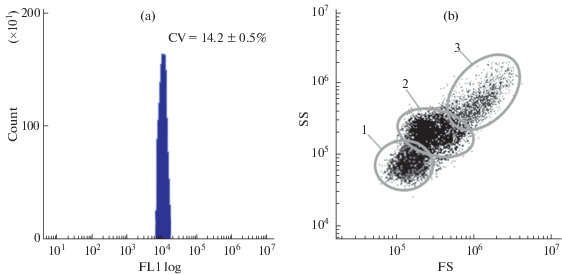
Рис. 2.
Идентификация субпопуляций гемоцитов Тихоокеанской устрицы методом проточной цитометрии. (a) Гистограмма содержания ДНК в гемоцитах устриц. Клетки суспендировали в стерильной фильтрованной морской воде (концентрация клеток 1– 2 × 106 клеток мл–1), инкубировали с SYBR Green I в течение 40 мин в темноте (финальная концентрация красителя в пробе 10 мкМ). (b) Распределение клеток гемолимфы устриц на основании величин относительного размера и гранулярности, демонстрирующее три популяции гемоцитов (1 – агранулоциты; 2 – гиалиноциты; 3 – гранулоциты). Графики представлены для контрольной группы моллюсков (n = 10).
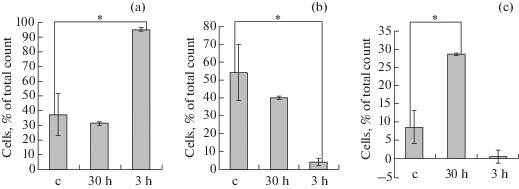
Суточная гипоксия не оказывала влияния на морфометрические характеристики гемоцитов устриц, однако существенно повлияла на соотношение типов гемоцитов в гемолимфе (рис. 3). Инкубация в условиях 30%-ного насыщения воды кислородом привела к значительному увеличению относительного числа гранулоцитов (на 20%, p < 0.05) (рис. 3с), доля агранулоцитов и гиалиноцитов при этом не изменилась. После суток в условиях 3%-ного содержания кислорода от уровня нормоксии в гемолимфе устриц на 58% возросло относительное содержание агранулоцитов (рис. 3a), содержание гиалиноцитов при этом снизилось на 50% (рис. 3b). Уровень смертности клеток гемолимфы не превышал 2% как в контрольных, так и в опытных группах. Изменений пролиферативной активности клеток гемолимфы при гипоксии не зафиксировано.
Рис. 3.
Влияние краткосрочной гипоксии на соотношение типов гемоцитов Тихоокеанской устрицы (Crassostrea gigas). (a) Изменение относительного числа агранулоцитов. (b) Изменение относительного числа гиалиноцитов. (с) Изменение относительно числа гранулоцитов. Моллюсков разделили на три группы, содержащихся в воде с различным уровнем растворенного кислорода: с – контрольная группа, 100%-ное насыщение кислородом (n = 10); 30 h – экспериментальная группа, 30%-ное насыщение воды кислородом (n = 10); 3 h – экспериментальна группа, 3%-ное насыщение воды кислородом (n = 10). Для идентификации типов клеток на проточном цитометре Beckman Coulter FC500 готовую суспензию гемоцитов окрашивали ДНК-красителем SYBR Green I (финальная концентрация в пробе 10 мкмоль л–1, время инкубации – 40 мин в темноте). Соотношение типов клеток оценивали по гистограмме распределения FSC/SSC, * – достоверные различия между контрольной и экспериментальной группами (p < 0.05).
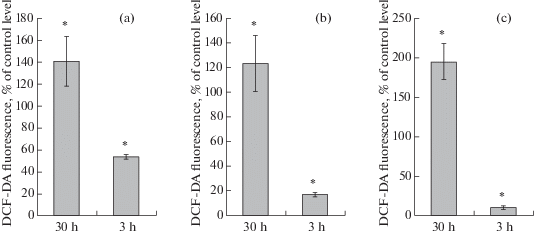
Инкубация устриц в условиях 30%-ного насыщения воды кислородом привела к усилению спонтанной продукции активных форм кислорода: у агранулоцитов в среднем на 40% (рис. 4a), а гранулоцитов более чем на 90%. Вместе с тем умеренная гипоксическая нагрузка не оказала существенного влияния на продукцию АФК гиалиноцитами. Экспозиция при 3%-ном насыщении воды кислородом ингибировала продукцию АФК всех типов клеток (рис. 4).
Рис. 4.
Влияние дефицита кислорода на способность гемоцитов Тихоокеанской устрицы (Crassostrea gigas) к спонтанной продукции АФК. (a) Aгранулоциты. (b) Гиалиноциты. (c) Гранулоциты. Устрицы содержались в течение 24 ч в условиях дефицита кислорода: 30 h – экспериментальная группа, 30%-ное насыщение воды кислородом (n = 10); 3 h – экспериментальна группа, 3%-ное насыщение воды кислородом (n = 10). Способность гемоцитов к спонтанной продукции АФК оценивали по флуоресценции клеток, окрашенных красителем DCF-DA. Финальная концентрация красителя в пробе составляла 10 мкмоль л–1. Флуоресценция красителя анализировалась в канале FL1 (зеленая область спектра). Уровень флуоресценции красителя DCF-DA на графике представлен как % от данного показателя в контрольных пробах. * – достоверность различий между контрольной и экспериментальной группой (p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что в результате воздействия дефицита кислорода у двустворчатых моллюсков часто наблюдается снижение общего числа циркулирующих гемоцитов, а также происходят изменения в соотношении типов гемоцитов в гемолимфе [23, 25, 28]. В нашем исследовании более глубокая гипоксическая нагрузка (3% от уровня нормоксии) привела к снижению доли гранулоцитов и гиалиноцитов, и увеличению доли агранулоцитов в гемолимфе устриц. Противоположный эффект – увеличение доли гранулоцитов, зафиксирован в группе устриц после инкубации при 30%-ном насыщении кислородом.
Среди возможных причин, лежащих в основе изменений клеточного состава гемолимфы моллюсков, наиболее существенны следующие:
1. Пролиферативная активность гемоцитов и их предшественников [25];
2. Гибель гемоцитов определенного типа [23];
3. Функциональные переходы одного типа гемоцитов в другой (дегрануляция, появление гранул) [36, 37];
4. Миграция гемоцитов в ткани [38].
Предположительно, агранулярные клетки – это незрелые гемоциты, пролиферация которых может осуществляться непосредственно в гемолимфе [39–42]. В условиях краткосрочного эксперимента маловероятно, что изменение в соотношении типов гемоцитов может быть вызвано пролиферативной активностью в гемопоэтической ткани. Это подтверждается данными об отсутствии в образцах гемолимфы устриц делящихся гемоцитов в обеих экспериментальных группах. Аналогичным образом не выявлены изменения в доле мертвых клеток в гемолимфе при гипоксии. При этом для гранулоцитов характерна дегрануляция и, как следствие, увеличение относительной доли агранулярных клеток в гемолимфе [43]. Не следует исключать также возможной миграции гранулоцитов в ткани, поскольку известно, что данный тип клеток способен активно перемещаться из сосудов гемолимфы в жабры, мантию и другие ткани и органы моллюсков [44]. Таким образом, краткосрочные изменения клеточного состава гемолимфы при гипоксии реализуются быстрыми адаптивными перестройками, среди которых наиболее вероятными стоит считать дегрануляцию гранулоцитов и/или их миграцию в ткани при глубокой гипоксии и функциональный переход агранулоцитов в гранулоциты при умеренном недостатке кислорода. Стоит отметить, что увеличение доли гранулярных клеток при 30%-ном насыщении воды кислородом и ее снижение после суточного воздействия глубокой гипоксии (3% насыщения воды кислородом от уровня нормоксии), вероятно, свидетельствуют о развитии компенсаторного адаптивного ответа у C. gigas в условиях неглубокой гипоксической нагрузки. Последнее также подтверждается увеличением уровня флуоресценции красителя DCF-DA у агранулоцитов и гранулоцитов после инкубации устриц при 30%-ном содержании кислорода и его снижением у всех типов клеток после 24 ч гипоксии при 3%-ном насыщении. Выявленные нами изменения в уровне спонтанной продукции АФК, в целом, согласуются с литературными данными. Так, у Mytilus coruscus и Chlamys farreri дефицит кислорода индуцировал увеличение продукции АФК [25], а у Perna viridis зафиксирован обратный эффект [23, 24]. Механизмы, лежащие в основе влияния дефицита кислорода на способность гемоцитов генерировать окислительный взрыв, остаются предметом дискуссии. Снижение продукции АФК объясняют метаболической корректировкой при участии HIF-фактора в ответ на гипоксическое воздействие [45]. Вероятно также, что обнаруженное нами увеличение концентрации АФК в гемоцитах устрицы является следствием реорганизации дыхательной цепи митохондрий, поскольку известно, что митохондрии являются основным источником АФК в гемоцитах C. gigas, и недостаток кислорода способен вызывать изменения в цепи переносчиков электронов [46, 47]. Это предположение косвенно подтверждается данными о том, что уровень внутриклеточного содержания АФК в клетках гемолимфы устриц коррелирует с изменениями величины митохондриального потенциала при гипоксии [14].
Таким образом, результаты настоящей работы свидетельствуют о том, что характер изменений параметров гемолимфы устриц определяется не только длительностью гипоксического воздействия, но и концентрацией растворенного кислорода. Повышение относительного числа гранулоцитов и способности генерировать окислительный взрыв, вероятно, свидетельствует о развитии компенсаторного ответа у тихоокеанской устрицы в результате воздействия умеренного недостатка кислорода. Вероятно, кратковременная инкубация в условиях 30%-ного уровня насыщения воды кислородом находится в переделах толерантности C. gigas к гипоксии. Глубокая гипоксия, в свою очередь, индуцировала снижение доли гранулоцитов в гемолимфе и подавление продукции активных форм кислорода в гемоцитах, оказывая угнетающее действие на клеточный иммунный ответ у устриц.
Список литературы
Paulmier A, Ruiz-Pino D (2009) Oxygen minimum zones (OMZs) in the modern ocean. Prog Oceanogr 80 (3–4): 113–128. https://doi.org/10.1016/j.pocean.2008.08.001
Howarth R, Chan F, Conley DJ, Garnier J, Doney SC, Marino R, Billen G (2011) Coupled biogeochemical cycles: eutrophication and hypoxia in temperate estuaries and coastal marine ecosystems. Front Ecol Environ 9 (1): 18–26. https://doi.org/10.1890/100008
Sirakov I, Slavcheva-Sirakova D (2015) The influence of climate changes on the hydrobionts: a review. JBES 6 (3): 315–329.
Weinstock JB, Collin R (2021) Hypoxia and warming are associated with reductions in larval bivalve abundance in a tropical lagoon. Mar Ecol Prog Ser 662: 85–95. https://doi.org/10.3354/meps13630
Wijsman JWM, Troost K, Fang J, Roncarati A (2019) Global production of marine bivalves. Trends and challenges. In: Goods and services of marine bivalves (7–26). Springer, Cham.
Harris J (2008) Pacific oyster, Crassostrea gigas (Thunberg, 1793). Aquatic Invasive Species Profile Aquat Invasions: 1–12.
Gray JS, Wu RSS, Or YY (2002) Effects of hypoxia and organic enrichment on the coastal marine environment. Mar Ecol Prog Ser 238: 249–279. https://doi.org/10.3354/meps238249
Melzner F, Thomsen J, Koeve W, Oschlies A, Gutowska MA, Bange HW, Körtzinger A (2013) Future ocean acidification will be amplified by hypoxia in coastal habitats. Mar Biol 160 (8): 1875–1888. https://doi.org/10.1007/s00227-012-1954-1
Wu RS (2002) Hypoxia: from molecular responses to ecosystem responses. Mar Pollut Bull 45 (1–12): 35–45. https://doi.org/10.1016/s0025-326x (02)00061-9
Baker SM, Mann R (1992) Effects of hypoxia and anoxia on larval settlement, juvenile growth, and juvenile survival of the oyster Crassostrea virginica. Biol 182 (2): 265–269. https://doi.org/10.1128/AEM.00317-08
Macey BM, Achilihu IO, Burnett KG, Burnett LE (2008) Effects of hypercapnic hypoxia on inactivation and elimination of Vibrio campbellii in the Eastern oyster, Crassostrea virginica. Appl Environ Microbio 74 (19): 6077–6084. https://doi.org/10.1016/j.jprot.2018.12.009
Khan B, Ringwood AH (2016) Cellular biomarker responses to hypoxia in eastern oysters and Atlantic ribbed marsh mussels. Mar Ecol Prog Ser 546: 123–133. https://doi.org/10.3354/meps11622
Sokolov EP, Markert S, Hinzke T, Hirschfeld C, Becher D, Ponsuksili S, Sokolova IM (2019) Effects of hypoxia-reoxygenation stress on mitochondrial proteome and bioenergetics of the hypoxia-tolerant marine bivalve Crassostrea gigas. J Proteom 194: 99–111. https://doi.org/10.1016/j.jprot.2018.12.009
Andreyeva AY, Gostyukhina OL, Kladchenko ES, Vodiasova EA, Chelebieva ES (2021) Acute hypoxic exposure: effect on hemocyte functional parameters and antioxidant potential in gills of the Pacific oyster, Crassostrea gigas. Mar Environ Res 105389. https://doi.org/10.1016/j.marenvres.2021.105389
Zolotarev V (1996) The Black Sea ecosystem changes related to the introduction of new mollusc species. Marine Ecology 17: 227–236. https://doi.org/10.1111/j.1439-0485.1996.tb00504.x
Allam B, Raftos D (2015) Immune responses to infectious diseases in bivalves. J Invertebr Pathol 131: 121–136. https://doi.org/10.1016/j.jip.2015.05.005
FısıER W.S. (1988) Environmental influence on bivalve hemocyte function. Am Fish Soc Symp 18: 225–237.
Auguste M, Balbi T, Ciacci C, Canonico B, Papa S, Borello A, Canesi L (2020) Shift in immune parameters after repeated exposure to nanoplastics in the marine bivalve Mytilus, Front Immunol 11: 426. https://doi.org/10.3389/fimmu.2020.00426
Loker ES, Adema CM, Zhang SM, Kepler TB (2004) Invertebrate immune systems–not homogeneous, not simple, not well understood. Immunol Rev 198 (1): 10–24. https://doi.org/10.1111/j.0105-2896.2004.0117.x
Allam B, Espinosa EP (2016) Bivalve immunity and response to infections: are we looking at the right place? Fish Shellfish Immunol 53: 4–12. https://doi.org/10.1016/j.fsi.2016.03.037
Wootton EC, Dyrynda EA, Ratcliffe NA (2003) Bivalve immunity: comparisons between the marine mussel (Mytilus edulis), the edible cockle (Cerastoderma edule) and the razor-shell (Ensis siliqua). Fish Shellfish Immunol 15 (3): 195–210. https://doi.org/ (02)00161-4https://doi.org/10.1016/S1050-4648
Rodrigues J, Brayner FA, Alves LC, Dixit R, Barillas-Mury C (2010) Hemocyte differentiation mediates innate immune memory in Anopheles gambiae mosquitoes. Science 329 (5997): 1353–1355. https://doi.org/10.1126/science.1190689
Wang Y, Hu M, Shin PK, Cheung SG (2011) Immune responses to combined effect of hypoxia and high temperature in the green-lipped mussel Perna viridis. Mar Pollut Bull 63: 201—208. https://doi.org/10.1016/j.marpolbul.2011.05.035
Wang Y, Hu M, Cheung SG, Shin PKS, Lu W, Li J (2012) Immune parameter changes of hemocytes in green-lipped mussel Perna viridis exposure to hypoxia and hyposalinity. Aquaculture 356: 22–29. https://doi.org/10.1016/j.aquaculture.2012.06.001
Sui Y, Kong H, Shang Y, Huang X, Wu F, Hu M, Wang Y (2016) Effects of short-term hypoxia and seawater acidification on hemocyte responses of the mussel Mytilus coruscus. Mar Pollut Bull 108: 46–52. https://doi.org/10.1016/j.marpolbul.2016.05.001
Andreyeva AY, Efremova ES, Kukhareva TA (2019) Morphological and functional characterization of hemocytes in cultivated mussel (Mytilus galloprovincialis) and effect of hypoxia on hemocyte parameters. Fish Shellfish Immunol 89: 361–367.
Chen MY, Yang HS, Delaporte M, Zhao SJ, Xing K (2007) Immune responses of the scallop Chlamys farreri after air exposure to different temperatures. J Exp Mar Biol Ecol 345 (1): 52–60. https://doi.org/10.1016/j.jembe.2007.01.007
Nogueira L, Mello DF, Trevisan R, Garcia D, da Silva Acosta D, Dafre AL, de Almeida EA (2017) Hypoxia effects on oxidative stress and immunocompetence biomarkers in the mussel Perna perna (Mytilidae, Bivalvia). Mar Environ Res 126: 109–115. https://doi.org/10.1016/j.marenvres.2017.02.009
Matozzo V, Monari M, Foschi J, Papi T, Cattani O, Marin MG (2005) Exposure to anoxia of the clam Chamelea gallina: I. Effects on immune responses. J Exp Mar Biol 325 (2): 163–174. https://doi.org/10.1016/j.jembe.2005.04.030
Wang W, Li M, Wang L, Chen H, Liu Z, Jia Z, Song L (2017) The granulocytes are the main immunocompetent hemocytes in Crassostrea gigas. Dev Comp Immunol 67: 221–228. https://doi.org/10.1016/j.dci.2016.09.017
Piaton E, Fabre M, Goubin-Versini I, Bretz-Grenier MF, Courtade-Saïdi M, Vincent S, Cochand-Priollet B (2016) Guidelines for May-Grünwald–Giemsa staining in haematology and non-gynaecological cytopathology: recommendations of the French Society of Clinical Cytology (SFCC) and of the French Association for Quality Assurance in Anatomic and Cytologic Pathology (AFAQAP). Cytopathology 27 (5): 359–368. https://doi.org/10.1111/cyt.12323
Kladchenko ES, Andreyeva AY, Kukhareva TA, Soldatov AA (2020) Morphologic, cytometric and functional characterisation of Anadara kagoshimensis hemocytes. Fish Shellfish Immunol 98: 1030–1032.
Carballal MJ, Lopez MC, Azevedo C, Villalba A (1997) Hemolymph cell types of the mussel Mytilus galloprovincialis. Diseases of Aquatic Organisms 29 (2): 127–135.
Andreyeva AY, Kladchenko ES, Kukhareva TA, Sakhon EG (2019) Analysis of Cell Cycle and Morphological and Functional Abnormalities of Mytilus galloprovincialis Lam., 1819 (Bivalvia) Hemocytes from Coastal Ecosystems near Sevastopol, Crimea. Inland Water Biol 12 (2): 96–103.
Andreyeva AY, Kladchenko ES, Vyalova OY, Kukhareva TA (2021) Functional Characterization of the Pacific Oyster, Crassostrea gigas (Bivalvia: Ostreidae), Hemocytes Under Normoxia and Short-Term Hypoxia. Turkish J Fish Aquat Sci 21 (3): 125–133.
Foley DA, Cheng TC (1977) Degranulation and other changes of molluscan granulocytes associated with phagocytosis. J Invertebr Pathol 29 (3): 321–325. https://doi.org/10.1016/S0022-2011(77)80037-2
Rebelo MDF, Figueiredo EDS, Mariante RM, Nóbrega A, de Barros CM, Allodi S (2013) New insights from the oyster Crassostrea rhizophorae on bivalve circulating hemocytes. PLoS One 8 (2): e57384. https://doi.org/10.1371/journal.pone.0057384
Lau YT, Gambino L, Santos B, Espinosa EP, Allam B (2018) Transepithelial migration of mucosal hemocytes in Crassostrea virginica and potential role in Perkinsus marinus pathogenesis. J Invertebr Pathol 153: 122–129. https://doi.org/10.1016/j.jip.2018.03.004
Ottaviani E, Franchini A, Barbieri D, Kletsas D (1998) Comparative and morphofunctional studies on Mytilus galloprovincialis hemocytes: Presence of two aging-related hemocyte stages. Ital J Zool 65 (4): 349–354. https://doi.org/10.1080/11250009809386772
Delaporte M, Synard S, Pariseau J, McKenna P, Tremblay R, Davidson J, Berthe FC (2008) Assessment of haemic neoplasia in different soft shell clam Mya arenaria populations from eastern Canada by flow cytometry. J Invertebr Pathol 98 (2): 190–197. https://doi.org/10.1016/j.jip.2007.12.005
Aladaileh S, Nair SV, Birch D, Raftos DA (2007). Sydney rock oyster (Saccostrea glomerata) hemocytes: morphology and function. J Invertebr Pathol 96 (1): 48–63. https://doi.org/10.1016/j.jip.2007.02.011
Cima F, Matozzo V (2018) Proliferation and differentiation of circulating haemocytes of Ruditapes philippinarum as a response to bacterial challenge. Fish Shellfish Immunol 81: 73–82. https://doi.org/10.1016/j.fsi.2018.07.010
de Freitas Rebelo M, de Souza Figueiredo E, Mariante RM, Nóbrega A, de Barros CM, Allodi S (2013) New insights from the oyster Crassostrea rhizophorae on bivalve circulating hemocytes. PLoS One 8 (2): e57384. https://doi.org/10.1371/journal.pone.0057384
Huang J, Li S, Liu Y, Liu C, Xie L, Zhang R (2018) Hemocytes in the extrapallial space of Pinctada fucata are involved in immunity and biomineralization. Sci Rep 8 (1): 1–11. https://doi.org/10.1038/s41598-018-22961-y
Michiels C, Minet E, Mottet D, Raes E (2002) Regulation of gene expression by oxygen: NF-kappaB and HIF-1, two extremes. Free Radic Biol Med 33: 1231–1242. https://doi.org/10.1016/S0891-5849(02)01045-6
Donaghy L, Kraffe E, Le Goïc N, Lambert C, Volety AK, Soudant P (2012) Reactive oxygen species in unstimulated hemocytes of the Pacific oyster Crassostrea gigas: a mitochondrial involvement. PloS one 7 (10): e46594. https://doi.org/10.1371/journal.pone.0046594
Donaghy L, Artigaud S, Sussarellu R, Lambert C, Le Goïc N, Hégaret H, Soudant P (2013) Tolerance of bivalve mollusc hemocytes to variable oxygen availability: a mitochondrial origin? Aquat Living Resour 26 (3): 257–261. https://doi.org/10.1051/alr/2013054
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


