Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 6, стр. 495-502
ВЛИЯНИЕ Gd3+ И Ca2+ НА СОКРАТИМОСТЬ СЕРДЕЧНОЙ МЫШЦЫ ЛЯГУШКИ И ДЫХАНИЕ, НАБУХАНИЕ И ПОТЕНЦИАЛ ВНУТРЕННЕЙ МЕМБРАНЫ МИТОХОНДРИЙ СЕРДЦА КРЫСЫ
С. М. Коротков 1, *, К. В. Соболь 1, И. В. Шемарова 1, А. В. Новожилов 1, Е. Р. Никитина 1, В. П. Нестеров 1
1 Федеральное государственное бюджетное учреждение науки Институт эволюционной физиологии и биохимии
им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: korotkov@SK1645.spb.edu
Поступила в редакцию 05.06.2020
После доработки 16.07.2020
Принята к публикации 25.07.2020
Аннотация
Исследовано инотропное и хронотропное действие гадолиния (Gd3+) на сокращение препаратов из сердечной мышцы лягушки Rana ridibunda. Также изучали влияние Gd3+ на скорости поглощения кислорода, набухание и потенциал внутренней мембраны (∆Ψмито) энергизованных глутаматом и малатом митохондрий сердца крысы (МСК). Установлено, что Gd3+ снижал амплитуду и частоту спонтанных сердечных сокращений. Вместе с тем он препятствовал индуцированному ионами Ca2+ набуханию этих органелл в солевых средах и уменьшению ∆Ψмито. При этом Gd3+, независимо от наличия в среде Ca2+, слабо влиял на дыхание митохондрий в состояниях 3 или 3РДНФ (в присутствии 2,4-динитрофенола). В опытах без кальция Gd3+ стимулировал пассивное набухание МСК. Обнаруженные нами эффекты Gd3+ могут свидетельствовать о том, что Gd3+ не оказывает токсического эффекта на МСК, а с другой стороны, он тормозит открытие в их внутренней мембране митохондриальной кальций-зависимой поры (МКЗП). Полученные данные важны для лучшего понимания механизмов действия редкоземельных элементов на Ca2+-зависимые процессы в миокарде позвоночных.
Хелаты гадолиния широко используются в качестве контрастных веществ для магнитно-резонансной томографии. Одобренные контрастные вещества на основе гадолиния (gadolinium-based contrast agents – GBCAs) долгое время считались безопасными и хорошо переносимыми при использовании в рекомендуемых дозировках [1–3].
Однако в течение почти десяти лет у пациентов с тяжелой почечной недостаточностью была выявлена связь между введением GBCAs и развитием нефрогенного системного фиброза (НСФ). Это привело к изменениям в клинической практике, направленным на снижение потенциала и частоты развития НСФ. Появились новые сообщения о накоплении гадолиния в различных тканях пациентов, у которых нет почечной недостаточности, включая кости, мозг и почки [3]. Несмотря на наблюдения за накоплением гадолиния в тканях независимо от функции почек, имеются весьма ограниченные клинические данные о потенциале и механизмах токсичности препарата [1, 2, 4]. Нет данных о действии солей Gd3+ как на сердечно-сосудистую систему, так и на митохондрии, являющиеся основным поставщиком АТФ для кардиомиоцитов. Этот значительный пробел в знаниях требует проведения дополнительных исследований, направленных на оценку влияния Gd3+ на отдельные органы, в первую очередь, на миокард, его жизнеспособность и сократительную функцию. Необходимо отметить, что из-за методических особенностей данное исследование выполнялось на позвоночных животных, эволюционно достаточно отдаленных друг от друга. Однако исходя из данных о единой структурной организации митохондрий в сократительных тканях всех типов многоклеточных животных [5] и, в том числе, изученные хондриомы сердца лягушки Rana ridibunda [6] и сердца крысы [7], можно полагать, что экстраполяция данных, полученных в экспериментах на этих двух видах животных, вполне оправдана. Таким образом, цель настоящей работы – изучить инотропные эффекты Gd3+ на изолированные препараты сердца лягушки, а также его действие на митохондрии как на возможные молекулярные мишени его токсического действия, определяющие жизнеспособность сердечной мышцы.
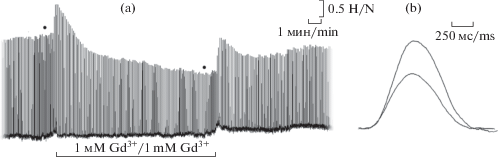
Рис. 1.
Влияние 1 мМ Gd3+ на спонтанные сокращения предсердий лягушки. Регистрация сокращений при различных временных интервалах. Полная схема опыта – (a); одиночное сокращение – (b). Время действия и концентрация Gd3+ обозначены горизонтальной линией под регистрацией сокращения. Черными кружками на рис. 1а отмечены одиночные сокращения, представленные на рис. 1б. Горизонтальные метки справа вверху – время, мин (а), миллисекунды (b); вертикальная – сила (Н).
Fig. 1. Effect of 1 mM Gd3+ on spontaneous contractions of the frog atria as recorded at different time intervals. Complete experimental design – (a), single contraction – (b). Gd3+ action time and concentration are indicated by a horizontal line under the contraction record. Black circles in Fig. 1a mark single contractions shown in Fig. 1b. Horizontal bars (top right) – time, min (a) or ms (b); vertical bar – contraction force (N).
МАТЕРИАЛЫ И МЕТОДЫ
Регистрация и анализ параметров сокращения. Для изучения сокращений использовали препараты сердца лягушки Rana ridibunda, как описано ранее [8, 9]. В наших экспериментах мы используем чувствительную модель спонтанных сердечных сокращений изолированных предсердий Rana ridibunda, поскольку спонтанные сокращения изолированных предсердий теплокровных отличаются нестабильностью. Общность физиологических процессов, лежащих в основе сердечной деятельности, позволяет нам проводить аналогии и обсуждать результаты, полученные на объектах разного вида животных.
Препараты растягивали до оптимальной длины, и сокращения регистрировали в изометрическом режиме. Препараты помещали в стеклянную термостатированную ячейку при 10°С, ориентировали вертикально и растягивали с помощью стальных крючков, сделанных из мандрена. Один стальной крючок присоединяли к фиксированному платиновому крючку, второй – к тензодатчику. Сигналы обрабатывали с помощью компьютерной программы WinPulse, силу сокращения определяли в ньютонах (Н). Оценивали следующие параметры сокращения: максимальное усилие, развиваемое мышечным препаратом (Fmax, мН), и период полурасслабления (t1/2, с). В экспериментах использовали нормальный раствор Рингера, содержащий 110 мМ NaCl, 2.5 мМ KCl, 1 мМ MgCl2, 2.5 мМ CaCl2, 0.75 мМ NaH2PO4, 0.5 мМ NaHCO3, 5 мМ глюкозы (pH 7.4). Хлорид гадолиния готовили в виде 100 мМ сток-раствора и вносили в экспериментальный раствор до конечных концентраций 1 мМ непосредственно перед экспериментом. Действие Gd3+ прекращали путем отмывания препарата нормальным раствором Рингера. Исследование действия гадолиния на сократительные характеристики сердечной мышцы лягушки Rana ridibunda проводили с использованием независимых препаратов, полученных от четырех (n = 4) отдельных животных. Использовали оптимальную 1 мМ концентрацию Gd3+, как в наших аналогичных опытах с другими лантаноидами (Y3+, La3+, Nd3+, Pr3+) [8–10]. Применяли стандартные способы статистической обработки результатов с использованием критерия Стьюдента. Различия считали достоверными при р < 0.05.
Выделение митохондрий. Для выделения одного препарата митохондрий сердца крысы (МСК) использовали 8 самцов линии Вистар массой 200–250 г. Суммарная масса сердечной ткани была около 10 г. Все процедуры проводили на льду согласно разработанной нами методике [10]. На итоговом этапе МСК суспендировали в 3 мл среды, содержащей 300 мМ сахарозу и 10 мМ трис-HCl (pH 7.3). Определенная по методу Бредфорда концентрация белка в митохондриальных препаратах была в пределах 20–30 мг/мл. В работе использовали: сахарозу, очищенную от примесей катионов на ионообменной колонке со смолой КУ-2-8, 2,4-динитрофенол (ДНФ) марки “ч. д. а.”; маннитол, CaCl2, Gd(NO3)3, NH4NO3, K-ацетат и H3PO4 марки “х. ч.”; сафранин, трис-ОН, KCl, олигомицин, глутамат, малат, АДФ, MgCl2, MOPS и EGTA − фирмы Sigma.
Спектрофотометрическая оценка изменения объема митохондрий. Увеличение объема (набухание) митохондрий в солевых средах становится возможным при одновременном поступлении в матрикс катионов с анионами и идущей вслед за ними воды [11]. При этом снижается оптическая плотность проходящего через митохондриальную суспензию света длиной волны 520–540 нм из-за уменьшения ее светорассеивания [12, 13]. В частности, изучение набухания МСК в солевых средах позволяет оценить транспорт катионов (K+ и H+) через внутреннюю мембрану [10, 11]. Набухание МСК регистрировали при температуре 20°C на спектрофотометре СФ-46 при длине волны 540 нм. Митохондрии (1 мг белка на 1 мл) вносили в среду, содержащую 5 мМ трис-HCl (pH 7.3) и 125 мМ NH4NO3 (рис. 2) или 100 мМ сахарозу, 10 мм трис-HCl (pH 7.3) и 25 мМ K-ацетат (рис. 3), а также 1 мкг/мл олигомицина. До внесения митохондрий вводили вещества до следующих концентраций: 60 мкМ Gd3+ и 250 мкМ Ca2+ (рис. 3) или 50 мкМ Gd3+ и 200 мкМ Ca2+ (рис. 4). После митохондрий в среду вносили субстраты до концентрации – 10 мМ глутамат и 2 мМ малат.
Рис. 2.
Действие Gd3+ и Ca2+ на набухание (ΔD540) митохондрий сердца крысы в среде с NH4NO3. Митохондрии (1 мг/мл) вносили в среду, содержащую 125 мМ NH4NO3, 5 мМ трис-HCl и 1 мкг/мл олигомицина, а также (где указано) 60 мкМ Gd3+ (Gd3+) и 250 мкМ Ca2+ (Ca2+). Цифрами справа от кривых показана добавка до митохондрий: 1 – без добавок (контроль), 2 – Gd3+, 3 – Ca2+, 4 – Ca2+ + Gd3+. Стрелками показана добавка в среду митохондрий сердца крысы (МСК), а также глутамата и малата соответственно до концентраций 10 мМ и 2 мМ (G+M).
Fig. 2. Effect of Gd3+ and Ca2+ on swelling (ΔA540) of rat heart mitochondria |(RHM) in the medium with NH4NO3. Mitochondria (1 mg/mL) were added into a medium containing 125 mM NH4NO3, 5 mM Tris-HCl, 1 µg/mL oligomycine, and (whenever indicated) 60 µM Gd3+ (Gd3+) and 250 µM Ca2+ (Ca2+). Numerals to the right of the traces show pre-mitochondrial addition agents: 1 – no additions (control), 2 – Gd3+, 3 – Ca2+, 4 – Ca2+ + Gd3+. Arrows indicate the addition of mitochondria into the medium and that of glutamate and malate up to concentrations of 10 mM and 2 mM, respectively (G+M).
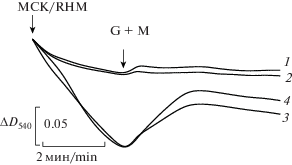
Рис. 3.
Действие Gd3+ и Ca2+ на набухание (ΔD540) митохондрий сердца крысы в среде с K-ацетатом и сахарозой. Митохондрии (1 мг/мл) добавляли в среду, содержащую 25 мМ K-ацетат, 100 мМ сахарозу и 1 мкг/мл олигомицина, а также (где указано) 60 мкМ Gd3+ (Gd3+) и 250 мкМ Ca2+ (Ca2+). Добавки и обозначения как на рис. 2.
Fig. 3. Effect of Gd3+ and Ca2+ on swelling (ΔA540) of rat heart mitochondria in the medium with potassium acetate and sucrose. Mitochondria (1 mg/mL) were injected into a medium containing 25 mM K-acetate, 100 mM sucrose, 1 µg/mL oligomycine, and (whenever indicated) 60 µM Gd3+ (Gd3+) and 250 µM Ca2+ (Ca2+). Additions and designations as in Fig. 2.
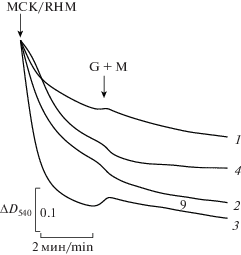
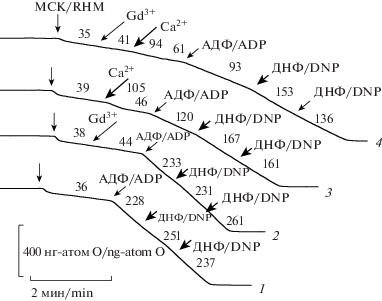
Рис. 4.
Влияние Gd3+ и Ca2+ на скорость поглощения кислорода энергизованными глутаматом и малатом митохондриями сердца крысы. Митохондрии (1 мг/мл) были суспендированы в среде, содержащей 125 мМ KCl, 20 мМ трис-MOPS (pH 7.3), 3 мМ трис-PO4, 10 мМ глутамат и 2 мМ малат. Цифрами над кривыми показаны скорости поглощения кислорода (нг-атом O/мин на 1 мг белка). Стрелками показаны добавки митохондрий (МCК), а также реагентов до концентраций – 50 мкМ Gd3+ (Gd3+), 200 мкМ Ca2+ (Ca2+), 130 мкМ АДФ (АДФ) и две добавки 2,4-динитрофенола (ДНФ) до коцентрации 10 мкМ. Цифрами справа от кривых показано: 1 – без добавок (контроль), 2 – Gd3+, 3 – Ca2+, 4 – Ca2+ + Gd3+.
Fig. 4. Effect of Gd3+ and Ca2+ on oxygen consumption rate in glutamate and malate energized rat heart mitochondria. Mitochondria (1 mg/mL) were suspended in the medium containing 125 mM KCl, 20 mM Tris-MOPS (pH 7.3), 3 mM Tris-PO4, 10 mM glutamate, and 2 mM malate. Numerals above the traces show oxygen consumption rates (ng-atom O/min per 1 mg of protein). Arrows indicate the additions of rat heart mitochondria (RHM) and reagents up to concentrations of 50 µM Gd3+ (Gd3+), 200 µM Ca2+ (Ca2+), 130 µM ADP (ADP), and two additions of 2,4-dinitrophenol (DNP) up to 10 µM concentration. Numerals to the right of the traces show: 1 – no additions (control), 2 – Gd3+, 3 – Ca2+, 4 – Ca2+ + Gd3+.
Измерение поглощения кислорода. Скорости поглощения кислорода (дыхание) митохондрий (нг-атом О/мин на мг белка) оценивали методом полярографии с применением закрытого платинового электрода Кларка на анализаторе Эксперт-001 (НПО Эконикс эксперт, Россия) при 26°С в ячейке объемом 1.4 мл [14]. Функциональные состояния изолированных митохондрий оценивали по Чансу [15]: состояние 40 (базальное, только субстрат в среде), состояние 3 (после внесения АДФ в среду с субстратом) и состояние 3РДНФ (дыхание разобщенное 2,4-динитрофенолом). Митохондрии (1 мг белка в 1 мл) добавляли в среду, содержащую 125 мМ KCl, 20 мМ трис-MOPS (pH 7.3), 3 мМ трис-PO4, 5 мкМ EGTA, а также 10 мМ глутамат и 2 мМ малат (рис. 4). После добавления митохондрий в среду вносили вещества (показано стрелками) до следующих конечных концентраций: Ca2+ (Ca2+) – 200 мкМ; Gd3+ (Gd3+) – 25 мкМ; ADP (ADP) – 300 мкМ; ДНФ (ДНФ) – 15 мкМ.
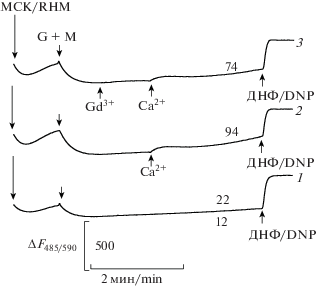
Определение митохондриального потенциала. Для оценки ∆Ψмито использовали стандартную методику Вальдмайера и др. [16]. Оценивали интенсивность флуоресценции сафранина в суспензии митохондрий при 20°С при длине волны возбуждающего света и эмиссии соответственно при 485 и 590 нм на спектрофлуориметре Shimadzu RF-1501 (Shimadzu, Япония) (рис. 5). Митохондрии (0.5 мг белка в 1 мл) вносили в кварцевую кювету с 3 мл среды, содержащей 125 мМ KCl, 10 мМ трис-HCl (pH 7.3), 50 мМ сахарозу, 3 мМ трис-PO4, 3 мМ MgCl2, 3 мкМ сафранин и 1 мкг/мл олигомицина. После митохондрий (показано стрелками) в среду инкубации добавляли вещества до следующих конечных концентраций: 10 мМ глутамат и 2 мМ малат (G+M); Ca2+ (Ca2+) – 600 мкМ; Gd3+ (Gd3+) – 150 мкМ; ДНФ (ДНФ) – 30 мкМ. На рисунках показаны типичные результаты, полученные для трех независимых экспериментов. Выбор используемых в настоящей работе концентраций Gd3+ и Ca2+ основывался на результатах наших опытов по оценке биологической активности ряда металлов, в том числе Y3+, La3+, Pr3+ и Nd3+ с использованием препаратов желудочков сердца лягушки и изолированных МСК в качестве биологических моделей [8–10]. Применяли стандартные способы статистической обработки результатов с использованием статистической программы Microsoft Origin 6.0. Различия считали достоверными при р < 0.05.
Рис. 5.
Влияние Gd3+ и Ca2+ на изменение потенциала (ΔΨмито) на внутренней мембране энергизованных глутаматом и малатом митохондрий сердца крысы. Митохондрии (0.5 мг/мл) вносили в среду, содержащую 125 мМ KCl, 10 мМ трис-HCl, 3 мМ MgCl2, 3 мМ трис-PO4, 3 мкМ сафранин и 1 мкг/мл олигомицина. Стрелками показано внесение в среду митохондрий сердца крысы (МСК), 10 мМ глутамат и 2 мМ малат (G+M), 350 мкМ Ca2+ (Ca2+), 67.5 мкМ Gd3+ (Gd3+) и 30 мкМ 2,4-динитрофенола (ДНФ). Цифрами справа от кривых показано: 1 – без добавок (контроль), 2 – Ca2+, 3 – Ca2+ + Gd3+. Над кривыми отмечена скорость изменения флуоресценции сафранина О в суспензии митохондрий (усл. ед./мин), которая рассчитывалась посредством программного продукта Excel 2003 за 1 мин до внесения в среду ДНФ.
Fig. 5. Effect of Gd3+ and Ca2+ on changes in the inner membrane potential (ΔΨmito) of glutamate and malate energized rat heart mitochondria. Mitochondria (0.5 mg/mL) were added into the medium containing 125 mM KCl, 10 mM Tris-HCl, 3 mM MgCl2, 3 mM Tris-PO4, 3 µM safranin, and 1 µg/mL oligomycine. Arrows indicate the additions of rat heart mitochondria (RHM), 10 mM glutamate and 2 mM malate (G+M), 350 µM Ca2+ (Ca2+), 67.5 µM Gd3+ (Gd3+) and 30 µM 2,4-dinitrophenol (DNP). Numerals to the right of the traces show: 1 – no additions (control), 2 – Ca2+, 3 – Ca2+ + Gd3+. Rates of safranine O fluorescence change (arbitrary units per min) in the mitochondrial suspension are shown above experimental traces as calculated in Excel 2003 for 1 min before DNP injection into the medium.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Действие Gd3+ на силу сердечных сокращений. Инотропное действие хлорида гадолиния определяли на изолированных препаратах предсердия сердца лягушки в условиях cпонтанного возбуждения/сокращения. Установлено, что ионы Gd3+ в концентрации 1 мМ через 10 мин после начала инкубации предсердий в растворе Рингера достоверно снижали амплитуду спонтанных сердечных сокращений (Fmax) на 36 ± 5% (n = 4, p < 0.01, рис. 1). При этом период полурасслабления незначительно уменьшался, на 4 ± 1% (n = 4). Частота сокращения также незначительно снижалась, на 13 ± 3% (n = 4). Незначительный отрицательный хронотропный эффект Gd3+ может быть обусловлен его ингибирующим действием на потенциал-управляемые Са2+-каналы (СаV) пейсмекерных клеток синоатриального узла (СА-узла). Таким образом, полученные данные (рис. 1) свидетельствуют о том, что Gd3+ оказывает значительное отрицательное инотропное действие на миокард.
Известно, что концентрация свободных ионов кальция в цитозоле [Ca2+]i, а также динамика его изменения внутри сердечной клетки определяют величину развиваемого напряжения и скорость сокращения/расслабления [17]. В наших экспериментах Gd3+ подавлял сократимость миокарда, что, вероятно, является следствием уменьшения концентрации Ca2+ в цитозоле при аппликации Gd3+. В КМ вход внеклеточного Ca2+ осуществляется преимущественно через потенциал-управляемые Ca2+-каналы L-типа (СaV1.2) [17]. Блокирование этих каналов с помощью специфических блокаторов (верапамила, нифедипина) приводит к нарушению механизма запуска сокращения в сердечной мышце [18], осуществляемого по принципу Ca2+-индуцированного высвобождения Ca2+, к падению амплитуды Fmax и в результате к нарушению сердечной деятельности.
В имеющейся литературе нет указаний на механизм действия Gd3+ как на кальциевые каналы плазматической мембраны в КМ, так и на сокращение КМ. Предполагается, что в электровозбудимых клетках лантаноиды блокируют входящие Ca2+ токи, активируемые деполяризацией поверхностной мембраны [19]. Сравнение влияния хлорида гадолиния и хлористого лантана на параметры сокращения КМ указывает на сходство в ингибирующем действии этих соединений, что может свидетельствовать об общем механизме их блокирующего действия на СaV1.2. Полученные результаты могут свидетельствовать о возможном действии Gd3+ на потенциал-управляемые Ca2+-каналы сердечных клеток, что выражается в уменьшении Fmax спонтанно сокращающихся препаратов, а также в снижении частоты спонтанных сокращений. Ионы Gd3+ практически не влияли на время полурасслабления сердечной мышцы, что может свидетельствовать о том, что Gd3+ не влияет на реабсорбцию кальция из цитозоля.
Не исключено, что отрицательный инотропный эффект Gd3+ мог быть обусловлен не только его конкурентным действием на кальциевые каналы плазматической мембраны, но и его влиянием на кальциевые транспортеры МСК. В этой связи представлялось важным определить влияние Gd3+ на функциональное состояние митохондрий и установить его действие на катионный транспорт через ВММ.
Ранее мы обнаружили, что иттрий не оказывал заметного влияния на дыхание изолированных МСК [10]. Однако, учитывая физико-химические различия этих двух металлов, можно предположить и наличие у них разной биологической активности.
Учитывая наши экспериментальные данные и данные литературы о блокирующем действии лантаноидов на CaV-каналы [9, 10, 20], мы предположили, что в КМ гадолиний, подобно действию других, ранее изученных нами лантаноидов [8–10], может оказывать заметное влияние на кальцийзависимые процессы в митохондриях и, в частности, ингибировать митохондриальный Ca2+-унипортер и влиять на дыхание митохондрий, находящихся в различных энергетических состояниях.
Действие Gd3+ на набухание митохондрий. Ранее было показано, что пассивную протонную проницаемость ВММ можно оценить по набуханию неэнергизованных митохондрий в среде с NH4NO3 [21]. Можно увидеть (рис. 2), что набухание неэнергизованных МСК в содержащей Gd3+ среде с NH4NO3 (кривая 2) было таким же, как в контроле, без Gd3+ (кривая 1). Далее, после внесения глутамата с малатом и независимо от наличия или отсутствия в среде Gd3+, энергизованные МСК во всех опытах сжимались (рис. 2, кривые 1, 2) из-за откачки протонов из матрикса протонными насосами дыхательной цепи [21]. Еще до внесения глутамата и малата в среду, МСК в среде с Ca2+ и не зависимо от наличия в ней Gd3+ (рис. 2, кривые 3, 4) демонстрировали гораздо большее набухание в сравнении с аналогичными опытами без Ca2+ (рис. 2, кривые 1, 2). Скорее всего, это связано с транспортом кальция в матрикс при участии эндогенных субстратов [9]. Энергизация МСК в среде с Ca2+ (кривая 4) стимулировала сжатие митохондрий, которое в среде с Gd3+ было сильнее, чем в аналогичных опытах с Ca2+ (кривая 3).
Известно [12], что набухание энергизованных митохондрий в гипоосмотической (160 мОсм) среде с 25 мМ K-ацетатом и 100 мМ сахарозой позволяет оценить энергозависимый транспорт ионов K+, поступающих в матрикс по механизму электрофоретического унипорта [11]. Параллельно этому в митохондрии, по градиенту концентрации, поступают молекулы уксусной кислоты, для которых ВММ свободно проницаема [11]. В матриксе они диссоциируют на анионы ацетата и ионы водорода, которые удаляются из энергизованных митохондрий протонными помпами электрон-транспортной цепи, что в конечном итоге приводит к накоплению в нем K-ацетата и набуханию органелл. Ранее мы получили экспериментальные доказательства того, что усиление набухания энергизованных МСК в среде с K-ацетатом в присутствии редкоземельных элементов (La3+, Y3+, Pr3+, Nd3+) связано с активацией этими ионами транспорта калия в матрикс митохондрий [8–10]. В наших экспериментах с Gd3+ (рис. 3) набухание МСК еще до внесения глутамата и малата в среду с K-ацетатом заметно ускорилось при наличии в ней Gd3+ (кривая 2) по сравнению с контролем (кривая 1). При последующей энергизации митохондрий набухание митохондрий дополнительно возросло. В аналогичных опытах с одним Ca2+ (рис. 3, кривая 3) набухание деэнергизованных митохондрий было заметно сильнее в сравнении с контролем (кривая 1). Однако это набухание ощутимо снизилось при совместном присутствии в среде Ca2+ и Gd3+ (кривая 4). Последующее внесение субстратов окисления не повлияло на соотношение величины этого набухания (кривые 3 и 4). Эти данные позволяют предположить, что дополнительное ускорение набухания митохондрий сердца крысы в среде с K-ацетатом и Gd3+ может быть связано со стимуляцией ионами Gd3+ калиевой проницаемости внутренней мембраны. Торможение набухания МСК в этой среде с Ca2+ в присутствии Gd3+, скорее всего, вызвано конкурентным ингибированием ионами Gd3+ митохондриального кальциевого унипортера [22]. А это, в свою очередь, может уменьшать поступление Ca2+ в матрикс митохондрий и снижать вероятность открытия МКЗП во внутренней мембране.
Действие Gd3+ на дыхание митохондрий. Ранее нами было показано, что ионы La3+, Y3+, Pr3+ и Nd3+ активировали дыхание МСК, находящихся в состоянии 40 [8–10]. На рис. 4 (кривая 2) видно, что Gd3+ также незначительно активировал дыхание МСК, находящихся в состоянии 40 и энергизованных глутаматом и малатом. По-видимому, этот эффект Gd3+ связан с активацией транспорта K+ в матрикс митохондрий, на что могут указывать данные, представленные на рис. 3, а также результаты, полученные нами ранее в аналогичных экспериментах с другими лантаноидами (см. выше). Ионы Gd3+, по сравнению с контролем, не действовали на дыхание МСК, находящихся в состояниях 3 и 3РДНФ (рис. 4, кривые 2 и 1). После внесения Ca2+ в среду (кривая 3) происходила кратковременная активация дыхания в состоянии 40, связанная с потенциал-зависимым поступлением ионов Ca2+ в матрикс с последующим снижением дыхания МСК в состояниях 3 и 3РДНФ. В том случае, когда Gd3+ вносили в среду до Ca2+ (кривая 4) скорости дыхания в состояниях 3 и 3РДНФ практически не изменялись. Подобные результаты были получены в аналогичных опытах с указанными выше трехвалентными катионами, что указывает на сходство механизмов действия ранее изученных лантаноидов и Gd3+ на МСК. Отсутствие эффекта Gd3+ на дыхание митохондрий в состояниях 3 и 3РДНФ в опытах без кальция (рис. 4, кривая 2) не позволяет говорить о каком-либо токсическом эффекте Gd3+ на МСК. Это отличает действие Gd3+ и других изученных нами редкоземельных элементов от действия тяжелого металла (Cd2+), который в подобных экспериментах заметно угнетал дыхание фосфорилирующих митохондрий [23]. С другой стороны, снижение скоростей дыхания митохондрий, находящихся в состоянии 3 и 3РДНФ в опытах с Са2+, вероятнее всего, связано с набуханием митохондрий [8] (рис. 2 и 3) и с активацией митохондриальной кальцийзависимой поры в их внутренней мембране [8, 24].
Действие Gd3+ на потенциал внутренней мембраны. На рис. 5 показано влияние Gd3+ и Ca2+ на потенциал внутренней мембраны МСК. Добавка в среду глутамата и малата (кривые 1–3) индуцировала потенциал-зависимое поглощение сафранина митохондриями, что наряду с данными полярографических опытов (рис. 4) доказывает их жизнеспособность и возникновение разности потенциалов на ВММ. Последующая добавка Gd3+ не приводила к изменению величины флуоресценции сафранина (кривая 3) и соответственно ΔΨмито. Итоговая инъекция ДНФ приводила к сбросу ΔΨмито на внутренней мембране МСК (кривые 1–3). После добавления Са2+ (в среду без Gd3+) (рис. 5, кривая 2) наблюдалось кратковременное повышение флуоресценции сафранина, связанное с потенциал-зависимым поглощением Ca2+ энергизованными митохондриями [25]. После этого происходило Ca2+-индуцированное снижение ΔΨмито, связанное с выходом сафранина в среду из-за открытия МКЗП [8, 25]. Внесение в среду Gd3+ (рис. 5, кривая 3) несколько ослабляло последующее действие Са2+ на ΔΨмито и вызывало задержку выхода сафранина из митохондрий, что видно при сравнении скоростей Ca2+-индуцированного увеличения сигнала сафранина в опытных (рис. 5, кривые 2, 3) и в контрольной пробах (рис. 5, кривая 1). Вызванное Gd3+ торможение кальцийзависимого кратковременного снижения потенциала и скорости Ca2+-индуцированного выхода сафранина из митохондрий можно объяснить уменьшением транспорта Ca2+ в матрикс МСК за счет конкурентного ингибирования митохондриального Ca2+-унипортера и, как следствие, последующего ингибирования Са2+-индуцированного открытия МКЗП во внутренней мембране митохондрий по аналогии с другими изученными нами лантаноидами [8–10, 26].
Таким образом, проведенные эксперименты показали, что ионы Gd3+ обладают значительным отрицательным инотропным и незначительным хронотропным действием при спонтанном сокращении миокарда (предсердия). Кроме того, ионы Gd3+ увеличивают ионную проницаемость внутренней мембраны митохондрий, оказывают блокирующее действие на энергозависимый транспорт Ca2+ в митохондрии, но при этом практически не влияют на дыхание изолированных митохондрий. Сочетание этих эффектов Gd3+ может быть причиной снижения сократимости сердечной мышцы при попадании солей Gd3+ в организм человека.
Исследования по определению митохондриального потенциала проводили на базе Центра коллективного пользования в ИЭФБ РАН.
Список литературы
Haley T.J., Raymond K., Komesu N., Upham H.C. Toxicological and pharmacological effects of gadolinium and samarium chlorides. Br. J. Pharmacol. Chemother. 17: 526–532. 1961. https://doi.org/10.1111/j.1476-5381.1961.tb01139.x
Ramalho J., Ramalho M., Jay M., Burke L.M., Semelka R.C. Gadolinium toxicity and treatment. Magn. Reson. Imaging. 34: 1394–1398. 2016. https://doi.org/10.1016/j.mri.2016.09.005
Rogosnitzky M., Branch S. Gadolinium-based contrast agent toxicity: a review of known and proposed mechanisms. Biometals. 29: 365–376. 2016. https://doi.org/10.1007/s10534-016-9931-7
Akhtar M.J., Ahamed M., Alhadlaq H., Alrokayan S. Toxicity Mechanism of Gadolinium Oxide Nanoparticles and Gadolinium Ions in Human Breast Cancer Cells. Curr. Drug Metab. 20: 907–917. 2019. https://doi.org/10.2174/1389200220666191105113754
Ченцов Ю.С. Хондриом – совокупность митохондрий клетки. Соросовский образовательный журнал. 1997. 12: 10–17.
Touraki M., Thomopoulos G.N., Beis I. Effects of calcium depletion and calcium paradox on the ultrastructure of the frog heart. J. Submicrosc. Cytol. Pathol. 1991. 23: 295–303.
Бакеева Л.Е., Скулачев В.П., Ченцов Ю.С. Межмитохондриальные контакты кардиомиоцитов. Цитология. 1982. 2: 161–166.
Коротков С.М., Соболь К.В., Шемарова И.В., Фураев В.В., Новожилов А.В., Нестеров В.П. Действие Nd3+ на кальций-зависимые процессы в изолированных митохондриях сердца крысы и сердечной мышце лягушки. Биол. мембраны. 35: 200–207. 2018. https://doi.org/10.7868/S0233475518030040
Korotkov S.M., Sobol K.V., Shemarova I.V., Furaev V.V., Shumakov A.R., Nesterov V.P. A comparative study of the effects of Pr3+ and La3+ ions on calcium dependent processes in frog cardiac muscle and rat heart mitochondria. Biophysics. 61: 733–740. 2016. https://doi.org/10.1134/S0006350916050122
Shemarova I.V., Sobol K.V., Korotkov S.M., Nesterov V.P. Effect of yttrium on calcium-dependent processes in vertebrate myocardium J. Evol. Biochem. Physiol. 50: 221–226. 2014. https://doi.org/10.1134/S0022093014030041
Brierley G.P. The uptake and extrusion of monovalent cations by isolated heart mitochondria. Mol. Cell. Biochem. 1976. 10 (1): 41–63. https://doi.org/10.1007/BF01731680
Brierley G.P., Jurkowitz M., Chávez E., Jung D.W. Energy-dependent contraction of swollen heart mitochondria. J. Biol. Chem. 252: 7932–7939. 1977.
Tedeschi H., Harris D.L. Some observations on the photometric estimation of mitochondrial volume. Biochim. Biophys. Acta. 1958. 28 (2): 392–402. https://doi.org/10.1016/0006-3002(58)90487-6
Панов А.В. Практическая митохондриология. Новосибирск. 2015. https://doi.org/10.13140/2.1.1599.3127
Chance B., Williams G.R. Respiratory enzymes in oxidative phosphorylation. III. The steady state. J. Biol. Chem. 217 (1), 409–427. 1955.
Waldmeier P.C., Feldtrauer J.J., Qian T., Lemasters J. Inhibition of the mitochondrial permeability transition by the nonimmunosuppressive cyclosporin derivative NIM811. J. Mol. Pharmacol. 62: 22–29. 2002. https://doi.org/10.1124/mol.62.1.22
Bers D.M. Cardiac excitation-contraction coupling. Nature. 10: 198–205. 2002. https://doi.org/10.1038/415198a
Talbert R.L., Bussey H.I. Update on calcium-channel blocking agents. Clin. Pharm. 2: 403–416. 1983.
Biagi B.A., Enyeart J.J. Gadolinium blocks low- and high-threshold calcium currents in pituitary cells. Am. J. Physiol. 259: 515–520. 1990. https://doi.org/10.1152/ajpcell.1990.259.3.C515
Triggle D.J. Calcium-channel drugs: structure-function relationships and selectivity of action. J. Cardiovasc. Pharmacol. 18: S1–S6. 1991.
Mitchell P., Moyle J. Translocation of some anions cations and acids in rat liver mitochondria. Eur. J. Biochem. 9: 149–155. 1969. https://doi.org/10.1111/j.1432-1033.1969.tb00588.x
Zhao J., Jin J.C., Zhou Z.Q., Xia C.F., Yang X.G., Jiang F.L., Dai J., Liu Y. High concentration of gadolinium ion modifying isolated rice mitochondrial biogenesis. Biol. Trace Elem. Res. 156: 308–315. 2013. https://doi.org/10.1007/s12011-013-9821-6
Shemarova I.V., Korotkov S.M., Nesterov V.P. Effect of oxidative processes in mitochondria on contractility of heart muscle of the frog Rana temporaria. Actions of Cd2+. J. Evol. Biochem. Physiol. 47: 360–365. 2011. https://doi.org/10.1134/S0022093011040074
Szabo I., Zoratti M. Mitochondrial channels: ion fluxes and more. Physiol. Rev. 94: 519–608. 2014. https://doi.org/10.1152/physrev.00021.2013
Korotkov S.M., Saris N.E. Influence of Tl+ on mitochondrial permeability transition pore in Ca2+-loaded rat liver mitochondria. J. Bioenerg. Biomembr. 43: 149–162. 2011. https://doi.org/10.1007/s10863-011-9341-z
Korotkov S.M., Konovalova S., Emelyanova L., Brailovskaya I. Y3+, La3+, and some bivalent metals inhibited the opening of the Tl+-induced permeability transition pore in Ca2+-loaded rat liver mitochondria. J. Inorg. Biochem. 141: 1–9. 2014. https://doi.org/10.1016/j.jinorgbio.2014.08.004
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


