Журнал эволюционной биохимии и физиологии, 2020, T. 56, № 2, стр. 162-165
ЭКСПРЕССИЯ СУБЪЕДИНИЦЫ α1 ИОНОТРОПНОГО ГАМК-А РЕЦЕПТОРА В НЕОКОРТЕКСЕ КРЫС ПОСЛЕ ПЕРИНАТАЛЬНОЙ ГИПОКСИИ
Л. И. Хожай 1, *, В. А. Отеллин 1
1 Федеральное государственное бюджетное учреждение науки Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: astarta0505@mail.ru
Поступила в редакцию 22.04.2019
После доработки 18.10.2019
Принята к публикации 21.11.2019
Основным тормозным нейротрансмиттером в ЦНС млекопитающих является γ-аминомасляная кислота (ГАМК). К настоящему времени известно два класса рецепторов ГАМК; ионотропные ГАМК-А и метаботропные ГАМК-В рецепторы [1, 2]. Установлено, что у млекопитающих ГАМК-А рецепторы включают 19 субъединиц, которые сгруппированы в семь классов: α, β, γ, δ, ε, π и σ [1, 3]. Комбинации этих субъединиц дают множество изоформ ГАМК-А рецепторов, которые определяют его функциональные свойства и специфичность эффектов модуляторов ГАМК-А рецепторов, таких как нейростероиды, барбитураты, бензодиазепины и цинк, а также кинетику активации рецепторов, влияющую на их десенситизацию [4, 5]. В ГАМК-А рецепторе присутствует целый ряд сайтов связывания аллостерических модуляторов, которые могут повышать или, наоборот, снижать эффективность активации ГАМК-А рецепторов [6], важными из них являются сайты связывания бензодиазепинов и барбитуратов, представляющие собой мишени для ряда препаратов, используемых в клинической практике в качестве антиконвульсантов, антиэпилептических, анксиолитических, миорелаксантов, седативных и гипнотических средств [6].
У крыс ГАМК-А рецептор, включающий субъединицу α1 в комбинации с субъединицами – β2- и γ2-, широко распространен в различных отделах головного мозга: в неокортексе, подкорковых структурах (гиппокампе, таламусе, стриатуме, подкорковых ядрах) [7].
Однако ничего неизвестно об экспрессии субъединицы α1 в неокортексе взрослых животных, перенесших гипоксию в перинатальный период. В связи с этим целью данной работы было изучить влияние перинатальной гипоксии на уровень экспрессии субъединицы α1 ГАМК-А рецептора, у животных, достигших половозрелого возраста.
Работа проведена на лабораторных крысах линии Wistar из питомника Института физиологии им. И.П. Павлова РАН. Воздействие гипоксией проводилось на 2-е постнатальные сутки. В работе использовали 2 группы животных: 1) крысята, подвергавшиеся в барокамере воздействию гипоксии в течение 1 ч при содержании в дыхательной смеси: кислорода – 7.6–7.8%; углекислого газа – 0.15–0.21%; азота – 91.8%, при температуре 21.3–23°С и нормальном общем атмосферном давлении (760 мм рт. ст.); 2) контрольные животные того же возраста, которых помещали в барокамеру без воздействия гипоксии. Каждая группа содержала по 8–10 крысят, отобранных из разных пометов. У животных исследовали сенсомоторную область неокортекса на 90-е постнатальные сутки (П90).
Головной мозг извлекали и фиксировали в цинк-этанол-формальдегиде на фосфатно-солевом буфере (pH = 7.4), заливали в парафин по общепринятой методике и готовили серийные фронтальные срезы мозга толщиной 6–7 мкм на уровне брегмы –1.80 мм–2.04 м [8].
Иммуногистохимическую реакцию на выявление субъединицы α1 ГАМК-А рецептора проводили с использованием кроличьих поликлональных антител GABA-A Receptor alpha 1 (Abcam, США). В качестве вторичных антител использовали EnVision+System-HRP Labelled Polymer Anti-Rabbit (DakoCytomation, США). Для визуализации продукта реакции использовали хромоген DAB+ (Dako, Дания). После проведения иммуногистохимической реакции часть срезов докрашивали гематоксилином Джилла и заключали в синтетическую заливочную среду Permaunt (Termo, США). При проведении иммуногистохимической реакции все процедуры были стандартизированы и осуществлялись одновременно для гистологических срезов, полученных от контрольных и подопытных животных.
Оптическую плотность продукта реакции оценивали в телах нейронов (выделяли иммунопозитивные нейроны) и нейропиле (выделяли участки сплетений иммунопозитивных отростков, терминалей, мелких зерен и крупных гранул (последние, предположительно, считают синаптическими структурами и их скоплениями [9]). Количественную оценку иммунореактивности производили с использованием системы анализа изображения, включающей световой микроскоп Olympus CX31 (Япония), цифровую камеру VideoZavr Standard VZ-C31Sr и программное обеспечение Видеозавр Мультиметр 2.3 (разработка ООО “АТМ-практика”, Санкт-Петербург). Оценивали среднюю оптическую плотность окраски в иммунопозитивных нейронах и нейропиле в относительных единицах.
Компьютерную морфометрию для подсчета иммунопозитивных нейронов проводили на изображениях, полученных с гистологических препаратов фронтальных срезов на стандартной площади 0.1 мм2 (условная единица площади) при увеличении ок. ×10; об. ×100. Подсчитывали средние арифметические значение и ошибку среднего значения. Измерения проводили на 10 серийных срезах мозга, взятого от 4–5 животных каждой исследуемой группы. Для статистической обработки данных использовали компьютерные программы Statistica 7.0 и 8.0. (Statsoft Inc., USA). Для анализа и сравнения результатов между разными группами животных использовали t критерий Стъюдента и oneway ANOVA. Данные считались значимо отличимыми при уровне достоверности p < 0.05.
Исследование распределения иммунореактивных нейронов в разных слоях сенсомоторной области коры у контрольных животных показало, что в верхних слоях II–IV присутствовало 7.5 ± 1.1 иммунопозитивных нейронов, число иммунонегативных нейронов составляло 20.8 ± 1.9, а общее число клеток – 28.3 ± 1.5 на условную единицу площади. В слое V присутствовало 5.8 ± 0.7 иммунопозитивных нейронов и 12.6 ± 0.8 иммунонегативных, общее число клеток было равно 18.4 ± 0.8. В слое VI 10.3 ± 1.2 иммунопозитивных нейронов, 12.7 ± 1.4 иммунонегативных, общее число клеток составляло 23.4 ± 1.3.
У животных, переживших воздействие перинатальной гипоксии в верхних слоях II–IV, число иммунопозитивных нейронов составляло 6.1 ± 1.7 на условную единицу площади и иммунонегативных 12.5 ± 1.6 (значения достоверно различимы от таковых в контроле, p < 0.05), общее число клеток составляло 18.0 ± 1.8 (значения достоверно различимы от таковых в контроле, p < 0.05). В слое V число иммунопозитивных нейронов было равно 5.2 ± 0.9 на условную единицу площади, иммунонегативных – 6.8 ± 1.1 (значения достоверно различимы от таковых в контроле, p < 0.05), общее число клеток – 12.2 ± 2.0 (значения достоверно различимы от таковых в контроле, p < 0.05). В слое VI число иммунопозитивных нейронов – 7.4 ± 1.0, иммунонегативных – 8.1 ± 0.7 (значения достоверно различимы от таковых в контроле, p < 0.05), общая численность клеток – 15.8 ± 2.1 на условную единицу площади (значения достоверно различимы от таковых в контроле, p < 0.05).
Таким образом, у животных, подвергавшихся воздействию перинатальной гипоксии, общая численность нейронов сокращалась в верхних слоях на 36.4% (II–IV), в глубоких слоях (V) на 33.3% и (VI) на 32.6%. Сравнительный анализ количественных данных по слоям сенсомоторной области неокортекса показал, что у животных, переживших перинатальную гипоксию, в глубоких слоях число нейронов, экспрессирующих α1 субъединицу ГАМК-А рецептора, снижалось на 37.2%. Выявлено, что у подопытных животных в слое 1 оптическая плотность продукта реакции по сравнению с контролем значимо снижалась в 2.6 раза (табл. 1). В верхних слоях (II–IV) в телах нейронов ее значения примерно одинаковы во всех сериях опытов и соответствуют контролю. Однако в нейропиле в отростках и синаптических структурах у контрольных животных значения оптической плотности продукта реакции в 1.5 раза выше, чем после воздействия гипоксии (табл. 1; рис. 1).
Таблица 1.
Значения оптической плотности продукта иммунной реакции на выявление субъединицы α1 ГАМК-А рецептора в разных слоях неокортекса в нейронах и нейропиле на 90-е постнатальные сутки у контрольных животных и после воздействия перинатальной гипоксии (в отн. ед.)
| Слои неокортекса | Контроль | После воздействии перинатальной гипоксии | |
|---|---|---|---|
| Слой I | (нейропиль) | 0.204 ± 0.18 | 0.077 ± 0.017 * |
| Слой II–IV | (нейроны) | 0.062 ± 0.13 | 0.083 ± 0.008 |
| (нейропиль) | 0.042 ± 0.005 | 0.027 ± 0.006 * | |
| Слой V | (нейроны) | 0.132 ± 0.016 | 0.053 ± 0.011 * |
| (нейропиль) | 0.058 ± 0.009 | 0.035 ± 0.007 * | |
| Слой VI | (нейроны) | 0.098 ± 0.014 | 0.114 ± 0.01 |
| (нейропиль) | 0.047 ± 0.009 | 0.021 ± 0.006* | |
Рис. 1.
Неокортекс крысы на 90 постнатальные сутки, сенсомоторная область. Иммуногистохимическая реакция на выявление субъединицы α1 ГАМК-А рецептора: а – контроль; б – после воздействия перинатальной гипоксии. Снижение интенсивности экспрессии субъединицы α1 ГАМК-А рецептора в слое V (длинная стрелка – иммунопозитивные нейроны, короткая стрелка – иммунопозитивные отростки, гранулы и их скопления в нейропиле); Увел. ок. ×10; об. ×100.
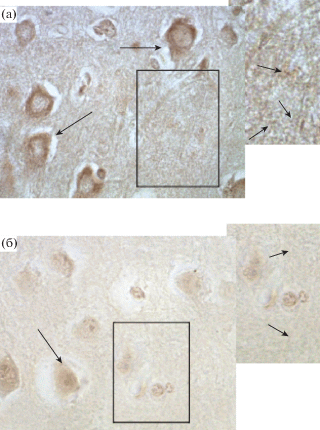
В глубоких слоях (V) у контрольных животных в цитоплазме нейронов и в нейропиле в отростках и синаптических структурах эти значения значимо выше (в 2.5 и в 1.6 раза соответственно), чем после воздействия гипоксии (табл. 1; рис. 1). В слое VI как у контрольных животных, так и подопытных, в цитоплазме нейронов значения оптической плотности продукта реакции примерно одинаковы. Однако у крыс в контроле в нейропиле в отростках и синаптических структурах эти значения значимо выше (в 2.2 раза), чем у животных, переживших перинатальную гипоксию (табл. 1).
Результаты исследования показали, что воздействие гипоксии в перинатальный период в сенсомоторной области неокортекса вызывает структурные изменения в цитоархитектонике, которые сохраняются до периода полового созревания. Во всех слоях коры значительно сокращается общая численность нейронов. Выявлено, что перинатальная гипоксия оказывает негативное воздействие на тормозную ГАМКергическую систему, последствия которого сохраняются у животных в отдаленные постнатальные сроки. Так, число нейронов, экспрессирующих субъединицу α1 ГАМК-А рецептора, сокращается более чем на 37%. Показано, что имеет место снижение интенсивности экспрессии субъединицы α1 ГАМК-А рецептора во всех слоях коры, при этом более значимое снижение отмечено в слое V. В контроле в неокортексе присутствует значительное количество вставочных ГАМКергических интернейронов, которые способны экспрессировать как ГАМК, так и рецепторные белки к ней, присутствующие в цитоплазме клеток, отростках и синапсах. Известно, что окончательное становление неокортекса, в том числе стратификация, происходит в ранний постнатальный период (первые 4 недели). Воздействие перинатальной гипоксии может нарушать как пролиферацию и дифференцировку ГАМКергических нейронов, так и их миграцию к дефинитивному месту расположения, что может сокращать численность их популяции. Более того, перинатальная гипоксия может влиять на формирование нейропиля и синаптогенез, при этом уменьшается число отростков, а также изменяется структура синапсов. В литературе есть сведения о нарушении экспрессии ГАМК-В1 и ГАМК-В2 субъединиц в гиппокампе после воздействия гипоксии/ишемии [10]. Однако механизм нарушения экспрессии субъединиц как ГАМК-В1, ГАМК-В2, так и в нашей работе α1 ГАМК-А после воздействия гипоксии остается неясным.
В заключение следует отметить, что воздействие гипоксии в перинатальный период приводит к сокращению общей численности нейронов в неокортексе, к уменьшению числа ГАМКергических нейронов, экспрессирующих субъединицу α1, и снижению уровня ее экспрессии, которые выявляются у животных в отдаленные сроки. Можно предположить, что эти изменения снижают передачу торможения в этой области коры. Учитывая широкую распространенность ГАМК-А рецептора в мозге млекопитающих, его важную роль в синаптической передаче торможения, субъединица α1 может быть удобной мишенью при применении фармакологических препаратов при ряде заболеваний центральной нервной системы. Данная работа выявила одну из мишеней воздействия гипоксии, а результаты будут способствовать поиску новых средств фармакологической коррекции ее последствий.
Список литературы
Kalanjati P., Miller S.M., Ireland Z., Colditz P.B., Bjorkman S.T. Developmental expression and distribution of GABA(A) receptor α1-, α3- and β2-subunits in pig brain. Dev. Neurosci. 33. 2: 99-109. 2011.
Gaspary H.L., Wang W., Richerson G.B. Carrier-mediated GABA release activates GABA receptors on hippocampal neurons. J. Neurophysiol. 80 (1): 270–281. 1998.
Hevers W., Korpi E.R., Luddens H. Assembly of functional alpha6beta3gamma2delta GABA(A) receptors in vitro. Neuroreport. 11 (18): 4103–4106. 2000.
Banks M.I., Pearce R.A. Kinetic differences between synaptic and extrasynaptic GABA(A) receptors in CA1 pyramidal cells. J. Neurosci. 20 (3): 937–948. 2000.
Cherubini E., Conti F. Generating diversity at GABAergic synapses. Trends Neurosci. 24 (3): 155–162. 2001.
Bai D., Zhu G., Pennefather P. Distinct functional and pharmacological properties of tonic and quantal inhibitory postsynaptic currents mediated by gamma-aminobutyric acid(A) receptors in hippocampal neurons. Mol. Pharmacol. 59 (4): 814–824. 2001.
Pirker S., Schwarzer C., Wieselthaler A., Sieghart W., Sperk G. GABA(A) receptors: immunocytochemical distribution of 13 subunits in the adult rat brain. Neuroscience. 101 (4): 815–50. 2000.
Paxinos G., Watson C. The Rat Brain in stereotaxic coordinates. London: Press. 1998.
Guthmann A., Fritschy J.M., Ottersen O.P., Torp R., Herbert H. GABA, GABA transporters, GABA(A) receptor subunits, and GAD mRNAs in the rat parabrachial and Kölliker-Fuse nuclei. J. Comp. Neurol. 400 (2): 229–243. 1998.
Cho S., Liu D., Fairman D., Li P., Jenkins L., McGonigle P., Wood A. Spatiotemporal evidence of apoptosis-mediated ischemic injury in organotypic hippocampal slice cultures. Neurochem. Int. 45: 117–127. 2004.
Дополнительные материалы отсутствуют.
Инструменты
Журнал эволюционной биохимии и физиологии


