Экология, 2023, № 3, стр. 228-234
Влияние гипомагнитных условий и изменения солености воды на продукционные и морфометрические показатели Daphnia magna Straus
А. А. Сизова a, *, Д. А. Сизов a, В. В. Крылов a
a Институт биологии внутренних вод им. И.Д. Папанина РАН
152743 Ярославская обл., Некоузский р-н, п. Борок, Россия
* E-mail: batrakova_a@mail.ru
Поступила в редакцию 25.04.2022
После доработки 15.12.2022
Принята к публикации 09.01.2023
- EDN: FOODCI
- DOI: 10.31857/S0367059723030071
Аннотация
Изучено совместное и раздельное влияние различной солености воды (0.5, 1.5 и 3 г/л) и гипомагнитных условий на пресноводных ракообразных Daphnia magna. Снижение индукции магнитного поля приводило к значимому уменьшению размеров самок и периода между выводками, увеличению количества производимого потомства и длины тела потомков в первом выводке с последующим уменьшением количества производимого потомства с четвертого по шестой выводки. Увеличение солености воды в меньшей степени сказалось на исследуемых показателях. В воде соленостью 3 г/л первое потомство появилось позже, чем в других группах, и было более многочисленным. Заметен тренд к росту длины хвостовой иглы с повышением солености. Взаимодействие факторов оказывало влияние на сроки появления первого выводка и размеры рачков-производителей. Обсуждаются причины и возможные механизмы возникновения описанных эффектов.
В последние годы проявления глобальных климатических изменений становятся заметнее. Трансформация параметров окружающей среды сказывается на живых организмах, вызывая изменение ареалов видов, смену стратегий популяций, усиление конкуренции [1–3]. Для человека итогом этих процессов могут стать существенные изменения в структуре и продуктивности биологических ресурсов [4, 5]. Несмотря на вероятностный характер долгосрочных прогнозов, необходимо сегодня оценить влияние возможных изменений климата на биоту.
В числе общих последствий глобальных климатических трансформаций для пресноводных экосистем указывают повышение солености за счет увеличения испарения с поверхности водных масс при недостатке поступления пресной воды [2, 3]. Кроме того, существенный вклад в засоление пресных вод вносит деятельность человека: сельское хозяйство, добыча полезных ископаемых, применение антиобледенителей на дорогах и т.п. [6]. Повышение солености водной среды может существенно сказаться на жизнедеятельности и размножении гидробионтов [7, 8].
В геологической истории нашей планеты неоднократно происходил процесс инверсии геомагнитных полюсов, что подтверждается различиями в намагниченности образцов вулканических пород, датируемых разным временем [9, 10]. Поскольку такие инверсии случались нерегулярно [11], существует вероятность, что регистрируемое в последние годы ускорение движения магнитных полюсов по коридорам инверсии может быть начальной стадией этого процесса [12]. В геологической истории инверсии геомагнитных полюсов сопровождались снижением напряженности магнитного поля Земли [10]. Такие гипомагнитные условия оказывают влияние на живые организмы [13], включая гидробионтов [14–16].
Существует вероятность того, что глобальные климатические изменения совпадут с процессом инверсии магнитных полюсов Земли. Однако в научной литературе нам не удалось найти публикаций об изучении влияния снижения напряженности геомагнитного поля и факторов, сопровождающих глобальные климатические изменения, на животных. Одним из наиболее удобных гидробиологических объектов для таких исследований является рачок Daphnia magna Straus – важное звено в трофической цепи пресноводных экосистем [17]. Дафнии быстро размножаются, неприхотливы при культивировании. D. magna – эвригалийный вид ветвистоусых ракообразных [18, 19]. Известно [18, 20], что популяции этого пресноводного вида могут существовать при солености 4‰. В литературе имеются сведения о раздельном влиянии солености [21–23] и гипомагнитных условий [16] на D. magna.
Цель настоящей работы – изучить влияние раздельного и совместного действия гипомагнитных условий и разной солености водной среды на морфометрические и продукционные показатели D. magna.
МАТЕРИАЛ И МЕТОДЫ
В качестве объекта исследований была использована лабораторная культура D. magna, предоставленная биологическим факультетом Московского государственного университета им. М.В. Ломоносова и изначально выделенная из пресноводной популяции. Рачки содержались в лаборатории популяционной биологии и генетики ИБВВ РАН на протяжении 3 лет в пресной воде. Условия культивирования дафний соответствовали стандартным [24]. Рачков содержали при температуре 21°С и фотопериоде 16 ч день/8 ч ночь в аэрированной жесткой воде, соответствующей водной среде в протоколах ASTM [25]. Электропроводность воды составляла 460 См, pH 7.97, содержание кислорода 7.71 мг/л. Воду меняли два раза в неделю. Дафний ежедневно кормили суспензией клеток Chlorella vulgaris Beijerinck (3–3.5) × 105 клеток/мл. Водоросли культивировали в среде Тамия и концентрировали при помощи центрифуги (K23D; MLW, Лейпциг, Германия).
В опытах использовали воду соленостью 0.5, 1.5 и 3 г/л. Первое значение соответствует солености, встречающейся в настоящее время в водоемах Ярославской области [26, 27], второе и третье моделируют вероятное увеличение этого показателя в связи с климатическими изменениями [28]. Солености 1.5 и 3 мг/л достигали путем растворения NaCl в культивационной воде. Контроль этих значений производили ежедневно путем измерения электропроводности (AP-2, HM Digital, Южная Корея) и перевода данного показателя в соленость с учетом количества растворенных ионов. При смене воды всегда готовили новые растворы солей, а контрольные замеры проводили до и после смены.
В опытах использовали геомагнитное поле (51.7 ± 0.2 мкТл) и гипомагнитные условия (0 ± ± 0.5 мкТл). Первое условие соответствует норме в месте проведения экспериментов, второе моделирует изменения в процессе инверсии магнитных полюсов Земли. Для создания гипомагнитных условий использовали три пары взаимно ортогональных колец Гельмгольца (диаметр 0.5 м), имеющие одинаковые геометрические размеры и общий центр, и три источника постоянного тока (АКИП-1103, Manson Engineering Industrial Ltd., Китай). На обмотку каждой пары колец Гельмгольца подавали ток такой силы, чтобы генерируемое магнитное поле было равным по силе и противоположно направленным каждой из трех компонент геомагнитного поля. При этом в центре системы колец Гельмгольца генерируемое постоянное магнитное поле компенсировало геомагнитное поле за счет суперпозиции. Контроль параметров магнитного поля внутри системы колец Гельмгольца, а также измерение параметров геомагнитного поля проводили ежедневно с помощью трехкомпонентного магнитометра НВ0302А (НПО ЭНТ, Санкт-Петербург).
Опыты проводили в полипропиленовых емкостях объемом 50 мл, содержащих 40 мл среды. Из синхронизированной культуры D. magna (потомки F2 одной особи) случайным образом отбирали 120 новорожденных особей не старше 24 ч. Рачков помещали в емкости с водой разной солености – по одной особи в каждую емкость. Одну часть дафний размещали в центре системы колец Гельмгольца, где генерировались гипомагнитные условия, другая оставалась в геомагнитном поле. Таким образом получили 6 экспериментальных групп по 20 рачков в каждой: 1) геомагнитное поле, соленость 0.5 г/л; 2) геомагнитное поле, соленость 1.5 г/л; 3) геомагнитное поле, соленость 3 г/л; 4) гипомагнитные условия, соленость 0.5 г/л; 5) гипомагнитные условия, соленость 1.5 г/л; 6) гипомагнитные условия, соленость 3 г/л.
Экспозиция дафний в исследуемых условиях продолжалась в течение 29 дней. Регистрировали день появления первого выводка, количество производимого потомства в первом выводке, количество производимого потомства в первых пяти выводках, число мертворожденных потомков в выводках, период между выводками, длину тела потомков в первом выводке, смертность родительских особей, а также длину тела, ширину карапакса и длину хвостовой иглы производителей к моменту окончания эксперимента.
Для определения морфометрических показателей рачки были сфотографированы при увеличении ×30 с помощью бинокулярного микроскопа МБС-8 и окуляр-камеры DCM-500 (Hangzhou Huaxin IC Technology, Hangzhou, China). Затем на фотографиях с использованием программы Image-Pro Plus (Media Cybernetics, Rockville, MD, USA) были определены морфометрические показатели путем соотношения числа пикселей, соответствующих промеру, с заданным эталонным размером.
Полученные данные имели нормальное распределение, поэтому для анализа использовали двухфакторный дисперсионный анализ. Различия между средними значениями оценивали при помощи апостериорного критерия Тьюки.
РЕЗУЛЬТАТЫ
Смертность дафний до окончания эксперимента составила 2.5% в группах рачков, находившихся в геомагнитном поле. Этот показатель не превышал предел случайного варьирования для контрольных условий при проведении токсикологических исследований [24]. В остальных вариантах выживаемость дафний составила 100%.
Если говорить о первом потомстве, то дисперсионный анализ показал значимое влияние магнитных условий на размеры молоди (F[1,111] = 19.852, p < 0.001, ŋ2 = 0.15) и количество особей в первом выводке (F[1,112] = 26.38, p < 0.001, ŋ2 = 0.19). Эти эффекты были связаны с увеличением размеров молоди и количества особей в первом выводке у содержавшихся в гипомагнитных условиях дафний в сравнении с самками, экспонированными в контрольных условиях (рис. 1а, 1б). Фактор солености также оказывал влияние на эти показатели: F[2,111] = 5.32, p < 0.01; ŋ2 = 0.09 – для размеров молоди; F[2,112] = 21.42, p < 0.001, ŋ2 = 0.28 – для количества особей в первом выводке. Здесь основную роль сыграло увеличение данных характеристик при содержании рачков в воде соленостью 3 г/л. Взаимодействие факторов не оказывало влияния на размеры молоди и количество особей в первом выводке.
Рис. 1.
Влияние магнитных условий и солености на продукционные показатели D. magna: а – размеры молоди, б – количество особей в первом выводке, в – сроки появления первого потомства, г – период между выводками. Приведены средние значения, планки погрешностей соответствуют стандартной ошибке. Значимые различия между группами (тест Тьюки, p < 0.05) обозначены разными буквами.
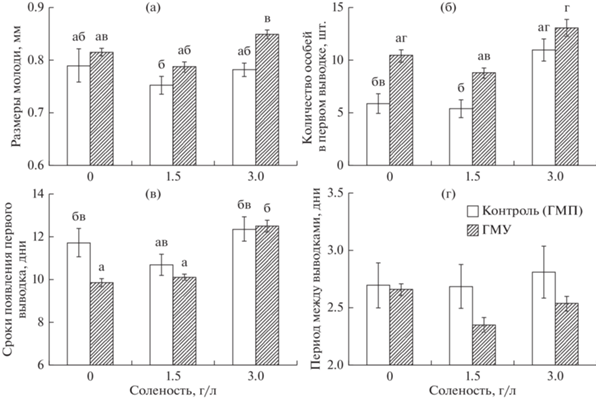
Сроки появления первого выводка зависели от солености водной среды (F[2,112] = 12.25, p < 0.001, ŋ2 = 0.18). В меньшей степени на этот показатель влияли магнитные условия (F[1,112] = 5.24, p < 0.05, ŋ2 = 0.04) и взаимодействие факторов (F[2,112] = = 3.17, p < 0.05, ŋ2 = 0.05). Средние значения показателя в исследованных группах рачков представлены на рис. 1в.
Дисперсионный анализ показал значимое влияние магнитных условий на период между выводками (F[1,110] = 6.54, p < 0.05, ŋ2 = 0.06), что было связано с увеличением этого показателя у дафний в геомагнитном поле в сравнении с рачками, содержавшимися в гипомагнитных условиях (рис. 1г).
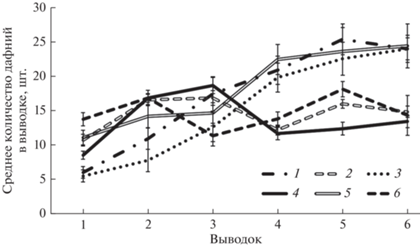
Динамика изменения количества потомков в выводках представлена на рис. 2. Заметны менее обильные по сравнению с другими группами первые выводки у дафний, развивавшихся в среде соленостью 0.5 и 1.5 г/л в геомагнитном поле. Впоследствии, начиная с 4-го выводка, заметно разделение на 2 группы: дафнии, содержавшиеся в геомагнитном поле при любой солености, производили больше молоди, тогда как объемы выводков у рачков, находившихся в гипомагнитных условиях, были заметно меньше.
Рис. 2.
Динамика изменения количества потомков в выводках D. magna: 1 – ГМП, соленость 0.5 г/л; 2 – ГМП, соленость 1.5 г/л; 3 – ГМП, соленость 3 г/л; 4 – ГМУ, соленость 0.5 г/л; 5 – ГМУ, соленость 1.5 г/л; 6 – ГМУ, соленость 3 г/л. Приведены средние значения, планки погрешностей соответствуют стандартной ошибке.
Дисперсионный анализ выявил значимое преимущественное влияние магнитных условий на ширину карапакса и длину тела самок на момент окончания эксперимента (F[1,110] = 14.35, p < 0.001, ŋ2 = 0.12 и F[1,110] = 8.21, p < 0.01, ŋ2 = 0.07 соответственно). Эти эффекты были обусловлены снижением размерных показателей дафний в гипомагнитных условиях (рис. 3а, 3б). В меньшей степени на размеры самок влияло взаимодействие факторов магнитных условий и солености (F[2,110] = 4.5540, p < 0.01, ŋ2 = 0.08). Описанный эффект был вызван тем, что средние значения показателя у дафний, содержавшихся в геомагнитном поле при максимальном уровне солености, были существенно и значимо выше, чем у самок, экспонированных в гипомагнитных условиях при той же солености (рис. 3а, 3б).
Рис. 3.
Влияние магнитных условий и солености на морфометрические показатели D. magna: а – ширина карапакса, б – длина тела самок, в – длина хвостовой иглы самок. Приведены средние значения, планки погрешностей соответствуют стандартной ошибке. Значимые различия между группами (тест Тьюки, p < 0.05) обозначены разными буквами.
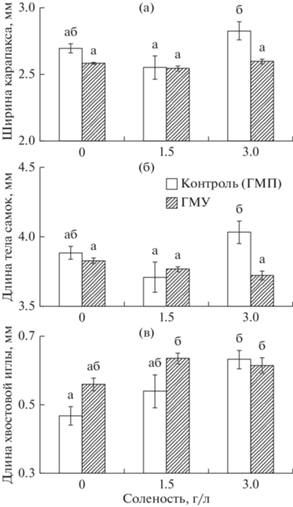
Напротив, на длину хвостовой иглы, соленость (F[2,108] = 8.12, p < 0.001, ŋ2 = 0.13) оказывала большее воздействие, чем магнитные условия (F[1,108] = 5.04, p < 0.05, ŋ2 = 0.04). Первый эффект обусловлен трендом к увеличению этого показателя с ростом концентрации соли в воде, второй – с незначительным увеличением длины хвостовой иглы в гипомагнитных условиях (рис. 3в).
ОБСУЖДЕНИЕ
Исследованные факторы значимо влияли на продукционные и морфометрические показатели D. magna. Можно выделить группу эффектов, вызванных изменением магнитных условий, к которым относятся снижение длины тела, ширины карапакса и незначительное увеличение длины хвостовой иглы у родительских особей, сокращение сроков появления первого выводка, увеличение размеров молоди и количества особей в первом выводке, которое впоследствии сменялось снижением количества потомства, производимого в 4–6-м выводках, при содержании дафний в гипомагнитных условиях.
Эти эффекты соотносятся с полученными ранее данными. В частности, сокращение количества производимого потомства во 2-, 4- и 5-м выводках и снижение размеров родительских особей были описаны при длительном пожизненном содержании D. magna в гипомагнитных условиях [16]. Снижение репродуктивного потенциала и размеров производителей при ослаблении индукции геомагнитного поля регистрировали для других видов беспозвоночных: темной цикадки Laodelphax striatellus и бурой рисовой цикадки Nilaparvata lugens [29]. Имеются сведения о нарушениях раннего развития позвоночных животных в гипомагнитных условиях [30, 31]. Описанные биологические эффекты ослабления индукции геомагнитного поля, по-видимому, имеют общебиологический характер.
Соленость повлияла на меньший набор исследуемых показателей в основном за счет эффектов, связанных с экспонированием рачков в воде с солесодержанием 3 г/л. Причем рост количества производимого потомства в первом выводке при увеличении сроков появления первого потомства в группах рачков, содержавшихся в воде с максимальной соленостью, может быть связано с резорбцией яичников или яиц у некоторых особей. Следующая, более многочисленная генерация потомков у таких особей, формально соответствующая первому выводку, появляется позднее, что приводит к изменениям, наблюдавшимся при экспонировании рачков в воде с солесодержанием 3 г/л. Следует отметить, что D. magna – довольно толерантный к изменению солености вид ветвистоусых ракообразных [18, 19]. В экспериментах других исследователей [32–34] соленость порядка 3–4‰ легко переносилась этими животными и также приводила к увеличению размеров тела и репродуктивной функции [35].
Таким образом, различия между группами рачков, развивавшимися в гипомагнитных условиях и геомагнитном поле при солености 3 г/л, можно рассматривать как аддитивные эффекты. Был выявлен эффект увеличения длины хвостовой иглы D. magna с повышением солености. В литературе встречаются упоминания об изменении этого признака в ответ на присутствие хищников [36]. В работах, посвященных исследованиям влияния различной солености на дафний, мы не смогли найти упоминаний о подобных эффектах, так как этот морфологический признак учитывается довольно редко. Известно, что длинная хвостовая игла позволяет дафниям медленнее спускаться на дно. Таким животным достаточна более низкая частота биений антенн для противодействия погружению по сравнению с дафниями, имеющими короткую хвостовую иглу [37, 38]. Увеличение хвостовой иглы с ростом солености в наших экспериментах можно рассматривать как адаптивное преобразование для снижения энергетических затрат.
Процессы осморегуляции у пресноводных гидробионтов в ответ на увеличение солености среды хорошо описаны [39]. Возможные механизмы воздействия слабых магнитных полей на организмы в настоящее время представлены несколькими гипотезами [40]. Наиболее часто в литературе обсуждается возможное влияние магнитных полей на ферромагнитные наночастицы в живых тканях [41], на синглет-триплетные переходы в бирадикальных биохимических реакциях [42], на динамику магнитных моментов парамагнитных ионов, протонов и других магнитных ядер [43]. Предполагается, что существенное ослабление геомагнитного поля, которое является ключевым элементом общего магнитного фона, влияет на множество обладающих магнитным моментом частиц в тканях, вызывая биологические эффекты на более высоких уровнях организации [40].
Обнаруженные нами эффекты задержки отрождения первого потомства, снижения количества потомков, производимых в 4–6-м выводках, и размеров рачков-производителей – это неспецифичные реакции дафний на неблагоприятные внешние воздействия. Ранее такие эффекты регистрировали у рачков в ответ на присутствие токсикантов, изменение температуры среды, фотопериода, доступности пищи и т. д. [44–48]. Отклонение факторов от оптимума ведет к затратам дополнительных ресурсов и энергии, что приводит к замедлению темпов роста рачков и снижению репродуктивного потенциала. Следует отметить, что результаты описанного эксперимента получены с использованием пресноводной популяции дафний. Вероятно, D. magna из солоноватых вод могут иначе ответить на исследованные воздействия. Проверка этой гипотезы может стать задачей дальнейших экспериментов.
Полученные нами результаты свидетельствуют о том, что изменения в окружающей среде, которые могут возникнуть вследствие глобальных климатических и геофизических процессов и смоделированные в данном эксперименте, существенно влияют на пресноводных ракообразных D. magna. Причем фактор солености, который существенно меняется в пределах ареала этого вида, оказывает меньшее воздействие в сравнении со снижением индукции геомагнитного поля. Палеомагнитные данные указывают на то, что последний раз гипомагнитные условия на Земле существовали около 42 000 лет назад [11]. Вполне закономерно, что изменения такого стабильного фактора менее ожидаемы организмом и, следовательно, приводили к более заметным эффектам в нашем эксперименте.
Учитывая эвригалийность D. magna [18, 19], незначительную смертность рачков в эксперименте и имеющиеся в литературе данные об адаптации этого вида к магнитным воздействиям в ряду поколений [49, 50], можно предположить, что при совпадении процессов засоления пресных вод с понижением индукции геомагнитного поля, сопровождающим инверсии магнитных полюсов Земли, дафнии смогут поддерживать численность популяции при условии, что другие виды в экосистемах будут столь же пластичны. Последнее требует отдельной экспериментальной проверки. Кроме того, чтобы точно знать, обратимы ли наблюдаемые эффекты совместного влияния гипомагнитных условий и засоления водной среды на дафний и позволит ли экологическая пластичность адаптироваться к подобным изменениям, необходимы дополнительные исследования.
Работа выполнена за счет гранта Российского научного фонда № 22-24-20053, https://rscf.ru/ project/22-24-20053/.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Dutkiewicz S., Scott J.R., Follows M.J. Winners and losers: Ecological and biogeochemical changes in a warming ocean // Glob. Biogeochem. Cycles. 2013. V. 27. P. 463–477. https://doi.org/10.1002/gbc.20042
Ficke A.D., Myrick C.A., Hansen L.J. Potential impacts of global climate change on freshwater fisheries // Rev. Fish Biol. Fish. 2007. V. 17. P. 581–613.
Suen J.P., Lai H.N. A salinity projection model for determining impacts of climate change on river ecosystems in Taiwan // J. Hydrol. 2013. V. 493. P. 124–131. https://doi.org/10.1016/j.jhydrol.2013.04.020
O’Connor M.I., Piehler M.F., Leech D.M. et al. Warming and resource availability shift food web structure and metabolism // PLoS Biol. 2009. V. 7. e1000178. https://doi.org/10.1371/journal.pbio.1000178
Bideault A., Galiana N., Zelnik Y.R. et al. Thermal mismatches in biological rates determine trophic control and biomass distribution under warming // Glob. Change Biol. 2020. V. 27. P. 257–269. https://doi.org/10.1111/gcb.15395
David Cunillera-Montcusí, Meryem Beklioğlu, Miguel Cañedo-Argüelles et al. Freshwater salinisation: a research agenda for a saltier world // Trends Ecol. Evol. 2022. V. 37. P. 440-453. https://doi.org/10.1016/j.tree.2021.12.005
Iqbal K.J., Qureshi N.A., Ashraf M. et al. Effect of different salinity levels on growth and survival of Nile tilapia (Oreochromis niloticus) // J. Anim. Plant. Sci. 2012. V. 22. P. 919–922.
Jeppesen E., Brucet S., Naselli-Flores L. et al. Ecological impacts of global warming and water abstraction on lakes and reservoirs due to changes in water level and related changes in salinity // Hydrobiologia. 2015. V. 750. P. 201–227. https://doi.org/10.1007/s10750-014-2169-x
Cande S.C., Kent D.V. Revised calibration of the geomagnetic polarity timescale for the Late Cretaceous and Cenozoic // J. Geophys. Res. 1995. V. 100. P. 6093–6095.
Valet J.-P., Fournier A. Deciphering records of geomagnetic reversals //Rev. Geophys. 2016. V. 54. P. 410–446. https://doi.org/10.1002/2015RG000506
Lutz T. The magnetic reversal record is not periodic // Nature. 1985. V. 317. P. 404–407. https://doi.org/10.1038/317404a0
Cooper A., Turney C.S.M., Palmer J. et al. A global environmental crisis 42000 years ago // Science. 2021. V. 371. P. 811–818.
Binhi V.N., Prato F.S. Biological effects of the hypomagnetic field: An analytical review of experiments and theories // PLoS One. 2017. V. 12. e0179340.
Kantserova N.P., Krylov V.V., Lysenko L.A. et al. Effects of hypomagnetic conditions and reversed geomagnetic field on calcium-dependent proteases of invertebrates and fish // Izv. Atmos. Ocean. Phys. 2017. V. 7. P. 719–723.
Golovanova I.L., Filippov A.A., Krylov V.V. Sensitivity of digestive glycosidases to heavy metals in roach Rutilus rutilus (L.) yearlings: the consequences of hypogeomagnetic conditions during early ontogenesis // Inland Water Biol. 2019. V. 12. P. 104–108.
Krylov V.V., Bolotovskaya I.V., Osipova E.A. The response of European Daphnia magna Straus and Australian Daphnia carinata King to changes in geomagnetic field // Electromagn. Biol. Med. 2013. V. 32. P. 30–39.
Peters P.H., De Bernardi R. Daphnia // Mem. Ist. Ital. Idrobiol. 1987. V. 45. P. 502.
Lagerspetz K. Physiological studies on the brackish water tolerance of some species of Daphnia // Arch. Soc. Zool. Bot. Fenn. Vanamo. 1955. V. 9. P. 138–143.
Ortells R., Reusch T.B.H., Lampert W. Salinity Tolerance in Daphnia magna characteristics of genotypes hatching from mixed sediments // Oecologia. 2005. V. 143. P. 509–516.
Bengtsson J. Life histories and interspecific competition between three Daphnia species in rockpools // J. Anim. Ecol. 1986. V. 55. P. 641–655.
Arner M., Koivisto S. Effects of salinity on metabolism and life history characteristics of Daphnia magna // Hydrobiologia. 1993. V. 259. P. 69–77.
Garreta-Lara E., Campos B., Barata C. et al. Combined effects of salinity, temperature and hypoxia on Daphnia magna metabolism // Sci. Total. Environ. 2018. V. 610–611. P. 602–612. https://doi.org/10.1016/j.scitotenv.2017.05.190
Goncalves A.M.M., Castro B.B., Pardal M.A., Goncalves F. Salinity effects on survival and life history of two freshwater cladocerans (Daphnia magna and Daphnia longispina) // Ann. Limnol. Int. J. Lim. 2007. V. 43. P. 13–20.
Методика измерений количества дафний (Daphnia magna Straus) для определения токсичности питьевых, пресных природных и сточных вод, водных вытяжек из грунтов, почв, осадков сточных вод, отходов производства и потребления методом прямого счета ПНД Ф Т 14.1:2:3:4.12-06 / Т 16.1:2:2.3:3.9-06. М.: Федеральная служба по надзору в сфере природопользования, 2014. 39 с.
Standard practice for conducting acute toxicity tests with fishes, macroinvertebrates and amphibians. Philadelphia: American Standards for Testing and Materials, 1980. 22 p.
Буторин Н.В. Экосистема озера Плещеево. Л.: Наука, 1989. 264 с.
Бикбулатов Э.С., Бикбулатова Е.М., Литвинов А.С., Поддубный С.А. Гидрология и гидрохимия озера Неро. Рыбинск: Рыбинский Дом печати, 2003. 192 с.
Климатический центр Росгидромета. Сценарные прогнозы на основе глобальных моделей CMIP5 https://cc.voeikovmgo.ru/ru/klimat/izmenenie-klimata-rossii-v-21-veke (ссылка активна 17.01.2023).
Wan G.J., Jiang S., Zhao Z.-C. et al. Bio-effects of near-zero magnetic fields on the growth, development and reproduction of small brown planthopper, Laodelphax striatellus and brown planthopper, Nilaparvata lugens // J. Insect Physiol. 2014. V. 68. P. 7–15.
Труханов К.А., Гурьева Т.С., Дадашева О.А. и др. Эмбриогенез японского перепела в гипомагнитных условиях применительно к дальним космическим полетам // Радиационная биология. Радиоэкология. 2014. Т. 54. № 2. С. 179–185. https://doi.org/10.7868/S086980311402012X
Fesenko E.E., Mezhevikina L.M., Osipenko M.A. et al. Effect of the “zero” magnetic field on early embryogenesis in mice // Electromagn. Biol. Med. 2010. V. 29. P. 1–8. https://doi.org/10.3109/15368371003627290
Gonçalves A.M.M., Castro B.B., Pardal M.A., Gonçalves F. Salinity effects on survival and life history of two freshwater cladocerans (Daphnia magna and Daphnialongispina) // Ann. Limnol. Int. J. Lim. 2007. V. 43. P. 13–20. https://doi.org/10.1051/limn/2007022
Martínez-Jerónimo F., Martínez-Jerónimo L. Chronic effect of NaCl salinity on a freshwater strain of Daphnia magna Straus (Crustacea: Cladocera): a demographic study // Ecotoxicol. Environ. Saf. 2007. V. 67. P. 411–416.
Zadereev E.S., Lopatina T.S., Ovchinnikov S.D. et al. The effect of salinity on the grazing rate and survival of Daphnia magna females adapted to different salinities // Aquat. Ecol. 2022. V. 56. P. 639–652. https://doi.org/10.1007/s10452-021-09941-7
Arnér M., Koivisto S. Effects of salinity on metabolism and life history characteristics of Daphnia magna // Hydrobiologia. 1993. V. 259. P. 69–77. https://doi.org/10.1007/BF00008373
Caramujo M.-J., Boavida M.-J. Induction and costs of tail spine elongation in Daphnia hyalina×galeata: reduction of susceptibility to copepod predation // Freshw. Biol. 2000. V. 45. P. 413–423.
Jacobs J. Untersuchungen zur funktion und evoluton der zyklomorphose bei Daphnia, mit besonderer berücksichtigung der selektion durch fische // Archiv für Hydrobiologie. 1967. Ht 62. S. 467–541.
Gießler S. Schwimm charakteristiken von Daphnia cucullata und Daphnia hyalina // Diplom-thesis. München: Ludwig-Maximilians-Universität, 1982.
Хлебович В.В., Аладин Н.В. Фактор солёности в жизни животных // Вестник РАН. 2010. Т. 80. № 5–6. С. 527–532.
Binhi V.N., Prato F.S. Biological effects of the hypomagnetic field: an analytical review of experiments and theories // PLoS One. 2017. V. 12. e0179340. https://doi.org/10.1371/journal.pone.0179340
Walker M.M. A model for encoding of magnetic field intensity by magnetite-based magnetoreceptor cells // J. Theor. Biol. 2008. V. 250. P. 85–91.
Buchachenko A.L. Magnetic field-dependent molecular and chemical processes in biochemistry, genetics and medicine // Russ. Chem. Rev. 2014. V. 83. P. 1–12.
Бинги В.Н. Первичный физический механизм биологических эффектов слабых магнитных полей // Биофизика. 2016. Т. 61. № 1. С. 201–208.
Enserink L., Luttmer W., Maas-Diepeveen H. Reproductive strategy of Daphnia magna affects the sensitivity of its progeny in acute toxicity tests // Aquat. Toxicol. 1990. V. 17. P. 15–25.
Gliwicz Z.M., Guisande C. Family planning in Daphnia: resistance to starvation in offspring born to mothers grown at different food levels // Oecologia. 1992. V. 91. P. 463–467.
Lampert W. Phenotypic plasticity of the size at first reproduction in Daphnia: the importance of maternal size // Ecology. 1993. V. 74. P. 1455–1466.
Enserink L., de la Haye M., Maas H. Reproductive strategy of Daphnia magna: implications for chronic toxicity tests // Aquat. Toxicol. 1993. V. 25. P. 111–123.
Alekseev V., Lampert W. Maternal effects of photoperiod and food level on life history characteristics of the cladoceran Daphnia pulicaria Forbes // Hydrobiologia. 2004. V.526. P. 225–230.
Krylov V.V., Osipova E.A. The response of Daphnia magna Straus to the long-term action of low-frequency magnetic fields // Ecotoxicology and Environmental Safety. 2013. V. 96. P. 213–219. https://doi.org/10.1016/j.ecoenv.2013.06.012
Krylov V.V., Osipova E.A. The response of Daphnia magna Straus to long-term exposure to simulated geomagnetic storms // Life Sciences in Space Research. 2019. V. 21. P.83–88. https://doi.org/10.1016/j.lssr.2019.04.004
Дополнительные материалы отсутствуют.


