Доклады Российской академии наук. Науки о жизни, 2023, T. 509, № 1, стр. 166-169
Белок Xmas-2 Drosophila melanogaster подвергается расщеплению на два фрагмента
М. М. Куршакова 1, академик РАН С. Г. Георгиева 1, Д. В. Копытова 1, *
1 Федеральное государственное учреждение науки Институт молекулярной биологии
Российской академии наук
Москва, Российская Федерация
* E-mail: d_dmitrieva@mail.ru
Поступила в редакцию 10.10.2022
После доработки 07.11.2022
Принята к публикации 10.11.2022
- EDN: NAZLMZ
- DOI: 10.31857/S2686738922700111
Аннотация
Комплекс TREX-2 объединяет несколько стадий экспрессии генов, таких как активация транскрипции и экспорт мРНК. У D. melanogaster TREX-2 состоит из четырех основных белков: Xmas-2, ENY2, PCID2, Sem1p. Белок Xmas-2 является ядром комплекса, с которым взаимодействуют другие субъединицы TREX-2. Гомологи Xmas-2 найдены у всех высших эукариот. Ранее было показано, что гомолог Xmas-2 человека, белок GANP, может подвергаться расщеплению на две части, вероятно, во время апоптотической гибели клеток. Мы показали, что белок Xmas-2 D. melanogaster также способен расщепляться на два фрагмента. Получающиеся фрагменты соответствуют двум большим доменам Xmas-2. Деление белка наблюдается как in vivo, так и in vitro. Однако раcщепление Xmas-2 у D. melanogaster наблюдается при нормальных условиях и, возможно, является частью механизма регуляции транскрипции и экспорта мРНК у D. melanogaster.
Регуляция экспрессии генов обеспечивает правильное функционирование клетки эукариот, ее деление, дифференцировку и взаимодействие с другими клетками. С мРНК на разных стадиях ее созревания и экспорта связываются различные белки, которые формируют мРНП частицу [1]. Комплекс TREX-2 является одним из основных участников экспорта мРНК из ядра в цитоплазму [2–5]. Основными белками комплекса D. melanogaster являются белки Xmas-2, PCID2, ENY2, Sem1p. Белок Xmas-2 в составе комплекса играет функцию скаффолда, с которым взаимодействуют все остальные белки.
К настоящему времени данные о доменах взаимодействия с другими белками комплекса и РНК имеются только для ортолога Xmas-2 у дрожжей – белка Sac3 [6–8]. На рис. 1а представлена схема доменной структуры Xmas-2, основанная на его гомологии с Sac3. На N-конце белка располагается РНК-связывающий домен. С 146 по 501 ак находится домен семейства Sac3-GANP. В этом домене и распространяясь несколько шире в C-концевую область, находится сайт взаимодействия Xmas-2 с PCID2 и РНК (WH). Сразу после WH домена уже в C-концевой части располагается CID домен. Этот домен у дрожжей отвечает за взаимодействие гомолога Xmas-2 с гомологом ENY2, который в свою очередь взаимодействует с комплексом SAGA и ядерной порой [9]. Нами был выделен совместный комплекс TREX-2 и ORC, участвующий в экспорте мРНК [10], было показано, что CID-домен и С-концевая область Xmas-2 необходимы для связывания Xmas-2 с субъединицей ORC комплекса – белком Orc3 в комплексе с ENY2 [10, 11].
Рис. 1.
Анализ Xmas-2 D. melanogaster. (а) – Схема доменной организации Xmas-2, основанная на его гомологии с ортологом дрожжей Sac3. Указаны домен семейства SAC3-GANP, домен взаимодействия с ENY2 – CID, домен взаимодействия с РНК – RRM, домен взаимодействия с PCID2 и Sem1p – WH. (б) – Фореграмма Вестерн-блот-анализа белков из ядерного эмбрионального экстракта D. melanogaster. Экстракт, при выделении которого были добавлены ингибиторы фосфатаз, указан как “+”. Гибридизация с антителами к Xmas-2. Слева – маркёр молекулярного веса.
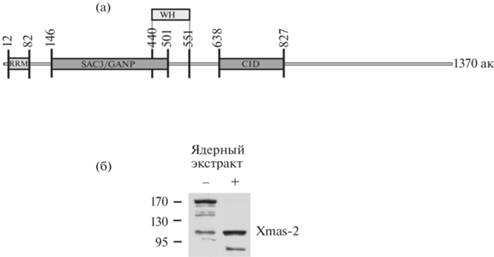
У гомолога Xmas-2 человека, белка GANP, показано расщепление белка на две части. Один из образующихся белков соответствует N-концевой части белка, в то время как C-концевая часть белка, включающая CID домен, входит в состав второго белка. У человека расщепление GANP не происходит в нестрессовых условиях [12]. У D. melanogaster при Вестерн-блот анализе белок Xmas-2 выявляется в виде полосы, соответствующей полноразмерному расчетному белку в ядерном эмбриональном экстракте, но также в минорном количестве выявляются полоски, соответствующие более низкомолекулярным белкам около 140 кДа и 100 кДа (рис. 1б). В экстракте, в который добавлены ингибиторы фосфатаз, Xmas-2, детектируется в виде двух полос, соответствующих белкам с молекулярным весом около 100 и 80 кДа (рис. 1б). Надо отметить, что условия экстракции соответствовали стандартным, однако, блокирование дефосфорилирования экстракта способствовало процессу расщепления белка.
Для подтверждения полученных результатов была создана конструкция для экспрессии белка в S2 клетках D. melanogaster, включающая ДНК, кодирующую полноразмерный Xmas-2 с FLAG-эпитопом на N-конце белка и HA-эпитопом на C-конце белка. Схема конструкции Xmas-2-FLAG/HA представлена на рис. 2а.
Рис. 2.
Расщепление Xmas-2 in vitro. (а) – Схема оверэкспрессированного с FLAG- и HA-эпитопами полноразмерного Xmas-2. Указаны FLAG-эпитоп на N-конце белка и HA-эпитоп на C-конце. (б) – Фореграмма Вестерн-блот-анализа белков из лизата S2 клеток без (контроль) и с оверэкспрессированным Xmas-2-FLAG/HA. Гибридизация с антителами к FLAG-эпитопу (левая панель) и HA-эпитопу (правая панель). Стрелочками указаны детектируемые белки. Маркёр молекулярного веса в обоих случаях указан слева.
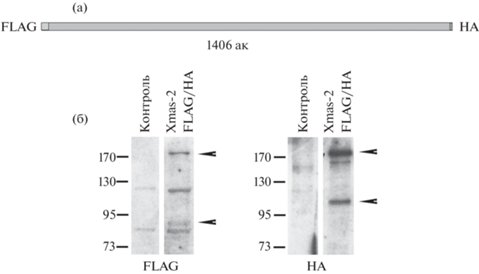
Результат оверэкспрессии Xmas-2-FLAG/HA был визуализирован методом Вестерн-блот анализа. Для визуализации были использованы антитела к FLAG- и HA-эпитопам. При гибридизации мембраны с антителами к FLAG-эпитопу выявлялся белок, соответствующий молекулярному весу 170 кДа (полноразмерный Xmas-2), но также детектировался белок, соответствующий молекулярному весу около 80 кДа. При гибридизации мембраны с антителами к HA-эпитопу выявлялся белок, соответствующий молекулярному весу полноразмерного Xmas-2, но также детектировался белок, соответствующий размеру около 100 кДа. (рис. 2б). Таким образом, полученные данные (рис. 2б) подтвердили эксперименты in vivo (рис. 1б).
Исходя из данных, полученных для гомолога Xmas-2 человека, и полученных нами данных, можно предположить, как расщепляется Xmas-2, принимая во внимание его доменную структуру. На рис. 3а представлены возможные образующиеся при расщеплении Xmas-2 белки. На рисунке указан известный сайт расщепления GANP (гомолога Xmas-2 человека) и возможное место расщепления Xmas-2.
Рис. 3.
Образующиеся в результате расщепления Xmas-2 белки. (а) Схема возможного расщепления Xmas-2 на основании его гомологии с GANP и полученными в экспериментах данными. На схеме указаны основные домены белка: SAC3-GANP, CID, RRM. Стрелочками отмечено возможное место протеолиза. Показаны образующиеся белки N-Xmas-2 и C-Xmas-2. (б) – Фореграмма Вестерн-блот-анализа белков из лизата S2 клеток без (контроль) и с оверэкспрессированными белками N-Xmas-2-FLAG и C-Xmas-2-HA. Гибридизация с антителами к FLAG/HA-эпитопам. Стрелочками указаны детектируемые белки. Маркёр молекулярного веса в обоих случаях указан слева.
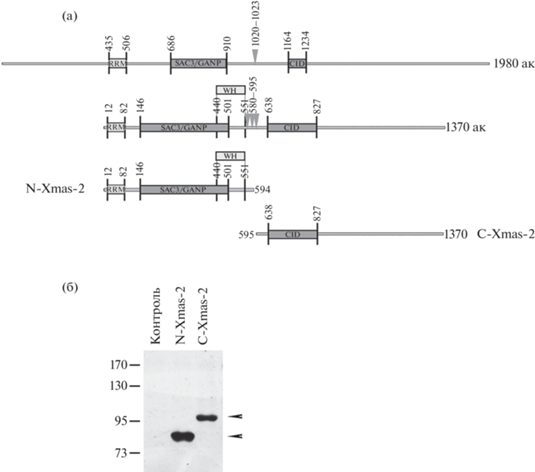
Образование N-концевого и С-концевого фрагментов Xmas-2 было исследовано в эксперименте с оверэкспрессией частей Xmas-2 в S2 клетках D. melanogaster. Были созданы конструкции, кодирующие последовательности ДНК, соответствующие последовательностям вероятных N- и C-концевых форм белка Xmas-2, слитые с FLAG- и НА-эпитопом соответственно (N-Xmas-2 и C-Xmas-2) (рис. 3а). Визуализация оверэкспрессированных белков методом Вестерн-блот анализа показала, что созданные N- и C-концевые части Xmas-2 по молекулярному весу соответствуют ранее выявленным в экспериментах in vivo и in vitro фрагментам Xmas-2: 80 кДа для N-концевой и 100 кДа для С-концевой части (рис. 3б).
Таким образом, у D. melanogaster Xmas-2 расщепляется так же, как и у человека, на два белка. Один из белков включает SAC3-GANP домен, отвечающий за взаимодействие с PCID2 и РНК, другой белок включает в себя C-концевую часть Xmas-2, отвечающую за взаимодействие с ORC, с ENY2 и через него с комплексом SAGA и NPC. Однако, в отличие от расщепления GANP [12], расщепление Xmas-2 происходит независимо от условий стресса. Возможно, расщепление Xmas-2 является необходимым механизмом регуляции количества комплексов экспорта мРНК, взаимодействующих с ядерной порой. Вероятно, такой протеолиз Xmas-2 отражает изменение строения комплекса TREX-2 и последовательные этапы процесса экспорта мРНК, происходящие как вблизи ядерной поры, так и в нуклеоплазме.
Список литературы
Wende W., Friedhoff P., Sträßer K. Mechanism and Regulation of Co-transcriptional mRNP Assembly and Nuclear mRNA Export // Advances in experimental medicine and biology. United States. 2019. V. 1203. P. 1–31.
Fischer T. et al. The mRNA export machinery requires the novel Sac3p-Thp1p complex to dock at the nucleoplasmic entrance of the nuclear pores // The EMBO journal. England. 2002. V. 21. № 21. P. 5843–5852.
Jani D. et al. Functional and structural characterization of the mammalian TREX-2 complex that links transcription with nuclear messenger RNA export // Nucleic acids research. England. 2012. V. 40. № 10. P. 4562–4573.
Kurshakova M.M. et al. SAGA and a novel Drosophila export complex anchor efficient transcription and mRNA export to NPC // The EMBO journal. England. 2007. V. 26. № 24. P. 4956–4965.
Rodríguez-Navarro S. et al. Sus1, a functional component of the SAGA histone acetylase complex and the nuclear pore-associated mRNA export machinery // Cell. United States. 2004. V. 116. № 1. P. 75–86.
Jani D. et al. Sus1, Cdc31, and the Sac3 CID region form a conserved interaction platform that promotes nuclear pore association and mRNA export // Molecular cell. United States. 2009. V. 33. № 6. P. 727–737.
Ellisdon A.M. et al. Structural basis for the assembly and nucleic acid binding of the TREX-2 transcription-export complex // Nature structural & molecular biology. United States. 2012. V. 19. № 3. P. 328–336.
Dimitrova L. et al. Structural Characterization of the Chaetomium thermophilum TREX-2 Complex and its Interaction with the mRNA Nuclear Export Factor Mex67:Mtr2 // Structure (London, England : 1993). United States. 2015. V. 23. № 7. P. 1246–1257.
Jani D., Valkov E., Stewart M. Structural basis for binding the TREX2 complex to nuclear pores, GAL1 localisation and mRNA export // Nucleic acids research. England. 2014. V. 42. № 10. P. 6686–6697.
Kopytova D. et al. ORC interacts with THSC/TREX-2 and its subunits promote Nxf1 association with mRNP and mRNA export in Drosophila // Nucleic acids research. 2016. V. 44. № 10. P. 4920–4933.
Куршакова М.М., Копытова Д.В., Георгиева С.Г. Исследование взаимодействия Xmas-2, основного белка TREX-2 комплекса экспорта мРНК, и белка Orc3, субъединицы ORC комплекса D. melanogaster // Доклады АН. 2021. Т. 496. С. 66–69.
Wickramasinghe V.O. et al. MCM3AP is transcribed from a promoter within an intron of the overlapping gene for GANP // Journal of molecular biology. 2011. V. 406. № 3. P. 355–361.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


