Доклады Российской академии наук. Науки о жизни, 2022, T. 502, № 1, стр. 77-82
ФИЛОГЕОГРАФИЯ СТЕПНОЙ НОЧНИЦЫ, MYOTIS DAVIDII (CHIROPTERA; VESPERTILIONIDAE) В ВОСТОЧНОЙ ЧАСТИ АРЕАЛА ВИДА
А. А. Горбань 1, И. В. Артюшин 1, А. А. Банникова 1, Э. Ундрахбаяр 2, С. В. Крускоп 3, *
1 Московский государственный университет
имени М.В. Ломоносова, Биологический факультет
Москва, Россия
2 Институт общей и экспериментальной биологии Монгольской академии наук
Улан-Батор, Монголия
3 Зоологический музей Московского государственного университета им. М.В. Ломоносова
Москва, Россия
* E-mail: selysius@mail.ru
Поступила в редакцию 10.09.2021
После доработки 21.09.2021
Принята к публикации 21.09.2021
- EDN: BVONTS
- DOI: 10.31857/S2686738922010085
Аннотация
Впервые изучена филогеография степной ночницы, Myotis davidii, в восточной части ее обширного ареала на основании анализа митохондриальных генетических маркеров. Подтверждено наличие двух основных внутривидовых групп – восточной и западной. Показана внутренняя структурированность восточной группы. В северо-западной Монголии и соседних регионах существует область высокого генетического разнообразия степных ночниц, где совместно присутствуют заметно различающиеся гаплотипы. Предположительно, это связано с плейстоценовыми рефугиумами, изолированными друг от друга хребтами Монгольского Алтая. Гаплогруппы юго-востока Монголии и Забайкалья связаны родством, при этом расположенную между этими регионами долину Керулена заселила гаплогруппа иного происхождения.
ВВЕДЕНИЕ
Знание о таксономической структуре широко распространенных видов представляется важным не только с точки зрения систематики как таковой, но также и для определения природоохранных приоритетов, понимания закономерностей расселения животных из возможных рефугиумов или центров происхождения и, соответственно, возможных путей распространения потенциальных патогенов [1].
Степная ночница была выделена из состава Myotis mystacinus на основании морфологических, кариологических и генетических данных [2–4] под названием M. aurascens. Бенда и др. [5, 6], на основании изучения типового материала, пришел к заключению, что название M. davidii (Peters) должно быть валидным для “степной усатой ночницы”.
В современном понимании, M. davidii – один из наиболее широкоареальных видов рукокрылых Палеарктики, распространенный от юго-восточной Европы до центрального Китая и, возможно, Кореи [4]. Можно предположить, что вид со столь обширным ареалом будет иметь более или менее выраженную филогеографическую структуру. Не менее 12 номинальных таксонов (ныне считающихся синонимами M. davidii) были описаны в пределах ареала вида [7], и некоторые из них могут представлять собой отдельные подвиды. Ранее опубликованные данные [7–9] достаточно надежно демонстрируют наличие у этого вида двух основных генетических линий – “западной” и “восточной”, граница между которыми проходит примерно по востоку Казахстана. Однако, если о структуре разнообразия “западной” линии есть некоторые представления, пусть и неполные [9], то филогеография “восточной” клады M. davidii практически не изучена. Чтобы восполнить этот пробел, мы осуществили настоящее исследование, впервые достаточно подробно охватывающее восточную часть ареала M. davidii.
МАТЕРИАЛЫ И МЕТОДЫ
Фиксированные в этаноле экземпляры и пробы тканей, хранящиеся в Зоологическом музее Московского государственного университета (ЗММУ), были использованы в качестве основного материала для данного исследования. Все действия с коллекционными материалами выполнены в соответствии с правилами Зоологического музея.
Геномную ДНК выделяли из фиксированных в этаноле проб тканей стандартным методом фенол-хлороформной депротеинизации [10]. Для митохондриального гена контрольного региона Д-петли (CR) были использованы специально разработанные праймеры (Tyx-F_Mdav: GTTGTTGGTTTCACGGAGGTAG, and Tyx-P_Mdau: CCCTACCATCAACACCCAAAGC). Реакция амплификации включала 35 циклов и осуществлялась при следующих условиях: денатурация при 94°C в течение 30 с, отжиг в течение 1 мин при 57°C, синтез в течение 1 мин при 72°С. Преденатурация осуществлялась в течение 3 мин при 94°C, и конечный синтез – в течение 6 мин при 72°C. Очистку продуктов ПЦР проводили с помощью набора Diatom DNA Clean-Up. Автоматическое секвенирование проведено на секвенаторе ABI PRISM 3500xl. Всего было получено 56 (от 56 экземпляров) последовательностей гена CR длиной 468 п.о. (пар оснований). В качестве второго анализируемого маркера был взят ген первой субъединицы цитохром-ц оксидазы (COI), последовательности которого были получены в соответствии с ранее опубликованными протоколами [11]. Было использовано 42 (от 42 экземпляров, из которых 18 общие с исследованными по гену CR) последовательности гена COI длиной 657 п.о., включая 10 ранее опубликованных и 3 последовательности из публичных проектов, размещенных в базе Штрих-код жизни (BOLD; www.boldsystems.org). Последовательности были выровнены с помощью алгоритма MAFFT v7.453 [12] и скорректированы вручную. Реконструкция филогенетических деревьев выполнена методами максимального правдоподобия (ML) в программе IQ-TREE v2.0.6. Сеть гаплотипов построена при помощи пакета Pegas v0.11.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
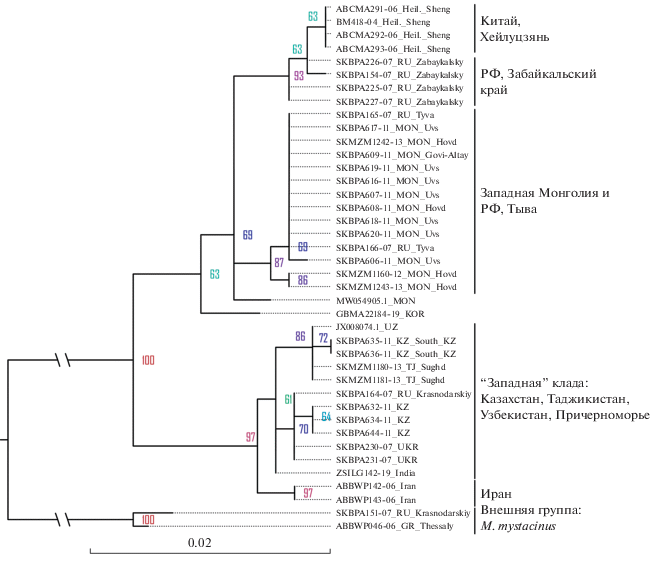
Топология дерева, полученного для гена COI, в целом соответствует ранее опубликованным данным [7, 9] и подтверждает разделение вида на два хорошо поддержанных кластера (рис. 1), разделенных дистанцией в 2.7% (здесь и далее указана р-дистанция). В составе “западного” кластера выделяется хорошо поддерживаемая ветвь, объединяющая экземпляры из Таджикистана и некоторые из казахстанских. “Восточный” кластер разделен, в свою очередь, на западную и восточную ветви. Первая включает экземпляры из Тывы и западной Монголии, вторая объединяет экземпляры из Забайкалья и северо-восточного Китая. Различия между этими двумя группами – 1.2%. Низкая межпопуляционная изменчивость гена COI делает его неприменимым для анализа на более низких уровнях.
Рис. 1.
Дерево филогенетических отношений внутри Myotis davidii, построенное по последовательностям гена COI, построенное методом максимального подобия (ML). В узлах указаны значения бутстреп-поддержек (получены из 500 итераций). Усатая ночница, M. mystacinus, взята в качестве внешней группы.
Реконструируя филогенетические отношения при помощи гена CR, мы получили филогенетическое дерево (рис. 2), отражающее глубокое разделение отдельных линий внутри изучаемого вида. Все экземпляры, собранные к востоку от восточного Казахстана, образуют по этому гену единую хорошо поддержанную кладу, что соответствует представлениям о границе между основными генетическими линиями M. davidii [9]. Как мы и ожидали, сама по себе эта клада сложно структурирована и содержит несколько обособленных гаплогрупп.
Рис. 2.
Дерево филогенетических отношений внутри Восточной клады M. davidii по данным гена CR, построенное методом максимального подобия (ML). В узлах указаны значения бутстреп-поддержек (получены из 500 итераций).
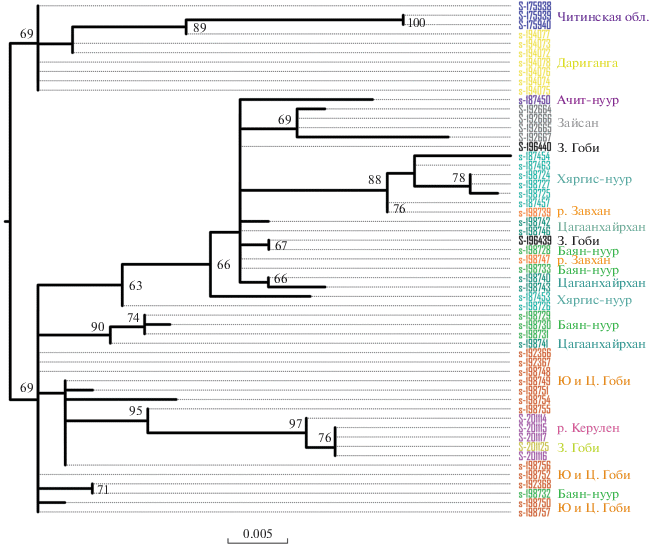
Наиболее обособленная гаплогруппа включает экземпляры из южного Забайкалья и юго-восточной Монголии (плато Дариганга). Большинство гаплотипов из северо-западной Монголии (оз. Баян-нуур и Ачит-нуур, горы Цагаанхайран) объединяются в обширный кластер с гаплотипами из Зайсанской котловины и из Западной Гоби, при этом гаплотипы с Зайсана сами по себе достаточно обособлены. Гаплотипы из восточной Монголии (р. Керулен) объединяются с некоторыми гаплотипами с юго-востока Монголии. Некоторые гаплотипы с Баян-нуура и Цагаанхайрана формируют собственный кластер. Наконец, положение ряда гаплотипов из Гоби, с Орог-нуура и Баян-нуура не определено, они не демонстрируют явного сходства с какой-либо линией.
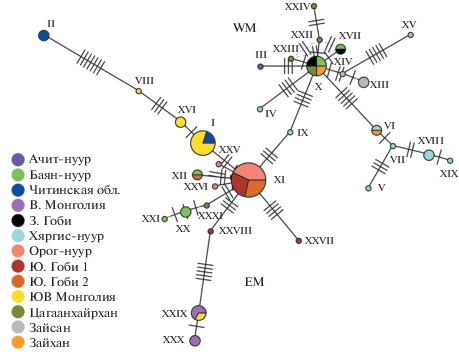
На построенной нами сети гаплотипов (рис. 3) можно выделить две крупных группы (WM и EM); при этом только гаплотипы из Котловины больших озер присутствуют в обеих. В первую группу входят гаплотипы из Котловины озер и окрестностей (р. Завхан, Ачит-нуур, Цагаанхайрхан, Баян-нуур, Хяргис-нуур), западной Монгольской Гоби (сомон Бугат) и с озера Зайсан; во вторую – гаплотипы из Долины озер и южной части Монгольской Гоби (Гурвантес, Сэврэй, Орог-нуур), с реки Керулен, с плато Дариганга и Восточной Гоби и из Читинской области.
В группе WM обособленные кластеры формируют гаплотипы с оз. Хяргис-нуур (V–VII, XVII, XIX) и с оз. Зайсан (XIII–XV). Центральное положение занимает гаплотип, распространенный по всему ареалу группы, кроме Зайсана и Ховда.
В группе EM обособленное положение занимают кластеры гаплотипов из Восточной Монголии (р. Керулен; XXIX, XXX) и из Юго-Восточной Монголии и Забайкалья (I, II, VIII, XVI). Центральное положение в группе занимает гаплотип XI, найденный в разных районах Монгольской Гоби и в Долине Озер. Можно заметить, что популяции из Котловины больших озер несут гаплотипы, которые заметно удалены друг от друга. Таким образом, в северо-западной Монголии и окрестных регионах располагается область высокого генетического разнообразия вида.
Во время нашего исследования мы обнаружили в полученных последовательностях гена CR повторы, характерные для случаев гетероплазмии, известных для этого гена [13]. Это первый случай выявления гетероплазмии гена CR у M. davidii.
ЗАКЛЮЧЕНИЕ
Наши данные хорошо соответствуют предположению о ярко выраженной филогенетической структуре у M. davidii. Они подтверждают глубокую дивергенцию между кладами из восточной и западной частей ареала вида и демонстрируют наличие сложной структуры генетического разнообразия, по крайней мере, внутри восточной клады. Таким образом, можно предположить, что ареал вида был разделен на части на разных этапах оледенения, и животные пережили ледниковые события в ряде отдельных рефугиумов.
Значительная часть западной Монголии, где было выявлено высокое генетическое разнообразие, покрыта многочисленными горными системами и образованными ими долинами, расположение которых имеет заметную меридиональную составляющую, формирующую потенциальные коридоры для перемещения животных во время ледниковых максимумов и последующего расселения. Даже если рефугиальные зоны M. davidii располагались южнее, расселение оттуда могло происходить по предгорьям и межгорным долинам. Можно предположить, что в период ледникового максимума в разных долинах обитали частично изолированные популяции с разными гаплотипами контрольного региона.
Гаплогруппы из долины Керулена и южной Гоби заметно отличаются от гаплогрупп, происходящих с плато Дариганга и из южного Забайкалья, что несколько противоречит предположениям, основанным на географических данных. Мы предполагаем, что M. davidii, вселившись на эту территорию с юга (по гену COI зверьки из Забайкалья сходны с животными из Хейлунцзяня), могла заселять плато Дариганга и одновременно распространяться в Забайкалье через Большой Хинган, минуя долину Керулена. В то же время последняя могла быть заселена животными, пришедшими откуда-то с запада.
Известно, что менее подвижные виды имеют более выраженную филогеографическую структуру [14, 15]. Данные о миграциях M. davidii отсутствуют, но выявленная генетическая структура в восточной части ареала свидетельствует о низком потоке генов между популяциями и, соответственно, о низкой миграционной активности этого вида. Можно предположить, что в гипер-аридном климате Монголии зверьки связаны с постоянными водоемами, что может еще больше ограничить поток генов и усложнить картину связей между популяциями даже по сравнению с аналогичными видами, населяющими более влажные территории.
Список литературы
Kholodova M.V. Comparative phylogeography: molecular methods, ecological interpretation // Molecular biology, 2009. V. 43. № 5. P. 847–854.
Benda P., Tsytsulina K. Taxonomic revision of Myotis mystacinus group (Mammalia: Chiroptera) // Acta Societatis Zoologicae Bohemicae, 2000. V. 64. P. 331–398.
Volleth M. 1987. Differences in the location of nucleolus organizer regions in European vespertilionid bats // Cytogenetic and Genome Research, 1987. V. 44. № 4. P. 186–197.
Tsytsulina K., Dick, M.H., Maeda, K., et al. Systematics and phylogeography of the steppe whiskered bat Myotis aurascens Kuzyakin, 1935 (Chiroptera, Vespertilionidae). Russian Journal of Theriology, 2012. V. 11. № 1. P. 1–20.
Benda P., Faizolâhi K., Andreas M., et al. Bats (Mammalia: Chiroptera) of the Eastern Mediterranean and Middle East. Part 10. Bat fauna of Iran // Acta Societatis Zoologicae Bohemicae, 2012. V. 76. № 1–4. P. 163–582.
Benda P., Gazaryan S., Vallo P. On the distribution and taxonomy of bats of the Myotis mystacinus morphogroup from the Caucasus region (Chiroptera: Vespertilionidae) // Turkish Journal of Zoology, 2016. V. 40. № 6. P. 842–863.
Kruskop S.V., Borisenko A.V., Ivanova N.V., et al. Genetic diversity of northeastern Palaearctic bats as revealed by DNA barcodes // Acta Chiropt., 2012. V. 14. № 1. P. 1–14.
Datzmann T., Dolch D., Batsaikhan N., et al. Cryptic diversity in Mongolian vespertilionid bats (Vespertilionidae, Chiroptera, Mammalia). Results of the Mongolian-German Biological Expeditions since 1962, № 299 // Acta Chiropt., 2012. V. 14. № 2. P. 243–264.
Çoraman E., Dundarova H., Dietz C., et al. Patterns of mtDNA introgression suggest population replacement in Palaearctic whiskered bat species // Royal Society Open Science. 2020. V. 7. P. e191805.
Sambrook J., Fritsch E.F., Maniatis T. Molecular cloning – a laboratory manual. Sec. ed. N.Y.: Cold Spring Harbour Lab. Press, 1989. 385 p.
Ivanova N.V., Clare E.L., Borisenko A.V. DNA barcoding in Mammals // Eds Kress W.J., Erickson D.L. DNA Barcodes: Methods and Protocols, 2012. 361 p.
Katoh T., Standley D.M. MAFFT multiple sequence alignment software version 7: improvements in performance and usability // Mol. Biol. Evol. 2013. V. 30. P. 772–780.
Mao X., Dong J., Hua P., et al. Heteroplasmy and ancient translocation of mitochondrial DNA to the nucleus in the Chinese Horseshoe Bat (Rhinolophus sinicus) complex // PLoS ONE, 2014. V. 9. № 5. P. e0098035.
Chinnasamy K., Pitchamuthu M., Doss P.S., et al. Genetic diversity and population structure of leaf-nosed bat Hipposideros speoris (Chiroptera: Hipposideridae) in Indian subcontinent // African J. Biotech., 2011. V. 10. № 8. P. 1320–1328.
Lin A.-Q., Csorba G., Li L.-F., et al. 2014. Phylogeography of Hipposideros armiger (Chiroptera: Hipposideridae) in the Oriental Region: the contribution of multiple Pleistocene glacial refugia and intrinsic factors to contemporary population genetic structure // J. Biogeogr., 2014. V. 41. № 2. P. 317–327.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни