Доклады Российской академии наук. Науки о жизни, 2020, T. 494, № 1, стр. 537-540
Повышение экспрессии гена мультимерина-1 в нервной системе мышей как результат геномной модификации локуса альфа-сунуклеина
К. Д. Чапров 1, 2, *, В. В. Голоборщева 2, 3, Т. В. Тарасова 1, 2, Е. В. Тетерина 1, М. В. Корокин 4, В. О. Солдатов 4, М. В. Покровский 4, В. Г. Кучеряну 3, член-корреспондент РАН С. Г. Морозов 3, Р. К. Овчинников 1
1 Институт физиологически активных веществ Российской академии наук
Черноголовка, Россия
2 Cardiff University, School of Biosciences
Cardiff, United Kingdom
3 Научно-исследовательский институт общей патологии и патофизиологии
Москва, Россия
4 Научно-исследовательский институт фармакологии живых систем
Белгород, Россия
* E-mail: chaprov@ipac.ac.ru
Поступила в редакцию 10.06.2020
После доработки 25.06.2020
Принята к публикации 25.06.2020
Аннотация
Мультимерин-1 (Mmrn-1) – белок, содержащийся в тромбоцитах и эндотелии кровеносных сосудов. Его функция и роль в патологии окончательно не изучены. Модификации локуса альфа-синуклеина (Snca), расположенного в геноме мыши на расстоянии 160 Кб от Mmrn-1, могут влиять на активность Mmrn-1. Нами была исследована экспрессия Mmrn-1 в коре головного мозга трех линий мышей с нокаутом Snca: B6(Cg)-Sncatm1.2Vlb/J, B6;129-Sncatm1Sud/J и B6;129X1-Sncatm1Rosl/J. У B6;129X1-Sncatm1Rosl/J мышей, в геноме которых привнесенная последовательность содержит бактериальный ген neo и активный промотор фосфоглицераткиназы (Pgk1), ориентированный в направлении гена Mmrn-1, выявлено 35-кратное повышение уровня мРНК для Mmrn-1. Обнаруженный нами эффект влияния этих посторонних последовательностей на регуляторные элементы гена Mmrn-1 следует учитывать при работе с альфа-синуклеин нокаутной линией B6;129X1-Sncatm1Rosl/J, которая широко используется в лабораториях мира для исследования механизмов нейродегенерации.
Физиологические функции высокомолекулярного растворимого белка мультимерина-1 (Mmrn-1), известного так же под названием эластинового микрофибриллярного интерфейсера 4 (elastin microfibril interfacer 4 – EMILIN-4), до конца не исследованы. Описанная у мышей линии C57BL/6J-OlaHsd спонтанная делеция генетического локуса, в котором располагается ген, кодирующий Mmrn-1, не ведет к выраженному фенотипу, из чего следует, что его отсутствие может быть компенсировано в процессе эмбрионального развития [1]. Однако детальный анализ методом микрокомпьютерной томографии (μCT) костных тканей C57BL/6J-OlaHsd мышей выявил снижение массы губчатого вещества эпифизов трубчатых костей, а гистологическое исследование клеточного состава костей показало повышенное содержание остеобластов при снижении их минерализации [2]. Это наблюдение и тот факт, что уровень экспрессии гена Mmrn-1 в костных тканях достаточно высок, явилось основанием для исследования его участия в метаболических процессах в остеобластах и формировании костей. В большом количестве белок Mmrn-1 содержится так же в эндотелии кровеносных сосудов и в альфа-гранулах тромбоцитов. Он синтезируется на достаточно высоком уровне в мегакариоцитах и был выявлен на поверхности активированных тромбоцитов в комплексе с фактором фон Виллебранда [3].
У мышей с делецией локуса Mmrn-1 обнаружены изменения в системе гемостаза, в частности, нарушение агрегации тромбоцитов и формирования тромба, а добавление мультимерина в in vitro экспериментах нивелировало эти нарушения [4]. В плазме крови Mmrn-1 не детектируется рутинными методами, но повышение его содержания в клеточной фракции крови больных острым миелоидным лейкозом (acute myelogenous leukemia AML) коррелирует с низким шансом ремиссии, более высоким риском рецидива заболевания и плохой выживаемостью пациентов [5].
Исследования нарушения функции Mmrn-1 в экспериментальных животных выполнены в основном с использованием линии мышей C57BL/6J-OlaHsd [6]. В геноме этой линии мышей спонтанная делеция протяженного участка размером 350 т.п.н. [1] включает помимо гена альфа-синуклеина (Snca), еще и Mmrn-1 поскольку эти гены расположены в непосредственной близости (около 160 т.п.н.) один от другого. Поскольку белку а-синуклеину (a-syn), являющемуся важным компонентом телец Леви, отводится важная роль в патогенезе болезни Паркинсона, было независимо создано несколько линий мышей с генетическими модификациями локуса Snca [7].
Нельзя исключить влияния вносимых модификаций на прилежащие области генома. В данной работе нами было проведено сравнительное исследование уровней экспрессии Mmrn-1 в трех линиях мышей с делецией Snca: B6;129X1-Sncatm1Rosl/J [AbKO] полученной из лаборатории A. Rosental [8], B6;129-Sncatm1Sud/J [ТаКО], полученной из лаборатории T. Sudhof [9] и B6(Cg)-Sncatm1.2Vlb/J [delta flox KO], полученной из лаборатории V. Buchman [10, 11].
Чтобы выяснить, могут ли различные модификации Snca локуса влиять на экспрессию гена Мmrn-1, расположенного всего в 160 Kb от Snca, нами было исследовано содержание мРНК Mmrn-1 в коре головного мозга методом ОТ-PCR в реальном времени.
Из тканей коры головного мозга самцов в возрасте 3 месяцев выделяли тотальную РНК с помощью наборов RNeasy Plus Mini (Qiagen, Германия) по инструкции производителя. 2 мкг полученной РНК использовали для синтеза комплементарной цепи ДНК в реакции обратной транскрипции и последующей амплификации реагентами qPCRmix-HS SYBR (Евроген, Россия) по протоколу производителя в режиме реального времени в установке BioRad CFX 96 (BioRad, США). Использовали праймеры: Mmrn1-for: 5'-GGACACTGGCTCTCATTTAC-3' и Mmrn1-rev: 5'-CAGCATTGGATGTCTTCTGAG-3'. В качестве референсного гена внутреннего контроля использовали глицеральдегид-3-фосфатдегидрогеназу (ГАФДГ) мыши. Последовательности праймеров:
q_m_GAPDH_for: 5'-CACTGAGCATCTCCCTCACA-3' и
q_m_GAPDH_rev: 5'-GTGGGTGCAGCGAACTTTAT-3'.
Проведенный анализ относительных уровней экспрессии Mmrn-1 в трех линиях мышей с генетическим нокаутом Snca показал, что его уровень был повышен в 35 раз у мышей линии AbKO, в то время как у delta flox KO и TaKO мышей он практически не отличался от уровня экспрессии Mmrn-1 в коре головного мозга контрольных дикого типа (рис. 1). Технология конструирования исследованных нокаутных линий включала использование эмбриональных стволовых клеток на стадии гомологической рекомбинации альфа-синуклеинового локуса с последующей селекцией клонов по продукции введенного в составе таргетной кассеты бактериального гена neo. При этом непосредственные модификации прилежащих к гену Snca последовательностей различались (рис. 2). Так, в линии AbKO после удаления второго и третьего экзонов альфа-синуклеина с прилегающими последовательностями (размер делеции порядка 3.2 Kb) в модифицированном локусе оставался фрагмент плазмидного вектора pGT-N39 размером 1.9 Kb, содержащий кодирующую часть гена neo под промотором мышиного гена фосфоглицераткиназы Pgk1 (рис. 2). В нокаутной линии ТаКО так же удалены второй и третий экзоны Snca с прилегающими участками, и общий размер делеции составил 3.9 Kb. Оставшаяся в модифицированном локусе генома посторонняя последовательность включала фрагмент плазмиды pTK-Neo3A, содержащий ген neo под промотором мышиного гена субъединицы A полимеразы II Polr2a (рис. 2).
Рис. 1.
Сравнительный анализ уровней экспрессии гена Mmrn-1 в трех линиях мышей с генетическим нокаутом альфа-синуклеина. Содержание мРНК для Mmrn-1 определено методом количественного ОТ-ПЦР в реальном времени в тканях коры головного мозга мышей B6;129X1-Sncatm1Rosl/J (АbКО), B6;129-Sncatm1Sud/J (ТаКО), B6(Cg)-Sncatm1.2Vlb/J (delta flox KO) и контрольных мышей дикого типа (WT). M ± SEM, n = 6 для каждой группы; ** p < 0.01 при сравнении AbKO с остальными группами. One-way ANOVA Tukey’s multiple comparisons test.
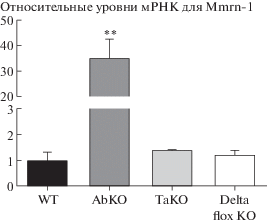
Рис. 2.
Схема модификаций локуса Snca гена в нокаутных линиях мышей. Закрашены привнесенные в мышиный геном посторонние последовательности: ген neo, LoxP сайт и промоторы генов фосфоглицераткиназы (Pgk1) и субъединицы A полимеразы II (Polr2a). Стрелками указано направление транскрипции.
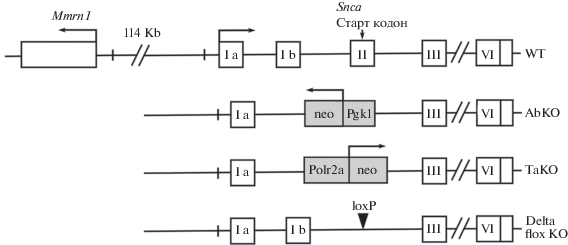
Важно отметить, что ориентации neo кассеты в геномах AbKO и ТаКО линий различались. В случае AbKO ген neo расположен дистальнее гена Snca и ориентирован в обратном направлении по отношению к модифицированному гену. В геноме ТаКО мышей промотор кассеты neo лежит проксимальнее по отношению к промотору Snca и ориентирован в том же направлении (рис. 2). В третьей анализированной нами линии – delta flox KO – делеция Snca гена была проведена с минимальными модификациями локуса. Из генома мыши был удален третий экзон, содержащий START-кодон, и небольшой участок прилегающей интронной последовательности размером всего 1.1 Kb, что существенно меньше, чем в линиях AbKO и ТаКО. Более того, и ген neo, и все значимые посторонние последовательности были удалены из модифицированного локуса полученных мышей. Единственной привнесенной вставкой, оставшейся в геноме delta flox KO мышей, является лишь LoxP сайт размером 34 bp (рис. 2).
Эти данные указывают на то, что функционально активный промотор pGT-N39 кассеты в геноме линии AbKO [8], ориентированный в направлении Mmrn-1, мог оказывать активирующий эффект на регуляторные последовательности этого гена. А ориентированный в обратном от гена Mmrn-1 направлении промотор из вектора pTK-Neo3A в конструкции ТаKO [9] обладал существенно меньшим воздействием на экспрессию гена Mmrn-1. В новой же нокаутной линии delta flox KO [10, 11] экспрессия гена Mmrn-1 практически не отличалась от экспрессии в немодифицированном геноме мышей дикого типа на том же генетическом фоне (рис. 1).
Биоинформационный анализ показал, что потенциальные регуляторные последовательности располагаются между генами Snca и Mmrn-1, а также в интронах Mmrn-1. В частности, между генами находятся два промотор-фланкирующих домена, а внутри Mmrn-1 есть два энхансера и два сайта связывания репрессора транскрипции CTCF, который вовлечен в регуляцию архитектуры хроматина и является разграничителем между эу- и гетерохраматином [12].
Полученные данные позволяют с высокой степенью вероятности предположить, что именно нарушения в работе регуляторных элементов генома являются причиной измененной экспрессии Mmrn-1 у AbKO мышей.
Несмотря на то, что нокаутная линия мышей AbKO (B6;129X1-Sncatm1Rosl/J) широко используется в лабораториях мира для исследования нейродегенерации, подробный анализ уровня экспрессии Mmrn-1 ранее выполнен не был.
Работы с животными проводили в соответствии с приказом Минздрава России от 01 апреля 2016 г. № 199н “Об утверждении Правил надлежащей лабораторной практики”.
Список литературы
Specht C.G., Schoepfer R. Deletion of multimerin-1 in α-synuclein-deficient mice. // Genomics. 2004. V. 83. № 6. P.1176–1178. https://doi.org/10.1016/j.ygeno.2003.12.014
Liron T., Raphael B., Hiram-Bab S., et al. Bone loss in C57BL/6J-OlaHsd mice, a substrain of C57BL/6J carrying mutated alpha-synuclein and multimerin-1 genes. // Journal of Cellular Physiology. 2018. V. 233. № 1. P.371–377. https://doi.org/10.1002/jcp.25895
Jeimy S.B., Tasneem S., Cramer E.M., et al. Multimerin 1. // Platelets. Taylor and Francis Ltd.; 2008. V. 19. P. 83–95. https://doi.org/10.1080/09537100701832157
Reheman A., Tasneem S., Ni H., et al. Mice with deleted multimerin 1 and α-synuclein genes have impaired platelet adhesion and impaired thrombus formation that is corrected by multimerin 1. // Thrombosis Research. 2010. V. 125. № 5. https://doi.org/10.1016/j.thromres.2010.01.009
Laszlo G.S., Alonzo T.A., Gudgeon C.J., et al. Multimerin-1 (MMRN1) as novel adverse marker in pediatric acute myeloid leukemia: A report from the Children’s Oncology Group. // Clinical Cancer Research. 2015. V. 21. № 14. P. 3187–3195. https://doi.org/10.1158/1078-0432.CCR-14-2684
Mekada K., Abe K., Murakami A., et al. Genetic differences among C57BL/6 substrains. // Experimental Animals. 2009. V. 58. № 2. P. 141–149. https://doi.org/10.1538/expanim.58.141
Goedert M., Jakes R., Spillantini M.G. The Synucleinopathies: Twenty Years on // Journal of Parkinson’s Disease. 2017. V. 7(s1). P. 53–71. https://doi.org/10.3233/JPD-179005
Abeliovich A., Schmitz Y., Fariñas I., et al. Mice lacking alpha-synuclein display functional deficits in the nigrostriatal dopamine system. // Neuron. 2000. V. 25. № 1. P. 239–252. https://doi.org/10.1016/s0896-6273(00)80886-7
Schlüter O.M., Fornai F., Alessandrí M.G., et al. Role of alpha-synuclein in 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-induced parkinsonism in mice. // Neuroscience. 2003. V. 118. № 4. P. 985–1002. https://doi.org/10.1016/s0306-4522(03)00036-8
Ninkina N., Connor-Robson N., Ustyugov A.A., et al. A novel resource for studying function and dysfunction of α-synuclein: Mouse lines for modulation of endogenous Snca gene expression // Scientific Reports. 2015. V. 13. № 5. P. 16615. https://doi.org/10.1038/srep16615
Roman A.Y., Limorenko G., Ustyugov A.A., et al. Generation of mouse lines with conditionally or constitutively inactivated Snca gene and Rosa26-stop-lacZ reporter located in cis on the mouse chromosome 6 // Transgenic Research. 2017. V. 26. № 2. P. 301–307. https://doi.org/10.1007/s11248-016-9995-8
Phillips J.E., Corces V.G. CTCF: Master Weaver of the Genome // Cell. 2009. V. 137. № 7. P. 1194–1211. https://doi.org/10.1016/j.cell.2009.06.001
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Науки о жизни


