Цитология, 2022, T. 64, № 6, стр. 600-606
Действие проназы на нервные ганглии моллюска, пиявки и лягушки вызывает образование нейронно-нейрональных щелевых контактов
О. С. Сотников 1, *, С. С. Сергеева 1, Н. М. Парамонова 2
1 Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, Россия
* E-mail: ossotnikov@mail.ru
Поступила в редакцию 05.03.2022
После доработки 11.05.2022
Принята к публикации 13.05.2022
- EDN: LGLYNY
- DOI: 10.31857/S0041377122060104
Аннотация
Впервые при помощи электронной микроскопии изучено действие проназы на нервные ганглии моллюска, пиявки и лягушки. Выявлено, что действие проназы вызывает ретракцию и удаление глиальных оболочек, денудацию нервных волокон и тел нейронов с одновременным сближением нейромембран этих структур и приводит к образованию щелевых контактов (ЩК). Такое действие проназы на мембраны относится к ряду необычных, непредвиденных функций, а наблюдаемый эффект был получен нами впервые. Так как нами ранее при таких же условиях в ганглиях лягушки и пиявки была зарегистрирована реверберация нервного импульса, мы полагаем, что полученные морфологические данные представляют собой доказательство формирования электрических синапсов (ЭС) при действии проназы на нервные ганглии.
Общепризнанной функцией протеаз является протеолиз – ферментативный гидролиз амидных связей в белках и пептидах, в связи с этим протеазы используются при выделении отдельных клеток для создания культуры ткани (Сотников, Костенко, 1981). Долгое время функции протеолитических ферментов связывали исключительно с их ролью в деструкции, в катаболических процессах (Антонов, 1991). Однако оказалось, что функции протеаз этим не ограничиваются (Kerstein et al., 2017). Привлекают внимание и регуляторные функции этих ферментов. Так, активный протеолиз в химическом синапсе признан ключевым фактором в управлении динамическими изменениями формы и функции дендритных шипиков (Magnowska et al., 2016). Металлопротеазы, увеличивая внутриклеточную концентрацию Ca2+, способствуют активации ветвления (арборизации) нейритов (Allen et al., 2016).
Хотя существует огромный выбор протеолитиков для экспериментов в биологии и эти ферменты обладают высокой специфичностью, мы считали целесообразным использовать проназу, т. к. она представляет собой комплекс нескольких протеаз одновременно. В качестве объектов для исследования действия проназы были выбраны нервные ганглии моллюска, пиявки и симпатический ганглий лягушки, морфологические и электрофизиологические характеристики которых хорошо известны.
В настоящее время щелевые контакты (ЩК) однозначно признаны жизненно важным компонентом в схемах мозга млекопитающих. В обзорах последних лет отмечается их важность и широкое распространение (Alcamí, Pereda, 2019; Ixmatlahua et al., 2020; Thomas et al., 2020). Изучение целого ряда свойств и морфологических особенностей ЩК в мозге in vivo сдерживает ряд факторов, главным из которых считается экспериментально сложная доступность к нервным клеткам, и незначительное количество ЩК в объеме мозга. Работы в основном проведены на мышах, нокаутных по коннексинам (Cx36, Cx45, Cx26), и с применением их блокаторов (Wang, Belousov, 2011; Xu et al., 2020; Wang, Wu, 2021; Talukdar et al., 2022). Сложнее провести морфологическое изучение структур ЩК, крайне редких в мозге. Считается, что ЩК и плотные контакты (ПК) между нейромембранами позволяют только косвенно определять их функциональную роль (Кириченко и др., 2008). Некоторые авторы описывают частично слившиеся мембраны нейронов и волокон под названием ЩК, даже не подозревая, что такой же функцией обладают межнейронные перфорации (синцитии) (Fontes et al., 2015; Spray et al., 2019; Nakagawa, Hosoya, 2019). ЩК в нейромембранах не только осуществляют метаболическую связь между нейронами, они способствуют упорядочиванию высокочастотной нервной импульсации, вместо одного импульса могут формировать серию (Сергеева и др., 2020; Сотников, 2021).
Целью работы было исследование на ультраструктурном уровне экспериментально полученных с помощью проназы ЩК, которые по всем морфологическим критериям соответствуют классическим, известным структурам ЭС.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования служили ганглии моллюска (Lymnaea stagnalis) (n = 5), ганглии мозга медицинской пиявки (Hirudo medicinalis L.) (n = 6) и симпатический ганглий травяной лягушки (Rana temporaria) (n = 6). Использовали 0.4% раствор проназы (лиофилизированная проназа из Streptomyces grisens, Serva, Германия) в который помещали ганглии на 60 мин.
Для электронно-микроскопического исследования нервные ганглии фиксировали в течение 1 ч в охлажденном растворе 2.5%-ного глютарового альдегида (Acros Organics, США) и 4%-ного параформальдегида, приготовленном на 0.1 М какодилатном буфере (рН 7.2–7.4), затем в 1%-ном растворе охлажденной четырехокиси осмия (Sigma-Aldrich, Германия). После дегидратации в растворах этилового спирта восходящей концентрации и абсолютном ацетоне образцы заливали в смесь аралдитов (аралдит M, аралдит H, аралдит B, дибутилфталат) (Fluka, Швейцария). Ультратонкие срезы изготавливали на ультратоме LKB-5 (Швеция) и контрастировали методом тройного контрастирования (цитрат свинца, уранил ацетат, цитрат свинца) (Sigma-Aldrich, Германия). Просмотр и фотосъемку проводили в электронном микроскопе FEI Tecnai G2 Spirit BioTWIN (Нидерланды) при напряжении 80 кВ, предоставленном Центром коллективного пользования Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН. Количество качественных снимков равнялось до 50 экземпляров в каждой серии экспериментов.
РЕЗУЛЬТАТЫ
Мы провели эксперименты на нервных ганглиях моллюска, брюшном мозге медицинской пиявки и симпатическом ганглии лягушки. При анализе контрольного материала мы не обнаружили ЩК на наших препаратах. Как известно, ЩК встречаются крайне редко. После обработки материала проназой, во всех видах ганглиев отмечается неспецифический процесс разрушения и удаления из ганглия глиальных оболочек. Оставшиеся незначительные фрагменты отростков глиоцитов сокращаются и образуют варикозные расширения (рис. 1а), которые можно видеть, в частности, в щелях, оставшихся после протеолиза глиоцитов (рис. 1б). Многие нервные волокна, лишенные глиоцитов, прилегают друг к другу на обычном межклеточном расстоянии, равном 20 нм. Другие противолежащие мембраны нервных волокон образуют ЩК или ПК. На некоторых препаратах мозга лягушки после обработки проназой ЩК образуются почти между всеми соседними клетками (рис. 2). Особенность мембран при обработке проназой состоит в том, что белки аксолеммы со временем при денатурации, агрегируя с мембраной, существенно утолщают ее поверхностные образования (“бахрома”) и маскируют светлую полосу, соответствующую гидрофобным жирным кислотам билипидной мембраны, и ее наружные контуры.
Рис. 1.
Фрагменты неспецифических изменений наружной и внутренней глиальных оболочек симпатических ганглиев пиявки, моллюска и лягушки в норме и после обработки проназой. а – Ганглий пиявки в норме; б – ганглий лягушки в норме; в – массовая диссоциация глиальной наружной оболочки в ганглии пиявки, варикозности после воздействия проназы; г – остатки глиальной оболочки между двумя нейронами в ганглии лягушки; 1 – варикозная форма фрагмента глиоцита после его отрыва, перед окончательным лизисом; стрелка – щелевой контакт; Г – глия; A – аксон; М – митохондрия. Электронная микроскопия. Масштабная линейка: а – 1.5 мкм; б – 1.5 мкм; в – 3 мкм; г – 4 мкм.
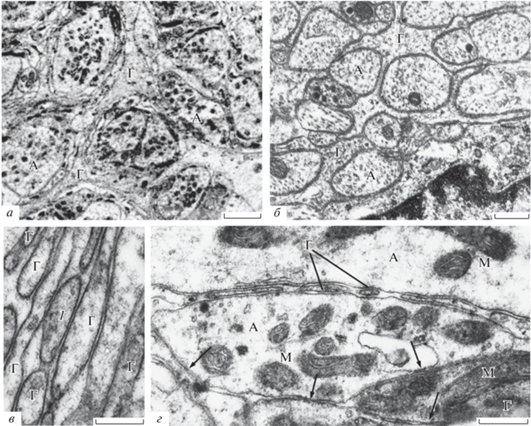
Рис. 2.
Безглиальные нервные волокна ганглия моллюска (а) и группа денудированных вегетативных нервных волокон ганглия лягушки, образующих мембранные контакты (б) после обработки проназой. 1 – пустоты, где ранее находились отростки глиоцитов; 2 – микротрубочки; 3 – остаток сократившейся в результате протеолиза “культи” глиальной оболочки; 4 – нейрон; 5 – митохондрии; стрелки – межнейронные щелевые контакты. Электронная микроскопия. Масштабная линейка: а – 2 мкм; б – 3 мкм.

В случае образованных глиоцитами оболочек нервных клеток и волокон ЩК выявляются на всех препаратах. Внутри щели бахрома часто маскирует слои билипидных мембран. По бокам ЩК нередко наблюдаются расширения межклеточного пространства (рис. 3), которые, по-видимому, формируются за счет скопления “свободной воды”, образующейся в результате процесса протеолиза мембранных белков. Обращает на себя внимание также и большое количество одиночных локальных ЩК (рис. 4). Их щели заполнены осмиофильными белковыми агрегатами, маскирующими семислойное строение ЩК. Встречаются и множественные, серийные ЩК в форме цепочки (рис. 5). Они расположены последовательно на пресинапсах.
Рис. 3.
Варианты спаренных щелевых контактов волокон мозга пиявки и ганглия лягушки после действия проназы. а – Три ЩК на препарате мозга пиявки; б – четыре ЩК на препарате ганглия лягушки; 1 –межнейронные щели, расширенные за счет накопления “свободной воды” после денатурации белков; стрелки – электрические синапсы; М – митохондрия; Н – нейроны. Электронная микроскопия. Масштабная линейка: а – 1 мкм; б – 2 мкм.

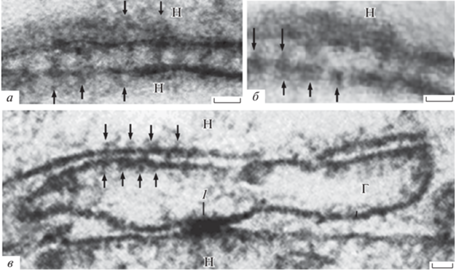
Рис. 4.
Одиночные щелевые контакты после обработки мозга пиявки 0.4%-ной проназой в течение 60 мин. Cтрелки – щелевые контакты. Электронная микроскопия. Масштабная линейка: а, б – 40 нм.

Рис. 5.
Множественные щелевые контакты в области химических синапсов, утратившие хеморецепторные специализации (специфические морфологические признаки пре- и постсинаптических мембран) после обработки проназой, в ганглиях моллюска (а, в) и лягушки (б). Н – нейрон; cтрелки – щелевые и плотные нейро-нейрональные контакты разной величины. Электронная микроскопия. Масштабная линейка: а–в – 1 мкм.

На ультраструктурном уровне контакты между нейронами моллюска, лягушки и пиявки имеют сходное строение. Их число достигает шести на одном нейрите. При этом следует вновь обратить внимание на многочисленные почти сплошные семислойные ЩК. На рис. 5 наряду с множественными ЩК представлены химические синапсы, характерной особенностью которых является отсутствие типичных пресинаптических и постсинаптических хеморецепторных специализаций в области скопления синаптических пузырьков, что является последствием протеолиза.
Удивительно, но в результате действия проназы, комплекса протеолитических ферментов, формируются межклеточные септы, представляющие собой агрегаты межнейрональных белков (рис. 6). Иногда они имеют сходные размеры и чередуются, располагаясь примерно на одном расстоянии друг от друга. Встречается небольшое количество и узких белковых глиально-нейрональных мостиков (рис. 6). Межклеточные белковые околомембранные агрегаты локализуются поперек мембран и имеют утолщения на своих концах. Они выпячиваются и внутрь, и наружу от обеих мембран, маскируя размеры межклеточной щели и, по-видимому, нарушая ее изоляционную функцию. В тех случаях, когда прослеживается межклеточная щель, можно отметить, что обе мембраны оказываются связанными поперечными, плохо видимыми белковыми мостиками. Перемычки продолжаются внутрь нейролеммы и обычно имеют пирамидальную форму. В результате действия проназы получено значительное разнообразие структур.
Рис. 6.
Множественные межклеточные трансмембранные мостики, выявляемые после обработки препарата проназой. а – Сформировавшиеся септы после обработки ганглия лягушки проназой; б – формирующиеся септы после обработки проназой ганглия лягушки; в – узкие нейронно-глиальные септы моллюска; 1 – непрерывный нейронно-глиальный контакт нейролеммы и глиолеммы сохранившейся варикозности отростка глиоцита после обработки проназой; стрелки – межнейрональные, нейронно-глиальные мостики и агрегаты околомембранных белков пирамидальной формы; Г – глия; Н – нейрон. Электронная микроскопия. Масштабная линейка: а, б – 20 нм; в – 40 нм.
ОБСУЖДЕНИЕ
Новообразование ЩК при действии проназы относится к ряду необычных, непредвиденных функций проназы. С помощью обработки ганглиев позвоночного и беспозвоночных животных 0.4%-ных раствором проназы впервые получены экспериментальные ЩК. Впервые выявлено деструктивное действие проназы на химические синапсы, приводящее к утрате пре- и постсинаптических структур. Новообразование ЩК при сближении мембран может встречаться при травмах, воспалениях, и приводить к изменению электрогенеза (Belousov et al., 2017). В химических синапсах, как известно, имеется четыре составляющих: пре- и постсинаптические структуры, синаптическая щель и пузырьки с медиатором в терминалях аксона. При протеолизе исчезают хеморецепторные околомембранные белковые комплексы, а пузырьки, ограниченные липидной мембраной, остаются хорошо видимыми.
Экспериментальные исследования, проводимые на “простых нервных системах”, вносят определенный вклад в различные разделы физиологии, позволяя изучать клеточные, молекулярные, генетические механизмы. Известно, что белковые агрегаты липидных бислоев (септы), могут быть электропроницаемыми (Беркинблит и др., 1981). Наши эксперименты, проведенные с проназой, продемонстрировали еще один вариант использования нервной системы моллюска, пиявки и лягушки. Поскольку проназа не изменяет амплитудные и кинетические характеристики ионных токов, участвующих в генерации нервных импульсов (Lun’ko et al., 2014), наша экспериментальная модель может быть полезной для изучения многих еще не понятых свойств и особенностей ЩК как ЭС. Действительно, в предыдущих наших электрофизиологических исследованиях было показано, что созданные de novo цепочки ЭС между мембранами нервных волокон у моллюска, пиявки и лягушки имеют особые электрические функции – они на один раздражающий импульс образуютю частотную серию (6–8) спайков, формируют реакцию реверберации (Сергеева и др., 2020; Сотников, 2021). Известно, что классическая физиология предположительно объясняет возникновение реверберации возбуждения круговой связью между цепочкой естественных ЩК в головном мозге. Мы впервые получили этот нервный процесс на экспериментальных, четко морфологически установленных ЩК.
Результатом настоящей работы является подтверждение на ультраструктурном уровне формирования большого числа ЩК в ганглиях моллюска, пиявки и лягушки под влиянием проназы. Так как в подобных условиях под действием проназы ранее нами доказано появление электрических синапсов, можно предполагать, что ЩК являются морфологическим эквивалентом ЭС.
Список литературы
Антонов В.К. 1991. Химия протеолиза. М.: Наука. (Antonov V.K. 1991. Chemistry of proteolysis. M.: Nauka.)
Беркинблит М.Б., Божкова В.П., Бойцова Л.Ю., Миттельман Л.А., Потапова Т.В., Чайлахян Л.М., Шаровская Ю.Ю. 1981. Высокопроницаемые контактные мембраны. М.: Наука. (Berkinblit M.B., Bozhkova V.P., Boitsova L.Yu., Mitelman L.A., Potapova T.V., Chailakhyan L.M., Sharovskaya Yu.Yu. 1981. Highly permeable contact membranes. M.: Nauka.)
Кириченко Е.Ю., Повилайтите П.Е., Сухов А.Г. 2008. Роль щелевых контактов в локальном ритмогенезе корковых колонок. Морфология. Т. 133. № 1. С. 31. (Kirichenko E.Y., Povilaitite P.E., Sukhov A.G. 2009. Role of gap junctions in local rhythmogenesis in cortical columns. Neurosci. Behav. Physiol. V. 39. № 2. P. 199.)
Сергеева С.С., Сотников О.С., Парамонова Н.М. 2020. Способ создания нейрофизиологической модели простой нервной системы, обладающей реверберацией. Физиол. Журн. им. И.М. Сеченова. Т. 106. № 9. С. 1163. (Sergeeva S.S., Sotnikov O.S., Paramonova N.M. 2020. A method for creating a neurophysiological model of a simple nervous system with reverberation. Fiziol. Zh. im. I.M. Sechenova. V. 106. № 9. P. 1163.) https://doi.org/10.31857/S0869813920080075
Сотников О.С., Костенко М.А. 1981. Реактивные изменения живых нервных окончаний в культуре изолированных нейронов, лишенных глии. Архив АГЭ. Т. 80. № 6. С. 17. (Sotnikov O.S., Kostenko M.A. 1981. Reactive changes of living nerve endings in the culture of isolated neurons deprived of glia. Archive of the ASGE. V. 80. №. 6. P. 17)
Сотников О.С. 2021. Серия экспериментальных электрических синапсов и реверберация нервного импульса. Технол. Живых Сист. Т. 18. № 3. С. 52. (Sotnikov O.S. 2021. A series of experimental electrical synapses and reverberation of a nerve impulse. Tekhnol. Zhivykh Sist. V. 18. № 3. P. 52.) https://doi.org/10.18127/j20700997-202103-05
Alcamí P., Pereda A.E. 2019. Beyond plasticity: the dynamic impact of electrical synapses on neural circuits. Nat. Rev. Neurosci. V. 20. P. 253. https://doi.org/10.1038/s41583-019-0133-5
Allen M., Ghosh S., Ahern G.P., Villapol S., Maguire-Zeiss K.A., Conant K. 2016. Protease induced plasticity: matrix metalloproteinase-1 promotes neurostructural changes through activation of protease activated receptor 1. Sci. Rep.V. 6. P. 35 497. https://doi.org/10.1038/srep35497
Fontes J.D., Ramsey J., Polk J.M., Koop A., Denisova J.V., Belousov A.B. 2015. Death of neurons following injury requires conductive neuronal gap junction channels but not a specific connexin. PLoS One. V. 10. e0125395. https://doi.org/10.1371/journal.pone.0125395
Ixmatlahua D.J., Vizcarra B., Gómez-Lira G., Romero-Maldonado I., Ortiz F., Rojas-Piloni G., Gutiérrez R. 2020. Neuronal glutamatergic network electrically wired with silent but activatable gap junction. J. Neurosci. V. 40. P. 4661. https://doi.org/10.1523/JNEUROSCI.2590-19
Kerstein P.C., Patel K.M., Gomez T.M. 2017.Calpain-mediated proteolysis of TALIN and FAK regulates adhesion dynamics necessary for axon guidance. J. Neurosci. V. 37. P. 1568. https://doi.org/1010.1523/JNEUROSCI.2769-16.2016
Lun’ko O.O., Isaiev D.S., Maxymiuk O.P., Kryshtal’ O.O., Isaieva O.V. 2014. The effect of enzymatic treatment using proteases on properties of persistent sodium current in CA1 pyramidal neurons of rat hippocampus. Fiziol. Zh. V. 60. P. 75.
Magnowska M., Gorkiewicz T., Suska A., Wawrzyniak M., Rutkowska-Wlodarczyk I., Kaczmarek L., Wlodarczyk J. 2016. Transient ECM protease activity promotes synaptic plasticity. Sci. Rep. V. 6. P. 27757. https://doi.org/10.1038/srep27757
Nakagawa N., Hosoya T. 2019. Slow dynamics in microcolumnar gap junction network of developing neocortical pyramidal neurons. Neuroscience. V. 406. P. 554. https://doi.org/10.1016/j.neuroscience.2019.02.013
Spray D.C., Iglesias R., Shraer N., Suadicani S.O., Belzer V., Hanstein R., Hanani M. 2019. Gap junction mediated signaling between satellite glia and neurons in trigeminal ganglia. Glia. V. 67. P. 791. https://doi.org/10.1002/glia.23554
Talukdar S., Emdad L., Das S.K., Fisher P.B. 2022. GAP junctions: multifaceted regulators of neuronal differentiation. Tissue Barriers. V. 10. 1982349. https://doi.org/10.1080/21688370.2021.1982349
Thomas D., Senecal J.M., Lynn B.D., Traub R.D., Nagy J.I. 2020. Connexin 36 localization along axon initial segments in the mammalian CNS. Int. J. Physiol. Pathophysiol. Pharmacol. V. 12. P. 153.
Wang Y., Belousov A.B. 2011. Deletion of neuronal gap junction protein connexin 36 impairs hippocampal LTP. Neurosci. Lett. V. 502. P. 30. https://doi.org/10.1016/j.neulet.2011.07.018
Wang G., Wu X. 2021. The potential antiepileptogenic effect of neuronal Cx36 gap junction channel blockage. Transl. Neurosci. V. 12. P. 46. https://doi.org/10.1515/tnsci-2021-0008
Xu Y., Shen F.Y., Liu Y.Z., Wang L., Wang Y.W., Wang Z. 2020. Dependence of generation of hippocampal CA1 slow oscillations on electrical synapses. Neurosci. Bull. V. 36. P. 39. https://doi.org/10.1007/s12264-019-00419-z
Дополнительные материалы отсутствуют.


