Цитология, 2021, T. 63, № 5, стр. 460-473
Морфогенез остеоидных структур при культивировании мезенхимных стромальных клеток на фибриллярном коллагене в присутствии силикоалюмофосфата
А. А. Гайдаш 1, *, М. И. Блинова 2, С. А. Александрова 2, Ю. А. Нащекина 2, В. К. Крутько 1, О. Н. Мусская 1, К. В. Скроцкая 3, А. В. Нащекин 4, Н. А. Михайлова 2, А. И. Кулак 1
1 Институт общей и неорганической химии НАН Белоруссии
220072 Минск, Белоруссия
2 Институт цитологии РАН
194064 Санкт-Петербург, Россия
3 Научно-исследовательский институт физико-химических проблем Белорусского государственного университета
220006 Минск, Белоруссия
4 Физико-технический институт им. А.Ф. Иоффе РАН
194021 Санкт-Петербург, Россия
* E-mail: aljack880@gmail.com
Поступила в редакцию 01.06.2021
После доработки 22.06.2021
Принята к публикации 01.07.2021
Аннотация
Изучено влияние стеклокристаллического материала “Биосит-Ср Элкор” на ранние стадии морфогенеза остеоидных структур в культурах мезенхимных стромальных клеток костного мозга. Максимальный срок культивирования 28 сут. Морфологические исследования выполнены с применением сканирующей электронной микроскопии. Установлено, что силикоалюмофосфат ускоряет образование остеоидных структур, усиливает синтез, компактизацию и минерализацию фибриллярного коллагена, активирует матриксные везикулы путем гиперплазии, гипертрофии и экскреции. В ходе культивирования стеклокристаллический материал частично растворяется и распадается, в питательную среду выходят химические агенты, обладающие сшивающими, поверхностно-активными и минерализующими свойствами. За счет действия поверхностно-активных агентов компактизированные коллагеновые волокна расправляются и перфорируются с формированием гаверсифицированных пластинчатых структур – структурных предшественников костных пластинок. Минерализующее действие опосредуется усилением гомо- и гетерогенной нуклеации кальцийфосфатов, отложением минеральных конкреций в дифференцирующихся клетках и в волокнах коллагеновой подложки, что ускоряет инволюцию клеточной культуры. Сделано заключение, что стеклокристаллический материал Биосит-Ср Элкор оказывает стимулирующее влияние на ранние стадии остеогенеза в условиях in vitro.
Морфогенез органотипических структур в условиях in vitro и, безусловно, in vivo − явление трехмерное, что предполагает соответствующие аналитические 3D-подходы. Тем не менее, классические способы культивирования дифференцирующихся стволовых клеток основаны на применении двумерных моделей, преимущества которых хорошо известны. Прежде всего, это быстрая и относительно простая экспериментальная проверка результатов, построенных на анализе прижизненных или фиксированных клеточно-тканевых материалов (Nelson, Bissell, 2006). Благодаря этому достигнуто немало. Но оно же затмило главный недостаток методологий 2D-подходов – морфогенез рассматривается исключительно в плоскостях горизонтальной направленности, а структуры в ортогональных проекциях недоступны. Недостаток в определенной мере компенсируют сканирующей зондовой технологией (сканирующая электронная, атомно-силовая, туннельная микроскопии), расширяющей инструментальный континуум и позволяющей изучать трехмерные интерфейсы с высоким пространственным разрешением. Особенно полезны подобные методики (в частности, сканирующая электронная микроскопия) при исследовании морфогенетических последствий влияния тех химических агентов, которые по своей природе образуют трехмерные связи.
Применительно к кремнию речь идет о силоксановых связях (≡Si–O–Si≡), формирующих устойчивые 3D-конфигурации. Именно трехмерные надмолекулярные конструкции могут оказаться морфогенетическим стартапом, детальный анализ которого в парадигме 2D-подходов явно ограничен. Одними из источников силоксановых связей являются природные и синтетические силикоалюмофосфаты (САПО) − микропористые твердые вещества с различным соотношением SiO2 : Al2O3 : P2O5. Синтетические САПО обладают технологически привлекательными свойствами: механической прочностью, термостойкостью, а также селективной каталитической активностью (Lok et al., 1984; Sinha et al., 1997; Fujdala, Tilley, 2001; Akhtar et al., 2014; Peng et al., 2018). Известны различные варианты (AlxPySiz)О2: САПО-11, САПО-18, САПО-34, САПО-34/18, САПО-39, САПО-40 и др., отличающиеся соотношением SiO2/Al2O3 (Li et al., 2019; Knyazeva et al., 2019; Wang et al., 2019).
Все разновидности САПО имеют структуру специфически расположенных бренстедовских кислотных центров, позволяющих использовать их для проведения направленных химических реакций. Биоситаллы – аморфные стеклокристаллические материалы, при растворении которых возникают фазовые неоднородности. Так, в жидких биомиметической среде (сыворотке крови) САПО постепенно растворяются без осаждения. При этом изменяется структура решетки стекла, в которую входят гидроксильные ионы, а в ходе выщелачивания высвобождаются кремний, кальций и фосфор (Nikolić et al., 2017; Aripova et al., 2020).
Хорошо известно, что это остеотропные химические элементы, которые повышают плотность костной ткани и сдерживают ее резорбцию при остеопении, спровоцированной геохимическими или патофизиологическими факторами (Bae et al., 2008; Laruelle et al., 2009; Kim et al., 2009; Bu et al., 2015; Rodella et al., 2014). Остеостимулирующие эффекты являются базовыми и хорошо изучены на популяционном и организменном уровнях. Что же касается клеточных механизмов, проявляющихся на ранних стадиях, то сведений об этом недостаточно. В этом смысле первичные культуры дифференцирующихся стволовых клеток являются подходящей моделью для изучения остеогенеза на ранних стадиях.
Цель работы – определить характер влияния силикоалюмофосфата на морфогенез остеоидных структур при культивировании мезенхимных стромальных клеток.
МАТЕРИАЛ И МЕТОДИКА
Клетки. Культуру диплоидных мультипотентных мезенхимных стромальных клеток (МСК) получали из костного мозга конечностей новорожденного кролика породы Шиншилла по стандартному методу (Николаенко, 2008). Для получения необходимого количества клетки культивировали в питательной (ростовой) среде следующего состава – αMEM (Sigma, США), 10% сыворотки эмбрионов коров (HyClone, США), 1% раствора антибиотиков Pen Strep (Sigma, США), 1% раствора глутамина Ultraglutamine (Lonza, Bеlgium). При пересеве открепление клеток осуществляли с помощью 0.25%-ного раствора трипсина в этилендиаминтетрауксусной кислоте (Invitrogen, Великобритания). Пассирование выполняли каждые 5–7 сут по достижении клетками субконфлюентного монослоя в культуральных флаконах площадью 25 и 75 см2 (TPP, Швейцария). Клетки открепляли и пересевали в чашки Петри Tissue Culture Flask (TPP, Швейцария) диаметром 34 мм.
Варианты экспериментов: 1) контроль – стандартное культивирование клеток; 2) культивирование на подложке из коллагена I типа; 3) культивирование в присутствии гранул стеклокристаллического материала “Биосит-Ср Элкор” (ГС); 4) культивирование с использованием коллагена I типа и ГС. Культивирование проводили в ростовой и дифференцировочной (остеогенной) средах StemPro Osteogenesis Differentiation Kit (Life Technologies, США) при 37°С в СО2-инкубаторе в атмосфере 5% СО2.
Получение коллагена I типа. Коллаген получен из паравертебральных хвостовых сухожилий крыс породы Вистар методом кислотной экстракции, который обеспечивает сохранение концевых телопептидов (Кухарева и др., 2003). Раствор коллагена приготовлен в следующей последовательности. Первичные образцы сухожильных нитей выводили из хвостов, промывали 0.9%-ным раствором NaCl и проводили экстракцию в 0.5 М CH3COOH. Полученный после экстракции материал осаждали, доводили концентрацию NaCl до 0.9 М; центрифугировали и диализовали против воды с последующей заменой на 0.1 М раствор уксусной кислоты. После диализа полученный раствор доводили до содержания уксусной кислоты 0.5 М. Далее проводили фосфатное осаждение: диализ против 0.5 М Na2HPO4 в течение 2 сут, затем заменяли раствор на 0.02 М Na2HPO4, эту процедуру повторяли еще три раза. Новый осадок разбавляли 0.5 М уксусной кислотой. Далее стерилизовали коллаген путем диализа в 0.5 М уксусной кислоте с хлороформом с последующей сменой раствора на 0.1, 0.001 М раствор уксусной кислоты. В течение следующих 4 сут меняли 0.001 М раствор уксусной кислоты еще 2 раза. В итоге получали концентрированный раствор коллагена I типа, который разводили в 0.001%-ном растворе уксусной кислоты до концентрации 100 мкг/мл (Швед и др., 2007). Белок в конечной концентрации наносили на внутреннюю поверхность культуральных сосудов или ГС, оставляли на 30 мин при 37°С. В результате такого способа нанесения на поверхностях формировался тонкий слой белка в молекулярной форме (Швед и др., 2007). После этого убирали не связавшийся с поверхностью белок, промывая фосфатно-солевым буферным раствором (PBS) и ростовой средой.
Стеклокристаллический материал “Биосит-Ср Элкор” (ГС). Материал разработан в ООО НПФ “Элкор” (Санкт-Петербург). Диаметр зернения ГС составлял 1–0.3 мм. В состав ГС входят (мас. %): 26.0–33.4 SiO2; 10.5–13.5 P2O5; 4.3–5.5 Al2O3; 23.6–30.4 CaO; 2.1–2.7 MgO; 3.5–4.5 ZnO, а также 30 об. % даллита. Общая пористость ГС составляет 60% (Елагина и др., 1999). Непосредственно перед использованием ГС дважды промывали полной ростовой средой с содержанием СЭК 10%.
На все варианты экспериментальных поверхностей высевали МСК-КМ в ростовую среду с разной плотностью: 21.7 тыс. кл./см2 для культивирования в течение 3 и 7 сут, 5.4 тыс. кл./см2 для культивирования в течение 14 сут и 2.7 тыс. кл./см2 (для культивирования в течение 21 и 28 сут. После прикрепления клеток к подложке в половине лунок заменяли среду на дифференцировочную. Клетки культивировали в течение указанных сроков, меняя соответствующую среду два раза в неделю.
Сканирующая электронная микроскопия (СЭМ). Для СЭМ образцы освобождали от питательной среды, промывали PBS и деионизованной водой. Затем фиксировали в растворе глутарового альдегида на PBS по схеме: 0.5%-ный раствор – 15 мин, 1%-ный – 30 мин, 2%-ный – 45 мин. Обезвоживали в растворах этанола в деионизованной воде восходящей концентрации по схеме: 10, 30, 45, 60, 70% – по 15 мин, 80% – 10 мин, 90% – 5 мин, 96% – 2 мин. Фиксированные образцы напыляли золотом в вакуумной установке K550X (Emitech, Англия) и изучали на растровых электронных микроскопах JSM-7001F (Jeol, Япония) и LEO 1420 (Carl Zeiss, Германия). Презентативность результатов обеспечивали 2–3 повторами каждой серии.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При культивировании МСК-КМ совместно с экзогенным коллагеном и ГС в дифференцировочной среде формируется структурно неоднородная волоконная подложка, состоящая из рыхлой и плотной частей. В рыхлой части коллагеновая подложка трансформируется в ячеистую структуру с множественными сообщающимися отверстиями, сплетенными коллагеновыми волокнами, утолщающимися в узлах и покрывающими делящиеся клетки (рис. 1а). В плотной части коллагеновые субфибриллы организованы в многослойную пористую пленку (рис. 1б). Размеры пор варьируют в пределах от 50 нм до 1.5 мкм. Форма пор аппроксимируется ближе к эллипсоидам с хаотично ориентированными длинными осями (рис. 1в), свидетельствующая о действии разнонаправленных сил растягивания, возможно, в связи с ростом поверхностного натяжения жидкой фазы. По мере увеличения сроков культивирования подложка дезорганизуется, сетчатые структуры распадаются (рис. 1г), пластинчатые структуры разрыхляются и частично отслаиваются (рис. 1д), коллагеновые волокна утолщаются, скручиваются, сморщиваются (рис. 1е).
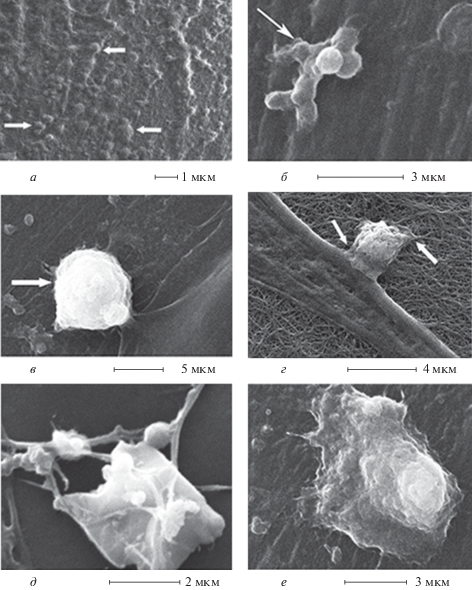
Рис. 1.
Микрофотографии структурных трансформаций коллагеновой подложки в ходе культивировании МСК-КМ в дифференцировочной среде (сканирующая электронная микроскопия). а – Сетчатая структура подложки (3 сут); б – стромальные клетки, погруженные в коллагеновую подложку, 3 сут (стрелки); в – пористые структуры коллагенового покрытия стромальной клетки (3 сут); г – распад сетчатой структуры коллагеновой подложки (7 сут); д – разрыхление и отслоение пластинки компактизированных коллагеновых волокон (14 сут); е – утолщение и механические деформации коллагеновых волокон подложки (14 сут).

В ходе культивирования коллагеновая подложка активно взаимодействует с ГС, также подвергающиеся закономерной трансформации. Частицы исходных образцов ГС имеют структуру склеенных полигональных линз (рис. 2а). По данным энергодисперсионного анализа в их состав входят (мас. %): O (31.0), Ca (23.0), Si (13.0), P (3.0), Al (2.5). В течение 3 сут культивирование ГС покрываются минерально-органической пленкой − пористой (рис. 2б) или плотной (рис. 2в). От пленок отходят короткие тонкие спайки, прикрепляющие ГС к подлежащим структурам (рис. 2г) и удерживающие их в фиксированном состоянии в условиях достаточно продолжительного культивирования (до 28 сут).
Рис. 2.
Микрофотографии структурных преобразований гранул ситалла при инкубации в дифференцировочной среде (сканирующая электронная микроскопия). а – Структура исходного образца ситалла; б – пористая пленка на поверхности гранулы ситалла (3 сут); в – плотная пленка на поверхности, сшивающая гранулы ситалла, 3 сут (стрелка); г – волокнистые спайки, фиксирующие гранулы к подложке, 14 сут (стрелка); д – микроканалы в грануле ситалла, 14 сут (стрелки); е – линза на месте распавшейся гранулы ситалла (14 сут).

Пористая структура ГС в какой-то мере сходна со структурой функционализированных мезопористых кремнеземов с расширенными порами, используемых в близких экспериментальных условиях для доставки полимерных и жидкоподобных биомиметических предшественников аморфизированных кальцийфосфатов (АКФ) со стимуляцией внутрифибриллярной минерализации коллагена (Luo et al., 2016; Wei et al., 2020). В питательных средах (в равной мере в ростовой и дифференцировочной) мезопористость ГС проявляет структурную нестабильность – гранулы пронизываются множественными широкими каналами (рис. 2д). Гранулы в нейтральном или слабощелочном растворах питательных сред беспорядочно расклеиваются, крошатся, фрагментируются по линиям спекания с высвобождением остроугольных кварцеподобных линз (рис. 2е), несомненно, увеличивающих риски повреждения клеток.
Физико-химические механизмы разрушения ГС под воздействием питательных сред не ясны. Растворение изоморфов кремнезема обусловлено нуклеофильным воздействием диполей воды на связи (≡Si−O−Si≡) в сети (SiO2)n. Молекулы воды ориентируют свой электроотрицательный кислород к атому Si, перемещая электронную плотность на силоксановые связи, растягивая их вплоть до разрыва и высвобождая гидратированные атомы Si в составе кремниевой кислоты H4SiO4 (Dove et al., 1990). Переход от твердого вещества к растворенному в подобных материалах происходит через промежуточное состояние геля, изменение структуры каталитических центров, и неизбежно сопровождается выходом в раствор активных молекулярных групп и, прежде всего, силикатных полианионов (${\text{iSiO}}_{4}^{{4 - }},$ где i – число атомов кремния), вытесняемых из ситаллов в ходе замены атомов кремния на атомы фосфора (Поляков и др. 2008; Douglass et al., 2018). В структурe ${\text{iSiO}}_{4}^{{4 - }}$ отсутствует дальний порядок, что снижает термодинамическую стабильность и ускоряет кинетику растворения (Alexandre et al., 1997). Вследствие этого повышаются связеобразующие свойства полианионов ${\text{iSiO}}_{4}^{{4 - }},$ усиливающие сшивку органических макромолекул, в том числе и фибриллярного коллагена. Таким образом, в данной модели силикатные полианионы функционируют как гелеобразующие агенты.
Сшивающее действие является, по нашему мнению, наиболее вероятным механизмом компактизации коллагеновых волокон при участии ситаллов. Все начинается с адгезии фибрилл, оплетающих минеральные частицы (рис. 3а), безусловно, приводящей к механической сшивке гранул. Силикаты вообще усиливают адгезионные взаимодействия между минеральной и органической фазами: ускоряется время схватывания пломбировочного (твердеющего или цементного) материала и увеличивается количество прилипших к нему клеток (Kang, 2020; Shie et al., 2012), склеиваются с костными трабекулами частицы гидроксиапатита (ГА) в кремнеземколлагеновом композите (Heinemann et al., 2013). Сшивающие свойства силикатов, конечно, синергичны имманентной способности к внеклеточной самосборке и агрегации коллагеновых волокон с формированием протяженных пластинчатых структур.
Рис. 3.
Микрофотографии ранних стадий формирующихся остеоидных структур с участием гранул ситалла (сканирующая электронная микроскопия). а – Фиксация тонких нитей коллагеновых волокон к гранулам ситалла, 3 сут (стрелки); б – перфорированные пластинки и расположенные на их поверхности стромальные клетки (3 сут); в – межфибриллярные скрепления в тонкой пластинке (3 сут); г – эластичная пленка, огибающая текстуру поверхности гранулы (3 сут); д – перфорированный участок коллагеновой пластинки с уплотненными гаверсоподобными отверстиями (3 сут); е – дебрис с останками пластинчатых структур (14 сут).

Усиливается этот процесс стволовыми клетками, о чем свидетельствует массовое расселение клеточных клонов на обширных пленочных покрытиях ГС (рис. 3б). Покрытия перфорированы, что увеличивает площадь крепежной поверхности в узлах сплетения коллагеновых нитей (рис. 3в) и способствует равномерному распределению механических нагрузок. Пленки явно гибкие, так как интимно облегают шероховатую текстуру поверхности гранул (рис. 3г). В итоге гранулы пакетируются, связи упрочняются, лизис и распад сдерживаются. Механические мотивы, оптимизирующие прочностные свойства данной конструкции, по-видимому, являются целеполагающими индукторами не только хорошо организованного перфорирования, но и особого структурирования отверстий, придающих пластинкам сходство с гаверсифицированными костными ламеллами, появляющимися в очагах регенерации костной ткани и в эмбриональных закладках остеогенной направленности. Перфорирование, уплотнение и выстояние краев, многорядность и принятие отверстиями термодинамически выгодной округлой формы (рис. 3д) необратимый и в данных экспериментальных условиях довольно быстротечный процесс. Через 14 сут культивирования большая часть ГС-ассоциированных ламелл разрушается, сохраняя в дебрисе обрывки с характерной структурой компактизированных коллагеновых волокон (рис. 3е).
Стволовые клетки чувствительны к действию остеоиндуктивных агентов, содержащихся в дифференцировочной среде. Наиболее ранним структурным откликом является гиперплазия везикул внутриклеточного матрикса. На коротких сроках культивирования МСК (до 7 сут) матриксные везикулы (МВ) имеют шаровидную форму и диаметр, варьирующий от 30 до 500 нм (рис. 4а). При увеличении продолжительности культивирования МВ делятся почкованием (рис. 4б) и мигрируют во внеклеточное пространство, где увеличиваются в размерах путем слияния в крупные до 5−7 мкм формы (рис. 4в), адгезируя к наружной поверхности клеток (рис. 4г). Матриксные везикулы непосредственно взаимодействуют с ГС: оседают, прилипают, формируя полиморфные агрегаты (рис. 4д). Увеличение численности и размеров МВ с формированием мегаформ, безусловно, свидетельствует об активации процессов гомогенной нуклеации. С учетом состава дифференцировочной среды можно с уверенностью заявить о стимулирующем действии остеогенных агентов, введенных в питательные среды.
Рис. 4.
Микрофотографии трансформаций матриксных везикул при культивировании МСК-КМ в дифференцировочной среде (сканирующая электронная микроскопия). а – Гиперплазия матриксных везикул в цитоплазме дифференцирующейся клетки, 3 сут (стрелки); б – деление матриксных везикул путем почкования во внеклеточном матриксе, 7 сут (стрелка); в – гипертрофия и адгезия матриксных везикул к поверхности клетки, 7 сут (стрелка); г – адгезия матриксных везикул к волокнам внеклеточного матрикса, 7 сут (стрелки); д – адгезия матриксных везикул и гранул ситалла к коллагеновым волокнам, 7 сут; е – адгезия слившихся матриксных везикул к новообразованным коллагеновым волокнам, 7 сут.
МВ – основные структуры, обеспечивающие гомогенную нуклеацию кальцийфосфатов (КФ), и напрямую индуцируют первичную минерализацию в ходе остеогенеза. Везикулы содержат нуклеационные комплексы (НК), состоящие из АКФ, фосфатидилсерина и аннексина V. Основным механизмом формирования НК является накопление во внутривезикулярной жидкости кислотно-лабильной фазы, включающей ионы Ca2+ и ${\text{PO}}_{4}^{{3 - }},$ в узком диапазоне значений рН между 7.4–7.8 (Valhmu et al., 1990). Интравезикулярные протеогликаны, обволакивая нуклеационные центры, создают диффузионный барьер, ограничивающий осаждение и распространение структурирующихся КФ (Howell et al., 1977). Везикулы имеют двуслойную цитолемму, по сравнению с плазматической мембраной более обогащенную сфингомиелином и фосфатидилсерином (Wuthier, 1975), связывающими и блокирующими проникновение в МВ ионов Ca2+ и ${\text{PO}}_{4}^{{3 - }},$ ингибируя тем самым минералогенез (Wu et al., 2002). Фосфолипазы деградируют липиды и, обеспечивая доступ Ca2+ и ${\text{PO}}_{4}^{{3 - }}$ к термодинамически устоявшимся центрам нуклеации (Blandford et al., 2003), стимулируют таким образом структурирование КФ.
Процессы гомогенной нуклеации поддерживаются нарастающим накоплением в нуклеационных ядрах Ca2+ и ${\text{PO}}_{4}^{{3 - }}$- в нерастворимых формах, проникающих в МВ из материнской фазы (культуральной жидкости), перенасыщенной КФ. Возможно, именно поэтому процессы гомогенной нуклеации активируются в непосредственной близости от микрозерен – источников ионных пар Ca2+ и ${\text{PO}}_{4}^{{3 - }},$ направленно мигрирующих по механизму электрохимического градиента к МВ внеклеточного матрикса. Приближение микрозерен к зонам избыточной концентрации химических прекурсоров приводит к увеличению степени локального пересыщения и повышает вероятность возникновения зародышей АКФ. Кластеры АКФ образуются через формирование отдельных структурных субъединиц Ca3(PO4)2 диаметром ~1.0 нм, объединяющихся в группы Поснера [Ca3(PO4)2]3 – энергетически наиболее устойчивые конфигурации прото-ядер, агрегирующиеся в частицы диаметром ~110 нм, не содержащие кристаллиты минерала и потому рентгеноаморфные (Wu et al., 1997). В местах минерализации за счет увеличения локальной концентрации фосфата и гидролиза неорганических пирофосфатов ${{{\text{P}}}_{2}}{\text{O}}_{7}^{{2 - }}$ (одних из самых мощных ингибиторов апатитогенеза) концентрация ионов кальция и фосфатов превышает точку их растворимости и накапливаются средние и основные КФ (Wuthier et al., 1972). По достижению критической концентрации структурированных КФ скачкообразно запускается кристаллизация ядер октакальцийфосфатов (ОКФ): зародыши структурирующихся КФ через трехсуточную лаг-стадию массово оседают на поверхностях ГС к 14 сут культивирования.
Везикулы внеклеточного матрикса в пространстве клеточной культуры распределены неравномерно. Вблизи коллагеновых субфибрилл, образованных de novo, ориентируются в основном крупные почкующиеся везикулы правильной округлой формы с четкими линиями мембран (рис. 4е). Многие МВ избирательно адгезированы к узким участкам волокон, возможно, стремясь к установлению связей аннексинов с C-телопептидами. Формирование такого рода интерфейса с одной стороны свидетельствует о структурной зрелости новообразованных фибрилл, а с другой, способствует локальному накоплению ионов Са2+ (Kirsch et al., 1994). Матриксные везикулы, дислоцированные в очагах отслоения коллагеновой подложки, менее крупные, контуры мембраны размыты, в популяции доминируют дефектные формы МВ. Таким образом, матриксные везикулы дифференцированно вовлекаются в ассоциирование с коллагеновыми волокнами в зависимости от степени структурно-метаболической конгруэнтности обоих партнеров.
В условиях культивирования гомогенная нуклеация осуществляется не изолированно, а в общем остеогенетическом тренде, направленном на образование костных пластинок. Вышеописанное структурирование плотных пластинок на ГС останавливается на 3−7 сут культивирования в дифференцировочной среде вследствие распада ГС в связи со структурно-механической несостоятельностью перфорированных пластин. Через 10−14 сут культивирования процессы компактизации коллагеновых волокон и структурирования КФ перемещаются в стволовые клетки, дифференцирующиеся в остеогенном направлении. Клетки активно, начиная с 3 сут культивирования в дифференцировочной среде, синтезируют пре-коллагены, вступающие во взаимодействия с МВ в ходе внутриклеточной самосборки (рис. 5а). Это может быть прямым следствием вторжения носителей силоксановых связей внутрь клеток, что вообще свойственно кремнийсодержащим соединениям, например, метасиликату натрия, который действует внутриклеточно, способствует образованию минерализованных конкреций и активирует синтез фибриллярного коллагена I типа в остеобластах (Kim et al., 2013).
Рис. 5.
Микрофотографии предшественников костных пластинок при культивировании МСК-КМ в дифференцировочной среде (сканирующая электронная микроскопия). а – Гиперплазия матриксных везикул в месте внутриклеточной компактизации протоколлагена, 14 сут (стрелка); б – секретированные во внеклеточное пространство коллагеновые фибриллы, 14 сут; в – полупрозрачная сформировавшаяся пластинка с адгезированными гранулами ситалла, 14 сут; г – экструзия из клетки компактизированных коллагеновых волокон, 14 сут; д – отростчатая пластинка с адгезированными матриксными везикулами и микрогранулами ситалла, 14 сут; е – депозит на поверхности минерализованных коллагеновых волокон, 14 сут (стрелка).

Фибриллы проявляют морфологические признаки структурной зрелости в виде упорядоченного чередования (с периодом в пределах 70−80 нм) тонких и толстых участков доменов первичных полипептидных цепей фибриллярного коллагена I типа. Одновременно с этим значительная часть нитей тропоколлагенов секретируется в ближайшее внеклеточное пространство (рис. 5б) и далее компактизируется в полупрозрачные пластинки (рис. 5в). Кроме внеклеточной, активно функционирует и внутриклеточная компактизация коллагеновых фибрилл, заканчивающаяся формированием толстых шнуров или же пластин, выталкиваемых из клеток (рис. 5г). Очевидно, что стволовые клетки дифференцировались в коллагенпродуцирующие остеобласты, которые способны генерировать энергетичные тяговые силы, позволяющие перемещать довольно массивные пакеты фибриллярного материала. Цитоплазма дифференцирующихся клеток уплотняется, МВ мигрируют в вытянутые перфорированные отростки, превращающиеся в отростчатые пластинчатые структуры (рис. 5д).
Минерализация костных пластинок осуществляется по механизмам гомо- и гетерогенной нуклеации. О гомогенной нуклеации свидетельствует локальное накопление МВ, а о гетерогенной – формирование депозитов на поверхностях кальцифицированных структур – остатков петрифицированных клеток и вытянутых отростчатых пластинок. Локальное накопление МВ происходит внеклеточно, в местах выхода компактизирующихся нитей тропоколлагена. В результате в поверхностных слоях цитоплазмы формируются минерализованные полоски.
Минерализация коллагеновых волокон, контактирующих с ГС, имеет свои особенности. Здесь явно интенсифицируются процессы компактизации коллагеновых волокон, инфильтрирующих расширенные поры гранул с формированием структурных прекурсоров костных пластинок, нередко обрастающих крупные гранулы, склонных к разрушению. По данным локального элементного микроанализа (ЭДС) микрогранулы пересыщены кальцием, десорбирующемся в ходе деструкции из ГС. Кроме того, источником кальция являются также и питательные среды, где он изначально присутствуют в составе солей. Заметим, что включение различных фаз КФ повышает активность кремнезем/коллагеновых композитов (Heinemann et al., 2009). Как бы ни было, но в окружении микрогранул создается концентрационный градиент по КФ, инициирующий минерализацию коллагеновых фибрилл по механизму гетерогенной нуклеации. Морфологически эти процессы визуализируются в виде отложения минерально-органических депозитов на коллагеновых субфибриллах с размерами, варьирующими от 100 нм до 3−5 мкм в зависимости от продолжительности культивирования. В состав депозитов входят пористые ГС, МВ диаметром до 1 мкм, фрагменты коллагеновых фибрилл. Некоторые депозиты имеют полигональную форму (рис. 5е).
Процессы гетерогенной нуклеации стартуют с осаждения сферических наночастиц АКФ в просветах интердигитирующих каналов – щелевидных пространств (зазоров) между сдвинутыми на четверть длины нитями тропоколлагенов. Численная плотность нитей тропоколлагенов и, соответственно, ширина зазоров в разных участках доменов отличается: в плотных (длиной до 35 нм) диаметр щелей не выше 1 нм. В рыхлых зонах интердигитирующие каналы представляют собой цилиндрические поры диаметром в пределах 2 нм (Xu et al., 2020). Преципитацию АКФ ускоряют положительный суммарный заряд С-концевых отделов коллагеновых волокон, увеличение рН в водных доменах и уплотнение наружной жидкой фазы гидратированных ионов КФ (чему способствует агрегация частиц АКФ с аспартатом), шероховатая текстура чередующихся выступов (впадин) коллагеновых фибрилл (Nudelman et al., 2010; Veis et al., 2012). Внутрифибриллярное структурирование АКФ происходит в ограниченном пространстве интердигитирующих каналов, где размер пор явно критичен по отношению к размерам субъединиц АКФ (~1 нм), имеющих, кроме того, не менее критично высокую (относительно объема) площадь поверхности. Без минимизации экстремальных уровней реактивной площади поверхности и, соответственно, избыточной свободной энергии структурирование ядер АКФ станет термодинамически запретным.
Структурно-геометрические особенности интердигитирующих каналов, по сути являющихся природной разновидностью мягких гибких нанотрубок, создают предпосылки для срабатывания эффекта наноразмерного удержания (конфайнмент), направленного на снижение уровней энергетических барьеров (Cantaert et al., 2013; Cantaert et al., 2013; Kim et al., 2018). Особое значение это имеет для нивелирования последствий структурного несоответствия при эпитаксиальном взаимодействии коллагеновых матриц и структурирующихся ядер АКФ. Это та ситуация, при которой именно внутрифибриллярный конфайнмент реализует термодинамически разрешенный тренд преобразования полиморфных сферических кластеров АКФ в монокристаллические наностержни ОКФ, которые трансформируются в стабильные двумерные поликристаллиты ГА, ориентированные по быстрорастущим осям. При этом росту кристаллитов не препятствуют стенки интердигитирующих каналов. Окончательные точки анизотропного роста структурирующихся КФ в нанокристаллиты ГА – это концевые отделы доменов нитей протоколлагенов.
Вышеприведенные морфологические и топологические особенности минерализации коллагеновых волокон свидетельствуют о наличии двух центров, где активно осуществляются эти процессы. Первый центр – околоклеточное пространство, место выхода пре-коллагенов и формирования тропоколлагена. Второй – ГС, места наибольшей концентрации КФ. Вне этих центров процессы минерализации коллагеновых волокон практически не происходят. Напомним, что источником используемого в данном исследовании экзоколлагена являются сухожилия, обработанные уксусной кислотой. Возможно, в ходе кислотной экстракции утрачиваются структурно-молекулярные атрибутивы, необходимые для минерализации. Одним из таковых может быть дезорганизованная доменная структура, обусловленная либо кислотной экстракцией фибриллярного коллагена, либо его скоротечным старением в процессе культивирования. В волокнах подложки, исходящих из экзогенного коллагена и лежащих вдали от клеток и за пределами ГС, признаки доменной организации слабо выражены.
Финальной стадий остеогенеза в условиях in vitro является образование костных пластинок, с характерной структурой, оформляющейся в период между 7 и 14 сут при культивировании в дифференцировочной среде. Все начинается, по-видимому, с уплотнения краевых отделов клетки (рис. 6а), кальцифицирующихся в точках контакта при взаимодействии с ГС (рис. 6б). Толстые стержни компактизированных коллагеновых волокон прорастают клеточную мембрану (рис. 6в), а на поверхности клеток появляются пластинчатые выросты агрегированных коллагеновых волокон с характерными гаверсоподобными отверстиями. Форма и размеры пластинок варьируют, но в основном представлены отростчатые, подковообразные экземпляры (рис. 6г, д) размерами от 13 мкм до 50 мкм. Окончательным этапом является отрыв костных пластинок от клеток и их свободное перемещение в инкубационной жидкости. Флотирующие пластинки имеют характерный вид: приподнятые отростки, широкие гаверсоподобные отверстия, плотное кальцифицированное тело (рис. 6е). Принципиально важным этапом морфогенеза остеоидных структур является стремление освободившихся костных пластинок к слиянию с формированием относительно толстых, разветвляющихся трабекулоподобных структур. На этом этапе остеогенетический потенциал клеточных культур в примененном формате исчерпывается.
Рис. 6.
Микрофотографии ранних стадий остеогенеза при культивировании МСК-КМ в дифференцировочной среде (сканирующая электронная микроскопия). а – Уплотнение внутриклеточного матрикса, 14 сут (стрелка); б – очаг минерализации внутриклеточного матрикса в области контакта с гранулой ситалла, 14 сут (стрелка); в – экструзия компактизированной пластинки с гаверсоподобными отверстиями из клетки, 14 сут (стрелка); г – подковообразная зрелая костная пластинка на поверхности клетки, 14 сут (стрелка); д – отросчатая костная пластинка на поверхности разрушенной клетки, 14 сут; е – оторвавшаяся свободно флотирующая костная пластинка, 14 сут (стрелка).

ЗАКЛЮЧЕНИЕ
Формирование остеоидных структур в условиях in vitro складывается из остеогенетических событий, происходящих внутри дифференцирующихся клеток, в интрафибриллярном и экстрафибриллярном пространствах. Остеогенез стартует с усиления синтеза фибриллярного коллагена и везикул внутриклеточного матрикса, их сопряженная гиперплазия и гипертрофия, секреция, внеклеточная самосборка фибрилл, направленная миграция везикул и избирательное вовлечение обоих партнеров в адгезионные и метаболические взаимоотношения. События, возникая вначале стохастически в виде разрозненных очагов остеогенетической активности, по мере увеличения продолжительности культивирования синхронизируются. В целом, ранние стадии морфогенеза остеоидных структур в условиях in vitro складываются из следующих этапов:
1) Усиление активности МВ, сопровождающееся гиперплазией, гипертрофией и направленной миграцией в зоны минерализации.
2) Компактизация коллагеновых волокон и пакетирование их в пластинчатые структуры.
3) Упорядоченное перфорирование и формирование гаверсифицированных прекурсоров костных ламелл.
4) Рост компактизированных коллагеновых волокон и экструзия их из клеток.
5) Созревание костных ламелл на поверхности клеток.
6) Отрыв от клеток и свободное флотирование созревших костных ламелл.
7) Агрегирование ламелл во внеклеточном пространстве и формирование трабекул, как окончательная стадия остеогенеза в условиях in vitro.
В механизмах минерализации остеоидных структур непосредственное участие принимают процессы гомо- и гетерогенной нуклеации КФ, а также конфайнмент, катализирующий кристаллогенез в ультратонких каналах коллагеновых фибрилл. Электронно-микроскопически усиление гомогенной нуклеации верифицируется везикуляцией и ассоциированием МВ с коллагеновыми волокнами. Гетерогенная нуклеация осуществляется интрафибриллярно – в виде увеличения количества, уплотнения и осаждения наноразмерных преципитатов КФ в интердигитирующих каналах, а также экстрафибриллярно – в виде отложения депозитов на поверхностях коллагеновых волокон.
Стеклокристаллический материал “Биосит-Ср Элкор” в ходе культивирования частично растворяется и подвергается распаду. При растворении в межклеточный матрикс выделяются сшивающие, поверхностно-активные химические агенты, а также КФ. В результате синергичного действия усиливается компактизация коллагеновых волокон, расправляются и перфорируются пластинчатые структуры, провоцируется коагуляция органической фазы и минерализация клеток и коллагеновой подложки. Таким образом, стеклокристаллический материал “Биосит-Ср Элкор” оказывает стимулирующее действие на остеогенез в условиях in vitro, но ускоряет инволютивные изменения в дифференцирующихся клетках. Неоднозначность влияния силиколюмофосфатов на морфогенез остеоидных структур делает необходимым проведение дальнейших исследований, уточняющих биотехнологические перспективы этого материала, биологическая активность которого еще во многом не изучена.
Список литературы
Елагина И.А., Лысенок Л.Н., Фоломеева Г.П. 1999. Остеопластический стеклокрисатллический композиционный материал для изготовления пористых имплантатов в виде гранул и способ их получения. Патент RU 2 132 702 C1. Номер заяв. 97121824/14. Дата регистрации: 26.12.1997. Дата публикации: 10.07.1999. (Elagina I.A., Lysenok L.N., Folomeeva G.P. 1999. Osteoplasticheskij steklokrisatllicheskij kompozicionnyj material dlya izgotovleniya poristyh implantatov v vide granul i sposob ih polucheniya. Patent RU 2132702 C1. Nomer zayav. 97121824/14. Data registracii: 26.12.1997. Data publikacii: 10.07.1999.)
Кухарева Л.В., Парамонов Б.А., Шамолина И.И., Семенова Е.Г. 2003. Способ получения коллагена для лечения патологий тканей организма. Патент. RU 2214827. (Kuhareva L.V., Paramonov B.A., SHamolina I.I., Semenova E.G. 2003. Sposob polucheniya kollagena dlya lecheniya patologij tkanej organizma. Patent. RU 2214827.)
Николаенко Н.С. 2008. Стволовые клетки взрослого организма в культуре. 2008. В кн.: Методы культивирования клеток. СПб.: Изд-во Политехн. Ун-та. С. 188. (Nikolaenko N.S. 2008. Stvolovye kletki vzroslogo organizma v kul’ture. 2008. V kn.: Metody kul’tivirovaniya kletok. SPb.: Izd-vo Politekhn. Un-ta. S. 188.)
Поляков В.Б., Арискин А.А. 2008. Моделирование состава и пропорций анионов в полимеризованных силикатных расплавах. Физика и химия стекла. Т. 35. № 1. С. 66. (Polyakov V.B., Ariskin A.A. 2008. Modeling the composition and proportion of anions in polymerized silicate melts. Phys. Chem. Glass. V. 35. № 1. P. 66.)
Швед Ю.А., Кухарева Л.В., Зорин И.М., Блинова М.И., Билибин А.Ю., Пинаев Г.П. 2007. Взаимодействие культивируемых клеток кожи с разными структурными формами коллагена, нанесенного на полилактидную матрицу. Цитология. Т. 49. № 1. С. 32. (Shved Yu.A., Kukhareva L.V., Zorin I.M., Blinova M.I., Bilibin A.YU., Pinayev G.P. 2007. Vzaimodeystviye kul’tiviruyemykh kletok kozhi s raznymi strukturnymi formami kollagena, nanesennogo na polilaktidnuyu matritsu. Tsitologiya. V.49. №1. P. 32.)
Akhtar F., Andersson L., Ogunwum, S., Hedin N., Bergström L. 2014. Structuring adsorbents and catalysts by processing of porous powders. J. Europ. Ceram. Soc. V. 34. P. 1643. https://doi.org/10.1016/j.jeurceramsoc.2014.01.008
Alexandre A., Meunier J.D., Colin F., Koud J.M. 1997. Plant impact on the biogeochemical cycle of silicon and related weathering processes. Geochim. Cosmochim. Acta. V. 61. P. 677.
Aripova M., Mkrtchan R. 2020. In vitro study of biodegradation of glass and glass crystals of the R2O–RO–CaF2–P2O5–Al2O3–SiO2 system. Chem. Chem. Eng. V. 3. P. 3. https://doi.org/10.51348/VLHK9013
Bae Y.-J., Kim J.-Y., Choi M.-K., Chung Y.-S., Kim M.-H. 2008. Short-term administration of water-soluble silicon improves mineral density of the femur and tibia in ovariectomized rats. biol. Trace Elem. Res. V. 124. P. 157. https://doi.org/10.1007/s12011-008-8138-3
Blandford N.R., Sauer G.R., Genge B.R., Wu L.N.Y., Wuthier R.E. 2003. Modeling of matrix vesicle biomineralization using large unilamellar vesicles. J. Inorg. Biochem. V. 94. P. 14. https://doi.org/10.1016/s0162-0134(02)00629-3
Bu S.Y., Kim M.-H., Choi M.-K. 2015. Effect of silicon supplementation on bone status in ovariectomized rats under calcium-replete condition. Biol. Trace Elem. Res. V. 171. P. 138. https://doi.org/10.1007/s12011-015-0506-1
Cantaert B., Beniash E., Meldrum F.C. 2013a. Nanoscale confinement controls the crystallization of calcium phosphate: Relevance to bone formation. Chemistry – A Eur. J. V. 19. P. 14918. https://doi.org/10.1002/chem.201302835
Cantaert B., Beniash E., Meldrum F.C. 2013b. The role of poly(aspartic acid) in the precipitation of calcium phosphate in confinement. J. Mater. Chem. B. V. 1. P. 6586. https://doi.org/10.1039/c3tb21296c
Douglass I., Harrowell P. 2018. Kinetics of dissolution of an amorphous solid. J. Phys. Chem. B. V. 122. P. 2425. https://doi.org/10.1021/acs.jpcb.7b12243
Dove P.M., Crerar D.A. 1990. Kinetics of quartz dissolution in electrolyte solutions using a hydrothermal mixed flow reactor. Geochim. Cosmochim Acta. V. 54. P. 955. https://doi.org/10.1016/0016-7037(90)90431-J
Fujdala K.L., Tilley T.D. 2001. An efficient, single-source molecular precursor to silicoaluminophosphates. J. Am. Chem. Soc. V. 123. P. 10133. https://doi.org/10.1021/ja0167295
Heinemann S., Heinemann C., Bernhardt R., Reinstorf A., Nies B., Meyer M., … Hanke T. 2009. Bioactive silica–collagen composite xerogels modified by calcium phosphate phases with adjustable mechanical properties for bone replacement. Acta Biomater. V. 5. P. 1979. https://doi.org/10.1016/j.actbio.2009.02.029
Heinemann S., Heinemann C., Wenisch S., Alt V., Worch H., Hanke T. 2013. Calcium phosphate phases integrated in silica/collagen nanocomposite xerogels enhance the bioactivity and ultimately manipulate the osteoblast/osteoclast ratio in a human co-culture model. Acta Biomater. V. 9. P. 4878. https://doi.org/10.1016/j.actbio.2012.10.010
Howell D.S., Pita J.C. 1977. Role of proteoglycans in calcification of cartilage. Upsala J. Med. Sci. V. 82. P. 97. https://doi.org/10.3109/03009737709179080
Kang S. 2020. Mineralization-inducing potentials of calcium silicate-based pulp capping materials in human dental pulp cells. Yeungnam Univ. J. Med. V. 37. P. 217. https://doi.org/10.12701/yujm.2020.00248
Kim D., Lee B., Thomopoulos S., Jun Y.-S. 2018. The role of confined collagen geometry in decreasing nucleation energy barriers to intrafibrillar mineralization. Nature Commun. V. 9. P. 1. https://doi.org/10.1038/s41467-018-03041-1
Kim E.-J., Bu S.-Y., Sung M.-K., Choi M.-K. 2013. Effects of silicon on osteoblast activity and bone mineralization of MC3T3-E1 Cells. Biol. Trace Element Res. V. 152. P. 105. https://doi.org/10.1007/s12011-012-9593-4
Kim M.-H., Bae Y.-J., Choi M.-K., Chung Y.-S. 2009. Silicon supplementation improves the bone mineral density of calcium-deficient ovariectomized rats by reducing bone resorption. Biol. Trace Elem. Res. V. 128. P. 239. https://doi.org/10.1007/s12011-008-8273-x
Kirsch T., Wuthier R.E. 1994. Stimulation of calcification of growth plate cartilage matrix vesicles by binding to type II and X collagens. J. Biol. Chem. V. 269. P. 11462.
Knyazeva E.E., Bok T.O., Kolozhvari B.A., Dobryakova I.V., Ivanova I.I. 2019. Preparation of binderless silicoaluminophosphates by vapor-phase crystallization of kaolin–phosphoric acid grains. Petroleum Chem. V. 59. P. 845. https://doi.org/10.1134/S0965544119080073
Laruelle G.G., Roubeix V., Sferratore A., Brodherr B., Ciuffa D., Conley D.J., Durr H.H., Garnier J., Lancelot C., Le Thi Phuong Q., Meunier J.-D., Meybeck M., Michalopoulos P., Moriceau B., Nı´ Longphuirt S. et al. 2009. Anthropogenic perturbations of the silicon cycle at the global scale: Key role of the land-ocean transition. Global Biogeochem. Cycles. V. 23. P. GB4031. https://doi.org/10.1029/2008gb003267
Li Y., Wang X., Thersleff T., Svensson G., Hedin N. 2019. Silicoaluminophosphate (SAPO)-templated activated carbons. ACS Omega. V. 4. P. 9889. https://doi.org/10.1021/acsomega.9b00135
Lok B.M., Messina C.A., Lyle Patton R., Gajek R.T., Cannan T.R., Flanigen E.M. 1984. Silicoaluminophosphate molecular sieves: Another new class of microporous crystalline inorganic solids. J. Am. Chem. Soc. V. 106. P. 6092.
Luo X., Yang H., Niu L., Mao J., Huang C., Pashley D. H., Tay F.R. 2016. Translation of a solution-based biomineralization concept into a carrier-based delivery system via the use of expanded-pore mesoporous silica. Acta Biomater. V. 31. P. 378. https://doi.org/10.1016/j.actbio.2015.11.062
Nelson C.M., Bissell M.J. 2006. Of extracellular matrix, scaffolds, and signaling: Tissue architecture regulates development, homeostasis, and cancer. Ann. Rev. Cell Dev. Biol. V. 22. P. 287.
Nikolić J.D., Tošić M.B., Grujić S.R., Živanović V.D., Đošić M.S., Matijašević S.D., Smiljanić S.V. 2017. Dissolution behavior of a polyphosphate glass in simulated body fluid. J. Serb. Chem. Soc. V. 82. P. 329. https://doi.org/10.2298/JSC161031009N
Nudelman F., Pieterse K., George A., Bomans P.H.H., Friedrich H., Brylka L.J., Hilbers P.A. J., Gijsbertus de With, Sommerdijk N.A.J.M. 2010. The role of collagen in bone apatite formation in the presence of hydroxyapatite nucleation inhibitors. Nature Mater. V. 9. P. 1004. https://doi.org/10.1038/nmat2875
Peng Q., Wang G., Wang Z., Jiang R., Wang D., Chen J., Huang J. 2018. Tuning hydrocarbon Pool Intermediates by the Acidity of SAPO-34 Catalysts for improving methanol-to-olefins reaction. ACS Sustainable Chem. Eng. V. 6. P. 16867. https://doi.org/10.1021/acssuschemeng.8b04210
Rodella L.F., Bonazza V., Labanca M., Lonati C., Rezzani R. 2014. A review of the effects of dietary silicon intake on bone homeostasis and regeneration. J. Nutrition Health Aging. V. 18. P. 820. https://doi.org/10.1007/s12603-014-0555-8
Shie M.Y., Chang H.C., Ding S.J. 2012. Effects of altering the Si/Ca molar ratio of a calcium silicate cement on in vitro cell attachment. Int. Endodontic J. V. 45. P. 337. https://doi.org/10.1111/j.1365-2591.2011.01981.x
Sinha A.K., Hegde S.G., Jacob N.E., Sivasanker S. 1997. Preparation and characterization of the silicoaluminophosphate SAPO-39. Zeolites. V. 18. P. 350. https://doi.org/10.1016/s0144-2449(97)00026-2
Valhmu W.B., Wu L.N.Y., Wuthier R.E. 1990. Effects of ratio, Ca2+ × Pi ion product, and pH of incubation fluid on accumulation of 45Ca2+ by matrix vesicles in vitro. Bone Mineral. V. 8. P. 195. https://doi.org/10.1016/0169-6009(90)90105-o
Veis A., Dorvee J.R. 2012. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcified Tissue Internat. V. 93. P. 307. https://doi.org/10.1007/s00223-012-9678-2
Wang Y.-S., Alrefaei Y., Dai J.-G. 2019. Silico-aluminophosphate and alkali-aluminosilicate geopolymers: A comparative review. Frontiers Materials. V. 6. P. 106. https://doi.org/10.3389/fmats.2019.00106
Wei S., Wu H., Luo X. 2020. Biomineralization precursor carrier system based on carboxyl-functionalized large pore mesoporous silica nanoparticles. Current Med. Sci. V. 40. P. 155. https://doi.org/10.1007/s11596-020-2159-3
Wu L.N.Y., Genge B.R., Dunkelberger D.G., LeGeros R.Z., Concannon B., Wuthier R.E. 1997. Physicochemical characterization of the nucleational core of matrix vesicles. J. Biolog. Chem. V. 272. P. 4404. https://doi.org/10.1074/jbc.272.7.4404
Wu L.N.Y., Genge B.R., Kang M.W., Arsenault A.L., Wuthier R.E. 2002. Changes in phospholipid extractability and composition accompany mineralization of chicken growth plate cartilage matrix vesicles. J. Biol. Chem. V. 277. P. 5126. https://doi.org/10.1074/jbc.m107899200
Wuthier R.E. 1975. Lipid composition of isolated epiphyseal cartilage cells, membranes and matrix vesicles. Biochim. Biophys. Acta. – Lipids Lipid Metab. V. 409. P. 128. https://doi.org/10.1016/0005-2760(75)90087-9
Wuthier R.E., Bisaz S., Russell R.G.G., Fleisch H. 1972. Relationship between pyrophosphate, amorphous calcium phosphate and other factors in the sequence of calcification in vivo. Calcified Tissue Res. V. 10. P. 198. https://doi.org/10.1007/bf02012549
Xu Y., Nudelman F., Eren E.D., Wirix M.J.M., Cantaert B., Nijhuis W.H., Hermida-Merino D., Portale G., Bomans P.H.H., Ottmann Ch., Friedrich H., Bras W., Akiva A., Orgel J.P.R.O., Meldrum F.C., Sommerdijk N. 2020. Intermolecular channels direct crystal orientation in mineralized collagen. Nature Commun. V. 11. P. 1. https://doi.org/10.1038/s41467-020-18846-2
Дополнительные материалы отсутствуют.


