Цитология, 2020, T. 62, № 7, стр. 487-492
Эпидермальный фактор роста в мезенхимных стромальных клетках эндометрия человека вызывает уменьшение количества CD146, не влияя на его интернализацию
Р. С. Каменцева 1, *, М. В. Истомина 2, М. В. Харченко 1, Е. С. Корнилова 1, 2, 3
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
3 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: rkamentseva@yandex.ru
Поступила в редакцию 09.04.2020
После доработки 15.04.2020
Принята к публикации 17.04.2020
Аннотация
Ранее методом проточной цитометрии нами было показано, что при длительном культивировании мезенхимных стромальных клеток эндометрия в присутствии эпидермального фактора роста (ЭФР) снижается количество CD146 на плазматической мембране. Одна из возможных причин – усиление неспецифической интернализации CD146 в таких условиях. В данном исследовании с помощью конфокальной микроскопии мы показали, что в контроле CD146 локализован не только на плазматической мембране, но и в везикулах, где он частично колокализуется с маркерами ранних и рециклирующих эндосом. Однако стимуляция эндоцитоза рецептора ЭФР не влияет на количество CD146+ везикул в течение 60 мин, хотя количество эндосом, содержащих рецептор ЭФР, значительно возрастает. Более того, при культивировании в присутствии ЭФР в течение 5 сут падает общая интенсивность флуоресценции клетки, ассоциированная как с CD146, так и с рецептором ЭФР. Таким образом, снижение количества CD146 при длительной инкубации в присутствии ЭФР не связано с усилением его эндоцитоза.
Поверхностный маркер CD146 (также известный как белок адгезии меланомы MCAM, Muc-18, S-endo 1, гицерин) часто используют для выделения и характеристики мезенхимных стромальных клеток (МСК) (Sorrentino et al., 2008). В различных исследованиях показано, что уровень CD146 может коррелировать со скоростью пролиферации и эффективностью дифференцировки (Ulrich et al., 2015; Paduano et al., 2016). Кроме того, мы обнаружили, что для МСК характерен высокий уровень экспрессии рецептора эпидермального фактора роста (ЭФР), сравнимый с таковым в клетках в линии HeLa. Методом проточной цитометрии мы показали, что доля CD146+ клеток в популяции эндометриальных мезенхимных стромальных клеток (энМСК) снижается при культивировании в течение 5 сут в среде, содержащей ЭФР, причем этот эффект лишь частично связан с увеличением плотности культуры (Каменцева и др., 2018).
Проточная цитометрия живых клеток, использованная нами ранее, позволяет оценить количество CD146 лишь на их поверхности. Полученные данные могут свидетельствовать об усилении интернализации этого белка под действием ЭФР. Действительно, для интернализации многих белков существенную роль играет ди-лейциновый мотив в цитоплазматическом домене (Wang et al., 2007), и подобный мотив обнаружен в структуре CD146 (Guezguez et al., 2006). Однако данные о внутриклеточной локализации и возможных путях эндоцитоза CD146 в МСК практически отсутствуют. Таким образом, целью данного исследования, было исследовать внутриклеточную локализацию CD146 в энМСК в контроле и под действием ЭФР.
МАТЕРИАЛ И МЕТОДИКА
Клетки. Мезенхимные стромальные клетки человека, полученные из десквамированного эндометрия (энМСК) и охарактеризованные в Институте цитологии РАН (Земелько и др., 2011), культивировали в полной культуральной среде (ПКС) на основе DMEM/F12 (Gibco, Великобритания), содержащей 10% фетальной бычьей сыворотки (Biowest, Франция), GlutaMAX (Gibco, Великобритания) и антибиотик/антимикотик (Capricorn, Германия) при 37°C в атмосфере 5% CO2.
Иммунофлуоресцентное мечение. Для иммунофлуоресцентного мечения энМСК сеяли на покровные стекла с плотностью 10 тыс. клеток/см2. На следующие сутки среду заменяли на ПКС, либо на ПКС, содержащую 10 нМ ЭФР (Molecular Probes, США). В этих средах клетки культивировали в течение указанного времени, после чего фиксировали формальдегидом в концентрации 3.6% (Sigma-Aldrich, США), приготовленным на PBS, в течение 15 мин. Далее все растворы готовили на основе PBS. После фиксации клетки промывали PBS и пермеабилизовали Brij56 в концентрации 0.05% (Sigma-Aldrich, США) 15 мин с последующими отмывками. Затем неспецифическое мечение блокировали с помощью 1%-ного бычьего сывороточного альбумина (БСА), в котором также разводили антитела: моноклональные антитела мыши против CD146 (клон P1H12, Cell Signaling (CS), Нидерланды, кат. № 13475) в разведении 1 : 50, поликлональные антитела кролика против рЭФР (CS, кат. № 4267), Rab5 (CS, кат. № 3547) или Rab11 (CS, кат. № 5589) в разведении 1 : 100. Клетки инкубировали с первичными антителами в течение ночи при 4°C. С вторичными антителами козы против антител мыши и кролика, конъюгированными с Alexa-488 и Alexa-568 соответственно (Molecular Probes, США), в разведении 1 : 200 и с добавлением Hoechst33342 в концентрации 1 мкг/мл (Molecular Probes, США) энМСК инкубировали 15 мин при 37°C. Затем клетки промывали PBS. Готовые препараты заключали в глицериновую среду, содержащую 1% DABCO (Sigma-Aldrich, США).
Конфокальная микроскопия. Микроскопические изображения получали с помощью конфокального микроскопа Olympus FLUOVIEW 3000 (Olympus, Япония) c объективом 40×/1.3 с масляной иммерсией. Для возбуждения флуоресценции использовали диодные источники света с длинами волн 405, 488 и 561 нм. Для регистрации флуоресценции в разных каналах использовали режим последовательного сканирования. Мощность лазеров и напряжение на детекторах оставались неизменными в течение эксперимента. “Стопки” изображений размером 1024 × × 1024 пикселей получали в режиме xyz с шагом в 500 нм по оси z.
Анализ изображений. Изображения анализировали в программе Fiji на базе ImageJ 1.52p (Schindelin et al., 2012). Для сегментации везикул использовали метод вычитания из исходного изображения картинки, полученной с помощью медианного фильтра с экспериментально подобранным радиусом 10 пикселей (Dunn et al., 2011). Такая манипуляция позволяет увеличить разницу интенсивности пикселей между краем везикулы и прилежащей областью, что способствует более точной сегментации. Полученные в результате сегментации на проекциях максимальной яркости контуры везикул переносили на исходное изображение для оценки интенсивности флуоресценции везикул. Для оценки интенсивности флуоресценции контуры клеток выделяли на проекциях максимальной яркости вручную. Для оценки колокализации везикул на оптическом срезе в базальной части клетки определяли долю частичного совпадения контуров везикул одного канала с масками везикул другого канала.
Анализ данных. Полученные данные анализировали в программе RStudio (RStudio, США). Все эксперименты были повторены как минимум 3 раза, на иллюстрациях представлен репрезентативный эксперимент. В каждом эксперименте анализировали не менее 10–15 клеток.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
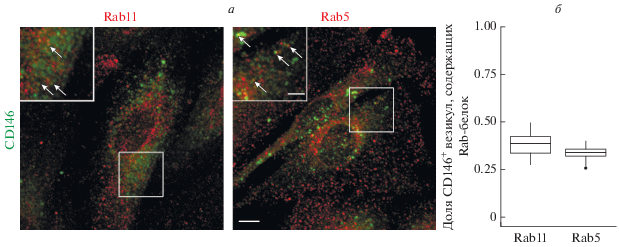
Мы обнаружили, что, в энМСК CD146 располагается не только на плазматической мембране, но и во внутриклеточных везикулах (рис. 1а, 2а). Подобная картина описана для других молекул клеточной адгезии иммуноглобулинового суперсемейства, например, для PECAM-1 (Mammadzada et al., 2016). В среднем 33.5 ± 1.2% этих везикул колокализуется с маркером ранних эндосом Rab5 и 38.4 ± 1.7% – с маркером околоядерного рециклирующего компартмента Rab11 (рис. 1б), но часть везикул не колокализуется с этими маркерами. Транспорт через Rab11+ компартмент описан для многих молекул клеточной адгезии и играет регуляторную роль в миграции, взаимодействии клетки с матриксом, эпителиально-мезенхимальном переходе и установлении клеточной полярности (Nishimura, Sasaki, 2008). Природа везикул, не содержащих исследованные Rab-белки, нам неизвестна.
Рис. 1.
Колокализация внутриклеточного CD146 с маркерами рециклирующих и ранних эндосом. а – энМСК, меченые антителами против CD146 (зеленый) и Rab11, либо Rab5 (красный), стрелками отмечены колокализующиеся везикулы. Масштабный отрезок на основных изображениях – 10 мкм, на врезках – 5 мкм. б – Результаты количественной оценки колокализации CD146 с Rab-белками представлены в виде графика типа “boxplot”, где отражены минимальное и максимальное значения, верхний и нижний квартили и медиана.
Под действием ЭФР происходит быстрая интернализация рЭФР в течение 15 мин с формированием в среднем 251 ± 44 везикул, но количество CD146+ везикул за то же время не увеличивается (рис. 2б). При этом около 25% рЭФР+ везикул колокализуется с CD146 (рис. 2в). Оценка скорости интернализации CD146 с помощью антител, конъюгированных с флуорохромом (Nollet et al., 2017), показала, что заметное количество CD146+ эндосом появляется лишь в течение 3 ч. Можно предположить, что интернализация CD146 и рЭФР происходит с помощью разных механизмов, хотя их колокализация может свидетельствовать как о неспецифичеком включении CD146 в рЭФР+ окаймленные ямки на мембране, так и о пересечении их путей в процессе слияний эндосом.
Рис. 2.
Внутриклеточная локализация CD146 в ходе эндоцитоза рЭФР. а – Эндоцитоз в энМСК был стимулирован добавлением ЭФР (10 нМ), затем клетки были зафиксированы в указанное время и помечены антителами против CD146 (зеленый) и рЭФР (красный), масштабный отрезок – 10 мкм; б – результаты оценки количества везикул, в – результаты количественной оценки колокализации CD146 с рЭФР. На графиках данные представлены в виде графика типа “boxplot”, где отражены минимальное и максимальное значения, верхний и нижний и медиана.

Полученные нами ранее данные указывали на снижение количества CD146 лишь на поверхности клеток в ходе длительного (5 сут) культивирования в среде, содержащей ЭФР. За это время клетки формируют плотный монослой. С помощью иммунофлуоресцентного анализа мы обнаружили, что снижается общее количество CD146 в клетке, в том числе и в везикулах, и это происходит во всей популяции энМСК (рис. 3). Кроме того, снижается и общая интенсивность флуоресценции рЭФР. Интересно, что на клетках эндотелия показано, что количество CD146 на поверхности клетки увеличивается при формировании монослоя (Bardin et al., 2001), тогда как в энМСК мы наблюдаем противоположный эффект. Вероятно, существуют тканеспецифические механизмы регуляции экспрессии CD146.
Рис. 3.
Интенсивность флуоресцентного мечения, ассоциированного с CD146 и рЭФР, снижается в течение 5 сут культивирования в среде, содержащей ЭФР. а – энМСК культивировали в течение 5 сут в ПКС или в ПКС, содержащей 10 нМ ЭФР (ПКС+ЭФР), затем клетки были зафиксированы, помечены антителами против CD146 (зеленый) и рЭФР (красный) и окрашены Hoechst33342 (синий), масштабный отрезок – 50 мкм; на графиках представлена плотность распределения клеток по средней интенсивности флуоресцентного мечения целой клетки (б) или CD146+ везикул (в).

Таким образом, снижение количества CD146 при культивировании в среде, содержащей ЭФР, не связано с усилением интернализации CD146. Мы предполагаем, что CD146 и рЭФР, хоть и медленно, но деградируют в лизосомах в ходе культивирования с ЭФР, при том, что синтез новых молекул может быть подавлен.
Список литературы
Земелько В.И., Гринчук Т.М., Домнина А.П., Арцыбашева И.В., Зенин В.В., Кирсанов А.А., Бичевая Н.К., Корсак В.С., Никольский Н.Н. 2011. Мультипотентные мезенхимные стволовые клетки десквамированного эндометрия. Выделение, характеристика и использование в качестве фидерного слоя для культивирования эмбриональных стволовых линий человека. Цитология. Т. 53. № 12. С. 919. (Zemelko V.I., Grinchuk T.M., Domnina A.P., Artzibasheva I.V., Zenin V.V., Kirsanov A.A., Bichevaia N.K., Korsak V.S., Nikolsky N.N. 2012. Multipotent mesenchymal stem cells of desquamated endometrium: Isolation, characterization, and application as a feeder layer for maintenance of human embryonic stem cells. Cell Tiss. Biol. V. 6. № 1. P. 1.)
Каменцева Р.С., Кошеверова В.В., Харченко М.В., Истомина М.В., Семенов О.М., Шатрова А.Н., Домнина А.П., Корнилова Е.С. 2018. Доля клеток CD146+ в популяции эндометриальных мезенхимных стромальных клеток снижается под действием ЭФР и TGF-α. Цитология. Т. 60. № 10. С. 801. (Kamentseva R.S., Kosheverova V.V., Kharchenko M.V., Istomina M.V., Semyonov O.M., Shatrova A.N., Domnina A.P., Kornilova E.S. 2018. CD146+ cells content in endometrial mesenchymal stromal cells (enMSC) population decreased after treating with EGF and TGF-a. Tsitologiya. V. 60. № 10. P. 801. )https://doi.org/10.7868/S0041377118100077
Bardin N., Anfosso F., Massé J.M., Cramer E., Sabatier F., Bivic A.L., Sampol J., Dignat-George F. 2001. Identification of CD146 as a component of the endothelial junction involved in the control of cell-cell cohesion. Blood. V.98. P. 3677. https://doi.org/10.1182/blood.V98.13.3677
Dunn K.W., Kamocka M.M., McDonald J.H. 2011. A practical guide to evaluating colocalization in biological microscopy. Am. J. Physiol. V. 300. P. C723. https://doi.org/10.1152/ajpcell.00462.2010
Guezguez B., Vigneron P., Alais S., Jaffredo T., Gavard J., Mè R-M., Dunon D. 2006. A dileucine motif targets MCAM-l cell adhesion molecule to the basolateral membrane in MDCK cells. FEBS Lett. V. 580. P. 3649. https://doi.org/10.1016/j.febslet.2006.05.048
Mammadzada P., Gudmundsson J., Kvanta A., André H. 2016. Differential hypoxic response of human choroidal and retinal endothelial cells proposes tissue heterogeneity of ocular angiogenesis. Acta Ophtalmol. V. 94. P. 805. https://doi.org/10.1111/aos.13119
Nishimura N., Sasaki T. 2008. Regulation of epithelial cell adhesion and repulsion: role of endocytic recycling. J. Med. Investig. V. 55. P. 9. https://doi.org/10.2152/jmi.55.9
Nollet M., Stalin J., Moyon A., Traboulsi W., Essaadi A., Robert S., Malissen N., Bachelier R., Daniel L., Foucault-Bertaud A., Gaudy-Marqueste C., Lacroix R., Leroyer A.S., Guillet B., Bardin N. et al. 2017. A novel anti-CD146 antibody specifically targets cancer cells by internalizing the molecule. Oncotarget. V. 8. P. 112283. https://doi.org/10.18632/oncotarget.22736
Paduano F., Marrelli M., Palmieri F., Tatullo M. 2016. CD146 expression influences periapical cyst mesenchymal stem cell properties. Stem Cell Rev. Rep. V. 12. P. 592. https://doi.org/10.1007/s12015-016-9674-4
Schindelin J., Arganda-Carreras I., Frise E., Kaynig V., Longair M., Pietzsch T., Preibisch S., Rueden C., Saalfeld S., Schmid B., Tinevez J.Y., White D.J., Hartenstein V., Eliceiri K., Tomancak P. et al. 2012. Fiji: An open-source platform for biological-image analysis. Nat. Methods. V. 9. P. 676. https://doi.org/10.1038/nmeth.2019
Sorrentino A., Ferracin M., Castelli G., Biffoni M., Tomaselli G., Baiocchi M., Fatica A., Negrini M., Peschle C., Valtieri M. 2008. Isolation and characterization of CD146+ multipotent mesenchymal stromal cells. Exp. Hematol. V. 36. P. 1035. https://doi.org/10.1016/j.exphem.2008.03.004
Ulrich C., Abruzzese T., Maerz J. K., Ruh M., Amend B., Benz K., Rolauffs B., Abele H., Hart M. L., Aicher W. K. 2015. Human placenta-derived CD146-positive mesenchymal stromal cells display a distinct osteogenic differentiation potential. Stem Cells Dev. V. 24. P. 1558. https://doi.org/10.1089/scd.2014.0465
Wang Q., Zhu F., Wang Z. 2007. Identification of EGF receptor C-terminal sequences 1005-1017 and di-leucine motif 1010LL1011 as essential in EGF receptor endocytosis. Exp. Cell. Res. V. 313. P. 3349. https://doi.org/10.1016/j.yexcr.2007.06.014
Дополнительные материалы отсутствуют.


