Журнал аналитической химии, 2020, T. 75, № 1, стр. 43-47
Определение минерального состава слюны человека при помощи микроплазменной атомно-эмиссионной спектроскопии
А. А. Жирков a, *, В. В. Ягов a, А. А. Антоненко b, А. С. Коротков a, Б. К. Зуев a, b
a Институт геохимии и аналитической химии им. В.И. Вернадского Российской академии наук
119991 Москва, ул. Косыгина, 19, Россия
b Государственный университет “Дубна”, факультет естественных и инженерных наук
141980 Дубна, ул. Университетская, 19, Россия
* E-mail: vdomah@gmail.com
Поступила в редакцию 25.06.2018
После доработки 19.11.2018
Принята к публикации 07.07.2019
Аннотация
Предложена методика определения макроэлементного состава слюны атомно-эмиссионным методом с капельно-искровым разрядом в качестве способа атомизации и возбуждения. Обсуждены перспективы использования подобного источника, а также прибора на его основе в клинической диагностике.
Определение минерального состава биологических жидкостей имеет важное клинико-диагностическое значение, особенно в отношении контроля регенеративных процессов [1]. В последние два десятилетия сложившаяся в медицинском сообществе практика использования для элементного анализа прямой потенциометрии и фактический отказ от использования атомно-эмиссионной спектроскопии привела к ситуации, когда рутинные диагностические задачи решаются эффективно, а более сложные затруднены из-за необходимости проводить определения в матрицах переменного состава [1–3]. В связи с этим актуальной задачей является создание анализатора, пригодного для внелабораторного анализа. Представляется, что такую роль мог бы играть беспламенный атомно-эмиссионный анализатор на базе капельно-искрового разряда. Такой прибор позволил бы сочетать присущие атомно-эмиссионным методам высокие воспроизводимость и правильность результатов анализа с возможностью работы непосредственно в медицинских учреждениях.
Среди беспламенных источников возбуждения и атомизации, используемых в современной атомно-эмиссионной спектроскопии, наиболее пригодным для создания портативного анализатора, на наш взгляд, является импульсный тлеющий разряд с электролитным катодом [4]. Несколько проигрывая стационарно горящему разряду в чувствительности [5], импульсный разряд намного превосходит его в удобстве работы – энергопотребление такого источника исчисляется единицами ватт, что существенно упрощает конструкцию всего прибора.
Слюна является одной из наиболее легкодоступных для сбора биологической жидкостью, что делает ее привлекательным объектом для экспресс-анализов. Ее минеральный состав содержит информацию о состоянии не только полости рта и слюнных желез, что используется в стоматологии [6, 7], но отчасти и о состоянии всего организма. Например, по содержанию в слюне тяжелых металлов можно диагностировать факт отравления и установить его природу и тяжесть [8, 9]. Вопрос о закономерности изменения минерального состава слюны при нарушениях обмена веществ и разработке метода клинической диагностики на этой основе является открытым [10, 11]. Например, весьма перспективной представляется задача выявления взаимосвязи нарушений в работе сосудов головного мозга с содержанием магния в секрете слюнных желез, а также корреляции этого содержания с появлением различных неврологических синдромов (в частности, дефицита внимания и гиперактивности у детей [12, 13]) и риском возникновения онкологических заболеваний гортани [11]. Тщательное изучение данных вопросов в значительной степени сдерживается недостаточным прогрессом в химико-аналитических методах, используемых в медицине [1, 3, 13].
Наибольший интерес представляет разработка экспрессной и простой методики определения минерального состава слюны (калия, кальция, натрия и магния), пригодной для использования во внелабораторных условиях с клинико-диагностическими целями.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Аппаратура. На рис. 1 приведена блок-схема разработанного прибора. Он состоит из источника атомизации и возбуждения с капельно-искровым разрядом собственной разработки, соединенного световодом (7) со спектроанализатором Maya 2000Pro (8) (Ocean Optics, США), синхронизируемого с компьютером по USB интерфейсу, компактного высоковольтного источника питания собственной разработки (10) (6 мкФ, 2.5 кВ, время заряда 15 с). Синхронизация процесса измерения осуществляется через плату АЦП (9), связанную с компьютером через интерфейс RS 232. Фоновый электролит – 0.4 М HCl – подается из резервуара (1). Пробу в виде капли (4) наносят микропипеткой (3) на катод прибора (5), выполненный в виде проволоки из нержавеющей стали с толстой фторопластовой оболочкой. Источником аналитического сигнала является электрический разряд, происходящий между нижним мениском жидкой линзы (каплей фонового электролита) (2), защищающей торец световода (7) и собирающей испущенное излучение, и верхним мениском капли пробы.
Рис. 1.
Блок-схема микроплазменного анализатора: 1 – резервуар фонового электролиа, 2 – капля “жидкая линза”, 3 – микропипетка, 4 – проба, 5 – катод, 6 – анод, 7 – световод, 8 – спектроанализатор, 9 – плата АЦП и управления, 10 – блок питания.
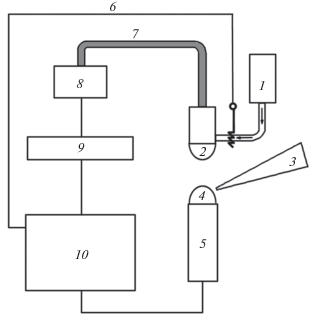
Аналитическим сигналом является интенсивность излучения, измеренная в первые 40 мс разряда на длине волны, соответствующей атомной линии металла (285.2 нм для Mg, 422.7 нм для Ca, 589.0 нм для Na, 766.5 нм для K), по сравнению с раствором контрольного опыта. Общее управление прибором и математическую обработку результатов выполняет разработанная авторами программа, работающая в среде Windows.
Растворители и реагенты. Использовали свежеприготовленную дистиллированную воду (установка очистки ДЭ-4, pH 5.8); натрий ГСО № 7775-2000, калий ГСО № 7771-2000, магний ГСО № 7767-2000, кальций ГСО № 7772-2000 (водные растворы 1 мг/мл, производства ЭАА “Экоаналитика”, Россия); соляную кислоту ос. ч. (ГОСТ 14261-77, ОАО “Химмед”, Россия).
Исследуемые растворы готовили непосредственно перед проведением измерений. Аликвотные части отбирали при помощи набора микропипеток серии “Thermo Fisher Scientific” (диапазоны объемов 5–50, 100–1000 и 1000–10 000 мкл, точность отбора аликвотной части ±1.5%). Содержание элементов определяли методом добавок, добиваясь сопоставимости величины сигналов пробы и пробы с добавкой.
Подготовка пробы к анализу. В пробирку из полиэтилентерефталата вносили 1.000 г исследуемой жидкости (слюны), добавляли 20 мкл HCl и разбавляли 9.00 мл разб. (0.4 М) HCl, интенсивно встряхивали в течение 30 с и оставляли отстаиваться не менее чем на 10 мин. Затем аликвотную часть отбирали микропипеткой и разбавляли 0.4 М HCl в два раза.
Методика определения. Резервуар для фонового электролита (1 на рис. 1) заполняли 0.4 М HCl, устанавливая скорость истечения 2 капли в мин. За время между разрядами с катода (5) удаляли микропипеткой жидкость, оставшуюся от предыдущего измерения, а затем наносили пробу объемом 25 мкл в виде капли (4).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Изучение аналитических возможностей капельно-искрового атомно-эмиссионного анализатора на модельной системе. В качестве модельной системы использовали растворы, содержащие одновременно 4 элемента (Na, K, Mg и Ca), приготовленные разбавлением ГСО в разб. (0.4 М) HCl. Полученные уравнения градуировочных зависимостей, нижняя и верхняя границы диапазона определяемых содержаний и предел обнаружения приведены в табл. 1. Предел обнаружения рассчитывали по 3σ-критерию согласно рекомендациям [14], а диапазон определяемых содержаний − как область, внутри которой относительное стандартное отклонение сходимости измерений составляет sr ≤ 0.33.
Таблица 1.
Некоторые метрологические характеристики использованного в работе атомно-эмиссионного анализатора на базе капельно-искрового разряда (n = 10, P = 0.95)
| Элемент | λ, нм | Уравнение градуировочной зависимости | Предел обнаружения нг/мл | Диапазон определяемых содержаний | |
|---|---|---|---|---|---|
| cн, мкг/мл | cв, мг/мл | ||||
| Na | 589.0 | I = (1870 ± 50)c | 8 | 0.02 | 0.02 |
| K | 766.5 | I = (790 ± 30)c | 12 | 0.05 | 0.1 |
| Mg | 285.2 | I = (144 ± 5)c | 350 | 1 | 0.3 |
| Ca | 422.7 | I = (95 ± 8)c | 500 | 1.5 | 1.0 |
Из представленных в табл. 1 данных следует, что диапазон линейности по всем элементам составляет 3 порядка величины содержания, причем его бóльшая часть находится в области содержаний ниже характерных для биологических жидкостей значений [2, 15, 16]. Это позволяет использовать предложенный анализатор в работе со слюной, но требует включить в методику стадию разбавления в десятки раз. За счет запаса чувствительности прибора сохраняется возможность значительного разбавления (до 2–3 порядков) образца при необходимости устранения матричного влияния, что может быть актуальным при анализе более сложных биологических коллоидов. Такой прием существенно упрощает пробоподготовку, исключая, как правило, необходимость сброса матрицы или концентрирования.
Определение минерального состава слюны. Основными компонентами минерального состава подавляющего большинства биологических жидкостей являются 4 элемента [15] – Na, K, Mg и Ca. Образцы слюны отбирали в день исследования утром натощак. Результаты приведены в табл. 2.
Таблица 2.
Макрокомпоненты минерального состава слюны, определенные с использованием микроплазменного атомно-эмиссионного анализатора (n = 5, P = 0.95)
| Элемент и линия | Введено, мкг/мл | Найдено, мкг/мл | Содержание, мкг/мл | Физиологическая норма [15], мкг/мл |
|---|---|---|---|---|
| Na 589.0 нм | 0 | 16.5 ± 0.3 | 330 ± 10 | 150–500 |
| 10.0 | 27.1 ± 0.5 | |||
| K 766.5 нм | 0 | 2.76 ± 0.06 | 55 ± 2 | 740–900 |
| 4.0 | 6.7 ± 0.1 | |||
| Mg 285.2 нм | 0 | 0.38 ± 0.01 | 7.6 ± 0.2 | 9–22 |
| 0.50 | 0.86 ± 0.03 | |||
| Ca 422.7 нм | 0 | 3.22 ± 0.09 | 64 ± 2 | 48–120 |
| 5.0 | 8.1 ± 0.2 |
Как видно из табл. 2, содержание натрия, магния и кальция находятся в пределах физиологической нормы. Пониженное содержание калия невозможно интерпретировать в рамках единичного измерения. С этой целью проведено определение минерального состава слюны в динамике, непосредственно после употребления жевательной резинки, а также спустя 20 и 60 мин. Результаты, полученные методом добавок и проверенные методом введено–найдено, приведены в табл. 3.
Таблица 3.
Динамика изменения содержания макрокомпонентов минерального состава слюны при употреблении жевательной резинки
| Элемент | Натощак, мкг/мл | После употребления жевательной резинки, мкг/мл | Физиологическая норма, мкг/мл [15] | ||
|---|---|---|---|---|---|
| сразу | через 20 мин | через 60 мин | |||
| Na | 330 ± 10 | 312 ± 10 | 185 ± 7 | 180 ± 8 | 150–500 |
| K | 55 ± 2 | 67 ± 2 | 14.2 ± 0.4 | 16.1 ± 0.4 | 740–900 |
| Mg | 7.6 ± 0.2 | 12.0 ± 0.4 | 25.5 ± 0.7 | 23.8 ± 0.8 | 9–22 |
| Ca | 64 ± 2 | 133 ± 5 | 92 ± 5 | 107 ± 5 | 48–120 |
| Общая соленость* | 19.6 ± 0.5 | 23.1 ± 0.6 | 15.1 ± 0.4 | 15.4 ± 0.4 | 28–53 |
Как видно из табл. 3, употребление жевательной резинки приводит к быстрому повышению общей минерализации слюны, сопровождающемуся резким ростом концентрации щелочноземельных металлов. Данный рост, вероятнее всего, вызван растворением зубного налета [2] и попаданием в слюну фосфатов кальция и магния. Повышенное содержание калия непосредственно после употребления жевательной резинки, вероятно, связано с усвоением пищевых продуктов растительного происхождения, содержащихся в ней. Также следует отметить, что двукратное повышение содержания кальция согласно [16] является индикатором насыщения слюны гидроксиапатитами. Подобное насыщение может быть вызвано реакцией эндокринной системы, направленной на снижение риска повреждения зубной эмали [17]. Интересно, что и через 20 и через 60 мин концентрация кальция остается заметно повышенной, что может свидетельствовать о продолжающейся стимуляции эндокринной системы.
Употребление жевательной резинки натощак, вероятно, привело также к нарушению секреторной функции поджелудочной железы, стимуляции выработки желудочного сока в отсутствие пищи и нарушению электролитного баланса в желудке. Это вызвало значительное понижение общей солености через 20 и 60 мин вследствие гиперсаливации (повышенного слюноотделения) (табл. 3), приводящей к разбавлению секрета слюнных желез. Гиперсаливацией объясняется также резкое снижение содержания калия в этом временном промежутке [16].
Из табл. 2 и 3 видно, что полученные результаты отличаются сравнительно узкими доверительными интервалами, а проверка правильности по методу введено−найдено во всех образцах демонстрирует хорошие результаты. Достигнутые метрологические характеристики комплекса прибор–методика: экспрессность (время единичного измерения составляет 30 с, полного цикла – не более 15 мин), воспроизводимость (относительное стандартное отклонение сходимости не превышает 0.03–0.05) и чувствительность определения (табл. 1) в сочетании с несложной пробоподготовкой, на наш взгляд, делают его пригодным для использования в клиническо-диагностической практике.
Следует учитывать, что метод атомно-эмиссионной спектрометрии значительно превосходит распространенную в клинической практике прямую потенциометрию с ионселективными электродами не только по чувствительности, но главным образом по воспроизводимости и правильности определения, особенно в сложных матрицах. Слюна представляет собой органоминеральную коллоидную систему и является неоптимальной средой для проведения ионометрических измерений, поскольку требует сложной подготовки пробы к анализу [18]. По сравнению с традиционными вариантами атомно-эмиссионной спектроскопии, предложенный в настоящей работе способ помимо очевидного преимущества отсутствия пламени (что означает отсутствие газовых коммуникаций, мощных вытяжек и т.п.) дает возможность работать с пробами сложного фазового состава, позволяя обойтись без капиллярного распылителя. Дополнительным преимуществом созданного анализатора является использование простых и доступных реагентов, а также возможность работы в полевых условиях в силу малых габаритов и массы (менее 2 кг), а также незначительного энергопотребления.
Список литературы
Методы клинических лабораторных исследований / Под ред. Камышникова В.С. М.: Медпресс-информ, 2016. 784 с.
Кишкун А.А. Клиническая лабораторная диагностика. Учебное пособие для медицинских сестер. М.: ГЭОТАР-Медиа, 2015. 720 с.
Клиническая лабораторная диагностика. Национальное руководство. Т. 2 / Под ред. Долгова В.В., Меньшикова В.В. М.: ГЭОТАР-Медиа, 2013. 814 с.
Ягов В.В., Зуев Б.К., Коротков А.С. Электрический разряд в межэлектролитном промежутке: перспективы создания атомно-эмиссионного сенсора // Доклады РАН. 1998. Т. 359. № 2. С. 208
Pohl P., Jamroz P., Swiderski K., Dzimitrowicz A., Lesniewicz A. Critical evaluation of recent achievements in low power glow discharge generated at atmospheric pressure between a flowing liquid cathode and a metallic anode for element analysis by optical emission spectrometry // Trends Anal. Chem. 2017. V. 88. P. 119.
Gow B.S. Analysis of metals in saliva by atomic absorption spectroscopy I. Calcium // J. Dental Res. 1965. V. 9–10. P. 885.
Rajesh K.S., Hegde Sh., Kumar M.S.A. Assessment of salivary calcium, phosphate, magnesium, pH and flow rate in healthy subjects, periodontitis, and dental caries // Contemporary Clinical Dentistry. 2015. V. 6. № 4. P. 461.
Gil F., Hernandez A., Marquez C., Femia P., Olmedo P., Lopez-Guarnido O., Pla A. Biomonitorization of cadmium, chromium, manganese, nickel and lead in whole blood, urine, axillary hair and saliva in an occupationally exposed population // Sci. Total Environ. 2011. V. 409. № 6. P. 1172.
Wang D., Du X., Zheng W. Alteration of saliva and serum concentration of manganese, copper, zinc, cadmium and lead among career welders // Toxicol. Lett. 2008. V. 176. № 1. P. 40.
Lear R.D., Gron P. Magnesium in human saliva // Arch. Oral Biol. 1968. V. 13. № 11. P. 1311.
Bagulkar B.B., Chaudhary M., Gawande M., Patil S., Gadbail A., Bagulkar S. Colorimetric determination of magnesium in blood and saliva in oral squamous cell carcinoma and potentially malignant disorders by titan yellow method // J. Orofacial Res. 2013. V. 3. № 4. P. 240.
Starobat-Hermelin B., Kozielec T. The effect of magnesium physiological supplementation on hyperactivity in children with attention deficit hyperactivity disorder. Positive response to magnesium oral loading test // Magnesium Res. 1997. V. 10. № 2. P. 149.
El Baza F., Al-Shahawi H.A., Zahra S., AbdelHakim R.A. Magnesium supplementation in children with attention deficit hyperactivity disorder // Egyptian J. Med. Human Genetics. 2016. V. 17. № 1. P. 63.
Inczedy J., Lengyel T., Ure A.M. IUPAC Compendium of Analytical Nomenclature. Definitive rules. 3rd Ed. Oxford: Blackwell Sc., 1998.
Семенов Н.В. Биохимические компоненты и константы жидких сред и тканей человека. М.: Медицина, 1971. 206 с.
Теппермен Дж., Теппермен Х. Физиология обмена веществ и эндокринной системы. Вводный курс. М.: Мир, 1989. 637 с.
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: Медицина, 1998. 704 с.
Carey C.M., Vogel G.L. Measurement of calcium activity in oral fluids by ion selective electrode: method evaluation and simplified calculation of ion activity products // J. Res. National Institute Stand. Technol. 2000. V. 105. P. 267.
Дополнительные материалы отсутствуют.
Инструменты
Журнал аналитической химии


