Агрохимия, 2023, № 4, стр. 51-61
Влияние предпосевной обработки семян яровой пшеницы (Triticum aestivum L.) органическими кислотами природного происхождения в разреженной среде на рост и развитие растений
Н. В. Верховцева 1, *, Е. Н. Кубарев 2, Г. Р. Балашов 1, А. Э. Роберт 1
1 Московский государственный университет им. М.В. Ломоносова, факультет почвоведения
119991 Москва, Ленинские горы, 1, стр. 12, Россия
2 Учебно-опытный почвенно-экологический центр Московского государственного университета им. М.В. Ломоносова
141592 Московская обл., Солнечногорский р-н, д. Чашниково, Россия
* E-mail: verh48@list.ru
Поступила в редакцию 15.12.2022
После доработки 27.12.2022
Принята к публикации 25.01.2023
- EDN: DJOINX
- DOI: 10.31857/S0002188123040142
Аннотация
Изучено влияние предпосевной обработки семян яровой пшеницы (Triticum aestivum L.) янтарной и салициловой кислотами в концентрации 10–5 М и 10–3 М с использованием и без использования вакуумного инфильтратора. Полученные результаты показали положительное влияние обработки семян в условиях разреженного давления (0.9 атм, 15 мин) на развитие колеоптиля и корня проростка на 7-е сут проращивания. На 3-и сут (при определении энергии прорастания) воздействие разреженной среды не выявило значимого влияния. В стрессовых условиях развития растений при гипертермии установлено, что обработка семян салициловой кислотой в концентрации 10–3 М в условиях разреженной среды обеспечивала наилучший результат по снижению стрессовой нагрузки за счет подавления каталазной активности. Янтарная кислота в концентрации 10–5 М показала себя как наилучший вариант в качестве усилителя роста. Совместно с использованием разреженной среды такая обработка наиболее значимо ускоряла развитие колеоптиля и корня проростка на 7-е сутк проращивания.
ВВЕДЕНИЕ
Урожайность зерновых культур во многом зависит от качества посевного материала, поэтому оптимизируя регуляторами роста стартовые условия путем предпосевной обработки семян зерновых культур, можно достичь улучшения посевных качеств и урожайности. Важно развивать такие направления в поиске новых технологий предпосевной обработки семян, как выявление наиболее эффективных и экологически безопасных веществ-регуляторов, способов и условий обработки. Изучение данного направления также является актуальным для управления продуктивностью и устойчивостью растений, обоснования энергосберегающих технологий без применения дорогостоящих химикатов. Применение разреженной среды в сочетании с органическими кислотами природного происхождения (образующиеся в растениях в результате естественных физиологических процессов) является одним из малоизученных и перспективных направлений предпосевной обработки семян зерновых культур.
В научных исследованиях изучены биостимулирующая и адаптогенная функции предпосевной обработки семян янтарной и салициловой кислотами. Янтарная кислота активирует дыхание прорастающих зерновок, гидролиз запасных веществ, что может приводить к увеличению активности гидролитических ферментов. Также янтарная кислота может влиять на процесс фотосинтеза. Ее активная форма – сукцинил-S-KoA и гликокол являются непосредственными предшественниками хлорофилла а (протопорфирина). Соответственно, экзогенное поступление янтарной кислоты способствуют биосинтезу хлорофилла и цитохромов. Салициловая кислота в ряде исследований рассматривается как эндогенный многофункциональный биорегулятор, который принимает участие в “клеточном сигналинге”, ростовых процессах, формировании адаптивных реакций растений [2–20].
Однако противоречивые результаты исследований привели к спорам о влиянии обработки семян этими кислотами природного происхождения на рост и развитие растений. Неправильное применение, пренебрежение физиологическими особенностями растений, передозировка кислотами могут не только не дать положительного эффекта, но и вызвать прямо противоположные, отрицательные изменения в организме [3].
Цель работы – исследование влияния и возможности применения в предпосевной обработке семян органических кислот природного происхождения на примере янтарной и салициловой кислот в различных концентрациях на первых этапах роста и развития яровой пшеницы, в том числе в условиях разреженной среды.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследования были начаты в Учебно-опытном почвенно-экологическом центре МГУ им. М.В. Ломоносова “Чашниково” и продолжены на базе кафедры агрохимии и биохимии растений факультета почвоведения МГУ.
Объектом исследования стали семена яровой пшеницы (Triticum aestivum L.) сорта Радмира. Для предпосевной обработки применяли растворы янтарной (ЯК) и салициловой кислот (СК) в качестве регуляторов роста в концентрациях 10–3 и 10–5 М, а также дистиллированную воду (контроль). Опыты проводили без применения и с применением вакуумного инфильтратора (на основе вакуумного насоса DVPLC.4, производства Vacuum Technology Srl, Италия) (рис. 1) с разрежением ~0.9 атм, выбранным как оптимальное, исходя из анализа изученной научной литературы и патентов [11, 12, 14]. Время экспозиции составило 15 мин. Таким образом, получили 10 вариантов лабораторного опыта (табл. 1).
Рис. 1.
Схематическое изображение вакуумного инфильтратора: 1 – кран, 2 – эксикатор (внутри расположены мерные стаканчики с раствором), 3 – крышка эксикатора, 4 – вакуумметр, 5 – вакуумный насос.

Таблица 1.
Варианты лабораторного опыта
| Вариант | Концентрация, М | Применение вакуумного инфильтратора | Условное обозначенение |
|---|---|---|---|
| 1. Контроль (Н2О) | – | Без применения | Контроль без вакуума (б/в) |
| 2. СК | 10–3 | СК 10–3 (б/в) | |
| 3. СК | 10–5 | СК 10–5 (б/в) | |
| 4. ЯК | 10–3 | ЯК 10–3 (б/в) | |
| 5. ЯК | 10–5 | ЯК 10–5 (б/в) | |
| 6. Контроль (Н2О) | – | С применением | Контроль с вакуумом (с/в) |
| 7. СК | 10–3 | СК 10–3 (с/в) | |
| 8. СК | 10–5 | СК 10–5 (с/в) | |
| 9. ЯК | 10–3 | ЯК 10–3 (с/в) | |
| 10. ЯК | 10–5 | ЯК 10–5 (с/в) |
В ходе лабораторных опытов использован ГОСТ 12038-84 [17] для определения прорастания семян на 3-и сут проращивания (энергии прорастания), на 7-е сут (всхожести) и морфометричекий метод (для определения ростовых характеристик проростка и длины главного корня).
Кроме лабораторных были проведены вегетационные опыты, в которых семена пшеницы, подверженные обработкам по представленной схеме, высевали в сосуды по 15 шт. Вегетационные сосуды (объемом 1 л) заполняли дерново-подзолистой почвой, доведенной до оптимальной влажности (0.6–0.7 ПВ). Выращивание растений осуществляли в течение 16 сут. Далее биомассу растений в вариантах опыта взвешивали и затем использовали для биохимических анализов определения активности каталазы перманганатометрическим методом Баха [1] и определения устойчивости растений к гипертермии методом Мацкова [11].
Полученные массивы данных были обработаны с помощью методов математической статистики в программе STATISTICA 10.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для определения энергии прорастания семян и всхожести было в целом проанализировано 4000 семян пшеницы (4 повторности по 100 семян в повторности и 10 вариантов опыта). Морфометрические показатели проростков семян пшеницы позволили оценить влияние предпосевной обработки семян на ростовые характеристики проростков и длину главного корня в различных условиях опыта (табл. 2).
Таблица 2.
Ростовые показатели проростков пшеницы в процессе проращивания семян при обработке органическими кислотами и использовании вакуумной инфильтрации (средние и доверительный интервал)
| Вариант | Доверительный интервал | Среднее | Доверительный интервал | Среднее | Доверительный интервал | Среднее |
|---|---|---|---|---|---|---|
| мм | ||||||
| Колеоптиль, 3-и сут | Колеоптиль, 7-е сут | Корень, 7-е сут | ||||
| 1. Контроль без вакуума (б/в) | 12.3–14.3 | 13.3 | 24.6–36.3 | 30.47 | 19.7–27.1 | 23.4 |
| 2. СК 10–3 (б/в) | 9.1–11.0 | 10.1 | 16.2–36.8 | 26.54 | 15.2–22.4 | 18.8 |
| 3. СК 10–5 (б/в) | 13.2–14.4 | 13.8 | 28.7–34.6 | 31.67 | 24.7–27.1 | 25.9 |
| 4. ЯК 10–3 (б/в) | 5.0–5.6 | 5.3 | 10.5–15.8 | 13.11 | 8.7–11.9 | 10.3 |
| 5. ЯК 10–5 (б/в) | 14.1–16.5 | 15.3 | 30.9–39.0 | 34.91 | 25.4–30.3 | 27.8 |
| 6. Контроль с вакуумом (с/в) | 4.5–5.2 | 4.9 | 17.0–43.5 | 30.27 | 11.9–39.2 | 25.6 |
| 7. СК 10–3 (с/в) | 0.1–0.1 | 0.1 | 1.5–7.0 | 4.24 | 1.9–5.4 | 3.7 |
| 8. СК 10–5 (с/в) | 5.7–6.3 | 6.0 | 22.9–45.8 | 34.37 | 21.7–42.1 | 31.9 |
| 9. ЯК 10–3 (с/в) | 4.6–5.8 | 5.2 | 14.8–48.6 | 31.66 | 18.6–41.8 | 30.2 |
| 10. ЯК 10–5 (с/в) | 6.0–7.1 | 6.6 | 30.0–62.7 | 46.30 | 42.1–67.4 | 54.7 |
Анализ результатов длины колеоптиля на 3-и сутки проращивания семян пшеницы показал, что фактор предварительного выдерживания семян в разреженной среде (РС) оказал подавляющее влияние на этот процесс при сравнении контрольных вариантов по предварительной обработке семян с применением разрежения в среде и без такого воздействия. Использование для обработки семян органических кислот как СК, так и ЯК в концентрациях 10–5 M улучшало ситуацию по угнетающему действию разрежения. Лучшие показатели отмечены для янтарной кислоты как при предварительном выдерживании в РС, так и без такой обработки – относительно контроля произошло увеличение длины колеоптиля на 35 и 15% соответственно.
На 7-е сутки наблюдений за развитием растений (определение всхожести) ситуация изменилась (табл. 2). Сравнение ростовых показателей контрольных семян, выдержанных в разреженной среде и не подвергнутых такой обработке, не отличались (определяющий фактор регулирования роста – наличие или отсутствие РС).
Влияние органических кислот сохранило ту же тенденцию, что и для 3-суточных проростков – положительный эффект, который для концентрации 10–5 М составил 15 и 53% соответственно для СК и ЯК после воздействия РС. Без обработки разрежением эффект от органических кислот был значительно меньше – 4 и 15% соответственно для СК и ЯК.
Такая же тенденция была показана при обработке данных длины корня на 7-е сутки проращивания. И в этом случае наибольший эффект был получен для ЯК в концентрации 10–5 М в разреженной среде – увеличение длины корня на 113% (табл. 2).
Для определения статистической значимости факторов обработки семян кислотами в разных концентрациях с применением и без применения фактора разрежения среды был использован дисперсионный анализ средних величин в повторностях. Данные были предварительно преобразованы в натуральные логарифмы. Анализировали фактор влияния обработки разными веществами, фактор применения вакуумной установки и совместное влияние 2-х факторов (рис. 3, 4).
Рис. 2.
Диаграмма размаха показателя длины колеоптиля на 3-и (а) и 7-е (б) сут проращивания (сравнение по фактору 1 – наличие разреженной среды).

Рис. 3.
Диаграмма размаха показателя длины колеоптиля на 7-е сут проращивания (сравнение по фактору 2 – регуляторы роста, органические кислоты).

Рис. 4.
Диаграмма размаха показателя длины корня на 7-е сут проращивания: (а) – сравнение по фактору 1 (наличие разреженной среды), (б) – сравнение по фактору 2 (регуляторы роста, органические кислоты).

Предварительно проводили проверку соответствия средних величин по градациям факторов нормальному распределению (α = 0.05) с применением теста Колмогорова–Смирнова в модификации Лиллиефорса. Было показано, что во всех вариантах опыта, кроме анализа влияния регуляторов роста на 3-и сут, было соответствие распределения нормальному с заданным уровнем значимости. Также с помощью критериев Кохрана, Бартлетта и Хартли было подтверждено условие равенства дисперсий в генеральных совокупностях.
Так как показатели ростовых характеристик семян, полученных на 3-и сут проращивания по градациям фактора “регуляторы роста”, не принадлежали нормальному распределению, был проведен однофакторный дисперсионный анализ только для фактора 1 – разреженная среда (табл. 3). По его результатам можно достоверно говорить о влиянии фактора 1 – наличие или отсутствие влияния разрежения среды.
Таблица 3.
Первичная таблица результатов дисперсионного анализа (3-и сут проращивания)
| Эффект | Степени свободы df | Сумма квадратов SS | Средний квадрат MS | Критерий Фишера F | Величина p-value |
|---|---|---|---|---|---|
| Взаимодействие | 1 | 14.2 | 14.2 | 502.86 | 0.00 |
| Фактор 1 (разреженная среда) | 1 | 1.05 | 1.05 | 37.15 | 0.00 |
| Ошибка | 38 | 1.07 | 0.02 | ||
| Общее | 39 | 2.12 | |||
Результаты измерения длины колеоптиля на 3-и сут проращивания представлены на графике типа boxplot (диаграмма размаха) (рис. 2а). Результаты свидетельствовали о том, что влияние фактора разреженная среда было значимо для длины колеоптиля.
Результаты измерений длины колеоптиля и корня на 7-е сут проращивания резко отличались по своему характеру от результатов, полученных на 3-и сутки проращивания, а именно: варианты опыта с обработкой семян в установке для создания разрежения показали существенное увеличение длины колеоптиля, что подтверждено уровнем значимости, который был получен при дисперсионном анализе (табл. 4, рис. 2б).
Таблица 4.
Таблица результатов 2-факторного дисперсионного анализа (длина колеоптиля и корня, 7-е сут)
| Эффект | Степени свободы df | Сумма квадратов SS | Средний квадрат MS | Критерий Фишера F | Величина p-value |
|---|---|---|---|---|---|
| Длина колеоптиля | |||||
| Взаимодействие | 1 | 63.7 | 63.7 | 5889.53 | 0.00 |
| Фактор 1 (разреженная среда) | 1 | 0.18 | 0.18 | 16.90 | 0.00 |
| Фактор 2 (обработка регулятором роста) | 4 | 4.21 | 1.05 | 97.43 | 0.00 |
| Фактор 1 × Фактор 2 | 4 | 1.14 | 0.28 | 26.45 | 0.00 |
| Ошибка | 30 | 0.32 | 0.01 | ||
| Общее | 39 | 5.86 | |||
| Длина корня | |||||
| Взаимодействие | 1 | 27.6 | 27.6 | 2552.74 | 0.00 |
| Фактор 1 (разреженная среда) | 1 | 0.00 | 0.00 | 0.41 | 0.52 |
| Фактор 2 (обработка регулятором роста) | 4 | 0.7 | 0.18 | 17.00 | 0.00 |
| Фактор 1 × Фактор 2 | 4 | 0.05 | 0.01 | 1.37 | 0.26 |
| Ошибка | 30 | 0.32 | 0.01 | ||
| Общее | 39 | 1.13 | |||
Низкие показатели роста при обработке семян СК в большой концентрации можно объяснить накоплением большого количества активных форм кислорода в результате ингибирования каталазы, способной к разложению пероксида водорода и нейтрализации таких реакционных состояний кислорода. Это согласуется с данными работ [4, 18], в которых показано ингибирование действия каталазы при высоких концентрациях экзогенной СК.
Неоднозначные результаты применения разрежения среды, связанные с негативным влиянием на энергию прорастания и существенным возрастанием показателя роста колеоптиля с 3-х по 7-е сут возможно было связано с состоянием “ростового покоя”, который следовал за первичным стрессом от разрежения среды. Показанное резкое увеличение роста свидетельствовало о положительном влиянии разреженной среды, ее синергизме с обработкой семян кислотами, что было выражено в достоверном совместном влиянии 2-х факторов на увеличение длины колеоптиля (табл. 4, рис. 3).
Есть вероятность, что замедление роста колеоптиля в начальный период онтогенеза зависит от уровня разрежения среды и длительности вакуумной обработки, поэтому для уточнения эффекта обработки семян с применением разрежения необходимы дополнительные опыты с другими величинами разрежения и временем экспозиции в разреженной среде.
С целью лучшего понимания эффективности совместного воздействия усилителей роста с применением установки для разрежения среды, были проанализированы однородные группы данных для длины колеоптиля на 7-е сут проращивания, полученные с помощью апостериорного критерия – наименьшей существенной разницы (НСР) Фишера (табл. 5).
Таблица 5.
Критерий НСР Фишера, однородные группы (длина колеоптиля, 7-е сут проращивания)
| Ошибка = 0.011, df = 30 | Однородные группы | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Вариант | Фактор 1 (разреженная среда) | Фактор 2 (обработка регулятором роста) | Среднее | 1 | 2 | 3 | 4 | 5 | 6 |
| 6 | 2 | 1 | 0.58 | * | |||||
| 1 | 1 | 1 | 0.93 | * | |||||
| 3 | 1 | 3 | 1.13 | * | |||||
| 2 | 1 | 2 | 1.14 | * | |||||
| 8 | 2 | 3 | 1.20 | * | |||||
| 7 | 2 | 2 | 1.20 | * | |||||
| 5 | 1 | 5 | 1.36 | * | |||||
| 4 | 1 | 4 | 1.40 | * | |||||
| 9 | 2 | 4 | 1.58 | * | |||||
| 10 | 2 | 5 | 2.06 | * | |||||
Как можно видеть из результатов анализа, разрежение воздушной среды усиливало воздействие ЯК в двух концентрациях и СК в большей концентрации, в то время как в контроле и в варианте воздействия СК в концентрации 10–5 М с использованием и без использования разрежения полученные данные были почти одинаковыми.
СК в растениях часто рассматривается в качестве стрессового фитогормона. Согласно научным источникам [7, 18], увеличение содержания СК в тканях растения ведет к окислительному стрессу за счет ингибирования фермента каталазы, которая выполняет функцию разложения пероксида водорода на воду и кислород. Такое воздействие вызывает смещение баланса прооксидантов и антиоксидантов в сторону активизации стресс-протекторной системы растений: происходит увеличение активности ферментов, таких как аскорбатпероксидаза и глутатионредуктаза, усиление экспрессии их генов [6]. Также существуют сведения что повышение содержания пероксида водорода в клетках растений индуцирует экспрессию генов, отвечающих за синтез непосредственно защитных белков [16]. Однако конкретные механизмы стресс-протекторных функций могут отличаться в растениях разных видов и в различных условиях [8].
Исходя из этого, в изученных проростках пшеницы было проведено определение активности каталазы перманганатметрическим методом Баха (рис. 5). По полученным результатам можно судить о наиболее сильном ингибировании фермента при обработке салициловой кислотой в концентрации 10–3 М как для семян, которые выдерживали в вакуумном инфильтаторе (на 40%), так и для не подвергнутых такой обработке (отмечено снижение каталазой активности в листьях растений примерно в 2 раза).
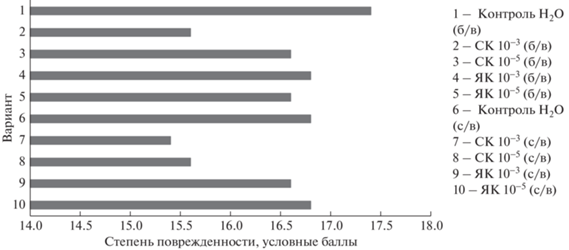
Для анализа связи окислительного стресса, вызванного пероксид-радикалами и резистентности тканей растений к экзогенным стрессорам, было выполнено определение устойчивости побегов яровой пшеницы, семена которой были обработаны аналогично предыдущим опытам, к гипертермии, проведенное по методу Мацкова. В ходе исследования побеги подвергали воздействию температур от 40 до 80°С на водяной бане. Каждый вариант включал по 10 образцов, причем изначальная температура 40°С была выдержана на протяжении 30 мин. Далее при каждом поднятии температуры на 10°С из растений, находящихся в условиях термического стресса, удаляли по 2 образца в каждом варианте, а остальные подвергали воздействию новой температуры в течение 10 мин до следующей итерации. Образцы, изъятые при одной температуре, помещали на пластиковый планшет и обрабатывали 0.2 н. HCl. Затем фиксировали уровень побурения растений во всех вариантах при каждой температуре и, исходя из этого, рассчитывали общий условный балл повреждения в соответствующем варианте (рис. 6).
Согласно полученным результатам, обработка семян СК в концентрации 10–3 М в условиях предварительного воздействия разреженной среды в вакуумном инфильтраторе показала самую низкую поврежденность листьев растений после их тепловой обработки, что может быть объяснимо подавляющим влиянием СК на каталазную активность и повышением защитных функций кислоты.
ЗАКЛЮЧЕНИЕ
Обработка семян пшеницы (Triticum aestivum l.) в вакуумном инфильтраторе с разрежением ~0.9 атм, в течение 15 мин вызывала уменьшение энергии прорастания, т.е. было отмечено состояние “ростового покоя”, вызванного разрежением среды (РС). Использование для обработки семян органических кислот как салициловая (СК), так и янтарная кислота (ЯК) в концентрациях 10–5 M улучшало ситуацию при угнетающем воздействии РС. Лучшие показатели отмечены для ЯК как при предварительном выдерживании в разреженной среде, так и без такой обработки (относительно контроля произошло увеличение длины колеоптиля на 35 и 15% соответственно).
На всхожесть семян (7-е сутки прорастания) оказала существенное влияние обработка органическими кислотами. Наилучшие показатели имели варианты, обработанные СК и ЯК в концентрации 10–5 М без применения разреженной среды. Положительный эффект от обработки ЯК при концентрации 10–5 М в условиях РС составил 53 и 15% только с обработкой кислотой, т.е. фактор РС не имел существенного влияния по сравнению с воздействием самой ЯК.
Обработка семян СК в концентрации 10–3 М в условиях РС дала наилучший результат в условиях гипертермии – снижение повреждения листьев растений после теплового воздействия было на 40% без предварительного использования РС и на 50% при совместном действии РС и СК. Это подтверждено данными по определению активности каталазы, когда обработка СК в концентрации 10–3 М приводила к наиболее существенному ингибированию фермента, что повышало устойчивость проростков к стрессу.
Список литературы
Величко А.К., Соловьев В.Б., Генгин М.Т. Методы лабораторного определения общей перекись-разрушающей активности ферментов растений // Изв. ПГПУ им. В.Г. Белинского. Естеств. науки. Биохимия. 2009. № 14 (18). С. 44–48.
Верещагин А.Л., Еремина В.В., Захарьева Ю.И., Хмелева А.Н., Кунец Л.Л. Биологическая активность сверхмалых концентраций ряда природных органических кислот – интермедиатов цикла Кребса // Изв. вузов. Прикл. химия и биотехнол. 2012. № 2 (3). С. 72–75.
Грабовская Н.И., Бабенко О.Н., Сафронова Н.М., Хусаинова Р.К. Особенности применения янтарной кислоты в качестве биостимулятора и адаптогена растений // Современная наука: актуальные проблемы теории и практики. Сер. Естеств. и техн. науки. 2020. № 1. С. 28–32.
Дмитриева С.А., Пономарева А.А., Минибаева Ф.В., Гордон Л.Х. АФК и протон-опосредованное действие салициловой кислоты на рост и ультраструктуру клеток корней пшеницы // Уч. запис. Казан. гос. ун-та. 2008. Т. 150. Кн. 3. Естеств. науки. С. 123–135.
Колупаев Ю.Е., Карпец Ю.В. Салициловая кислота и устойчивость растений к абиотическим стрессорам // Вестн. Харьков. нац. аграрн. ун-та. Сер. биол. 2009. Вып. 2 (17). С. 19–39.
Колупаев Ю.Е., Карпец Ю.В., Кабашникова Л.Ф. Антиоксидантная система растений: клеточная компартментация, защитные и сигнальные функции, механизмы регуляции (обзор) // Прикл. биохим. и микробиол. 2019. Т. 55. № 5. С. 419–440.
Колупаев Ю.Е., Карпец Ю.В., Ястреб Т.О., Мусатенко Л.И. Участие пероксидазы и супероксиддисмутазы в усилении генерации активных форм кислорода колеоптилями пшеницы при действии салициловой кислоты // Физиол. и биохим. культ. раст. Биология. 2010. Т. 42. № 3. С. 210–217.
Коц Г.П., Ястреб Т.О., Швиденко Н.В., Батова Е.Н., Мирошниченко Н.Н., Туренко В.П., Колупаев Ю.Е. Влияние экзогенных салициловой и янтарной кислот на устойчивость растений проса к абиотическим и биотическим стрессорам // Вестн. Харьков. нац. аграрн. ун-та им. В.В. Докучаева. Сер. биол. 2012. Вып. 1 (25). С. 32–38.
Колупаев Ю.Е., Ястреб Т.О. Стресс-протекторные эффекты салициловой кислоты и ее структурных аналогов // Физиол. и биохим. культур. раст. 2013. Т. 45. № 2. С. 113–126.
Мацков Ф.Ф. Распознавание живых, мертвых и поврежденных хлорофиллоносных тканей растений по реакции образования феофитина при оценке устойчивости к экстремальным воздействиям // Методы оценки устойчивости растений к неблагоприятным условиям среды. Л.: Колос, 1976. С. 54–60.
Мирошников С.А., Лебедев С.В., Сизова Е.А., Яушева Е.В., Докина Н.Н., Рогачев Б.Г., Сандакова Г.Н., Фролов Д.В., Кизаев М.А., Гавриш И.А. Способ предпосевной обработки семян яровой сильной пшеницы. 2019. RU 2700616 C1.
Мирошников С.А., Малышева А.В., Дерябина Т.Д., Фролов Д.В., Павлов Л.Н., Рогачев Б.Г. Эффективный способ предпосевной обработки семян нута // Вестн. мясн. скотоводства. 2011. Т. 4. № 64. С. 104–110.
Молодченкова О.О. Влияние салициловой кислоты на ответные реакции проростков кукурузы при абиотических стрессах // Вестн. Харьков. нац. аграр. ун-та им. В.В. Докучаева. Сер. биол. 2012. Вып. 3 (15). С. 24–32.
Мушинский А.А., Сизова Е.А., Аминова Е.В., Рогачев Б.Г., Пашинина Т.А., Докина Н.Н., Кизаев М.А., Фролов Д.В. Способ предпосадочной обработки клубней семенного картофеля. 2018. RU 2690937 C1.
Низова Г.К. Влияние предпосевной обработки семян янтарной кислотой на качество зеленой массы и зерна овса // Научн.-техн. бюл. ВИР. 1988. Т. 184. С. 17–20.
Чемерис О.В. Влияние салициловой кислоты на активность каталазы в инфицированных грибом Heterobasidion annosum (Fr.) Bref. проростках Pinus pallasiana D. Don // Пром. ботаника. 2019. Вып. 19. № 2. С. 29–33.
ГОСТ 12038-84. Семена сельскохозяйственных культур. Методы определения всхожести. Дата введения в действие 01.07.1986. М.: Стандартинформ, 2011. 64 с.
Horvath E., Janda T., Szalai G., Paldi E. In vitro salicylic acid inhibition of catalase activity in maize: differences between the isozymes and a possible role in the induction of chilling tolerance // Plant Sci. 2002. V. 163. P. 1129–1135.
Kang G., Wang Z., Xia K., Sun G. Protection of ultrastructure in chilling-stressed banana leaves by salicylic acid // J. Zhejiang Univ. Sci. B. 2007. V. 8. № 4. P. 277–282.
Raskin I. Salicylic acid, a new plant hormone // Plant Physiol. 1992. V. 99. P. 799–803.
Дополнительные материалы отсутствуют.