Агрохимия, 2022, № 4, стр. 24-29
Влияние дифенилмочевины на энергозапасающие реакции фотосинтеза в онтогенезе растений рапса
Н. П. Татаринцев 1, *, Н. С. Захарченко 2, А. Н. Шмарев 3, В. Д. Креславский 3, Д. В. Демин 3, Г. А. Семенова 4, А. П. Глинушкин 1
1 Всероссийский научно-исследовательский институт фитопатологии
143050 Московская обл., Одинцовский р-н, пос. Большие Вяземы, ул. Институт, влад. 5, Россия
2 Филиал Института биоорганической химии РАН
142290 Московская обл., Пущино, просп. Науки, 6, Россия
3 Институт фундаментальных проблем биологии РАН
142290 Московская обл., Пущино, ул. Институтская, 2, Россия
4 Институт теоретической и экспериментальной биофизики РАН
142290 Московская обл., Пущино, ул. Институтская, 3, Россия
* E-mail: nicktatarintsew@yandex.ru
Поступила в редакцию 13.12.2021
После доработки 27.12.2021
Принята к публикации 15.01.2022
- EDN: GZINMR
- DOI: 10.31857/S0002188122040135
Аннотация
Исследовано влияние N,N1-дифенилмочевины (ДФМ), обладающей цитокининовой активностью, на фотосинтез, скорость фотофосфорилирования и структуру клеток мезофилла хлоропластов в фазе цветения растений рапса. Обработка растений рапса ДФМ влияла на фотосистему 2 (ФС-2) и изменяла соотношение скоростей циклического (ЦФ) и нециклического фотофосфорилирования (НЦФ) препаратов тилакоидных мембран, выделенных из флагового листа. Через 24 ч после обработки растений ДФМ скорость ЦФ в хлоропластах возрастала на 25–30%, а скорость НЦФ не изменялась. Соотношение скоростей ЦФ и НЦФ сохранялось в течение нескольких суток. Обработка растений ДФМ приводила к повышению максимального квантового выхода ФС-2 (Fv : Fm). Полученные результаты свидетельствовали, что обработка растений рапса ДФМ изменяла углеводный обмен в хлоропластах, увеличивая содержание крахмальных зерен в листьях и жира на 20% в зерне конечной продукции.
ВВЕДЕНИЕ
Исследование механизмов регуляции роста и развития растений является актуальной проблемой физиологии растений [1]. Основную роль в этом процессе играют фитогормоны – индолилуксусная кислота (ИУК) и цитокинины (ЦК), которые синтезируются централизованно: ИУК – в верхушке побега, ЦК – в корнях. Они индуцируют деление клеток и участвуют в регуляции их роста, дифференциации и включают 2 важнейшие генетические программы – побего- и корнеобразование. Эти 2 фитогормона, взаимодействуя по принципу обратных положительных связей, обеспечивают поступательное развитие и старение растительного организма. ИУК индуцирует закладку новых корней, что приводит к увеличению синтеза цитокининов корневой системой. А это, в свою очередь, способствует закладке в апексе новых метамеров, а при переходе к репродуктивной фазе вегетации – регуляции процесса старения [1–3]. Обработка растений злаков цитокининами в фазе кущения приводит к изменению обмена веществ уже закончивших рост органов. Кинетин, например, задерживает процессы старения и распада. Установлено также влияние ЦК на синтез белков и энергетический обмен как на уровне целого растения, так и хлоропластов в злаковых культурах [2–5]. Ранее было обнаружено влияние природного соединения N,N-дифенилмочевины (ДФМ), обладающего цитокининовой активностью, на скорость циклического (ЦФФ) и нециклического фотофосфорилирования (НФФ) в хлоропластах и пул индолов во флаговых листьях растений пшеницы, обработанных в начале фазы цветения [6]. Нами установлено изменение индукции флоуресценции и реакции хлорофилла на поражение пшеницы микозами (влияние стресс-факторов) [7, 8]. Однако механизм действия ДФМ на энергетический и углеводный обмен в различных фазах онтогенеза растений во многом остается неясным и является целью настоящего исследования.
МЕТОДИКА ИССЛЕДОВАНИЯ
Растения рапса сорта Галант выращивали в теплице в сосудах, содержащих 5 кг серой лесной почвы. Использовали стандартные семена рапса от производителя. Семена до посева в почву замачивали на 2 сут в воде (контроль) и в водном растворе ДФМ (10–5 М). Перед посевом, готовя почвосмесь для исследования, вносили удобрения: мочевину, двойной суперфосфат, K2SO4 в дозах 8 мг/100 г (эквивалентно 20 г/м2) почвы для каждого элемента питания (NPK). Растения обрабатывали раствором ДФМ (0.2 мг/м2) стандартным опрыскиванием из расчета 300 литров рабочего раствора на 1 га в начале фазы цветения. Исследования в теплице проводили в течение 3-х лет. Растительный материал брали утром в 9–10 ч. Тилакоидные мембраны хлоропластов выделяли из флаговых листьев по методу [9]. Циклическое фотофосфорилирование проводили в присутствии феназинметасульфата (ФМС), нециклическое – в присутствии феррицианида и субстратов, АДФ – 3 мМ, 5 мМ фосфата и 3 мМ хлористого магния в 10 мМ Трицин–NaОH буфере (рН 7.8). Суспензию хлоропластов добавляли в количестве, эквивалентном 30 мкг хлорофилла. Реакционную смесь освещали белым светом с интенсивностью 300 вт/м2 в течение 3 мин. Количество образованного АТФ измеряли биолюминесцентным методом по свечению люциферин-люциферазной системы [10]. Структуру хлоропластов в фазе молочно-восковой спелости исследовали с помощью электронной микроскопии [11]. Для этой цели аликвоту суспензии хлоропластов фиксировали с 2.5%-ным глутаровым альдегидом в фосфатном буфере (рН 7.4) с последующей фиксацией в 1%‑ном растворе OsO4. Фиксированные образцы обезвоживали в спирте и ацетоне и заполняли эпоном 812. Ультратонкие срезы окрашивали уранилацетатом и цитратом свинца.
Измерение флуоресценции хлорофилла. Активность ФС-2 оценивали путем измерения флуоресценции хлорофилла с помощью метода быстрой флуоресценции (БФл). Перед измерениями листья закрепляли внутри измерительной ячейки и держали в темноте 15 мин.
Различные флуоресцентные параметры, такие как F0, Fv и Fm, где F0 – начальная (минимальная) флуоресценция, Fm – максимальная флуоресценция, Fv – переменная (Fv = Fm – F0), определяли с помощью ПАМ флуориметра (XE-PAM, Heinz Walz, Германия). Индукционные кривые БФл (OJIP-transient) были оценены в электронном виде и записаны на компьютере [12]. Оценивали максимальную квантовую эффективность ФС-2 по величине соотношения Fv : Fm. На основе индукционных кривых БФл рассчитывали также величину ET0 : RC – поток электронов, перенесенных от QA на QВ в расчете на РЦ ФС-2 и S0 – нормализованную площадь, число восстановленных пластохиноновых переносчиков электронов в ФС-2 (табл. 1).
Таблица 1.
Параметры полифазной индукции флуоресценции листьев рапса, рассчитанные из индукционных кривых быстрой флуоресценции хлорофилла
| Параметр | Контроль | Контроль + + ДФМ* |
|---|---|---|
| Fv : Fm – максимальная квантовая эффективность ФС-2 | 0.735 ± 0.01 | 0.770 ± 0.01 |
| ET0 : RC – поток электронов перенесенных от QA к QB в расчете на реакционный центр ФC-2 | 0.93 ± 0.02 | 0.98 ± 0.01 |
| Sv – нормализованная площадь, число восстановленных пластохиноновых переносчиков электрона в ФС-2 | 32 ± 1 | 36 ± 1 |
Опыт проводили в 3-х повторностях, аналитические измерения – в 5-ти повторениях. Представлены среднеарифметические величины типичного опыта и их стандартные отклонения. Достоверность различий определяли по t-критерию Стьюдента при p < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
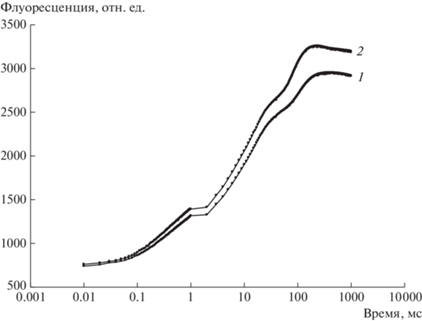
Было исследовано действие ДФМ на фотосинтетическую активность ФС-2. Типичные кривые быстрой флуоресценции представлены на рис. 1. Индукционная кривая растений обработанных ДФМ, располагается выше контроля и площадь под ней, отражающая емкость пластохинонового пула, больше, чем площадь под индукционной кривой контроля. Из чего следует, что число молекул пластохинона – переносчика электрона в ЭТЦ ФС-2 было больше у растений, обработанных ДФМ, чем в контроле. Также, в результате обработки растений ДФМ увеличивались величины ряда параметров флуоресценции Хл а, в том числе максимальный квантовый выход ФС-2 (Fv : Fm), максимальный поток электронов, перенесенных от первичного стабильного акцептора в фотосистеме 2 QA к вторичному акцептору QB, в расчете на реакционный центр ФC-2 (ET0 : RC) (табл. 1). Известно, что фотосинтетический аппарат (ФА) (особенно ФС-2) является одной из наиболее чувствительных систем к воздействию стрессов различной природы [13, 14]. Полученные данные согласуются с ранее полученными данными в работе [15], где было показано, что ДФМ замедляла старение и снижала степень окислительного стресса в листьях. Таким образом, на уровне первичных процессов фотосинтеза проявлялся стимулирующий эти процессы эффект ДФМ.
Рис. 1.
Индукционные кривые быстрой флуоресценции Хл а в листьях контрольных и обработанных дифенилмочевиной (ДФМ) растений рапса в начале фазы цветения: 1 – контроль, 2 – ДФМ; время – миллисекунды (мс).
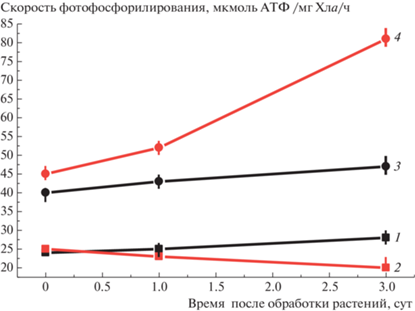
Уже на 2-е сут после обработки растений ДФМ, проведенной в начале фазы цветения растений рапса, наблюдали увеличение скорости циклического фотофосфорилирования, а скорость нециклического фотофосфорилирования изменялась незначительно (рис. 2). При этом максимальная разница между опытом и контролем достигалась к середине фазы цветения. Согласно нашим данным, полученным на проростках пшеницы по влиянию умеренного теплового стресса на фотохимическую активность и скорость фотофосфорилирования [12], такая разница между циклическим и нециклическим фотофосфорилированием может объясняться проявлением умеренного окислительного стресса (ОС), индуцированного стрессором. За счет развития ОС усиливается ЦФФ и снижается НФФ. Предположили, что обработка ДФМ аналогично индуцирует развитие слабого окислительного стресса во флаговом листе, что приводит к усилению циклического фотофосфорилирования. В работе [15] было установлено, что обработка злаковых растений в начале фазы цветения приводит к изменению структуры хлоропластов, увеличению скорости циклического фотофосфорилирования и соотношения некоторых аминокислот в зерне и их содержания. В частности, наблюдали увеличение содержания пролина в обработанных злаковых растениях. Считается, что пролин является маркером развития стресса в растениях [16]. При этом, как показано ранее в работах [5, 6], изменяется содержание индолов и фенолов в листьях злаков и, соответственно, соотношение цитокининов и ауксинов. Обработка растений ячменя в начале фазы цветения, когда формируется колос (активен флаговый лист), приводит к увеличению урожайности и снижению содержания запасного белка (что подтверждено эффектом разбавления: крахмальные составляющие нарабатываются быстрее, белковость зерна ячменя снижается). Имеются литературные данные, свидетельствующие о том, что после обработки злаковых растений цитокининами в фазе колошения отмечено увеличение количества зерен в колосе и урожайности растений [17], это можно объяснить большей выполненностью зерен в колосе и колосках злаков, особенно многорядного ячменя, пшеницы и овса по сравнению с карбамидно-аммиачной смесью [18–20]. На основе полученных результатов и литературных данных [21, 22] можно сделать предположение, что обработка растений ДФМ изменяет скорость поступления метаболитов углеводного и белкового обмена в репродуктивные органы рапса и их накопление за вегетационный период. Обработка вегетирующих растений ДФМ энергетически и экономически менее затратная по сравнению с применением КАС 28. ДФМ перспективен для изучения и на других культурах, в том числе по физиолого-экономическим основаниям.
Рис. 2.
Влияние обработки растений рапса сорта Галант дифенилмочевиной (ДФМ) в начале фазы цветения на скорости циклического (ЦФ) и нециклического (НЦФ) фотофосфорилирования в препаратах тилакондных мембран хлоропластов: 1 – контроль – скорость НЦФ, 2 – обработка ДФМ – скорость НЦФ через 1 и 3 сут, 3 – контроль – скорость ЦФ, 4 – обработка ДФМ – скорость ЦФ через 1 и 3 сут.
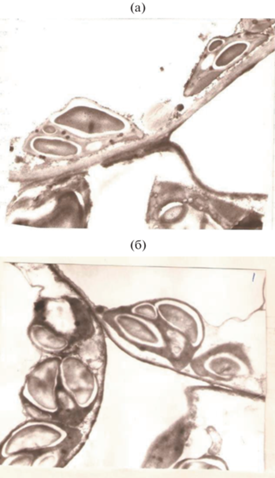
Полученные нами результаты по структуре хлоропластов, выделенных в фазе начала молочной спелости (электронная микроскопия) свидетельствовали о том, что обработка семян и растений рапса ДФМ в начале фазы цветения изменяла углеводный обмен в хлоропластах, увеличивая содержание крахмальных зерен (рис. 3). Результаты анализа содержания жира в семенах контрольных и обработанных ДФМ растений рапса (табл. 2), свидетельствовали о существенном увеличении содержания жира (до 26.3%) в сформированных семенах рапса при опрыскивании растений.
ВЫВОДЫ
1. Обработка растений ДФМ приводила к повышению максимального квантового выхода ФС-2 (Fv : Fm) и изменяла соотношение скоростей циклического (ЦФ) и нециклического (НЦФ) фотофосфорилирования препаратов тилакоидных мембран.
2. Обработка растений рапса ДФМ изменяла углеводный обмен в хлоропластах, увеличивая содержание крахмальных зерен в листьях и жира на 20% в зерне конечной продукции.
Список литературы
Дерфлинг К. Гормоны растений. М.: Мир, 1985. 298 с.
Кулаева О.Н. Цитокинины, их структура и функции. М. Наука, 1973. 263 с.
Кулаева О.Н., Кузнецов В.В. Новейшие достижения и перспективы в области изучения цитокининов // Физиология растений. 2002. Т. 49. № 4. С. 626–640.
Якушкина Н.И., Похлебаев С.М. Особенности фотофосфорилирования хлоропластов, выделенных из обработанных фитогормонами листьев ячменя и пшеницы // Физиология растений. 1982. Т. 29. № 3. С. 502–507.
Татаринцев Н.П., Лебедева А.И., Пачепская Л.Б., Рузиева Р.Х., Герц С.М., Руденко Т.И. Взаимосвязь различных типов фотофосфорилирования и пулов метаболитов индольной и фенольной природы в онтогенезе злаковых культур // Физиология растений. 1993. Т. 41. № 5. С. 709–714.
Tatarintsev N.P. Low-frequency cyclic variations in the energy-storing reactions of photosynthesis and indole pool size in wheat plant during ontogeny // Biophysics. 2002. V. 47. P. 78–81.
Тимофеев Н.П., Маторин Д.Н., Глинушкин А.П., Горячев С.Н., Алексеев А.А. Индукция флуоресценции хлорофилла у зараженной корневой гнилью озимой пшеницы // Естеств. и техн. науки. 2017. Т. 3. № 105. С. 17–19.
Маторин Д.Н., Тимофеев Н.П., Глинушкин А.П., Братковская Л.Б., Заядан Б.К. Исследование влияния грибковой инфекции Bipolaris sorokoniana на световые реакции фотосинтеза пшеницы с использованием флуоресцентного метода // Вестн. МГУ. Сер. 16: Биология. 2018. Т. 73. № 4. С. 247–253.
Opanasenko V.K., Agafonov A.V., Demidova R.N. Effects of heterocyclic and tertiary permeant amines on the electron transfer in thylakoid membranes // Photosynth. Res. 2002. V. 72. P. 242–253.
Schmidt G., Graber P. The rate of ATP synthesis by reconstituted CF0F1 liposomes // Biochim. Biophys. Acta. 1998. V. 808. C. 46–51.
Semenova G.A. Structural reorganization of thylakoid systems in response to heat treatment // Photosynthetica. 2004. V. 42. P. 521–527.
Kreslavski V., Tatarinzev N., Shabnova N., Semenova G., Kosobrukhov A. Characterization of the nature of photosynthetic recovery of wheat seedlings from short-time dark heat exposures and analysis of the mode of acclimation to different light intensities // J. Plant Physiol. 2008. V. 165. P. 1592–1600.
Barber J., Andersson B. Too much of a good thing: light can be bad for photosynthesis // Trend. Biochem. Sci. 1992. V. 17. P. 61–66.
Allakhverdiev S.I., Kreslavski V.D., Klimov V.V., Los D.A., Carpentier R., Mohanty P. Heat stress: an overview of molecular responses in photosynthesis // Photosynth. Res. 2008. V. 98 P. 541–550.
Татаринцев Н.П., Семенова Г.А., Креславский В.Д. Фотофосфорилирование, структура хлоропластов и аминокислотный состав запасного белка в зерне ячменя и пшеницы под влиянием N,N-дифенилмочевины // Сел.-хоз. биол. 2013. Т. 3. С. 66–71.
Кузнецов Вл.В., Шевякова Н.И. Пролин при стрессе: биологическая роль, метаболизм, регуляция // Физиология растений. 1999. № 46. С. 391–336.
Caers M., Vendrig I.C. Benzyladenine effects on the development of the photosynthetic apparatus in Zea mays // Physiol. Plant. 1986. V. 66. P. 686–691.
Спиридонов Ю.Я., Соколов М.С., Глинушкин А.П., Каракотов С.Д., Коршунов А.В., Торопова Е.Ю., Сараев П.В., Семенов А.М., Семенов В.М., Никитин Н.В., Калиниченко В.П., Лысенко Ю.Н. Адаптивно-интегрированная защита растений. М., 2019. 628 с.
Торопова Е.Ю., Глинушкин А.П., Селюк М.П., Казакова О.А., Овсянкина А.В. Развитие почвенных инфекций у яровой пшеницы и ячменя под влиянием гидротермических стрессов в условиях лесостепи Западной Сибири и Зауралья // Рос. сел.-хоз. наука. 2018. № 2. С. 25–29.
Тулякова М.В., Баталова Г.А., Пермякова С.В., Градобоева Т.П. Результаты изучения перспективных линий овса конкурсного сортоиспытания в условиях Кировской области // Вестн. Марий. Гос. ун-та. Сер.: Сел.-хоз. науки. Эконом. науки. 2020. Т. 6. № 3 (23). С. 325–333.
Пшибытко Н.Л., Бачище Т.С., Кабашникова Л.Ф. Влияние повышенной температуры на перенос электронов в хлоропластах ячменя // Изв. Нац. акад. наук Беларуси. Сер. биол. науки. 2020. Т. 65. № 2. С. 153–162.
Агаев Р.А.О., Беспалова Л.А., Агаева Е.В. Посевные и урожайные свойства семян пшеницы мягкой озимой в зависимости от зоны репродуцирования // Политемат. сетев. электр. научн. журн. Кубан. ГАУ. 2020. № 157. С. 312–323.
Дополнительные материалы отсутствуют.