Агрохимия, 2022, № 4, стр. 88-93
Метод совместного определения остаточных количеств абамектина и индоксакарба в сельскохозяйственных культурах
Е. Ю. Алексеев 1, *, В. И. Долженко 1
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург–Пушкин, шоссе Подбельского, 3, Россия
* E-mail: anscreation@yandex.ru
Поступила в редакцию 13.12.2021
После доработки 27.12.2021
Принята к публикации 15.01.2022
- EDN: PZRXAR
- DOI: 10.31857/S0002188122040032
Аннотация
Анализ растительных образцов на содержание остаточных количеств пестицидов после обработки сельскохозяйственных культур многокомпонентными препаратами достаточно трудоемкий процесс, поэтому разработка мультиметодов определения остаточных количеств пестицидов в одной пробе является важным направлением. В данной работе была разработана методика совместного определения индоксакарба и абамектина в капусте, сое и картофеле при использовании метода пробоподготовки QuEChERS и метода ВЭЖХ-УФ анализа. Разработанный метод имеет высокую степень извлечения действующих веществ, а также показал практическую значимость при изучении препарата Стилет, МД.
ВВЕДЕНИЕ
Известно, что в настоящее время бóльшая часть выращиваемой сельскохозяйственной продукции обрабатывается пестицидами для защиты урожая от вредителей, сорных растений и возбудителей болезней. Однако пестициды являются токсичными веществами для теплокровных животных и человека. Также среди ассортимента химических средств защиты растений выделяется группа препаратов, в состав которых входит не одно, а 2 и более действующих веществ [1].
Анализ растительных образцов на содержание остаточных количеств пестицидов после обработки сельскохозяйственных культур многокомпонентными препаратами достаточно трудоемкий процесс. Для каждого из компонентов по существующим методам анализа проводят отдельную пробоподготовку с последующим качественным и количественным определением [2]. Разработка универсальных методик, которые позволяют совместно определять действующие средства многокомпонентных пестицидов, является приоритетным направлением.
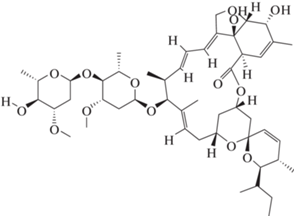
Препарат Стилет, МД (индоксакарб 100 г/л + + абамектин 40 г/л), содержит в своем составе 2 действующих вещества – индоксакарб и абамектин. Абамектин относится к авермектинам – инсектицидам и акарицидам, которые получают из почвенных бактерий Streptomyces avermitilis. Абамектин – естественный продукт брожения этой бактерии [3], является нейротоксикантом. Абамектин способствует выделению γ-аминомасляной кислоты, что приводит к ингибированию передачи нервного импульса и, как следствие, параличу у насекомых и клещей [4] (рис. 1).
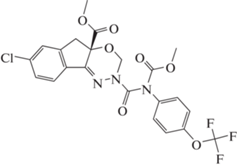
Индоксакарб – химическое действующее вещество пестицидов из класса оксидиазины, используется в сельском хозяйстве и личных подсобных хозяйствах для борьбы с вредными насекомыми. Индоксакарб блокирует движение ионов натрия в каналах нервных клеток, что приводит к параличу и гибели вредителей [6, 7] (рис. 2).
На сегодняшний день в основе большинства современных методик определения остаточных количеств пестицидов лежит метод пробоподготовки QuEChERS. QuEChERS (Quick, Easy, Cheap, Effective, Rugged, and Safe – Быстро, Просто, Дешево, Эффективно, Надежно и Безопасно) – быстрый и эффективный метод, позволяющий извлекать из проб остаточные количества целевых соединений, удаляя нежелательные помехи, такие как органические кислоты, липиды, пигменты, сахара и другие соединения [9].
Одной из задач исследователей является разработка методов, которые могли бы определять сразу несколько действующих веществ в анализируемом объекте. Такие методы позволяют проводить экотоксикологический анализ быстрее и дешевле. На сегодняшний день существует несколько разработанных методов, которые позволяют одновременно определять десятки пестицидов в различных матрицах [10, 11]. Однако это возможно только с использованием дорогих масс-спектрометрических (МС) детекторов, которые не всегда доступны в большинстве лабораторий. Современные диодно-матричные детекторы, работающие с системой высокоэффективной жидкостной хроматографии (ВЭЖХ-УФ), позволяют идентифицировать разные вещества одновременно, благодаря использованию широкого диапазона длин волн. Существуют методы, позволяющие определять несколько пестицидов с использованием метода детектирования ВЭЖХ-УФ [12, 13]. Однако чаще всего определяемые данными методами пестициды принадлежат одному классу. Стоит отметить, что действующие вещества большинства комбинированных препаратов часто относятся к разным химическим классам. Поэтому разработка быстрых и дешевых мультиметодик по определению остаточных количеств на основе методов QuEChERS и ВЭЖХ-УФ является перспективным направлением.
Цели работы – разработка мультиметода определения остаточных количеств абамектина и индоксакарба в картофеле, капусте, сое и масле сои, а также его апробирование при изучении препарата Стилет, МД.
МЕТОДИКА ИССЛЕДОВАНИЯ
Модифицированный метод пробоподготовки QuEChERS. Навеску измельченной матрицы помещают в полипропиленовую центрифужную пробирку вместимостью 50 см3, последовательно добавляют 10 см3 ацетонитрила и 1 г хлористого натрия. При анализе сои дополнительно добавляют 10 см3 дистиллированной воды. Пробирку плотно закрывают и помещают в перемешивающее устройство на 10 мин, затем центрифугируют в течение 10 мин при скорости 4000 об./мин. От верхнего ацетонитрильного слоя отбирают 5 см3, переносят в центрифужную пробирку вместимостью 15 см3, содержащую 150 мг сорбента на основе силикагеля с привитыми пропиламинными группами (PSA) и 900 мг безводного сульфата магния. Пробирку плотно закрывают и помещают в перемешивающее устройство на 10 мин, затем центрифугируют в течение 10 мин при скорости 4000 об./мин. Далее отбирают 2 см3 экстракта, упаривают досуха и растворяют в 1 см3 смеси ацетонитрил : 0.005 М раствор ортофосфорной кислоты (1 : 1 по объему).
Условия детектирования. Используют ультраэффективный жидкостной хроматограф (“ACQUITY” фирмы Waters) с быстросканирующим УФ-детектором, снабженный дегазатором, автоматическим пробоотборником и термостатом колонки, и аналитическую колонку, заполненную сорбентом с привитыми монофункциональными полярными группами С18 (ACQUITY BEH C-18 (Waters)) (100 × 2.1) мм, 1.7 мкм. Температура колонки – 30 ± 1°С, скорость потока элюента – 0.2 см3/мин, рабочая длина волны УФ-детектора – 310 и 245 нм, объем вводимой пробы – 10 мм3, режим элюирования – градиентный. Элюент А – ацетонитрил, элюент В – 0.005 М раствор ортофосфорной кислоты (табл. 1).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для первичной экстракции пестицидов из растительных матриц по методу QuEChERS EN 15 662 обычно используют следующие соли: безводный сульфат магния, цитратный буфер, состоящий из двухосновного сесквигидрата цитрата натрия и трехосновного дигидрата цитрата натрия, и хлористый натрий. Данные соли повышают ионную силу раствора, создают комфортный для экстракции pH, что увеличивает долю (в %) извлечения аналитов. Однако нами было выдвинуто предположение, что использование дорогостоящих реактивов для создания стабильного pH не целесообразно, т.к. исследуемые матрицы не обладают выраженными кислотными или основными свойствами и скорей всего не смогут оказать сильный эффект на процесс экстракции. Также из опыта прошлых исследований было отмечено, что для увеличения эффективности экстракции необходимо, чтобы в системе присутствовала вода. Безводный сульфат магния связывает часть воды, а также может сорбировать на себе некоторые количества действующих веществ. Поэтому было принято решение отказаться от него. Для разделения жидкой и органической фазы добавляется NaCl в количестве 1 г. Данного количества хватает для разделения фаз и повышения ионной силы водного раствора.
Было проведено 2 испытания: первичная экстракция по классическому методу и по модифицированному методу. Первичная экстракция с использованием только NaCl и ацетонитрила показала лучшее извлечение действующих веществ. Поэтому данный вариант был принят за основной.
Так как в пробе присутствует достаточно много сопутствующих веществ (жиры, пигменты и т.п.), которые могут мешать точной идентификации целевого аналита, а также могут привести к загрязнению хроматографической колонки, что непосредственно может сказаться на точности анализа, необходимо провести очистку первичного экстракта. Очистку было решено провести насыпными сорбентами. Были апробированы следующие сорбенты: силикагель, PSA, С18Е, силикагель и GCB (графитированая сажа), PSA.
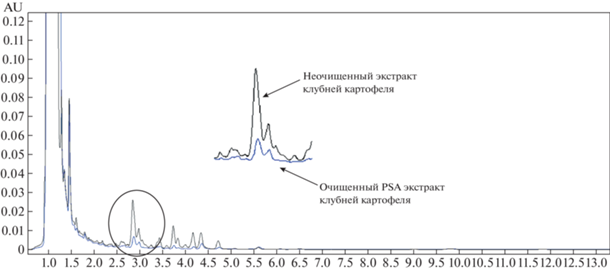
GCB и его сочетания обеспечивают хорошую очистку, но сильно уменьшают долю выхода (в %) действующего вещества. Сорбент С18Е оказал эффект только при очистке экстрактов сои и продукта его переработки – масла. Ощутимое уменьшение хроматографического фона происходит при использовании сорбента PSA, при этом он никак не влияет на долю выхода действующих веществ и эффективен для всех исследуемых матриц. На рис. 3 представлены хроматограммы картофеля до и после очистки PSА. Таким образом, было принято проводить пробоподготовку по схеме, приведенной выше. Полнота извлечения абамектина и индоксакарба по данной методике приведена в табл. 2.
Таблица 2.
Полнота извлечения абамектина и индоксакарба в анализированных матрицах
| Объект исследования | Доля извлечения абамектина | Доля извлечения индоксакарба |
|---|---|---|
| % | ||
| Картофель | 90.1 ± 2.6 | 91.2 ± 2.9 |
| Капуста | 87.3 ± 1.9 | 85.1 ± 3.1 |
| Соя | 85.2 ± 3.4 | 83.8 ± 4.4 |
| Масло сои | 86.7 ± 2.4 | 80.9 ± 3.3 |
Для совместного определения настройки диодно-матричного детектора были выставлены 2 длины волны – 310 и 245 нм. Для быстроты проводимого анализа было принято использовать градиентный режим хроматографирования, что позволяет детектировать действующие вещества за 10 мин. На рис. 4 представлены хроматограммы сои с внесением индоксакарба и абамектина, полученные из одной пробы. С использованием данной методики были проанализированы пробы сои и капусты после обработки препаратом Стилет, МД в 3-х почвенно-климатических зонах в 2019 г. Результаты представлены в табл. 3, 4. В урожае и продуктах переработки остаточных количеств действующих веществ обнаружено не было. Таким образом, при соблюдении регламентов препарат Стилет, МД может быть использован для защиты капусты и сои от вредителей.
Рис. 4.
Хроматограммы сои с внесением: (а) – индоксакарба и (б) – абамектина в количестве 0.1 мг/кг.
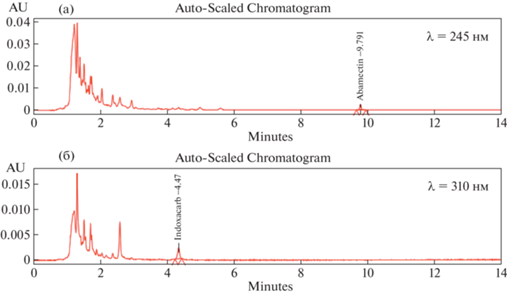
Таблица 3.
Концентрация индоксакарба и абамектина в анализированных пробах капусты
| Время после обработки, сут | Анализируемый объект | Почвенно-климатические зоны | ||
|---|---|---|---|---|
| Санкт-Петербург (1-я зона) | Тамбов (2-я зона) | Волгоградская обл. (3-я зона) | ||
| Индоксакарб | ||||
| Обработка | Сегменты кочанов | 3.58 | 4.89 | 1.52 |
| 7 | То же | 2.58 | 3.26 | 0.12 |
| 14 | “–” | н/о | 0.25 | н/о |
| 21 | “–” | н/о | ||
| Урожай (29 сут) | “–” | |||
| Абамектин | ||||
| Обработка | Сегменты кочанов | 0.28 | 0.14 | 0.15 |
| 7 | То же | н/о | 0.13 | 0.03 |
| 14 | “–” | н/о | ||
| 21 | “–” | |||
| Урожай (29 сут) | “–” | |||
Таблица 4.
Концентрация индоксакарба и абамектина в анализированных пробах сои и продукте ее переработки
| Время после обработки, сут | Анализируемый объект | Почвенно-климатические зоны | ||
|---|---|---|---|---|
| Орел (1-я зона) | Краснодар (2-я зона) | Волгоградская обл. (3-я зона) | ||
| Индоксакарб | ||||
| Обработка | Зеленая масса | 3.01 | 2.67 | 1.57 |
| 7 | То же | 0.98 | 1.32 | 1.33 |
| 14 | “–” | 0.48 | 0.74 | 0.90 |
| 21 | Бобы | 0.12 | 0.09 | 0.01 |
| Урожай (29 сут) | То же | Не обнаружено | ||
| Урожай (29 сут) | Масло | |||
| Абамектин | ||||
| Обработка | Зеленая масса | 0.21 | 0.40 | 0.20 |
| 7 | То же | Не обнаружено | ||
| 14 | “–” | |||
| 21 | Бобы | |||
| Урожай (29 сут) | То же | |||
| Урожай (29 сут) | Масло | |||
ЗАКЛЮЧЕНИЕ
Разработанный метод имеет ряд неоспоримых преимуществ: во-первых, он позволяет детектировать 2 действующих вещества, относящихся к разным химическим классам, одновременно. Во-вторых, он значительно сокращает время, затраченное на пробоподготовку и непосредственно на хроматографический анализ. В-третьих, данный метод позволяет отказаться от использования дорогостоящих и труднодоступных реактивов, что положительно сказывается на стоимости анализа. Разработанный метод показал высокую долю извлечения действующих веществ. Преимущества данного метода подтверждены в процессе изучения динамики деградации действующих веществ в сое и капусте при обработке препаратом Стилет, МД. Данный метод может быть использован для экотоксикологической оценки препаратов на основе данных действующих веществ не только в комбинации, но и в отдельности. Также данная методика будет актуальна для изучения остаточных количеств действующих веществ в импортной продукции.
Список литературы
Остроухова О.К., Комарова А.С. Оптимизация методов контроля содержания многокомпонентных пестицидов в сельскохозяйственных культурах. 2016. Вып. 2. С. 72–75.
Зенкевич И.Г., Остроухова О.К., Долженко В.И. Выбор оптимальных аналитических параметров для хроматографической идентификации пестицидов // ЖАХ. 2002. Вып. 57. № 1. С. 43–48.
Белов Д.А. Химические методы и средства защиты растений в лесном хозяйстве и озеленении. Учеб. пособ. для студентов. М.: МГУЛ, 2003. 128 с.
Долженко Т.В., Буркова Л.А., Долженко В.И. Абамектин в защите сада от сосущих вредителей // Мат-лы научн. конф. “Проблемы защиты растений в условиях современного сельскохозяйственного производства”. СПб., 2009. С. 51–52.
National Center for Biotechnology Information. PubChem Compound Summary for CID 6435890, Abamectin. [Electronic resource]. 2021.
McCann S.F. The discovery of indoxacarb: oxadiazines as a new class of pyrazoline-type insecticides. // Pest Manag. Sci. 2001. V. 57. № 2. P. 153–164.
Lapied B., Grolleau F., Sattelle D.B. Indoxacarb, an oxadiazine insecticide, blocks insect neuronal sodium channels // Br. J. Pharmacol. 2001. V. 132. № 2. P. 587–595.
National Center for Biotechnology Information. PubChem Compound Summary for CID 107720, Indoxacarb [Electronic resource]. 2021.
Anastassiades M. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce // J. AOAC Int. AOAC Inter. 2003. V. 86. № 2. P. 412–431.
Tian F. Development of a fast multi-residue method for the determination of succinate dehydrogenase inhibitor fungicides in cereals, vegetables and fruits by modified QuEChERS and UHPLC-MS/MS // J. Chromatogr. B Anal. Technol. Biomed. Life Sci. Elsevier B.V., 2020. V. 1152.
Feng C. Comprehensive strategy for analysis of pesticide multi-residues in food by GC-MS/MS and UPLC-Q-Orbitrap // Food Chem. Elsevier Ltd, 2020. V. 320.
Hou. A Modified QuEChERS method for determination of pyrethroid residues in traditional chinese medicine oral liquids by high-performance liquid chromatography // Mol. MDPI AG. 2019. V. 24. № 8. P. 1470.
Mahdavi V. Health risk assessment of neonicotinoid insecticide residues in pistachio using a QuEChERS-based method in combination with HPLC-UV // Biomed. Chromatogr. John Wiley and Sons Ltd, 2020. V. 34. № 3. P. e4747.
Дополнительные материалы отсутствуют.