Агрохимия, 2020, № 3, стр. 62-69
ВЛИЯНИЕ БАКТЕРИЙ Rhizobium leguminosarum bv. viceae И Pseudomonas syringae bv. pisi НА СОДЕРЖАНИЕ НЕГАТИВНЫХ АЛЛЕЛОПАТИЧЕСКИХ СОЕДИНЕНИЙ В КОРНЕВЫХ ЭКССУДАТАХ ПРОРОСТКОВ ГОРОХА (Pisum sativum L.)
Л. Е. Макарова 1, *, И. Г. Петрова 1, Н. А. Соколова 1, А. С. Мориц 1
1 Сибирский институт физиологии и биохимии растений СО РАН
664033 Иркутск, ул. Лермонтова, 130, Россия
* E-mail: makarova@sifibr.irk.ru
Поступила в редакцию 13.08.2019
После доработки 21.10.2019
Принята к публикации 10.12.2019
Аннотация
Сравнили реакцию на инокуляцию бактериями Rhizobium leguminosarum bv. viceae (мутуалист) и Pseudomonas syringae bv. pisi (антагонист), внесенных раздельно или совместно в водную среду роста корней проростков гороха (Pisum sativum L.) сорта Торсдаг. Показателями реакции были изменения содержания негативных аллелопатических соединений (пизатина, N-фенил-2-нафтиламина, фталатов) в корневых экссудатах. После инокуляции проростки росли 1 сут в камере “BINDER KBW-240” при 21°С, освещении 81 μМ/м2/сек и фотопериоде 16/8 ч (день/ночь). В этилацетатных экстрактах из водной среды, куда погружали корни проростков, содержание соединений определяли методом ВЭЖХ, а изменения в составе фталатов – методом ГХ-МС. Установлено одинаковое влияние моно- и смешанных культур ризобий и псевдомонад на содержание пизатина и дибутилфталата, но различное – на содержание N-фенил-2-нафтиламина и соотношения фталатов в корневых экссудатах.
ВВЕДЕНИЕ
Начальные этапы взаимодействия растений с почвенными бактериями в ризосфере и ризоплане осуществляются посредством метаболитов, синтезируемых в клетках обоих партнеров. В почве в прикорневой области растений важную роль играют экскретируемые в виде корневых экссудатов высокомолекулярные (полисахаридные слизи или муцигель, ферменты) и низкомолекулярные (сахара, аминокислоты, органические кислоты, липиды, витамины, фенольные соединения и др.) соединения. Основными функциями этих веществ являются привлечение в прикорневую зону бактерий, контролирование их размножения и видового состава [1–4].
Сахара, аминокислоты, органические кислоты, липиды в корневых экссудатах доминируют среди низкомолекулярных компонентов и характеризуются специфичностью состава не только у растительных генотипов, но и у сортов растений [4–6]. По сравнению с перечисленными соединениями, количество ароматических соединений в корневых экссудатах много меньше [6], однако состав фенольных компонентов в экссудатах также определяется видовой принадлежностью растений [7]. В прикорневой зоне, отнесенной к области наиболее активного развития микроорганизмов [4], все вышеназванные низкомолекулярные компоненты корневых экссудатов, вероятно, имеют определяющее значение в регуляции взаимоотношений между конкретными видами растений и микроорганизмов. Специфическая роль фенольных соединений во взаимодействиях между растением и бактериями доказана многими исследователями бобово-ризобиального симбиоза, где эта их роль изучена в наибольшей степени [7–9]. Данные литературы позволяют констатировать, что компоненты корневых экссудатов ароматической и неароматической (сахара, аминокислоты, карбоновые кислоты) природы имеют схожее значение в отношении регуляции аттракции (хемотаксиса) бактерий и их трофике [7, 9, 10]. Ряд представителей обоих групп соединений участвуют в снижении действия токсических элементов на растения и микрофлору почв [4, 11, 12].
Значение фенольных соединений в ризосфере бобового растения не ограничивается только их ролью в инициации инфицирования и нодуляции корней бобового растения. Необходимым для нормального существования и роста растения является контролирование посредством его метаболитов концентрации, а также видового состава микроорганизмов в его ризосфере и ризоплане. В этом аспекте особенно важным является участие ароматических соединений негативного действия на микроорганизмы. К числу веществ такого типа действия относят фитоалексины, химическая природа которых различается не только у представителей разных семейств растений, но и у представителей одного семейства [13].
У растений гороха (Pisum sativum L.), служивших объектом нашего исследования, наряду с фитоалексином пизатином к соединениям негативного действия отнесены N-фенил-2-нафтиламин и фталаты [14, 15]. Эти соединения могут появляться в почве не только вследствие проникновения в нее из синтезирующих их растений, но и иметь техногенное происхождение, поскольку интенсивно используются в химической промышленности. Например, N-фенил-2-нафтиламин находит применение как стабилизатор резины, ингибитор полимеризации, компонент топлива для ракет и т.п. Фталаты используют в химической промышленности в качестве пластификаторов полимеров и обнаруживают среди отходов промышленных производств [16]. N-фенил-2-нафтиламин и фталаты относят к ксенобиотикам, негативно действующим на живые организмы.
На примере сортов гороха Аксайский усатый и Ямальский ранее выявлена зависимость содержания в экссудатах пизатина, N-фенил-2-нафтиламина и фталатов от размера корня, обнаружены изменения в их содержании в связи с инокуляцией бактериями Rhizobium leguminosarum bv. viceae и Pseudomonas syringae pv. pisi [15, 17]. На содержание N-фенил-2-нафтиламина в экссудатах проростков гороха весьма заметно влияли абиотические факторы: условия освещения и температуры [15, 18]. При росте проростков гороха сорта Торсдаг в условиях температур 21 и 9°С в их экссудатах были замечены различия состава фталатов [19].
Вместе с ризобиями в ткани корней могут проникать ряд сосуществующих с ними видов бактерий из прикорневой зоны бобового растения [20]. Полагают, что виды бактерий, проникшие в корни вместе с ризобиями, могут сосуществовать в клубеньках, совместно участвуя в метаболических процессах в бактероидных тканях клубеньков.
Для 2-х видов бактерий (R. leguminosarum bv. viceae и P. syringae pv. Pisi), являющихся симбионтами растений гороха, но различной стратегии сосуществования с растением-хозяином (мутуалист и антагонист), данные о совместном их проникновении в ткани корня гороха в литературе отсутствуют. В то же время присутствие представителей рода Pseudomonas в бактероидных тканях некоторых дикорастущих бобовых растений было замечено [21].
В работе [22] приведены данные, указывающие на различные адсорбционные свойства R. leguminosarum bv. viceae и P. syringae pv. pisi в течение 6 ч после инокуляции проростков гороха сорта Рондо. В течение указанного периода наблюдений адсорбция ризобий на поверхности корня усиливалась во времени, а у бактерий P. syringae pv. pisi зафиксировано ее ослабление уже после 15 мин после инокуляции корней проростков гороха. Возможно, для данного вида псевдомонад, поражающего у названного выше представителя бобовых культур органы его надземной части (листья), проникновение в ткани корня или не характерно, или ограничено.
Цель работы – изучение особенностей защитной (антимикробной) реакции растения гороха, проявляющейся на уровне его ризосферы при инфицировании его корней монокультурами и при совместной инокуляции бактериями R. leguminosarum bv. viceae и P. syringae pv. pisi (мутуалиста и антагониста). Для этого через 1 сут после инокуляции бактериями проследили за изменениями содержания (относительно контроля) в корневых экссудатах проростков гороха негативных аллелопатических соединений – пизатина, N-фенил-2-нафтиламина и фталатов.
МЕТОДИКА ИССЛЕДОВАНИЯ
Объекты исследования. Объектами исследования служили проростки гороха (Pisum sativum L.) сорта Торсдаг и бактерии R. leguminosarum bv. viceae (штамм 245а, получен из Всероссийского научно-исследовательского института сельскохозяйственной микробиологии, г. Пушкин) и P. syringae pv. pisi (штамм 1845, из коллекции Центра коллективного пользования (ЦКП) “Биоресурсный центр” Сибирского института физиологии и биохимии растений (СИФИБР) СО РАН, г. Иркутск). Бактерии выращивали на твердых агаризованных средах, составленных по прописи [23].
Семена гороха обеззараживали путем промывания водопроводной водой с мылом и с последующей обработкой 3%-ным раствором пероксида водорода. Прорастание семян и рост проростков проходили в течение 2-х сут на стерильной фильтровальной бумаге, смоченной водопроводной водой, в термостате при 21°С, без освещения. Дальнейший рост проростков, после погружения их корней в водную среду, содержавшую микроэлементы [15], в течение 1 сут происходил в камере BINDER KBW-240 при 21°С, освещении 81 μМ/м2/сек и фотопериоде 16/8 ч (день/ночь). Объем раствора в сосудах составлял 250 мл, число проростков, приходившихся на 1 сосуд – 36. Средние размеры корней исходных проростков составляли в длину 30–35 мм, по окончании эксперимента – 40–45 мм. Для инокуляции растений культуру бактерий вносили в водную среду в виде водного смыва с твердой агаризованной среды, до концентрации 1.0 × 108 кл./мл (1.0 × 104 кл./мл для каждого вида при совместной инокуляции). Инокуляцию осуществляли одновременно с помещением корней проростков в водную среду. Контролем в эксперименте служили одновозрастные неинокулированные проростки.
Получение экстрактов аллелопатических веществ, входящих в состав корневых экссудатов. Фенольные соединения корневых экссудатов трехкратно экстрагировали при помощи этилацетата из водной среды (соотношение 1 : 1, v/v), предварительно подкисленной раствором HCl до рН 3.0. Этилацетат из экстрактов упаривали в токе холодного воздуха в условиях затемнения. Сухой остаток растворяли 1.0 мл метанола, и содержащиеся в нем соединения вначале исследовали методом ВЭЖХ. Затем из экстракта в вакууме удаляли метанол. Остаток перерастворяли в этилацетате, производили силилирование соединений экстракта и исследовали их состав методом газо-хромато-масс-спектрометрического (ГХ-МС) анализа. Экстракты, растворенные в метаноле и этилацетате, помещали в стеклянные виалы.
Определение содержания аллелопатических соединений методом ВЭЖХ. Определение содержания пизатина, N-фенил-2-нафтиламина и дибутилфталата осуществляли методом ВЭЖХ на хроматографе “Shimadzu LC-10ATvp” с УФ-детектором (“Shimadzu”, Япония). Идентифицировали соединения в адсорбционных профилях по времени удерживания метчиков, которое подтверждали УФ-спектрами, полученными в остановленном потоке элюента для метчиков и для изучаемых веществ. Для идентификации и получения калибровочных графиков использовали аутентичные образцы N-фенил-2-нафтиламина (“Sigma”, США), дибутилфталата (“Реахим”, Россия) и пизатина, который был любезно предоставлен профессором Х.Д. Ван-Эттеном (Отдел науки о растениях университета Аризоны, США). Разделение содержавшихся в экстрактах фенольных компонентов проводили на колонке (250 × × 4.6 мм, 5 мкм) Perfect (“MZ Analisentechnik”, Германия), в возрастающем градиенте А : В от 30 до 90% в течение 80 мин при скорости 0.5 мл/мин (А – ацетонитрил, В – 0.2 н. перхлорат Li в 0.1%-ном водном растворе трифторуксусной кислоты, рН 4.0). Детектирование соединений проводили при 280 нм. Количественные расчеты производили по адсорбционным профилям по высоте пиков, с использованием калибровочных графиков, построенных для разных концентраций исследованных соединений. Величины достоверности аппроксимации (R2) составляли 0.96 – для N-фенил-2-нафтиламина, 0.98 – для дибутилфталата, 0.99 – для пизатина.
Исследование состава фталатов в корневых экссудатах. Анализ состава фталатов в экстрактах проводили методом ГХ-МС-анализа с использованием хромато-масс-спектрометра “7000QQQTripleQuad/7890A MSD/DS” (“Agilent Technology”, США). Объем вводимой пробы – 0.2 мкл, температура испарителя – 250°С, источника ионов – 230°С, детектора – 150°С, линии, соединяющей хроматограф с масс-спектрометром, – 280°С. Диапазон сканирования – 50–600 а.е.м. Капиллярная колонка – 5MS (30 м × 0.250 мм × 0.50 мкм), неподвижная фаза – 5%-ный фенилметилполисилоксан. Градиент температуры: от 100 до 280°С со скоростью 5°С/мин, 2 мин при 280°С, затем от 280 до 340°С со скоростью 5°С/мин. Подвижная фаза – гелий, скорость потока газа 1 мл/мин. Режим разделения потоков – 5 : 1. Способ ионизации – электронный удар, энергия ионизации 70 эВ. Анализ проводили в режиме регистрации полного ионного тока (SCAN). Для идентификации анализируемых соединений использовали библиотеки масс-спектров NIST08 и WILEY7, а также проводили сравнение с аутентичными образцами дибутилфталата (“Реахим”, Россия), бис(2-этилгексил)фталата (синоним – диоктилфталат) и диэтилфталата (“Sigma–Aldrich”, Германия). Аналитическая работа выполнена на оборудовании ЦКП “Биоаналитика” СИФИБР СО РАН (г. Иркутск).
Статистическая обработка данных. Полученные данные статистически обработаны и на рис. 1 и в табл. 1 приведены средние величины и стандартные отклонения для них, которые получены в 3-х независимых экспериментах.
Рис. 1.
Влияние инокуляции монокультурами Rhizobium leguminosarum bv. viceae и Pseudomonas syringae bv. pisi и совместного действия данных бактерий на содержание негативных аллелопатических соединений в среде роста корней проростков гороха через 1 сут после инокуляции, варианты: 1 – инокуляция Rhizobium leguminosarum bv. viceae, 2 – Pseudomonas syringae bv. pisi, 3 – обоими видами бактерий, контроль – неинокулированные проростки. N-ФНА – N-фенил-2-нафтиламин; ДФт – дибутилфталат.
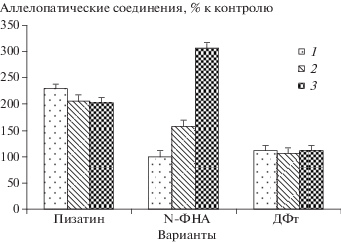
Таблица 1.
Состав и показатели времени удерживания (tуд) и степени вероятности (Ver, %) для фталатов в экстрактах из водной среды роста корней проростков гороха
| Соединение | tуд, мин | Ver, % | Относительная площадь пика, % | |||
|---|---|---|---|---|---|---|
| контроль | Rhizobium | Pseudomonas | Rhizobium + + Pseudomonas | |||
| Диэтилфталат | 14.2 | 80.0 | 32.2 ± 9.7 | 23.0 ± 5.1 | 13.0 ± 0.9 | 4.6 ± 0.5 |
| Бутил-тетрадецил фталат | 19.7 | 16.6 | 3.6 ± 0.1 | 3.4 ± 0.4 | 2.7 ± 0.3 | 3.2 ± 0.1 |
| Дибутилфталат | 21.6 | 34.8 | 100 | 100 | 100 | 98.5 ± 1.7 |
| Диоктилфталат | 31.5 | 70. 7 | 99.9 ± 0.8 | 92.6 ± 5.0 | 85.6 ± 9.0 | 90.6 ± 9.4 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При анализе полученных методом ВЭЖХ данных показано, что общее количество негативных аллелопатических соединений в экссудатах контрольного варианта составило 13.2 нмоль/растение. Инокуляция монокультурами R. leguminosarum bv. viceae и P. syringae pv. pisi усиливала выделение корнями во внешнюю среду этих соединений почти в 1.5 раза, а совместное их действие на корни проростков – в 1.8 раза (рис. 1). Можно видеть, что содержание пизатина в экссудатах повышалось по сравнению с контролем практически одинаково во всех вариантах инокуляции – более чем в 2.0 раза. Хотя при инокуляции ризобиями оно было немного больше, чем при действии бактерий в 2-х других вариантах инокуляции. Существенными оказались различия эффекта влияния бактерий в 3-х вариантах инокуляции на содержание в экссудатах N-фенил-2-нафтиламина. Относительно контроля при инокуляции ризобиями его содержание в экссудатах было неизменным, но возросло в 1.6 раза под влиянием псевдомонад и в 3.1 раза – при совместной инокуляции обоими видами бактерий.
При увеличении содержания N-фенил-2-нафтиламина в ризосфере возможно усиление его аккумуляции в бактериальных клетках и, вследствие этого, могут происходить негативные изменения в мембранных структурах этих организмов [24]. Этим явлениям способствуют хорошо известные физико-химические свойства N-фенил-2-нафтиламина, как его высокая липофильность, которая обусловливает легкость проникновения в мембраны, и высокая антиоксидантная активность, которая является свидетельством его значительной реагенности [24, 25]. Следовательно, его негативный эффект на ризосферную микробиоту должен прямо зависеть от количества N-фенил-2-нафтиламина в корневых экссудатах. Ухудшения условий для существования бактерий в прикорневой зоне проростков гороха возможны при инокуляции псевдомонадами и при их совместной инокуляции с ризобиями. Основанием для данного предположения является повышение содержания обсуждаемого соединения в экссудатах этих растений вышеуказанных вариантов инокуляции (рис. 1).
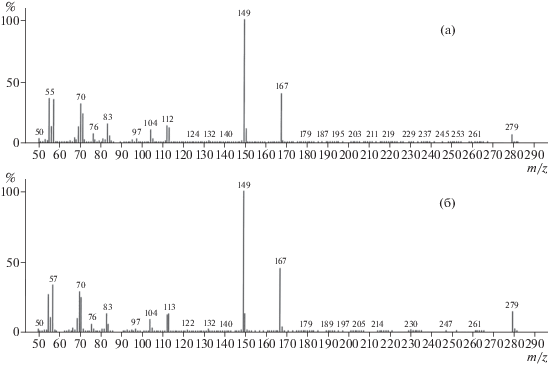
В корневых экссудатах проростков гороха присутствовали фталаты 4-х видов (табл. 1). Для дибутил- и диоктилфталатов на рис. 2, 3 приведены ионные спектры, подтверждающие их структуру. Наличие в экссудатах диэтилфталата также установили методом ГХ-МС-анализа, сопоставив ионные спектры для аутентичного образца и для найденного в составе экссудатов, а также провели сравнение с данными из библиотеки масс-спектров. Бутил-тетрадецил фталат, соединение с разноцепочечными спиртами, образующими эфирные связи с о-фталевой кислотой, идентифицировано с невысокой степенью вероятности (табл. 1) по данным библиотеки масс-спектров NIST08.
Рис. 2.
Масс-спектры дибутилфталата, представленного в библиотеке масс-спектров “NIST” (а) и для выделенного из корневых экссудатов проростков гороха (б). По оси ординат – интенсивность сигнала, %.
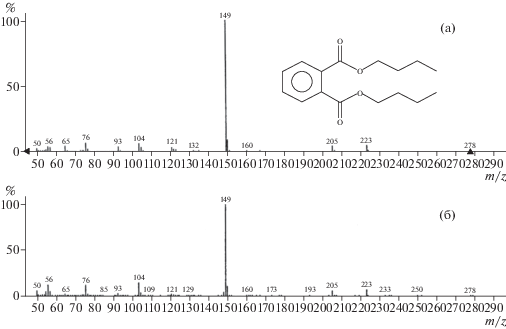
Рис. 3.
Масс-спектры для бис(2-этилгексил)фталата (диоктилфталат), аутентичного образца (а) и для выделенного из корневых экссудатов проростков гороха (б). По оси ординат – интенсивность сигнала, %.
Можно констатировать, что в экссудатах дибутилфталат доминировал относительно содержания других видов фталатов. По долевому содержанию диоктилфталат приближался к дибутилфталату, а диэтилфталат при своем максимальном содержании составлял всего лишь 1/3 от содержания последнего. Под действием бактерий в экссудатах уменьшалось количество диоктил- и диэтилфталатов. Но при этом для диоктилфталата снижение содержания относительно контроля было мало заметным, а более выраженным оно было для диэтилфталата. Менее всего количество диэтилфталата уменьшалось при инокуляции ризобиями, наиболее – при совместной инокуляции изученными видами бактерий. Содержание бутил-тетрадецил фталата, по сравнению с другими видами фталатов, было невелико и практически одинаковым в экссудатах контроля и во всех вариантах инокуляции проростков.
Ранее было показано, что оба использованных в наших экспериментах вида бактерий способны деградировать N-фенил-2-нафтиламин с образованием фталатов и преобразовывать одни виды фталатов в другие [19, 26]. Небольшое увеличение уровня дибутилфталата в ответ на инокуляцию бактериями (рис. 1) можно использовать как подтверждение деградации данными микроорганизмами N-фенил-2-нафтиламина до фталатов. Но при этом пока не представляется возможным объяснить причины понижения под влиянием бактерий долевого содержания диэтил- и диоктилфталатов (табл. 1). Не исключено, что в этом случае имеет место упомянутый выше процесс преобразования фталатов.
Вопрос о регуляторной роли фталатов в ризосфере растений, секретирующих их во внешнюю среду, может иметь ответ в результатах исследований, раскрывших действие фталатов в качестве ингибиторов роста бактерий [14, 27–29]. Было показано, что степень негативного эффекта фталатов определяется не только концентрацией их в среде, но и видом алкильных группировок в их молекулах, которые соединены эфирной связью с о-фталевой кислотой, а также зависит от вида бактерий, испытывающих их действие. Антибиотические свойства диоктилфталата по отношению к достаточно широкому ряду бактерий продемонстрированы в работе [27]. Роль высокотоксичного диэтилфталата в негативной регуляции растительно-микробных взаимодействий, по-видимому, может определяться его деструктирующим действием на липопротеиновые системы живых клеток [30]. Тем не менее, многие микроорганизмы способны использовать различные эфиры орто-фталевой кислоты в качестве единственного источника углерода и энергии, что дает им определенные селективные преимущества [31].
В работе [29] отмечено неоднозначное действие представителей фталатов на рост бактерий в планктонной культуре и в биопленках. Следовательно, можно полагать, что возникающие под влиянием бактерий изменения в составе фталатов будут иметь неодинаковое значение для регуляции состава микробиоты в экторизосфере и в ризоплане растения, где различен образ существования бактерий (свободное существование в экторизосфере и переход в состояние биопленки в ризоплане).
ЗАКЛЮЧЕНИЕ
Показано, что различные по типу взаимодействия с растениями гороха бактерии (мутуалист и антагонист) неодинаково влияли на содержание в экссудатах некоторых из соединений, могущих подавлять рост микроорганизмов. Исследованные виды бактерий – Rhizobium leguminosarum bv. viceae (мутуалист) и Pseudomonas syringae pv. pisi (антагонист), вызывали двукратное увеличение содержания пизатина в корневых экссудатах проростков гороха. Указанное выше повышение содержания пизатина практически не зависело от того, вносили в среду роста корней данные виды бактерий раздельно или одновременно. На содержание N-фенил-2-нафтиламина в экссудатах не повлияли ризобии, а инокуляция псевдомонадами и одновременное действие этих 2-х видов бактерий его увеличили соответственно в 1.6 и 3.1 раза. Во всех вариантах инокуляции содержание дибутилфталата в экссудатах возросло незначительно.
В составе фталатов после инокуляции произошли изменения в соотношениях между присутствовавшими среди них видами. В частности, обнаружено снижение, в сравнении с контролем, содержания диоктил- и диэтилфталатов. При этом содержание диэтилфталата изменялось более заметно. Количество его в экссудатах уменьшалось минимально при инокуляции ризобиями, максимально – при совместном действии ризобий и псевдомонад на проростки.
Приведенные в работе данные позволили заключить, что вместе с фитоалексином пизатином перспектива участия в негативной регуляции роста бактериальных клеток в ризосфере проростков гороха у N-фенил-2-нафтиламина и фталатов, присутствующих в корневых экссудатах бобовых растений, вполне реальна. Роль в указанной регуляции N-фенил-2-нафтиламина вследствие повышения его содержания в корневых экссудатах может возрастать при инокуляции псевдомонадами и вероятно в наибольшей мере при совместном воздействии ризобий и псевдомонад на корни проростков гороха.
Список литературы
Kato K., Arima Y., Hirata H. Effect of exudate released from seeds and seedling roots of common bean (Phaseolus vulgaris L.) on prolifiration of Rhizobium sp. (Paseolus) // Soil Sci. Plant Nutr. 1997. V. 43(2). P. 275–283.
Dennis P.G., Miller A.J., Hirsh P.R. Are root exudates more important than other sources of rhizodeposits in structuring rhizosphere bacterial communities? // FEMS Microbiol Ecol. 2010. V. 72. № 3. P. 313–327.
Li X., Zhang T., Wang X., Hua K., Zhao l., Han Z. The composition of root exudates from two different resistant peanut cultivars and their effects on the growth of soil-borne pathogen // Inter. J. Biol. Sci. 2013. V. 9(2). P. 164–173.
Шапошников А.И., Пухальский Я.В., Кравченко Л.В., Белимов А.А. Роль корневой экссудации в трофических взаимодействиях растений с ризосферными микроорганизмами / Под ред. Тихоновича И.А. СПб.: Информ-Навигатор, 2016. 104 с.
Vanĉura V., Hanzikova A. Root exudates of plants: IV. Differences in chemical composition of seed and seedlings exudates // Plant and Soil. 1972. V. 36. № 2. P. 271–282.
Azaizeh H.A., Marschner H., Römheld V., Wittenmaer L. Effects of vesicular-arbuscular mycorrizal fungus and other soil microorganisms on growth, mineral nutrient acquisition and root exudation of soil-grown maize plants // Mycorrhiza. 1995. V. 5. № 5. P. 321–327.
Hirsch A.M., Lum M.R., Downie J.A. What Makes the rhizobia-legume symbiosis so special? // Plant Physiol.2001. V. 127. № 4. P. 1484–1492.
Cooper J.E. Early interactions between legumes and rhizobia: disclosing complexity in a molecular dialogue // J. Appl. Microbiol. 2007. V. 108. № 5. P. 1355–1365.
Dacora F.D. Defining new roles for plant and rhizobial molecules in sole and mixed plant cultures involving symbiotic legumes // New Phytologist. 2003. V. 18. № 1. P. 39–49.
Mergaert P., Uchiumi T., Alunni B., Evanno G., Cheron A., Catrice O., Mausset A.-E., Barloy-Hubler F., Galibert F., Kondorosi A., Kondorosi E. Eukaryotic control on bacterial cell cycle and differention in the Rhizobium-legume symbiosis // PNAS. 2006. V. 103. № 13. P. 5230–5235.
Mira L., Fernandez M.T., Santos M., Rocha R., Flořencio M.H., Jennings K.R. Interactions of flavonoids with iron and copper ions: a mechanism for their antioxidant activity // Free Radic. Res. 2002. V. 36. № 11. P. 1199–1208.
Psotová J., Lasovsky J., Vičar J. Metal-chelating properties, electrochemical behavior, scavenging and cytoprotective activities of six natural phenolics // Biomed. Paperts. 2003. V. 147. № 2. P. 147–153.
Makoi J.H.R., Ndakidemi P.A. Biological, ecological and agronomic significance of plant phenolic compounds in rhizosphere of the symbiotic legumes // Afric. J. Biotechnol. 2007. V. 6(12). P. 1358–1368.
Макарова Л.Е., Смирнов В.И., Клыба Л.В., Петрова И.Г., Дударева Л.В. Роль аллелопатических соединений в регуляции и формировании бобово-ризобиального симбиоза // Прикл. биохим. и микробиол. 2012. Т. 48. № 4. С. 394–403.
Макарова Л.Е., Дударева Л.В., Петрова И.Г., Васильева Г.Г. Выделение фенольных соединений в экссудаты корней проростков гороха при инокуляции Rhizobium leguminosarum bv. viceae и Pseudomonas siringae pv. pisi // Прикл. биохим. и микробиол. 2016. Т. 52. № 2. С. 306–311.
Пастухова Е.С., Егорова Д.О., Ястребова О.В., Плотникова Е.Г. Бактерии-деструкторы орто-фталевой кислоты, выделенные из отходов калийного производства // Вестн. Перм. ун-та. Биология. 2010. Вып. 3. С. 24–28.
Makarova L.E., Dudareva L.V., Petrova I.G. The content of phenolic compounds in the pea seedling root exudates depends on size of their roots and inoculation of bacteria mutualistic and antagonistic type of interactions // J. Stress Physiol. Biochem. 2015. V. 11. № 3. P. 94–103.
Макарова Л.Е., Дударева Л.В. Регуляция бобово-ризобиального симбиоза при различных температурах и участии N-фенил-2-нафтиламина // Агрохимия. 2013. № 9. С. 59–64.
Макарова Л.Е., Мориц А.С., Соколова Н.А., Нестеркина И.С. Исследование состава фталатов в корневых экссудатах проростков гороха, инокулированных Rhizobium leguminosarum bv. viceae и Pseudomonas syringae pv. pisi при разных температурах // Сб. мат-лов Годичного собрания ОФР, Всеросс. научн. конф. В 2-х частях. Иркутск: Ин-т географии им. В.Б. Сочавы СО РАН, 2018. С. 488–492. https://doi.org/10.31255/978-5-94797-319-8-488-491
Benito P., Alonso-Vega P., Aguado C., Luján R., Anzai Y., Hirsch A.M., Trujillo M.E. Monitoring the colonization and infection of legume nodules by Micromonospora in co-inoculation experiments with rhizobia // Sci. Reports. 2017. 7:11051. https://doi.org/10.1038/s41598-017-11428-1
Muresu R., Polone E., Sulas L., Baldan B., Tondello A., Delogu G., Cappuccinelli P., Alberghini S., Benhizia Y., Benhizia H., Benguedouar A., Mori B., Calamassi R., Dazzo F.B., Squartini A. Coexistence of predominantly noncultur able rhizobia with diverse, endophytic bacterial taxa within nodules of wild legumes // FEMS Microbiol Ecol. 2008. V. 6. № 3. P. 383–400.
Ломоватская Л.А., Кузакова О.В., Романенко А.С., Гончарова А.М. Активность аденилатциклаз и изменение концентрации цАМФ в клетках корня проростков гороха при инфицировании мутуалистами и фитопатогенами // Физиология растений. 2018. Т. 65. № 4. С. 310–320.
Берестецкий В.А. Методические рекомендации по получению новых штаммов Rhizobium leguminosarum и оценки их эффективности. Л.: ВНИИСХМ, 1976. 31 с.
Altenburger R., Brack W., Greco W.R., Groot M., Jung K., Ovari A., Riedl J., Schwab K., Kữster E. On the mode of action of N-phenyl-2-naphthylamine in plants // Environ. Sci. Technol. 2006. V. 40. № 19. P. 6163–6169.
Marek E.V., Koslitz S., Weiss T., Fartasch M., Schlüter G., Käfferlein H.U., Brüning T. Quantification of N-phenyl-2-naphthylamine by gas chromatography and isotope-dilution mass spectrometry and its percutaneous absorption ex vivo under workplace conditions // Arch. Toxicol. 2017. V. 91. № 11. P. 3587–3596.
Макарова Л.Е., Мориц А.С. Деградация N-фенил-2-нафтиламина, присутствующего в корневых экссудатах бобовых растений, ризосферными бактериями разных видов // Сб. научн. ст. по мат-лам X Международ. симп. “Фенольные соединения: фундаментальные и прикладные аспекты”. М.: PRESS-BOOK.RU, 2018. С. 258–262.
Kim S.-J., Kim S.-I., Han Y.-S. Isolation and identification of antimicrobial compound from green laver (Enteromorpha linza) // Corean J. Gerontol. 1997. V. 7. № 3. P. 70–76.
Alim Al-Bari M.A., Sayeed M.A., Rahman M.S., Mossadik M.A. Characterization and antimicrobial activities of a phthalic acid derivative producted by Streptomyces bangladeshiensis a novel species collected in Bangladesh // Res. J. Med. Sci. 2006. V. 1. № 2. P. 77–81.
Шафикова Т.Н., Омеличкина Ю.В., Еникеев А.Г., Бояркина С.В., Гвильдис Д.Э., Семенов А.А. Эфиры орто-фталевой кислоты подавляют способность фитопатогенов образовывать биопленки // Докл. РАН. 2018. Т. 480. № 3. С. 381–383.
Kim S.M., Yoo J.A., Baek J.M., Cho K.H. Diethyl phthalate exposure is associated with embryonic toxicity, fatty liver changes, and hypolipidemia via impairment of lipoprotein functions // Toxicol. in vitro. 2015. V. 30. Is. 1. Part B. P. 383–393.
Liang D.-W., Zhang T., Fang H.H.P., He J. Phthalates biodegradation in the environment // Appl. Microbiol. Biotechnol. 2008. V. 80. № 2. P. 183–198.
Дополнительные материалы отсутствуют.


