Агрохимия, 2019, № 12, стр. 22-31
ВЛИЯНИЕ БИОПРЕПАРАТОВ НА ОСНОВЕ АССОЦИАТИВНЫХ БАКТЕРИЙ НА МИКРОБИОЛОГИЧЕСКУЮ АКТИВНОСТЬ ЧЕРНОЗЕМА СЕГРЕГАЦИОННОГО
А. Ю. Чевердин 1, *, Ю. И. Чевердин 1, В. И. Турусов 1
1 Научно-исследовательский институт сельского хозяйства Центрально-Черноземной полосы им. В.В. Докучаева
397463 Воронежская обл., п/о Институт им. Докучаева, уч. 2, Таловский р-н, Российская Федерация
* E-mail: cheverdin62@mail.ru
Поступила в редакцию 20.02.2019
После доработки 10.04.2019
Принята к публикации 10.09.2019
Аннотация
В условиях Центрального Черноземья изучено изменение микробиологической активности чернозема сегрегационного под влиянием штаммов ассоциативных бактерий. Установлено, что отдельные показатели биологической активности почвы зависели от примененных ризобактерий. Положительный эффект активизации микробиологической активности отмечен как в варианте без удобрения, так и на фоне предпосевного использования азотного удобрения в дозе N30. Бактериальные препараты оказали положительное влияние на численность аммонификаторов, актиномицетов, микромицетов, минерализаторов гумуса. На естественном фоне ассоциативные штаммы увеличивали количество бактерий-нитрификаторов. Численность колоний азотобактера снижалась независимо от фона минерального питания.
ВВЕДЕНИЕ
Микробиологическая активность почвы во многом зависит от интенсивности сельскохозяйственной деятельности и применяемых технологических приемов [1–4]. Оценка показателей биогенности почв может быть использована как для раскрытия генезиса почв, так и в прикладных производственных целях [5, 6]. Микробное сообщество почвы является важным компонентом формирования плодородия и развития сельскохозяйственных растений [7, 8].
Активность почвенной микрофлоры в ризоплане растений во многом определяет доступность и обеспеченность растений биогенными элементами. Микроорганизмы, развивающиеся в корневой зоне, повышают количество не только минеральных элементов, но и стимулируют развитие растений за счет продукции физиологических активных веществ – витаминов и фитогормонов [9].
Отмечено существенное увеличение количества микрофлоры под влиянием ризобактерий [10]. Ризосферные бактерии могут стать мощным инструментом в современных агробиотехнологиях [11–13], повышающих урожайность и обеспеченность элементами минерального питания [14–21]. Показан существенный рост биологической активности почвы при использовании микробных препаратов [22]. При этом суммарная биомасса микроорганизмов и растительных остатков является основным источником потенциально мобилизуемого азота в почве [23]. Отмечено пролонгированное действие микробных препаратов (альбит, фитоспорин) на увеличение продуктивности, обусловленное усилением биохимических и микробиологических процессов в почве [24].
Микробные диазотрофные препараты при определенных условиях способствуют поддержанию бездефицитного баланса азота в почве [25, 26]. Показана их положительная роль в увеличении корневой массы растений [27].
Наличие в почве достаточного количества усвояемого углерода способствует активному включению азота корневых выделений в устойчивые фракции органического вещества – гумина. Корневые выделения не только стимулируют мобилизационные процессы, но и сами участвуют в процессах трансформации азота в почве [28].
Для большинства пахотных почв характерно низкое содержание активного органического вещества [29]. Предпосевная инокуляция семян биопрепаратами, увеличивая общий объем пожнивно-корневых остатков, способствует накоплению гумуса в пахотном слое в количестве от 1.0 до 2.7 т/га [30].
Цель работы – оценка изменения структуры микробного ценоза чернозема сегрегационного под посевами ярового ячменя при предпосевной инокуляции посевного материала активными штаммами ассоциативных бактерий.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследование проведено в условиях Центрального Черноземья в 2015–2018 гг. в НИИСХ ЦЧП им. В.В. Докучаева, географические координаты места проведения – 51.024109 с.ш. и 40.732875 в.д. Объектом исследования являлся чернозем сегрегационный среднемощный среднегумусовый на карбонатных лёссовидных суглинках со следующей агрохимической характеристикой: гумус – 6.1–6.5%, обменно-поглощенный кальций – 20.3–22.0 ммоль экв/100 г почвы, обменно-поглощенный магний – 5.4–6.0 ммоль экв/100 г, общий азот – 0.275%, валовой фосфор – 0.164%, валовой калий – 1.86%, рН$_{{{{{\text{Н}}}_{{\text{2}}}}{\text{О}}}}$ – 7.02.
Определение почвенных показателей выполнены следующими методами: содержания гумуса в почве – методом Тюрина в модификации Симакова (ГОСТ 26213-91), рН водной суспензии почвы – потенциометрическим методом; содержание подвижных элементов минерального питания в почве: нитратного азота – дисульфофеноловым методом, подвижного фосфора и обменного калия – по Чирикову из одной вытяжки (ГОСТ 26204-91), обменных кальция и магния – трилонометрическим методом. Вытеснение обменных катионов кальция и магния провели хлористым натрием по методике Почвенного института. Содержание общего азота (в %) определяли по Гинзбург, общего фосфора (в %) – по Гинзбург и Щегловой (ГОСТ 26261-84), общего калия (в %) – по Ожигову.
Исследование проведено в посевах ярового ячменя в двухфакторном полевом опыте. Фактор 1-го порядка – уровни минерального питания (естественный неудобренный фон и N30), фактор 2-го порядка – штаммы ассоциативных бактерий. Минеральные удобрения в форме Naa вносили вручную непосредственно под предпосевную культивацию из расчета N30.
Технология возделывания ячменя в опытах была общепринятой для Центрального Черноземья. Химические средства для борьбы с сорной растительностью и вредными объектами не использовали. Удаление сорняков в целях исключения негативного влияния химических средств осуществляли с помощью ручных прополок. Сорт ячменя – Таловский 9, районированный в Воронежской обл., норма высева – 5.0 млн всхожих семян/га, срок посева – 3-я декада апреля, посевная площадь делянки 5.0 м2, повторность шестикратная, предшественник – озимые зерновые. Основную обработку почвы провели осенью после уборки предшественника – вспашка на 20–22 см. Весной после наступления физической спелости почвы проводили ранневесеннее боронование и в последующем – предпосевную культивацию на глубину 4–6 см, посев – сеялкой СУ‑10. Уборку посевов при наступлении полной спелости ячменя (3-я декада июня) осуществляли комбайном ХЕГЕ.
Перед посевом семена инокулировали активными штаммами ассоциативных бактерий. Были использованы следующие препараты: штамм 8 азоризин – бактериальный препарат, созданный на основе штаммов, относящихся к роду Azospirillum, относится к диазотрофам [31]; штамм 18-5 на основе Pseudomonas sp., штамм 17-1 – на основе Pseudomonas sp, не являются диазотрофами [32]. Семена обрабатывали активными штаммами бактерий в день посева. Препараты получены из ВНИИ сельскохозяйственной микробиологии.
Почвенные образцы отбирали слоя из 0–20 см почвы из прикорневой зоны растений в 5-кратной повторности и формировали смешанный образец. Срок отбора – фаза трубкования–начало колошения (первая половина июня).
Анализ основных физиологических групп почвенных проводили по методике ВНИИ сельскохозяйственной микробиологии путем высева почвенной суспензии определенных разведений на элективные питательные среды [33]. Бактерии, принимающие участие в ассимиляции органических форм азота, учитывали на мясо-пептонном агаре (МПА), актиномицеты и бактерии, использующие минеральный азот – на крахмало-аммиачном агаре (КАА); грибы – на подкисленной среде Чапека, азотобактер – на почвенных пластинах, целлюлозоразлагающие микроорганизмы – на среде Виноградского с фильтрами, нитрифицирующие бактерии – на выщелоченном агаре, минерализаторы гумуса – на нитратном агаре [33].
Для оценки изменения направленности микробиологических процессов трансформации органического вещества был рассчитан коэффициент трансформации органического вещества (Пм) [34], показывающий направленность процессов гумусообразования. Его рассчитывают по формуле: Пм = (МПА + КАА) × (МПА/КАА), где Пм – коэффициент трансформации органического вещества, МПА – количество микроорганизмов аммонификаторов, КАА – численность микроорганизмов, использующих минеральные формы азота.
Статистическую обработку и корреляционный анализ результатов выполнили в программе Exсel. Для расчета коэффициентов корреляции использованы данные определения микробиологической активности почвы и содержание биогенных элементов питания в соответствующие фазы развития растений ярового ячменя.
В годы проведения исследования гидротермические условия складывались не совсем благоприятно. Проведенный анализ гидротермических условий показал довольно значительное отклонение от среднемноголетних показателей. При этом, не смотря на достаточно высокий уровень атмосферного увлажнения, растения испытывали негативное влияние, обусловленное высокими температурами.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Живые организмы и их метаболиты могут стать источником важнейшей информации об актуальном состоянии почвы и происходящих в ней изменениях [35–37]. Негативные процессы, происходящие в микробном сообществе пахотных почв, являются индикатором нарушения функционального потенциала почвенной микрофлоры [38].
Процесс разложения азотсодержащих соединений с выделением аммиака называется аммонификацией. Аммонификация имеет важное значение для питания растения. Процесс этот осуществляется бактериями в аэробных и анаэробных условиях [39]. В почвенной среде обитает большое разнообразие микроорганизмов, разлагающих органические азотсодержащие вещества с образованием аммиака (конечного продукта распада) [40]. Микроорганизмы, произрастающие на среде МПА, принимают участие в трансформации органических форм азота. Эта группа микроорганизмов вносит значительный вклад в иммобилизацию легкодоступного углерода.
Предпосевная инокуляция семян ячменя повлияла на направленность микробиологических процессов и численность отдельных физиологических групп. Результаты исследования вполне однозначно позволили утверждать о наличии определенных изменений в активности аммонификаторов под влиянием ризобактерий. Учет их количества свидетельствовал о положительном влиянии инокуляции на активность этой группы микроорганизмов. При применении штаммов A. brasilense 204, Pseudomonas sp. 18-5 и 17-1 для инокуляции семян ячменя на естественном фоне минерального питания в среднем за годы исследования отмечено увеличение численности аммонификаторов от 5.4 до 41.0% (табл. 1).
Таблица 1.
Численность основных физиологических групп микроорганизмов под посевами ярового ячменя при инокуляции семян ассоциативными бактериями, (2015–2018 гг.)
| Фон удобренности | Вариант | Численность | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| млн КОЕ/г почвы | тыс. КОЕ/г почвы | тыс. КОЭ/50 г почвы | ||||||||
| МПА | КАА | актиномицеты | минерализаторы гумуса | грибы | целлюлозо- литические | нитрификаторы | азотобактер | |||
| Без удобрений | Контроль | 7.51 ± 1.51 | 16.5 ± 0.7 | 2.87 ± 0.15 | 7.40 ± 1.20 | 25.1 ± 0.8 | 54.6 ± 1.8 | 0.41 ± 0.03 | 297 ± 24 | |
| Штамм 8 | 8.38 ± 1.20 | 16.3 ± 1.3 | 2.98 ± 0.15 | 10.5 ± 1.4 | 33.7 ± 2.2 | 59.0 ± 3.0 | 0.42 ± 0.01 | 264 ± 22 | ||
| Штамм 17-1 | 10.6 ± 1.0 | 20.7 ± 0.8 | 3.25 ± 0.15 | 12.1 ± 1.2 | 32.3 ± 1.9 | 61.5 ± 3.5 | 0.47 ± 0.03 | 244 ± 28 | ||
| Штамм 18-5 | 7.92 ± 0.71 | 17.7 ± 1.0 | 2.75 ± 0.19 | 10.5 ± 1.1 | 42.9 ± 2.8 | 64.1 ± 3.3 | 0.46 ± 0.03 | 224 ± 22 | ||
| Среднее | 8.6 | 17.8 | 3.0 | 10.1 | 33.8 | 59.8 | 0.44 | 257 | ||
| N30 | Контроль | 7.86 ± 1.02 | 17.9 ± 0.2 | 2.67 ± 0.07 | 9.19 ± 1.19 | 30.9 ± 0.7 | 60.7 ± 2.2 | 0.44 ± 0.03 | 267 ± 28 | |
| Штамм 8 | 9.10 ± 1.20 | 16.4 ± 1.0 | 2.78 ± 0.05 | 11.9 ± 1.3 | 41.3 ± 3.2 | 73.5 ± 3.3 | 0.45 ± 0.02 | 233 ± 24 | ||
| Штамм 17-1 | 8.78 ± 1.04 | 19.8 ± 1.2 | 2.83 ± 0.06 | 13.1 ± 0.7 | 34.6 ± 3.1 | 64.8 ± 3.0 | 0.42 ± 0.03 | 202 ± 29 | ||
| Штамм 18-5 | 9.36 ± 1.11 | 18.1 ± 0.8 | 2.88 ± 0.05 | 13.1 ± 0.5 | 34.9 ± 1.7 | 71.8 ± 2.7 | 0.52 ± 0.03 | 257 ± 24 | ||
| Среднее | 8.78 | 18.0 | 2.79 | 11.8 | 35.4 | 67.7 | 0.46 | 240 | ||
Заметное увеличение численности аммонификаторов прослежено при дополнительном использовании минерального азота для улучшения корневого питания растений. Рост их численности в среднем на удобренном фоне составил 0.18 млн КОЕ/г. Азотное удобрение в чистом виде (вариант без инокуляции) повышало количество аммонификаторов на 0.35 млн КОЕ/г.
Использование ассоциативных штаммов на фоне минерального азота способствовало дальнейшему росту количества аммонификаторов. Увеличение их численности по отношению к контролю (семена без инокуляции) составило от 11.7 до 19.1% или на 0.92–1.50 млн КОЕ/г. Более высокая их активность отмечена при применении штаммов 8 и 18-5 на основе бактерий Azospirillum и Pseudomonas sp. соответственно.
Увеличение численности аммонификаторов, по нашему мнению, связано с формированием большей корневой массы растений ячменя в опытных вариантах. Корневые экссудаты растений служат хорошей средой для развития аммонификаторов. Определение массы корневых остатков в фазе спелости ячменя показало увеличение их объема до 30% под воздействием инокулянтов.
Улучшение условий корневого питания за счет дополнительного внесения минерального азота вызвало активизацию деятельности микроорганизмов, произрастающих на среде КАА с использованием минеральных форм азота. Увеличение их количества было характерно как для естественного фона минерального питания, так и при дополнительном использовании азотного удобрения. Причем несколько более высокие показатели численности данной группы микроорганизмов отмечены в вариантах сочетания минерального азота с инокуляцией семян. В среднем в удобренном варианте превышение численности микроорганизмов, использующих минеральный азот, составило 0.22 млн КОЕ/1 г почвы (табл. 1). При этом азотное удобрение в чистом виде повышало их численность на 1.43 млн КОЕ/г (с 16.5 до 17.9).
Более высокое относительное повышение численности бактерий, произрастающих на крахмало-аммиачном агаре, прослежено в варианте без удобрений – на 7.3–25.8%, на фоне азотного удобрения оно было несколько меньше (на 1.3–10.5%). Необходимо отметить также такую особенность, как низкую активность при инокуляции штаммом A. brasilense 8 на обоих фонах минерального питания.
Таким образом, применение минерального азота оказывало положительное влияние на активность этой группы микроорганизмов. Можно предположить, что микроорганизмы, использующие органические и минеральные формы, находятся в определенной корреляционной зависимости. Проведенный анализ установил отрицательный коэффициент корреляции только для удобренного фона, который равнялся r = –0.50 ± ± 0.11 при tфакт = 4.54 > tтеор = 2.68. В варианте без удобрений коэффициент корреляции составил всего r = 0.10.
На наш взгляд, главное значение во влиянии ассоциативных бактерий на биологическую активность чернозема сегрегационного имело изменение направленности микробиологических процессов трансформации органического вещества в сторону развития процесса гумусонакопления. О нем можно судить по предложенному в работе [34] коэффициенту трансформации Пм = = (МПА + КАА) × (МПА/КАА). В нашем исследовании обработка штаммами ассоциативных бактерий повышала коэффициент трансформации независимо от фона минерального питания (табл. 2). При этом наиболее заметно роль микробных препаратов прослежена на фоне минерального азота. В неудобренном варианте (контроль) Пм был равен 10.9. При предпосевной инокуляции штаммами 8 и 17-1 он повысился до 12.7 и 16.0 соответственно. При использовании штамма Pseudomonas sp. 18-5 отмечена тенденция увеличения коэффициента трансформации органического вещества, но в несколько меньших размерах – до 11.5.
Таблица 2.
Коэффициент трансформации растительных остатков в органическое вещество почвы (2015–2018 гг.)
| Вариант | Без удобрения | N30 |
|---|---|---|
| Контроль | 10.9 | 11.3 |
| Штамм 8 | 12.7 | 14.2 |
| Штамм 17-1 | 16.0 | 12.7 |
| Штамм 18-5 | 11.5 | 14.2 |
| Среднее | 12.8 | 13.1 |
При использовании минерального азота было также отмечено положительное влияние всех штаммов при более высокой величине коэффициента Пм. При этом применение минерального азотного удобрения в чистом виде оказывало незначительное положительное влияние на изменение процессов гумусонакопления (Пм увеличился с 10.9 до 11.3). Комплексное их использование с ризобактериями способствовало дальнейшей активизации микробиологических процессов, направленных на трансформацию органического вещества. Коэффициент Пм повышался до 12.7–14.2. Таким образом, ассоциативные бактерии снижают возможные риски негативного влияния минеральных удобрений на процессы накопления органического вещества в черноземах и усиливают процессы гумусонакопления.
Образующиеся в результате минерализации ионы аммония могут быть использованы во многих биологических процессах. Бактерии – нитрификаторы способствуют превращению избыточного, с точки зрения обеспечения растений элементами питания, аммония в нитрит, в дальнейшем в нитрат. Энергетические потребности нитрификаторов покрываются при окислении аммония и нитрита, источник углерода – СО2. Оптимальными экологическими условиями для них является хорошо аэрируемая и относительно бедная растворимыми органическими веществами среда с реакцией pH от 7.0 до 8.5. При снижении pH до 6.0 процессы жизнедеятельности нитрифицирующих микроорганизмов замедляются, а при pH 5.0 нитрификация прекращается. Активизация процесса нитрификации не всегда является положительным моментом. При высоком содержании, превышающим потребность растений, нитраты вымываются почвенными водами легче, чем аммоний, и это приводит к потере доступного для растений источника азота. На следующем этапе, попадая с грунтовыми водами в водоемы, нитраты вызывают дисбаланс веществ и изменение биологического равновесия в водной среде. Нитриты, образующиеся в результате этих процессов, токсичны для живых организмов.
Существенная роль в оптимизации плодородия почвы принадлежит нитрифицирующим бактериям. По нашим данным, в среднем за годы проведения исследования более заметное увеличение численности нитрифицирующих бактерий под влиянием биопрепаратов было характерно для естественного неудобренного фона – с 0.41 до 0.47 тыс. КОЕ/г или 14.6% (табл. 1). Тем самым они улучшают условия корневого питания и доступность почвенного азота культурным растениям. Применение азотных удобрений в меньшей степени увеличивало численность нитрификаторов – на 7.3%.
Комплексное использование почвенных ризобактерий с минеральным удобрением вызвало незначительное увеличение активизации жизнедеятельности нитрификаторов. Практически во всех вариантах их количество было на уровне контроля или несколько больше. Использование минерального азота часто сопровождается снижением активности нитрификаторов вследствие биологической иммобилизации азота микроорганизмами. В наших исследованиях при использовании ризобактерий в сочетании с азотным удобрением способность почвы к накоплению нитратов была в среднем больше на 9.5%. При этом необходимо отметить вариант со штаммом 18-5, в котором, как в среднем за годы исследования, так и в годы опыта, активность нитрификаторов была больше в среднем на 18.2%.
Статистический анализ показал существование отрицательной тесной корреляционной зависимости между активностью нитрификаторов и аммонификаторов: r = –0.70 ± 0.12, при tфакт = = 5.83 > tтеор = 2.68 (фон без удобрения). Для микромицетов эти величины составили: r = –0.59 ± ± 0.13 при tфакт = 4.53 > tтеор = 2.68.
Одним из показателей высокой продуктивности почв может служить наличие Azotobacter chroococcum. Он широко распространен в высокоплодородных нейтральных почвах большинства климатических зон. Azotobacter отличается более высокой потребностью во влаге, чем другие бактерии [41].
Анализ данных содержания азотобактера показал снижение его количества как под влиянием штаммов препаратов, так и при внесении минерального азота. Причем наиболее заметное уменьшение было характерно для удобренного фона. Максимальным количеством азотобактера характеризовался контрольный вариант естественного фона – в среднем 297 КОЕ/50 г почвы (табл. 1). Ассоциативные штаммы бактерий вызывали снижение их количества на 12.6–32.9%. Еще более существенные изменения численности колоний азотобактера были отмечены на удобренном фоне. В контрольном варианте (необработанные семена) количество колоний равнялось всего 267 КОЕ/50 г почвы. Предпосевная инокуляция приводила к дальнейшему снижению азотобактера до минимума: 202 КОЕ/50 г почвы (штамм 17-1). Снижение численности азотобактера на 2-х фонах минерального питания было связано, по нашему мнению, с конкуренцией между свободноживущими азотфиксаторами и отселектированными штаммами ризобактерий. Предпосевная инокуляция семян активными штаммами ассоциативных азотфиксаторов вероятно приводила к антагонизму с азотобактером. В то же время негативно влияло и азотное удобрение, примененное в небольшой дозе.
Установлена довольно тесная взаимосвязь численности азотобактера с численностью минерализаторов гумуса, целлюлозолитиками и нитрификаторами. Парные коэффициенты корреляции равнялись соответственно: r = 0.69 ± 0.12 при tфакт = 5.75 > tтеор = 2.68, r = 0.60 ± 0.13 при tфакт = = 4.62 > tтеор = 2.68 и r = 0.43 ± 0.15 при tфакт = 2.86 > > tтеор = 2.68.
Группа целлюлозоразрушающих микроорганизмов по-разному требовательна к азотсодержащим источникам питания и определяется экологическими условиями. Микроорганизмы-целлюлозолитики при низких температурах в условиях холодного климата могут развиваться в обедненных почвах с низким содержанием азота. В условиях южных регионов микроорганизмам, разрушающим клетчатку, необходимо обеспечить более высокое содержание азота. В свою очередь усиление процессов нитрификации положительно влияет на увеличение численности микроорганизмов, ответственных за деструкцию целлюлозы [42]. Наряду с этим, отмечают смену грибной микрофлоры на бактериальную. Аналогичное действие вызывает применение минеральных и органических удобрений [41].
Анализ результатов исследования показал увеличение численности бактерий-целлюлозолитиков. Более высокое общее фоновое количество было характерно для удобренного фона. В среднем за годы исследования при внесении минерального азота количество колониеобразующих единиц было равно 67.7 тыс./г почвы (табл. 1). В вариантах естественного фона удобренности численность целлюлозолитиков составила 59.8 тыс. КОЕ/г, что было меньше на 13.2%. Инокуляция семян штаммами ризобактерий оказывала положительное влияние на активность этой группы микроорганизмов, независимо от фона удобренности. В вариантах без использования минеральных удобрений увеличение численности целлюлозоразлагающих микроорганизмов варьировало в пределах от 4.39 до 9.55 тыс. КОЕ/г или было больше на 8.0–17.5%. Наиболее высокие показатели были отмечены при использовании штамма Pseudomonas sp. 18-5.
Комплексное использование штаммов микроорганизмов в сочетании с минеральным азотом способствовало дальнейшему росту активности целлюлозолитиков. Увеличение их численности по отношению к контролю (семена без инокуляции) составило 4.11–12.8 тыс. КОЕ/г (на 18.7–44.7%). Максимальное их количество отмечено при инокуляции штаммом A. brasiliense 8. Необходимо отметить, что штаммы ассоциативных микроорганизмов, использованные на естественном фоне, по своей эффективности не уступали воздействию азотных удобрений в отношении изменения численности целлюлозолитиков. Но комплексное применение ассоциативных штаммов и минерального азота имело больший эффект.
Статистический анализ показал существование средней корреляционной зависимости между численностью колоний целлюлозолитиков и азотобактера. Коэффициент парной корреляции для 2-х фонов удобренности равнялся r = 0.52 ± 0.14, при tфакт = 3.71 > tтеор = 2.68. Несколько выше была зависимость между активностью целлюлозолитиков и содержанием нитратного азота в период всходов ярового ячменя: r = 0.62 ± 0.13, при tфакт = = 4.76 > tтеор = 2.68 (для 2-х фонов удобренности).
В почвенной среде постоянно происходят взаимодополняющие процессы трансформации (минерализации и гумификации) растительно-корневых остатков. Оценка активности почвенных микроорганизмов-минерализаторов гумуса показала их существенное увеличение. В абсолютном выражении максимальное их количество отмечено на фоне предпосевного внесения азотных удобрений. Ассоциативные бактерии увеличивали активность минерализаторов гумуса при применении как в чистом виде, так и в сочетании с минеральным азотом. На фоне без азота рост численности минерализаторов варьировал от 3.13 до 4.65 млн КОЕ/г абсолютно сухой почвы (контроль – 7.40 млн КОЕ/г) (табл. 1). Максимальная активность минерализаторов гумуса отмечена при инокуляции семян штаммом Pseudomonas sp. 17-1 – 12.1 млн КОЕ/г, что превышало контрольный вариант на 62.8%. В вариантах с внесением минерального азота численность минерализаторов гумуса изменялась на более высоком уровне – в пределах от 9.19 (контроль – необработанные семена) до 13.1 млн КОЕ/ на 1 г.
Численность минерализаторов гумуса имела среднюю корреляционную зависимость с другими компонентами микробного ценоза почвы (для 2-х фонов удобренности). Коэффициент парной корреляции с количеством КОЕ азотобактера равнялся r = 0.59 ± 0.13 при tфакт = 4.54 > tтеор = = 2.68, нитрификаторов – r = 0.54 ± 0.14 при tфакт = 3.85 > tтеор= 2.68 и целлюлозолитиков – r = 0.52 ± ± 0.14 при tфакт = 3.71 > tтеор= 2.68. Также прослежена корреляционная зависимость численности минерализаторов гумуса с показателями эффективного плодородия почвы: с содержанием нитратного азота в фазе всходов (r = 0.52 ± 0.14, при tфакт = 3.71 > tтеор = 2.68) и подвижного фосфора (r = 0.47 ± 0.15, при tфакт = 3.13 > tтеор = 2.68).
В сложной переработке органического вещества активное участие принимают актиномицеты и грибы. Под термином “актиномицеты” понимают широкий круг грамположительных бактерий (более 100 родов). Значительная их часть (более 50 родов) обладает способностью к формированию ветвящегося грибоподобного мицелия, но в 5–7 раз более тонкого. Во многом деятельность актиномицетов в почвенной среде связана с процессами синтеза и разложения гумусовых веществ, балансом азота и продукцией антибиотических веществ [43].
В наших исследованиях штаммы ассоциативных микроорганизмов оказали положительное влияние на активность актиномицетов, наиболее существенно – на естественном фоне (за исключением штамма 18-5). Рост их численности составил до 13.2% (табл. 1). На удобренном фоне численность данной группы микроорганизмов оставалась практически без изменений и уступала их количеству на фоне без удобрения. В среднем на этом фоне содержание актиномицетов было на уровне 2.96 млн КОЕ/г, что несколько больше, чем на фоне с использованием минерального азота. Азот, внесенный под предпосевную культивацию в дозе N30 в варианте без инокулянтов, снижал численность данной группы микроорганизмов на 0.2 млн КОЕ/г.
Наиболее высокая активность актиномицетов была при использовании штамма Pseudomonas sp. 17-1 – 3/25 млн КОЕ/г (неудобренный фон). На фоне с минеральным азотом этот штамм также обеспечивал максимально высокое содержание по сравнению с другими препаратами – 2.83 млн КОЕ/г.
Таким образом, препараты на основе ассоциативных штаммов, изменяя биологическую активность, способствовали увеличению обеспеченности черноземов доступным углеродом. В почве заметно увеличилась численность актиномицетов, которые являются активными гидролитиками и трансформируют свежие органические остатки и корневые выделения. Эти процессы были характерны для неудобренного фона. Использование минерального азота не имело существенного влияния на эти процессы.
Микромицетам, грибам, бактериям, актиномицетам и дождевым червям отводится важная роль в минерализации корневого опада [44]. Грибы разрушают наиболее устойчивые органические соединения.
Учет количества микромицетов позволил утверждать об их существенном росте под влиянием почвенных микробных препаратов. Наиболее заметный рост их численности был характерен на естественном неудобренном фоне питания. По отношению к контролю увеличение их активности варьировало в пределах от 22.6 до 70.6% (табл. 1), при внесении минерального азота – соответственно от 12.1 до 33.8%. Общее более высокое количество грибной микрофлоры было характерно для удобренного фона – 35.4 тыс. КОЕ/г против 33.8 тыс. КОЕ/г на естественном фоне питания.
Увеличением активности микромицетов можно в некоторой степени объяснить повышение обеспеченности растений доступным фосфором. Бактерии и грибы могут растворять достаточное количество фосфата, например, из Са3(РО4)2 для своего собственного роста и освобождать избыточные ионы ортофосфата. Оксикислоты лучше других кислот растворяют апатит, предположительно потому, что они образуют хелаты с кальцием в дополнение к снижению величины рН. Некоторые бактерии образуют 2-кетоглюконовую кислоту, которая также образует хелаты с кальцием, восстанавливая, таким образом, химическое равновесие, и это уравновешивается одновременным переходом ионов фосфата в раствор, что приводит к увеличению содержания ортофосфата в почвенном растворе [43].
Статистический анализ показал существование средней корреляционной зависимости между численностью микромицетов и зольными элементами питания (в среднем для 2-х фонов удобренности). Например, коэффициент парной корреляции между активностью микромицетов и содержанием доступного фосфора в фазе колошения был равен r = 0.58 ± 0.14, при tфакт= 4.14 > tтеор= 2.68.
Между содержанием доступного калия и численностью микромицетов корреляция была отрицательной: r = –0.54 ± 0.14, при tфакт = 3.86 > tтеор = = 2.68. При этом также была отмечена средняя корреляционная связь с другими структурными единицами микробоценоза. Корреляционное отношение между количеством актиномицетов и нитрификаторами составило: r = 0.44 ± 0.15, при tфакт = 2.93 > tтеор= 2.68, активностью каталазы: r = = 0.46 ± 0.15, при tфакт = 3.07 > tтеор = 2.68.
Таким образом, в результате проведенного полевого исследования отмечено изменение микробиологической активности почвы. Характер и направленность этих изменений зависели от фона удобренности и примененных штаммов инокулянтов.
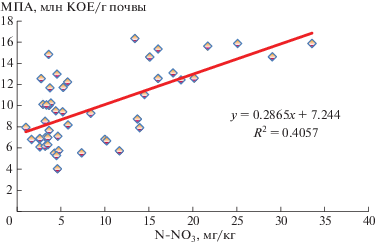
Проведенный статистический анализ позволил установить довольно тесную корреляционную зависимость между элементами структуры микробного ценоза и обеспеченностью растений биогенными элементами питания (рис. 1). Коэффициент парной корреляции связи аммонификаторов с содержанием нитратного азота варьировал в пределах r = 0.63 ± 0.14…0.74 ± 0.12. Также отмечено довольно существенное влияние нитрификаторов (r = 0.52 ± 0.10…0.66 ± 0.11) и минерализаторов гумуса (r = 0.34 ± 0.12…0.52 ± 0.13) на доступность азота для растений.
Рис. 1.
Зависимость обеспеченности почвы нитратным азотом от активности аммонификаторов, (МПА), фаза всходов (2015–2018 гг.).
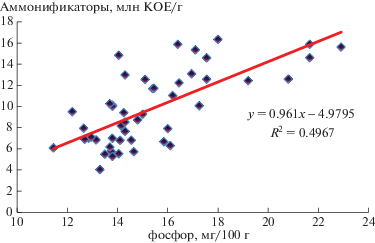
Обеспеченность почвы доступным фосфором также зависела от активности отдельных групп микробного пула. Наиболее высокий коэффициент парной корреляции отмечен между величиной содержания фосфатов и количеством аммонификаторов в фазе спелости: r = 0.70 ± 0.12 (рис. 2). Содержание микроорганизмов, использующих минеральные формы азота, в меньшей степени оказывало влияние на обеспеченность растений ячменя доступным фосфором. Коэффициент парной корреляции был равен r = 0.50 ± 0.13 в фазе колошения. На этом же уровне отмечена и связь с количеством грибной микрофлоры: r = = 0.54 ± 0.11.
ЗАКЛЮЧЕНИЕ
В условиях Центрального Черноземья, в полевом опыте на черноземе сегрегационном среднегумусном тяжелосуглинистом с яровым ячменем установлено, что предпосевная инокуляции семян ассоциативными штаммами почвенных ризобактерий оказывала влияние на численность основных физиологических групп микробного ценоза. В большей степени активизировалась деятельность аммонификаторов, минерализаторов гумуса, микромицетов, целлюлозолитиков, в меньшей – актиномицетов и нитрификаторов. Вследствие проявления антагонизма отмечено снижение численности колоний азотобактера под влиянием ризобактерий.
Расчетный коэффициент трансформации органического вещества показал стабилизацию процессов гумусонакопления под воздействием инокулянтов. При этом ризобактерии снижали негативный эффект азотного удобрения в черноземе сегрегационном и усиливали процессы гумусонакопления.
Подводя итоги изменения структуры микробного ценоза, можно отметить существенную роль биопрепаратов на основе ассоциативных ризобактерий в активизации микробиологической активности чернозема обыкновенного. Установлена довольно тесная корреляционная зависимость между отдельными группами микроорганизмов и обеспеченностью растений ярового ячменя биогенными элементами питания.
Список литературы
Маркова Н.Л., Самсонова А.С., Зименко Т.Г. Влияние органических удобрений на микрофлору загрязненной почвы // Почвоведение. 1990. № 4. С. 73–80.
Возняковская Ю.М., Попова Ж.П., Курдюков Ю.Ф., Лощинина Л.П., Круглов Ю.В. Микробиологические аспекты плодородия черноземов Поволжья // Почвоведение. 1990. № 7. С. 67–74.
Паринкина О.М., Клюева Н.В., Петрова Л.Г. Биологическая активность и эффективное плодородие почв // Почвоведение. 1993. № 9. С. 76–81.
Горобцова О.Н., Улигова Т.С., Темботов Р.Х., Хакунова Е.М. Оценка уровня биологической активности агрогенных и естественных черноземов Кабардино-Балкарии // Почвоведение. 2017. № 5. С. 614–623.
Гельцер Ю.Г. Показатели биологической активности в почвенных исследованиях // Почвоведение. 1990. № 9. С. 47–60.
Фомичева Н.В., Рабинович Г.Ю., Смирнова Ю.Д. Влияние некорневых обработок вегетирующих растений на микрофлору почвы // Вестн. Рос. сел.-хоз. науки. 2018. № 6. С. 19–23.
Иванов А.Л. Роль микробиологии в оценке почвенных ресурсов // Вестн. Рос. сел.-хоз. науки. 2015. № 6. С. 26–28.
Пинчук И.П., Полянская Л.М., Кириллова Н.П., Степанов А.Л. Особенности формирования микробного сообщества дерново-подзолистой почвы в процессе вегетации ячменя (Hordeum vulgare L.) // Почвоведение. 2018. № 12. С. 1498–1505.
Звягинцев Д.Г., Добровольская Т.Г., Бабьева И.П., Зенова Г.М., Лысак Л.В., Марфенина О.Е. Роль микроорганизмов в биогеоценотических функциях почв // Почвоведение. 1992. № 6. С. 63–77.
Хамова О.Ф., Черемисин А.И., Дергачева Н.В. Эффективность применения биопрепаратов комплексного действия при возделывании сортов картофеля в условиях южной лесостепи Западной Сибири // Агрохимия. 2016. № 9. С. 33–38.
Анохина Т.О., Сиунова Т.В., Сизова О.И., Захарченко Н.С., Кочетков В.В. Ризосферные бактерии рода Pseudomonas в современных агробиотехнологиях // Агрохимия. 2018. № 10. С. 54–66.
Соболева О.М. Роль ризосферных бактерий в повышении экологизации агроценозов // Достиж. науки и техн. АПК. 2018. Т. 32. № 5. С. 1–22.
Рябчинская Т.А., Зимина Т.В. Средства, регулирующие рост и развитие растений, в агротехнологиях современного растениеводства // Агрохимия. 2017. № 12. С. 62–92.
Кирпичников Н.А., Волков А.А., Чернышкова Л.Б., Юрков А.П., Якоби Л.М., Кожемяков А.П., Завалин А.А. Влияние фосфорных удобрений, известкования и биопрепаратов на растения ячменя и клевера в смешанном посеве // Агрохимия. 2012. № 11. С. 16–27.
Пашкевич Е.Б., Нейматов Е.Л. Влияние бактериальных препаратов на агрохимические свойства тепличного грунта и поступление элементов питания в растения розы сорта Flash Night // Агрохимия. 2012. № 7. С. 57–61.
Вильдфлуш И.Р., Цыганова А.А. Эффективность применения бактериальных препаратов, микроудобрений и регуляторов роста растений при возделывании озимой ржи на дерново-подзолистой легкосуглинистой почве // Агрохимия. 2012. № 1. С. 65–73.
Завалин А.А., Чернова Л.С., Гаврилова А.Ю., Чеботарь В.К. Влияние минеральных удобрений, биомодифицированных микробным препаратом бисолбифит, на урожай ярового ячменя // Агрохимия. 2015. № 4. С. 21–33.
Яхин О.И., Лубянов А.А., Яхин И.А. Физиологическая активность биостимуляторов и эффективность их применения // Агрохимия. 2016. № 6. С. 72–94.
Галимзянова Н.Ф., Кузьмина Л.Ю., Кудоярова Г.Р., Высоцкая Л.Б., Архипова Т.Н., Сидорова Л.В., Гуватова З.Г., Рябова А.С., Ионина В.И., Габбасова И.М., Мелентьев А.И. Влияние предпосевной бактеризации семян фосфатмобилизующими и ауксинпродуцирующими микроорганизмами на продуктивность пшеницы и подвижность почвенного фосфора в ризосфере // Агрохимия. 2018. № 4. С. 50–58.
Миннебаев Л.Ф., Рафикова Г.Ф., Четвериков С.П., Чанышев И.О., Логинов О.Н. Влияние азотфиксации несимбиотическими бактериями на содержание азота в грунте без растений // Агрохимия. 2018. № 9. С. 63–68.
Никитин С.Н., Завалин А.А. Влияние удобрений и биопрепаратов на продуктивность зернопарового севооборота, потоки элементов питания и свойства чернозема выщелоченного в лесостепи Среднего Поволжья // Агрохимия. 2017. № 6. С. 12–29.
Сулейманов С.Р., Низамов Р.М. Продуктивность подсолнечника и микробиологическая активность почвы под воздействием биопрепаратов в условиях Республики Татарстан // Достижения науки и техн. АПК. 2015. Т. 29. № 8. С. 39–42.
Семенов В.М., Кузнецова Т.В., Кудеяров В.Н. Высвобождение доступного для растений азота при минерализации активной фазы органического вещества почвы // Почвоведение. 1995. № 6. С. 732–739.
Пусенкова Л.И., Ильясова Е.Ю., Киреева Н.А. Влияние биопрепаратов на биологическую активность почвы и продуктивность сахарной свеклы // Агрохимия. 2012. № 10. С. 20–26.
Умаров М.М., Шабаев В.П., Смолин В.Ю., Мамедов Н.М. Нитрогеназная активность в ризосфере и урожай тритикале при применении азотфиксирующих смешанных культур микроорганизмов // Почвоведение. 1993. № 9. С. 70–75.
Шабаев В.П. Влияние внесения азотфиксирующей бактерии Pseudomonas putida 23 на баланс азота в почве // Почвоведение. – 010. № 4. С. 471–476.
Шабаев В.П., Бочарникова Е.А., Остроумов В.Е. Влияние ростстимулирующих ризосферных бактерий на устойчивость растений ячменя к токсическому действию кадмия при загрязнении почвы тяжелым металлом // Агрохимия. 2017. № 11. С. 67–73.
Мергель А.А., Тимченко А.В., Кудеяров В.Н. Роль корневых выделении растений в трансформации азота и углерода в почве // Почвоведение. 1996. № 10. С. 1234–1239.
Семенов В.М., Когут Б.М., Зинякова Н.Б., Масютенко Н.П., Малюкова Л.С., Лебедева Т.Н., Тулина А.С. Биологически активное органическое вещество в почвах Европейской части России // Почвоведение. 2018. № 4. С. 457–472.
Завалин А.А., Алметов Н.С., Чернова Л.С. Эффективность использования минеральных удобрений и биопрепаратов в зернотравяных севооборотах // Агрохимия. 2014. № 9. С. 35–47.
Кожемяков А., Тимофеева С. Биопрепараты комплексного действия защищают растения от болезней // Аграр. эксперт. 2007. № 2. С. 26–29.
Завалин А.А., Алметов Н.С. Применение биопрепаратов и биологический азот в земледелии Нечерноземья. М.: ВНИИА, 2009. С. 6–13.
Теппер Е.З., Шильникова В.К., Переверзева Г.И. Практикум по микробиологии. Уч. пособ. для вузов. М.: Дрофа, 2004. 256 с.
Муха В.Д. О показателях, отражающих интенсивность и направленность почвенных процессов. Харьков: Изд-во Харьков. СХИ, 1980. Т. 273. С. 13–16.
Добровольская Т.Г., Головченко А.В., Якушев А.В., Юрченко Е.Н., Манучарова Н.А., Чернов И.Ю. Бактериальные комплексы верхового торфяника в условиях различного микрорельефа // Почвоведение. 2017. № 4. С. 483–489.
Martin N.J., Siwasin J., Holding A.J. The bacterial population of a blanket peat // J. Appl. Bacteriol. 1982. V. 53. P. 35–48.
Opelt K., Chobot V., Hadacek F., Schonmann S., Eberl L., Berg G. Investigations of the structure and function of bacterial communities associated with Sphagnum mosses // Environ. Microbiol. 2007. V. 9. № 11. P. 2795–2809.
Горобцова О.Н., Гедгафова Ф.В., Улигова Т.С., Темботов Р.Х. Сравнительная оценка биологических свойств почв культурных и естественных ценозов Центрального Кавказа (на примере территорий Терского варианта поясности в пределах Кабардино-Балкарии) // Почвоведение. 2016. № 1. С. 100–106.
Звягинцев Д.Г. Почва и микроорганизмы. М.: Изд-во МГУ. 1987. 256 с.
Йожеф Сэги. Методы почвенной микробиологии / Под ред. Муромцева Г.С. М.: Колос, 1983. 296 с.
Мишустин Е.Н. Ценозы почвенных микроорганизмов // Почвенные организмы как компоненты биогеоценоза. М.: Наука, 1984. С. 5–24.
Теплякова 3.Ф. Актиномицеты горных и подгорных почв Заилийского Алатау // Физиология и экология микроорганизмов. Тр. Ин-та микробиол. и вирусол. АН КазССР. 1961. Т. 5. С. 129–138.
Зенова Г.М., Кураков А.Б. Методы определения структуры комплексов почвенных актиномицетов и грибов. М.: Изд-во МГУ, 1988. 54 с.
Аристовская Т.В. Микробиология процессов почвообразования Л., 1980. 275 с.
Дополнительные материалы отсутствуют.