РАДИОХИМИЯ, 2023, том 65, № 6, с. 557-564
УДК 546.719:546.262.3:547.828.1
«2+1Б» ТРИКАРБОНИЛЬНЫЕ КОМПЛЕКСЫ
ТЕХНЕЦИЯ-99m И РЕНИЯ
С N,N'-БИДЕНТАТНЫМИ ЛИГАНДАМИ
И МЕТИЛ-2-(ДЕЦИЛТИО)-6-ИЗОЦИАНОГЕКСАНОАТОМ
© 2023 г. А. Е. Мирославова,б,в,*, В. В. Кузьминг, А. П. Сахоненковаа,б,в,
М. Ю. Тюпинаа,в, Г. В. Сидоренкоа,в,**, А. Р. Кочергинаа,в, В. А. Полукеевг
а Радиевый институт им. В.Г. Хлопина, 194021, Санкт-Петербург,
2-й Муринский пр., д. 28
б Санкт-Петербургский государственный университет,
199034, Санкт-Петербург, Университетская наб., д. 7/9
в Озерский технологический институт - филиал НИЯУ МИФИ,
456783, Озерск Челябинской обл., пр. Победы, д. 4
г АО «Вектон», 192019, Санкт-Петербург, ул. 2-й Луч, д. 9
e-mail: *amiroslav@mail.ru, **gevasid@mail.ru
Поступила в редакцию 04.10.2023, после доработки 14.11.2023, принята к публикации 16.11.2023
«2+1Б» трикарбонильные комплексы вида
[M(CO)3(N^N)CN(CH2)4CH(COOMe)SC10H21]ClO4, где
M = 99mTc или Re, N^N = 2,2'-бипиридин (bipy) или 1,10-фенантролин (phen), получены по реакции
[M(CO)3(N^N)(MeOH)]ClO4 с метил-2-(децилтио)-6-изоцианогексаноатом в метаноле. Комплексы
рения выделены в индивидуальном виде и охарактеризованы методами ЯМР 1H и ИК спектроскопии.
Образование комплексов технеция-99m подтверждено с помощью ВЭЖХ. Измерена липофильность
технециевых комплексов.
Ключевые слова: технеций, рений, трикарбонильные комплексы, бипиридин, фенантролин,
метил-2-(децилтио)-6-изоцианогексаноат, липофильность.
DOI: 10.31857/S0033831123060084, EDN: NZHGXW
ВВЕДЕНИЕ
задачей. Несмотря на довольно большое количество
публикаций, посвященных введению 99mTc в жир-
Данная статья продолжает цикл наших исследо-
ные кислоты [6-18], препаратов на основе жирных
ваний по разработке радиофармпрепаратов на ос-
кислот, меченных технецием-99m, до сих пор нет в
нове жирных кислот для изучения метаболических
клинической практике.
процессов миокарда. Поскольку жирные кисло-
Известно, что линейные жирные кислоты под-
ты подвергаются метаболизму в тканях миокарда,
вергаются метаболизму за довольно короткое вре-
введение в них радиоактивной метки позволят ви-
мя, недостаточное для проведение полноценной
зуализировать области сердца, повреждённые, на-
ОФЭКТ диагностики, и для замедления метаболиз-
пример, в результате инфаркта миокарда. К насто-
ма используют жирные кислоты с разветвленной
ящему времени для ОФЭКТ диагностики миокарда
углеводородной цепочкой, обычно с заместителем в
в клинической практике используют в основном
β-положении. Иногда для этой цели в углеводород-
препараты, содержащие метку 123I [1-5]. Поскольку
ную цепочку ближе к карбоксильной группе вводят
123I - довольно дорогостоящий изотоп, нарабаты-
гетероатом (например, серу). Длина углеводород-
ваемый с помощью циклотронных технологий, его
ной цепочки обычно варьируется от 14 до 18 атомов
замена на более дешевый 99mTc является актуальной
углерода.
557
558
МИРОСЛАВОВ и др.
В предыдущих наших работах в качестве исход-
кислоты по ранее описанной процедуре [22]. Перед
ного соединения для введения радиометки в моле-
использованием пентакарбонильные комплексы до-
кулы жирной кислоты мы использовали трикарбо-
полнительно очищали сублимацией в форвакууме.
нилтриаквакомплекс технеция
[Tc(CO)3(H2O)3]+,
Источником технеция-99m являлся элюат, полу-
который традиционно применяется в последнее
ченный из экстракционного технециевого генерато-
время для разработки новых препаратов на осно-
ра 99Mo/99mTc (Радиевый институт им. В.Г. Хлопи-
ве 99mTc [19]. Для введения технециевой метки в
на, Санкт-Петербург, Россия) [23]. Элюат представ-
молекулу жирной кислоты мы применили так на-
лял собой раствор Na99mTcO4 в физиологическом
зываемый 2+1Б подход, в рамках которого коор-
растворе (активность 1-3 ГБк/мл).
динационная сфера трикарбонильного фрагмента
Поскольку [99mTc(CO)3(H2O)3]+, синтезирован-
заполняется вначале бидентатным лигандом
(2)
ный нами из элюата экстракционного генератора
и затем монодентатным лигандом, соединенным
по стандартной процедуре (боранокарбонат натрия,
с биомолекулой (1Б) - в нашем случае молекулой
тетраборат натрия, виннокислый натрий, карбонат
жирной кислоты. В качестве бидентатных лиган-
натрия) [24, 25], образовывался с выходом не бо-
дов мы исследовали гетероциклические амины
лее 50% и содержал много неидентифицированных
(1,10-фенатролин и 2,2'-бипиридин), а в качестве
примесей, в данной работе трикарбонилтриаква-
монодентатного лиганда - изоцианидную группу.
комплекс 99mTc был получен через промежуточный
Ранее мы показали, что комбинация бидентатных
[99mTcI(CO)5]. [99mTcI(CO)5] синтезировали карбо-
гетероциклических аминов и 2-этилизоцианоацета-
нилированием элюата экстракционного генератора
та, используемого нами в качестве модельного сое-
99mTc монооксидом углерода в присутствии KI и
динения, образует прочные комплексы с трикарбо-
серной кислоты по ранее описанной процедуре [22].
нильным фрагментом Re(CO)3+ [20] и является пер-
Несмотря на довольно низкий выход данного ком-
спективной для введения изотопов 186,188Re и 99mTc
плекса (порядка 10-15%), он может быть выделен
в различные биомолекулы. Позднее данная методи-
со 100%-ной радиохимической чистотой (рис. 1) и
ка была успешно применена для синтеза 2+1Б три-
легко превращен в требуемый [99mTc(H2O)3(CO)3]+
карбонильных комплексов технеция-99 и рения с
нагреванием в водном растворе при температуре
линейным
11-метилизоцианоундеканоатом
[21].
95°С в течение 30 мин. Радиохимическая чистота
Цель данной работы - изучить возможность введе-
продукта составила 91%. Хроматограммы исход-
ния метки 99mTc в молекулу разветвленной жирной
ного [99mTcI(CO)5] и [99mTc(CO)3(H2O)3]+ представ-
кислоты и определить липофильность полученных
лены на рис. 1. Все эксперименты проводили без
2+1Б трикарбонильных комплексов 99mTc. Липо-
специальной защиты от воздуха и влаги.
фильность является важным параметром, опреде-
Процедура синтеза метилового эфира 2-(децил-
ляющим процент накопления препарата в тканях
тио)-6-изоцианогексановой кислоты описана в до-
миокарда.
полнительных материалах к статье.
ИК спектры растворов регистрировали на спек-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
трометре Shimadzu FT-IR 8700 в диапазоне 1700-
2400 см-1 с использованием кювет с окнами из CaF2.
Для синтеза 2+1Б трикарбонильных комплексов
Спектры ЯМР 1Н снимали на приборе Bruker Avance
использовали химические чистые реагенты (Fluka
III 400 с рабочей частотой 400.13 МГц при 298 K, в
и Sigma-Aldrich). Хлористый метилен перегоняли
качестве растворителя использовали CDCl3.
над P2O5. Перхлорат серебра получали осаждением
карбоната серебра из водного раствора нитрата се-
Хроматографический анализ проводили на
ребра карбонатом натрия с последующим растворе-
хроматографе 940 Professional IC Vario ONE/LPG
нием осадка в хлорной кислоте. Перед использова-
(фирма Metrohm AG, Швейцария), UV/Vis детек-
нием перхлорат серебра обезвоживали нагреванием
тор - 947 Professional UV/VIS Detector Vario (фир-
в вакууме при 50-60°C. [ReCl(CO)5] получали авто-
ма Metrohm AG, Швейцария), γ-детектор - HERM
клавным карбонилированием K2[ReCl6] смесью му-
LB500 (фирма Berthold Technologies GmbH & Co.
равьиной и соответствующей галогеноводородной
KG, Германия). Колонка: Atlantis dC18 5 мкм,
РАДИОХИМИЯ том 65 № 6 2023
«2+1
Б
» ТРИКАРБОНИЛЬНЫЕ КОМПЛЕКСЫ
559
mV
mV
100.0
100.0
80.0
80.0
60.0
60.0
40.0
40.0
20.0
20.0
0
0.0
2.0
4.0
6.0
8.0
10.0
12.0
14.0
16.0
18.0
20.0
22.0
24.0
26.0 28.0
30.0
32.0
34.0
min
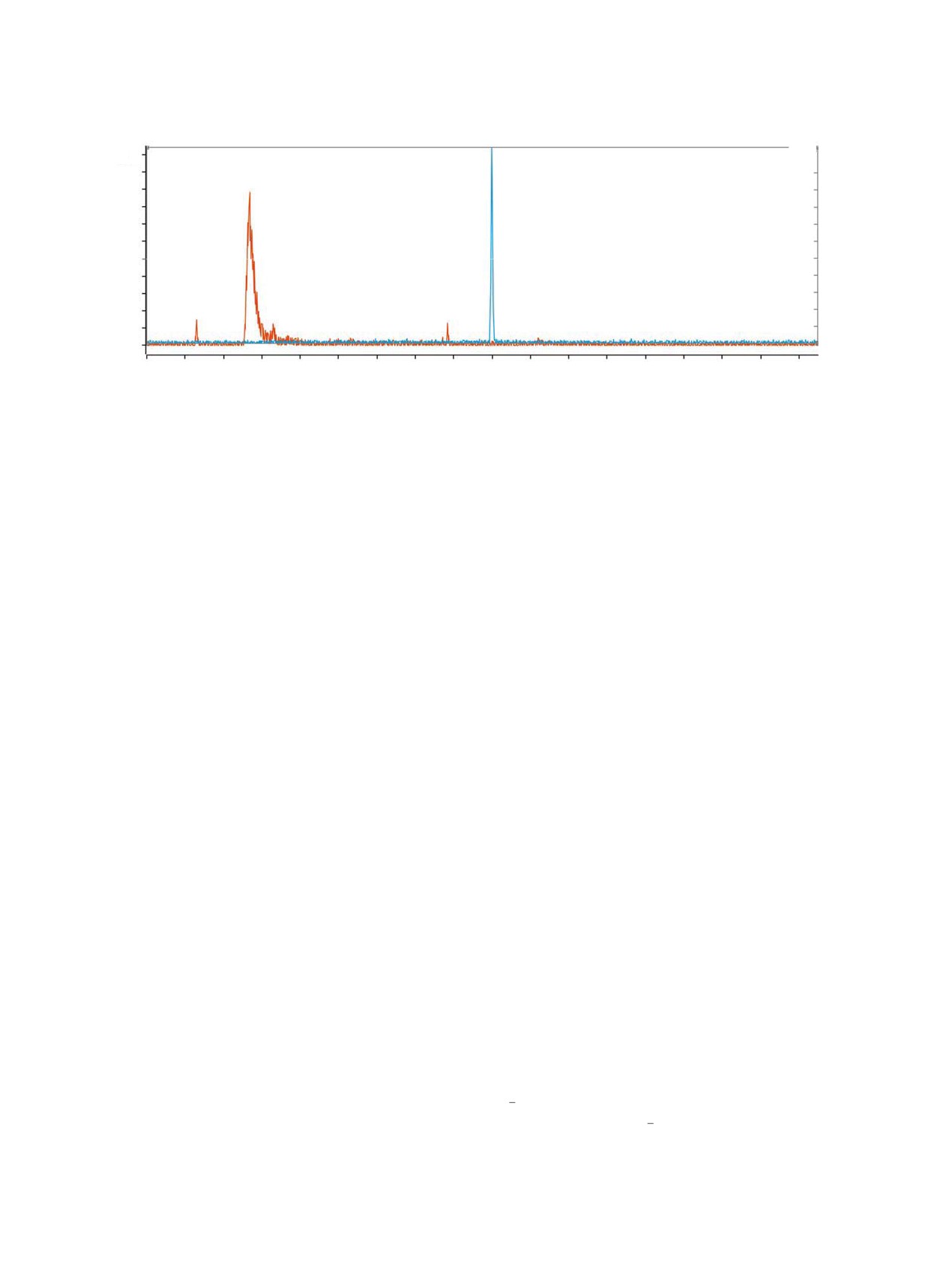
Рис. 1. ВЭЖХ хроматограмма [99mTc(CO)3(H2O)3]+ (красный) и [99mTcI(CO)5] (синий).
150 × 4.6 мм. Петля: 20 мкл. Программное обе-
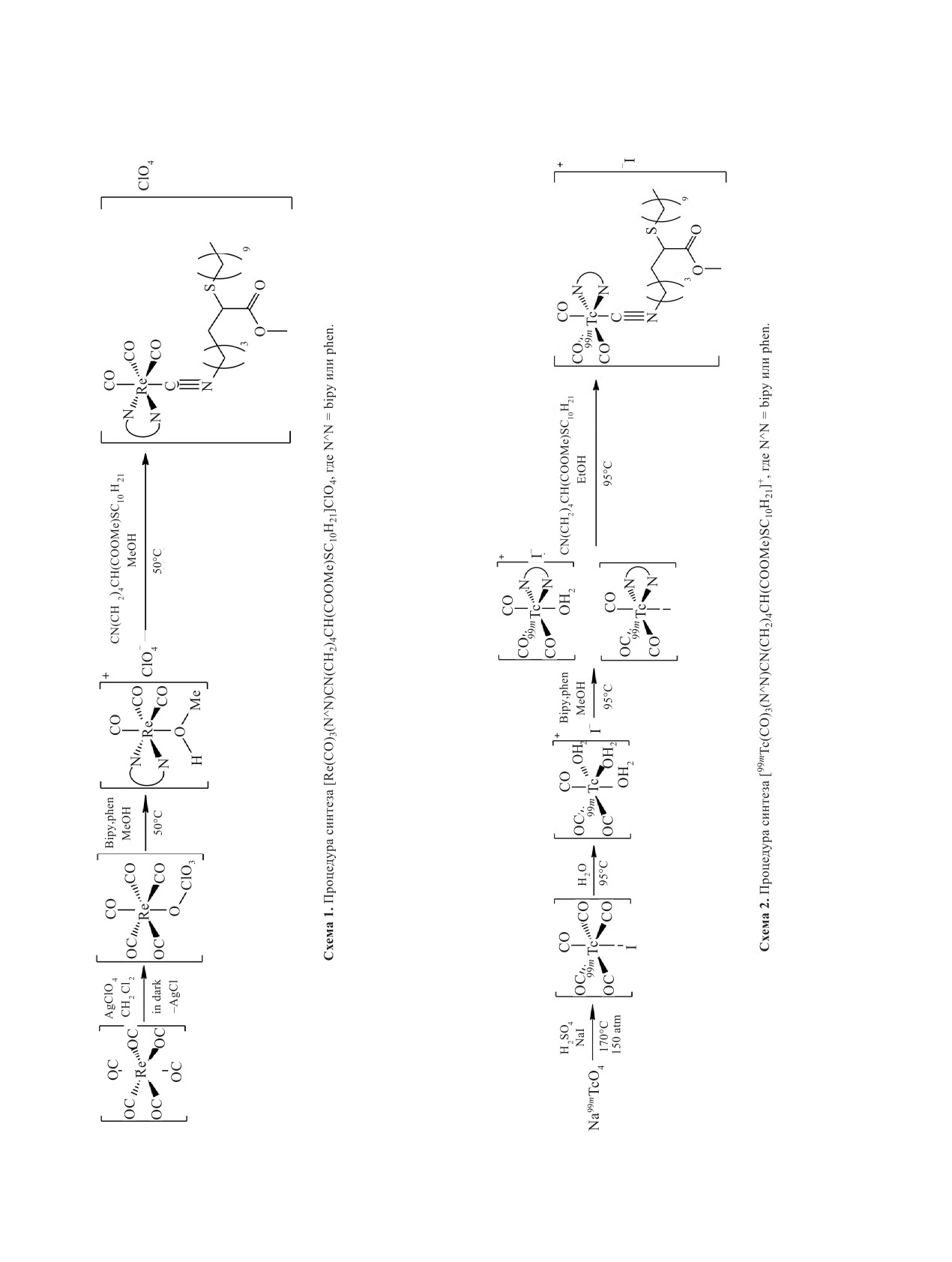
[Re(CO)3(bipy)CN(CH2)4CH(COOMe)-
спечение: MagIC Net 3.3.
SC10H21]ClO4 (1). Навески [ReCl(CO)5] (50.5 мг,
0.140 ммоль) и AgClO4 (300 мг, 1.44 ммоль) поме-
Градиентная система: ацетонитрил (A) - 0.1%-ная
щали в пенициллиновый флакон и добавляли 4 мл
водная трифторуксусная кислота (B) в градиент-
дихлорметана. Реакционную смесь интенсивно пе-
ном режиме: 0-5 мин, 100% В; 5-6 мин, 0→5% А;
ремешивали при комнатной температуре в темноте
6-9 мин, 5→34% А; 9-10 мин, 34→40% А; 10-
в течение 4 ч. Образовавшийся осадок AgCl и избы-
11.6 мин, 40→50% А; 11.6-15 мин, 50→70% А;
ток перхлората серебра оделяли центрифугирова-
15-17 мин, 70→82% А; 17-19 мин, 82→94% А;
нием. Полученный раствор [Re(ClO4)(CO)5] остав-
19-20 мин, 94→100% А; 20-25 мин, 100% А; 25-
ляли в открытом флаконе на ночь для самопроиз-
26 мин, 100% А→100% В; 26-35 мин, 100% В. Т =
вольного удаления растворителя. К образовавше-
25°С, Рmах = 145 бар, расход 1 мл/мин.
муся твердому остатку добавляли 5 мл метанола и
Определение липофильности 2+1Б трикар-
2,2'-бипиридин (21.9 мг, 0.140 ммоль). Полученный
бонильных комплексов технеция-99m. Липо-
раствор перемешивали при 50°С в течение 4 ч. Со
фильность комплексов определяли по стандартной
временем реакционная смесь приобретала желтую
процедуре [26-28]. Водно-спиртовой раствор тех-
окраску. Раствор остужали до комнатной темпера-
нециевых комплексов (1 мл) (соотношение объемов
туры и добавляли к нему заранее приготовленный
воды и этанола 2 : 1) встряхивали при температуре
раствор метилового эфира 2-(децилтио)-6-изоциа-
20-22°С в течение 10 мин (легкое перемешивание в
ногексановой кислоты (44.0 мг, 0.140 ммоль) в 2 мл
режиме маятника) с 1 мл октанола в узкой пробир-
метанола. Реакционную смесь перемешивали при
ке, не допуская прямого контакта с поверхностью
55°С в течение 17 ч, охлаждали до комнатной тем-
рук, чтобы избежать изменения температуры экспе-
пературы и оставляли в открытом пенициллиновом
флаконе для самопроизвольного испарения раство-
римента. Разделение фаз проводили центрифугиро-
рителя. В результате был получен спектрально-чи-
ванием при 4000 об/мин с последующей декантаци-
стый комплекс (1) в виде желтого аморфного про-
ей. Объем отбираемых органических и водных фаз
дукта. ИК спектр (CH2Cl2), ν, см-1: 2214.1 сл (C≡N),
составлял 0.8 мл. Измерения радиоактивности ото-
2040.5 с (C≡O), 1967.3 с (C≡O), 1936.4 с (C≡O),
бранных аликвот обеих фаз проводили в пеницил-
1732.0 ср (COOMe). Спектр ЯМР 1Н (CDCl3, 298 К),
линовых флаконах на Curiementor 3 (Германия, по-
δ, м. д.: 9.085 д (2H, bipy, 3J 4.0 Гц), 8.27 д (2H, bipy,
грешность 3%). Смешение водной и органической
3J 8.0 Гц), 8.12 т (2H, bipy, 3J 6.0 Гц), 7.58 т (2H,
фаз не учитывалось. Липофильность определяли
bipy, 3J 6.0 Гц), 3.76 с (3H, -O-CH3), 3.47 т (2H, CN-
как логарифм коэффициента распределения препа-
CH2-, 3J 6.0 Гц), 3.20 т (1H, 3J 6.0 Гц), 2.45 с (2H),
рата между октанольной и водной фазами:
1.23-1.98 м (20H, -CH2-), 0.9 т (3H, -CH3, 3J 8.0 Гц).
lgP = lg(Aoctanol/Awater).
Rf = 20.69 мин.
РАДИОХИМИЯ том 65 № 6 2023
560
МИРОСЛАВОВ и др.
[Re(CO)3(phen)CN(CH2)4CH(COOMe)-
в течение 40 мин. После охлаждения реакционной
SC10H21]ClO4 (2). Навески [ReCl(CO)5] (50.6 мг,
смеси до комнатной температуры проводили ВЭЖХ
0.139 ммоль) и AgClO4 (300 мг, 1.44 ммоль) поме-
анализ полученных продуктов.
щали в пенициллиновый флакон и добавляли 4 мл
дихлорметана. Реакционную смесь интенсивно
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
перемешивали при комнатной температуре в тем-
ноте в течение 4 ч. Образовавшийся осадок AgCl
В данной работе для создания новых кардиотроп-
и избыток перхлората серебра отделяли центрифу-
ных препаратов мы изучили возможность использо-
гированием. Полученный раствор [Re(ClO4)(CO)5]
вания метилового эфира 2-(децилтио)-6-изоциано-
оставляли в открытом флаконе на ночь для само-
гексановой кислоты, содержащего гетероатом серы
произвольного удаления растворителя. К образо-
вблизи карбоксильной группы. Для введения 99mTc
вавшемуся твердому остатку добавляли 5 мл ме-
мы использовали так называемый 2+1Б подход, опи-
танола и 1,10-фенантролин (25.0 мг, 0.139 ммоль).
санный выше. В качестве бидентатных лигандов
Полученный раствор перемешивали при 55°С в те-
были взяты гетероциклические амины (2,2'-бипи-
чение 17 ч. Со временем реакционная смесь приоб-
ридин и 1,10-фенантролин), а в качестве моноден-
ретала желтую окраску. Раствор остужали до ком-
татного лиганда - изоцианидная группа жирной
натной температуры и добавляли к нему заранее
кислоты. Следует также отметить, что используе-
приготовленный раствор метилового эфира 2-(де-
мый нами подход 2+1Б был отработан только на ма-
цилтио)-6-изоцианогексановой кислоты
(43.7 мг,
кроколичествах рения и технеция-99 и модельном
0.139 ммоль) в 2 мл метанола. Реакционную смесь
комплексе технеция-99m с изоцианоацетатом [29] и
перемешивали при 55°С в течение 17 ч, охлаждали
не опробован применительно к синтезу комплексов
до комнатной температуры и оставляли в откры-
технеция-99m c длинноцепочечной жирной кисло-
том пенициллиновом флаконе для самопроизволь-
той. Целью данной работы было также восполнить
ного испарения растворителя. В результате был
этот пробел. Первоначально нами был синтезиро-
получен спектрально-чистый комплекс (2) в виде
ваны реперные соединения аналогичных трикарбо-
желтого аморфного продукта. ИК спектр (CH2Cl2),
нильных комплексов рения. В качестве исходного
ν, см-1: 2214.1 сл (C≡N), 2040.5 с (C≡O), 1967.3 с
комплекса мы использовали пентакарбонилхлорид
(C≡O), 1940.3 с (C≡O), 1732.0 ср (COOMe). Спектр
рения [ReCl(CO)5], синтезированный в нашей лабо-
ЯМР 1Н (CDCl3, 298 К), δ, м. д.: 9.44 д (2H, phen, 3J
ратории. Поскольку хлоридный лиганд в комплек-
6.0 Гц), 8.61 д (2H, phen, 3J 8.0 Гц), 8.07 с (2H, phen),
се [ReCl(CO)5] прочно связан с центральным ато-
7.дд (2H, phen, 3J 8.0 Hz, 3J 6.0 Hz), 3.75 с (3H, -O-
мом, его замещали на лабильную легко уходящую
CH3), 3.44 т (2H, CN-CH2-, 3J 6.0 Гц), 3.17 т (1H, 3J
перхлоратную группу. Далее рениевые комплексы
6.0 Гц), 2.45 с (2H), 1.23-1.98 м (20H, -CH2-), 0.9 т
[Re(CO)3(N^N)CN(CH2)4CH(COOMe)SC10H21]ClO4
(3H, -CH3, 3J 8.0 Гц). Rf = 21.02 мин.
синтезировали по ранее разработанной нами про-
цедуре [21], приведенной на схеме 1.
[99mTc(CO)3(bipy)CN(CH2)4CH(COOMe)-
SC10H21]+ (3) и
[99mTc(CO)3(phen)CN(CH2)4CH-
Поскольку нам не удалось получить моно-
(COOMe)SC10H21]+ (4). К водному раствору (2 мл)
кристаллы
[Re(CO)3(N^N)CN(CH2)4CH(COOMe)-
[99mTc(CO)3(H2O)3]+ в пенициллиновом флаконе до-
SC10H21]ClO4, вероятно из-за наличия длинного и
бавляли 0.003 М раствор bipy/phen в этаноле (1 мл).
разветвленного алифатического фрагмента, соеди-
Флакон закрывали резиновой пробкой, проткнутой
нения характеризовали с помощью спектроскопи-
медицинской иглой, и нагревали на водяной бане
ческих методов. ИК спектр полученных комплек-
при 80°С в течение 40 мин. Флакон охлаждали во-
сов в области валентных колебаний карбонильных
дой и добавляли 0.003 М раствор метил-2-(децил-
групп содержит три полосы, характерные для три-
тио)-6-изоцианогексаноата в этаноле (1 мл). Флакон
карбонильного фрагмента. Полоса изоцианидной
закрывали и нагревали на водяной бане при 80°С
группы при 2214.1 см-1 сдвинута относительно
РАДИОХИМИЯ том 65 № 6 2023
«2+1
Б
» ТРИКАРБОНИЛЬНЫЕ КОМПЛЕКСЫ
561
РАДИОХИМИЯ том 65 № 6 2023
562
МИРОСЛАВОВ и др.
Ƚɚɦɦɚ
Ƚɚɦɦɚ
mV
mV
160.0
400.0
120.0
300.0
80.0
200.0
40.0
100.0
0
0.0
0.0
4.0
8.0
12.0 16.0
20.0
24.0 28.0
32.0
0.0
4.0
8.0
12.0
16.0
20.0 24.0
28.0
32.0
min
min
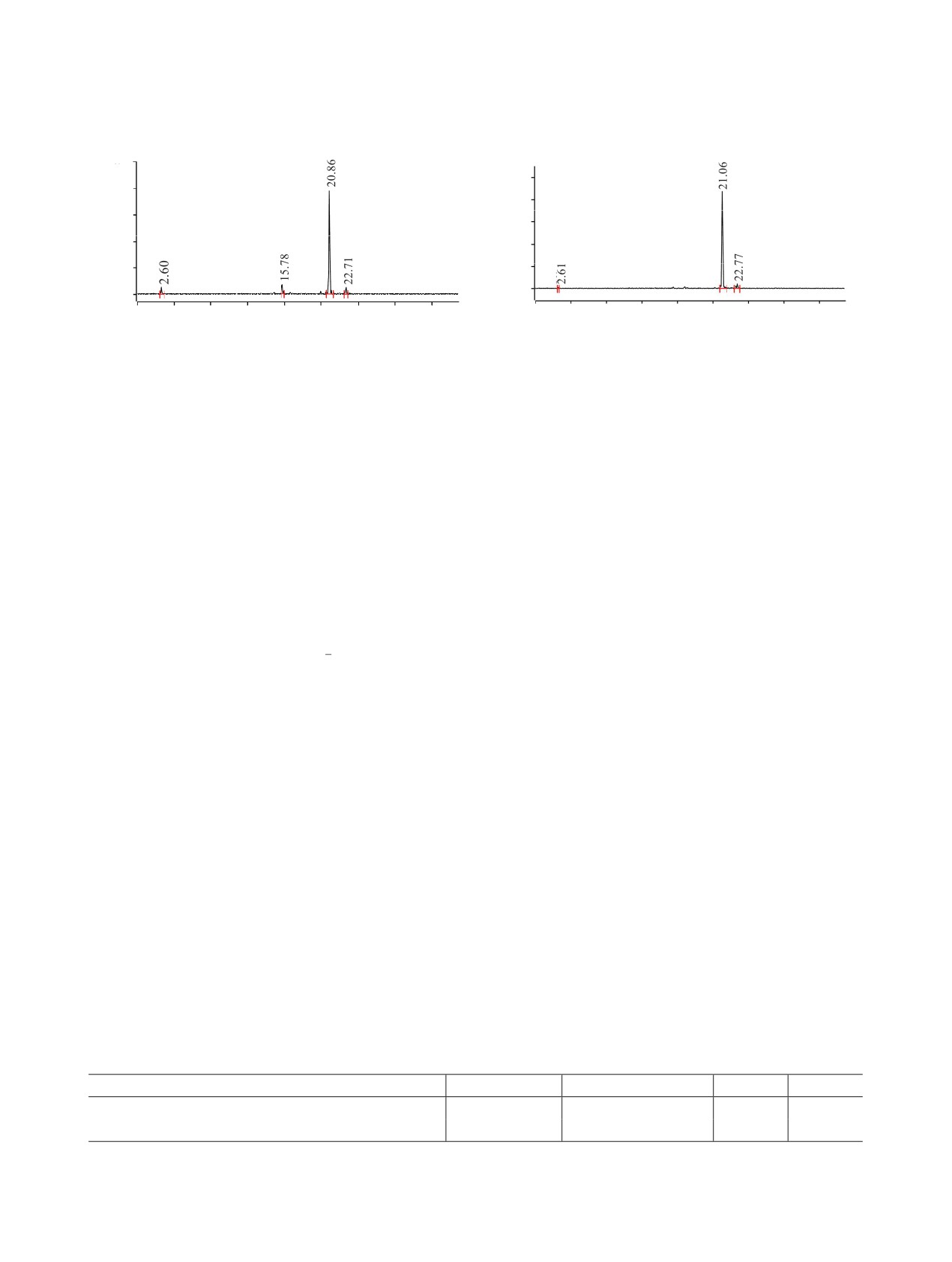
Рис.
2.
ВЭЖХ хроматограмма
[99mTc(CO)3(bipy)-
Рис.
3.
ВЭЖХ хроматограмма
[99mTc(CO)3(phen)-
CN(CH2)4CH(COOMe)SC10H21]+.
CN(CH2)4CH(COOMe)SC10H21]+.
полосы свободного лиганда в высокочастотную
Радиохроматографический анализ бипиридиль-
область на 65.5 см-1, что однозначно указывает на
ного и фенантролинового комплексов показал, что
координацию изоцианида к металлу. Аналогичный
их РХЧ составила 84.8 и 94.4% соответственно; Rf =
сдвиг мы наблюдали при координации метилового
20.86 и 21.06 мин соответственно (рис. 2 и 3).
эфира 11-изоцианоундекановой кислоты к трикар-
Данные по липофильности этих комплексов
бонильным фрагментам Re(I) и Tc(I) [21]. Полоса
приведены в табл. 1.
средней интенсивности при 1732.0 см-1 относится
Следует отметить, что несмотря на присутствие
к валентным колебаниям сложноэфирной группы.
длинных углеводородных радикалов в молекуле
Координацию изоцианидной группы подтвер-
технециевых комплексов, данные соединения мож-
но отнести к умеренно липофильным, вероятно,
ждают также данные спектроскопии ЯМР 1H. Сиг-
благодаря наличию гидрофильной сложноэфирной
нал протонов группы CN-CH2-сдвинут относи-
группы в их структуре и наличию электрического
тельно сигнала свободного изоцианида на 0.4 м.д. в
заряда. В дальнейшем мы предполагаем изучить
сильное поле. В спектре присутствуют также сигна-
биораспределение технециевых комплексов в орга-
лы всех протонов гетероциклических аминов, сме-
низме лабораторных животных.
щенные относительно свободных лигандов.
ВЭЖХ хроматограммы рениевых комплексов 1
ЗАКЛЮЧЕНИЕ
и 2 содержат пики основного вещества со временем
удерживания 20.69 и 21.02 мин соответственно.
Нами впервые синтезированы
2+1Б трикар-
Имея в руках охарактеризованные реперные соеди-
бонильные комплексы вида
[Re(CO)3(N^N)-
нения, мы перешли к синтезу комплексов 99mTc. Пу-
CN(CH2)4CH(COOMe)SC10H21]ClO4, где N^N
=
тем последовательного замещения водных лигандов
2,2'-бипиридин (bipy) или 1,10-фенантролин (phen),
в комплексе [99mTc(CO)3(H2O)3]+ на бидентатный
по реакции
[M(CO)3(N^N)(MeOH)]ClO4 с ме-
амин и метиловый эфир 2-(додецилтио)-6-изоциа-
тил-2-(децилтио)-6-изоцианогексаноатом в метано-
ногексановой кислоты нами были синтезированы
ле. Комплексы выделены в индивидуальном виде и
[99mTc(CO)3(N^N)CN(CH2)4CH(COOMe)SC10H21]+,
охарактеризованы методами ЯМР 1H и ИК спектро-
где N^N = bipy или phen (схема 2).
скопии. Аналогичные комплексы 99mTc получены
Таблица 1. Результаты определения липофильности [99mTc(CO)3(N^N)CN(CH2)4CH(COOMe)SC10H21]+, где N^N =
bipy или phen
Комплекс
Водная фаза
Органическая фаза
P
lgP
[99mTc(CO)3(bipy)CN(CH2)4CH(COOMe)SC10H21]+
0.140 ± 0.001
0.812 ± 0.003
5.802
0.764
[99mTc(CO)3(phen)CN(CH2)4CH(COOMe)SC10H21]+
0.117 ± 0.001
0.657 ± 0.003
5.613
0.749
РАДИОХИМИЯ том 65 № 6 2023
«2+1
Б
» ТРИКАРБОНИЛЬНЫЕ КОМПЛЕКСЫ
563
исходя из [99mTcI(CO)5]. Радиохимическая чистота
Wunderlich G., Kraus W., Pietzsch H.-J., Kropp J.,
бипиридинового и фенантролинового комплексов
Deussen A., Spies H. // Bioconjugate Chem.
2007.
Vol. 18, N 1. P. 216-230.
составила 84.8 и 94.4% соответственно. Значения
7.
Yamamura N., Magata Y., Arano Y., Kawaguchi T.,
липофильности этих комплексов составили 0.724 ±
Ogawa K., Konishi J., Saji H. // Bioconjugate Chem.
0.023 и 0.749 ± 0.022 соответственно.
1999. Vol. 10, N 3. P. 489-495.
8.
Mirtschink P., Stehr S.N., Walther M., Pietzsch J.,
БЛАГОДАРНОСТИ
Bergmann R., Pietzsch H.-J., Weichsel J., Pexa A.,
Dieterich P., Wunderlich G., Binas B., Kropp J.,
Deussen A. // Nucl. Med. Biol. 2009. Vol. 36, N 7.
Коллектив авторов выражает благодарность
P. 833-843.
П.М. Кузьменко - сотруднику Института химии
9.
Mirtschink P., Stehr S.N., Walther M., Pietzsch J.,
Санкт-Петербургского государственного универси-
Bergmann R., Pietzsch H.-J., Weichsel J., Pexa A.,
тета - за помощь в выборе методик органического
Dieterich P., Wunderlich G., Binas B., Kropp J.,
синтеза.
Deussen A. // Nucl. Med. Biol. 2009. Vol. 36, N 7.
P. 845-852.
10. Jung C.M., Kraus W., Leibnitz P., Pietzsch H.-J., Kropp J.,
ФОНДОВАЯ ПОДДЕРЖКА
Spies H. // Eur. J. Inorg. Chem. 2002. Vol. 2002, N 5.
P. 1219-1225.
Исследование выполнено при финансовой под-
11. Lee B.C., Kim D.H., Lee J.H., Sung H.J., Choe Y.S.,
держке Российского научного фонда (проект № 22-
Chi D.Y., Lee K.-H., Choi Y., Kim B.-T. // Bioconjugate
13-00057).
Chem. 2007. Vol. 18, N 4. P. 1332-1337.
12. Tsotakos T.C., Papadopoulos A., Pelecanou M.,
КОНФЛИКТ ИНТЕРЕСОВ
Papadopoulos M., Pirmettis I. // Nucl. Med. Biol. 2010.
Vol. 37, N 6. P. 683.
Авторы заявляют об отсутствии конфликта инте-
13. Zeng H., Zhang H., Wu X., Chao F., Yu G., Zhang L.,
ресов в связи с публикацией данной статьи.
Jiang H., Liu H., Hou H., Zhan H., Zhang H., Tian M. //
J. Label. Compd. Radiopharm. 2013. Vol. 56, N 1.
P. 1-5.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
14. Lee B.C., Kim D.H., Lee I., Choe Y.S., Chi D.Y., Lee K.-H.,
Choi Y., Kim B.-T. // J. Med. Chem. 2008. Vol. 51, N 12.
Дополнительные материалы для этой статьи
P. 3630-3634.
доступны по doi 10.31857/S0033831123060084 для
15. Mathur A., Mallia M.B., Sarma H.D., Banerjee S.,
Venkatesh M. // J. Label. Compd. Radiopharm. 2010.
авторизированных пользователей.
Vol. 53, N 9. P. 580-585.
16. Chu T., Zhang Y., Liu X., Wang Y., Hu S., Wang X. //
СПИСОК ЛИТЕРАТУРЫ
Appl. Radiat. Isot. 2004. Vol. 60, N 6. P. 845-850.
17. Jones G.S., Elmaleh D.R., Strauss H.W., Fischman A.J. //
1.
Morishita S., Kusuoka H., Yamamichi Y., Suzuki N.,
Nucl. Med. Biol. 1994. Vol. 21, N 1. P. 117-123.
Kurami M., Nishimura T. // Eur. J. Nucl. Med. 1996.
18. Mach R.H., Kung H.F., Jungwiwattanaporn P.,
Vol. 23, N 4. P. 383-389.
Guo Y.Z. // Int. J. Radiat. Appl. Instrum. Part B: Nucl.
2.
Uehara T., Uemura T., Hirabayashi S., Adachi S.,
Med. Biol. 1991. Vol. 18, N 2. P. 215-226.
Odaka K., Akizawa H., Magata Y., Irie T., Arano Y. //
J. Med. Chem. 2007. Vol. 50, N 3. P. 543-549.
19. Sidorenko G.V., Miroslavov A.E., Tyupina M.Yu. //
3.
Shikama N., Nakagawa T., Takiguchi Y., Aotsuka N.,
Coord. Chem. Rev. 2023. Vol. 476. Article 214911.
20. Тюпина М.Ю., Мирославов А.Е., Сидоренко Г.В., Гур-
Kuwabara Y., Komiyama N., Terano T., Hirai A. //
Circ. J. 2004. Vol. 68, N 6. P. 595-598.
жий В.В., Сахоненкова А.П. // ЖОХ. 2022. T. 92, № 1.
4.
Nishimura T., Uehara T., Shimontagata T., Nagata S.,
C. 110-120.
Haze K. // Ann. Nucl. Med. 1993. N 7. P. 35-39.
21. Мирославов А.Е., Сахоненкова А.П., Тюпина М.Ю.,
5.
Harada Y., Shimada K., Harada S.J., Sato T., Kubota Y.,
Сидоренко Г.В. // ЖОХ. 2023. T. 93, № 2. C. 273-278.
Yamashita M. // J. Imaging. 2022. Vol. 8, N 11. P. 296.
22. Miroslavov A.E., Lumpov A.A., Sidorenko G.V.,
6.
Walther M., Jung C.M., Bergmann R., Pietzsch J.,
Levitskaya E.M., Gorshkov N.I., Suglobov D.N.,
Rode K., Fahmy K., Mirtschink P., Stehr S., Heintz A.,
Alberto R., Braband H., Gurzhiy V.V., Krivovichev S.V.,
РАДИОХИМИЯ том 65 № 6 2023
564
МИРОСЛАВОВ и др.
Tananaev I.G. // J. Organomet. Chem. 2008. Vol. 693,
26. Hassanzadeh L., Erfani M., Sadat Ebrahimi S.E. //
N 1. P. 4-10.
J. Label. Compd. Radiopharm. 2012. Vol. 55, N 10.
P. 371-376.
23. Филянин А.Т. Создание экстракционных центро-
27. Mastrostamatis
S.G.,
Papadopoulos
M.S.,
бежных полупротивоточных генераторов для про-
Pirmettis I.C., Paschali E., Varvarigou A.D.,
изводства радионуклидов медицинского назначе-
Stassinopoulou C.I., Raptopoulou C.P., Terzis A.,
ния: Автореф. дис. … к.т.н. М.: ИФХЭ РАН, 2004.
Chiotellis E. // J. Med. Chem. 1994. Vol. 37, N 20.
24. Alberto R., Schibli R., Egli A., Schubiger A.P.,
P. 3212-3218.
28. Zhang J., Yu Q., Huo J., Pang Y., Yang S., He Y.,
Abram U., Kaden T.A. // J. Am. Chem. Soc. 1998.
Tang T., Yang C., Wang X. // J. Radioanal. Nucl. Chem.
Vol. 120, N 31. P. 7987-7988.
2010. Vol. 283, N 2. P. 481-485.
25. Alberto R., Ortner K., Wheatley N., Schibli R.,
29. Sidorenko G.V., Miroslavov A.E., Tyupina M.Yu.,
Schubiger A.P. // J. Am. Chem. Soc. 2001. Vol. 123,
Gurzhiy V.V., Sakhonenkova A.P., Lumpov A.A. // Inorg.
N 13. P. 3135-3136.
Chem. 2023. Vol. 62, N 38. P. 15593-15604.
«2+1B» Tricarbonyl Complexes of Technetium-99m
and Rhenium with N,N'-Bidentate Ligands and Methyl
2-(Decylthio)-6-isocyanohexanoate
A. E. Miroslavova,b,c,*, V. V. Kuz’mind, A. P. Sakhonenkovaa,b,c, M. Yu. Tyupinaa,c,
G. V. Sidorenkoa,c,**, A. R. Kocherginaa,c, and V. A. Polukeevd
а Khlopin Radium Institute, St. Petersburg, 194021 Russia
b St. Petersburg State University, St. Petersburg, 199034 Russia
c Ozersk Institute of Technology, Branch of National Research Nuclear University MEPhI,
Ozersk, Chelyabinsk oblast, 456783 Russia
d AO Vekton, St. Petersburg, 192019 Russia
e-mail: *amiroslav@mail.ru, **gevasid@mail.ru
Received October 4, 2023; revised November 14, 2023; accepted November 16, 2023
«2+1B» tricarbonyl complexes of the general formula [M(CO)3(N^N)CN(CH2)4CH(COOMe)SC10H21]ClO4,
where M = 99mTc or Re, N^N = 2,2'-bipyridine (bipy) or 1,10-phenanthroline (phen), were prepared by the
reaction of [M(CO)3(N^N)(MeOH)]ClO4 with methyl 2-(decylthio)-6-isocyanohexanoate in methanol.
The rhenium complexes were isolated and characterized by 1H NMR and IR spectroscopy. The formation
of technetium-99m complexes was confirmed by HPLC. The lipophilicity of the technetium complexes was
measured.
Keywords: technetium, rhenium, tricarbonyl complexes, bipyridine, phenanthroline, methyl 2-(decylthio)-6-
isocyanohexanoate, lipophilicity
РАДИОХИМИЯ том 65 № 6 2023
Вспомогательные материалы
«2+1Б» ТРИКАРБОНИЛЬНЫЕ КОМПЛЕКСЫ ТЕХНЕЦИЯ-99m И
РЕНИЯ С N,N'-БИДЕНТАНТНЫМИ ЛИГАНДАМИ И МЕТИЛ-2-
(ДЕЦИЛТИО)-6-ИЗОЦИАНОГЕКСАНОАТОМ
© А. Е. Мирославов*а,б,в, В. В. Кузьминг, А. П. Сахоненковаа,б,в,
М. Ю. Тюпинаа,в, Г. В. Сидоренко**а,в, А .Р. Кочергинаа,в, В. А. Полукеевг
а Радиевый институт им. В. Г. Хлопина, 194021, Санкт-Петербург, 2-й
Муринский пр., д. 28
б Санкт-Петербургский государственный университет,
199034,
Санкт-Петербург, Университетская наб., д. 7/9
в Озерский технологический институт
- филиал НИЯУ МИФИ,
456783, Озерск Челябинской обл., пр. Победы, д. 4
г АО «Вектон», 192019, Санкт-Петербург, ул. 2-й Луч, д. 9
e-mail: *amiroslav@mail.ru, **gevasid@mail.ru
Процедура синтеза
метилового
эфира
2-(децилтио)-6-
изоцианогексановой кислоты:
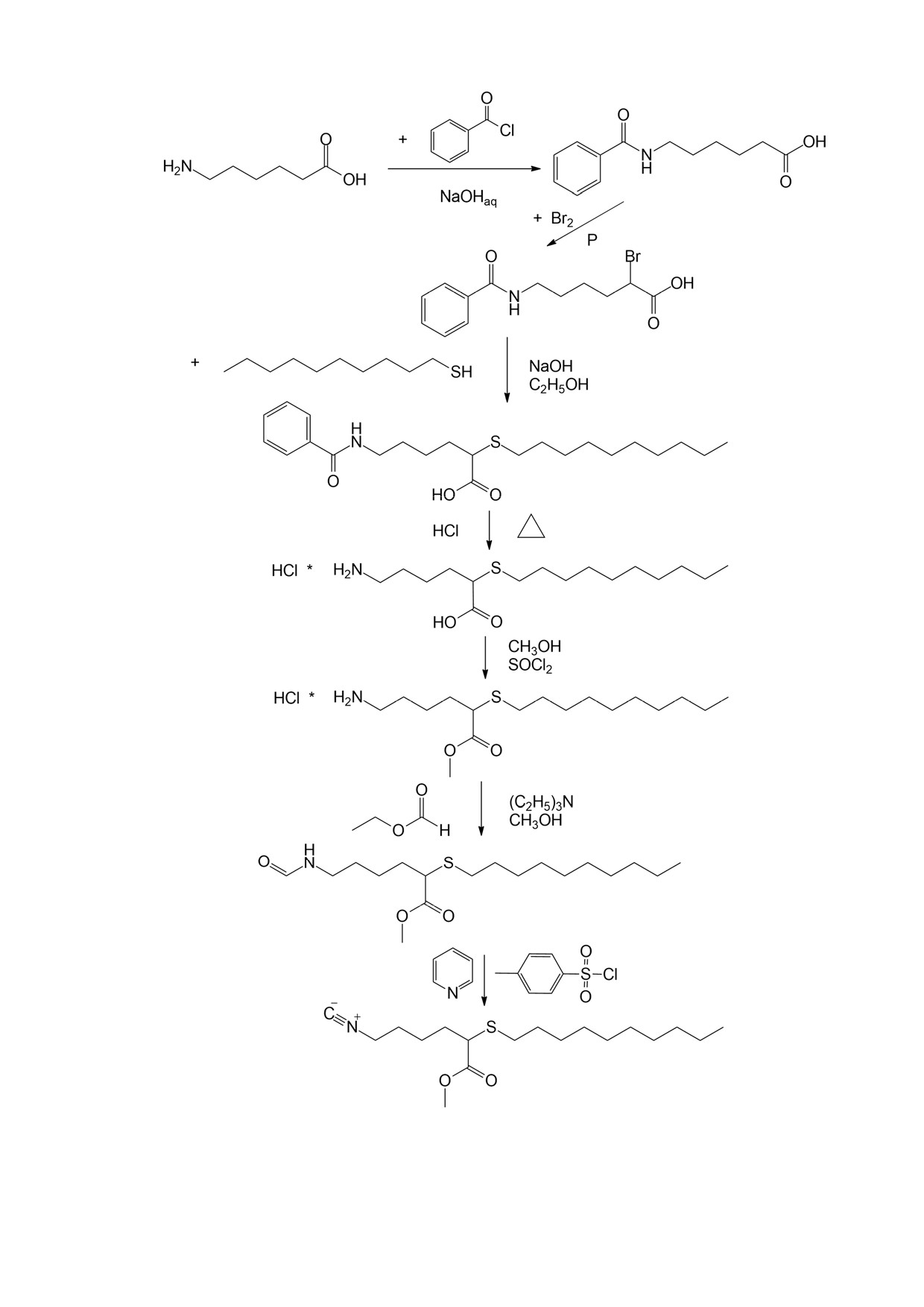
2-н-Децилтио-6-N-бензоиламиногексановая кислота: к раствору
NaOH (4.0 г, 100 ммоль) в 130 мл этанола добавляли 1-декантиол (8.52 г, 49
ммоль). Полученный раствор добавляли в один приём к перемешиваемой
суспензии 2-бром-6-N-бензоиламиногексановой кислоты (15.07 г, 48 ммоль)
в 100 мл этанола в атмосфере аргона. Полученный раствор кипятили в
течение 2 ч с обратным холодильником, затем упаривали в вакууме. Остаток
в виде вязкого масла растворяли в
120 мл дихлорметана, раствор
фильтровали, обработывали конц. HCl (7 мл, 82 ммоль) и постепенно
упаривали под действием тока воздуха при перемешивании. При этом
продукт выделялся в виде бесцветных кристаллов. Его отфильтровывали,
промывали водой (3 × 25 мл) и гексаном (2 × 15 мл), сушили в вакуум-
эксикаторе. Выход 9.44 г (48.2%), т.пл. 73-76°С. Спектр ЯМР 1Н (DMSO-d6),
δ, м.д.: 0.85 т (3H, -CH3, 3J 8.0 Гц), 1.23-1.60 м (22H, -CH2-), 1.71-1.80 м (1H,
-NH-), 2.54-2.61 м (2H, -S-CH2-), 3.18 т (1H, -S-CH-COO, 3J 8.0 Гц), 3.24
д.т. (2H, 3J 4.0 Гц, 3J 6.0 Гц, -N-CH2-), 7.45 д.д. (2H, -C6H5, 3J 6.0 Гц), 7.51 т
(1H, -C6H5, 3J 6.0 Гц), 7.83 д (2H, -C6H5, 3J 4.0 Гц), 8.46 с (1H, -COOH).
Гидрохлорид 2-н-децилтио-6-аминогексановой кислоты: суспензию
2-н-децилтио-6-N-бензоиламиногексановой кислоты (9.1 г, 22 ммоль) в смеси
50 мл конц. HCl и 50 мл воды кипятили в течение 60 ч с обратным
холодильником, при этом исходное соединение постепенно переходило в
раствор. При охлаждении полученного раствора до 8°С выпадали бесцветные
кристаллы. Их отфильтровывали, сушили в вакуум-эксикаторе, затем
промывали абсолютным эфиром двумя порциями (25 и 10 мл), сушили в
вакуум-эксикаторе. Выход 3.46 г (46.2%), т.пл. 141-143°С. Спектр ЯМР 1Н
(DMSO-d6), δ, м.д.: 0.86 т (3H, -CH3, 3J 8.0 Гц), 1.25-1.80 м (22H, -CH2-),
2.54-2.61 м (2H, -S-CH2-), 2.75 м (2H, -S-CH-), 3.19 т (1H, 3J 8.0 Гц, -S-CH-
COO), 7.86 с (3H, -NH3Cl) 12.56 c (1H, -COOH).
Метиловый эфир гидрохлорида 2-н-децилтио-6-аминогексановой
кислоты: к раствору гидрохлорида
2-н-децилтио-6-аминогексановой
кислоты (3.22 г, 9.5 ммоль) в 40 мл метанола при перемешивании и
охлаждении на ледяной бане медленно добавляли хлористый тионил (4.3 г,
32 ммоль). Полученный раствор кипятили с обратным холодильником в
течение 4 ч, затем упаривали в вакууме. Остаток тщательно размешивали с
абсолютным эфиром
(15 мл), осадок отфильтровывали и промывали
абсолютным эфиром (10 мл). Выход 2.08 г (62%), т.пл. 49-52°С. Спектр ЯМР
1Н (DMSO-d6), δ, м.д.: 0.86 т (3H, -CH3, 3J 8.0 Гц), 1.25-1.62 м (22H, -CH2-),
1.73-1.82 м (1H), 2.55-2.58 м (2H, -S-CH2-), 2.75 м (2H, -S-CH2-), 3.66 с (3H,
CH3-O-CO-), 7.97 с (3H, -NH3Cl).
Метиловый эфир
2-(децилтио)-6-изоцианогексановой кислоты:
метиловый эфир гидрохлорида 2-н-децилтио-6-аминогексановой кислоты
(0.5 г, 0.0014 моль) помещали в колбу объемом 100 мл и прибавляли метанол,
этилформиат (4 мл) и триэтиламин (0.143 мл, 0.0014 моль). Полученный
раствор кипятили 36 ч с обратным холодильником. После охлаждения
реакционной смеси выпадал осадок, который отфильтровывали и растворяли
в хлороформе. Раствор промывали водой, затем отгоняли растворитель.
Осадок растворяли в 15 мл пиридина и прибавляли тозилхлорид (0.4 г, 2
ммоль). Смесь перемешивали 1.5 ч при 0°С, после чего экстрагировали
продукт диэтиловы эфиром. Полученный раствор промывали водным
раствором NaCl и отгоняли растворитель на роторном испарителе. Продукт
дополнительно очищался методом флеш-хроматографии. Наполнитель
колонки - силикагель, элюент - диэтиловый эфир/гексан (2 : 5). Выход 0.16 г
(36 %). ИК спектр (CaF2, cм-1) (гексан : диэтиловый эфир, 5 : 2 v/v): 2144.7
(C≡N), 1735.8 (C=O, сложноэфирн.), (MeOH) 2148.6 (C≡N), 1731.9 (C=O,
сложноэфирн.). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 0.9 т (3H, -CH3, 3J 8.0 Гц),
1.23-1.98 м (21H, -CH2-), 2.45 с (1H), 2.60 м (2H), 3.26 т (1H, 3J 6.0 Гц), 3.41 т
(2H, CN-CH2-, 3J 6.0 Гц), 3.77 с (3H, -O-CH3).
Обобщенная схема синтеза метилового эфира 2-(децилтио)-6-
изоцианогексановой кислоты