РАДИОХИМИЯ, 2023, том 65, № 6, с. 546-556
УДК 542.81:544.723:544.58
СОРБЦИЯ ИОНОВ Sr(II) ТРИКАЛЬЦИЙФОСФАТОМ
В ПРИСУТСТВИИ ГУМИНОВЫХ КИСЛОТ
© 2023 г. А. А. Иошин, И. В. Волков, Е. В. Поляков*
Институт химии твердого тела УрО РАН,
620108, Екатеринбург, ул. Первомайская, д. 91
*e-mail: polyakov@ihim.uran.ru
Поступила в редакцию 13.07.2023, после доработки 14.08.2023, принята к публикации 21.08.2023
Исследовано сорбционное поведение микроконцентраций Sr(II) по отношению к β-Ca3(PO4)2 (TCP) в
зависимости от концентрации катиона, рН и концентраций гуминовых кислот (ГК) в растворе. Термоди-
намический анализ растворимости ТСР (1) выполнен с учётом образования Ca(OH)2 (2), Ca(H2PO4)2 (3),
CaHPO4·2H2O (4), Ca5(PO4)3OH - гидроксиапатита (5) и Ca2P2O7 (6). Показано, что в зависимости от
рН раствора основными равновесными с раствором являются фазы (4) и (5). Данные рентгенофазового
анализа, КР-спектроскопии и ЯМР на ядрах 31Р образцов ТСР после контакта с раствором 0.01 моль/л
NaNO3 около 10 сут показали присутствие только фазы (1). Растворимость фазы (1) по ионам Ca2+, PO43-
и стехиометрическое отношение (Ca/P) в растворах в зависимости от рН соответствует присутствию
фаз (4) или (5). Модель поверхностного комплексообразования в генриевской области адекватно опи-
сывает механизм сорбции Sr(II) поверхностной фазой (5) на частицах ТСР в виде комплекса SrHPO40.
Образование гуматного комплекса Sr(II) в растворе не влияет на Kd(Sr) в диапазоне концентраций ГК
0-150 мг/л из-за конкурентного влияния гидрофосфат-ионов на закомплексованность стронция.
Ключевые слова: трикальцийфосфат, сорбент, ионы стронция, сорбция, гуминовые кислоты.
DOI: 10.31857/S0033831123060072, EDN: NZEUIB
ВВЕДЕНИЕ
шевых сорбентов, производимых в промышленных
масштабах. Современные отечественные возмож-
Фосфаты кальция находят широкое применение
ности промышленного производства специализи-
в биологии, геохимии, агрохимии, промышленно-
рованных сорбентов, выпускаемых российскими
сти, медицине, ядерных технологиях. Функции и
предприятиям для очистки ЖРО низкого и среднего
области применения фосфатов кальция определя-
уровня активности, весьма немногочисленны и ка-
ются их структурой, составом, стабильностью и
саются в основном оксидов, фосфатов титана, цир-
растворимостью отдельных фаз. Эти свойства под-
кония, цианоферратов [8, 9].
робно обсуждаются в многочисленных междисци-
Дезактивация почв и земель сельскохозяй-
плинарных исследованиях [1-5].
ственного назначения сорбционными методами
Возрастание роли атомной энергетики в произ-
представляет существенно более сложную радио-
водстве энергоносителей требует постоянного со-
химическую задачу [10], учитывая масштабы про-
вершенствования технологических возможностей
изошедших в прошлом аварий в мире. Если техно-
предотвращения нештатных ситуаций на предпри-
логические решения по дезактивации почв от ра-
ятиях ядерно-топливного цикла. Среди них особая
дионуклидов цезия активно обсуждаются [11-13],
роль принадлежит поиску новых, более эффектив-
сорбционные методы выделения радионуклидов
ных и экономически доступных принципов и тех-
90Sr требуют дальнейшего поиска селективных со-
нологий дезактивации жидких (ЖРО) и твердых
рбентов [8, 10, 14, 15], методов их применения для
(ТРО) радиоактивных отходов [6, 7]. Переход к
дезактивации суспензий [16]. Известные походы к
перспективным экологически приемлемым и эко-
дезактивации почв основываются на механических,
номичным технологиям дезактивации требует де-
сорбционных, электрохимических, фито-сорбцион-
546
СОРБЦИЯ ИОНОВ Sr(II) ТРИКАЛЬЦИЙФОСФАТОМ
547
ных способах удаления радионуклидов [8, 12, 13,
нако экспериментальных сведений о влиянии ГК
17-20, 21]. Инженерная реализация таких способов
на растворимость труднорастворимых природных
не всегда чётко формулируется, но представляет
солей кальция крайне мало. Так, установлено, что
собой разновидности техники создания сорбцион-
при рН 8-9 и концентрации ГК 5-10 мг/л раство-
но-геохимического барьера на пути миграции 90Sr.
римость гипса снижается по сравнению с водным
Потенциально пригодными для дезактивации мо-
раствором без ГК из-за образования новых мине-
гут быть материалы группы труднорастворимых
ральных фаз [30]. ГК также замедляют кинетику
фосфатов кальция, выпускаемые в промышленных
растворения CaCO3 при рН > 4 [2]. В литературе
масштабах [1, 22]. Среди них вызывает интерес
нами не найдено количественных данных о влия-
трикальцийфосфат β-Ca3(PO4)2 (TCP, фосфоритная
нии гуминовых кислот на физико-химическое по-
мука) - труднорастворимое в воде соединение, ко-
ведение фосфатов кальция, включая TCP в водных
торое применяют в качестве удобрения для кислых
растворах.
почв [4, 5, 23]. Преимуществом ТСР является су-
Целью данной работы являлось совместное ис-
ществование его крупнотоннажного производства
следование растворимости и сорбционного поведе-
для предприятий сельского хозяйства и пищевой
ния ТСP по отношению к Sr(II) на уровне микрокон-
промышленности. Установлен ряд особенностей,
центраций для оценки возможности использования
характеризующих химические превращения TCP
TCP в качестве сорбента, способного локализовать
при его взаимодействии с водными растворами [3,
загрязнение почв радионуклидами Sr(II) на фоне
24-26].
высокой конкуренции других щелочноземельных
катионов и присутствия растворов гуминовых кис-
В системе Ca(OH)2-H3PO4-H2O выделяют
лот.
одиннадцать фосфатов кальция с различной сте-
хиометрией и растворимостью [25]. Нами рассмо-
МЕТОДИКА ЭКСПЕРИМЕНТА
трена возможность совместного присутствия в
водном растворе следующих фаз, химически свя-
Моделирование
занных с трикальцийфосфатом: гидроксид каль-
ция Ca(OH)2 (calcium hydroxide, CH), трикальций-
Моделирование растворимости ТСР проводили
фосфат α,β-Ca3(PO4)2 (tricalcium phosphate, ТСР),
с помощью программы HSC Chemistry и MathCad с
однозамещенный фосфат безводный Ca(H2PO4)2
учётом всех вероятных ионных частиц Ca(II) и из-
(monocalcium phosphate anhydrous, MCPA), двуза-
вестных фаз фосфатов кальция.
мещенный фосфат дигидрат CaHPO4·2H2O (dibasic
Для анализа по программе HSC Chemistry выбра-
calcium phosphate dihydrate, DCPD), гидроксиапатит
Ca5(PO4)3OH (hydroxyapatite, OHAp) и пирофосфат
ли условия совместного существования фаз фосфа-
кальция Ca2P2O7 (dicalcium pyrophosphate, DCPP).
тов кальция с участием 32 зависимых компонентов в
сосуществующих фазах. Газовая фаза: N2(g), O2(g),
Термодинамический анализ растворимости
H2O(g); водная фаза: H2O(l), PO4(-3a), H2PO4(-a),
ТСР (1) проведён в данной работе с учётом обра-
HPO4(-2a), H3PO4(a), Ca3(PO4)2(ia), Ca(H2PO4)2(ia),
зования CH (2), MCPA (3), DCPD (4), OHAp (5) и
CaOH(+a), Ca(OH)2(ia), CaHPO4(ia), OH(-a),
DCPP (6).
HP2O7(-3a), H2P2O7(-2a), H3P2O7(-a), H4P2O7(a),
По химической устойчивости и растворимости
Na(+a), NO3(-a), P2O7(-4a), H(+a), Ca(+2a), твёр-
в водных растворах ТСР занимает промежуточное
дые фазы: Ca3(PO4)2, Ca(OH)2, Ca(H2PO4)2,
положение между гидроксиапатитами и другими
CaHPO4·2H2O, Ca5(PO4)3OH, Ca2P2O7. Формулы
фосфатами кальция [25].
веществ приведены так, как записаны в тексте про-
Гуминовые кислоты (ГК), составляющие важ-
граммы. Условия анализа устойчивости фаз в под-
нейший компонент органического вещества почв
программе HSC Chemistry 8 Gem, состояли в том,
и торфов, реагируют с соединениями кальция и
что для заданного начального количества фазы ТСР
стронция, образуя комплексы [27-29], и могут вли-
в водном растворе проводили расчёт равновесного
ять на ход сорбции Sr(II) фосфатами кальция. Од-
состава раствора электролита (NaNO3) программ-
РАДИОХИМИЯ том 65 № 6 2023
548
ИОШИН и др.
нивали с результатами моделирования растворимо-
2.00
1.60
сти 32-компонентной системы по программе HSC
1.20
CaOH(+a)
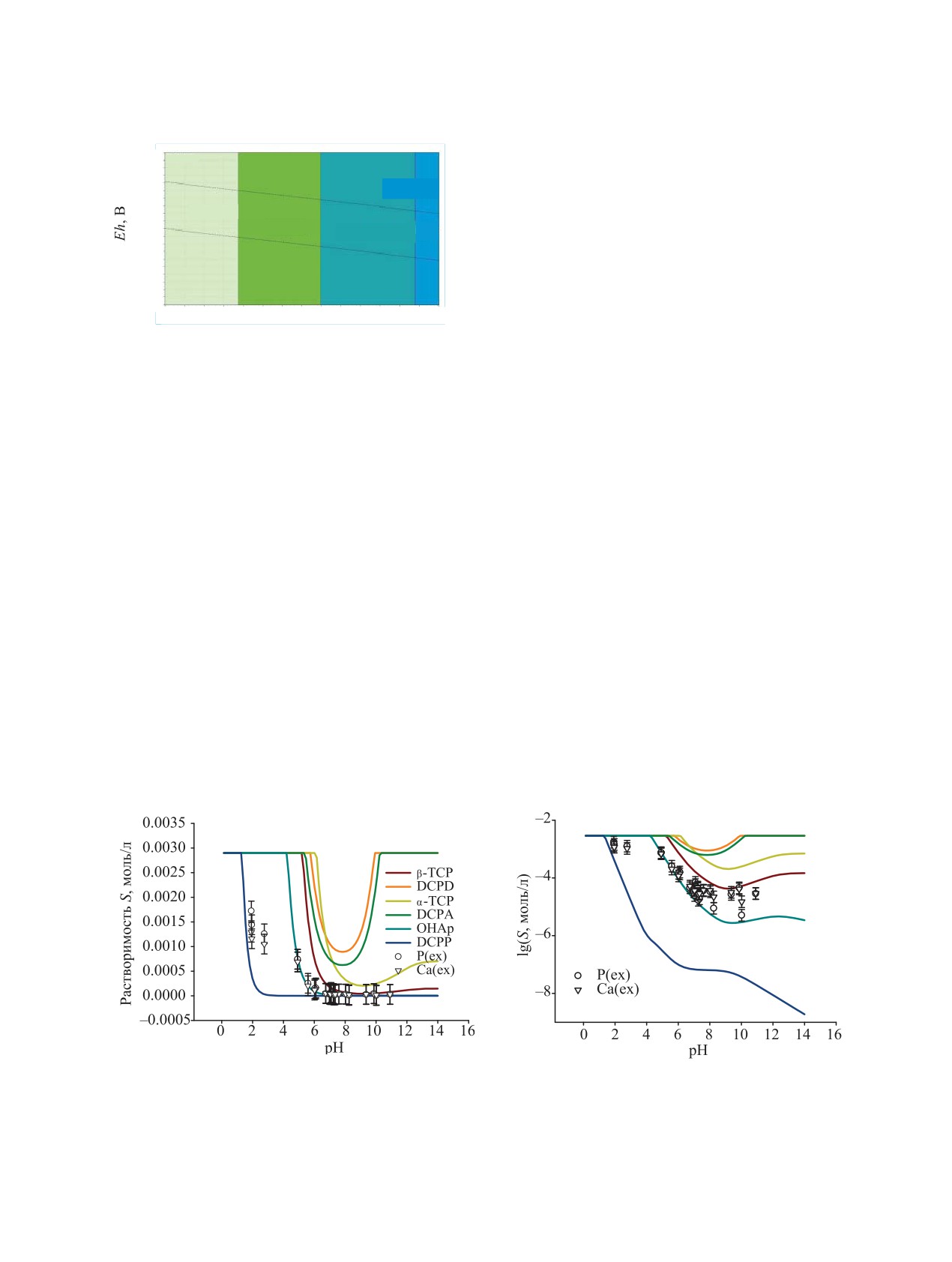
Chemistry, Eh-pH в координатах диаграммы Пурбэ.
0.80
Ca(+2a)
0.40
Пример полученных с помощью расчётных подпро-
CaHPO4*2H2O Ca5(PO42OH
)
0.00
грамм результатов показан на рис. 1, 2.
-0.40
-0.80
-1.20
Эксперименты
-1.60
–2.00
0
2
4
6
8
10
12
14
pH
В качестве объекта исследования использова-
ли β-Ca3(PO4)2 производства Sigma-Aldrich (≥95%
Рис. 1. Равновесное соотношение фаз при помещении
основного вещества, фазовая примесь - DCPP).
ТСР в водный раствор в зависимости от рН по данным мо-
делирования с использованием программ HSC Chemistry
Растворы гуминовой кислоты (Sigma-Aldrich) за-
8. Концентрация ТСР 1 ммоль/кг, температура 25℃.
данной концентрации готовили из раствора 0.5 г/л
ным способом, задавая переменную концентрацию
в 0.1 М NaOH (квалификация х.ч.). Для создания
Н+ при постоянной концентрации ОН--ионов в рас-
ионной силы использовали NaNO3 (квалифика-
творе или меняя концентрацию ОН--ионов в рас-
ция х.ч.). Для определения массовой концентра-
творе при заданной концентрации протонов. Такая
ции Sr(II) использовали ГСО 7145-95, Ca(II) - ГСО
процедура была эквивалентна кислотно-основному
7682-99, фосфора - ГСО 7241-96. Массовую кон-
«титрованию» смеси фаз за счёт изменения концен-
центрацию Ca(II), P(V) в электролите определяли
трации протонов и гидроксильных ионов при по-
методом атомно-эмиссионной спектроскопии на
стоянном объёме водной фазы и давлении. Раствор
приборе Optima 8000 (Perkin Elmer). Концентрацию
электролита рассматривали как идеальный раствор
Sr(II) определяли масс-спектрометрически (Elan
катионов, анионов и молекул с единичными коэф-
9000, Perkin Elmer). Контроль рН осуществляли с
фициентами активности. Расчёт конгруэнтной рас-
помощью рН-метра И-160.
творимости (S) труднорастворимых фосфатов по
Спектры комбинационного рассеяния образцов
программе MathCad 14 выполняли в соответствии с
измеряли при комнатной температуре с помощью
записью закона действующих масс для каждого со-
микроскопа-спектрометра InVia Reflex (Renishaw).
единения и стехиометрии для электронейтральной
Мощность лазера P = 10 мВт, длина волны λ =
смеси ионов в идеальном растворе электролита.
532 нм. Рентгенофазовый анализ проводили на
Полученные по результатам расчёта данные срав-
рентгеновском автодифрактометре XRD
7000
ɚ
ɛ
Рис. 2. Результаты расчёта растворимости (S) индивидуальных Са-фосфатных фаз по фосфат-ионам (моль/л) в зависимости
от рН, полученные с помощью программы MathCad. Линейная (а) и логарифмическая (б) шкалы S. Растворимость рассчи-
тывали по данных ПР отдельных фаз [3, 25]. Точки - экспериментальная растворимость S, найденная по ионам Ca(II) и Р(V)
в нескольких сериях экспериментов, моль/л. На логарифмической шкале растворимости черные и белые кружки - расчёт-
ные величины растворимости гидроксиапатита стронция (OHAp_Sr) и дистронцийфосфата дигидрата (DSrDH), [40].
РАДИОХИМИЯ том 65 № 6 2023
СОРБЦИЯ ИОНОВ Sr(II) ТРИКАЛЬЦИЙФОСФАТОМ
549
ɚ
ɂɫɯɨɞɧɵɣ ȕ &D3(PO4)2
T
968
ɛ
ȼɵɞɟɪɠɚɧɧɵɣ
T ± ȕ &D3(PO4)2
ɜ ɪɚɫɬɜɨɪɟ
P ± ȕ &D
P2O7
2
948
T
T
1044
406
T
T
T
T T
438
T
P
610
1086
T
T
T
T
T
T
T
T
T
479547
625737
P
P
T TTT
T
T
T
T
¨Ȟ ɫɦ-1
ș ɝɪɚɞ ɦ ɞ
ɜ
5
±
±
31P 0$; ɯɢɦ ɫɞɜɢɝ SSP
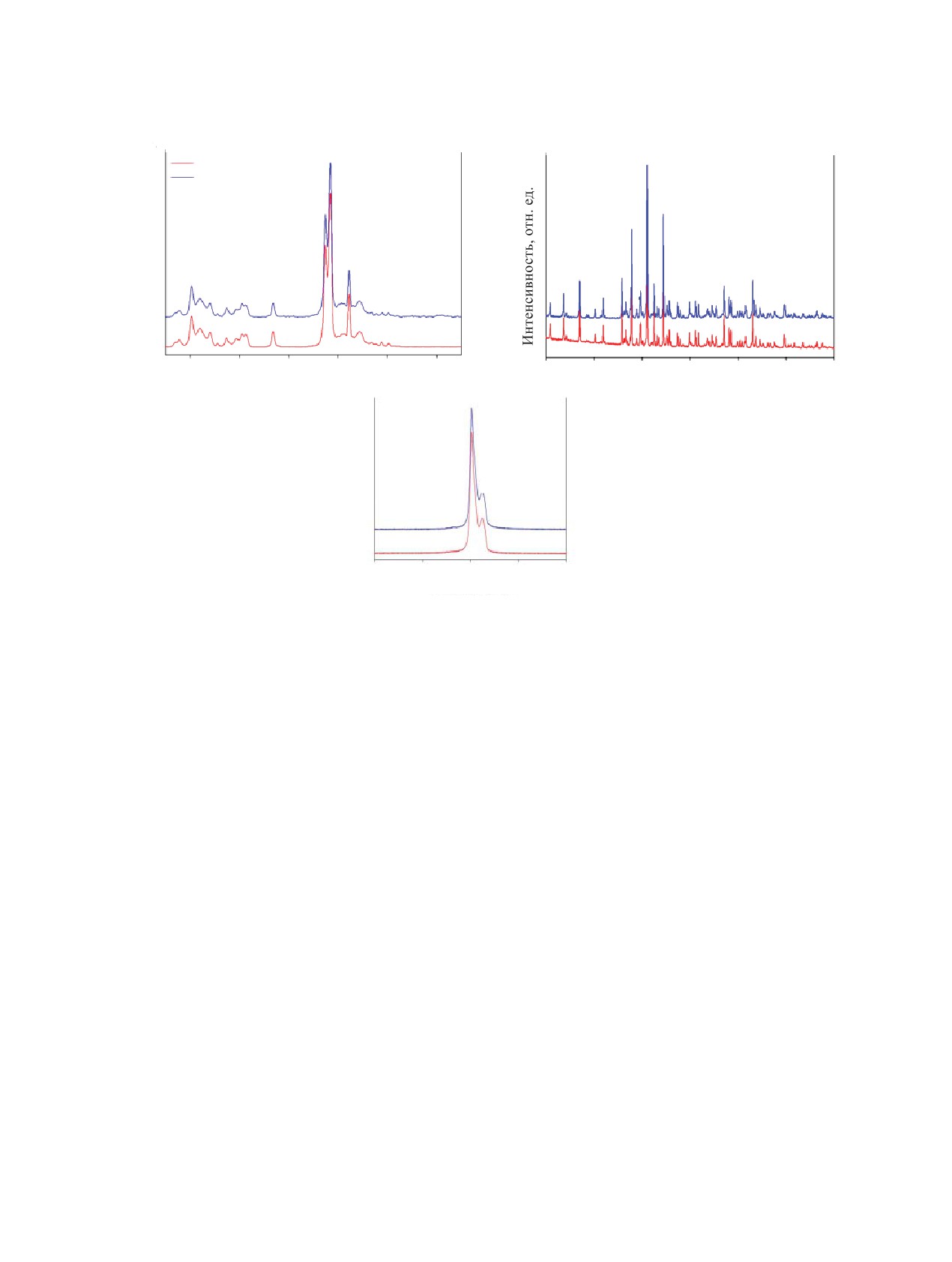
Рис. 3. Спектры КР (а), рентгеновской дифракции (б) и ЯМР на ядрах 31P (в) исходного TCP и воздушно-сухого фосфата
после выдержки в растворе ГК.
(Shimadzu) с использованием монохроматического
концентрации ионов Sr(II) в растворе электролита
CuKα-излучения. Расшифровку дифрактограмм вы-
6.0-60.0 мкмоль/л.
полняли методом Ритвельда в программе FullProf.
Спектры ЯМР 31P получали с помощью спектроме-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
тра Agilent 400 WNMR при частоте 12 кГц методом
кросс-поляризации с вращением под «магическим
Поскольку ТСР и другие фосфаты кальция об-
углом» (MAS), рис. 3.
ладают конечной растворимостью, зависящей от
Для определения растворимости и стехиометри-
кислотности раствора, для корректного термодина-
ческого отношения (Ca/P) в электролите в ёмкость
мического описания сорбционного поведения ТСР
из полипропилена объёмом 60 мл приливали 50 мл
необходимо было установить область устойчивости
раствора хлорида стронция в 0.01 моль/л NaNO3
фаз фосфатов кальция в зависимости от рН. Тер-
с установленным рН и добавляли 20 мг порош-
модинамическое моделирование растворимости
ка ТСР. Растворы перемешивали на орбитальном
и взаимных превращений фосфатов показало, что
встряхивателе HY-5 со скоростью 50 мин-1. Затем
ТСР не является в условиях эксперимента основ-
растворы оставляли на 7 сут для экспозиции. После
ной термодинамически устойчивой фазой в диапа-
выдержки растворы отделяли на центрифуге MPW-
зоне рН 3.0-12.0. Основными устойчивыми фазами,
310 при скорости 9000 об/мин в течение 7 мин. Фу-
согласно построенной диаграммы Пурбэ, являются
гат отбирали в пробирки для анализа и добавляли
фаза DCPD при 3.6 < рН < 7 и фаза ОНАр при рН > 7
2 капли концентрированной азотной кислоты для
(рис. 1). Из результатов расчёта растворимости ин-
подготовки проб к определению массовой концен-
дивидуальных фосфатов кальция в зависимости от
трации элементов. Сорбционные эксперименты
рН (рис. 2) видно, что область устойчивости ОНАр
выполняли в статике при тех же условиях, что экс-
занимает более широкий диапазон рН. Поскольку
перименты по растворимости ТСР, при начальной
растворимость DCPD выше, чем у ОНАр, устойчи-
РАДИОХИМИЯ том 65 № 6 2023
550
ИОШИН и др.
вость обоих фосфатов в равновесном растворе регу-
лируется присутствием гидроксиапатита (рис. 1, 2).
По данным ЯМР 31Р, рентгенофазового анализа
и КР-спектроскопии исходного и экспонирован-
ного в растворе электролита трикальцийфосфата,
их фазовый и химический состав соответствует
β-Ca3(PO4)2 [31]. В спектрах образцов ТСР после
контакта с растворами электролита отсутствуют ли-
нии поглощения равновесных продуктов - DCPD и
OHAp (рис. 3).
Измерение растворимости S и мольного отноше-
ния (Ca/P) в растворах над осадком TCP показало,
что зависимость S-рН совпадает с изотермой рас-
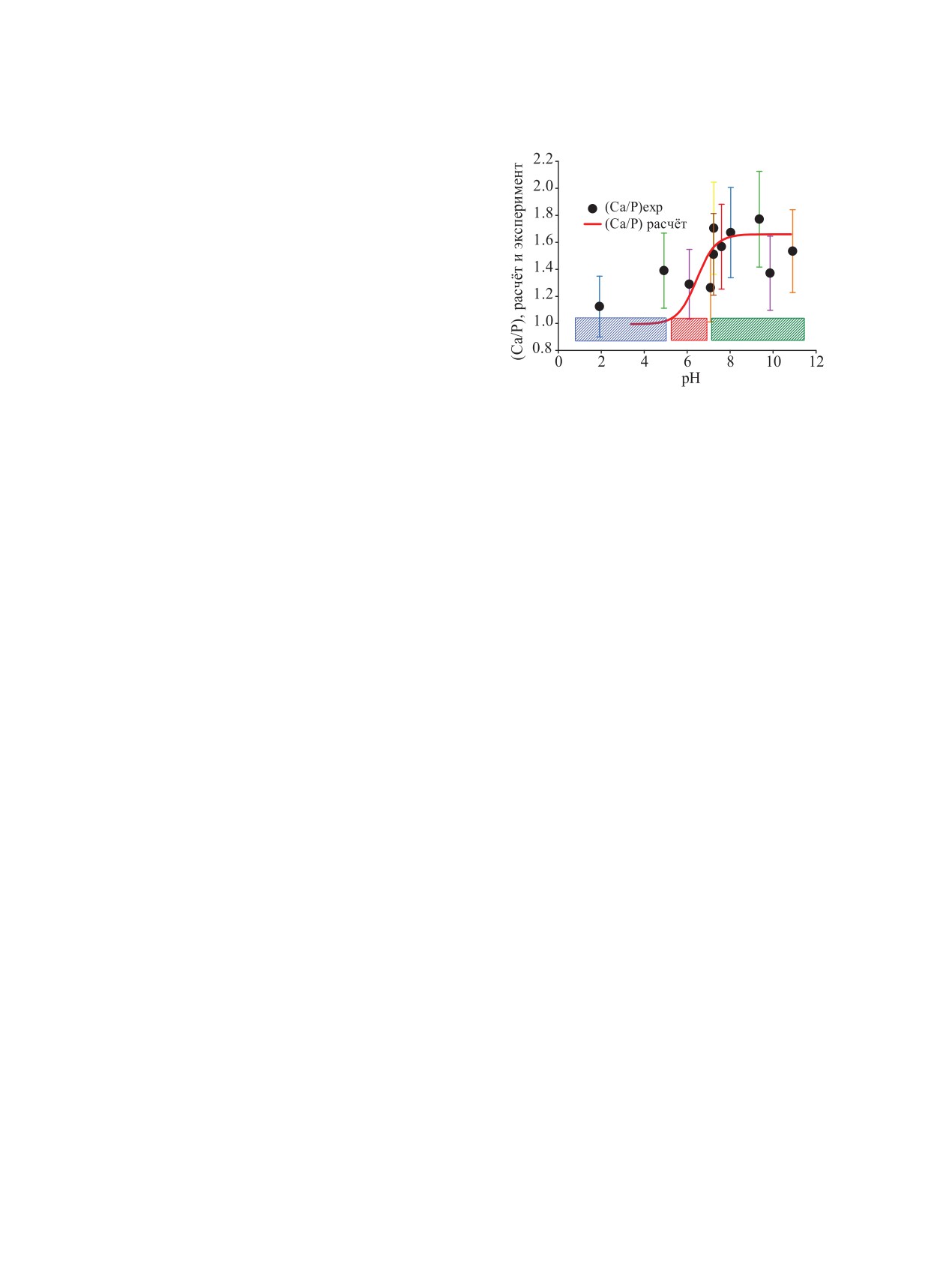
Рис. 4. Сравнение расчётной (цветная линия) и экспери-
ментальной величины стехиометрического отношения
творимости ОНАр при рН > 5, а при рН 2-5 она
(Ca/P) в раствор над кристаллами ТСР. Заштрихованы
соответствует растворимости фазовой примеси
зоны преобладания DCPD-DCPP (синяя), OHAp (зелё-
DCPP (рис. 2). Наблюдаемые отношения (Ca/P) в
ная), переходная зона составов (красная) по данным тер-
растворе над осадком при рН 2-12 изменяются от
модинамического расчёта. Температура 23℃.
1.00 до 1.66 (рис. 4, 5). Найденные растворимость
ности определения концентрации. Такое взаимное
S и мольное отношение (Ca/P) согласуются с рав-
изменение концентрации ионов C(Sr)-С(P)-C(Ca)
новесным распределением фаз DCPD, примесной
в сорбенте и растворе означает, что сорбция строн-
фазы DCPP и OHAp с учётом их индивидуальной
ция активными центами поверхности кристаллов
растворимости (рис. 1, 2). По данным измерения
OHAp/TCP происходит в виде фосфатного ком-
фазового состава кристаллов ТСР, экспонирован-
плекса. Альтернативой этому сорбционному про-
ных в растворе электролита (рис. 3), наблюдаемое
цессу является осаждение смешанного труднорас-
равновесие не касается основной массы зёрен ис-
творимого фосфата Sr - Ca на поверхности зёрен
ходного ТСР и относится к некоторому небольшому
кристаллов ТСР. Этот сорбционный механизм,
по массе поверхностному слою вокруг частиц ТСР,
идентифицированный В.В. Вольхиным как гетеро-
контактирующему с раствором электролита [26].
Этот вывод согласуется с литературными данными
генная ионообменная реакция (ГИОР, [32]), обла-
о примесном составе ТСР при его осаждении из во-
дает общим признаком: отношение концентраций
дных растворов, где фиксируются кристаллические
ионов-конкурентов (в нашем случае, отношение
примеси DCPD и OHAp [1, 20].
ионов (Sr/Ca) в растворе над сорбентом должно со-
храняться постоянным во всем диапазоне действия
Неравновесный фазовый состав ТСР сказывает-
механизма).
ся на его сорбционных свойствах. Изотерма сорб-
ции ионов Sr(II) кристаллами ТСР в зависимости
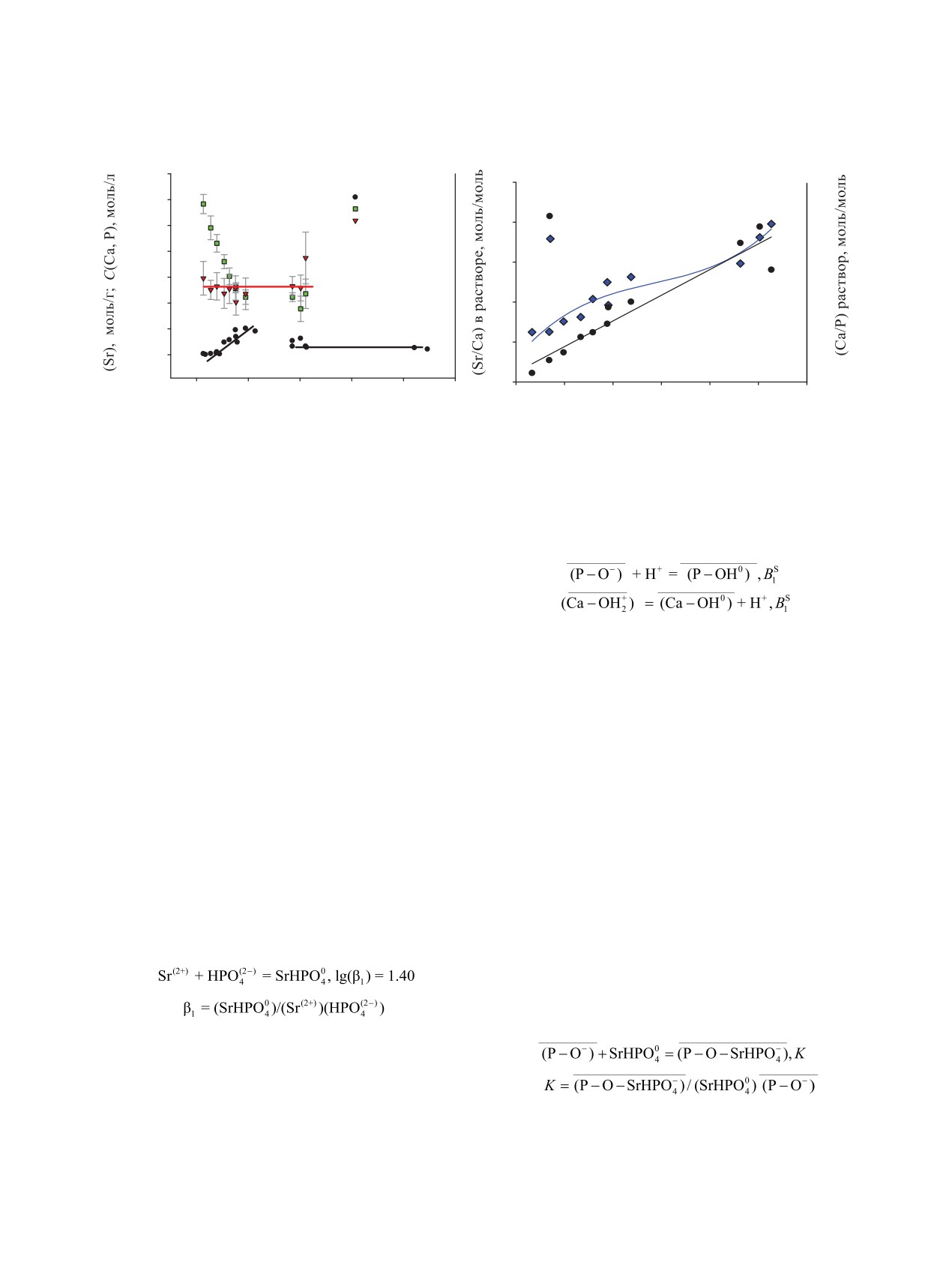
Из экспериментальных данных видно, что от-
от равновесной концентрации ионов стронция в
ношение Sr/Ca в растворе существенно меняется в
растворе имеет сложный вид. Это следует из сопо-
ходе сорбционного процесса (рис. 5). Ещё один при-
ставления изотермы сорбции с изменением раство-
знак заметной сорбции по механизму ГИОР состо-
римости фосфата по ионам Ca, P и их соотношению
ит в необходимости существенного различия про-
в растворе сорбата при рН 8.0 ± 0.5 (рис. 5). Началь-
изведений растворимости солей обменивающихся
ный участок изотермы сорбции стронция при кон-
катионов, в нашем случае Sr- и Ca-фосфатов, DCPD
центрации (0-5) × 10-6 моль/л подчиняется уравне-
или OHAp, либо их смешанных солей. По дан-
нию Генри с Kd = (2.5 ± 1.6) × 103 мл/г (рис. 6).
ным TG-DTA-анализа, исходный ТСР не содержит
Из данных рис. 5 видно, что рост концентрации
воды, а линия потери массы образца с продуктом
Sr(II) в растворе сопровождается линейным умень-
сорбции соответствует удалению ~10 молекул воды
шением в растворе концентрации фосфат-ионов при
гидратной оболочки сорбированных ионов Sr(II).
сохранении концентрации ионов Ca(II) на постоян-
Это не противоречит представлениям о том, что
ном уровне 2.8 × 10-5 моль/л в пределах погреш-
сорбированный Sr(II) находится не в объёме ТСР,
РАДИОХИМИЯ том 65 № 6 2023
СОРБЦИЯ ИОНОВ Sr(II) ТРИКАЛЬЦИЙФОСФАТОМ
551
7 × 10-5
ɚ
ɛ
0.5
2.0
C (Sr) ɫɨɪɛɟɧɬ
6 × 10-5
C (P) ɪɚɫɬɜɨɪ
(Sr/CD ɪɚɫɬɜɨɪ
C(Ca) ɪɚɫɬɜɨɪ
0.4
5 × 10-5
1.5
(Ca/P)ɪɚɫɬɜɨɪ
4 × 10-5
0.3
3 × 10-5
1.0
2 × 10-5
0.2
10-5
0.5
0.1
0
0.0
0.0
0
5.0 × 10-6
1.5 × 10-5
2.5 × 10-5
0
4.0 × 10-6
8.0 × 10-6
1.2 × 10-5
Ʉɨɧɰɟɧɬɪɚɰɢɹ ɢɨɧɨɜ Sr ɜ ɪɚɫɬɜɨɪɟ, ɦɨɥɶ/ɥ
Ʉɨɧɰɟɧɬɪɚɰɢɹ Sr ɜ ɪɚɫɬɜɨɪɟ, ɦɨɥɶ ɥ
Рис. 5. (а) изотерма сорбции Sr(II) кристаллами ТСР (1), изменение в растворе концентрации ионов Ca (2), P (3). (б) изме-
нение отношения Ca/P в растворе в зависимости от равновесной концентрации ионов Sr(II). Солевой фон 0.01М NaNO3, рН
8, температура раствора 23℃.
а во внешней обкладке двойного слоя и координи-
Согласно работам [35, 36], кислотно-основные
рован на фосфатную группу в поверхностном слое
свойства фазы OHAp характеризуются следующи-
OHAp/TCP вместе со своим гидратным окружени-
ми реакциями протонного обмена:
ем. Таким образом, характер изменения концентра-
,
ции компонентов сорбционной системы в растворе
(2)
противоречит предположению о сорбции Sr(II) по
механизму ГИОР. Поэтому далее интерпретацию
Константа протонирования BS соответствует пре-
результатов, полученных в области концентрации
обладанию в исследуемой области рН 5-10 сорбци-
онных центров анионного типа (≡P-O-). Поскольку
Sr(II) 0-5 мкмоль/л, основывали на представлени-
в этом диапазоне рН наблюдается рост поглощения
ях о сорбции ионов стронция функциональными
ионов стронция ТСР, далее принято, что за сорбцию
группами гидроксиапатита (2) в зоне поверхност-
нейтрального фосфатного комплекса SrHPO40 отве-
ного слоя OHAp/TCP по механизму поверхностного
чают центры этого вида, Взаимодействию с ними
комплексообразования (рис. 5, 6). С ростом концен-
электронейтрального комплекса SrHPO0 не препят-
трации Sr(II) выше 10 мкмоль/л начинается ионооб-
ствует кулоновский барьер анионных центров [36].
менный процесс замещения Ca(II)-Sr(II) в твердой
Из двух присутствующих в растворе форм строн-
фазе [15, 20, 32, 33].
ция - Sr2+ и SrHPO0 - преобладающим является
электронейтральный гидрофосфатный комплекс,
Склонность катионов Ca(II), Sr(II) к образова-
который и определяет весь процесс межфазного
нию в присутствии фосфат-ионов электронейтраль-
распределения Sr(II) меду раствором и кристалла-
ных гидрофосфатных комплексов, по данным рабо-
ми ТСР.
ты [34], характеризуется следующей реакцией:
Модель поверхностного комплексообразования
,
сорбируемых ионов [35, 36] даёт следующее выра-
жение для реакции сорбции электронейтрального
(1)
комплекса
Величина константы устойчивости (β1) комплек-
,
са SrHPO4 при нулевой ионной силе хотя и ниже,
чем у комплекса CaHPO4 (lgβ1 = 2.74), [34]), но спо-
(3)
собна обеспечить преобладание этих комплексов в
Черта сверху означает принадлежность к твёр-
растворе над поверхностным слоем OHAp/TCP.
дой фазе. K - концентрационная константа гетеро-
РАДИОХИМИЯ том 65 № 6 2023
552
ИОШИН и др.
генной реакции сорбции, круглые скобки являются
4.0
символом аналитической концентрации химиче-
ской формы элемента в растворе и в сорбенте. Об-
3.5
щий (брутто) коэффициент распределения Kd ионов
стронция для обсуждаемой системы имеет вид [37]
3.0
(4)
2.5
Для того чтобы учесть протекающие в гетероген-
2.0
ной системе побочные реакции, определим реакции
протонирования сорбционного центра фосфата [36,
1.5
38] для кислой-слабощелочной областей рН:
-5.6
-5.4
-5.2
-5.0
-4.8
-4.6
lg(Sr, ɦɨɥɶ/ɥ)
Рис. 6. Влияние концентрации ионов Sr(II) в растворе
,
(5)
на Kd Sr(II) кристаллами ТСР. Электролитический фон
, рН 8, температура раствора 23℃.
0.01 моль/л NaNO3
где h - концентрация протонов в растворе, моль/л,
B1s - константа протонирования (≡P-O-)-группы
рН виде изотермы Kd-рН (рис. 7). После установ-
фосфата, л/моль, G0,P - общая сорбционная ёмкость
ления качественного согласия формы изотермы по
фосфатного сорбента и ёмкость (≡P-O-)-групп,
уравнению (7) экспериментальным данным в ген-
моль/кг. Изменение состава фосфат-ионов опреде-
риевской области равновесных концентраций Sr(II)
ляется уравнением материального баланса:
(рис. 5, 6) находили МНК-оценки всех входящих в
уравнение (7) параметров. Сравнение установлен-
ных параметров (7) с табулированными значения-
ми (Bs, KH(1,2,3), β1) [34, 36] показало их согласие в
пределах погрешности (табл. 1).
,
(6)
Из сопоставления данных таблицы можно за-
где P0 - общая концентрация фосфора в растворе
ключить, что механизм сорбции ионов стронция
в условиях эмпирического равновесия, F - вспо-
TCP в области Генри определяется образованием
могательная функция, KH(1,2,3) - константы про-
и поглощением электронейтрального комплекса
тонирования фосфат-ионов в растворе. Результаты
стронция SrHPO0 отрицательно заряженными фос-
сорбционных экспериментов дают возможность
фатными группами (≡P-O-) с образованием поверх-
количественно оценить соответствие предлагаемых
ностного сорбционного комплекса по реакции (3).
модельных представлений о сорбции Sr(II) наблю-
Кислотно-основные свойства фосфатных групп, об-
даемой картине.
разующих сорбционный комплекс (B1s ~107 л/моль,
Kd(Sr) ~ 2 × 103 мл/г), идентичны таковым групп
Из уравнений (3), (5) следует итоговая система
≡P-O- гидроксиапатита [20, 36]. Процесс сорбции
уравнений (7) рассматриваемой модели, в которой
фосфатного комплекса завершается, когда концен-
связаны зависимая (Kd) и независимая (pH) пере-
трация ионов PO3- в растворе над осадком сорбен-
менные:
та достигнет минимальной величины (рис. 5, а,
точки 3). При более высоких концентрациях Sr(II)
сорбция по данному механизму сменяется ионо-
обменным механизмом замещения ионов Ca(II)
ионами Sr(II) в гидроксиапатите (рис. 6) [32, 33].
(7)
Этот вывод согласуется с данными по влиянию
Проверку модели (7) выполняли, используя экс-
концентрации фосфат-ионов на сорбцию комплек-
периментальные данные по сорбции Sr(II) частица-
са стронция SrHPO40: их увеличение в растворе ве-
ми ТСР для области начальной концентраций Sr(II)
дёт к росту Kd стронция в соответствии с принятой
в растворе менее 5 × 10-6 моль/л в зависимости от
моделью (рис. 7, вставка).
РАДИОХИМИЯ том 65 № 6 2023
СОРБЦИЯ ИОНОВ Sr(II) ТРИКАЛЬЦИЙФОСФАТОМ
553
сильно взаимодействие ГК с ионами кальция и
3.4
фосфат-ионами в растворе проявляется в области
рН 7-8 (рис. 8). Увеличение отношения Ca/P с ро-
3.2
стом концентрации ГК вызвано параллельным ро-
4.0
3.0
Kd-PO4
стом концентрации Ca(II), присутствующего в гу-
3.5
ɗɤɫɩɟɪɢɦɟɧɬ
3.0
Ɇɨɞɟɥɶ
матном растворе [29].
2.8
2.5
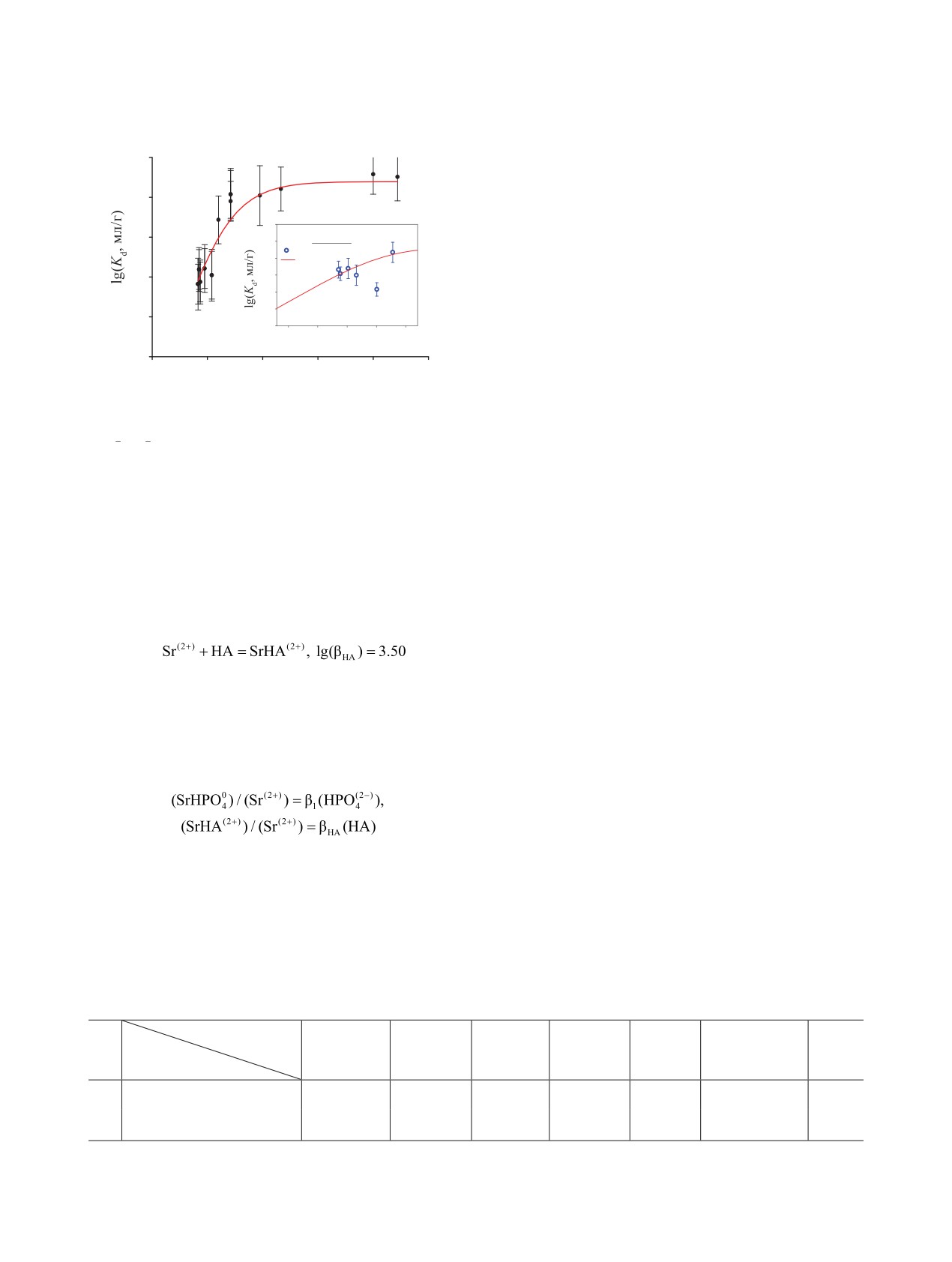
На рис. 9 показаны результаты расчёта заком-
2.0
1.5
плексованности ионов стронция с гидрофосфат-и-
2.6
1.0
онами и молекулами ГК по данным о концентрации
-5.5
-5.0
-4.5
-4.0
-3.5
), ɦɨɥɶ/ɥ
C(PO4
свободной ГК и HPO2--ионов в растворе над сор-
2.4
6
7
8
9
10
11
бентом. Согласно оценочному расчету, при кон-
ɪɇ
центрации ГК не более 5 × 10-5 моль/л в растворе
Рис. 7. Изотерма сорбции ионов Sr(II) частицами ТСР в
над сорбентом доминирует фосфатный комплекс.
зависимости от рН и концентрации PO43--ионов (вставка
Kd-PO4); pH 8.0 ± 0.5, 0.01 NaNO3, температура раствора
С дальнейшим ростом концентрации ГК в раство-
23℃. Линии - результат регрессионного анализа данных
ре начинает преобладать положительно заряжен-
по уравнению модели поверхностного комплексообразо-
ный гуматный комплекс стронция. Можно видеть,
вания (7).
что в пределах погрешности коэффициент распре-
Предварительную оценку влияния концентра-
деления остаётся постоянным и равным Kd(Sr) в
ции гуминовых кислот на сорбцию ионов Sr(II) ча-
растворе без ГК (рис. 9). Вплоть до концентрации
стицами ТСР выполняли с использованием данных
5 × 10-4 моль/л (~150 мг) гуминовая кислота в обла-
по комплексообразованию согласно уравнениям ре-
сти рН 7-10 не влияет на сорбцию гидрофосфатно-
акций (1), (8) [27] и данных [39], характеризующих
го комплекса стронция частицами ТСР.
устойчивость гуматного комплекса стронция
Равновесная оценка устойчивости и раствори-
мости ТСР (1) в равновесных пересыщенных рас-
(8)
творах с учётом продуктов (2)-(6) показала, что
В уравнении (8) символ SrHA(2+) относится к со-
наиболее устойчивыми во всем диапазоне рН явля-
ставу комплекса Sr(II) : ГК = 1 : 1 [39]. Уравнения (1)
ются фазы (5), (4). Пирофосфат кальция (6), если
и (8) приводят к следующему выражению для доли
он находится в исходном ТСР в качестве примеси,
закомплексованного Sr(II) в виде гидрофосфатного
также сохраняется в качестве равновесного про-
и гуматного комплексов (закомплексованности)
дукта. Экспериментально определённая раство-
римости (S) образцов TCP по ионам Ca2+, PO3- и
стехиометрическое отношение Ca/P в растворе в
(9)
зависимости от рН соответствуют равновесным фа-
Из зависимости растворимости ТСР от рН при
зам (5) и/или (4), которые, вероятно, присутствуют
различных концентрациях ГК следует, что кис-
в относительно небольшой поверхностной области
лотность влияет на стехиометрию растворения
зёрен исходного неравновесного материала ТСР.
ТСР в присутствии гуминовых кислот. Наиболее
Образование поверхностного слоя продукта харак-
Таблица 1. Параметры регрессионного уравнения (7) -lg(KHi, Bs, β1), характеризующие статистическое согласие
эмпирических параметров модели сорбции по реакциям (3)-(6) с термодинамическими данными [34, 36]. SSE, Adj.
r2 относятся к линейной корреляции данных в строках 1 и 2.
Стандартная
)
lg(KHi, Bs, β1
s
№
KH11
KH2
KH3
B
β1
погрешность
Adj. r2
Источник
(SSE)
1
Уравнение (7)
12.4 ± 2.3
6.80 ± 5.2
1.80 ± 1.7
6.80 ± 7.2
4.4 ± 7.0
0.59
0.97
2
[34, 36]
12.34
7.20
2.14
6.68
1.4
РАДИОХИМИЯ том 65 № 6 2023
554
ИОШИН и др.
распределения Kd(Sr) уменьшается до 2 × 102 мл/г
в связи с переходом от механизма поверхностного
комплексообразования к катионообменной сорб-
ции.
Таким образом, получены новые данные о сор-
бционном поведении β-трикальцийфосфата (TCP)
по отношению к микроконцентрациям Sr(II) в за-
висимости от концентрации катиона, рН и кон-
центраций гуминовых кислот (ГК) в растворе. По
результатам термодинамического анализа с учётом
возможности совместного образования фаз ТСР (1),
Ca(OH)2 (2), Ca(H2PO4)2
(3), CaHPO4·2H2O
(4),
Ca5(PO4)3OH (5), Ca2P2O7 (DCPP, 6) установлено,
Рис. 8. Растворимость ТСР в растворах ГК различной
что фаза (1) неустойчива во всём диапазоне рН. В
концентрации как функция рН при температуре 23℃.
зависимости от рН раствора основными равновес-
терно для диффузионно-контролируемых реакций
ными с раствором являются фазы (4) и (5). Экспе-
с участием фосфат-ионов [42]. Подтверждают это
риментальная растворимость фазы (1) по ионам
предположение также результаты термодинами-
Ca2+, PO3- и стехиометрическое отношение Ca/P в
ческого моделирования и экспериментального ис-
растворах соответствуют фазам (4) или (5) в зави-
следования изотерм сорбции ионов стронция ТСР
симости от рН. Однако данные рентгенофазового
при изменении рН. Изотермы сорбции отвечают
анализа, КР-спектроскопии и ЯМР на ядрах 31Р об-
уравнению Генри с коэффициентом распределения
разцов ТСР после контакте с раствором 0.01 моль/л
Kd(Sr) = 2 × 103 мл/г при равновесной концентра-
NaNO3 около 10 сут показывают присутствие толь-
ции Sr(II) в растворе менее 5 мкмоль/л в диапазоне
ко макроскопической фазы (1). Это, по мнению
рН 7-11. Модель поверхностного комплексообразо-
авторов, вызвано формированием на поверхности
вания (5)-(7) в генриевской области адекватно опи-
частиц фазы (1) слоя равновесной фазы (5). Под-
сывает механизм сорбции Sr(II) поверхностной фа-
тверждением данной гипотезы является совокуп-
зой гидроксиапатита на частицах трикальцийфос-
ность экспериментальных данных по сорбции и
фата, OHAp/ТСР, в виде комплекса SrHPO0. При
её физико-химическая интерпретация. Модель по-
более высоких концентрациях Sr(II) коэффициент
верхностного комплексообразования в генриевской
4
Kd(Sr)
Рис. 9. Влияние концентрации гуминовых кислот (НА, Sigma-Aldrich) на конкуренцию закомплексованности иона Sr(II)
ионами HPO2- и ГК при сорбции частицами ТСР. Электролитический фон 0,01 моль/л NaNO3, pH 7.5-8.3, температура
22℃. Прерывистые линии - границы 95%-ного интервала изменения Kd в эксперименте.
РАДИОХИМИЯ том 65 № 6 2023
СОРБЦИЯ ИОНОВ Sr(II) ТРИКАЛЬЦИЙФОСФАТОМ
555
области адекватно описывает механизм сорбции
13. Воронина А.В., Куляева И.О., Гупта Д.К. // Ра-
микроколичеств Sr(II) в виде комплекса SrHPO0
диохимия. 2018. Т. 60, №1. С. 35 (Voronina A.V.,
Kulyaeva I.O., Gupta D.K. // Radiochemistry.
2018.
поверхностной фазой (5) как равновесный процесс.
Vol. 60. Р. 35).
Образование гуматного комплекса Sr(II) в растворе
14. Сапожников П.М., Онищенко Е.А. // Проблемы агро-
не влияет на Kd(Sr) в диапазоне концентраций ГК
химии и экологии. 2021. Т. 3-4. С. 74.
0-150 мг/л из-за конкурентного влияния гидрофос-
15. Иванец А.И., Шашкова И.Л., Китикова Н.В.,
фат-ионов на закомплексованность стронция.
Дроздова Н.В., Сапрунова Н.А., Радкевич А.В.,
Кульбицкая Л.В. // Радиохимия. 2014. Т. 56, № 1.
ФОНДОВАЯ ПОДДЕРЖКА
С. 30 (Ivanets A.I., Shashkova I.L., Kitikova N.V.,
Drozdova N.V., Saprunova N.A., Radkevich A.V.,
Kul'bitskaya L.V. // Radiochemistry. 2014. Vol.
56.
Работа выполнена по планам бюджетных тем
P. 32).
АААА-А19-119031890028-0 и FUWF-2024-0012.
16. Polyakov E.V., Ioshin A.A., Volkov I.V // Remediation
Measures for Radioactively Contaminated Areas / Eds
КОНФЛИКТ ИНТЕРЕСОВ
D.K. Gupta, A. Voronina. Springer, 2019. P. 65.
17. Remediation Measures for Radioactively Contaminated
Авторы заявляют об отсутствии конфликта ин-
Areas / Eds D.K. Gupta, A. Voronina. Springer, 2019.
тересов.
18. Yasutaka T., Naito W., Nakanishi J. // PLOS ONE. 2013.
Vol. 8, N 9. P. e75308.
СПИСОК ЛИТЕРАТУРЫ
19. Санжарова Н.И., Сысоева А.А., Исамов Н.Н., Алек-
сахин Р.М., Кузнецов В.К., Жигарева Т.Л. // Росс.
1.
Щегров Л.Н. Фосфаты двухвалентных металлов.
хим. журн. 2005. Т. XLIX, № 3. С. 26.
Киев: Наукова думка, 1987. 216 с.
20. Иванец А.И., Шашкова И.Л., Китикова Н.В., Радке-
2.
Compton R.G., Sanders G.H.W. // J. Colloid Interface
вич А.В., Давыдов Ю.П. // Радиохимия. Т. 57, № 6.
Sci. 1993. Vol. 158. P. 439.
С. 521 (Ivanets A.I., Shashkova I.L., Kitikova N.V.,
3.
Chow L.C. // J. Ceram. Soc. Jpn. 1991. Vol. 99, N 10.
Radkevich A.V., Davydov Yu.P. // Radiochemistry.
P. 954-964.
2015. Vol. 57. P. 610).
4.
Горячкина К.А., Нефедьева В.В., Варламова Л.Д. //
21. İnan S. // J. Radioanal. Nucl. Chem. 2022. Vol. 331.
Вестн. Нижегор. гос. сельскохоз. акад. 2013. Т. 3.
P. 1137.
С. 360.
22. Nishiyama Yu., Hanafusa T., Yamashita J., Yamamoto Y.,
5.
Кулеш О.Г., Мезенцева Е.Г., Симанков О.В., Шведо-
Ono T. // J. Radioanal. Nucl. Chem. 2016. Vol. 307.
ва О.А. // Почвоведение и агрохимия 2020. Т. 1, № 64.
P. 1279-1285.
С. 94-103.
23. Титова В.И., Варламова Л.Д., Дабахова Е.В., Баха-
6.
рев А.В. // Агрохим. вестн. 2011. № 2. С. 3.
ekonomika/12751945 (22.10.2022).
24. Gregory T.M., Moreno E.C., Patel J.M., Brown W.E. //
7.
Господарчик М.М. Международное агентство
J. Res. Natl. Bur. Stand. A: Phys. Chem. 1974. Vol. 78A,
N 6. P. 667.
(24.10.2022).
25. Tung M.S. Calcium phosphates: structure, composition,
8.
Милютин В.В., Некрасова Н.А., Каптаков В.О. // Ра-
solubility, and stability
// Calcium Phosphates in
диоактивные отходы. 2020. Т. 4, № 13. С. 80.
Biological and Industrial Systems / Ed. Z. Amjad.
9.
Remez V.P., Zheltonozhko E.V., Sapozhnikov Yu.A. //
Kluwer Academic, 1998.
Radiat. Protect. Dosim. 1998. Vol. 75, № 1-4. P. 77.
26. Dorozhkin S.V. // World J. Methodol. 2012. Vol. 26,
10. Российский национальный доклад: 35 лет Черно-
N 2(1). P. 1.
быльской аварии: Итоги и перспективы преодоле-
27. Волков И.В., Поляков Е.В. // Радиохимия. 2020. Т. 62,
ния ее последствий в России 1986-2021 / Под ред.
Л.А. Большова. М.: Академ-Принт, 2021. 104 с.
№ 2. C. 93 (Volkov I.V., Polyakov E.V. // Radiochemistry.
11. Shashkova I.L., Ivanets A.I., Kitikova N.V., Sillanpää M. //
2020. Vol. 62. P. 141).
J. Taiwan Inst. Chem. Eng. 2017. Vol. 80. P. 787.
28. Поляков Е.В., Волков И.В., Иошин А.А., Чеботи-
12. Nikitin N.A., Shurankova O.A., Popova O.I.,
на М.Я., Гусева В.П. // Радиохимия. 2020. Т. 62,
Cheshyk I.A., Spirov R.K. // Remediation Measures for
№ 1. С. 56 (Polyakov E.V., Volkov I.V., Ioshin A.A.,
Radioactively Contaminated Areas / Eds. D.K. Gupta,
Chebotina M.Ya., Guseva V.P. // Radiochemistry. 2020.
A. Voronina. Springer, 2019. P. 113.
Vol. 62. Р. 85-94).
РАДИОХИМИЯ том 65 № 6 2023
556
ИОШИН и др.
29. Волков И.В., Поляков Е.В., Денисов Е.И., Ио-
37. Егоров Ю.В. Статика сорбции микрокомпонентов
шин А.А. // Радиохимия. 2017. Т. 59, № 1. С. 63
оксигидратами. М: Атомиздат, 1975. 198 c.
(Volkov I.V., Polyakov E.V., Denisov E.I., Ioshin A.A. //
38. Поляков Е.В. Реакции ионно-коллоидных форм ми-
Radiochemistry. 2017. Vol. 59. Р. 70-79).
крокомпонентов и радионуклидов в водных раство-
30. Fiskus W.C., Manning T.J. // Florida Sci. 1998. Vol. 61,
рах. Екатеринбург: УрО РАН, 2003. 279 c.
N 1. P. 46-51.
39. Paulenova А., Rajec P., Zemberyova М., Saskoiova G.,
31. Yesinowski J.P. Nuclear magnetic resonance
Visacky V. // J. Radoanal. Nucl. Chem. 2000. Vol. 246,
spectroscopy of calcium phosphates
// Calcium
N 3. P. 623-628.
Phosphates in Biological and Industrial Systems / Ed. Z.
40. Кумок В.Н., Кулешова О.М., Карабин Л.А. Произве-
Amjad. Boston: Springer, 1998.
дения растворимости / Под ред. В.И. Белеванцева.
32. Вольхин В.В., Егоров Ю.В., Белинская Ф.А., Бойчино-
Новосибирск: Наука, 1983. 267 c.
ва Е.С., Малофеева Г.И. // Ионный обмен / Под ред.
41. Janossy L. Theory and Practice of the Evaluation of
М.М. Сенявина. М.: Наука, 1981. С. 25.
Measurements. Budapest: Hungarian Acad. Sci., 1965.
33. Cawthray J.F., Creagh A.L., Haynes Ch.A., Orvig Ch. //
42. Van der Zee, S.E.A.T.M., Van Riemsdijk, W.H. Model
Inorg. Chem. 2015. Vol. 54. P. 1440.
for the reaction kinetics of phosphate with oxides and
34. Kotrly S., Sucha L. Handbook of Chemical Equilibria in
soil // NATO ASI Ser. Vol. 190: Interactions at the Soil
Analytical Chemistry. Chichester: Wiley, 1985. 252 p.
Colloid-Soil Solution Interface / Eds G.H. Bolt, M.F.
35. Wu L., Forsling W., Schindler P.W. // J. Colloid Interface
Sci. 1991. Vol. 147, N 1. P. 178.
De Boodt, M.H.B. Hayes, M.B. McBride, E.B.A. De
36. Krestou A., Xenidis A., Panias D. // Min. Eng. 2004.
Strooper. Springer: Dordrecht. 1991. P. 205-240.
Vol. 17. P. 373.
(Footnotes)
Sorption of Sr(II) Ions with Tricalcium Phosphate
in the Presence of Humic Acids
A. A. Ioshin, I. V. Volkov, and E. V. Polyakov*
Institute of Solid State Chemistry, Ural Branch, Russian Academy of Sciences, Yekaterinburg, 620108 Russia
*e-mail: polyakov@ihim.uran.ru
Received July 13, 2023; revised August 14, 2023; accepted August 21, 2023
The sorption behavior of traces Sr(II) toward β-Ca3(PO4)2 (TCP) depending on the concentration of the cation,
pH, and concentrations of humic acids (HA) in the solution was studied. Thermodynamic analysis of the
solubility of TCP (1) was performed taking into account the formation of Ca(OH)2 (CH, 2), Ca(H2PO4)2
(MCPA, 3), CaHPO4·2H2O (DCPD, 4), Ca5(PO4)3OH (hydroxyapatite, OHAp, 5), and Ca2P2O7 (DCPP, 6). It
is shown that, depending on the pH of the solution, the main equilibrium phases with the solution are phases
(4) and (5). X-ray diffraction analysis, Raman spectroscopy, and 31P NMR data of the phase (1) samples after
contact with a solution of 0.01 mol/L NaNO3 for about 10 days showed the presence of only the phase (1). The
solubility of (1) regarding the concentration of Ca2+, PO43- ions and the stoichiometric ratio (Ca/P) in solutions,
depending on pH, corresponds to the presence of surface phases (4) or (5). The model of surface complexation
in the Henry region adequately describes the mechanism of sorption of Sr(II) by the surface phase (5) on TCP
particles in the form of the SrHPO0 complex. The formation of the HA complex Sr(II) in solution does not
affect distribution coefficient Kd(Sr) in the range of HA concentrations of 0-150 mg/L due to the competitive
effect of hydrogen phosphate ions on strontium complexes.
Keywords: tricalcium phosphate, sorbent, strontium ions, sorption, humic acids
РАДИОХИМИЯ том 65 № 6 2023