РАДИОХИМИЯ, 2023, том 65, № 6, с. 512-517
УДК 621.039.59
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ОКИСЛЕНИЯ UN И UO2
В ВОЗДУХЕ И ГЕМИОКСИДЕ АЗОТА
© 2023 г. М. И. Волгина, б, *, С. А. Кулюхина, Ю. М. Неволина
а Институт физической химии и электрохимии им. А.Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4
б Химический факультет Московского государственного университета им. М.В. Ломоносова,
119234, Москва, Ленинские горы, д. 1, стр. 3
*e-mail: forfschool@mail.ru
Поступила в редакцию 01.06.2023, после доработки 13.07.2023, принята к публикации 20.07.2023
При помощи термического анализа исследовано окисление UO2 и UN кислородом воздуха и гемиокси-
дом азота, являющимся труднолокализуемым парниковым газом. Для окисления использовали смеси
N2O-N2 и O2-N2 с объемной долей окислителя 20%. Для UO2 и UN фазовый состав конечного продукта
окисления на воздухе и в N2O одинаков и представляет собой U3O8. В обоих случаях N2O ведёт себя
как более мягкий по сравнению с кислородом воздуха окислитель. Окисление UO2 и UN в токе N2O
начинается при температуре соответственно на 180 и 70°С выше, чем на воздухе. Окисление UN в токе
N2O протекает в три стадии. На первой стадии продуктами реакции являются UO2 и U2N3, на второй
стадии - UO2, на третьей - U3O8. В процессе окисления UO2 выраженной стадийности не наблюдается.
Показана возможность утилизации гемиоксида азота при его использовании в процессе волоксидации
(окисления) отработавшего ядерного топлива.
Ключевые слова: мононитрид урана, диоксид урана, окисление, воздух, гемиоксид азота.
DOI: 10.31857/S0033831123060023, EDN: NZCBRS
Важной задачей переработки отработавше-
па) (U,Pu)N в HNO3 [16], в процессе денитрации
го ядерного топлива (ОЯТ) является локализация
радиоактивных отходов [17], а также при хранении
трития - радионуклида, способного легко загряз-
высокоактивных отходов, содержащих нитрат-ион
нять технологические среды и природные воды, и
и органические восстановители [18]. Несмотря на
радиоактивных благородных газов (РБГ). Для лока-
активную разработку подходов к утилизации ге-
лизации трития и удаления РБГ предложен процесс
миоксида азота [19, 20] поиск альтернативных ре-
волоксидации - окисления топлива в кислородсо-
шений является актуальным. Известно, что N2O в
держащей среде. При этом тритий окисляется с об-
ряде реакций проявляет окислительные свойства,
разованием тритированной воды и удаляется вместе
аналогичные кислороду [21]. Использование этих
с РБГ из материала топлива с током газа. Процесс
свойств послужило идеей данной работы: исполь-
волоксидации хорошо проработан в отношении то-
зовать N2O для волоксидации (окисления) UO2 и
плива на основе UO2 [1]. В то же время, несмотря на
UN вместо воздуха, либо в смеси с ним, с целью его
то, что в настоящее время в лабораторных услови-
утилизации. В данном случае будут одновременно
ях достаточно подробно изучен процесс окисления
решаться две задачи - волоксидация ОЯТ и утили-
перспективного топлива на основе UN [2, 3] различ-
зация N2O. В связи со сказанным выше целью дан-
ными окислителями [4-10], для внедрения процес-
ной работы стало сравнение окисления UO2 и UN в
са его волоксидации в технологическую практику
атмосфере воздуха и гемиоксида азота.
требуются дальнейшие изыскания [11]. Помимо
трития, специфичным газообразным отходом при
переработке топлива на основе UN является геми-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
оксид азота N2O [12, 13] - труднолокализуемый газ
с выраженными парниковыми свойствами [14, 15].
Исходные UO2 (МСЗ) и UN (ВНИИХТ) пред-
С учетом разрабатываемых в настоящее время тех-
ставляли собой коммерчески доступные компакт-
нологических схем по переработке различных ви-
ные образцы. Фазовый состав исходных образцов
дов ОЯТ можно ожидать образования N2O на ста-
исследовали методом порошковой рентгеновской
дии растворения некондиционных таблеток (скра-
дифракции (РФА) с использованием дифрактоме-
512
СР
АВНИТЕЛЬНЫЙ АНАЛИЗ ОКИСЛЕНИЯ UN И UO2
513
ɚ
ɛ
UO2[00-005-0550]
35000
UO2[00-005-0550]
18000
UN[03-065-0870]
16000
30000
14000
25000
12000
20000
10000
8000
15000
6000
10000
4000
5000
2000
0
0
20
30
40
50
60
70
80
20
30
40
50
60
70
80
ș ɝɪɚɞ
ș ɝɪɚɞ
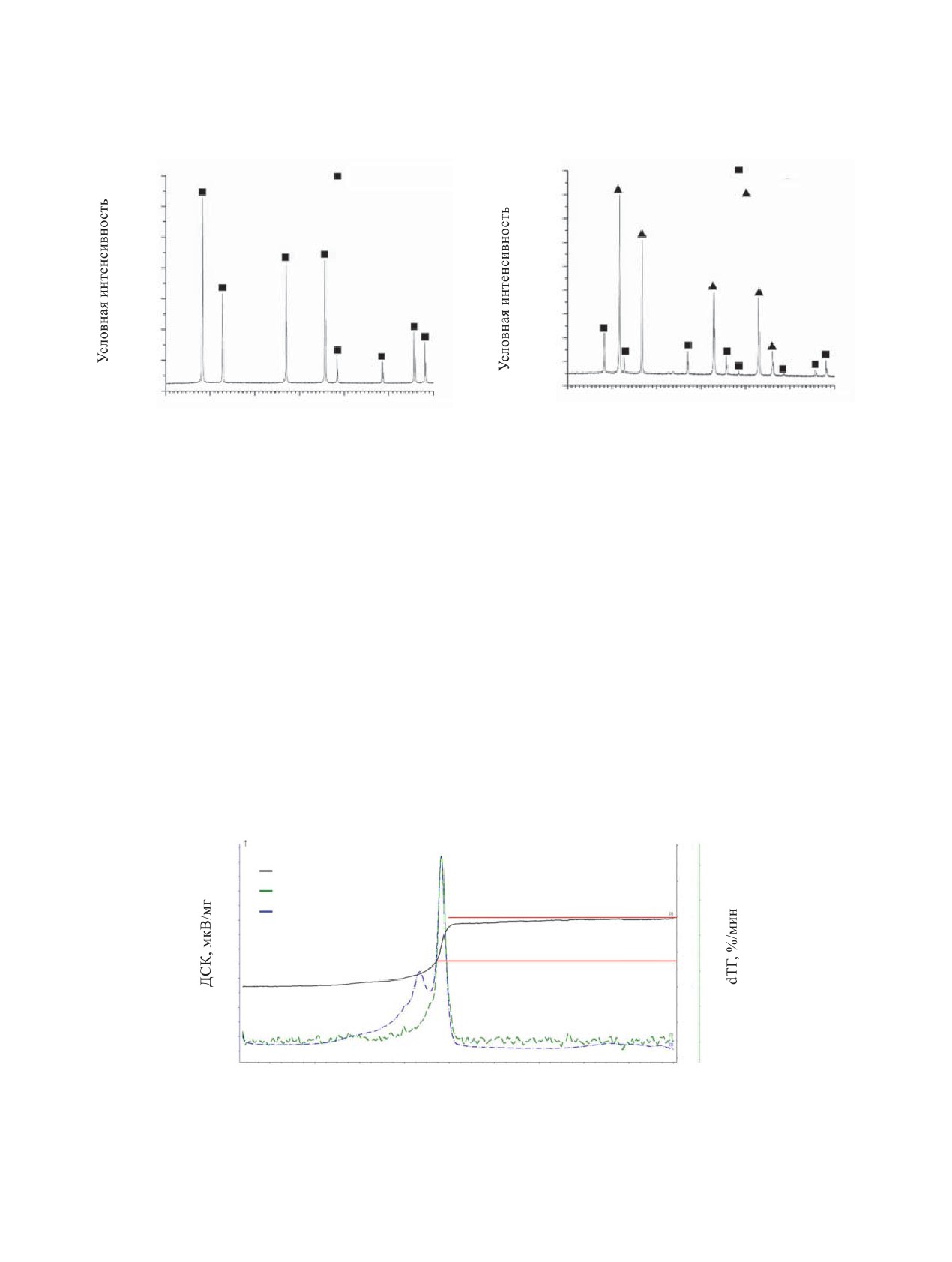
Рис. 1. Рентгенограммы исходного диоксида (а) и мононитрида (б) урана.
тра Panalytical Aeris с излучением CuKα. По дан-
квадрупольный масс-спектрометр Netzsch QMS
ным РФА, образец UO2 является монофазным, об-
Aelos 403, соединённый линией транспорта газов с
разец UN содержит примесь UO2 в количестве до
термоаналитическим комплексом. Ионизация осу-
15 мас% (рис. 1).
ществлялась методом электронного удара, сканиро-
вание проводили в диапазоне m/z 1-50 а.е.м. Фазо-
Окисление образцов проводили, используя тер-
вый состав конечных и промежуточных продуктов
моаналитический комплекс Netzsch STA 449 F3
Jupiter. Процесс окисления исследовали в интер-
окисления идентифицировали с помощью РФА.
вале температур 40-1000°С при скорости нагрева
10°С/мин с одновременной регистрацией данных
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
термогравиметрического анализа (ТГ) и дифферен-
циальной сканирующей калориметрии (ДСК). Ат-
Окисление UO2
мосферой нагрева служил либо синтетический воз-
дух, получаемый смешением 80 об% N2 и 20 об%
Окисление диоксида урана на воздухе начинает-
O2, либо смесь 80 об% N2 и 20 об% N2O. Порошки
ся при 260°С (здесь и далее приведена экстраполи-
исходных веществ массой 20 мг помещали в пла-
рованная температура начала окисления), при этом
тино-родиевые тигли с крышкой. В серии экспери-
скорость окисления в интервале 260-400°С остает-
ментов одновременно был исследован состав газо-
ся низкой (рис. 2). Быстрая стадия окисления про-
вой фазы в ходе реакции. Для этого использовали
текает в диапазоне от 400-550°С, что согласуется
ɌȽ
ɗɄɁɈ
108
1.2
1.0
ɌȽ
106
1.0
GɌȽ
0.8
UO8
ȾɋɄ
0.8
104
0.6
0.6
U4O
102
9
0.4
0.4
100
0.2
0.2
98
0
0.0
96
Ɍɟɦɩɟɪɚɬɭɪɚ ɋ
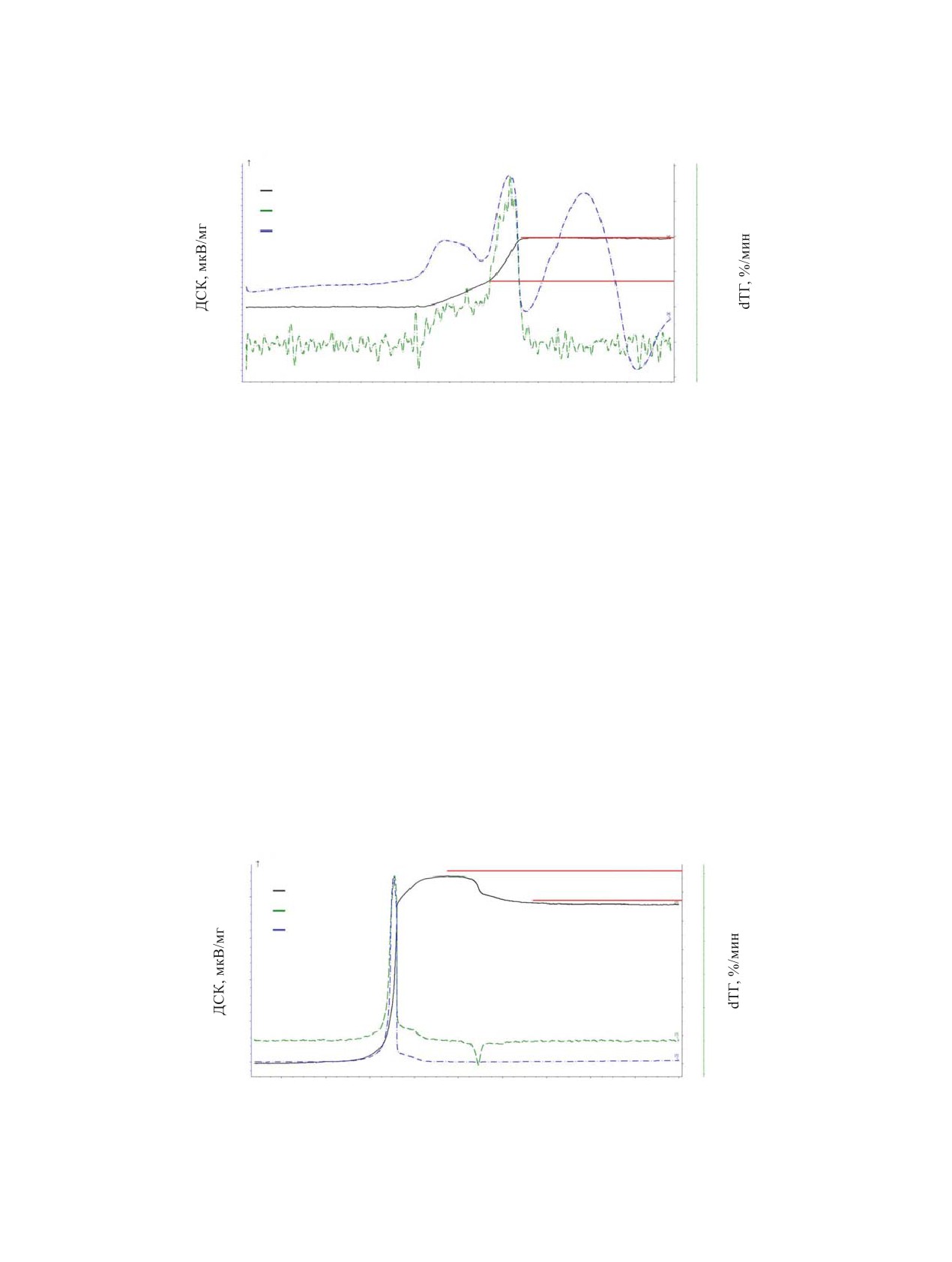
Рис. 2. Кривые ТГ-ДСК окисления UO2 на воздухе. Красными линиями обозначены приросты массы для соответствующих
соединений.
РАДИОХИМИЯ том 65 № 6 2023
514
ВОЛГИН и др.
ɌȽ
ɗɄɁɈ
108
0.5
0.4
ɌȽ
106
0.3
0.4
GɌȽ
0.2
ȾɋɄ
U3O8
1040.3
0.1
U4O9
1020.2
0.0
1000.1
-0.1
-0.2
98
0.0
-0.3
96
-0.1
Ɍɟɦɩɟɪɚɬɭɪɚ ɋ
Рис. 3. Кривые ТГ-ДСК окисления UO2 в атмосфере N2O. Красными линиями обозначены приросты массы для соответ-
ствующих соединений.
с литературными данными [1]. Кривая ДСК также
Кривая ТГ, как и в случае окисления на воздухе, со-
отражает стадийность окисления UO2 и содержит
ответствует двум стадиям процесса. Согласно при-
два экзотермических эффекта с температурами мак-
росту массы, промежуточным продуктом окисле-
симума 434 и 483°С. Эволюция фазового состава
ния, как и в случае воздушной атмосферы, является
продуктов окисления UO2 по мере роста температу-
U4O9. Необычная форма ДСК сигнала выше 700°С,
ры известна из литературы [22]. Вероятным проме-
вероятно, вызвана экзотермическим разложением
жуточным продуктом окисления является U4O9, что
N2O на металлической поверхности тиглей и тер-
согласуется с наблюдаемым приростом массы на
мопары, поскольку подобный сигнал наблюдался в
первом этапе. Финальный прирост масс составил
холостом эксперименте.
3.83%, что на 0.12% меньше теоретического значе-
ния при окислении UO2 до U3O8. Данные РФА при
Окисление UN
этом свидетельствуют о том, что конечным продук-
том окисления является U3O8.
Окисление мононитрида урана на воздухе на-
Окисление диоксида урана в N2O начинается при
чинается при 340°С и завершается по достижении
460°С, что на 200°С выше, чем на воздухе (рис. 3).
480°С, при этом наблюдается экзотермический пик
Окончание окисления наблюдается при 650°С, при
ДСК сигнала с максимумом при 350°С (рис. 4).
этом можно отметить более низкую скорость окис-
Общий прирост массы по достижении 480°С со-
ления UO2 по сравнению с воздушной атмосферой.
ответствует образованию UO3. Исходя из формы
ɌȽ
UO3
ɗɄɁɈ
5
ɌȽ
U3O8
112
20
GɌȽ
4
110
ȾɋɄ
15
3
108
2
10
106
104
1
5
102
0
0
100
-1
Ɍɟɦɩɟɪɚɬɭɪɚ ɋ
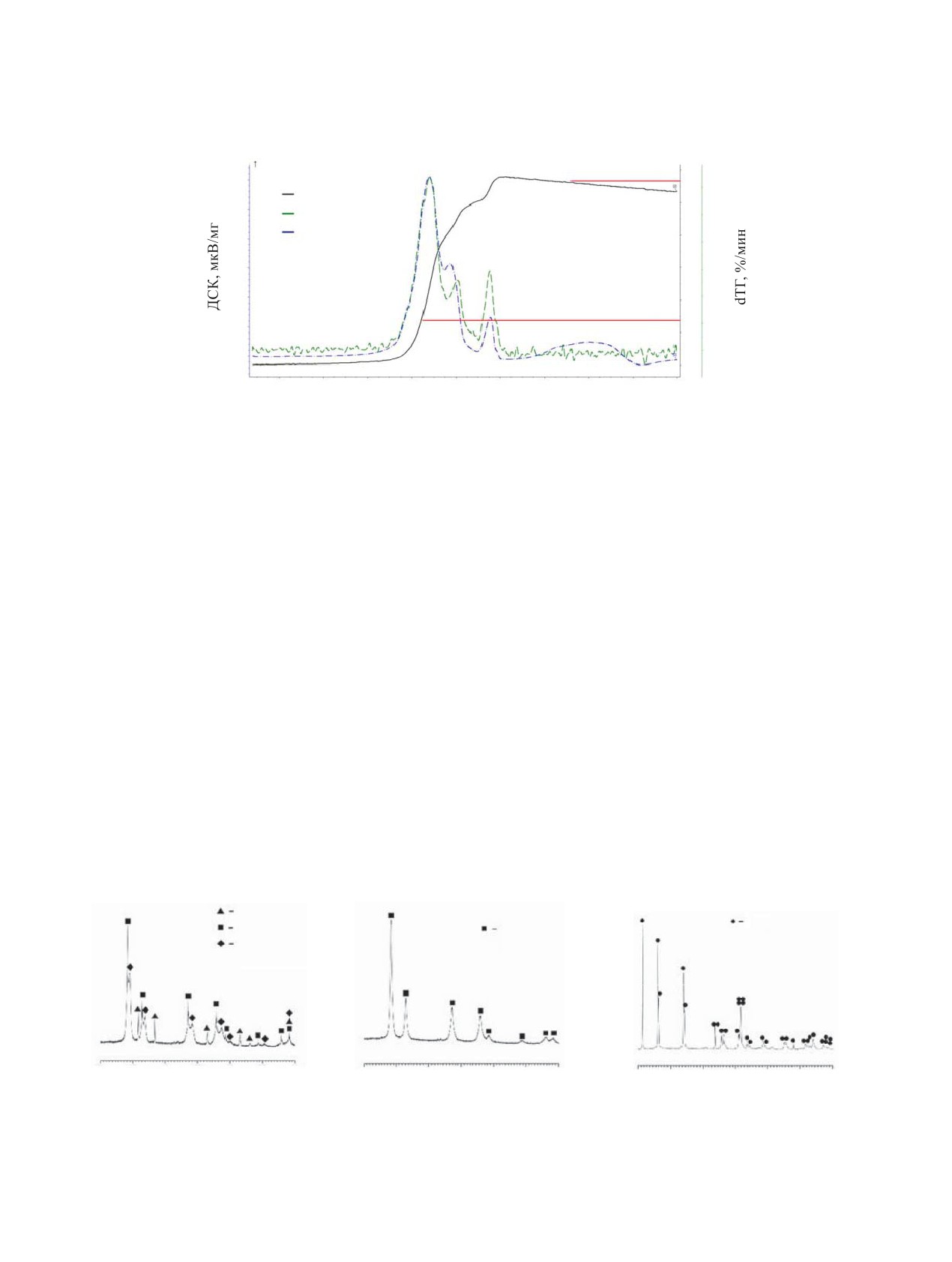
Рис. 4. Кривые ТГ-ДСК окисления UN на воздухе.
РАДИОХИМИЯ том 65 № 6 2023
СР
АВНИТЕЛЬНЫЙ АНАЛИЗ ОКИСЛЕНИЯ UN И UO2
515
ɌȽ
ɗɄɁɈ
U3O8
112
6
1.2
ɌȽ
110
5
GɌȽ
1.0
ȾɋɄ
108
4
0.8
3
106
0.6
2
104
0.4
U2N3
1
0.2
102
0
0.0
100
Ɍɟɦɩɟɪɚɬɭɪɚ ɋ
Рис. 5. Кривые ТГ-ДСК данные окисления UN в атмосфере N2O.
ТГ-кривой можно говорить о наличии как минимум
ца молекулярного азота, образовавшегося в процес-
двух стадий окисления. Первая из них реализуется
се реакции. При окислении мононитрида урана на
до 360°С, а вторая -до 480°С. В диапазоне от 480
воздухе подобной продолжительной потери массы
до 600°С наблюдается разложение UO3 до U3O8. В
на высокотемпературном участке не наблюдается.
целом наблюдаемые особенности окисления UN в
По-видимому, при окислении на воздухе большая
воздухе соответствуют литературным данным [4].
часть азота удаляется при разложении аморфного
UO3 до U3O8.
Окисление мононитрида урана в гемиоксиде
азота начинается при температуре 410 и завершает-
Исходя из данных по термической стабильности
ся к 610°С (рис. 5). В отличие от воздуха, в котором
N2O [21] можно предполагать возможность его са-
мононитрид урана быстро окисляется до UO3, в ге-
мостоятельного разложения в ходе нагрева исследу-
миоксиде азота окисление происходит в три хоро-
емых образцов по реакции
шо различимые стадии. Промежуточные продукты
2N2O → 2N2 + O2.
(1)
окисления были определены с помощью рентгено-
фазового анализа. В продуктах первого этапа окис-
Образующийся по реакции (1) кислород может
ления были обнаружены U2N3 и UO2. Продуктом
являться истинным окислителем исследованных
второго этапа являлся UO2. На третьем этапе проис-
соединений урана. Для ответа на этот вопрос была
ходит дальнейшее окисление UO2 до U3O8 (рис. 6).
исследована эволюция состава газовой фазы в ходе
Дальнейшее нагревание выше 610°С ведет к отно-
нагрева при помощи масс-спектрометрии (рис. 7).
сительно равномерной потере массы образцом, что,
Полученные данные позволили установить, что
по-видимому, связано с удалением из объёма образ-
окисление UN происходит именно за счёт взаимо-
ɚ
ɛ
ɜ
UN[03-065-0870]
U3O8-x[01-075-0630]
UO2[00-005-0550]
UO2[00-005-0550]
U2N3[01-073-1712]
20
30
40
50
60
70
80
20
30
40
50
60
70
80
20
30
40
50
60
70
80
ș ɝɪɚɞ
ș ɝɪɚɞ
ș ɝɪɚɞ
Рис. 6. Рентгенограммы продуктов окисления UN в гемиоксиде азота, полученные при нагревании до температуры, °С:
(а) - 440, (б) - 490, (в) - 1000.
РАДИОХИМИЯ том 65 № 6 2023
516
ВОЛГИН и др.
ɋ
112
0.5
110
0.4
ɋ
ɋ
108
03
106
H2O
0.2
104
0.1
102
O2
100
0.0
100
200
300
400
500
600
700
800
900
1000
Ɍɟɦɩɟɪɚɬɭɪɚ ɋ
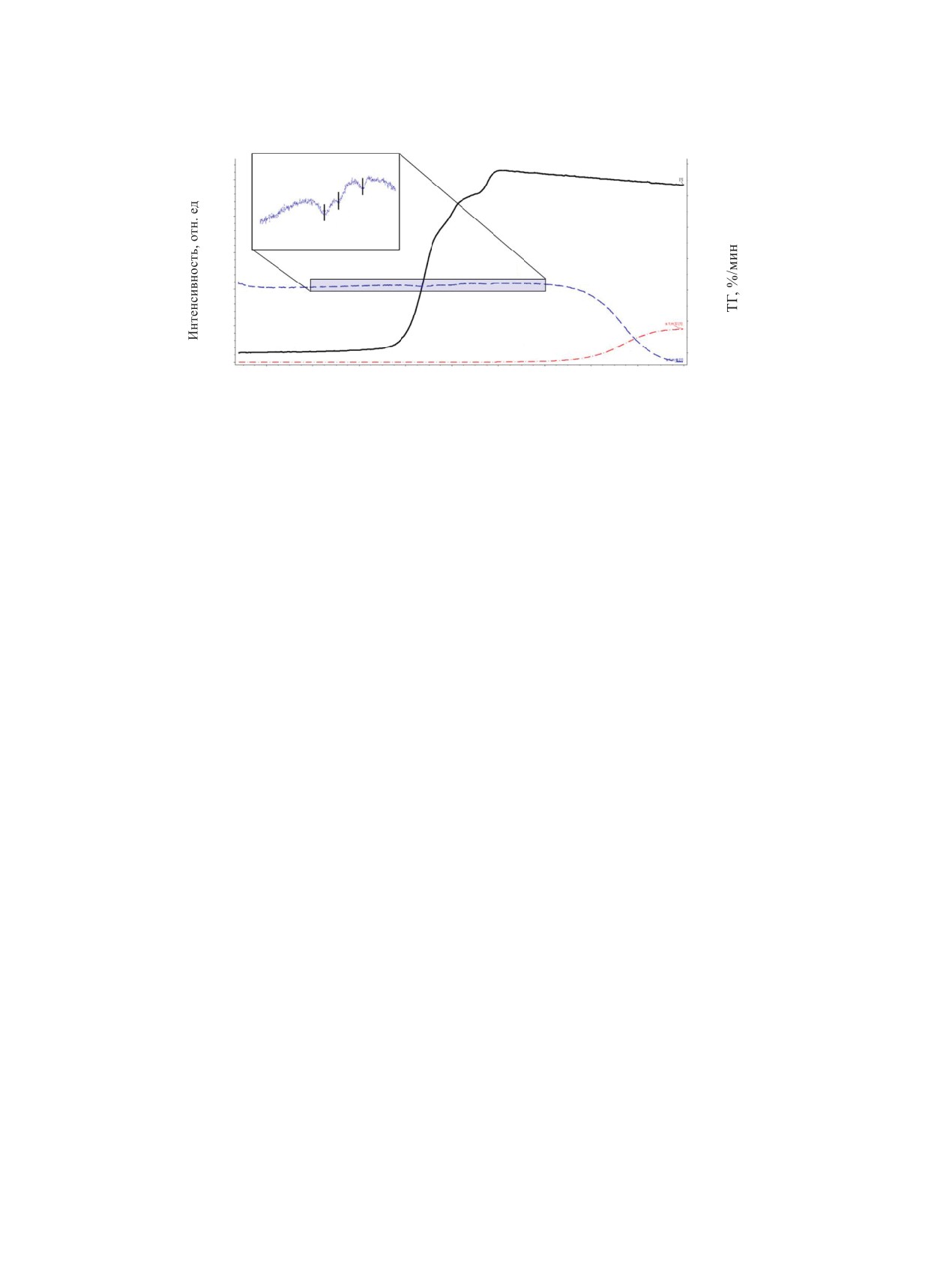
Рис. 7. Соотнесение содержания N2O и O2 в газовой фазе с ТГ-кривой окисления UN по данным масс-спектрометри
действия с гемиоксидом азота, а не с продуктами
КОНФЛИКТ ИНТЕРЕСОВ
его разложения. Во-первых, при температурах, со-
ответствующих значимому набору массы, ионный
Авторы заявляют об отсутствии конфликта ин-
ток, соответствующий исходному N2O, понижался,
тересов.
что говорило о потреблении газа.
Во-вторых, разложение N2O с образованием O2
СПИСОК ЛИТЕРАТУРЫ
наблюдалось лишь по достижении 700°С, когда
окисления UN уже не происходило.
1.
Goode J.H. Voloxidation—Removal of Volatile Fission
Products from Spent LMFBR Fuels: ORNL-TM-3723.
Oak Ridge, Tennessee, the United States: Oak Ridge
ЗАКЛЮЧЕНИЕ
National Laboratory, 1973. 137 p.
2.
Allbutt M., Dell R.M. // J. Nucl. Mater. 1967. Vol. 24.
Таким образом, гемиоксид азота может быть ис-
N 1. P. 1-20.
пользован для окисления UO2 и UN, конечным про-
3.
Grachev A.F., Zabudko L.M., Mochalov Y.S., Zvir E.A.,
дуктом реакции в этом случае является U3O8. При
Kryukov F.N., Zozulya D.V., Ivanov Y.A., Skupov M.V.
этом окисление протекает с меньшей интенсивно-
Development of innovative fast reactor nitride fuel in
стью, чем при использовании кислорода воздуха.
Russian Federation: State-of-art // Int. Conf. on Fast
Полученные данные свидетельствуют о возможно-
Reactors and Related Fuel Cycles: Next Generation
сти утилизации гемиоксида азота при введении его
Nuclear Systems for Sustainable Development (FR17).
в газовую фазу в ходе волоксидации оксидного либо
Vienna, Austria, 2017.
нитридного ОЯТ. При этом более медленное проте-
4.
Dell R.M., Wheeler V.J., McIver E.J. // Trans. Faraday
кание окисления способствует повышению пожаро-
Soc. 1966. Vol. 62. P. 3591-3606.
безопасности процесса.
5.
Ohmichi T., Honda T. // J. Nucl. Sci. Technol. 1968.
Vol. 5, N 11. P. 600-602.
БЛАГОДАРНОСТИ
6.
Dell R.M., Wheeler V.J. // J. Nucl. Mater. 1967. Vol. 21,
N 3. P. 328-336.
Работа выполнена с использованием оборудова-
7.
Sole M.J., Van der Walt C.M. // Acta Metall. 1968.
ния ЦКП ФМИ ИФХЭ РАН.
Vol. 16, N 4. P. 501-510.
8.
Rama Rao G.A., Mukerjee S.K., Vaidya V.N.,
ФОНДОВАЯ ПОДДЕРЖКА
Venugopal V., Sood D.D. // J. Nucl. Mater.
1991.
Vol. 185. P. 231-241.
Исследование выполнено при финансовой под-
9.
Kulyukhin S.A., Nevolin Y.M., Gordeev A.V.,
держке Министерства науки и высшего образова-
Bessonov A.A. // Radiochemistry. 2019. Vol. 61, N 2.
ния Российской Федерации.
P. 146-155.
РАДИОХИМИЯ том 65 № 6 2023
СР
АВНИТЕЛЬНЫЙ АНАЛИЗ ОКИСЛЕНИЯ UN И UO2
517
10. Shadrin A.Y., Dvoeglazov K.N., Mochalov Y.S.,
17. Рябков Д.В., Зильберман Б.Я., Мишина Н.Е., Ан-
Vidanov V.V, Kashcheev V.A., Terentiev A.G.,
дреева Е.В., Водкайло А.Г., Шадрин А.Ю., Костро-
Gerasimenko M.N., Cheshuyakov S.A. // J. Phys. Conf.
мин К.В. Патент RU 2596816C1. 2015.
Ser. 2020. Vol. 1475. Article 012021.
18. Walker D.D., Hobbs D.T., Tiffany J.B., Bibler N.E.,
11. Konings R.J.M. Comprehensive Nuclear Materials.
Meisel D. Nitrous oxide production from radiolysis
Vol. 3: Advanced Fuels. Fuel Cladding. Nuclear Fuel
of simulated high-level nuclear waste solutions, no.
Performance. Modeling and Simulation. Amsterdam:
WSRC-MS-91-446; CONF-920307-78. Aiken, SC,
Elsevier, 2012. 818 p.
the United States, 1992.
12. Hadibi-Olschewski N., Glatz J.P., Bokelund H.,
19. Kapteijn F., Rodriguez-Mirasol J., Moulijn J.A. // Appl.
Leroy M.J.F. // J. Nucl. Mater. 1992. Vol. 188. P. 244-
Catal. B: Environmental. 1996. Vol. 9, N 1-4. P. 25-64.
248.
20. Konsolakis M. // ACS Catal. 2015. Vol. 5, N 11. P. 6397-
13. Kulyukhin S.A., Rumer I.A., Gorbacheva M.P.,
6421.
Bessonov A.A. // Radiochemistry. 2020. Vol. 62, N 2.
P. 177-188.
21. Дроздов А.А., Зломанов В.П., Мазо Г.Н., Спиридо-
14. Wang W.C., Yung Y.L., Lacis A.A., Mo T., Hansen J.E. //
нов Ф.М. Неорганическая химия: В 3 т. / Под ред.
Science. 1976. Vol. 194, N 4266. P. 685-690.
Ю.Д. Третьякова. Т. 2: Химия непереходных элемен-
тов: Учебник для студ. высш. учеб. заведений. М.:
15. Khalil M.A.K. // Annu. Rev. Energy Environ. 1999.
Vol. 24, N 1. P. 645-661.
Академия, 2004. 368 с.
16. Kulyukhin S.A., Shadrin A.Y., Voskresenskaya Y.A.,
22. Mors L.R., Edelstein N.M., Fuger J. Actinide and
Bessonov A.A., Ustinov O.A. // J. Radioanal. Nucl.
Transactinide Elements. Dordrecht: Springer, 2008. 2nd
Chem. 2015. Vol. 304, N 1. P. 425-428.
ed. 4058 p.
Comparative Analysis of UN and UO2 Oxidation in Air
and Nitrogen Hemioxide
M. I. Volgina, b, *, S. A. Kulyukhina, and Yu. M. Nevolina
a Frumkin Institute of Physical Chemistry and Electrochemistry, Russian Academy of Sciences,
Moscow, 119071 Russia
b Department of Chemistry, Lomonosov State University, Moscow, 119991 Russia
*e-mail: forfschool@mail.ru
Received June 1, 2023; revised July 13, 2023; accepted July 20, 2023
Oxidation of UO2 and UN by atmospheric oxygen and nitrogen hemioxide, which is a hard-to-localize
greenhouse gas, was investigated by thermal analysis. For oxidation, mixtures of N2O-N2 and O2-N2 were used
with a volume fraction of the oxidizing agent of 20%. For UO2 and UN, the phase composition of the final
oxidation product in air and in N2O is the same and is U3O8. In both cases, N2O behaves as a milder oxidizing
agent compared to atmospheric oxygen. Oxidation of UO2 and UN in a flow of N2O begins at a temperature
180 and 70°C higher than in air, respectively. The oxidation of UN in a flow of N2O proceeds in three stages. At
the first stage, the reaction products are UO2 and U2N3; UO2 is the product of the second stage; and at the third
stage U3O8 is produced. No pronounced staging is observed in the process of UO2 oxidation. The possibility
of utilizing nitrogen hemioxide when it is used in the process of voloxidation (oxidation) of spent nuclear fuel
is shown.
Keywords: uranium mononitride, uranium dioxide, oxidation, air, nitrogen hemioxide, voloxidation
РАДИОХИМИЯ том 65 № 6 2023