РАДИОХИМИЯ, 2023, том 65, № 5, с. 418-426
УДК 542.61
ВЛИЯНИЕ ТИПА РАЗБАВИТЕЛЯ НА
ЭКСТРАКЦИОННУЮ СПОСОБНОСТЬ
N,N,N',N'-ТЕТРАБУТИЛДИГЛИКОЛЬАМИДА
ПО ОТНОШЕНИЮ К Eu(III), Am(III) и Cm(III)
© 2023 г. В. Э. Шаров*, Г. В. Костикова
Институт физической химии и электрохимии имени А.Н. Фрумкина РАН,
119991, Москва, Ленинский пр., д. 31, корп. 4
e-mail: sharov.vladislav.4444@gmail.com
Поступила в редакцию 31.03.2023, после доработки 12.07.2023, принята к публикации 19.07.2023
Изучено влияние концентрации HNO3 на экстракцию Eu(III), Am(III) и Cm(III) N,N,N',N'-тетрабутил-
дигликольамидом в 5 различных разбавителях: нитробензоле, толуоле, хлороформе, 1,2-дихлорэтане
и 1,1,2,2-тетрахлорэтане. Установлена зависимость коэффициентов распределения указанных метал-
лов от природы разбавителя в следующем ряду соединений: нитробензол > м-трифторметилнитробен-
зол > смесь н-додекана с деканолом-1 (объемное отношение 90 : 10) > четыреххлористый углерод >
1,2-дихлорэтан > бензол > 1,1,2,2-тетрахлорэтан > толуол > хлороформ. Найдены условия разделения
пар Eu(III)/Am(III) и Am(III)/Cm(III). Предложено объяснение наблюдаемому повышению коэффици-
ентов разделения пары Am(III)/Cm(III) с ростом концентрации азотной кислоты в равновесной водной
фазе.
Ключевые слова: экстракция, разбавители, N,N,N',N'-тетрабутилдигликольамид, европий, америций,
кюрий.
DOI: 10.31857/S0033831123050039, EDN: XVLWKU
ВВЕДЕНИЕ
шей утилизации Am и Cm предложено дожигание
их в высокопоточных реакторах с образованием
Актиниды представляют собой наиболее дол-
коротко- и среднеживущих продуктов деления [5].
гоживущие компоненты отработавшего ядерного
Реализация такой технологии обращения с ОЯТ
топлива (ОЯТ). В ходе водно-экстракционной пере-
требует разработки процессов выделения амери-
работки облученных тепловыделяющих сборок U,
ция и кюрия из ВАО, отделения их от лантанидов и
Pu и Np выделяют в индивидуальном виде и воз-
непосредственно разделения этих элементов. Бли-
вращают в ядерный топливный цикл [1]. Минорные
зость химических свойств Am, Cm и Ln делает не-
актиниды, такие как Am и Cm, при этом остаются
пригодным использование осадительных методов
вместе с продуктами деления в рафинатах перво-
для достижения подобных целей [6]. Более того,
го экстракционного цикла [2]. В настоящее время
традиционные экстрагенты, такие как три-н-бутил-
эти высокоактивные отходы (ВАО) подвергают
фосфат (TBP), ди-2-этилгексилфосфорная кислота
остекловыванию и дальнейшему захоронению в
(D2EHPA) и три-н-октилфосфиноксид (ТОРО), не
устойчивых геологических формациях [3]. Время,
обладают достаточной селективностью для разде-
за которое активность ВАО снижается до есте-
ления этих элементов [7]. Использование диамидов
ственного фона, составляет около 10 тысяч лет [4].
малоновой и дигликолевой кислот более перспек-
Выделение из ОЯТ наиболее долгоживущих ради-
тивно [8]. Некоторые из соединений, относящихся
онуклидов - актинидов - позволит снизить этот
к этим классам, тестировались в динамическом ре-
срок, а также уменьшить дозовые нагрузки на ма-
жиме для совместного выделения An(III) и Ln(III)
териалы долговременных хранилищ. Для дальней-
из реальных высокоактивных растворов
[9-11].
418
ВЛИЯНИЕ ТИПА Р
АЗБАВИТЕЛЯ
419
К сожалению, несмотря на высокую селективность
3-5% (что составляет ошибку титриметрического
к трехзарядным катионам лантанидов и актинидов,
определения концентрации кислоты), сказывается
дигликольамиды демонстрируют низкие коэффици-
на концентрации кислоты в равновесной водной
енты разделения пары Am(III)/Cm(III) [12, 13].
фазе. Поэтому далее мы считали концентрации
HNO3 в исходной и равновесной водной фазах рав-
Ранее нами была исследована зависимость экс-
ными и не проводили предварительного насыщения
тракции Eu(III), Am(III) и Cm(III) N,N,N',N'-тетра-
бутилдигликольамидом (TBDGA) из азотнокислых
экстрагента кислотой.
растворов от природы разбавителя [14]. В каче-
Экстракцию проводили при соотношении объе-
стве разбавителей были рассмотрены смесь доде-
мов фаз, равном 1 : 1, комнатной температуре (22 ±
кан - деканол-1 (объемное отношение 90 : 10) (DD +
2°С) и интенсивном перемешивании. Время пере-
Dec-1), бензол (PhН), м-трифторметилнитробензол
мешивания, необходимое для установления рав-
(F-3) и хлороформ. Оказалось, что коэффициенты
новесия, равное 3 мин, определяли на основании
разделения пар Eu(III)/Am(III) и Am(III)/Cm(III) в
предварительного кинетического эксперимента.
значительной степени зависят от природы разбави-
После расслаивания фаз в течение 10-15 мин в сте-
теля и концентрации кислоты в равновесной водной
клянной делительной воронке органическую и вод-
фазе. Более того, могут быть найдены условия, при
ную фазу разделяли и измеряли их γ-счет.
которых возможно разделение указанных элемен-
Коэффициенты распределения Eu(III), Am(III) и
тов. Вследствие всего вышесказанного нами было
Cm(III) рассчитывали на основании γ-метрическо-
решено расширить ряд разбавителей, для которых
го определения активностей равновесных органи-
были бы установлены зависимости экстракции
ческой и водной фаз (по 0.5 мл). Значение D опре-
Eu(III), Am(III) и Cm(III) TBDGA от концентрации
деляли как отношение γ-активности равновесной
HNO3.
органической фазы к γ-активности равновесной
водной. Правильность измерений контролировали
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
по сходимости материального баланса активности
исходной водной и суммы равновесных водной и
Синтез TBDGA проводили по методике, приве-
органической фаз.
денной в работе [14]. В качестве разбавителей ис-
Радиометрическое определение активности проб
пользовали толуол, нитробензол, 1,2-дихлорэтан,
проводили при помощи γ,β,α-спектрометра-ради-
1,1,2,2-тетрахлорэтан, хлороформ, н-додекан, де-
ометра МКГБ-01 производства Scientific Technical
канол-1, бензол, м-трифторметилнитробензол ква-
Centre RADEK Ltd. на основе 51 × 51 мм NaI-де-
лификации ч. Остальные реактивы использовали
тектора.
квалификации х.ч. и о.с.ч. и не подвергали допол-
нительной очистке.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
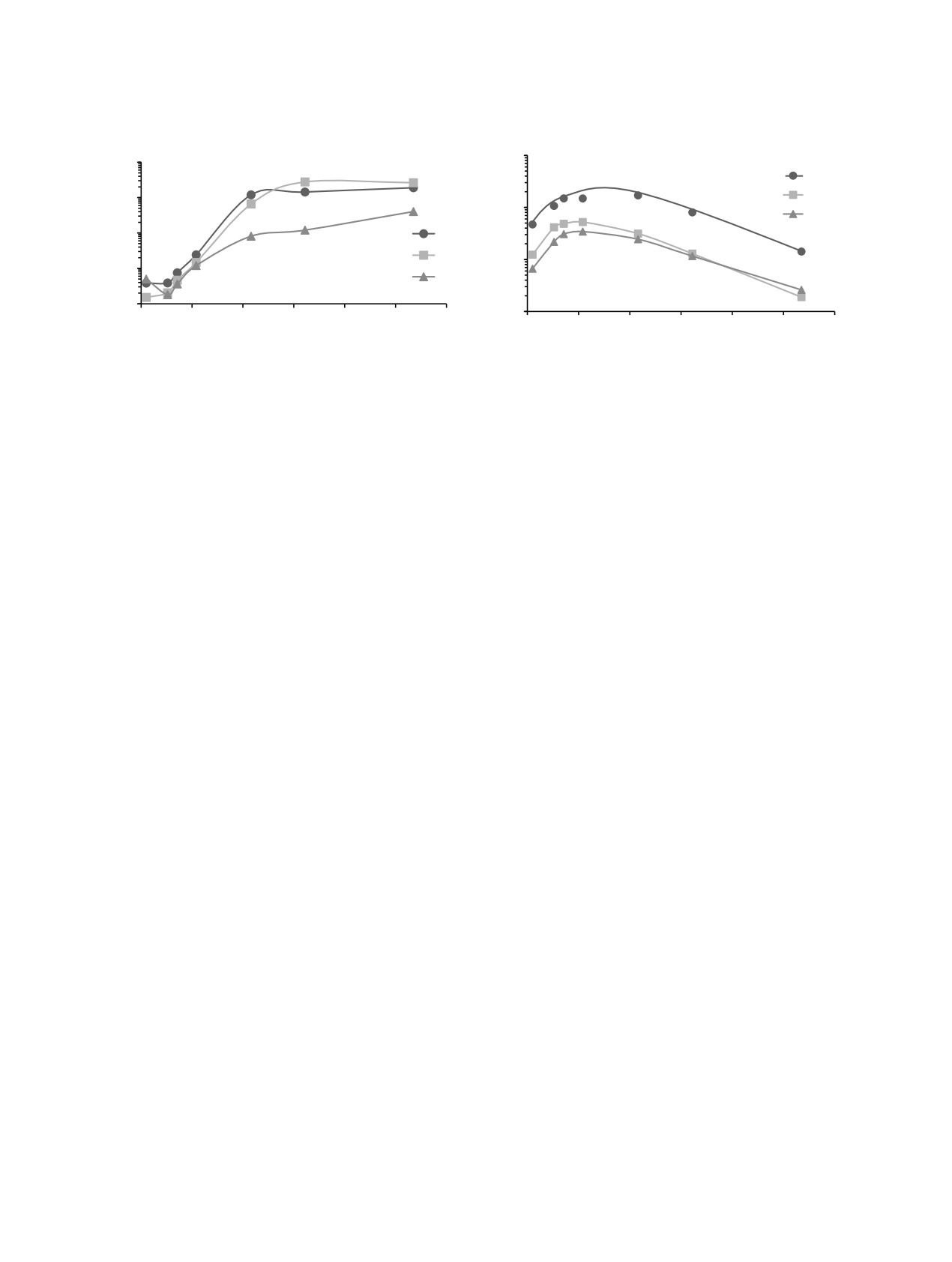
Опыты по изучению зависимостей коэффициен-
тов распределения (D) Eu(III), Am(III) и Cm(III) от
На первом этапе были исследованы зависимо-
концентрации HNO3 в равновесной водной фазе при
сти коэффициентов распределения Eu(III), Am(III) и
экстракции их TBDGA в различных разбавителях
Cm(III) от концентрации азотной кислоты в равно-
проводили в делительных воронках объемом 10 мл.
весной водной фазе при экстракции их 0.1 М TBDGA
Вначале готовили растворы кислоты заданной кон-
в толуоле (PhMe, рис. 1). В области концентраций
центрации, которую проверяли титрованием 0.1 М
HNO3 от 0.5 до 2 М наблюдался рост экстрагируе-
раствором NaOH с индикатором бромфеноловым
мости указанных металлов. При высоких концен-
синим. После ввода радиоактивной метки, пред-
трациях кислоты графики соответствующих зависи-
ставляющей собой азотнокислый раствор 152-154Eu,
мостей для Am(III) и Eu(III) выходили на плато, что,
241Am или 244Cm, γ-метрически определяли актив-
по-видимому, связано с конкурирующей экстракци-
ность исходной водной фазы.
ей HNO3. В области умеренных концентраций азот-
Ранее нами было показано [14], что переход
ной кислоты в равновесной водной фазе (0.5-2.5 М)
HNO3 в экстракт (для используемых в работе кон-
наблюдался характерный для дигликольамидов по-
центраций TBDGA) незначительно, в пределах
рядок экстрагируемости: Eu(III) > Am(III) > Cm(III).
РАДИОХИМИЯ том 65 № 5 2023
420
ШАРОВ, КОСТИКОВА
100
D(M)
1000
D(M)
1
100
2
10
3
10
1
2
1
1
3
0.1
0.1
0
1
2
3
4
5
6
0
1
2
3
4
5
6
[HNO3]ɜɮ , M
[HNO3]ɜɮ, M
Рис. 1. Зависимости коэффициентов распределения ин-
Рис. 2. Зависимости коэффициентов распределения ин-
дикаторных количеств Eu(III) (1), Am(III) (2) и Cm(III) (3)
дикаторных количеств Eu(III) (1), Am(III) (2) и Cm(III) (3)
от концентрации HNO3 в равновесной водной фазе при
от концентрации HNO3 в равновесной водной фазе при
экстракции их 0.1 M TBDGA в толуоле.
экстракции их 0.01 M TBDGA в нитробензоле.
В конечных точках зависимостей значения D аме-
ления пары Cm(III)/Am(III). Организация процесса
риция оказались несколько выше, чем D европия.
разделения в данных условиях теоретически воз-
Следует отметить, что в области низких концен-
можна, но с технологической точки зрения весьма
траций кислоты в равновесной водной фазе экстра-
сомнительна. Использование низких концентраций
гируемость Cm(III) была выше экстрагируемости
кислоты может привести к образованию осадков
Am(III). Схожие данные были получены нами ранее
вследствие гидролиза тех или иных компонентов.
для систем с бензолом [14]. Причиной такого пове-
В целом для систем с толуолом характерны те же
дения Am(III) и Cm(III) может служить различие в
закономерности, что и для систем с бензолом [14].
экстракции частично гидролизованных форм ме-
Высокая экстракционная способность TBDGA
таллов (эксперименты проведены для ультрамалых
в нитробензоле (PhNO2) по отношению к исследу-
количеств металлов при низкой концентрации кис-
емым металлам не позволила с удовлетворительной
лоты) TBDGA в ароматических углеводородах. В
точностью оценить D при концентрации экстраген-
целом, полученные результаты хорошо согласуются
та в равновесной органической фазе, равной 0.1 М.
с литературными данными [15]. Значения коэффи-
Вследствие этого далее эксперименты проводили с
циентов распределения Am(III) лежат между анало-
0.01 М раствором TBDGA в PhNO2. На графиках за-
гичными значениями для Nd(III) и Sm(III) [15]. Сле-
висимостей коэффициентов распределения Eu(III),
дует отметить, что зависимости D Am(III) и Eu(III)
Am(III) и Cm(III) от концентрации HNO3 в равно-
от концентрации HNO3 в равновесной водной фазе
весной водной фазе в области концентраций кис-
при экстракции N,N,N',N'-тетраоктилдигликольа-
лоты от 0.5 до 1 М наблюдались точки максимума
мидом (TODGA) в толуоле несколько отличаются
для всех металлов (рис. 2). Этот эффект аналогичен
от таковых для TBDGA [16].
тому, что наблюдался для систем с F-3 [14]. Его при-
Во всех точках полученных зависимостей были
чиной может служить высокая конкурирующая экс-
рассчитаны коэффициенты разделения (β) пар
тракция азотной кислоты, приводящая к вытесне-
Eu(III)/Am(III) и Am(III)/Cm(III) (табл. 1). Близкие
нию металлов из экстракта. Следует отметить, что
D Am(III) и Eu(III) не позволяют организовать про-
для TODGA в F-3 наблюдается тот же эффект [17].
цесс их разделения в данных условиях. В области
Экстрагируемость Eu(III) во всем исследованном
высоких концентраций кислоты наблюдались до-
интервале концентраций кислоты выше, чем экс-
статочно большие значения β пары Am(III)/Cm(III).
трагируемость An(III). Коэффициенты распреде-
К сожалению, высокая степень извлечения этих
ления Am(III) на начальном участке зависимости
двух металлов в экстракт не позволяет организовать
несколько выше, чем Cm(III), однако при высокой
процесс их разделения. Однако при низкой концен-
концентрации HNO3 наблюдается обратный поря-
трации HNO3 в равновесной водной фазе были по-
док экстрагируемости. Для всех точек зависимо-
лучены удовлетворительные коэффициенты разде-
стей были получены коэффициенты разделения пар
РАДИОХИМИЯ том 65 № 5 2023
ВЛИЯНИЕ ТИПА Р
АЗБАВИТЕЛЯ
421
Таблица 1. Коэффициенты разделения (β) пар Eu(III)/Am(III) и Am(III)/Cm(III) при экстракции их 0.1 М TBDGA в
PhMe и 0.01 М TBDGA в PhNO2
0.1 M TBDGA - PhMe
0.01 M TBDGA - PhNO2
[HNO3]в.ф., M
βEu/Am (βAm/Eu)
βAm/Cm (βCm/Am)
βEu/Am (βAm/Eu)
βAm/Cm (βCm/Am)
0.1
2.54
(3.33)
3.82
1.86
0.52
1.90
1.12
2.58
1.91
0.71
1.62
1.28
3.08
1.58
1.08
1.65
1.22
2.85
1.53
2.16
1.82
8.11
5.43
1.28
3.22
(1.92)
23.02
6.20
1.12
5.35
(1.39)
6.53
7.53
(1.37)
Eu(III)/Am(III) и Am(III)/Cm(III) (табл. 1). При кон-
высоких концентраций HClO4 происходит падение
центрации азотной кислоты в равновесной водной
D [18]. На начальном участке наблюдалась схожая
фазе, равной 5 М, возможно организовать процесс
экстрагируемость Am(III) и Cm(III), однако затем
разделения Eu(III) и An(III). Близкие D Am(III) и
коэффициенты распределения Am(III) увеличива-
Cm(III) делают невозможным их разделение в дан-
лись в большей степени, чем Cm(III). Вследствие
ных условиях.
этого при высокой концентрации HNO3 в равно-
весной водной фазе наблюдался следующий поря-
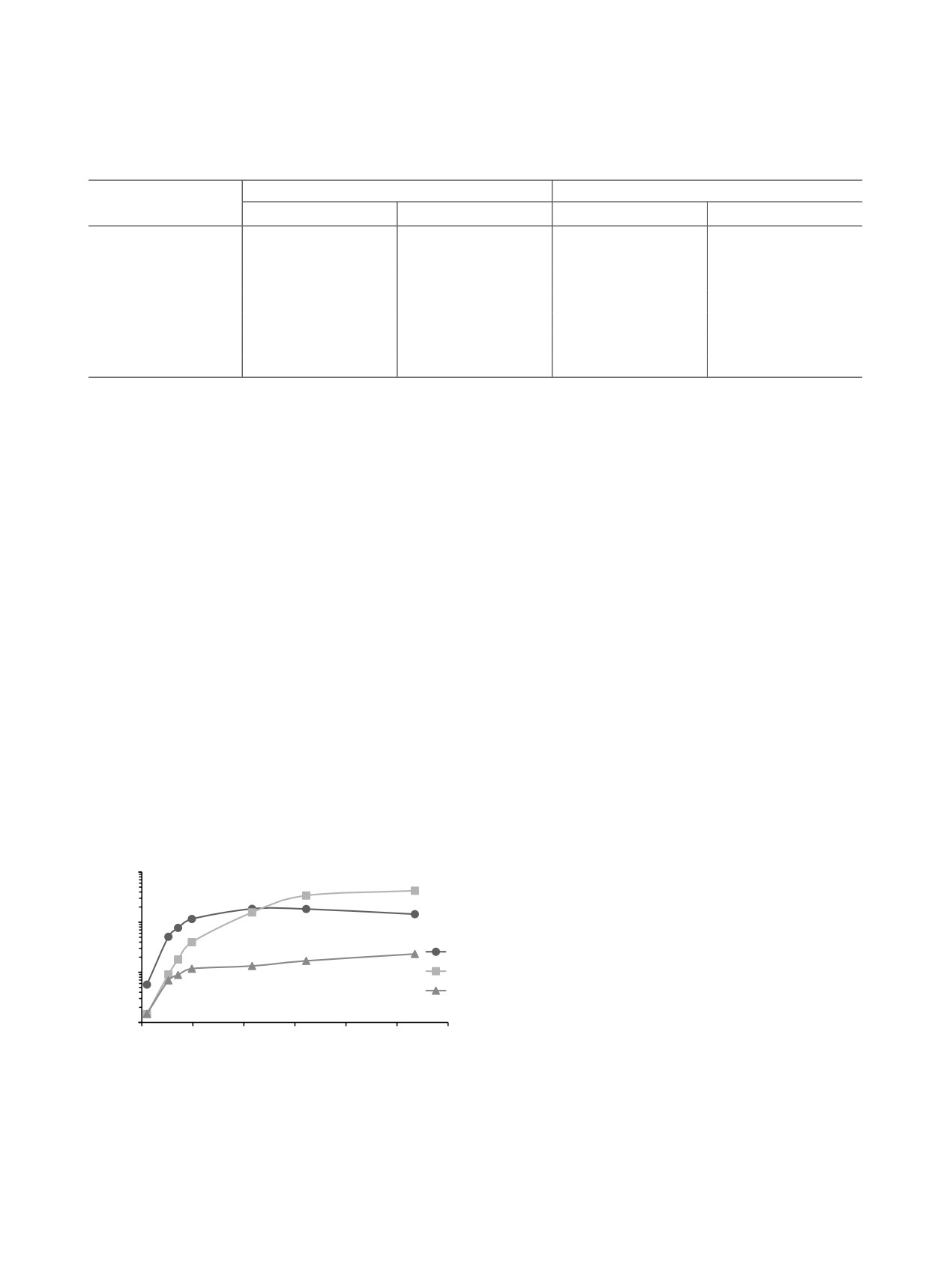
Далее были изучены экстракционные системы с
док экстрагируемости: Am(III) > Eu(III) > Cm(III).
хлорсодержащими разбавителями. На рис. 3 пред-
Интересно отметить, что для аналогичных систем
ставлены зависимости D Eu(III), Am(III) и Cm(III)
с TODGA вид зависимостей несколько отличается
от концентрации HNO3 в равновесной водной
[16]: при высоких концентрациях кислоты в равно-
фазе при экстракции их TBDGA в 1,2-дихлорэта-
весной водной фазе не наблюдается выхода графи-
не (DCE). Для исследуемых металлов наблюдалась
ков зависимостей на плато. Экстракционная способ-
высокая экстрагируемость уже на начальных участ-
ность в системах с TBDGA при этом выше, чем для
ках зависимостей (при [HNO3]в.ф. = 0.5 M коэффи-
систем с TODGA, что в целом характерно для диг-
циенты распределения Eu(III), Am(III) и Cm(III)
ликольамидов [19]. В области низких концентраций
были равны 51.2, 9.0 и 6.9 соответственно). В слу-
HNO3 в равновесной водной фазе (от 0.1 до 1 М)
чае Eu(III) в области высоких концентраций кисло-
наблюдались достаточно большие значения β пары
ты график зависимости вышел на плато. Похожий
Eu(III)/Am(III), а в области высоких (от 2 до 5 М) -
эффект наблюдается при экстракции европия из
пары Am(III)/Cm(III) (табл. 2). К сожалению, в дан-
перхлоратных сред, однако в этом случае в области
ном случае коэффициент разделения является чисто
математической величиной - организовать процесс
1000
D (M)
разделения невозможно вследствие высокой экс-
тракционной способности TBDGA в 1,2-дихлорэта-
100
не по отношению ко всем трем металлам.
1,2-Дихлорэтан обладает высокой летучестью,
1
вследствие чего использование его как разбавителя в
10
2
3
промышленном масштабе маловероятно. 1,1,2,2-Те-
трахлорэтан (TCE) менее летуч, поэтому было инте-
1
ресно исследовать экстракционные системы на его
0
1
2
3
4
5
6
[HNO3]ɜɮ, M
основе. На рис. 4 представлены зависимости коэф-
фициентов распределения Eu(III), Am(III) и Cm(III)
Рис. 3. Зависимости коэффициентов распределения ин-
от концентрации азотной кислоты в равновесной
дикаторных количеств Eu(III) (1), Am(III) (2) и Cm(III) (3)
водной фазе при экстракции их TBDGA в данном
от концентрации HNO3 в равновесной водной фазе при
экстракции их 0.1 M TBDGA в 1,2-дихлорэтане.
разбавителе. Для указанных металлов наблюдалось
РАДИОХИМИЯ том 65 № 5 2023
422
ШАРОВ, КОСТИКОВА
1000
D (M)
1000
D (M)
100
100
10
10
1
1
1
2
2
1
3
0.1
3
0.1
0.01
0
1
2
3
4
5
6
0
1
2
3
4
5
6
[HNO3]ɜɮ, M
[HNO3]ɜɮ , M
Рис. 4. Зависимости коэффициентов распределения ин-
Рис. 5. Зависимости коэффициентов распределения ин-
дикаторных количеств Eu(III) (1), Am(III) (2) и Cm(III) (3)
дикаторных количеств Eu(III) (1), Am(III) (2) и Cm(III) (3)
от концентрации HNO3 в равновесной водной фазе при
от концентрации HNO3 в равновесной водной фазе при
экстракции их 0.1 M TBDGA в 1,1,2,2-тетрахлорэтане.
экстракции их 0.1 M TBDGA в хлороформе.
увеличение D с ростом концентрации HNO3 во всем
по свойствам элементов характерна общая законо-
исследованном интервале. Порядок экстрагируемо-
мерность: понижение экстрагируемости компонен-
сти типичен для TBDGA: Eu(III) > Am(III) > Cm(III).
тов приводит к возрастанию селективности. Вслед-
Для америция и европия при переходе от DCE к TCE
ствие этого можно было бы ожидать значительные
значения коэффициентов распределения несколько
коэффициенты разделения пар Eu(III)/Am(III) или
снижаются, а для кюрия остаются приблизительно
Am(III)/Cm(III) в системах с хлороформом. Однако
теми же. Во всем исследованном интервале концен-
расчет β (табл. 2) показал, что в области низких и
траций HNO3 в равновесной водной фазе значения
средних концентраций HNO3 селективность отсут-
βEu(III)/Am(III) были больше 2 (табл. 2). В области
ствует. Только в области высоких концентраций
высоких концентраций кислоты наблюдались зна-
кислоты наблюдаются высокие коэффициенты раз-
чительные величины коэффициентов разделения
деления пары Am(III)/Cm(III). К сожалению, как и в
пары Am(III)/Cm(III), но, к сожалению, в связи с
других аналогичных случаях, организовать процесс
высокими степенями извлечения металлов в экс-
разделения америция и кюрия в указанных услови-
тракт процесс их разделения организовать нельзя.
ях не представляется возможным ввиду их высокой
экстрагируемости.
Для экстракционных систем с хлороформом
наблюдались наиболее низкие коэффициенты рас-
В настоящей и опубликованной нами ранее [14]
пределения исследуемых металлов. Значительная
работах наблюдается интересная закономерность:
(D > 2) экстракция европия, америция и кюрия на-
в большинстве экстракционных систем (TBDGA в
чиналась только при концентрации HNO3 свыше
бензоле, толуоле, четыреххлористом углероде, хло-
2 М. Этот факт не явился для нас неожиданностью,
роформе, 1,2-дихлорэтане, 1,1,2,2-тетрахлорэтане,
так как для TODGA также наблюдается значитель-
смеси н-додекана с деканолом-1) в области высоких
ное снижение экстракционной способности при
концентраций HNO3 в равновесной водной фазе для
использовании в качестве разбавителя CHCl3 [20].
кюрия характерна значительно меньшая экстраги-
Графики зависимостей D Eu(III), Am(III) и Cm(III)
руемость, чем для америция, результатом чего яв-
от концентрации азотной кислоты в равновесной
ляются высокие значения коэффициентов разделе-
водной фазе при экстракции их TBDGA в хлорофор-
ния пары Am(III)/Cm(III). К сожалению, разделение
ме в области низких и средних концентраций HNO3
указанных металлов в данных условиях организо-
([HNO3]в.ф. меньше либо равно 3 М) идут практиче-
вать невозможно, поэтому с технологической точки
ски параллельно (рис. 5). Для высоких концентра-
зрения этот факт не вызывает интереса. С другой
ций кислоты наблюдается несколько меньший рост
стороны, хорошая воспроизводимость результатов
коэффициента распределения кюрия по сравнению
для разных разбавителей может свидетельствовать
с европием и америцием. Как и в случае систем с
о едином для всех случаев механизме указанного
TCE, графики зависимостей на плато не выходят.
явления. В работе [16] было отмечено, что увеличе-
Для экстракционных процессов разделения близких
ние концентрации азотной кислоты в равновесной
РАДИОХИМИЯ том 65 № 5 2023
ВЛИЯНИЕ ТИПА Р
АЗБАВИТЕЛЯ
423
Таблица 2. Коэффициенты разделения (β) пар Eu(III)/Am(III) и Am(III)/Cm(III) при экстракции их 0.1 М TBDGA в
DCE, TCE и CHCl3
0.1 M TBDGA-DCE
0.1 M TBDGA-TCE
0.1 M TBDGA-CHCl3
[HNO3]в.ф., M
βEu/Am (βAm/Eu)
βAm/Cm (βCm/Am)
βEu/Am (βAm/Eu)
βAm/Cm β(Cm/Am)
βEu/Am (βAm/Eu)
βAm/Cm (βCm/Am)
0.1
3.88
(1.02)
2.52
(1.32)
2.23
(1.19)
0.52
5.66
1.31
2.36
(1.10)
1.94
(1.03)
0.71
4.28
2.03
2.74
(1.14)
1.79
1.19
1.08
2.90
3.37
2.64
1.24
1.82
1.33
2.16
1.18
11.7
2.36
3.11
2.26
1.09
3.22
(1.85)
20.1
2.31
4.84
2.96
4.07
5.35
(2.94)
18.3
3.66
2.85
(1.22)
24.4
водной фазе приводит к возрастанию коэффициен-
Для рассмотренных нами экстракционных си-
тов разделения пары Eu(III)/Am(III) при экстракции
стем, характеризующихся наименьшим переходом
их TODGA в хлороформе и толуоле. В качестве
азотной кислоты в экстракт (TBDGA в PhH, PhMe
причины данного явления указывалось различие в
и CHCl3), графики зависимостей коэффициентов
распределения Eu(III), Am(III) и Cm(III) от концен-
константах комплексообразования соединений, в
трации HNO3 в равновесной водной фазе линеа-
которых на один атом металла приходилось по од-
ризовались в координатах lg(DM)-lg([NO–]в.ф.). В
ной и две молекулы HNO3. Ранее нами было отме-
случае всех трех разбавителей для Eu(III) и Am(III)
чено [14], что начало экстракции азотной кислоты
значения тангенсов углов наклона полученных пря-
TBDGA совпадает с резким увеличением перехода
мых близки к 4, а для Cm(III) - к 3 (табл. 3). Это
америция и кюрия в экстракт. Это может указывать
свидетельствует о том, что в состав экстрагируемо-
на то, что HNO3 участвует в образовании экстра-
го соединения для Eu(III) и Am(III) входит молеку-
гируемых соединений. С учетом вышесказанного,
ла HNO3, чего не наблюдается для Cm(III). Таким
равновесия, устанавливающиеся в экстракционных
образом, различие в составе экстрагируемых соеди-
системах, могут быть описаны следующим уравне-
нений Am(III) и Cm(III) подтверждает высказанное
нием:
выше предположение о причине возрастания коэф-
фициентов разделения этих элементов в области
высоких концентраций азотной кислоты.
(1)
Далее, для установления влияния природы раз-
бавителя на коэффициенты распределения Eu(III),
Значение y увеличивается от 0 для систем с ма-
Am(III) и Cm(III) при экстракции их TBDGA из
лой концентрацией кислоты до 2 для систем с вы-
азотнокислых растворов было проведено сравнение
сокой [16]. Различие в экстракции Am(III) и Cm(III)
значений D для всех трех металлов при концентра-
при высокой концентрации HNO3 в равновесной
ции HNO3 в равновесной водной фазе, равной 1 М,
водной фазе может быть, таким образом, объяснено
и концентрации экстрагента в равновесной органи-
различием в устойчивости экстрагируемых соеди-
ческой фазе, равной 0.01 М. Был рассмотрен сле-
нений, в которых присутствуют 0-2 молекулы кис-
дующий ряд разбавителей: PhH, PhMe, PhNO2, F-3,
лоты, для двух этих металлов. На это также указы-
CHCl3, DCЕ, TCE, CCl4, DD + Dec-1.
вает меньшая устойчивость нитратных комплексов
Перед обсуждением полученных результатов
кюрия по сравнению с америцием [21]. Аналогич-
следует обозначить общие тенденции таких зависи-
ный эффект используется в технологии для разделе-
мостей для дигликольамидов. В работе [15] отме-
ния редкоземельных элементов при экстракции их
чено, что с повышением полярности разбавителя
TBP из высококонцентрированных азотнокислых
должно происходить уменьшение экстрагируемо-
растворов [22].
сти металлов вследствие усиления сольватации ак-
РАДИОХИМИЯ том 65 № 5 2023
424
ШАРОВ, КОСТИКОВА
тивных групп экстрагента. При экстракции Eu(III)
Таблица 3. Значения тангенсов углов наклона и до-
стоверности линейной аппроксимации зависимостей
TODGA из азотнокислых растворов D уменьшает-
lg(DM)-lg([NO3-]в.ф.) при экстракции Eu(III), Am(III) и
ся в следующем ряду разбавителей [23]: н-гексан ~
Cm(III) из растворов азотной кислоты 0.1 M TBDGA в
нитробензол ~ октанол-1 ~ этилацетат > диэтило-
PhH, PhMe и CHCl3, а также соотношение M : NO3- в экс-
вый эфир > н-додекан > 1,2-дихлорэтан > бензол >
трагируемых соединениях
толуол > четыреххлористый углерод > хлороформ.
-
Разбавитель
М
tgα
R2
M : NO3
Таким образом, отсутствует корреляция между
Eu
4.1
0.9563
1 : 4
полярностью разбавителя и экстракционной спо-
PhMe
Am
4.1
0.9659
1 : 4
собностью систем на его основе. Для сходного по
Cm
2.7
0.9986
1 : 3
строению с TBDGA N,N,N',N'-тетрабутилмало-
намида получено уменьшение экстрагируемости
Eu
4.3
0.9561
1 : 4
Sm(III) из азотнокислых растворов в следующем
PhH
Am
3.9
0.9471
1 : 4
ряду [24]: н-октан > н-гексан > циклогексан > толу-
Cm
2.8
0.9930
1 : 3
ол > бензол ~ ксилол > CCl4 > CHCl3. Наблюдается
Eu
3.8
0.9665
1 : 4
следующая закономерность: наибольшая экстраги-
CHCl3
Am
4.1
0.9814
1 : 4
руемость Ln(III) характерна для систем с предель-
Cm
2.7
0.9907
1 : 3
ными углеводородами и нитробензолом, наимень-
шая - для систем с четыреххлористым углеродом,
хлороформом и ароматическими углеводородами,
Причиной этого явления может быть дополнитель-
содержащими алкильные заместители.
ная сольватация катиона металла молекулами раз-
В качестве характеристики, определяющей по-
бавителя. Атомы кислорода нитрогрупп несут на
лярность разбавителя, нами была выбрана его
себе частичный отрицательный заряд. При этом
диэлектрическая проницаемость. Этот параметр
угол O-N-O хорошо подходит для хелатирования
уменьшается в следующем ряду [25]: PhNO2 > F-3 >
катиона металла. Подтверждением высказанного
DCE > TCE > CHCl3 > DD + Dec-1 ~ CCl4 ~ PhH ~
предположения может служить тот факт, что в си-
PhMe.
стемах с нитробензолом при экстракции Eu(III) [26]
При экстракции исследуемых металлов TBDGA
и Am(III) [27] TODGA из азотной кислоты соотно-
из азотнокислых растворов наблюдалось уменьше-
шения металл : лиганд в экстрагируемых соедине-
ние коэффициентов распределения (соответствую-
ниях равны 1:2. При этом для указанных систем ха-
щие значения приведены в скобках) в следующих
рактерна наибольшая экстракционная способность.
рядах:
Еще одним доказательством может служить моно- и
Eu(III): PhNO2 (16.26) > F-3 (6.67) > DD+Dec-1
бидентатная координация сходного по строению с
(3.22) > CCl4 (0.45) > DCE (0.32) > PhH (0.17) > TCE
нитрогруппой нитрат-аниона в соединениях, обра-
(0.03) > PhMe (0.008) > CHCl3 (0.002);
зующихся при экстракции Eu(III) и Am(III) N,N'-ди-
Am(III): PhNO2 (4.26) > F-3 (2.35) > CCl4 (0.40) >
метил-N,N'-диоктилгексилэтоксималонамидом из
DCE (0.36) > DD + Dec-1 (0.31) > TCE (0.05) > PhH
нитратных растворов [28]. Некоторое уменьшение
(0.03) > PhMe (0.002) > CHCl3 (<0.001);
D металлов при переходе от PhNO2 к F-3 может
Cm(III): PhNO2 (3.42) > F-3 (2.35) > CCl4 (0.23) ~
быть связано с уменьшением электронной плотно-
DCE (0.23) > DD + Dec-1 (0.16) > TCE (0.04) > PhH
сти на атомах кислорода нитрогрупп за счет элек-
(<0.001) ~ PhMe (<0.001) ~ CHCl3 (<0.001).
троноакцепторного действия трифторметильного
заместителя. Для четыреххлористого углерода,
Таким образом, для Am(III) и Cm(III) наблюда-
ются одинаковые зависимости D от природы раз-
1,2-дихлорэтана и смеси н-додекана с деканолом-1
бавителя. В случае Eu(III) подобная зависимость
(объемное отношение 90 : 10) сольватация катио-
несколько отличается от таковой для An(III). Одна-
на металла нехарактерна. Наличие такого эффекта
ко для всех трех металлов самая высокая экстраги-
можно предположить только для систем с DCE, на
руемость наблюдается для систем с ароматически-
что указывает соотношение TODGA : Am(III) в экс-
ми углеводородами, содержащими нитрогруппы.
трагируемом соединении, равное 2 : 1 [20]. Одна-
РАДИОХИМИЯ том 65 № 5 2023
ВЛИЯНИЕ ТИПА Р
АЗБАВИТЕЛЯ
425
ко этот эффект должен быть выражен значительно
КОНФЛИКТ ИНТЕРЕСОВ
слабее, чем для атомов кислорода нитрогрупп. Наи-
меньшая экстракционная способность, характерная
Авторы заявляют об отсутствии конфликта ин-
для систем с ароматическими углеводородами, не
тересов.
содержащими заместителей или содержащими ал-
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
кильные заместители, а также с хлороформом, свя-
зана с сольватацией молекулами этих разбавителей
Дополнительные материалы для этой статьи
активных групп экстрагента. В случае PhH и PhMe
доступны по doi 10.31857/S0033831123050039 для
происходит донирование электронной плотности
авторизированных пользователей.
карбонильных атомов кислорода на сопряженную
π-систему ароматического кольца, а хлороформ вы-
СПИСОК ЛИТЕРАТУРЫ
ступает донором водородной связи. При этом взаи-
модействие первого типа значительно слабее, чем
1.
Taylor R. Reprocessing and Recycling of Spent Nuclear
второго, что объясняет понижение экстракционной
Fuel. Elsevier, 2015.
способности TBDGA при переходе от систем c аро-
2.
Herbst R.S., Baron P., Nilsson M.
// Advanced
матическими углеводородами к системам с CHCl3.
Separation Techniques for Nuclear Fuel Reprocessing
Таким образом, вероятнее всего на значения коэф-
and Radioactive Waste Treatment. Elsevier,
2011.
P. 141-175.
фициентов распределения металлов влияет не по-
3.
Birkholzer J., Houseworth J., Tsang C.-F. // Annu. Rev.
лярность разбавителя, а его способность сольвати-
Environ. Res. 2012. Vol. 37. P. 79-106.
ровать катион металла или активные группировки
4.
Cohen B.L.
// CRC Handbook of Environmental
экстрагента. В первом случае будет наблюдаться
Radiation. CRC, 2019. P. 269-304.
увеличение экстракционной способности TBDGA,
5.
Liu B., Han J., Liu F., Sheng J., Li Z. // Prog. Nucl.
а во втором - ее уменьшение.
Energ. 2020. Vol. 119. Article 103148.
6.
Baron P., Cornet S.M., Collins E.D., DeAngelis G., Del
Cul G., Fedorov Y., Glatz J.P., Ignatiev V., Inoue T.,
ЗАКЛЮЧЕНИЕ
Khaperskaya A. // Prog. Nucl. Energy. 2019. Vol. 117.
Article 103091.
Исследована зависимость коэффициентов рас-
7.
Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev.
пределения Eu(III), Am(III) и Cm(III) от концентра-
2017. Vol. 46, N 23. P. 7229-7273.
8.
Evsiunina M.V., Matveev P.I., Kalmykov S.N.,
ции азотной кислоты в равновесной водной фазе
Petrov V.G. // Moscow Univ. Chem. Bull. 2021. Vol. 76,
при экстракции их TBDGA в 5 различных разба-
N 5. P. 287-315.
вителях. Найдены условия разделения пар Eu(III)/
9.
Ansari S.A.,
Pathak P., Mohapatra P.K.,
Am(III) и Am(III)/Cm(III). Предложено объяснение
Manchanda V.K. // Sep. Purif. Rev. 2011. Vol. 40, N 1.
наблюдаемому повышению коэффициентов разде-
P. 43-76.
ления пары Am(III)/Cm(III) с увеличением концен-
10. Magnusson D., Christiansen B., Glatz J., Malmbeck R.,
Modolo G., Serrano-Purroy D., Sorel C. // Solvent Extr.
трации HNO3 в равновесной водной фазе. Выявле-
Ion Exch. 2009. Vol. 27, N 1. P. 26-35.
ны закономерности во влиянии природы разбави-
11. Modolo G., Asp H., Schreinemachers C., Vijgen H. //
теля на экстракционную способность TBDGA по
Solvent Extr. Ion Exch. 2007. Vol. 25, N 6. P. 703-721.
отношению к Eu(III), Am(III) и Cm(III).
12. Chapron S., Marie C., Arrachart G., Miguirditchian M.,
Pellet-Rostaing S. // Solvent Extr. Ion Exch.
2015.
ФОНДОВАЯ ПОДДЕРЖКА
Vol. 33, N 3. P. 236-248.
13. Gujar R.B., Ansari S.A., Mohapatra P.K., Leoncini A.,
Verboom W. // J. Radioanal. Nucl. Chem. 2016. Vol. 309,
Работа выполнена при частичном финансирова-
N 2. P. 819-825.
нии Министерства науки и высшего образования
14. Шаров В.Э., Костикова Г.В. // Радиохимия. 2023.
Российской Федерации в рамках Госзадания ИФХЭ
Т. 65, № 1. С. 47-53.
РАН на 2023 год с использованием оборудования
15. Mowafy E.A., Aly H.F. // Solvent Extr. Ion Exch. 2006.
ЦКП ИФХЭ РАН.
Vol. 24, N 5. P. 677-692.
РАДИОХИМИЯ том 65 № 5 2023
426
ШАРОВ, КОСТИКОВА
16. Sasaki Y., Rapold P., Arisaka M., Hirata M., Kimura T.,
23. Sasaki Y., Sugo Y., Tachimori S. // Int. Conf. «Scientific
Hill C., Cote G. // Solvent Extr. Ion Exch. 2007. Vol. 25,
Research on the Back-End of the Fuel Cycle for the 21
N 2. P. 187-204.
Century» (Atalante 2000). P. 6.
17. Елисеев И.И. Диамиды дикарбоновых кислот-экс-
трагенты и ионофоры для извлечения и определения
24. Sun G.-X., Cui Y., Zhang Z.-W., Xu R.-Q., Jiang R.-T.,
радионуклидов: Автореф. дис. … к.х.н. СПб.: Радие-
Sun S.-X. // J. Serb. Chem. Soc. 2004. Vol. 69, N 8-9.
вый ин-т им. В.Г. Хлопина, 2011. С. 8-10.
P. 675--681.
18. Turanov A.N., Karandashev V.K., Kharlamov A.V.,
25. Wohlfahrt C. Pure Liquids: Data: Part 2 of Static
Bondarenko N.A., Khvostikov V.A. // Solvent Extr. Ion
Exch. 2019. Vol. 37, N 1. P. 65-80.
Dielectric Constants of Pure Liquids and Binary Liquid
19. Chen Z., Yang X., Song L., Wang X., Xiao Q., Xu H.,
Mixtures. Springer, 1991. P. 5-228.
Feng Q., Ding S. // Inorg. Chim. Acta. 2020. Vol. 513.
26. Ansari S.A., Pathak P.N., Manchanda V.K., Husain M.,
Article 119928.
Prasad A.K., Parmar V.S. // Solvent Extr. Ion Exch.
20. Panja S., Mohapatra P.K., Tripathi S.C., Gandhi P.M.,
Janardan P. // J. Membr. Sci. 2012. Vols. 403-404.
2005. Vol. 23, N 4. P. 463-479.
P. 71-77.
27. Sasaki Y., Sugo Y., Morita K., Nash K.L. // Solvent Extr.
21. Лебедев И.А., Пирожков С.В., Яковлев Г.Н. // Радио-
Ion Exch. 2015. Vol. 33, N 7. P. 625-641.
химия. 1960. Т. 2, № 5. С. 549-558.
28. Gannaz B., Antonio M.R., Chiarizia R., Hill C., Cote G. //
22. Николаев А.В., Рябинин А.И., Афанасьев Ю.А. // Ра-
диохимия. 1970. Т. 12, № 2. C. 326-335.
Dalton Trans. 2006. N 38. P. 4553.
Influence of the Nature of the Diluent on the Extraction
Capacity of N,N,N',N'-Tetrabutyldiglycolamide to Eu(III),
Am(III) and Cm(III)
V. E. Sharov* and G. V. Kostikova
Frumkin Institute of Physical Chemistry and Electrochemistry, Russian Academy of Sciences,
Moscow, 119991 Russia
*e-mail: sharov.vladislav.4444@gmail.com
Received March 31, 2023; revised July 12, 2023; accepted July 19, 2023
The influence of HNO3 concentration on the extraction of Eu(III), Am(III) and Cm(III) by N,N,N',N'-
tetrabutyldiglycolamide in 5 diluents (nitrobenzene, toluene, 1,2-dichloroethane, 1,1,2,2-tetrachloroethane and
chloroform) was studied. The dependence of the distribution ratios of the listed metals on the nature of the diluent
was examined. The extraction of Eu(III), Am(III) and Cm(III) decreases in the following order: nitrobenzene >
m-trifluoromethylnitrobenzene > mixture of n-dodecane and decanol-1 (90 : 10 vol/vol) > tetrachloromethane
> 1,2-dichloroethane > benzene > 1,1,2,2-tetrachloromethane > toluene > chloroform. The conditions for the
separation of Eu(III)/Am(III) and Am(III)/Cm(III) pairs were determined. The explanation of the observed
increase of the Am(III)/Cm(III) separation factors with the increase of the nitric acid concentration in the
equilibrium aqueous phase was suggested.
Keywords: extraction, diluents, N,N,N',N'-tetrabutyldiglycolamide, europium, americium, curium
РАДИОХИМИЯ том 65 № 5 2023