РАДИОХИМИЯ, 2023, том 65, № 5, с. 410-417
УДК 542.61:546.65/66
ЭКСТРАКЦИЯ АКТИНИДОВ И ЛАНТАНИДОВ ИЗ
АЗОТНОКИСЛЫХ РАСТВОРОВ ДИОКСИДАМИ
ДИФОСФИНОВ В ПРИСУТСТВИИ ИОННОЙ
ЖИДКОСТИ
© 2023 г. А. Н. Туранова, В. К. Карандашевб, О. И. Артюшинв, В. К. Брельв,*
а Институт физики твердого тела им. Ю.А. Осипьяна РАН,
142432, Черноголовка Московской обл., ул. Академика Осипьяна, д. 2
б Институт проблем технологии микроэлектроники и особо чистых материалов РАН,
142432, Черноголовка Московской обл., ул. Академика Осипьяна, д. 6
в Институт элементоорганических соединений им. А. Н. Несмеянова РАН,
119334, Москва, ул. Вавилова, д. 28
* e-mail:v_brel@mail.ru
Поступила в редакцию 02.05.2023, после доработки 10.07.2023, принята к публикации 13.07.2023
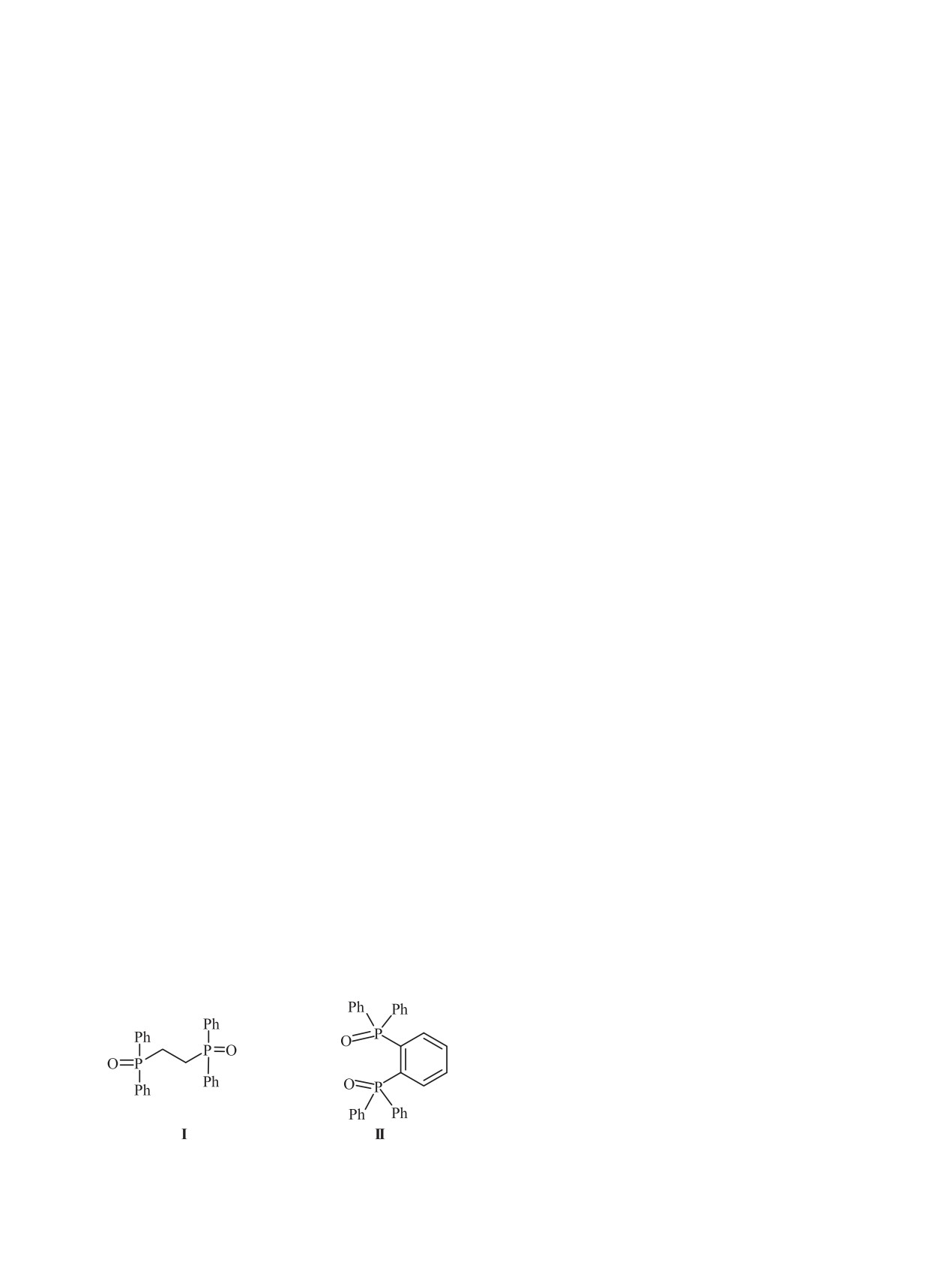
Исследовано влияние ионной жидкости бис[(трифторметил)сульфонил]имида 1-бутил-3-метилимида-
золия на экстракцию лантанидов(III), U(VI) и Th(IV) из азотнокислых растворов 1,2-бис(дифенилфос-
финил)этаном I и 1,2-бис(дифенилфосфинил)бензолом II. Определена стехиометрия экстрагируемых
комплексов. Раствор диоксида II в дихлорэтане экстрагирует ионы металлов значительно более эффек-
тивно, чем раствор диоксида I. Установлено, что в присутствии ионной жидкости в органической фазе
эффективность экстракции ионов металлов из азотнокислых растворов растворами диоксида I значи-
тельно возрастает, а диоксида II - уменьшается. В результате этого в присутствии ионной жидкости в
органической фазе диоксид II существенно уступает диоксиду I по эффективности экстракции Ln(III),
U(VI) и Th(IV) из азотнокислых растворов, что связано со значительно большей способностью диокси-
да II экстрагировать HTf2N.
Ключевые слова: экстракция, лантаниды(III), уран(VI), торий(IV), диоксиды дифосфинов, ионные
жидкости.
DOI: 10.31857/S0033831123050027, EDN: XSQQLE
Экстракционные методы широко используются
молекуле диоксида тетрафенилметилендифосфина
в процессах концентрирования и разделения акти-
(ТФМДФО) приводит к разрушению системы со-
нидов и лантанидов, в том числе при переработ-
пряженных связей, возникающей при образовании
ке отработанного ядерного топлива [1]. Высокой
шестичленного хелатного цикла в результате ком-
экстракционной способностью по отношению к
плексообразования ТФМДФО с ионами актинидов
актинидам и лантанидам в азотнокислых средах
и лантанидов (Ln) [8]. В результате этого диок-
обладают полифункциональные фосфорорганиче-
сид тетрафенилэтилендифосфина I экстрагирует
ские реагенты [2-7], в частности, диоксиды алки-
Am(III) и Ln(III) значительно менее эффективно,
лендифосфинов. Влияние строения этих реагентов
чем ТФМДФО [8]. С другой стороны, замена эти-
на их экстракционную способность и селектив-
ленового мостика в молекуле диоксида I на виниле-
ность изучено достаточно подробно [8]. Природа
новый приводит к значительному повышению DAm
мостика между двумя дифенилфосфорильными
и DU [9, 10]. Это было объяснено восстановлением
группами молекулы диоксидов дифосфинов су-
системы сопряженных связей в семичленном хелат-
щественно влияет на их экстракционную способ-
ном цикле, образующемся при комплексообразова-
ность. Увеличение длины алкиленового мостика в
нии цис-изомера диоксида тетрафенилвиниленди-
410
ЭКСТР
АКЦИЯ АКТИНИДОВ И ЛАНТАНИДОВ
411
фосфина с ионами актинидов [10]. По-видимому,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
с этим же связана высокая экстракционная способ-
ность 1,2-бис(дифенилфосфинил)бензола II по от-
Соединения I [25] и II [26] получены известны-
ношению к U(VI), Th(IV), Am(III) и Ln(III) в азот-
ми методами. Ионную жидкость бис[(трифторме-
нокислых средах [11].
тил)сульфонил]имид
1-бутил-3-метилимидазолия
(С4mimTf2N) (Merck), литиевую соль бис[(трифтор-
В последнее время значительно возрос инте-
метил)сульфонил]имида (LiTf2N) (Sigma-Aldrich)
рес к использованию в экстракционной практике
и 1.2-дихлорэтан марки х.ч. использовали без до-
ионных жидкостей (ИЖ) в качестве растворителей
полнительной очистки. Водный раствор HTf2N по-
нейтральных экстрагентов [12-19]. При этом экс-
лучали путем пропускания раствора LiTf2N через
тракция актинидов и Ln(III) растворами карбамоил-
колонку с катионитом КУ-2. Растворы экстрагентов
метилфосфиноксидов (КМФО) в ИЖ - гексафтор-
и С4mimTf2N в дихлорэтане готовили по точным
фосфатах и бис[(трифторметил)сульфонил]имидах
навескам.
метилалкилимидазолия - значительно возрастает
Распределение ионов Ln(III), U(VI) и Th(IV)
по сравнению с экстракцией растворами КМФО в
между водной и органической фазами изучали
традиционных растворителях [19]. Для повышения
при изменении концентрации HNO3 в диапазоне
эффективности извлечения актинидов и Ln(III) из
0.1-5.0 моль/л. Исходная концентрация каждого из
растворов HNO3 достаточно даже небольшой кон-
элементов составляла 2 × 10-6 моль/л. Экстракцию
центрации ИЖ в органическом растворителе, содер-
проводили при температуре 22 ± 2°С и соотно-
жащем нейтральный экстрагент [20-24]. Поскольку
шении объемов органической и водной фаз 1 : 1.
сами ИЖ практически не экстрагируют ионы ак-
Контакт фаз осуществляли на аппарате для переме-
тинидов и Ln(III) из азотнокислых растворов, ИЖ
шивания со скоростью 60 об/мин в течение 1 ч, что
можно рассматривать как активный компонент си-
достаточно для установления постоянных значений
нергетической смеси. Величина синергетического
коэффициентов распределения (D).
эффекта в таких системах зависит как от природы
Содержание Ln(III), U(VI) и Th(IV) в исходных
ИЖ, так и от строения экстрагента. Ранее нами ис-
и равновесных водных растворах определяли ме-
следовано влияние строения КМФО на экстракцию
тодом масс-спектрометрии с ионизацией пробы в
ионов металлов в присутствии ИЖ [20]. Влияние
индуктивно связанной плазме с использованием
строения диоксидов дифосфинов на экстракцию
масс-спектрометра XSeries 2 (Thermo Scientific,
ионов актинидов и Ln(III) в присутствии ИЖ ранее
США). Содержание элементов в органической фазе
не рассматривалось.
определяли по разнице концентраций в водном
Цель данной работы - исследование влияния
растворе до и после экстракции. Когда эта разни-
строения диоксидов I и II, отличающихся приро-
ца была мала, содержание элементов в органиче-
дой мостика между фосфорильными группами, на
ской фазе определяли после реэкстракции раство-
их экстракционную способность по отношению
ром 0.1 моль/л оксиэтилидендифосфоновой кис-
к U(VI), Th(IV) и Ln(III) в азотнокислых средах в
лоты. Коэффициенты распределения элементов
присутствии ИЖ бис[(трифторметил)сульфонил]
рассчитывали как отношение их концентраций в
имида 1-бутил-3-метилимидазолия в органической
равновесных фазах. Погрешность определения ко-
фазе.
эффициентов распределения не превышала 10%.
Концентрацию HNO3 в равновесных водных фазах
определяли потенциометрическим титрованием
раствором KOH. Концентрацию ионов Tf2N- в во-
дных растворах определяли атомно-эмиссионным
методом с ионизацией пробы в индуктивно связан-
ной плазме с использованием спектрометра ICAP-
61 (Thermo Jarrell Ash, США).
РАДИОХИМИЯ том 65 № 5 2023
412
ТУРАНОВ и др.
3.5
3.0
3.0
2.5
1
2
2.5
2.0
3
1
4
2.0
2
1.5
3
1.5
1.0
4
1.0
0.5
0.5
0.0
0.0
-0.5
-0.5
-1.0
-1.5
-1.0
-0.5
-0.0
0.5
1.0
-1.0
-0.6
-0.4
-0.2
0.0
0.2
0.4
0.6
0.8
lg[HNO3]
lg[HNO
]
3
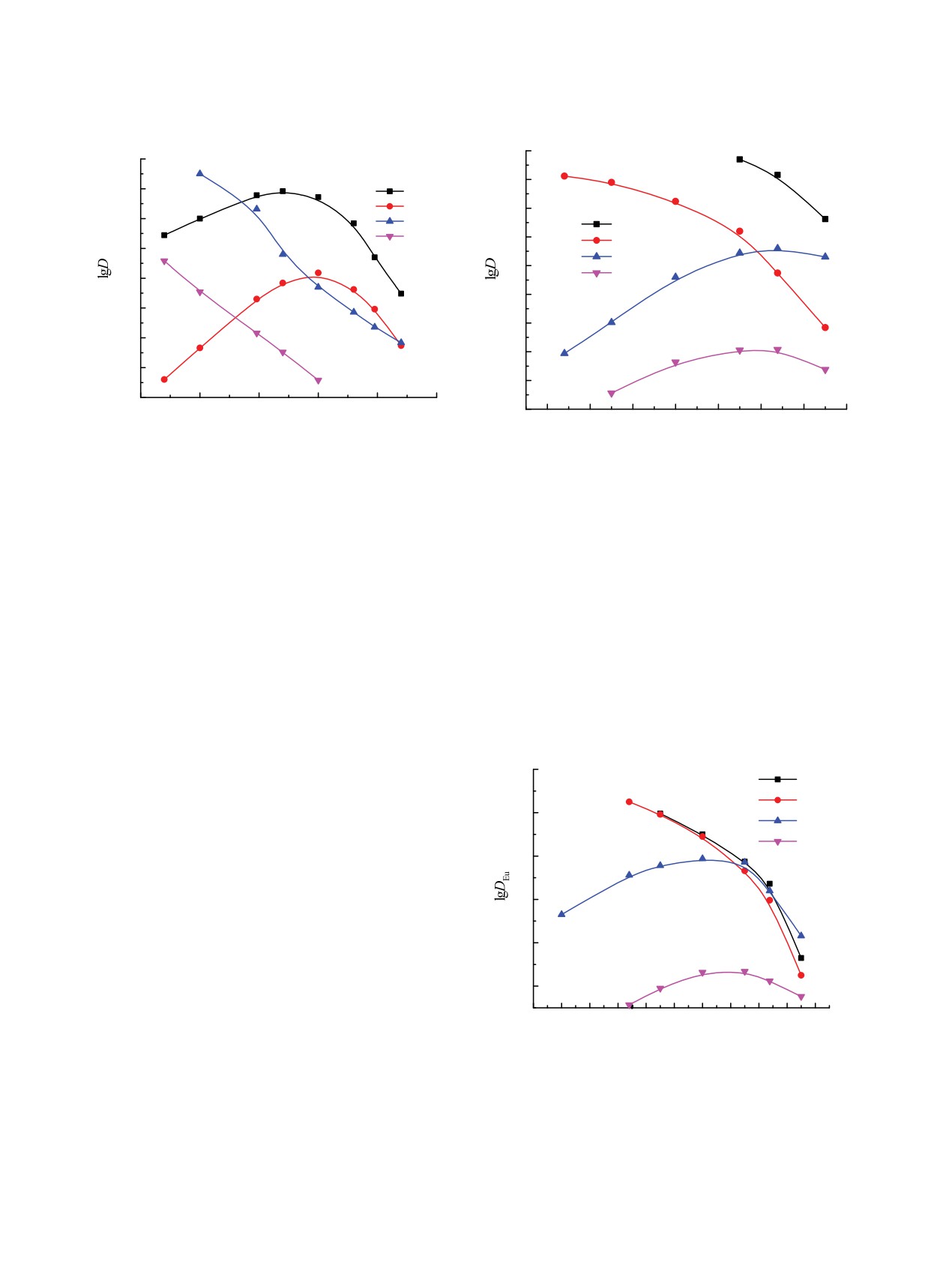
Рис.
1. Зависимость коэффициентов распределения
Рис. 2. Зависимость коэффициентов распределения U(VI)
Th(IV) (1, 3) и U(VI) (2, 4) от концентрации HNO3 в
(1, 3) и Th(IV) (2, 4) от концентрации HNO3 в водной фазе
водной фазе при экстракции растворами 0.001 моль/л ди-
при экстракции растворами 0.0001 моль/л диоксида II в
оксида I в дихлорэтане (3, 4) и дихлорэтане, содержащем
дихлорэтане (1, 2) и дихлорэтане, содержащем 0.1 моль/л
0.1 моль/л C4mimTf2N (1, 2).
C4mimTf2N (3, 4).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
коэффициенты распределения в присутствии и в от-
сутствие ИЖ в органической фазе) уменьшается с
Сопоставлены зависимости коэффициентов рас-
ростом [HNO3], однако синергизм в системе с диок-
пределения U(VI), Th(IV) и Ln(III) от концентра-
сидом I наблюдается даже в сильнокислых средах
ции азотной кислоты в водной фазе при экстрак-
(рис. 1, 3).
ции растворами диоксидов I и II в дихлорэтане
Синергизм при экстракции U(VI) и Th(IV) сме-
(ДХЭ), содержащем С4mimTf2N, и чистом ДХЭ.
сями диоксида II и С4mimTf2N проявляется только
При экстракции растворами диоксидов I и II в ДХЭ
наблюдаются зависимости lgD-[HNO3] с макси-
4
мумами (рис. 1-3), что связано с высаливающим
1
действием ионов NO– и связыванием экстрагента
2
3
азотной кислотой. Присутствие С4mimTf2N в орга-
3
нической фазе существенно изменяет характер за-
4
2
висимости lgD-[HNO3]: происходит снижение DU,
DTh и DLn с ростом [HNO3], что отмечалось ранее
1
при экстракции ионов металлов растворами ней-
тральных экстрагентов в присутствии ИЖ [18-23].
0
Добавка С4mimTf2N в раствор диоксида I приводит
к увеличению экстракции U(VI), Th(IV) (рис. 1) и
Ln(III) (рис. 3) во всем исследованном диапазоне
-1
концентрации HNO3. Наблюдаемый синергетиче-
-1.2
-0.8
-0.4
0.0
0.4
0.8
ский эффект, по-видимому, связан с вхождением
]
lg[HNO3
гидрофобных анионов Tf2N- в состав экстрагиру-
Рис.
3. Зависимость коэффициентов распределения
емых комплексов, что приводит к увеличению их
Eu(III) от концентрации HNO3 в водной фазе при экстрак-
гидрофобности по сравнению с сольватированны-
ции растворами 0.02 моль/л диоксида I (1, 4) и диоксида
ми нитратами Ln(III), U(VI) и Th(IV). Величина
II (2, 3) в дихлорэтане (3, 4) и дихлорэтане, содержащем
синергетического эффекта SC = D/D0 (где D и D0 -
0.1 моль/л C4mimTf2N (1, 2).
РАДИОХИМИЯ том 65 № 5 2023
ЭКСТР
АКЦИЯ АКТИНИДОВ И ЛАНТАНИДОВ
413
2.0
1.5
1.0
0.5
1
2
0.0
3
4
5
–0.5
6
-1.0
-1.5
La Ce Pr Nd Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Рис. 4. Коэффициенты распределения Ln(III) при экстракции из раствора 3 моль/л HNO3 растворами 0.02 моль/л диоксида I
(1, 2, 6) и диоксида II (3-5) в дихлорэтане (3, 6), дихлорэтане, содержащем 0.1 моль/л C4mimTf2N (2, 4) и в неразбавленном
C4mimTf2N (1, 5).
при низкой концентрации HNO3 (рис. 2), а при экс-
на соотношение DLn при экстракции диоксидами I
тракции Ln(III) - при [HNO3] < 2 моль/л (рис. 3). В
и II (рис. 4). Если в системе с диоксидом I добавка
области более высокой концентрации кислоты до-
С4mimTf2N приводит к значительному увеличению
бавка С4mimTf2N в органическую фазу приводит к
DLn, то в системе с диоксидом II наблюдается сни-
подавлению экстракции U(VI), Th(IV) и Ln(III).
жение DLn. В результате этого в присутствии ИЖ
Сопоставление величин DU и DTh при экстракции
диоксид I экстрагирует ионы Ln(III) более эффек-
из растворов 3 моль/л HNO3 растворами диоксидов
тивно, чем диоксид II. Различие в эффективности
I и II показало, что изменение структуры диоксидов
экстракции ионов Ln(III) диоксидами I и II еще
различным образом влияет на эффективность экс-
более увеличивается, когда в качестве растворите-
тракции ионов металлов при использовании в каче-
ля используется неразбавленная ИЖ С4mimTf2N
стве растворителя ДХЭ или смеси его с С4mimTf2N
(рис. 4).
(табл. 1). Замена в молекуле диоксида I этиленового
Стехиометрическое соотношение металл : экс-
мостика между группами P(O) на о-фениленовый
трагент в комплексах, экстрагируемых в присут-
приводит к увеличению DU в 1380, а DTh - в 39 раз
ствии ИЖ, определено методом сдвига равновесия.
при экстракции раствором диоксида II в ДХЭ. В
Полученные данные (рис. 5) показали, что Ln(III) и
присутствии С4mimTf2N диоксид II экстрагирует
U(VI) экстрагируются диоксидами I и II в основном
U(VI) более эффективно, чем диоксид I, только в
в виде трисольватов (угловой наклон зависимости
48 раз, а Th(IV) - даже значительно менее эффек-
lgD-lg[L] составляет 2.85 ± 0.1). Th(IV) извлекается
тивно, чем диоксид I. Аналогичное влияние оказы-
в этих условиях диоксидом II виде трисольватов, а
вает присутствие С4mimTf2N в органической фазе
диоксидом I - в виде смеси ди- и трисольватов.
Таблица 1. Коэффициенты распределения U(VI) и Th(IV)
Процесс экстракции Ln(III) растворами диок-
раствора-
при экстракции из растворов 3 моль/л HNO3
сидов I и II (L) в присутствии ИЖ в органической
) и
ми 0.0005 моль/л диоксидов I и II в дихлорэтане (D0
фазе может быть описан уравнением
дихлорэтане, содержащем 0.1 моль/л С4mimTf2N (D)
U(VI)
Th(IV)
Ln3+(в) + 3L(о) + 3C4mimTf2N(о) ↔
Экстрагент
↔ LnL3(Tf2N)3(о) + 3C4mim+(в),
(1)
lgD0
lgD
lgD0
lgD
I
-0.38
0.45
1.28
2.47
(где символы (о) и (в) относятся к компонентам
II
2.76
2.13
1.87
0.75
экстракционной системы в органической и водной
РАДИОХИМИЯ том 65 № 5 2023
414
ТУРАНОВ и др.
3.0
2.5
1
2.5
2
2.0
3
2.0
4
1.5
5
1.5
6
1.0
1
1.0
2
0.5
3
0.5
4
0.0
5
0.0
6
-0.5
7
-0.5
8
-1.0
-1.0
-4.0
-3.5
-3.0
-2.5
-2.0
-1.5
-4.5
-4.0
-3.5
-3.0
-2.5
-2.0
-1.5
lg[L]
lg[L]
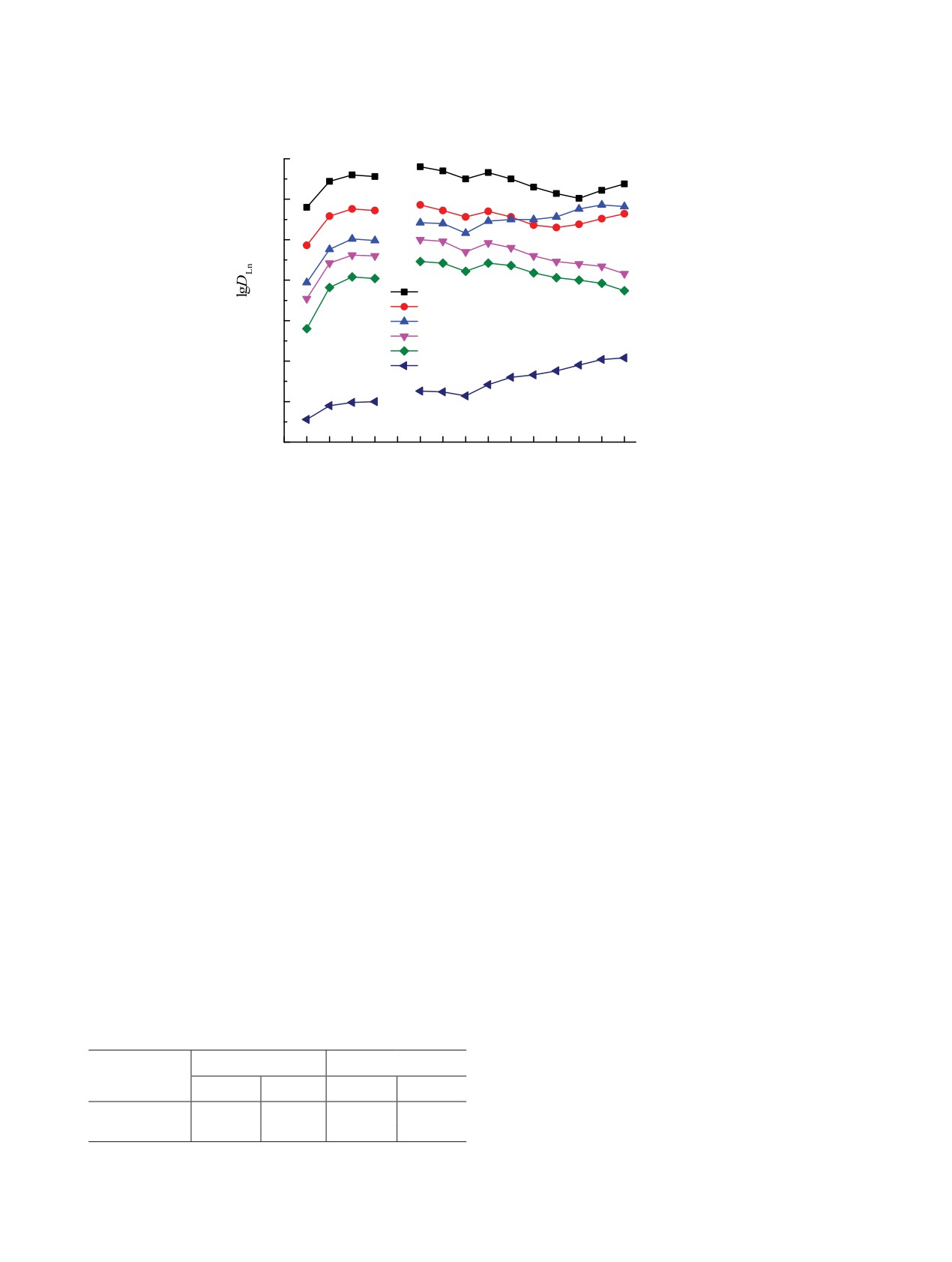
Рис.
5. Зависимость коэффициентов распределения
Рис.
6. Зависимость коэффициентов распределения
Th(IV) (1, 3), U(VI) (2, 4) и Eu(III) (5, 6) от концентрации
Eu(III) (1, 6), La(III) (2, 7), Ho(III) (3, 8) и Lu(III) (4, 5)
диоксида I (1, 4, 5) и диоксида II (2, 3, 6) в дихлорэтане,
от концентрации диоксида I (5-8) и диоксида II (1-4) в
содержащем 0.1 моль/л C4mimTf2N, при экстракции из
дихлорэтане при экстракции из раствора 0.001 моль/л
раствора 3 моль/л HNO3.
LiTf2N.
фазах соответственно), а константа экстракции вы-
в виде комплексов LnL3(Tf2N)3. Константы экстрак-
ражается как
ции Ln(III), рассчитанные по уравнению
Kex = [LnL3(Tf2N)3](о)[Ln3+]-1(в)[L]-3(о)[C4mimTf2N]-3(о)
KLn = DLn[L]3(о)[Tf2N-]3(в),
(5)
[C4mim+]3(в),
(2)
(где [L](о) - равновесная концентрация экстраген-
или, учитывая распределение ИЖ между фазами
та в органической фазе), приведены в табл. 2. Из
C4mim+(в) + Tf2N-(в) ↔ C4mimTf2N(о), KИЖ,
(3)
этих данных видно, что устойчивость комплексов
Kex = [LnL3(Tf2N)3](о)[Ln3+]-1(в)[L]-3(о)KИЖ-3[Tf2N-]-3(в) =
LnL3(Tf2N)3, образуемых диоксидом II, значительно
= KLnKИЖ-3,
(4)
Таблица 2. Концентрационные константы экстракции
где KLn - константа экстракции Ln(III) растворами
Ln(III), lgKLn, растворами диоксидов I и II в дихлорэтане
диоксидов I и II в дихлорэтане из растворов, содер-
из растворов LiTf2N
жащих ионы Tf2N-, которая характеризует устойчи-
Ln(III)
lgKLn(I)
lgKLn(II)
вость комплексов LnL3(Tf2N)3.
La
15.62 ± 0.03
19.75 ± 0.03
Для определения констант экстракции Ln(III)
Ce
15.96 ± 0.03
20.08 ± 0.03
растворами диоксидов I и II в дихлорэтане из рас-
Pr
16.07 ± 0.03
20.16 ± 0.03
творов, содержащих ионы Tf2N-, рассмотрена зави-
Nd
16.04 ± 0.03
20.07 ± 0.04
симость DLn от концентрации ионов Tf2N- в водной
Sm
16.11 ± 0.03
20.18 ± 0.04
фазе при постоянной концентрации диоксидов I и II
Eu
15.97 ± 0.03
20.11 ± 0.03
в органической фазе. Угловой наклон зависимости
Gd
15.68 ± 0.03
19.89 ± 0.05
lgDLn-lg[Tf2N-] близок к 3 для всех Ln(III), что со-
Tb
15.56 ± 0.03
19.80 ± 0.03
ответствует экстракции Ln(III) в виде комплексов
Dy
15.29 ± 0.03
19.55 ± 0.04
с стехиометрическим соотношением Ln : Tf2N- =
Ho
15.09 ± 0.03
19.46 ± 0.03
1 : 3. Стехиометрическое соотношение Ln : L в экс-
Er
15.17 ± 0.03
19.30 ± 0.04
трагируемых комплексах, определенное методом
Tm
15.41 ± 0.03
19.19 ± 0.03
разбавления, составляет 1 : 3 (рис. 6), что соответ-
Yb
15.85 ± 0.03
19.13 ± 0.04
ствует экстракции Ln(III) из водных растворов, со-
Lu
16.32 ± 0.03
18.97 ± 0.03
держащих ионы Tf2N-, растворами диоксидов I и II
РАДИОХИМИЯ том 65 № 5 2023
ЭКСТР
АКЦИЯ АКТИНИДОВ И ЛАНТАНИДОВ
415
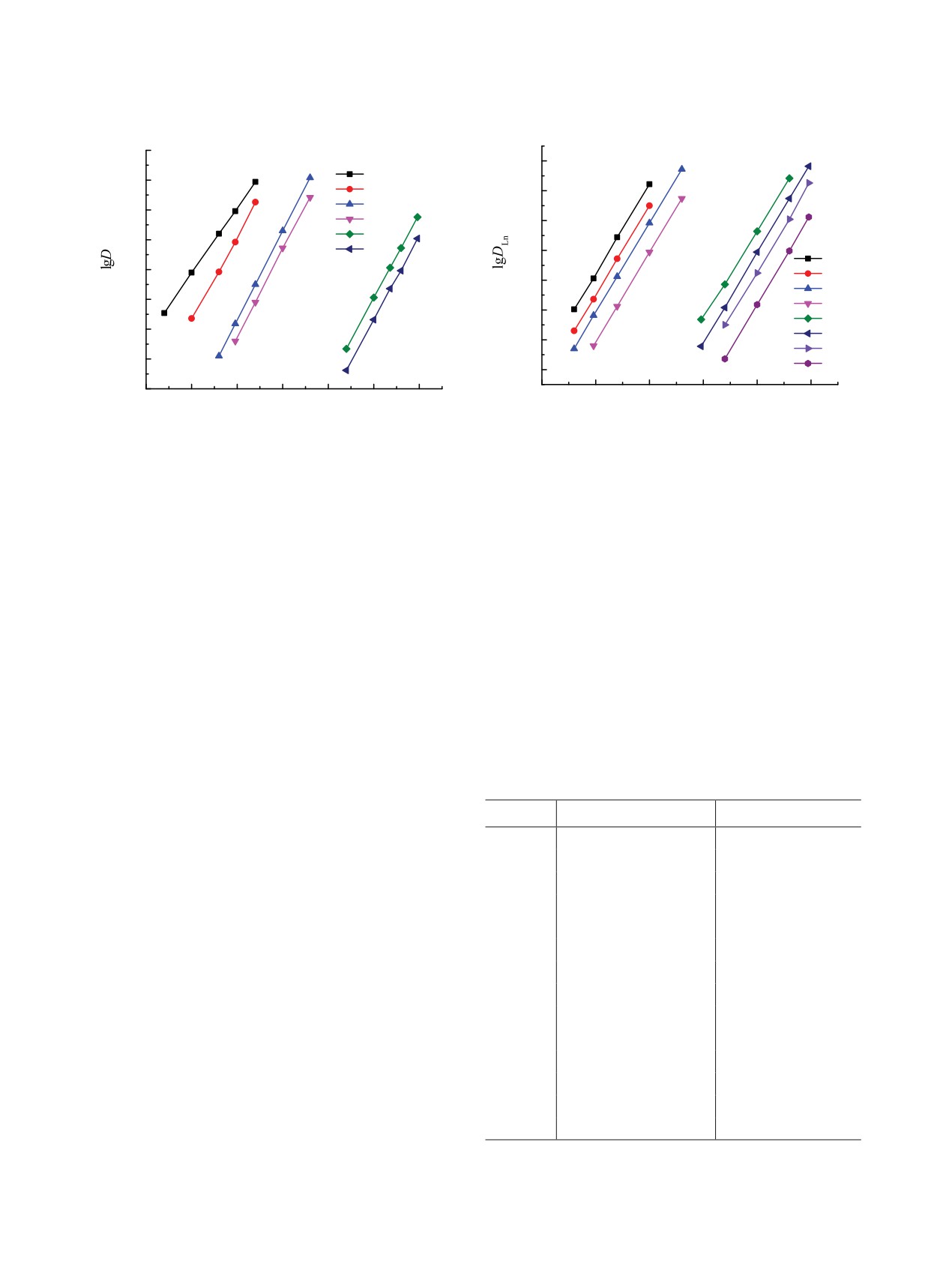
При экстракции Ln(III) из азотнокислых раство-
II
0.010
I
ров растворами диоксидов I и II в присутствии ИЖ
зависимость DLn от концентрации компонентов ор-
0.008
ганической и водной фаз может быть выражена как
DLn = KLnKИЖ-3[L]3(о) исх f -3[Tf2N-]3(в),
(8)
0.006
2
где f
= 1 + KHNO3(1)[H+][NO3-]γ
+ KHNO3(2)[H+]2
0.004
[NO–]2γ4 + KHTf2N[H+][Tf2N-]) - поправка на связы-
вание экстрагента HNO3 и HTf2N. Различие в эф-
0.002
фективности экстракции Ln(III) диоксидами I и II
в сопоставимых условиях, выраженное как отноше-
0.000
ние коэффициентов распределения DLn(I)/DLn(II),
0.00
0.05
0.10
0.15 0.20 0.25 0.30
0.35
зависит от устойчивости комплексов LnL3(Tf2N)3,
[HTf2N]ɜ , M
экстракционной способности диоксидов по отно-
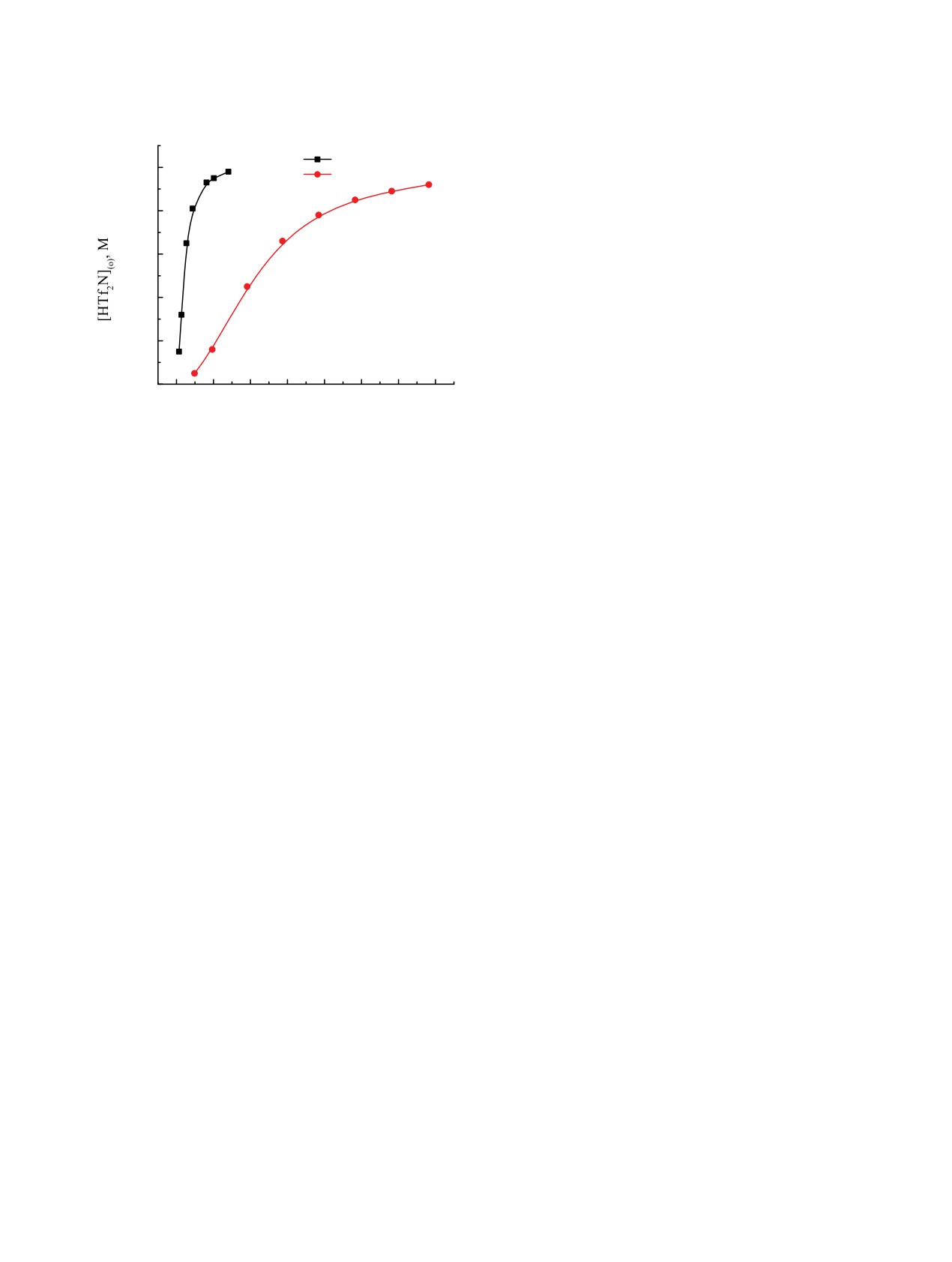
Рис. 7. Экстракция HTf2N растворами 0.01 моль/л диок-
шению к HNO3 и HTf2N, а также концентрации
сидов I и II в дихлорэтане
HNO3 и ионов Tf2N- в водной фазе:
DLn(I)/DLn(II) = KLn(II)KLn(I)-1f(I)-3f(II)3.
(9)
выше, чем устойчивость аналогичных комплексов с
диоксидом I. Между тем, эффективность экстрак-
Из этого соотношения следует, что при экстрак-
ции Ln(III) из азотнокислых растворов диоксидом
ции Ln(III) из нейтральных и слабокислых рас-
I в присутствии C4mimTf2N выше, чем в системе с
творов DLn(I)/DLn(II) ≈ KLn(I)/KLn(II), т.е. диоксид
диоксидом II (рис. 4).
I в присутствии ИЖ экстрагирует Ln(III) менее
Рассмотрим возможные причины таких изме-
эффективно, чем диоксид II. С ростом концентра-
нений эффективности экстракции ионов Ln(III)
ции HNO3 величина отношения f(II)/f(I) возраста-
растворами диоксидов I и II в присутствии ИЖ.
ет, и диоксид I в присутствии C4mimTf2N экстра-
Процесс экстракции ионов металлов растворами
гирует Ln(III) более эффективно, чем диоксид II.
этих экстрагентов в присутствии ИЖ из кислых
Поскольку величина f зависит от концентрации ио-
растворов сопровождается взаимодействием экс-
нов Tf2N- в равновесной водной фазе, увеличение
трагентов с HNO3 и HTf2N, находящейся в раство-
концентрации ИЖ в органической фазе приводит
ре вследствие заметного перехода компонентов
к увеличению величины f(II)/f(I) и соответственно
C4mimTf2N в водную фазу [27]. Данные по рас-
к росту DLn(I)/DLn(II). Поэтому при использовании
пределению HTf2N между ее водными раствора-
чистой ИЖ C4mimTf2N в качестве растворителя
ми и растворами соединений I и II в дихлорэтане
различие между DLn(I) и DLn(II) возрастает (рис. 4).
(рис. 7) указывают на то, что отношение концентра-
Можно заключить, что, хотя диоксид II образует
ции HTf2N, связанной в комплексы с экстрагентом,
более устойчивые комплексы LnL3(Tf2N)3, чем ди-
и исходной концентрации экстрагента в органиче-
оксид I (KLn(II) >> KLn(I)), его более высокая спо-
ской фазе близко к 1. Следовательно, экстракция
собностью экстрагировать HTf2N (KHTf2N(II) >>
HTf2N растворами диоксидов I и II может быть
KHTf2N(I)) приводит к тому, что он в присутствии
описана уравнением
C4mimTf2N менее эффективно экстрагирует ионы
металлов из растворов с умеренной и высокой кон-
H+ +Tf2N- + L(o) ↔ HTf2NL(o),
(6)
центрации HNO3, чем диоксид I.
а константа экстракции выражена как
Представленные данные показали, что природа
фрагмента, соединяющего фосфорильные группы
KHTf2N = [HTf2NL]/([L][H+][Tf2N-]).
(7)
в молекулах диоксидов дифосфинов, существенно
Концентрационные константы экстракции
влияет на их экстракционную способность. Замена
HTf2N растворами диоксидов I и II в дихлорэтане,
этиленового мостика в молекуле диоксида I на
рассчитанные исходя из данных рис. 7, составляют
о-фениленовый приводит к значительному повы-
92.6 ± 5.6 и (9.11 ± 0.92) × 103 соответственно.
шению экстракционной способности диоксида II
РАДИОХИМИЯ том 65 № 5 2023
416
ТУРАНОВ и др.
по отношению к Ln(III), U(VI) и Th(IV) в азотнокис-
6.
Bhattacharyya A., Mohapatra P.K. // Radiochim. Acta.
лых средах. Устойчивость комплексов LnL3(Tf2N)3,
2019. Vol. 107. P. 931.
образуемых диоксидом II, также значительно
7.
Розен А.М., Крупнов Б.В. // Успехи химии. 1996.
выше, чем устойчивость аналогичных комплек-
Т. 65, № 11. С. 1052-1079; Rozen A.M., Krupnov B.V. //
сов с диоксидом I. Экстракция ионов металлов из
Russ. Chem. Rev. 1996. Vol. 65, N 11. P. 973.
азотнокислых растворов растворами диоксида I
значительно возрастает в присутствии ионной жид-
8.
Turanov A.N.,Matveeva A.G.,Kudryavtsev I.Yu.,
кости C4mimTf2N в органической фазе, а диоксида
Pasechnik M.P., Matveev S.V., Godovikova M.I.,
Baulina T.V., Karandashev V.K., Brel V.K. // Polyhedron.
II - уменьшается. В системе с C4mimTf2N диоксид I
2019. Vol. 161. P. 276.
превосходит диоксид II по эффективности экстрак-
ции Ln(III), U(VI) и Th(IV) из азотнокислых раство-
ров. Такое изменение порядка экстракционной спо-
9.
Беркман З.А., Бертина Л.Э., Кабачник М.И.,
Коссых В.Г., Медведь Т.Я., Нестерова Н.П.,
собности диоксидов I и II по отношению к ионам
Розен А.М., Юдина К.С. // Радиохимия. 1975. Т. 17,
металлов в присутствии ионной жидкости связано
№ 2. С. 210.
с более высокой способностью диоксида II экстра-
10. Розен А.М., Николотова З.И., Карташева Н.А.,
гировать HTf2N.
Медведь Т.Я., Нестерова Н.П., Юдина К.С., Кабач-
ник М.И. // Радиохимия. 1976. Т. 18, № 6. С. 846.
ФОНДОВАЯ ПОДДЕРЖКА
11. Туранов А.Н., Карандашев В.К., Артюшин О.И.,
Костикова Г.В., Федосеев А.М., Брель В.К. // ЖОХ.
Работа выполнена в рамках Государственного
2022. Т. 92, № 8. С. 1289.
задания 2023 г. ИФТТ РАН, ИПТМ РАН и ИНЭОС
12. Riano S., Foltova S.S., Binnemans K. // RSC Adv. 2020.
РАН. Синтез исходных соединений выполнен при
Vol. 10. P. 307.
финансовой поддержке Российского научного фон-
да (проект 20-13-00329).
13. Raut D.R., Sharma S., Ghosh S.K., Mohapatra P.K. //
Sep. Sci. Technol. 2017. Vol. 52. P. 1430.
14. Khodakarami M., Alagha L. // Sep. Purif. Technol. 2020.
КОНФЛИКТ ИНТЕРЕСОВ
Vol. 232. Article 115952.
15. Murakami S., Matsumiya M., Yamada T., Tsunashima K. //
Авторы заявляют об отсутствии конфликта ин-
Solvent Extr. Ion Exch. 2016. Vol. 34. P. 172.
тересов.
16. Kolarik Z. // Solvent Extr. Ion Exch. 2013. Vol. 31. P. 24.
СПИСОК ЛИТЕРАТУРЫ
17. Iqbal M., Waheed K., Rahat S.B., Mehmood T.,
Lee M.S. // J. Radioanal. Nucl. Chem. 2020. Vol. 325.
1.
Myasoedov B.F., Kalmykov S.N., Kulyako Yu.M.,
P. 1.
Vinokurov S.E. // Geochem. Int. 2016. Vol. 54, N 13.
P. 1156.
18. Atanassova M.
// J. Mol. Liq.
2021. Vol.
343.
Article 117530.
2.
Аляпишев М.Ю., Бабаин В.А., УстынюкЮ.А. // Успехи
химии. 2016. Т. 85, № 9. С. 943; Alyapyshev M Yu.,
19. Sun T., Zhang Y., Wu Q., Chen J., Xia L., Xu C. // Solvent
Babain V.A., Ustynyuk Yu.A. // Russ. Chem. Rev. 2016.
Extr. Ion Exch. 2017. Vol. 35. P. 408.
Vol. 85, N 9. P. 943.
20. Туранов А.Н., Карандашев В.К., Яркевич А.Н. //
3.
Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev.
Радиохимия. 2022. Т. 64, № 2. С. 164; Turanov A.N.,
2017. Vol. 46. P. 7229.
Karandashev V.K., Yarkevich A.N. // Radiochemistry.
2022. Vol. 64, N 2. P. 163.
4.
Wilson A.M., Bailey P.J., Tasker P.A. // Chem. Soc. Rev.
2014. Vol. 43. P. 123.
21. Turanov A.N., Karandashev V.K., Sharova E.V.,
5.
Werner E.J., Biros S.M. // Org. Chem. Front. 2019.
Genkina G.K., Artyushin O.I., Baimukhanova A.
//
Vol. 6. P. 2067.
Radiochim. Acta. 2018. Vol. 106. P. 355.
РАДИОХИМИЯ том 65 № 5 2023
ЭКСТР
АКЦИЯ АКТИНИДОВ И ЛАНТАНИДОВ
417
22. Прибылова Г.А., Смирнов И.В., Новиков А.П. //
26. Matveeva A.G., Artyushin O.I., Pasechnik M.P.,
Радиохимия. 2012. Т. 54, № 5. С. 435.
Stash A.I.,
Vologzhanina A.V., Matveev S.V.,
23. Pribilova G., Smirnov I., Novikov A. // J. Radioanal.
Godovikov I.A., Aysin R.R., Moiseeva A.A., Turanov A.N.,
Nucl. Chem. 2012. Vol. 295. P. 83.
Karandashev V.K., Brel V.K.
// Polyhedron.
2021.
Vol. 198. Article 115085.
24. Gan Q., Cai Y., Fu K., Yuan L., Feng W. // Radiochim.
Acta. 2020. Vol. 108. P. 239.
27. Gaillard C., Boltoeva M., Billard I., Georg S., Mazan V.,
25. Tsvetkov E.N., Bondarenko N.A., Malakhova I.G.,
Ouadi A., Ternova D., Henning C. // ChemPhysChem.
Kabachnik M.I. // Synthesis. 1986. N.3. P.198.
2015. Vol. 16. P. 2653.
Extraction of Actinides and Lanthanides
from Nitric Acid Solutions with Diphosphine Dioxides
in the Presence of an Ionic Liquid
A. N. Turanova, V. K. Karandashevb, O. I. Artyushinc, V. K. Brelc,*
a Osipyan Institute of Solid State Physics, Russian Academy of Sciences,
Chernogolovka, Moscow oblast, 142432 Russia
b Institute of Microelectronics Technology and High Purity Materials,
Russian Academy of Sciences, Chernogolovka, Moscow oblast, 142432 Russia
c Nesmeyanov Institute of Organoelement Compounds, Russian Academy of Sciences, Moscow, 119334 Russia
*e-mail: v_brel@mail.ru
Received May 2, 2023; revised July 10, 2023; accepted July 13, 2023
The effect of 1-butyl-3-methylimidazolium bis[(trifluoromethyl)sulfonyl]imide ionic liquid on the extraction
of lanthanides(III), U(VI), and Th(IV) from nitric acid solutions with 1,2-bis(diphenylphosphinyl)ethane I and
1,2-bis(diphenylphosphinyl)benzene II has been studied. The stoichiometry of the extractable complexes was
determined. A solution of dioxide II in dichloroethane extracts metal ions much more efficiently than a solution
of dioxide I. It has been established that, in the presence of an ionic liquid in the organic phase, the efficiency
of extraction of metal ions from nitric acid solutions with solutions of dioxide I increases significantly, while
that of dioxide II decreases. As a result, in the presence of an ionic liquid in the organic phase, dioxide II is
significantly inferior to dioxide I in terms of the efficiency of extraction of Ln(III), U(VI), and Th(IV) from
nitric acid solutions, which is associated with a much higher ability of dioxide II to extract HTf2N.
Keywords: extraction, lanthanides(III), uranium(VI), thorium(IV), diphosphine dioxides, ionic liquids.
РАДИОХИМИЯ том 65 № 5 2023