РАДИОХИМИЯ, 2023, том 65, № 5, с. 403-409
УДК 541.11:542.61:544.54
МОДЕЛИРОВАНИЕ ТЕРМИЧЕСКОГО
РАЗЛОЖЕНИЯ АЗОТНОКИСЛОГО РАСТВОРА
АЦЕТОГИДРОКСАМОВОЙ КИСЛОТЫ
В ПРОЦЕССЕ ПЕРЕРАБОТКИ ОЯТ
© 2023 г. В. В. Калистратова, А. В. Смирнов, Е. В. Белова*
Институт физической химии и электрохимии им. А.Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4
*e-mail: bl174@bk.ru
Поступила в редакцию 05.05.2023, после доработки 03.07.2023, принята к публикации 10.07.2023
Проведён термический анализ раствора ацетогидроксамовой кислоты в 12 моль/л HNO3. Определены
энергия активации, удельный тепловой эффект, длительность протекания и скорость экзотермической
реакции, предэкспоненциальный множитель, стартовая температура и величина саморазогрева образ-
ца, изменение давления и удельный объём выделившихся газов. Показано, что в условиях эксперимента
данная реакция проходит в автокаталитическом режиме. На основе экспериментальных данных полу-
чено кинетическое уравнение реакции, которое использовали для создания модели протекания реакции
в различных условиях. Достоверность результатов моделирования проверена методом дифференциаль-
но-сканирующей калориметрии.
Ключевые слова: ацетогидроксамовая кислота; азотная кислота; калориметрия; параметры экзотерми-
ческих процессов; кинетическая модель.
DOI: 10.31857/S0033831123050015, EDN: XTWPZI
ВВЕДЕНИЕ
клидов способствует протеканию взаимодействия
восстановителя АГК с окислителем и при мень-
В процессе гидрометаллургической переработ-
ших температурах. Это может негативно сказаться
ки отработавшего ядерного топлива (ОЯТ) приме-
на их термической стабильности, увеличивая риск
няют этап химического восстановления для отде-
перерастания экзотермических реакций в тепловой
ления Pu(IV) от U(VI), тем самым последовательно
взрыв.
восстанавливая оба актинида в отдельных потоках
Случаи тепловых взрывов с выделением боль-
продуктов. Этап восстановления также способству-
ших объёмов газообразных продуктов реакции, ко-
ет удалению соэкстрагированного нептуния (Np) из
торые приводили к разгерметизации оборудования
потока уранового продукта. В качестве замены ги-
и выбросу радиоактивных растворов за его преде-
дразин-стабилизированных восстановителей пред-
лы, известны в практике работы предприятий [10].
ложены простые гидроксамовые кислоты [1-2],
При использовании и переработке топлива реакто-
особенно ацетогидроксамовая кислота (АГК), кото-
ров на быстрых нейтронах интенсивность эксплу-
рая непосредственно образует комплексы с ионами
атации технологических смесей возрастает. Поэ-
Pu(IV) и Np(IV), тем самым отделяя их в водную
тому большое внимание отводится обеспечению
фазу, в дополнение к восстановлению экстрагируе-
естественной безопасности всех процессов, вклю-
мого Np(VI) до неизвлекаемого Np(V) [3-8].
чая переработку ОЯТ, что вызывает необходимость
АГК является неустойчивым веществом и при
детального изучения реакций с выделением тепла.
температурах 70-80С в растворах азотной кисло-
При этом задача масштабирования параметров,
ты гидролизуется и разлагается с выделением теп-
полученных в ходе лабораторных экспериментов
ла [9]. Присутствие теплогенерирующих радиону-
на большие промышленные объёмы, актуализиру-
403
404
КАЛИСТРАТОВА и др.
ет создание кинетических моделей, описывающих
возникновения теплового взрыва. АГК в азотно-
конкретные экзотермические реакции.
кислых растворах подвергается гидролизу уже при
комнатной температуре и со временем разлагается
В работе на основе экспериментального опреде-
[9, 11], поэтому растворы готовили непосредствен-
ления параметров разложения раствора АГК стехи-
но перед экспериментом. Обработку результатов
ометрического состава в 12 моль/л HNO3 получено
проводили с помощью программ ProteusNetzsch и
кинетическое уравнение экзотермической реакции.
KineticsNeo (Netzsch).
Цель исследования
- выявление потенциально
опасных процессов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение исходных калориметрических данных
Исследования проводили в адиабатическом ка-
Из литературных данных [11] и полученных ра-
лориметре Netzsch MMC 274Nexus с тепловой ком-
нее результатов исследования растворов АГК [9]
пенсацией в сканирующем режиме постоянного
известно, что стартовые температуры экзотермиче-
нагрева и в режиме поиска экзотермической реак-
ских реакций находятся в интервале от 70 до 80С.
ции в адиабатическом режиме, используя функцию
Поэтому на первом этапе изучали раствор 50 г/л
Heat-Wait-Search (HWS). В экспериментах измеря-
АГК в 12 моль/л HNO3 в режиме постоянного на-
ли температуру начала экзотермической реакции
грева со скоростью 1 К/мин. Механизм взаимодей-
(Tст, С), давление (Pmax, бар), величину максималь-
ствия АГК с азотной кислотой состоит из несколь-
ного саморазогрева (ΔТ, С), скачок давления в про-
ких этапов [12]: сначала АГК в растворе азотной
цессе реакции (ΔP, бар), тепловой эффект реакции
кислоты гидролизуется до уксусной кислоты и ги-
(Q, Дж), длительность протекания экзотермической
дроксиламина (ГА) (реакция (1)); затем протекает
реакции (τ, мин), удельный объем выделившихся
двухстадийная реакция взаимодействия гидрок-
газообразных продуктов (Vуд, л/гАГК) и время до до-
силамина с азотной кислотой (реакции (2) и (3)).
стижения максимальной скорости реакции (TMR,
Стадия взаимодействия гидроксиламина с HNO2
мин). В качестве контейнера для образца использо-
протекает с выделением тепла и большого объёма
вали тигель из хастеллоя объёмом 8.5 мл, в который
газообразных продуктов, поэтому она представляет
помещали 3 мл раствора. Погрешность определения
наибольший интерес и является объектом данного
стартовой температуры, величины саморазогрева и
исследования.
скачка давления составляет 3%. Погрешность рас-
чета величины тепловыделения не превышала 2%.
CH3CONHOH + H3O+ → CH3COOH + NH3OH+,
(1)
Для оценки влияния длительности выдержки и
NH3OH+ + 2HNO3 → 3HNO2 + H+ + H2O,
(2)
скорости нагрева использовали прибор синхрон-
NH3OH+ + HNO2 → N2O + H+ + 2H2O.
(3)
ного термического анализа Netzsch 449 F5 Jupiter.
Навеску раствора объемом 10 мкл нагревали в
В результате эксперимента определены изме-
герметичном тигле из хром-никелевой стали со
нения температуры образца (рис. 1, а) и давления
скоростью 2 и 5 К/мин в интервале 50-250С для
(рис. 1, б) во времени при нагреве со скоростью
определения температуры начала экзотермической
1 К/мин. Величина стартовой температуры экзо-
реакции (Тст.дин, С) и длительности ее протекания
термической реакции (Тст) равна 76С, что соот-
(τдин, мин). Погрешность измерений не превыша-
ветствует данным работ [10, 12], величина само-
ла 3%.
разогрева (ΔТ) составила 22С. С учётом тепловой
Раствор ацетогидроксамовой кислоты с концен-
инерции, коэффициент которой равен 3, в системе,
трацией 50 г/л готовили растворением навески АГК
где масса сосуда сопоставима или меньше массы
(марка ч., содержание основного вещества 98%) в
его содержимого, величина ΔТ может достигать
12 моль/л HNO3. Этот состав выбран как консерва-
65.2С. В этом случае температура в образце ме-
тивный случай, который мало достижим в реально-
нее чем за 1 мин способна вырасти с 76 до 141С.
сти, но позволяет исследовать граничные условия
В процессе реакции выделилось 104 Дж/г тепла.
РАДИОХИМИЯ том 65 № 5 2023
МОДЕЛИРОВАНИЕ ТЕРМИЧЕСКОГО Р
АЗЛОЖЕНИЯ АЗОТНОКИСЛОГО РАСТВОРА
405
ɚ
ɛ
140
10
120
8
100
6
80
4
60
2
40
0
20
25
30
35
40
45
50
55
60
20
25
30
35
40
45
50
55
60
ȼɪɟɦɹ ɦɢɧ
ȼɪɟɦɹ ɦɢɧ
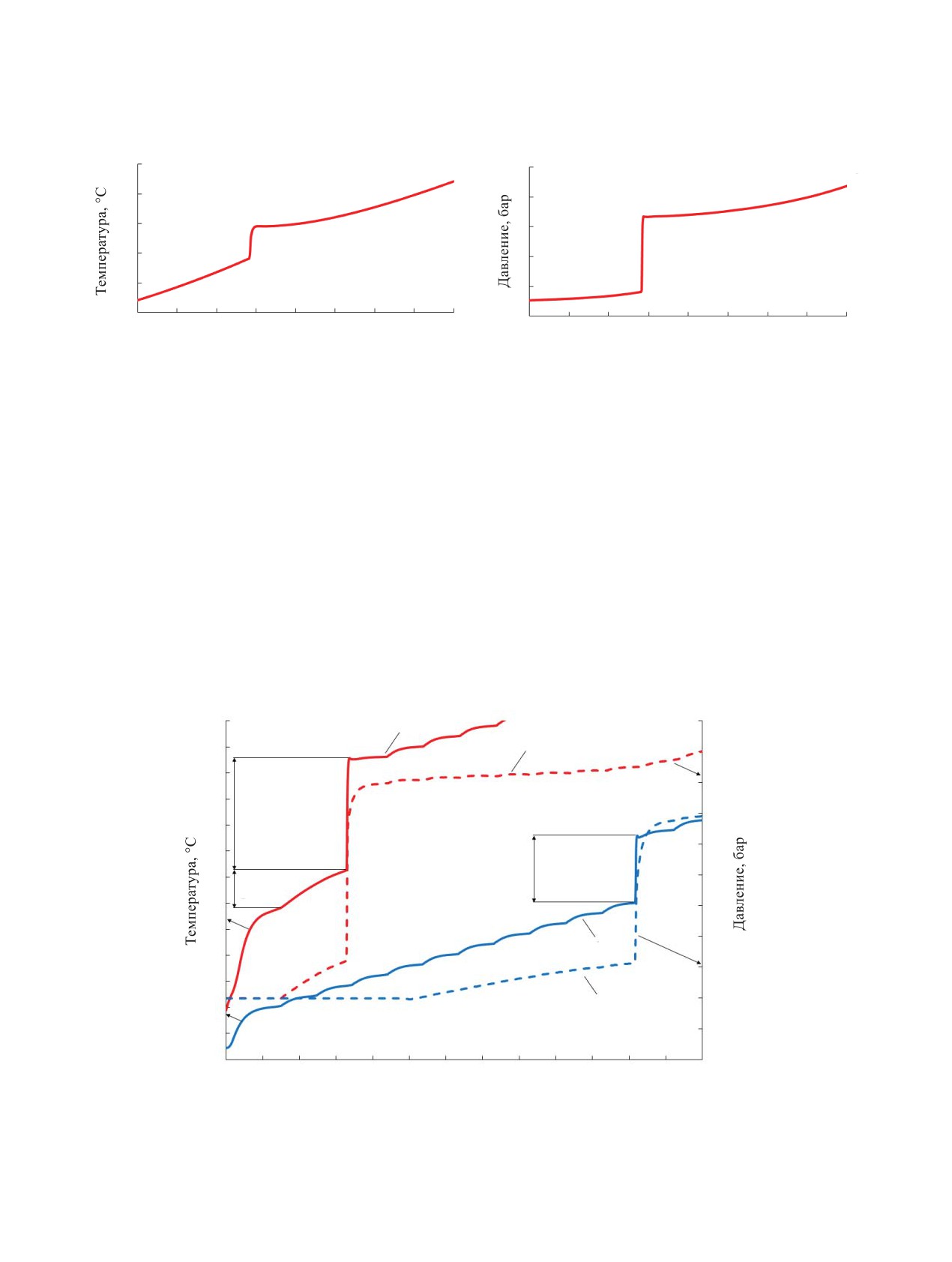
Рис. 1. Зависимость температуры (а) и давления (б) образца 50 г/л АГК в 12 моль/л HNO3 от времени в режиме постоянного
нагрева.
Данный тепловой эффект сопровождался интенсив-
времени мала, что характерно для автокаталитиче-
ным ростом давления в 5 бар (0.18 л/гАГК), а с учё-
ских реакций.
том атмосферного давления и роста за счёт нагрева-
Для изучения характеристик экзотермической
ния Pmax после реакции составит 6.7 бар (рис. 1, б).
реакции провели исследование в адиабатических
Удельный объём неконденсируемых газообразных
условиях в режиме
«нагрев-ожидание-поиск»
продуктов (Vуд), выделившихся в процессе реак-
(HWS), который позволяет уточнить значение Tст,
ции, определяется по остаточному давлению в со-
определить скорость реакции и рассчитать кинети-
суде после его охлаждения до комнатной темпера-
ческие параметры. Для учета теплопроводности ма-
туры. Это позволяет учесть вклад давления паров
териала тигля использовали функцию компенсации
воды, равного 2.1 бар, что соответствует значению
тепловой инерции, уменьшив её значение до 1.1.
0.08 л/гАГК. Это следует учитывать при расчёте дав-
Из данных, представленных на рис. 2, следует,
ления в аппарате и его заполнении. Реакция имеет
что взаимодействие компонентов раствора происхо-
скачкообразный характер, её продолжительность во
дит в два последовательных этапа. На первом этапе
85
ɚ
5.5
ɛ
80
5.0
75
ɋɚɦɨɭɫɤɨɪɟɧɢɟ
4.5
70
ɪɟɚɤɰɢɢ
4.0
65
3.5
60
ɋɚɦɨɭɫɤɨɪɟɧɢɟ
ɪɟɚɤɰɢɢ
55
ɇɚɱɚɥɨ
3.0
ɪɟɚɤɰɢɢ
50
2.5
45
2.0
ɚ
40
1.5
35
1.0
ɛ
30
0.5
25
20
0.0
0
50
100
150
200
250
300
350
400
450
500
550
600
650
ȼɪɟɦɹ ɦɢɧ
Рис. 2. Зависимость температуры (1а, 2а) и давления (1б, 2б) от времени для раствора 50 г/л АГК в 12 моль/л НNО3 в адиа-
батическом режиме с поиском экзотермической реакции от 30 (1а, б) и от 22С (2а, б).
РАДИОХИМИЯ том 65 № 5 2023
406
КАЛИСТРАТОВА и др.
0.7
0.6
1
2
0.6
0.5
1
0.5
0.4
0.4
0.3
0.3
2
0.2
0.2
0.1
0.1
3
0
0
20
30
40
50
60
70
80
30
40
50
60
70
80
90
100 110 120 130
Ɍɟɦɩɟɪɚɬɭɪɚ qɋ
Ɍɟɦɩɟɪɚɬɭɪɚ ɋ
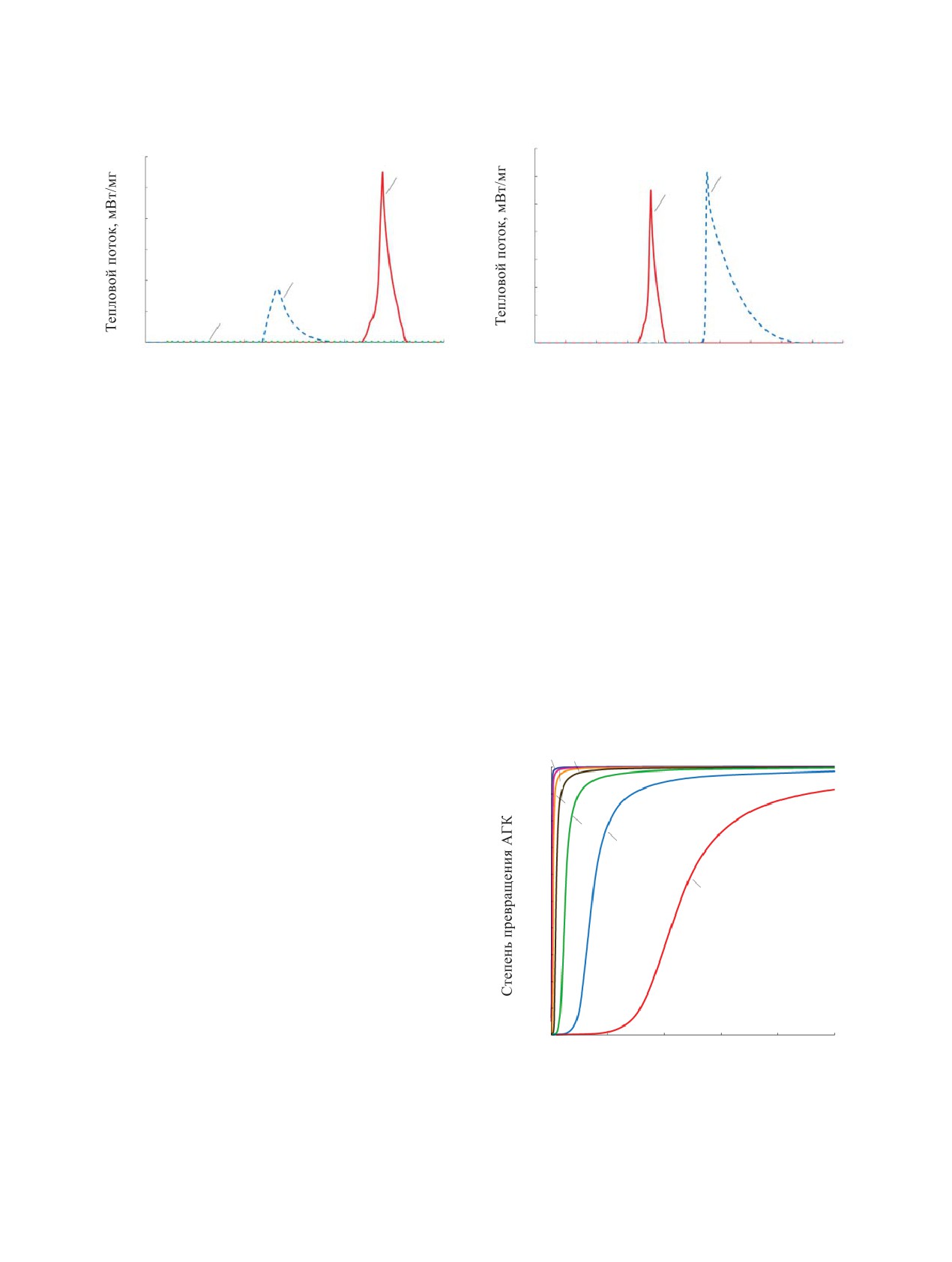
Рис. 3. Зависимость теплового потока от температуры
при выдержке раствора 50 г/л АГК в 12 моль/л HNO3 при
Рис. 4. Зависимость теплового потока для раствора 50 г/л
комнатной температуре: 1 - свежий раствор, 2 - 3 сут, 3 -
АГК в 12 моль/л HNO3 от температуры при скорости на-
7 сут.
грева, К/мин: 1 - 2, 2 - 5.
начинается реакция с газовыделением, но без те-
2 К/мин снижает величину Тст с 85 до 65С, при
пловыделения, на втором этапе происходит резкий
этом удельные тепловые эффекты имеют близкие
скачок температуры и давления. По сравнению с ре-
значения.
жимом постоянного нагрева (τ = 35 мин, рис. 1, а) в
Моделирование (KineticsNeo) процесса на осно-
адиабатическом режиме нагрева (τ = 150 мин, рис 2,
ве экспериментальных данных показало, что сте-
кривая 1а) величина Тст снижается с 76 до 49С. Ве-
пень превращения АГК при окислении по данной
личина саморазогрева снижается на 36.2С: от 65.2
реакции через 1 ч составит 80% (рис. 5).
до 29С, удельное тепловыделение снижается поч-
Параметры экзотермической реакции зависят от
ти в 2 раза (51 Дж/г), давление - на 1.5 бар.
времени контакта компонентов раствора в нагретом
Для подтверждения тенденции уменьшения ве-
состоянии - их величины снижаются с увеличением
личины саморазогрева, теплового эффекта и дав-
температуры и времени взаимодействия компонен-
ления в зависимости от условий нагрева и темпе-
тов. Это обстоятельство связано, вероятнее всего, с
ратуры перехода в режим HWS провели поиск эк-
зотермической реакции от комнатной температуры
7
4
(рис. 2, кривые 2а,б). Из-за низкой скорости нагрева
1
6
первый этап реакции растянут во времени. Экзотер-
0.9
5
мическая реакция началась через 550 мин при тем-
0.8
3
пературе 49С, величина саморазогрева снизилась
2
0.7
до 13С, удельное тепловыделение - до 24 Дж/г, а
давление составило 2.4 бар. Время протекания ре-
0.6
1
акции сократилось до 10 мин за счёт отсутствия
0.5
длительного периода низкой скорости экзотерми-
0.4
ческой реакции («начала реакции»), характерного
0.3
для процесса с поиском экзотермической реакции
от 30С (рис. 2, кривые 1а,б).
0.2
Влияние времени выдержки (рис. 3) и скоро-
0.1
сти нагрева раствора (рис. 4) изучали на приборе
0
0
1
2
3
4
5
синхронного термического анализа Netzsch
449
ȼɪɟɦɹ ɱ
F5 Jupiter. Выдержка при комнатной температуре
Рис. 5. Зависимость степени превращения АГК от време-
снижает интенсивность экзотермической реакции
ни в растворе 50 г/л АГК в 12 М НNО3в адиабатическом
примерно вдвое, а после 7 сут реакция вообще от-
режиме при различных температурах, °С: 1 - 10, 2 - 20,
сутствует. Уменьшение скорости нагрева с 5 до
3 - 30, 4 - 40, 5 - 50, 6 - 60, 7 - 70.
РАДИОХИМИЯ том 65 № 5 2023
МОДЕЛИРОВАНИЕ ТЕРМИЧЕСКОГО Р
АЗЛОЖЕНИЯ АЗОТНОКИСЛОГО РАСТВОРА
407
70
16
2
29
2
14
65
24
12
19
60
10
14
55
8
1
6
9
50
4
1
4
45
2
-1
40
0
552
554
556
558
560
562
564
557
558
559
560
561
562
563
564
-2
ȼɪɟɦɹ ɦɢɧ
ȼɪɟɦɹ ɦɢɧ
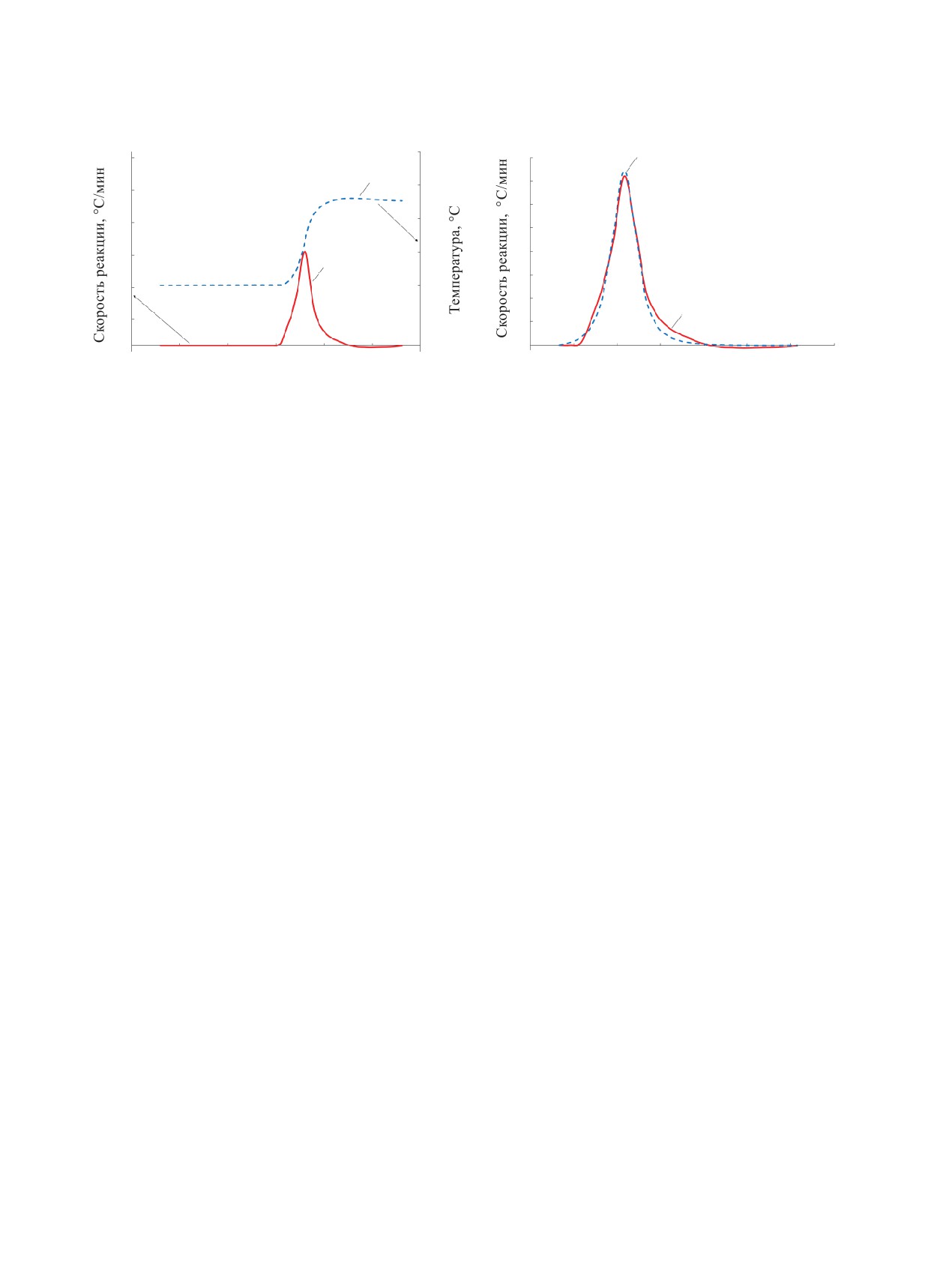
Рис. 6. Изменение скорости реакции (1) и температуры
Рис. 7. Зависимость скорости реакции от времени в экс-
образца (2) во времени.
перименте (1) и расчетная модель (2).
увеличением доли разложившейся АГК до момента
n - порядок реакции; m - порядок автокатализа; z0 -
возникновения экзотермической реакции и косвен-
константа автокатализа.
но подтверждает предположение, что одновремен-
Программное обеспечение ProteusNetzsch по-
но могут протекать реакции между АГК и НNО3
зволяет подбирать параметры уравнения (E, А, n,
(NО2) и образовавшимся ГА и НNО3. Поэтому ки-
m), при которых максимально точно описывается
нетику взаимодействия АГК и НNО3 необходимо
кривая скорости (рис. 7). Таким образом, значения
исследовать для свежеприготовленных растворов
параметров уравнения для кривой скорости, полу-
при максимальном содержании компонентов.
ченной для кривых 2а,б на рис. 2 составили: Е =
82.56 кДж/моль; А = 12.28log(1/s); n = 1.79; m = 1.21.
Составление кинетической модели
При расчёте кинетических параметров для ре-
акции, описываемой кривыми 1а, б на рис. 2 и яв-
Для масштабирования результатов необходимо
ляющейся более интенсивной по ΔТ и ΔP, значения
кинетическое уравнение, описывающее скорость
кинетических параметров близки, находятся в пре-
тепловыделения в системе, для чего надо получить
делах погрешности расчёта: Е = 87.38 кДж/моль;
кривую зависимости скорости реакции от времени.
А = 13.23log(1/s); n = 1.45; m = 0.71.
Метод адиабатической калориметрии позволяет
Важным параметром экзотермической реакции
определять скорость реакции в каждый момент вре-
является время достижения максимальной скоро-
мени через измерение температуры образца. Мате-
сти реакции (Time to maximum rate, TMR), которое
матически это выражается с помощью производной
зависит от начальной температуры эксперимен-
от температуры по времени (dT/dτ) (рис. 6).
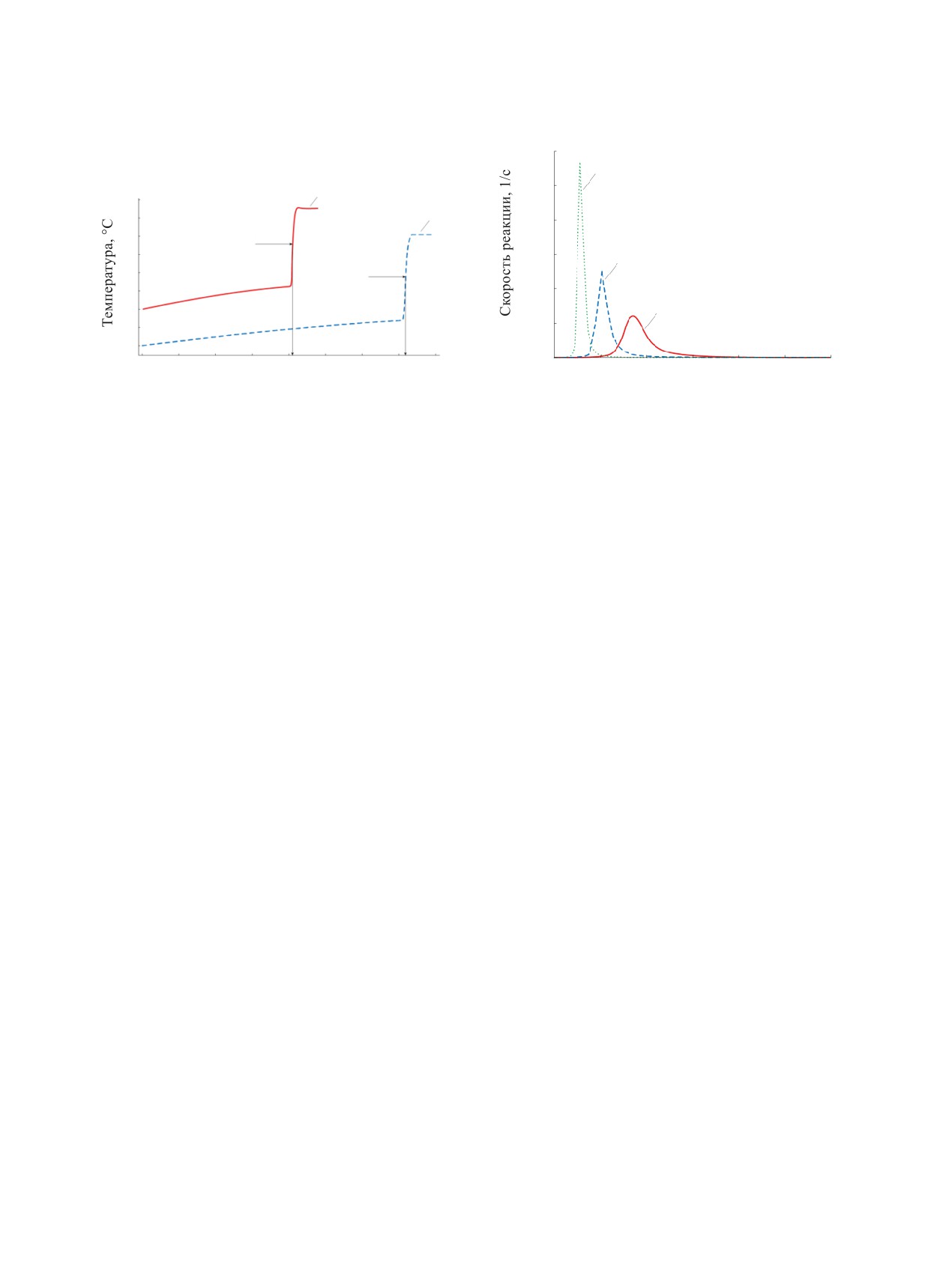
та. Установлено, что при снижении температу-
Для математического описания кривой необхо-
ры на 10°С с 50 до 40С TMR увеличится с 82 до
димо подобрать параметры формального кинетиче-
143 мин (рис. 8).
ского уравнения. Так как реакция протекает с само-
На основании выведенного кинетического урав-
ускорением, выбираем автокаталитический меха-
нения можно построить модель для оценки поведе-
низм. Кинетическое уравнение автокаталитической
ния системы в динамических условиях, т.е. при раз-
реакции в общем виде
ных скоростях линейного нагрева (рис. 9). Как вид-
W = A·exp(-Eа/(RT))·(1 - α)n·(z0 + αm),
но, АГК способен разложиться менее чем за 1 ч для
где W - скорость реакции (тепловыделения), 1/с;
скоростей нагрева выше 0.8 К/мин. Для скорости
Т - температура, К; A - предэкспоненциальный
нагрева 5 К/мин время реакции составит 17 мин, а
множитель, 1/с; R - универсальная газовая постоян-
при 2 К/мин - 26 мин. Данный результат важен для
ная, 8.31 Дж/(моль К); α - глубина превращения по
оценки поведения экстракционных растворов в ус-
данной стадии; Ea - энергия активации, кДж/моль;
ловиях их выдержки.
РАДИОХИМИЯ том 65 № 5 2023
408
КАЛИСТРАТОВА и др.
0.012
3
0.010
1
80
2
75
0.008
70
Ɇɚɤɫɢɦɚɥɶɧɚɹ
ɫɤɨɪɨɫɬɶ
65
0.006
2
Ɇɚɤɫɢɦɚɥɶɧɚɹ
60
ɫɤɨɪɨɫɬɶ
55
0.004
1
50
0.002
45
40
00
10
20
30
40
60
80
ȼɪɟɦɹ ɦɢɧ
ȼɪɟɦɹ ɦɢɧ
Рис. 8. Зависимость температуры образца от времени и
TMR при различной начальной температуре, С: 1 - 50,
Рис. 9. Зависимости скорости реакции от времени при
2 - 40.
различных скоростях нагрева, С/мин: 1 - 0.8, 2 - 2, 3 - 5.
Сравнивая расчётные данные кинетического
согласно этому уравнению, находится в интервале
уравнения с экспериментами на ДСК, можно сделать
от 80 до 90 кДж/моль. На основе полученной ки-
вывод: при скорости нагрева 2 К/мин (рис. 4) тепло-
нетической модели рассчитаны скорости реакции
вой поток растянут во времени и обладает низкой ин-
и степени разложения раствора в различных усло-
тенсивностью, экзотермическая реакция завершает-
виях - адиабатических, изотермических, динами-
ческих. Показана принципиальная возможность
ся за 27 мин (рис. S1). Это сопоставимо с расчётны-
оценки термической устойчивости азотнокислых
ми данными (рис. 9), согласно которым при скорости
растворов с учётом вариабельности условий с по-
нагрева 2 К/мин время полного протекания составит
мощью модели на основе кинетических уравнений
26 мин. При скорости нагрева 5 К/мин эксперимен-
реакции. Проведена методом ДСК проверка модели
тальное время протекания реакции составило 18,
и показано соответствие расчетных и эксперимен-
а расчётное - 17 мин, что говорит об их хорошей
тальных данных.
сходимости.
Совокупность экспериментальных данных сви-
детельствует о том, что азотнокислые растворы
ЗАКЛЮЧЕНИЕ
АГК достаточно быстро разлагаются при низких
температурах, поэтому в условиях работы выпар-
В адиабатических условиях экзотермическая ре-
ной установки АГК не может накапливаться в зна-
акция раствора АГК стехиометрического состава
чительных количествах в какой-нибудь ее части.
с азотной кислотой является автокаталитической.
Следовательно, при своевременном отводе газо-
Определены температура начала экзотермической
образных продуктов реакции операция упаривания
реакции, величины саморазогрева и удельного тепло-
азотнокислых растворов АГК не является взрывоо-
выделения. Рассчитанный удельный объём некон-
пасной.
денсируемых газов в системе составил 0.08 л/гАГК.
Установлено влияние скорости и времени нагрева
БЛАГОДАРНОСТИ
растворов на перечисленные выше параметры; по-
казано, что все они снижаются при увеличении вре-
Исследование проводили на оборудовании ЦКП
мени нагрева. На эти параметры значительное вли-
ФМИ ИФХЭ РАН и УНУ КРХИ ИФХЭ РАН.
яние оказывает инерционность системы, которую
следует учитывать при масштабировании экспери-
ФОНДОВАЯ ПОДДЕРЖКА
ментальных данных на конкретные аппараты.
Определены кинетические параметры уравне-
Работа выполнена при финансовой поддержке
ния, описывающего зависимость скорости экзотер-
Министерства науки и высшего образования Рос-
мической реакции от времени. Энергия активации,
сийской Федерации.
РАДИОХИМИЯ том 65 № 5 2023
МОДЕЛИРОВАНИЕ ТЕРМИЧЕСКОГО Р
АЗЛОЖЕНИЯ АЗОТНОКИСЛОГО РАСТВОРА
409
КОНФЛИКТ ИНТЕРЕСОВ
5.
Tkac P., Paulenova A. // Sep. Sci. Technol. 2008. Vol. 43.
N 9-10. P. 2670.
Авторы заявляют об отсутствии конфликта ин-
6.
Taylor R.J., Sinkov S.I., Choppin G.R. // Proc. ISEC
тересов.
2008 Int. Solvent Extraction Conf. Tucson, USA, 2008.
7.
Li Z., Zhao H., Chen M., Li Q., Zhang L.
//
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
Hydrometallurgy. 2018. Vol. 182. P. 1.
8.
Usachev V.N., Markov G.S. // Radiochemistry. 2003.
Дополнительные материалы для этой статьи
доступны по doi 10.31857/S0033831123050015 для
Vol. 45, N 1. P. 1.
авторизированных пользователей.
9.
Obedkov A.S., Kalistratova V.V., Skvortsov I.V.,
Belova E.V. // Nucl. Eng. Technol. 2022. Vol. 54, N 9.
СПИСОК ЛИТЕРАТУРЫ
P. 3580.
10. Нештатные ситуации на предприятиях радиохими-
1.
Наумов А.А., Голецкий Н.Д., Зильберман Б.Я., Мур-
ческих производств. Отчеты по НИР. М.: ВНИИНМ,
зин А.А. // Радиохимия. 2017. Т. 59, № 6. С. 525-533.
2.
Голецкий Н.Д., Зильберман Б.Я., Кудинов А.С., Фе-
1993.
доров Ю.С., Рябков Д.В., Кухарев Д.Н., Пузиков Е.А.
11. Cao X.J., Wang J.H., Li Q., Wu M.H., Bao B.R.,
Патент. RU 2535332. 2014.
Zheng W.F., He H., Zhang S.D. // At. Energy Sci.
3.
Chung D.Y., Lee E.H. // Bull. Korean Chem. Soc. 2005.
Technol. 2014. Vol. 48, N 11. P. 1933.
Vol. 26, N 11. P. 1692.
12. Gowland R.J., Stedman G. // J. Inorg. Nucl. Chem. 1981.
4.
Tkac P., Paulenova A., Vandegrift G.F., Krebs J.F. // J.
Radioanal. Nucl. Chem. 2009. Vol. 280, N 2. P. 339.
Vol. 43, N 11. Р.2859.
Simulation of Thermal Decomposition of a Nitric Acid
Solution of Acetohydroxamic Acid during SNF Reprocessing
V. V. Kalistratova, A. V. Smirnov, E. V. Belova*
Frumkin Institute of Physical Chemistry and Electrochemistry,
Russian Academy of Sciences, Moscow, 119071 Russia
*e-mail: bl174@bk.ru
Received May 5, 2023; revised July 3, 2023; accepted July 10, 2023
A thermal analysis of a solution of acetohydroxamic acid in 12 mol/L HNO3 was carried out. The activation
energy, the specific thermal effect, the duration and rate of the exothermic reaction, the pre-exponential factor,
the onset temperature and self-heating value of the sample, and the change in pressure and the specific volume
of the evolved gases were determined. It was shown that under experimental conditions this reaction proceeds
in the autocatalytic mode. On the basis of experimental data, a kinetic equation for the reaction was obtained,
which was used to create a model of the reaction under various conditions. The reliability of the simulation
results was verified by differential scanning calorimetry.
Keywords: acetohydroxamic acid; nitric acid; calorimetry; exothermic processes parameters; kinetic model
РАДИОХИМИЯ том 65 № 5 2023