РАДИОХИМИЯ, 2023, том 65, № 4, с. 310-316
УДК 542.61:546.65/66
ЭКСТРАКЦИЯ U(VI), Th(IV), РЗЭ(III) И Sc(III)
ИЗ НИТРАТНЫХ И ПЕРХЛОРАТНЫХ РАСТВОРОВ
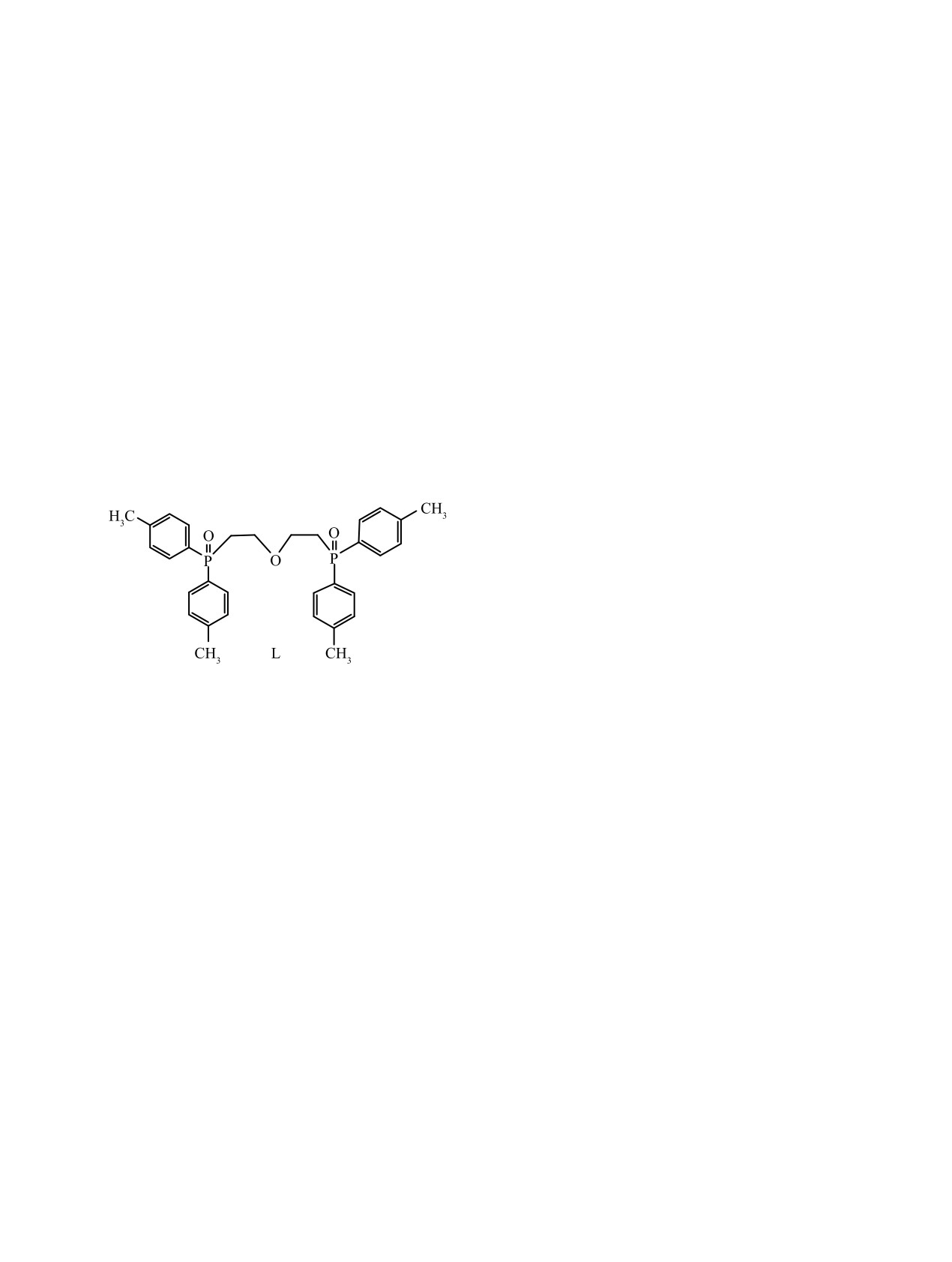
1,5-БИС[ДИ(п-ТОЛИЛ)ФОСФОРИЛ]-3-ОКСАПЕНТАНОМ
© 2023 г. А. Н. Туранова, В. К. Карандашевб, В. Е. Баулинв, Д. В. Баулинг,*
а Институт физики твердого тела им. Ю.А. Осипьяна РАН,
142432, Черноголовка Московской обл., ул. Акад. Осипьяна, д. 2
б Институт проблем технологии микроэлектроники и особо чистых материалов РАН,
142432, Черноголовка Московской обл., ул. Акад. Осипьяна, д. 6
в Институт физиологически активных веществ Федерального исследовательского центра
проблем химической физики и медицинской химии РАН,
142432, Черноголовка Московской обл., Северный проезд, д. 1
г Институт физической химии и электрохимии им. А.Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4
*e-mail: badmitriy@gmail.com
Поступила в редакцию 16.01.2023, после доработки 21.03.2023, принята к публикации 27.03.2023
Исследована экстракция U(VI), Th(IV), РЗЭ(III) и Sc(III) из нитратных и перхлоратных растворов
растворами фосфорилподанда 1,5-бис[ди(п-толил)фосфорил]-3-оксапентана (L) в 1,2-дихлорэтане
в зависимости от концентрации кислот в водной фазе. Определена стехиометрия экстрагируемых
комплексов. Установлено, что по мере увеличения концентрации кислот величина «перхлоратного»
эффекта снижается, и при концентрации кислот выше 0.3 моль/л ионы РЗЭ(III) экстрагируются
подандом L из растворов HClO4 менее эффективно, чем из растворов HNO3. При экстракции Sc(III)
«перхлоратный» эффект проявляется и в области высокой концентрации кислот, что приводит к
повышению коэффициентов разделения Sc(III) и РЗЭ(III), U(VI) и Th(IV) при экстракции подандом L
из растворов HClO4.
Ключевые слова: экстракция, уран(VI), торий(IV), редкоземельные элементы(III), скандий(III), фосфо-
рилсодержащие поданды.
DOI: 10.31857/S0033831123040020, EDN: IKRTCE
В процессах переработки отработанного ядерно-
ность и селективность таких реагентов существен-
го топлива широко используются экстракционные
но зависит от длины полиэфирной цепи, конформа-
методы извлечения, концентрирования и разделе-
ционной жесткости молекулы, а также природы за-
ния актинидов и редкоземельных элементов (РЗЭ) в
местителя при атомах фосфора. Замена алкильных
азотнокислых средах [1]. Высокой экстракционной
радикалов при одном или двух атомах фосфора мо-
способностью по отношению к этим элементам об-
лекулы ФП на арильные приводит к сильному росту
ладаю бидентатные нейтральные фосфорорганиче-
коэффициентов распределения Am(III) и РЗЭ(III)
ские соединения (БНФОС), такие как диоксиды за-
при их экстракции из азотнокислых растворов [6].
мещенных алкилендифосфинов и оксиды диарил(-
В системах с БНФОС [7, 8], а также замещен-
диалкилкарбамоилметил)фосфинов (КМФО) [2-5].
ными дигликольамидами [9] и дипиколинамида-
В последние десятилетия возрос интерес к исполь-
ми [10] отмечено проявление «перхлоратного» эф-
зованию в экстракционной практике фосфорилсо-
фекта - значительное увеличение эффективности
держащих подандов (ФП) - соединений, молекула
экстракции U(VI), Am(III) и РЗЭ(III) при переходе
которых состоит из двух РО-групп, соединенных
от азотнокислых сред к хлорнокислым. Возможные
полиэфирной цепочкой. Экстракционная способ-
причины такого эффекта обсуждались в ряде ра-
310
ЭКСТР
АКЦИЯ U(VI), Th(IV), РЗЭ(III) И Sc(III)
311
бот [11, 12]. На практике этот эффект использован
тана. Смесь перемешивали еще 3 ч при 180-200°С
для повышения степени концентрирования U(VI),
c одновременной отгонкой триметилхлорсилана.
Am(III) и РЗЭ(III) из растворов азотной и фосфор-
После охлаждения до 20°С реакционную смесь
ной кислот растворами КМФО при добавке неболь-
разбавляли 50 мл этанола, добавили 10 мл 30%-ной
ших количеств хлорной кислоты или перхлоратов
H2O2, перемешивали 1 ч при 80°С, затем разбавля-
щелочных металлов в водную фазу [7].
ли 200 мл воды и подкисляли концентрированной
HCl до рН 1. Полученную смесь экстрагировали
Проявление «перхлоратного» эффекта в экс-
CHCl3 (3 × 50 мл), экстракт промываи 20%-ным
тракционных системах и его величина существенно
раствором FeSO4 (3 × 40 мл), водой (2 × 50 мл),
зависят от природы используемого экстрагента и
20%-ным раствором Na2CO3 (3 × 40 мл), водой (3 ×
кислотности водной фазы [13]. Возможность про-
50 мл) и удаляли растворитель в вакууме. Остаток
явления этого эффекта в системах с ФП ранее не
хроматографировали на колонке с силикагелем
рассматривалось.
(элюент - CHCl3 и CHCl3 : i-PrOH = 10 : 1). Выход
Цель работы - оценить возможность проявления
L 11.76 г (65%), т.пл. 91-94°С (бензол-гексан).
«перхлоратного» эффекта при экстракции ионов ме-
Найдено, %: C, 72.34, 72 49; H, 6.80, 6 95; P, 11.48,
таллов растворами фосфорилсодержащего поданда
11.57 C32H36O3P2. Вычислено, %: C, 72.44; H, 6.84;
1,5-бис[ди(п-толил)фосфорил)]-3-оксапента (L).
5; P, 11.68. Спектр ПМР (CDCl3, δ, м.д.): 2.36 с (12Н,
4CH3-Ar), 2.4 м (4Н, 2СН2-Р), 3.66 м (4Н, 2ОСН2),
7.24-7.44 м (8Н, Ar-H), 7.60-7.75 м (8Н, Ar-H).
Спектр ЯМР 31Р (CDCl3, δ, м.д.): 30.29.
В экспериментах по экстракции в каче-
стве органического растворителя использовали
1,2-дихлорэтан х.ч. без дополнительной очистки.
Концентрацию HNO3 или HClO4 в водной фазе
варьировали в диапазоне 0.003-7 моль/л при изуче-
нии межфазного распределения ионов U(VI), Th(IV),
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
РЗЭ(III) и Sc(III). Ионы U(VI), Th(IV), Sc(III) и всех
РЗЭ(III) (кроме Pm) одновременно присутствовали
1,5-Бис[ди(п-толил)фосфорил)]-3-оксапентан
в водном растворе, исходная концентрация каждого
впервые получен по методу, описанному в рабо-
из них составляла 2 × 10-6 моль/л.
те [14]. Исходные соединения ди(п-толил)фосфи-
Опыты по экстракции проводили при температу-
нистая кислота и 1,5-дихлор-3-оксапентан были за-
ре 21 ± 2°С и соотношении объемов органической и
куплены в ООО «Сорбент-технологии», г. Москва.
водной фаз 1 : 1. Перемешивание фаз осуществляли
Спектры ЯМР 1H и 31Р записаны на спектрометре
в роторном миксере со скоростью 60 об/мин в те-
Bruker СХР-200; стандарты - ТМС (внутренний) и
чение 1 ч, что достаточно для установления посто-
85% Н3РО4 (внешний). Температуры плавления из-
янных значений коэффициентов распределения (D).
мерены на приборе Boetius PHMK 05. Анализ со-
Концентрацию U(VI), Th(IV), Sc(III) и РЗЭ(III)
держания С и Н проводили на С,Н,N-анализаторе
в исходных и равновесных водных растворах опре-
(Carlo Erba Strumentazione, Италия). Содержание Р
деляли методом масс-спектрометрии с ионизацией
определяли методом атомной эмиссии с индуктив-
в индуктивно связанной плазме с использованием
но связанной плазмой.
масс-спектрометра X-7 (Thermo Elemental, США).
1,5-Бис[ди(п-толил)фосфорил)]-3-оксапен-
Содержание элементов в органической фазе опреде-
тан (L). Смесь 15.70 г (68.25 ммоля) ди(п-толил)
ляли после реэкстракции раствором 0.1 моль/л ок-
фосфинистой кислоты и 22.00 г (136.50 ммоля)
сиэтилидендифосфоновой кислоты. Коэффициенты
гексаметилдисилазана в токе аргона нагревали до
распределения элементов (D) рассчитывали как от-
120°С и перемешивали 1 ч, затем по каплям при-
ношение их концентраций в равновесных фазах.
бавляли 4.84 г (34.12 моля) 1,5-дихлор-3-оксапен-
Погрешность их определения не превышала 10%.
РАДИОХИМИЯ том 65 № 4 2023
312
ТУРАНОВ и др.
Концентрацию HNO3 и HClO4 в равновесных
0.025
водных фазах определяли потенциометрическим
титрованием раствором NaOH, в органических -
0.020
таким же образом после реэкстракции кислот во-
1
дой. Параллельно определяли содержание кислот в
2
0.015
органической фазе при экстракции кислот чистым
дихлорэтаном (холостой опыт). Результаты холо-
0.010
стого опыта учитывали при расчете общей концен-
трации комплексов HNO3 и HClO4 с экстрагентом в
0.005
органической фазе.
0.000
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
0
1
2
3
4
5
>+$@ ɦɨɥɶ ɥ
Поскольку процесс экстракции ионов металлов
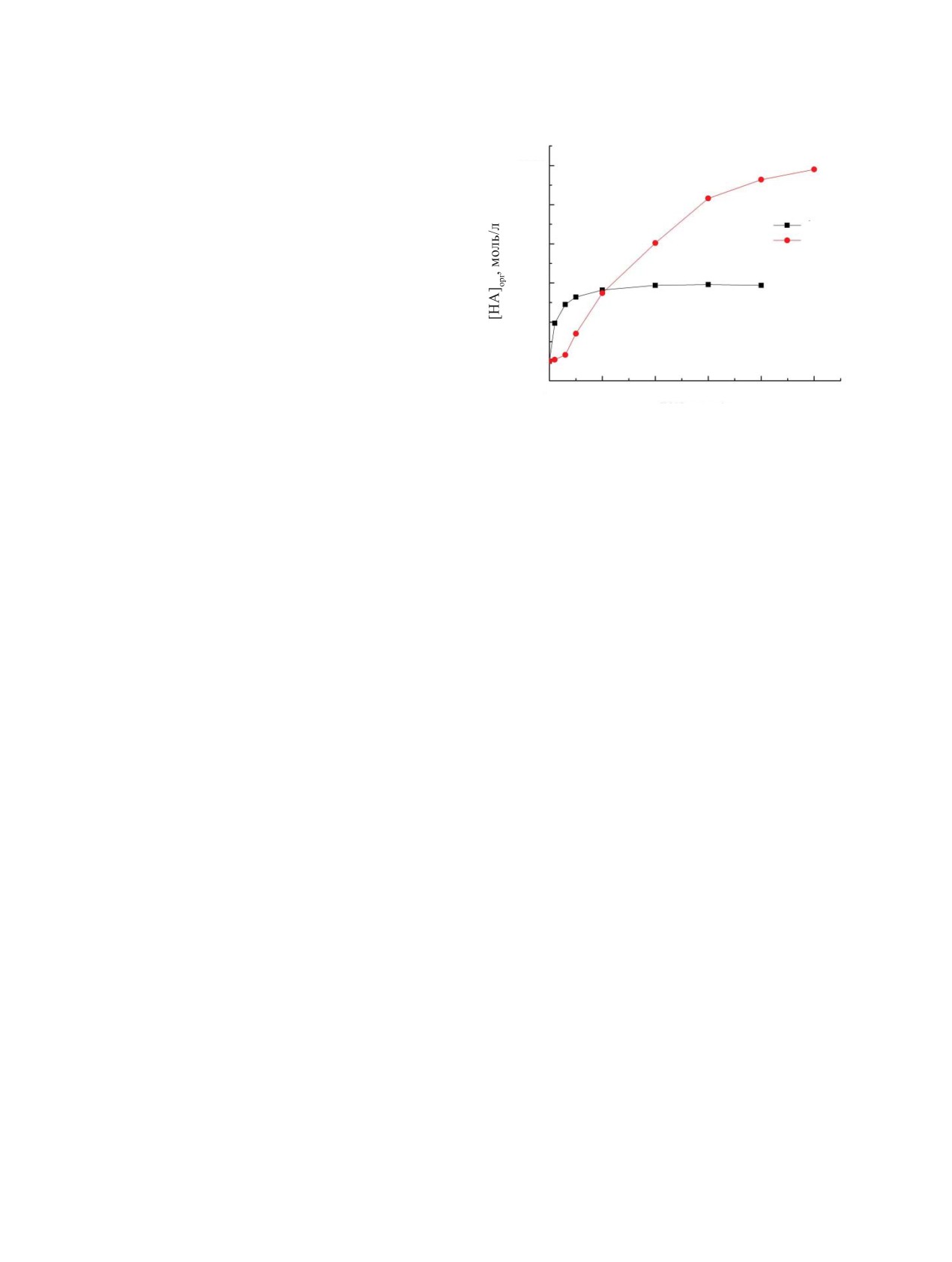
Рис. 1. Экстракция HClO4 (1) и HNO3 (2) растворами
из растворов HNO3 и HClO4 нейтральными фос-
0.01 моль/л поданда L в дихлорэтане.
форорганическими соединениями сопровождает-
лых растворов на кривых зависимостей lgD-[HNO3]
ся взаимодействием этих кислот с экстрагентом,
наблюдаются максимумы, что связано с высалива-
предварительно исследована экстракция HNO3 и
ющим действием ионов NO– и связыванием экстра-
HClO4 раствором поданда L в дихлорэтане. Данные
гента азотной кислотой. Эффективность экстрак-
по распределению HNO3 и HClO4 между их водны-
ции ионов металлов из азотнокислых растворов
ми растворами и раствором поданда L в дихлорэ-
возрастает в ряду Ln(III) < Sc(III) < U(VI) < Th(IV).
тане (рис. 1) указывают на то, что при [HNO3] >
3 моль/л отношение концентрации HNO3, связанной
При экстракции РЗЭ(III) из растворов хлор-
в комплексы с экстрагентом, и исходной концентра-
ной кислоты максимумы на кривых зависимостей
ции экстрагента в органической фазе превышает 2.
lgDLn-[HClO4] сдвинуты в область более низкой
Это указывает на то, что при высокой концентра-
кислотности, чем при экстракции из азотнокислых
ции HNO3 в водной фазе все три донорные центры
растворов (рис. 3). По-видимому, это связано с тем,
молекулы поданда L (две группы P=O и эфирный
что ФП экстрагируют HClO4 в большей степени,
атом О) участвуют в комплексообразовании с моле-
чем HNO3 [18].
кулами HNO3. При экстракции хлорной кислоты в
При экстракции U(VI), Th(IV) и Sc(III) из рас-
органическую фазу переходят комплексы с соотно-
творов с концентрацией HClO4 от 0.003 до 2 моль/л
шением HClO4 : L = 1 : 1 во всем исследованном ди-
наблюдаются зависимости lgD-[HClO4] с максиму-
апазоне концентрации HClO4. Практически полное
мами (рис. 2), что соответствует экстракции этих
связывание экстрагента кислотой наблюдается при
ионов нейтральным экстрагентом L по механизму
[HClO4] > 1 моль/л (рис. 1). Отметим, что экстрак-
координационной сольватации. Дальнейшее увели-
ционная способность поданда L по отношению к
чение концентрации HClO4 в водной фазе от 2 до
HClO4 значительно превышает таковую оксида ди-
фенил(дибутилкарбамоилметил)фосфина (КМФО
6 моль/л не приводит к уменьшению DU и сопро-
Ph2Bu2) и диоксида тетрафенилметилендифосфина
вождается ростом коэффициентов распределения
(ТФМДФО): при равной кислотности водной фазы
Th(IV) и особенно Sc(III) (рис. 2). По-видимому,
концентрация HClO4 в равновесной органической
при экстракции из растворов с [HClO4] > 2 моль/л в
фазе, содержащей поданд L, существенно выше,
комплексообразовании с ионами металлов участву-
чем при экстракции растворами КМФО Ph2Bu2 [15,
ют комплексы L с HClO4, концентрация которых в
16] и ТФМДФО [17].
органической фазе растет с ростом концентрации
Рассмотрено влияние концентрации HNO3 и
HClO4 в водной фазе. При этом эффективность экс-
HClO4 в водной фазе на экстракцию U(VI), Th(IV),
тракции Sc(III) подандом L из слабокислых (0.05-
Sc(III) (рис. 2) и РЗЭ(III) (рис. 3) растворами подан-
0.3 моль/л) растворов HClO4 значительно выше,
да L в дихлорэтане. При экстракции из азотнокис-
чем из растворов 3 моль/л HClO4 (рис. 2).
РАДИОХИМИЯ том 65 № 4 2023
ЭКСТР
АКЦИЯ U(VI), Th(IV), РЗЭ(III) И Sc(III)
313
1
1
2
1.0
2
3
3
4
3
6
0.5
5
5
6
4
2
0.0
-0.5
1
-1.0
0
-1.5
-1
-2.0
3.0
-2.5 -2.0 -1.5 -1.0 -0.5
0.0
0.5
1.0
-2.0
-2.5
-1.0
-0.5
0.0
0.5
1.0
lgC
lgC
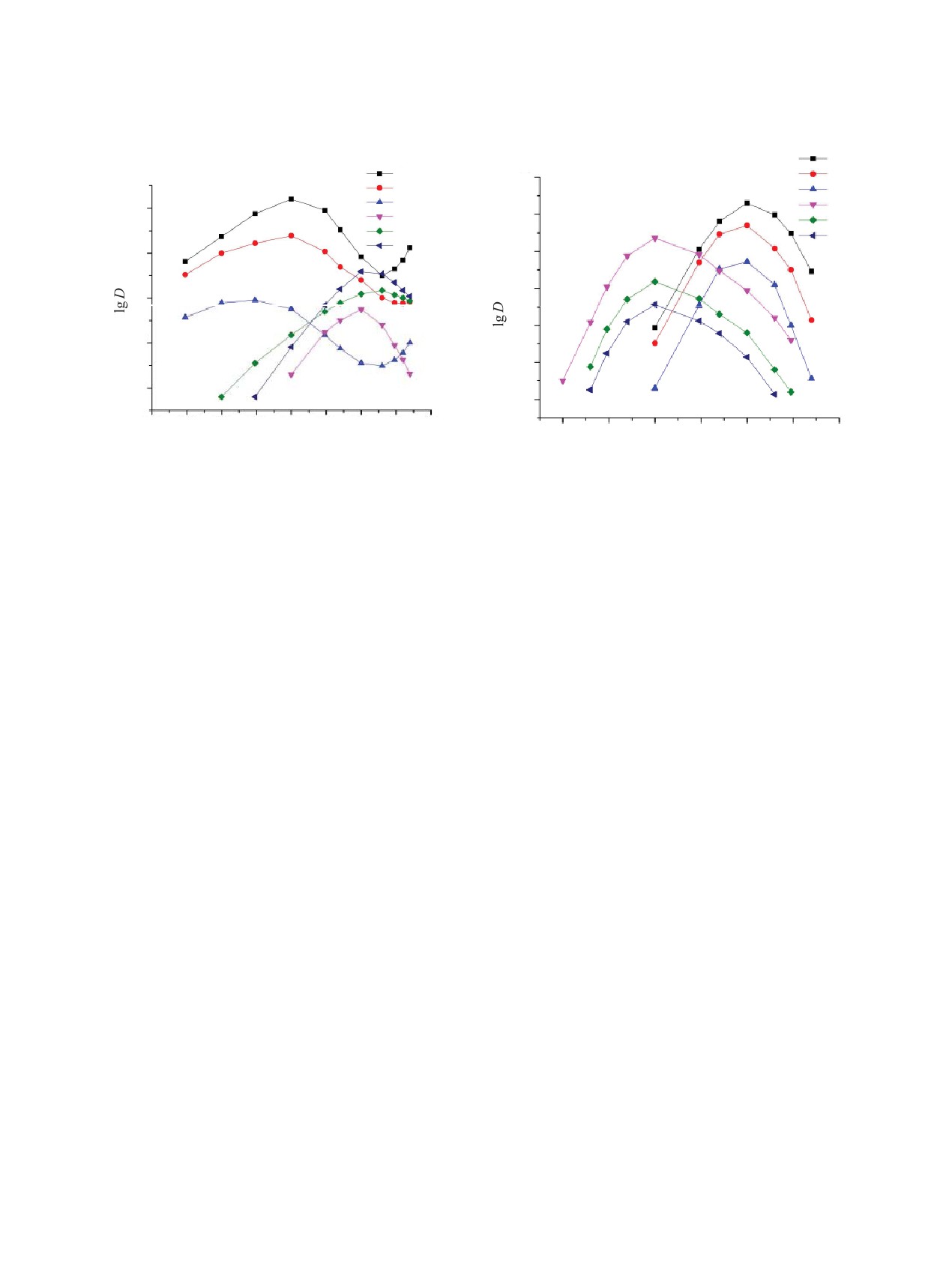
Рис.
3. Зависимость коэффициентов распределения
Рис.
2. Зависимость коэффициентов распределения
Lu(III) (1, 4), Eu(III) (2, 5) и Nd(III) (3, 6) от концентра-
Sc(III) (1, 6), U(VI) (2, 5) и Th(IV) (3, 4) от концентра-
ции HNO3 (1-3) и HClO4 (4-6) в равновесной водной
ции HClO4 (1-3) и HNO3 (4-6) в равновесной водной
фазе при экстракции растворами 0.05 моль/л поданда L
фазе при экстракции растворами 0.01 моль/л поданда L
в дихлорэтане.
в дихлорэтане.
Следует отметить, что эффективность экстрак-
динации ионов ClO– с ионами экстрагируемых ме-
ции ионов металлов из растворов HClO4 возрастает
таллов. Более высокая гидрофобность анионов ClO4-,
в ряду Ln(III) < Th(IV) < U(VI) < Sc(III) в отличие
а также увеличение значений сольватных чисел в
от последовательности, наблюдаемой при экстрак-
экстрагируемых комплексах определяют более эф-
ции из азотнокислых растворов. Причиной этого
фективную экстракцию ионов U(VI), Th(IV), Sc(III)
может различное строение экстрагируемых ком-
и РЗЭ(III) подандом L из перхлоратных растворов,
плексов. При экстракции из азотнокислых раство-
чем из нитратных, т.е. проявление «перхлоратного»
ров ионы NO3- координируют ионы металлов, входя
эффекта. Величину такого эффекта обычно опреде-
во внутреннюю координационную сферу экстраги-
ляют как отношение коэффициентов распределения
руемых комплексов [19], тогда как в присутствии
ионов металлов при экстракции из растворов, со-
ионов ClO–, обладающих слабой координирующей
держащих ионы ClO– и NO3-, в сопоставимых усло-
способностью, ионы металлов переходят в органи-
виях, K(ClO4-/NO–) = D(ClO–)/D(NO–).
ческую фазу в виде ионных пар [Mn+Ls][ClO4]n (s -
Сопоставление значений D при экстракции
сольватное число).
U(VI), Th(IV), Sc(III) (рис. 2) и РЗЭ(III) (рис. 3) со-
Стехиометрическое соотношение металл : экс-
единением L из растворов HClO4 и HNO3 показало,
трагент в экстрагируемых комплексах определяли
что только при экстракции Sc(III) соединением L
методом сдвига равновесия. Полученные данные
«перхлоратный» эффект проявляется во всем ис-
(рис. 4), показывают, что из азотнокислых раство-
следованном диапазоне концентрации кислот. Это
ров соединение L экстрагирует РЗЭ(III) и U(VI) в
приводит к увеличению коэффициента разделения
виде смесей моно- и дисольватов, Sc(III) в основ-
Sc(III) и ионов других металлов (βSc/M = DSc/DM).
ном в виде дисольватов, а Th(IV) в виде смеси ди- и
трисольватов. При экстракции из растворов HClO4
При экстракции из раствора 3 моль/л HNO3 раство-
ионы РЗЭ(III) и U(VI) экстрагируются в виде дис-
рами 0.01 моль/л поданда L в дихлорэтане βSc/Eu =
ольватов, а Sc(III) и Th(IV) - в основном в виде три-
250, а U(VI) и Th(IV) экстрагируются более эффек-
сольватов. Увеличение значений сольватных чисел
тивно, чем Sc(III). При экстракции же из раствора
в комплексах, экстрагируемых из растворов HClO4,
3 моль/л HClO4 растворами поданда L такой же кон-
связано с невозможностью непосредственной коор-
центрации βSc/Eu = 8.9 × 105, βSc/Th = 107 и βSc/U = 5.7.
РАДИОХИМИЯ том 65 № 4 2023
314
ТУРАНОВ и др.
1
2
2.5
2.5
6
8
2.0
7
2.0
5
Lu(III)
1.5
4
1.5
Eu(III)
3
La(III)
1.0
1.0
0.5
0.5
0.0
0.0
-0.5
-0.5
–1.0
-1.8
-1.4
-1.0
-0.6
-0.2
0.2
-3.0
-2.5
-2.0
-1.5
-1.0
lg[L]
lg[H+]
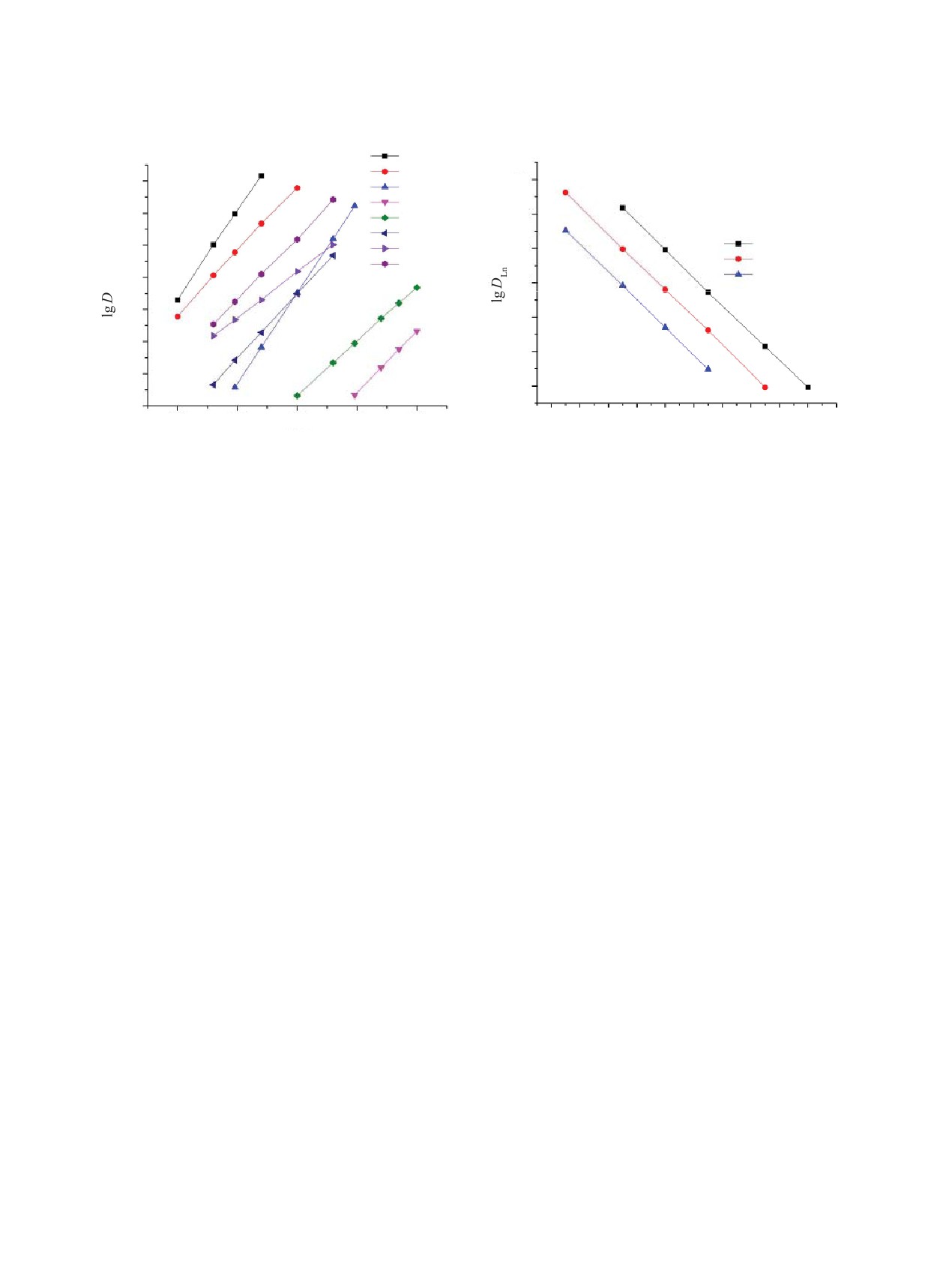
Рис.
4. Зависимость коэффициентов распределения
Рис.
5. Зависимость коэффициентов распределения
Sc(III) (1, 5), U(VI) (2, 4), Th(IV) (3, 6) и Eu(III) (7, 8)
Lu(III) (1), Eu(III) (2) и La(III) (3) от концентрации ио-
от концентрации поданда L в дихлорэтане при экстрак-
нов H+ в равновесной водной фазе при экстракции рас-
ции из растворов 0.1 моль/л HClO4 (1, 2, 6, 8) и 1 моль/л
творами 0.05 моль/л поданда L в дихлорэтане. [ClO–] =
HNO3 (3-5, 7).
1 моль/л.
Ионы U(VI), Th(IV) и РЗЭ(III) экстрагируются из
ряду РЗЭ(III) от La(III) к Ho(III), а затем мало изме-
растворов хлорной кислоты более эффективно, чем
няются с увеличением Z (рис. 6). По-видимому, при
из растворов азотной кислоты, только при достаточ-
экстракции тяжелых РЗЭ(III) действие двух факто-
но низкой кислотности водной фазы. Увеличение
ров (увеличение прочности экстрагируемых ком-
кислотности водной фазы приводит к уменьшению
плексов и увеличение энергии гидратации ионов
величины
«перхлоратного» эффекта. Например,
Ln3+ с увеличением Z), влияющих на переход ионов
при экстракции U(VI) увеличение концентрации
Ln3+ в органическую фазу в противоположном на-
кислот от 0.01 до 1 моль/л сопровождается умень-
правлении, взаимно компенсируется.
шением величины K(ClO
–/NO
–)от 1580 до 2.0.
При экстракции РЗЭ(III) подандом L из раство-
Ионы РЗЭ(III) экстрагируются подандом L из
ра NH4ClO4 значения DLn на два порядка выше, чем
растворов азотной кислоты значительно более эф-
при экстракции из раствора NH4NO3. В случае же
фективно, чем из растворов хлорной кислоты, при
экстракции из растворов соответствующих кислот
концентрации кислот выше 0.3 моль/л (рис. 3). Это
такой же концентрации «перхлоратный» эффект
связано с тем, что увеличение кислотности водной
не наблюдается (рис. 6). В системах с БНФОС, в
фазы при постоянной концентрации ионов ClO–
молекулах которых две координирующие группы
приводит к уменьшению DLn при экстракции подан-
Р(О) и/или С(О) группы соединены метиленовым
дом L (рис. 5) вследствие снижения концентрации
мостиком, «перхлоратный» эффект проявляется и
свободного экстрагента, вызванного связыванием
в кислых средах. Например, при экстракции Eu(III)
его в виде комплексов с хлорной кислотой.
растворами КМФО Ph2Bu2 из растворов 3 моль/л
При экстракции ионов РЗЭ(III) из перхлоратных
HClO4 и HNO3 величина K(ClO4-/NO–) составляет
3 × 105 [15].
сред растворами поданда L наблюдается тенденция
увеличения DLn с увеличением атомного номера (Z)
Резкое различие в поведении поданда L и БНФОС
РЗЭ (рис. 6). Такой характер зависимости DLn-Z
в экстракционных системах с HClO4 может быть
обычно связывают с увеличением устойчивости
связано с более высокой устойчивостью протониро-
комплексов Ln(III) с жесткими (по Пирсону) лиган-
ванного комплекса, образуемого подандом L, чему
дами по мере увеличения плотности заряда ионов
способствует участие эфирного атома кислорода в
Ln3+ с увеличением Z [20]. При экстракции ионов
образовании такого комплекса [21]. Ранее отмеча-
РЗЭ(III) из нитратных растворов DLn возрастают в
лось, что изменение структуры БНФОС, приводя-
РАДИОХИМИЯ том 65 № 4 2023
ЭКСТР
АКЦИЯ U(VI), Th(IV), РЗЭ(III) И Sc(III)
315
3
2
1
0
1
2
-1
3
4
-2
La Ce Pr Nd - Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
Рис. 6. Коэффициенты распределения РЗЭ(III) при экстракции растворами 0.025 (1) и 0.05 моль/л (2-4) поданда L в дихлорэ-
тане из растворов 1 моль/л NH4ClO4 (1), NH4NO3 (2), HNO3 (3) и HClO4 (4).
щее к повышению их экстракционной способности
нологии микроэлектроники и особо чистых мате-
по отношению к HClO4, сопровождается значитель-
риалов РАН, Института физиологически активных
ным снижением величины «перхлоратного» эффек-
веществ Федерального исследовательского центра
та [12, 13].
проблем химической физики и медицинской химии
Представленные данные показали, что величи-
РАН и Института физической химии и электрохимии
на «перхлоратного» эффекта при экстракции ионов
им. А.Н. Фрумкина РАН.
металлов нейтральными фосфорорганическими
соединениями сильно зависит от их строения, кис-
КОНФЛИКТ ИНТЕРЕСОВ
лотности водной фазы и природы экстрагируемых
ионов металлов. При низкой кислотности водной
Авторы заявляют об отсутствии конфликта ин-
фазы фосфорилсодержащий поданд L экстрагирует
тересов.
U(VI), Th(IV) и РЗЭ(III) из перхлоратных растворов
значительно более эффективно, чем из нитратных.
СПИСОК ЛИТЕРАТУРЫ
По мере увеличения концентрации кислот вели-
чина «перхлоратного» эффекта снижается, и уже
1.
Myasoedov B.F., Kalmykov S.N., Kulyako Yu.M.,
при концентрации кислот выше 0.3 моль/л ионы
Vinokurov, S.E. // Geochem. Int. 2016. Vol. 54, N 13.
РЗЭ(III) экстрагируются подандом L из растворов
P. 1156.
HClO4 менее эффективно, чем из растворов HNO3.
2.
Аляпишев М.Ю., Бабаин В.А., Устынюк Ю.А. //
При экстракции Sc(III) «перхлоратный» эффект
Успехи химии. 2016. Т. 85, № 9. С. 943.
проявляется и в области высокой концентрации
3.
Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev.
кислот, что приводит к повышению коэффициентов
2017. Vol. 46. P. 7229.
разделения Sc(III) и U(VI), Th(IV), РЗЭ(III) при экс-
4.
Розен А.М., Крупнов Б.В. // Успехи химии. 1996.
Т. 65, № 11. С. 1052.
тракции подандом L из растворов HClO4.
5.
Чмутова М.К., Литвина М.Н., Прибылова Г.А.,
Иванова Л.А., Смирнов И.В., Шадрин А.Ю.,
ФОНДОВАЯ ПОДДЕРЖКА
Мясоедов Б.Ф. // Радиохимия. 1999. Т. 41, № 4.
С. 331.
Работа выполнена в рамках Государственного
6.
Туранов А.Н., Карандашев В.К., Баулин В.Е.,
задания Института физики твердого тела
Баулин Д.В., Костикова Г.В., Федосеев А.М. // ЖОХ.
им. Ю.А. Осипьяна РАН, Института проблем тех-
2022. Т. 92, № 11. С. 1754.
РАДИОХИМИЯ том 65 № 4 2023
316
ТУРАНОВ и др.
7.
Чмутова М.К., Юссонуа М., Литвина М.Н.,
16. Стоянов Е.С., Воробьева Т.П., Смирнов И.В. // ЖСХ.
Нестерова Н.П., Мясоедов Б.Ф., Кабачник М.И. //
Т. 44, № 3. С. 414.
Радиохимия. 1990. Т. 32, № 4. С. 56.
17. Розен А.М., Николотова З.И., Карташева Н.А.,
8.
Smirnov I.V., Babain V.A., Shadrin A.Yu., Efremova T.I.,
Большакова А.С. // Радиохимия. 1978. Т. 20, № 5.
Bondarenko N.A., Herbst R.S., Peterman D.R.,
С. 725.
Todd T.A. // Solvent Extr. Ion Exch. 2005. Vol. 23. P. 1.
18. Сергиевский В.В., Джакупова Ж.Е., Гарифзянов А.Р.,
9.
Tachimori S., Sasaki Y., Suzuki S. // Solvent Extr. Ion
Храмов А.Н., Торопова В.Ф. // ЖОХ. 1990. Т. 60, № 9.
Exch. 2002. Vol. 20. P. 687.
С. 1942.
10. Аляпышев М.Ю., Бабаин В.А., Антонов Н.Г.,
19. Демин С.В., Жилов В.И., Нефедов С.Е. Баулин В.Е.,
Смирнов И.В. // ЖПХ. 2006. Т. 79, № 11. С. 1827.
Цивадзе А.Ю. // ЖНХ. 2012. Т. 57, № 6. С. 970;
11. Nash K. // Sep. Sci. Technol. 1999. Vol. 34. P. 911.
Demin S.V., Nefedov S.E., Zhilov V.I. Baulin V.E.,
12. Смирнов И.В. // Радиохимия. 2007. Т. 49, № 1. С. 40.
Tsivadze A.Y.
// Russ. J. Inorg. Chem. 2012. Vol. 57,
13. Туранов А.Н., Карандашев В.К., Баулин В.Е.,
N 6. P. 897.
Баулин Д.В. // Радиохимия. 2019. Т. 61, № 2. С. 117.
14. Евреинов В.И., Баулин В.Е., Вострокнутова З.Н.,
20. Nash K.L., Jensen M.P. // Sep. Sci. Technol. 2001.
Цветков Е.Н. // Изв. АН. Сер. хим. 1993. № 8. С. 518.
Vol. 36. N 5-6. P. 1257.
15. Чмутова М.К., Литвина М.Н., Нестерова Н.П.,
Кочеткова Н.Е., Мясоедов Б.Ф., Кабачник М.И. //
21. Stoyanov E.S., Smirnov I.V. // J. Mol. Struct.
2005.
Радиохимия. 1990. Т. 32, № 5. С. 88.
Vol. 740. P. 9.
Extraction of U(VI), Th(IV), REE(III), and Sc(III)
from Nitrate and Perchlorate Solutions
with 1,5-bis[di(p-tolyl)phosphoryl]-3-oxapentane
A. N. Turanova, V. K. Karandashevb, V. E. Baulinc, D. V. Baulind*
a Osipyan Institute of Solid State Physics, Russian Academy of Sciences,
Chernogolovka, Moscow oblast, 142432 Russia
b Institute of Microelectronics Technology and Highly Pure Materials, Russian Academy of Sciences,
Chernogolovka, Moscow oblast, 142432, Russia
c Institute of Physiologically Active Substances, Federal Research Center for Problems of Chemical Physics
and Medicinal Chemistry, Russian Academy of Sciences, Chernogolovka, Moscow oblast, 142432 Russia
d Frumkin Institute of Physical Chemistry and Electrochemistry, Russian Academy of Sciences,
Moscow, 119071 Russia
*e-mail: badmitriy@gmail.com
Received January 16, 2023; revised March 21, 2023; accepted March 27, 2023
Extraction of U(VI), Th(IV), REE(III), and Sc(III) from nitrate and perchlorate solutions with solutions of
phosphorylpodand 1,5-bis[di(p-tolyl)phosphoryl]-3-oxapentane (L) in 1,2-dichloroethane depending on the
concentration of acids in the aqueous phase was studied. The stoichiometry of the extractable complexes was
determined. It was found that, as the concentration of acids increases, the magnitude of the «perchlorate»
effect decreases, and at acid concentrations above 0.3 mol/L, REE(III) ions are extracted by podand L from
HClO4 solutions less efficiently than from HNO3 solutions. During the extraction of Sc(III), the «perchlorate»
effect also manifests itself in the region of high acid concentration, which leads to an increase in the separation
coefficients of Sc(III) and REE(III), U(VI), and Th(IV) during extraction with podand L from HClO4 solutions.
Keywords: extraction, uranium(VI), thorium(IV), rare earth elements(III), scandium(III), phosphoryl-
containing podands
РАДИОХИМИЯ том 65 № 4 2023