РАДИОХИМИЯ, 2023, том 65, № 3, с. 269-276
УДК 541.13+11
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ
ТЕРМИЧЕСКИХ ПРОЦЕССОВ С УЧАСТИЕМ
РАДИОНУКЛИДОВ УРАНА, ПЛУТОНИЯ, ЕВРОПИЯ
ПРИ НАГРЕВЕ РАДИОАКТИВНОГО ГРАФИТА
В АТМОСФЕРЕ ВОЗДУХА
© 2023 г. Н. М. Барбин а, б, *, С. А. Титова, Д. И. Терентьев а, А. М. Кобелев а
а Уральский институт Государственной противопожарной службы МЧС России,
620062, Екатеринбург, ул. Мира, д. 22
б Уральский федеральный университет имени первого президента России Б.Н. Ельцина,
620002, Екатеринбург, ул. Мира, д. 19
* e-mail:NMBarbin@mail.ru
Поступила в редакцию 24.12.2022, после доработки 22.02.2023, принята к публикации 28.02.2023
Методом термодинамического моделирования исследовано поведение радионуклидов U, Pu, Eu при
нагревании радиоактивного графита в атмосфере воздуха. При помощи программного комплекса
TERRA проведен полный термодинамический анализ в интервалах температур от 300 до 3600 К с целью
установления возможного состава газовой фазы. Установлено, что уран в диапазоне температур от 300
до 2000 К находится в виде конденсированных UO2(к), UOCl2(к), UOCl(к), CaUO4(к), при повышении
температуры от 2000 до 3600 К в виде газообразных UCl4, UO3, UO2 и виде ионизированных UO3-,
UO2+. Плутоний при температуре от 300 до 1900 К находится в виде конденсированных PuCl3(к),
PuOCl(к), Pu2O3(к), PuO2(к), при увеличении температуры от 1900 до 3600 К в виде газообразных PuO2,
PuO и виде ионизированного PuO+. Европий на участке температур от 300 до 2000 К находится в виде
конденсированных EuCl2(к), EuCl3(к), EuOCl(к), Eu2O3(к), EuO(к) при повышении температуры от 2000
до 3600 К в виде газообразных EuO, Eu и виде ионизированного Eu+. Установлены основные реакции
внутри отдельных фаз и между конденсированными и газовой фазами. Рассчитаны их константы
равновесия.
Ключевые слова: термодинамическое моделирование, термические процессы, радионуклиды,
атмосфера воздуха, радиоактивный графит, константы равновесия.
DOI: 10.31857/S0033831123030085, EDN: EOAUSU
ВВЕДЕНИЕ
ров не предусматривались технические решения
по выводу из эксплуатации, а также отсутствовали
Атомная энергетика является одним из основ-
безопасные технологии обращения с облученным
ных источников выработки электроэнергии в мире.
реакторным графитом [1, 2]. На сегодняшний день
Всего в мире эксплуатируется 182 атомные электро-
объем облученного графита в мире составляют
станции общей электрической мощностью 411 ГВт.
260000 т (из них 60000 т находится в Российской
В России эксплуатируется 11 АЭС общей электри-
Федерации) [3].
ческой мощностью 30 ГВт.
Одним из способов решения данной проблемы
В России и странах мирового сообщества суще-
является высокотемпературная термическая обра-
ствует проблема обращения с облученным реак-
ботка графита в различных средах. Под воздействи-
торным графитом активных зон уран-графитовых
ем температуры часть радионуклидов переходит в
реакторов. При проектировании ядерных реакто-
газообразное состояние и выходит из системы [3].
269
270
БАРБИН и др.
Таблица 1. Состав исходной системы
энтропии в соответствии со вторым началом термо-
Фазовый
Содержание,
динамики для равновесных систем [5].
Фаза
состав
мас%
Термодинамическое моделирование проводили
Газовая (89.44%)
O2
21.42
в атмосфере воздуха при давлении 0.1 МПа в тем-
N2
78.57
пературном интервале от 300 до 3600 К с шагом
Конденсированная
C
99.98
100 К. В расчетах учитывались только компоненты
(10.56%)
U
1.15 × 10-2
с концентрацией не менее 10-10 моль/кг.
Cl
1.89 × 10-3
Информация об исходном составе реакторно-
Ca
2.70 × 10-4
го графита взята из работ [9, 10], исходный состав
Pu
7.27 × 10-5
газовой фазы (воздух) взят из справочника [11].
Eu
1.15 × 10-6
Эти данные приведены в табл. 1. Предполагаемые
формы существования радионуклидов в данной си-
При переработке радиоактивного графита методом
стеме приведены в табл. 2. Возможные соединения
сжигания в атмосфере воздуха важно знать поведе-
радионуклидов U, Pu, Eu, присутствующих в равно-
ние радионуклидов, присутствующих в нем.
весной системе взяты из баз данных по свойствам
Данное исследование проводилось методом тер-
индивидуальных веществ ИВТАНТЕРМО и HSC.
модинамического моделирования, которое позво-
После завершения вычисления получали зависимо-
ляет определять равновесный состав исследуемой
сти равновесного состава от температуры.
системы и спрогнозировать результаты фазовых
и химических превращений. Ранее было изучено
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
поведение U, Pu, Eu при нагреве радиоактивного
графита в атмосфере водяного пара методом термо-
Распределение урана по равновесным фазам
динамического моделирования [4], что показало его
при нагревании радиоактивного графита в воздухе
эффективность.
представлено на рис. 1. При повышении темпера-
тур от 300 до 700 К (табл. 3) по реакции (1) кон-
МЕТОДИКА РАСЧЕТА
денсированный диоксид урана взаимодействует с
конденсированным хлоридом кальция и переходит
Проведение натурных экспериментов при вы-
в конденсированный оксихлорид урана и конденси-
соких температурах не всегда позволяет получить
рованный уранат кальция. В диапазоне температур
достоверные сведения в связи с их сложностью и
от 300 до 800 К по реакции (2) конденсированный
ошибками измерений. Метод термодинамического
оксихлорид урана(IV) преобразуется в конденси-
моделирования успешно используется для иссле-
рованный оксихлорид урана(III) с образованием
дования высокотемпературных систем [5-8]. Про-
хлора. В интервале температур от 700 до 1000 К,
водили полный термодинамический анализ всей
конденсированный оксихлорид урана протекает в
системы в целом, который позволяет учесть абсо-
газообразный хлорид урана(IV) и конденсирован-
лютно все процессы. В работе применяли програм-
ный диоксид урана, реакция (3). На участке тем-
му TERRA, основанную на принципе максимума
ператур от 800 до 1400 К конденсированный ок-
Таблица 2. Предполагаемые формы существования радионуклидов
Радионуклид в графите
Тип соединения в равновесной системе
238U, 236U, 235U
UC(к), UC2(к), U2C3(к), UN(к), UN2(к), U2N3(к), UH2O4(к), UH4O5(к), U(г), UO(г),
UO2(к), UO2(г), UO3(к), UO3(г), U3O8(к), U4O9(к), UCl3(г), UCl4(г), UCl5(г), UCl3(к),
UCl4(к), UCl5(к), UCl6(к), UOCl(к), UOCl2(к), UOCl3(к), UO2Cl(к), UO2Cl2(к),
-
U2O2Cl5(к), U2O4Cl3(к), CaUO4(к), U+, UO+, UO2+, UO2-
, UO3
239Pu, 240Pu, 241Pu, 242Pu
PuC(к), PuN(к), PuOCl(к), Pu(г), PuO(г), PuO2(г), PuO2(к), Pu2O3(к), PuC2(к), PuCl3(к),
+
Pu2C3(к), PuOCl(к), Pu+(г), PuO+
, PuO2
150Eu, 151Eu, 152Eu, 153Eu, 154Eu, 155Eu
Eu(г), EuO(к), EuO(г), Eu2O3(к), EuCl2(к), EuOCl(к), EuCl3(к), EuCl(к), Eu+
РАДИОХИМИЯ том 65 № 3 2023
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ ТЕРМИЧЕСКИХ ПРОЦЕССОВ
271
Таблица 3. Основные реакции и соответствующие им константы равновесия
Номер
Реакция
ΔT, К
a
b
Δa
Δb
реакции
1
3UO2(к) + CaCl2(к) = 2UOCl(к) + CaUO4(к)
300-700
9.13533
-17623
1.09308
477.698
2
UOCl2(к) = UOCl(к) + Cl
300-800
14.6828
-28428
0.29739
163.062
3
2UOCl2(к) = UCl4 + UO2(к)
700-1000
25.054
-20819
3.65814
2880.67
4
UOCl(к) + CO2 = UO2(к) + CO + Cl
800-1400
15.1182
-32089
0.01239
12.9388
5
UCl4 + 2CO2 = UO2(к) + 4Cl + 2CO
1100-1300
40.4246
-96956
0.06449
76.8496
6
UO2(к) + CO2 = UO3 + CO
1500-2000
21.4434
-64114
0.10343
178.394
7
UO2(к) + CaCl2 + 2CO2 = CaUO4(к) + 2Cl + 2CO
1600-1800
13.2948
-48503
0.02837
48.0607
8
UO2(к) + CO2 = UO– + CO - e-
1800-2000
20.7042
-68238
0.25165
476.813
9
UO2(к) = UO+ + e-
1800-2000
19.5468
-7225
0.36354
688.817
10
UO2(к) = UO2
1800-2000
19.004
-69274
0.04789
90.7453
11
UO3 = UO– - e-
2000-3100
1.05712
-7488.8
0.10099
250.343
12
UO3 = UO2 + O
2000-3600
16.5822
-71102
0.02492
66.5033
13
UO+ = UO2 - e-
2000-2200
2.38074
-7877.9
0.04626
96.92
14
UO2 + CO2= UO– + CO - e-
2000-2200
4.51476
-4575.9
0.03088
64.7057
15
UO3 = UO+ + O + e-
2200-3600
16.8397
-69236
0.2701
756.775
16
UO3- = UO+ + O + e-
3100-3600
24.0539
-88708
1.66822
5566.71
17
UO3- = UO2 + O + e-
3100-3600
20.1977
-78550
0.83863
2798.44
18
PuCl3(к) + CO2 = PuOCl(к) + CO + 2Cl
700-1300
33.1622
-67437
0.00877
8.23171
19
2PuOCl(к) + CO2 = Pu2O3(к) + 2Cl + CO
1500-1800
26.6688
-82349
0.05005
82.0127
20
PuOCl(к) + CO2 = PuO2 + CO + Cl
1600-1900
32.6683
-105770
0.0978
170.093
21
Pu2O3(к) + CO2 = 2PuO2 + CO
1800-2000
38.2121
-128325
0.09837
186.377
22
PuO2(к) = PuO2
1900-2100
28.9804
17349.9
2.02939
4048.63
23
PuO2 = PuO+ + O + e-
2000-3600
16.9583
-74148
0.2217
591.577
24
PuO2 = PuO + O
2000-3600
16.1369
-72247
0.009
24.0191
25
EuCl3(к) = EuCl2(к) + Cl
300-800
17.57229
-27842.2
0.252047
138.1992
26
EuCl2(к) + CO2 = EuOCl(к) + Cl + CO
1300-1600
-17.4212
-35999.4
0.276605
397.4906
27
4EuCl2(к) + 6CO2 = 2Eu2O3(к) + 8Cl + 6CO
1600-1800
103.5502
-301347
0.154251
261.3181
28
EuCl2(к) + CO2 = EuO(к) + 2Cl + CO
1600-1800
25.9643
-84986
0.05389
91.2959
29
2EuOCl(к) + CO2 = Eu2O3(к) + 2Cl + CO
1600-1800
30.415
-83309
0.00191
3.243
30
Eu2O3(к) = 2EuO + O
1800-2100
52.4327
-206052
0.08046
156.126
31
EuO(к) = EuO
1800-2100
17.2322
-61591
0.01389
26.9535
32
EuO(к) = Eu+ + O + e-
1800-2000
32.3081
-121448
0.33742
639.317
33
EuO(к) = Eu + O
1800-2000
29.7068
-119526
0.03313
62.7665
34
Eu+ + CO2 = EuO + CO - e-
2200-2700
3.62844
-4931.3
0.04676
113.718
35
Eu + CO2 = EuO + CO
2000-2700
5.78855
-6482.9
00.01278
29.5949
36
EuO = Eu+ + O + e-
2700-3600
15.2943
-61823
0.55494
1726.13
37
EuO = Eu + O
2700-3400
11.9718
-56719
0.01194
36.1101
38
Eu = Eu+ + e-
3400-3600
9.84401
-27541
0.73014
2553.41
РАДИОХИМИЯ том 65 № 3 2023
272
БАРБИН и др.
100
90
80
70
1
60
3
50
2
40
30
5
8
20
9
7
4
10
0
300
800
1300
1800
2300
2800
3300
T, K
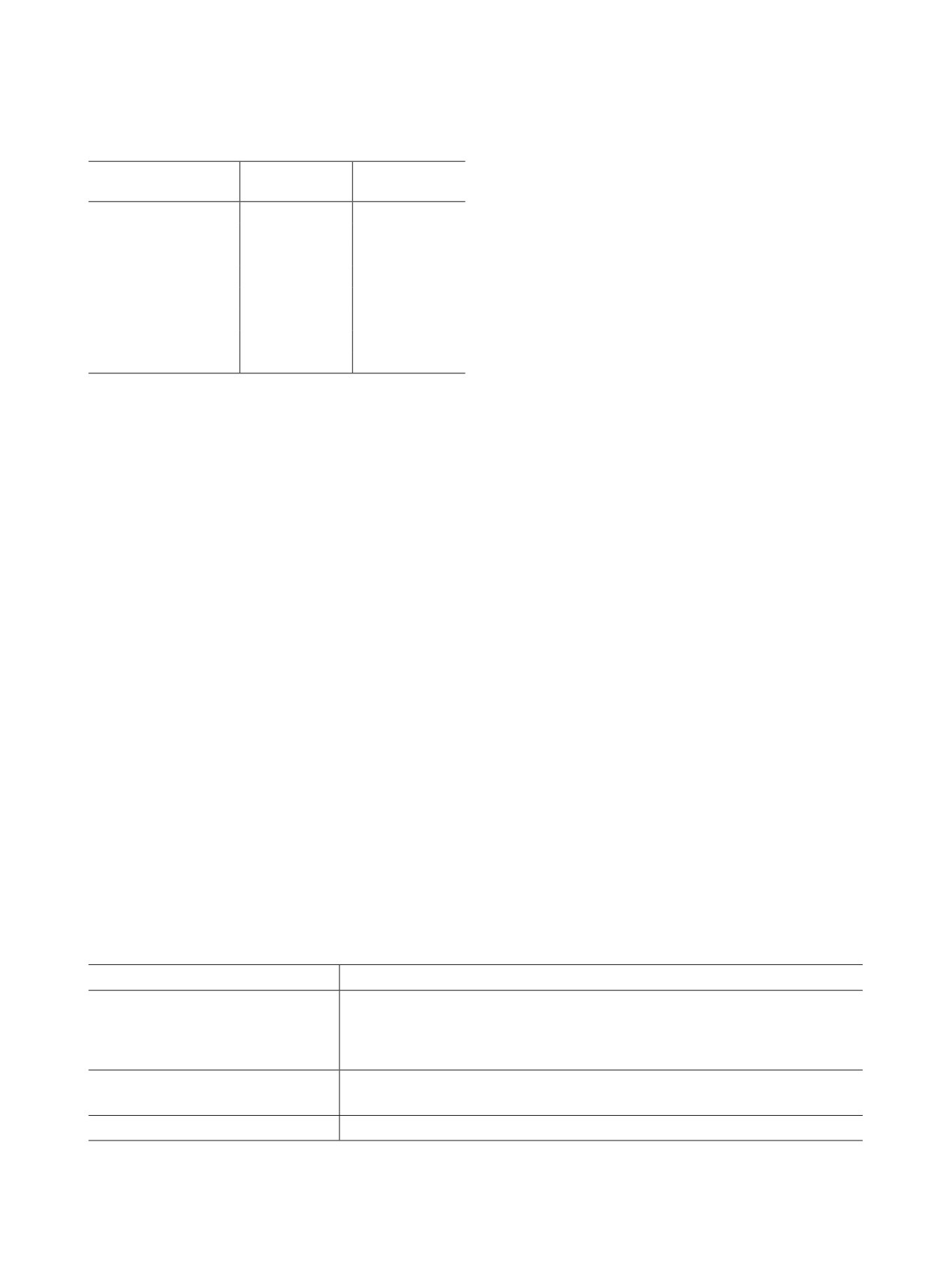
Рис. 1. Распределение урана по равновесным фазам при нагревании радиоактивного графита в воздухе: 1 - UO2(к), 2 -
UOCl2(к), 3 - UOCl(к), 4 - UCl4, 5 - UO3, 6 - CaUO4(к), 7 - UO3-, 8 - UO+, 9 - UO2.
сихлорид урана реагирует с диоксидом углерода с
происходит термическая диссоциация газообразно-
образованием конденсированного диоксида урана,
го оксида урана(VI). В области температур от 2000
монооксида углерода и хлора, реакция (4). В обла-
до 2200 К по реакции (13) ионизированный диок-
сти температур от 1100 до 1300 К по реакции (5)
сид урана превращается в газообразный диоксид
газообразный хлорид урана (IV) вступает в взаи-
урана. В том же отрезке температур газообразный
модействие с диоксидом углерода и образует кон-
диоксид урана реагирует с диоксидом углерода с
денсированный диоксид урана, хлор и монооксид
образованием ионизированного оксида урана(VI)
углерода. В отрезке температур от 1500 до 2000 К
и монооксида углерода, реакция (14). При повыше-
конденсированный диоксид урана начинает дей-
нии температуры от 2200 до 3600 К в соответствии
ствовать с диоксидом углерода и происходит об-
с реакцией (15) газообразный оксид урана(VI) обра-
разование газообразного оксида урана(VI) и моно-
тимо разлагается на ионизированный диоксид ура-
оксида углерода по реакции (6). При температуре
на и кислород. В диапазоне температур от 3100 до
от 1600 до 1800 К в соответствии с реакцией (7)
3600 К протекает термическая диссоциация иони-
наблюдается взаимодействие конденсированного
зированного оксида урана(VI), реакции (16) и (17).
диоксида урана с хлоридом кальция и диоксидом
Распределение плутония по равновесным фазам
углерода, в результате чего возникают конденсиро-
при нагревании радиоактивного графита в воздухе
ванный уранат кальция, хлор и монооксид углерода.
представлено на рис. 2. При повышении температу-
В диапазоне температур от 1800 до 2000 К по реак-
ры от 700 до 1300 К в соответствии с реакцией (18)
ции (8) конденсированный диоксид урана начинает
наблюдается взаимодействие конденсированного
действовать с диоксидом углерода и переходит в ио-
хлорида плутония с диоксидом углерода, в резуль-
низированный оксид урана(VI) с образованием мо-
тате чего на выходе образуются конденсированный
нооксида углерода. В том же интервале температур
оксихлорид плутония(III), монооксид углерода и га-
конденсированный диоксид урана превращается в
зообразный хлор. В диапазонах температур от 1500
первом случае в ионизированный диоксид урана по
до 1800 и от 1600 до 1900 К конденсированный
реакции (9), во втором - в газообразный диоксид
оксихлорид плутония(III) реагирует с диоксидом
урана по реакции (10). В интервале температур от
углерода и переходит в первом случае в конденси-
2000 до 3100 К в соответствии с реакцией (11) газо-
рованный оксид плутония(III), монооксид углерода
образный оксид урана(VI) превращается в ионизи-
и газообразный хлор согласно реакции (19), во вто-
рованный оксид урана(VI). На участке температур
ром - в газообразный оксид плутония(IV), моноок-
от 2000 до 3600 К в соответствии с реакцией (12)
сид углерода и газообразный хлор, реакция (20). В
РАДИОХИМИЯ том 65 № 3 2023
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ ТЕРМИЧЕСКИХ ПРОЦЕССОВ
273
100
1
3
90
80
70
60
50
40
30
4
20
5
6
10
2
7
0
T .
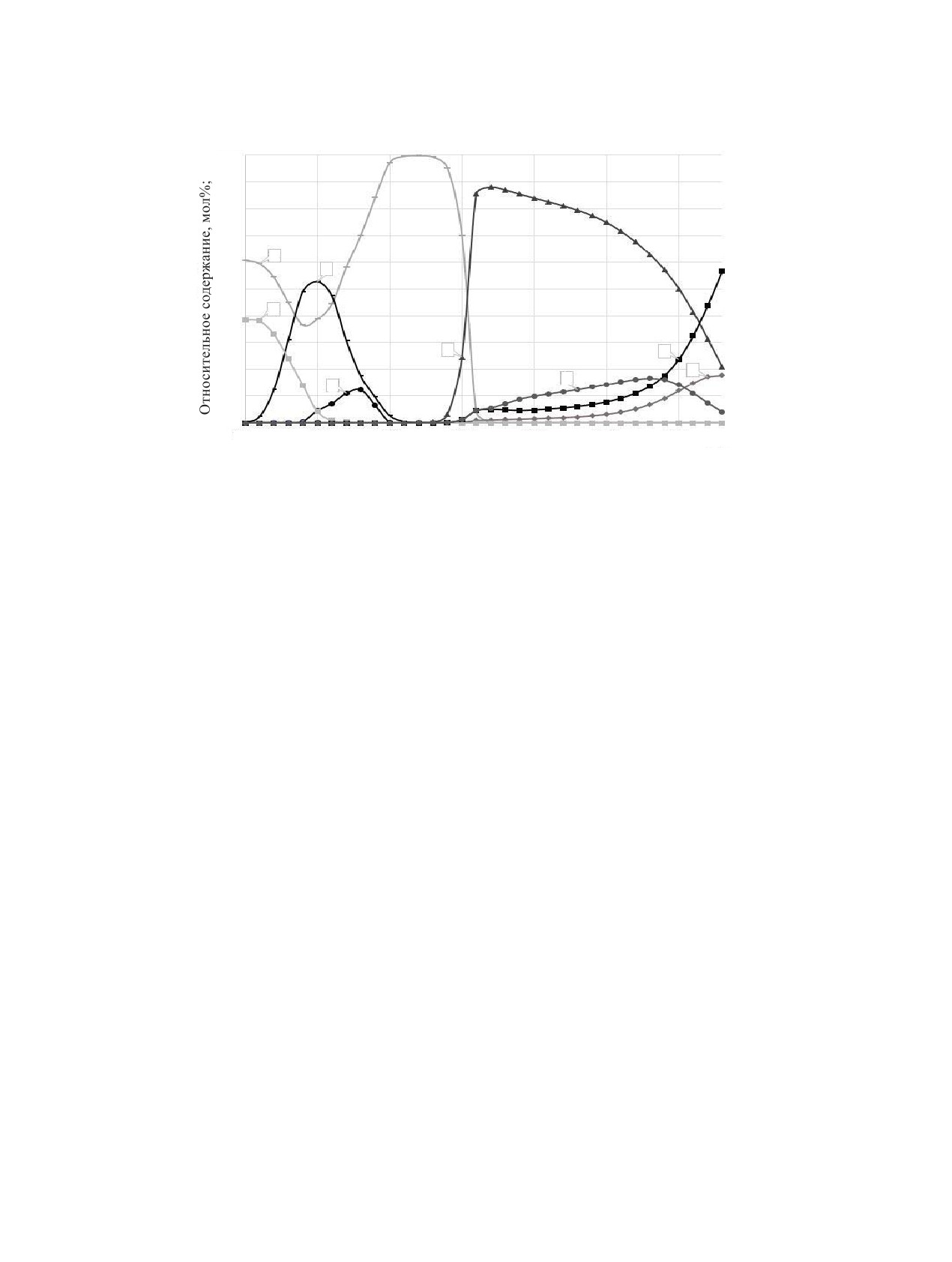
Рис. 2. Распределение плутония по равновесным фазам при нагревании радиоактивного графита в воздухе: 1 - PuCl3(к), 2 -
PuOCl(к), 3 - PuO2, 4 - Pu2O3(к), 5 - PuO2(к), 6 - PuO+, 7 - PuO.
100
90
80
1
70
60
4
6
50
40
7
30
5
3
2
20
10
8
0
300
800
1300
1800
2300
2800
3300
T .
Рис. 3. Распределение европия по равновесным фазам при нагревании радиоактивного графита в воздухе: 1 - EuCl2(к), 2 -
EuCl3(к), 3 - EuOCl(к), 4 - Eu2O3(к), 5 - EuO(к), 6 - EuO, 7 - Eu+; 8 - Eu.
интервале температур от 1800 до 2000 К на основа-
представлено на рис. 3. В интервале температур от
нии реакции (21) конденсированный оксид плуто-
300 до 800 K в соответствии с реакцией (25) проис-
ния(III) начинает реагировать с диоксидом углерода
ходит термическое разложение конденсированного
с образованием конденсированного оксида плуто-
хлорида европия(III) с образованием конденсиро-
ния(IV) и монооксида углерода. В области темпе-
ванного хлорида европия(II) и газообразного хлора.
ратур от 1900 до 2100 К по реакции (22) конден-
На участке температур от 1300 до 1600 К происхо-
сированный оксид плутония(IV) превращается в га-
дит взаимодействие конденсированного хлорида
зообразный оксид плутония(IV). На участке темпе-
европия(II) с диоксидом углерода с образованием
ратур от 2000 до 3600 К наблюдается термическая
конденсированного оксихлорида европия(III), га-
диссоциация газообразного оксида плутония(IV),
зообразного хлора и монооксида углерода по ре-
реакции (23) и (24).
акции (26). При температуре от 1600 до 1800 К по
Распределение европия по равновесным фазам
реакции (27) конденсированный хлорид европия(II)
при нагревании радиоактивного графита в воздухе взаимодействует с диоксидом углерода, в результа-
РАДИОХИМИЯ том 65 № 3 2023
274
БАРБИН и др.
10
InK
3
0
-10
1
-20
4
-30
26
-40
2
18
-50
-60
-70
0.0008
0.0013
0.0018
0.0023
0.0028
0.0033
1T, K-1
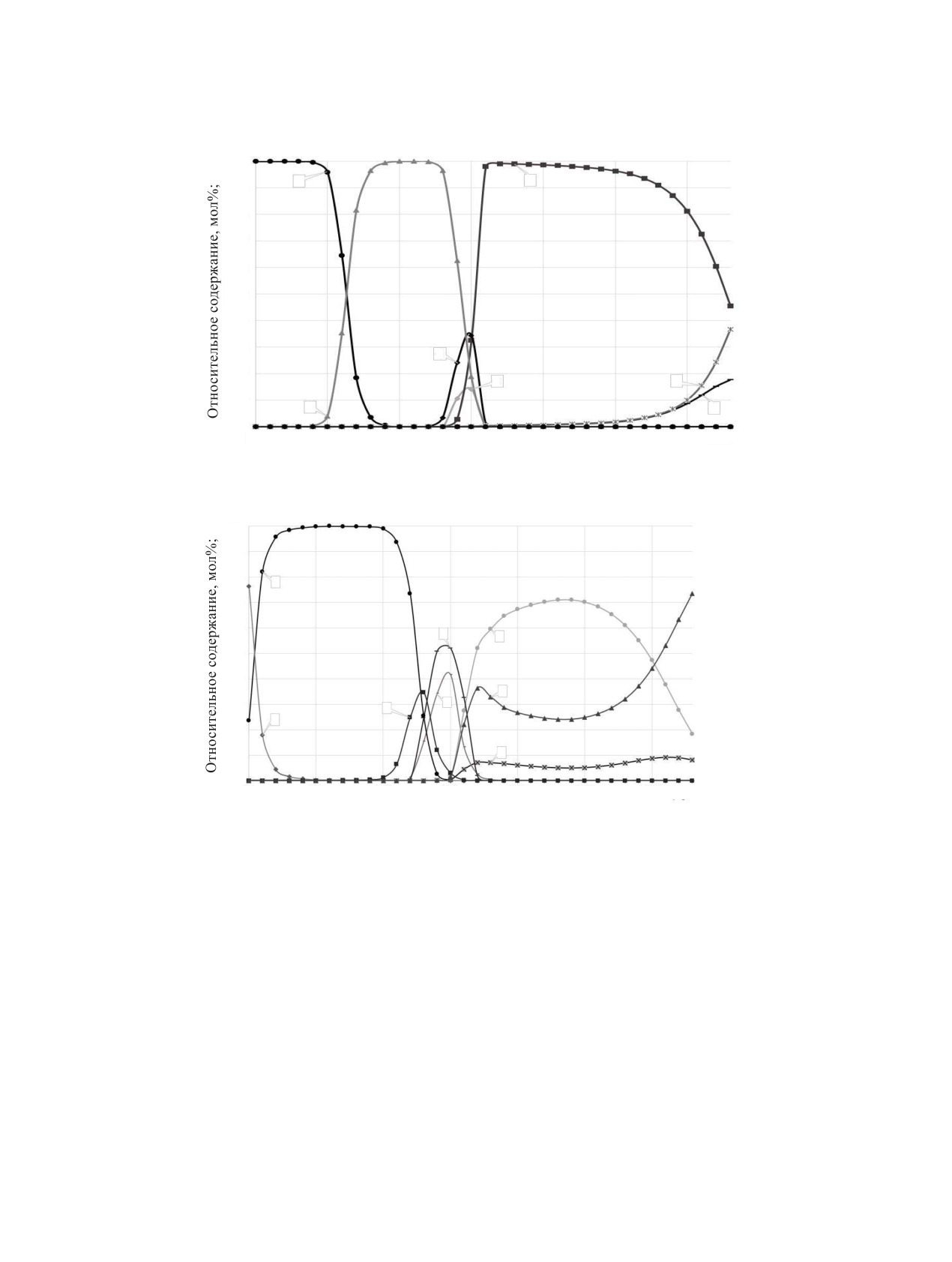
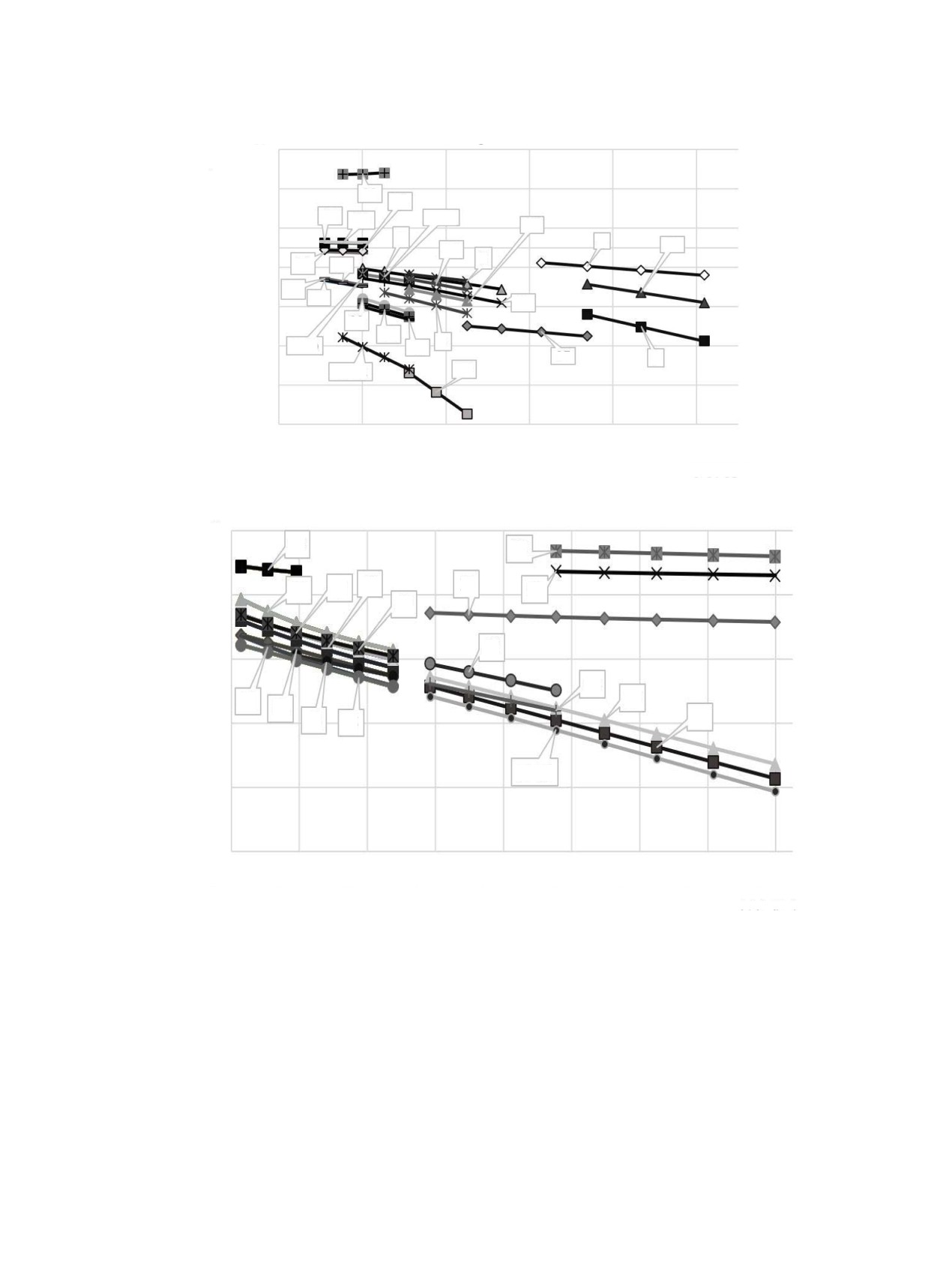
Рис. 4. Зависимость константы равновесия реакций от 1/Т в интервале температур 300-1000 К. Цифрами обозначены номера
реакций; то же на рис. 5, 6.
те чего образуются конденсированный оксид евро-
(36) и (37) протекает термическая диссоциация га-
пия(III), газообразный хлор и монооксид углерода.
зообразного оксида европия(II). В диапазоне тем-
В том же интервале температур конденсированный
ператур от 3400 до 3600 К газообразный европий
хлорид европия(II) реагирует с диоксидом углерода
частично переходит в ионизированный европий в
с образованием конденсированного оксида евро-
соответствии с реакцией (38).
пия(II), газообразного хлора и монооксида углеро-
По результатам термодинамического моделиро-
да, реакция (28). В том же диапазоне температур
вания, были определены основные реакции и их
в соответствии с реакцией (29) конденсированный
константы равновесия (табл. 3). Константы равно-
оксихлорид европия(III) взаимодействует с диок-
сидом углерода и переходит в конденсированный
весия представлены аналитическими уравнениями
оксид европия(III), газообразный хлор и моноок-
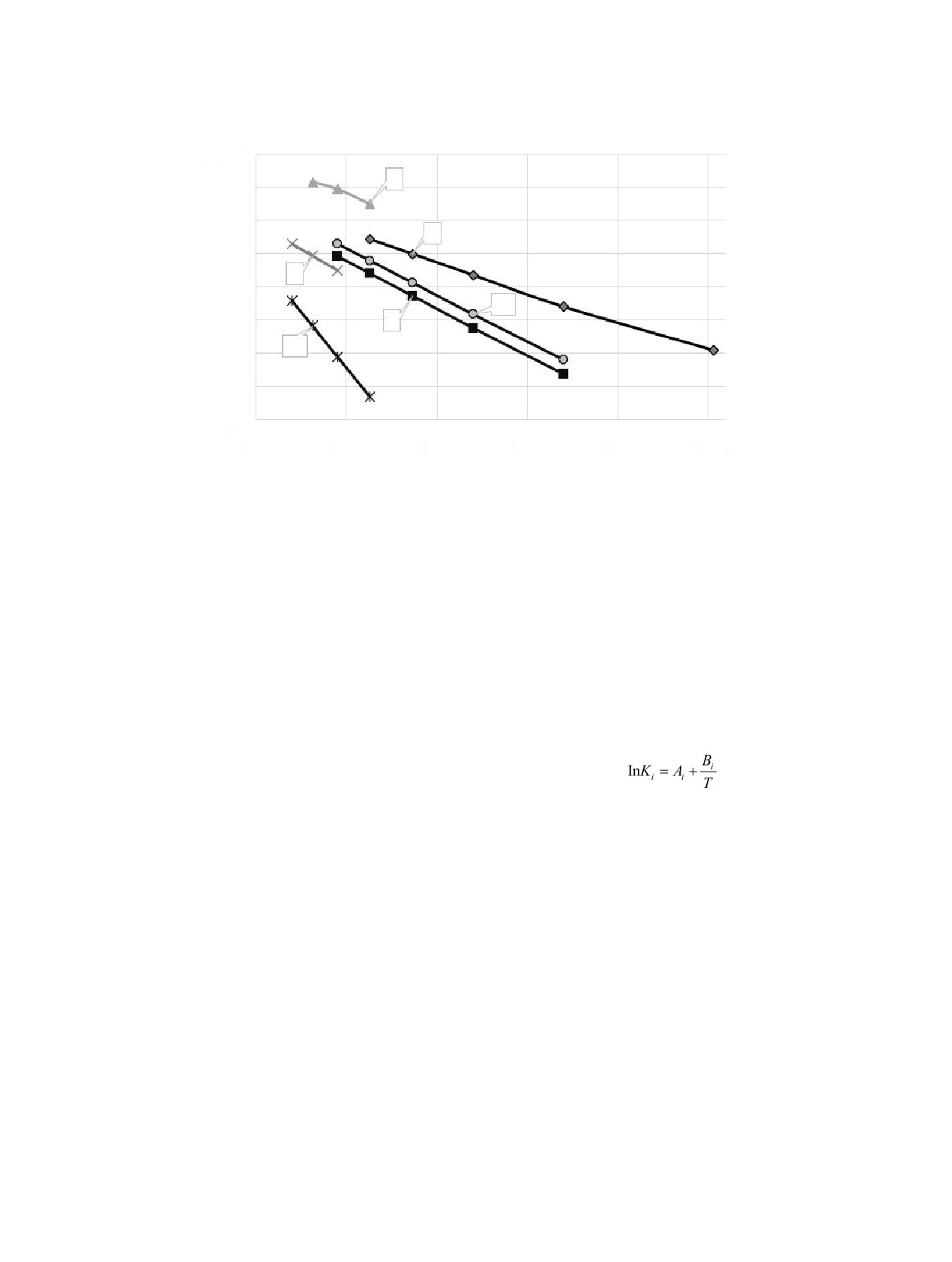
вида:
сид углерода. На участке температур от 1800 до
2100 К по реакции (30) конденсированный оксид
европия(III) превращается в газообразный оксид
Зависимость константы равновесия реакций от
европия(II) с образованием кислорода. При тем-
1/Т приведены на рис. 4-6. В интервале температур
пературе от 1800 до 2100 К в соответствии с ре-
акцией (31) конденсированный оксид европия(II)
300-1000 К с увеличением температуры константы
превращается в газообразный оксид европия(II). В
равновесия реакций увеличиваются, данное изме-
диапазоне температур от 1800 до 2000 К происхо-
нение показано на рис. 4 для реакций (1)-(4), (18),
дит термическая диссоциация конденсированного
(26).
оксида европия(II), реакции (32) и (33). В интервале
В диапазоне температур 1000-2200 К с увели-
температур от 2200 до 2700 К ионизированный ев-
чением температуры константы равновесия реак-
ропий взаимодействует с диоксидом углерода, в ре-
ций увеличиваются, данное изменение показано
зультате чего образуются газообразный оксид евро-
на рис. 5 для реакций (4)-(10), (12), (18), (19), (22),
пия(II) и монооксид углерода. В области температур
(24), (25), (27)-(34). Также на данном участке с уве-
от 2000 до 2700 К в соответствии с реакциями (34)
личением температуры константы равновесия реак-
и (35) наблюдается взаимодействие газообразного
европия с диоксидом углерода с образованием ок-
ций уменьшается, наблюдается это в реакции (23);
сида европия(II) и монооксида углерода. На участке
константы равновесия не меняются в реакциях (11),
температур от 2700 до 3600 К согласно реакциям
(13), (14), (36).
РАДИОХИМИЯ том 65 № 3 2023
ТЕРМОДИНАМИЧЕСКОЕ МОДЕЛИРОВАНИЕ ТЕРМИЧЕСКИХ ПРОЦЕССОВ
275
50
InK
30
23
14
13
9-10
36
28
10
6
4
18
29
7
11
24
-10
12
25
19
-30
22
34
9-10
8
-50
33
27
5
31-32
30
–70
-90
0.0004
0.0005
0.0006
0.0007
0.0008
0.0009
1/T, K-1
Рис. 5. Зависимость константы равновесия реакций от 1/Т при нагревании радиоактивного графита в атмосфере воздуха
при Т = 1000-2200 К.
5
39
36
InK
15
11
16
37
35
0
17
37
-5
38
24
15
12
38
12
-10
25
24-25
-15
-20
0.000275
0.000295 0.000315
0.000335
0.000355
0.000375 0.000395 0.000415 0.000435
1/T, K-1
Рис. 6. Зависимость константы равновесия реакций от 1/Т при нагревании радиоактивного графита в атмосфере воздуха
при Т = 2200-3600 К.
В области температур 2200-3600 К с увеличе-
В системе радиоактивный графит-водяной пар про-
нием температуры константы равновесия реакций
текало 15 реакций с участием урана, три реакции
увеличиваются, данное изменение показано на
с участием плутония, восемь реакций с участием
рис. 6 для реакций (11), (12), (15)-(17), (24), (25),
европия [4, 12]. В системе радиоактивный графит-
(35)-(39).
воздух протекало 17 реакций с участием урана, семь
Изменение реакционной среды (пар или воздух)
реакций с участием плутония, 14 реакций с участи-
ведет к изменению химических реакций, возникаю-
ем европия. В различных атмосферах для урана
щих в процессе переработки реакторного графита.
протекает реакция (6), при этом температура начала
РАДИОХИМИЯ том 65 № 3 2023
276
БАРБИН и др.
протекания реакции на 173 К ниже и реакция (10)
2.
Цыганов А.А., Хвостов В.И., Комаров Е.А., Кот-
протекает на 127 К выше для системы радиоактив-
лярский С.Г., Павлюк А.О., Шаманин И.В., Несте-
ров В.Н. // Изв. Томского политехн. ун-та.
2007.
ный графит-воздух. В различных атмосферах для
Т. 310, № 2. С. 94-98.
плутония протекает реакция (22), при этом темпе-
ратура начала протекания реакции на 227 К выше и
3.
Скачек М.А. Радиоактивные компоненты АЭС: обра-
щение, переработка, локализация: учеб. пособие для
реакция (24) протекает на 27 К выше для системы
вузов. М.: МЭИ, 2014.
радиоактивный графит-воздух. В различных атмос-
ферах для европия протекает реакция (31), при этом
4.
Барбин Н.М., Кобелев А.М., Терентьев Д.И., Алексе-
ев С.Г. // Радиохимия. 2017. Т. 59, № 5. С. 445-448.
температура начала протекания реакции на 227 К
выше и реакция (35) протекает на 27 К выше для
5.
Белов Г.В., Трусов Б.Г. Термодинамическое модели-
рование химически реагирующих систем. М.: МГТУ
системы радиоактивный графит-воздух. Данные
им. Н.Э. Баумана, 2013. 96 с.
сведения необходимы для разработки установок по
переработке радиоактивного графита.
6.
Ватолин Н.А., Моисеев Г.К, Трусов Б.Г. Термодина-
мическое моделирование в высокотемпературных
Термодинамическое моделирование показало,
системах. М.: Металлургия, 1994. 352 с.
что уран, плутоний и европий, находящиеся в ради-
7.
Моисеев Г.К., Вяткин Г.П., Барбин Н.М. Применение
оактивном графите в виде примесей, при нагреве в
термодинамического моделирования для изучения
атмосфере воздуха при достижении определенных
взаимодействия с участием ионных расплавов. Че-
температур переходят в газовую фазу. Это связано
лябинск: Изд-во ЮУрГУ, 2002. 166 с.
с взаимодействием графита и оксидной конденси-
8.
Барбин Н.М., Тикина И.В., Терентьев Д.И., Алексе-
рованной фазы с кислородом воздуха в исследован-
ев С.Г. Термические свойства расплавов. Москва:
ном диапазоне температур.
Инфра-Инженерия, 2022. 276 с.
9.
Роменков А.А., Туктаров М.А., Карлина О.К., Павло-
БЛАГОДАРНОСТИ
ва Г.Ю., Юрченко А.Ю., Апаркин Ф.М., Горелов К.А.,
Барбин Н.М. // Годовой отчет НИКИЭТ-2010: Сб.
Работа выполнена по плану НИР МЧС России
статей. М.: НИКИЭТ, 2010. С. 150.
(приказ МЧС России от 21.12.2021 № 893).
10. Шидловский В.В., Роменков А.А., Хаттарова Е.А.,
Гуськов А.В., Мартьянов А.В. // Годовой отчет НИ-
КОНФЛИКТ ИНТЕРЕСОВ
КИЭТ-2010: Сб. статей. М.: НИКИЭТ, 2010. С. 178.
11. Перельман В.П. Краткий справочник химика / Под
Авторы заявляют об отсутствии конфликта ин-
ред. В.В. Некрасова. М.: ГНТИ химической литера-
тересов.
туры, 1957. 530 с.
12. Кобелев А.М. Комбинированный способ переработ-
СПИСОК ЛИТЕРАТУРЫ
ки реакторного графита в водяном паре и оксид-
но-солевых расплавах: дис. … к.т.н. Екатеринбург:
1.
Блинова И.В., Соколова И.Д. // Атом. техника за рубе-
Уральский федеральный ун-т им. первого Президен-
жом. 2012. № 6. С. 3-14.
та России Б.Н. Ельцина, 2021. 264 с.
РАДИОХИМИЯ том 65 № 3 2023