РАДИОХИМИЯ, 2023, том 65, № 2, с. 130-149
УДК 616-073.916
ФТОР-18 ИЛИ ГАЛЛИЙ-68:
МНЕНИЕ ПЭТ РАДИОХИМИКА
© 2023 г. Р. Н. Красикова
Институт мозга человека им. Н.П. Бехтеревой РАН,
197376, Санкт-Петербург, ул. Академика Павлова, д. 12а
e-mail: raisa@ihb.spb.ru
Поступила в редакцию 17.01.2023, после доработки 17.01.2023, принята к публикации 18.01.2023
На данном этапе развития позитронной эмиссионной томографии (ПЭТ) лидирующую роль играют два
радионуцлида - 18F (T1/2 110 мин) и 68Ga (T1/2 68 мин). В представленном обзоре сравниваются ядер-
но-физические свойства фтора-18 и галлия-68 и методы их получения, а также на примере наиболее
востребованных радиофармпрепаратов обсуждаются преимущества и недостатки двух конкурирую-
щих радионуклидов в клинических ПЭТ исследованиях.
Ключевые слова: позитронная эмиссионная томография, диагностика, радиофармпрепараты, пепти-
ды, нейроэндокринные опухоли, PSMA агенты, FAPi.
DOI: 10.31857/S003383112302003X, EDN: WZXJIK
Позитронная эмиссионная томография (ПЭТ)
простым и высокопроизводительным методом (до
занимает ведущее место в группе методов медицин-
25 Ки) получения в водной мишени циклотрона и
ской визуализации (medical imaging). Применение
возможностью доставки РФЛП на достаточно боль-
ПЭТ в комбинации с компьютерной рентгеновской
шие расстояния. Основным РФЛП для ПЭТ, исполь-
томографией или магнитно-резонансной томо-
зуемым в более 90% всех исследований, был и оста-
графией (ПЭТ-КТ, ПЭТ-МРТ) позволяет решать
ется меченный фтором-18 фторированный аналог
многие задачи диагностики онкологических, кар-
глюкозы - 2-[18F]фтор-2-дезокси-D-глюкоза ([18F]
диологических и нейропсихических заболеваний,
FDG) [1]. Большинство других клинически исполь-
его использование позволяет сократить сроки кли-
зуемых РФЛП на основе фтора-18 [2, 3] также пред-
нических исследований (и расходы) при разработ-
ставляют собой простые молекулы (аминокислоты,
ке новых лекарственных средств. В основе метода
нуклеотиды, рецепторные радиолиганды и др.),
лежит использование радиотрейсеров (радиофарм-
получаемые подобно [18F]FDG методом прямого
препаратов - РФЛП) - биологически активных сое-
нуклеофильного фторирования, легко поддающим-
динений, в состав которых входят короткоживущие
ся автоматизации. Что касается РФЛП на основе
радиоактивные изотопы (15O, 11C, 13N, 18F, изотопы
сложных биологически активных молекул (пепти-
металлов и др.) с позитронным типом распада. Воз-
ды, протеины и др.), для введения метки фтора-18 в
можности метода ПЭТ во многом определяются
эти соединения необходимы сложные многоступен-
доступностью радиотрейсеров для визуализации
чатые синтезы, включающие стадию трудоемкой и
различных процессов (гликолиза, пролиферации,
длительной очистки с помощью полупрепаратив-
гипоксии, перфузии, рецепторных и нейротранс-
ной ВЭЖХ [4]. Эти методы так называемого «не-
миттерных взаимодействий) и, соответственно,
прямого» радиофторирования существенно усту-
доступностью соответствующих радионуклидов. В
пают простым методам введения радиоизотопов
течение всего периода развития ПЭТ наиболее вос-
металлов через бифункциональные хелатирующие
требованным радионуклидом по праву считается
агенты (БХА), в свою очередь образующие кова-
фтор-18 (T1/2 109.8 мин), что обусловлено его «иде-
лентные связи с различными биомолекулами. В ка-
альными» ядерно-физическими характеристиками,
честве основного конкурента фтору-18 выступает
130
ФТОР-18 ИЛИ ГАЛЛИЙ-68
131
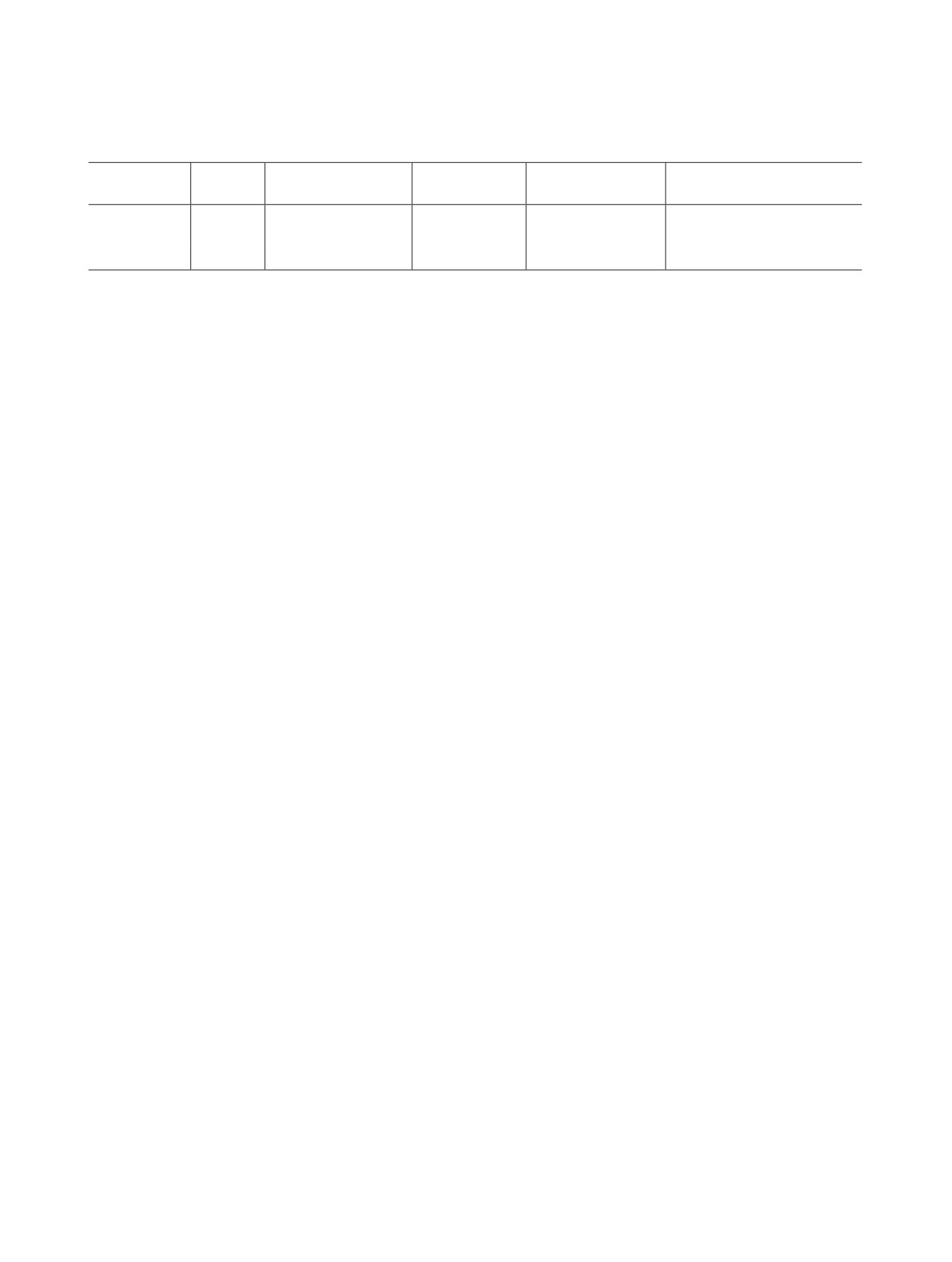
Таблица 1. Ядерные характеристики 18F и 68Ga
Пробег позитронов
Радионуклид
Т1/2, мин
Тип распада
Eβ+max, МэВ
Основной метод получения
в ткани, мм
18F
109.8
β+ 96.9%, ЭЗ 3.1%
0.634
2.45
Циклотрон, 18O(p,n)18F,
водная мишень
68Ga
67.7
β+ 88.9%, ЭЗ 11.1 %
1.9
9.6
Генератор, 68Ge (270.95 сут)
галлий-68 (T1/2 68 мин) [5, 6], важнейшим преиму-
ной поставки радиотрейсеров на достаточно боль-
ществом которого является доступность из изотоп-
шие расстояния. Кроме того, в отличие от галлия-68
ного генератора 68Ge/68Ga. В настоящее время ПЭТ с
с фтором-18 получено множество радиотрейсеров
РФЛП на основе галлия-68 лидирует в диагностике
метаболизма (аминокислоты, сахара, нуклеотиды
нейроэндокринных опухолей ([68Ga]DOTA-TATE,
и др.) и различных рецепторных радиолигандов.
[68Ga]DOTA-TОС) [7], рака предстательной железы
Что касается галлия-68, производство в коммер-
(меченые галлием-68 ПСМА-ингибиторы - [68Ga]
чески доступном генераторе 68Gе/68Ga непосред-
PSMA-11, [68Ga]PSMA-617 [8]), многих эпители-
ственно в медицинском учреждении, несомненно,
альных опухолей ([68Ga]FAPi-46) [9] и др. Однако,
является преимуществом. Интерес к 68Ga обуслов-
в последние годы благодаря разработке новых под-
лен и быстрым развитием таргетной радиотерапии
ходов к радиофторированию, основанных на хела-
(ТРТ) с использованием изотопов металлов (177Lu,
тировании фтора-18 в форме Al[18F]F различными
225Ac и др.), где РФЛП на основе галлия-68 необ-
БХА [10], наблюдается заметный сдвиг в сторону
ходимы как для первичной диагностики опухоли,
использования соответствующих РФЛП в качестве
отбора пациентов для ТРТ и последующхего кон-
альтернативы галлийсодержащим радиотрейсерам.
троля эффективности лечения в рамках концепции
В представленном мини-обзоре сравниваются ядер-
тераностики [11-13].
но-физические свойства фтора-18 и галлия-68 и ме-
тоды их получения, а также на примере наиболее
Методы получения фтора-18
востребованных РФЛП обсуждаются преимуще-
ства и недостатки двух конкурирующих радиону-
Из более двадцати известных методов получения
клидов в клинических ПЭТ исследованиях.
фтора-18 на практике применяют две ядерные ре-
акции (табл. 2), из которых получение радионукли-
Ядерно-физические характеристики фтора-18
да при облучении [18O]Н2О (обогащение 95-97%)
и галлия-68 и методы их получения
в водной мишени циклотрона протонами является
приоритетным. Радионуклид стабилизируется в
Ядерно-физическиe характеристики двух радио-
химической форме [18F]фторида и после его акти-
нуклидов приведены в табл. 1.
вации используется в синтезе РФЛП методом ну-
Детальное сравнение свойств 18F и 68Ga можно
клеофильного радиофторирования. Газообразный
найти в работе [6]. Фтор-18 имеет ряд преимуществ
[18F]F2, используемой в реакциях электрофильного
по сравнению с галлием-68: высокий процент
фторирования, традиционно получают облучением
эмиссии позитронов и их малый пробег в ткани
газовой мишени, заполненной смесью неона и фто-
(2.4 мм у 18F против 9.6 мм у 68Ga), и, как резуль-
ра, дейтонами по реакции 20Ne(d,α)18F, хотя более
тат, максимальное пространственное разрешение
производительным является облучение газовой ми-
ПЭТ изображения и относительно большой пери-
шени, заполненной смесью обогащенного [18О]О2 и
од полураспада 18F, совместимый с длительными
фтора.
протоколами ПЭТ исследования. Ввиду высокой
Нуклеофильное радиофторирование с использо-
активности [18F]фторида, генерируемого в водной
ванием высоких активностей получаемого в водной
мишени циклотрона, можно получать десятки кли-
мишени [18F]фторида - наиболее распространенный
нических доз РФЛП за один синтез для обеспечения
метод получения различных классов радиотрейсе-
работы нескольких сканнеров или централизован-
ров [2, 3]; именно он применяется в автоматизиро-
РАДИОХИМИЯ том 65 № 2 2023
132
КРАСИКОВА
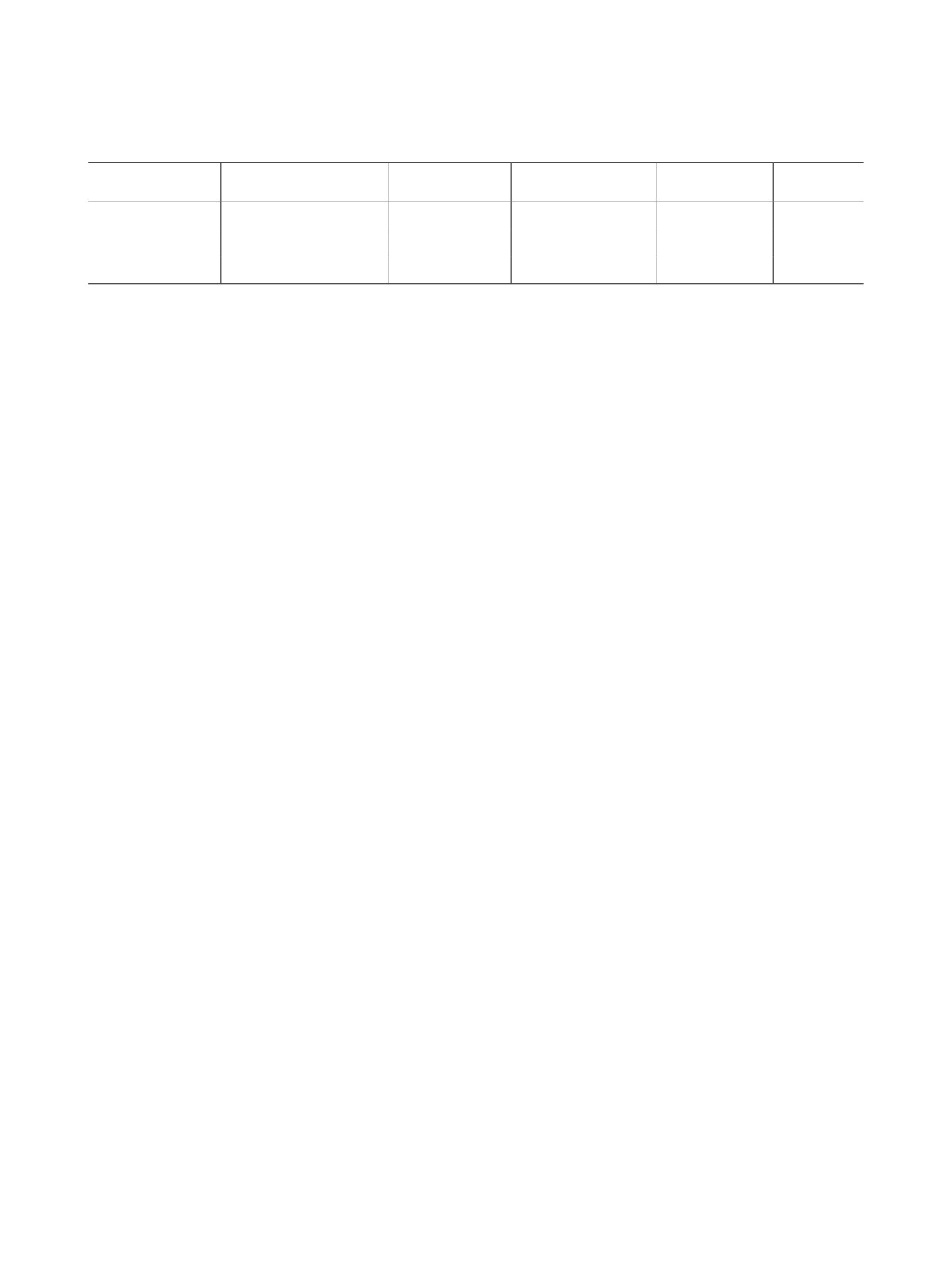
Таблица 2. Основные ядерные реакции получения фтора-18
Химическая
Максимальная
Добавление
Ядерная реакция
Облучаемое вещество
Сечение σmax, мб
форма фтора-18
активность
носителя
18О(p,n)18F
[18O]Н2О
[18F]фторид
700
до 25 Ки*
Нет
20Ne(d,α)18F
Ne (0.5-1% F2)
[18F]F2
115
300 мКи
Да
18О(p,n)18F
[18O]О2 (1% F2)
[18F]F2
700
1.3 Ки
Да
* При одновременном облучении двух мишеней током пучка 80 мкА в течение 2 ч [14].
ванном синтезе [15, 16] большинства клинически
дозы РФЛП за одно элюирование). Несмотря на то,
значимых РФЛП, включая [18F]FDG. Принципи-
что первые генераторы 68Ge/68Ga были предложены
ально важным является тот факт, что [18F]фторид
около 60 лет назад [20], интенсивное клиническое
производится без добавления носителя (no carrier
применение началось лишь с возможностью по-
added), снимая тем самым проблемы, связанные с
лучения 68Ga в форме [68Ga]GaCl3 (элюент - рас-
низкой мольной активностью РФЛП, получаемых
твор соляной кислоты), наиболее подходящей для
из [18F]F2 электрофильным методом. Ограничением
образования комплексов с БХА. Различные этапы
электрофильного метода, кроме низкой мольной ак-
разработки генераторов 68Ge/68Ga и исторические
тивности, является невысокая производительность
аспекты подробно обсуждаются в ряде обзоров и
газовой мишени по сравнению с водной мишенью
монографий [21-25], и их рассмотрение выходит за
и необходимость использования двухступенчатого
рамки данной статьи.
протокола облучения [17]. Кроме того, теоретиче-
Один из первых генераторов галлия-68 был соз-
ский выход электрофильного радиофторирования
дан в России в результате работ Института био-
составляет лишь 50%, поскольку в молекулу «вне-
физики МЗ СССР (Москва) и ЗАО «Циклотрон»
дряется» лишь один из двух атомов фтора. В це-
(Обнинск) [26, 27]. Этот генератор интенсивно ис-
лом электрофильный метод не позволяет получать
пользовался в доклинических и клинических иссле-
высокие активности РФЛП. Он применяется в тех
дованиях РФЛП не только в России, но и многих
случаях, когда введение метки в молекулу нукле-
других странах [28, 29] и в настоящее время при-
офильным методом невозможно или требует мно-
меняется в ПЭТ исследованиях пациентов в четы-
гостадийного синтеза [18], как, например, в случае
рех российских ПЭТ центрах. За последние годы в
6-L-[18F]FDOPA - важнейшего радиотрейсера для
мире налажено массовое производство генераторов
оценки плотности дофаминергических нейронов
галлия-68 различных марок (IGG, Eckert & Ziegler
при болезни Паркинсона и диагностики ряда опу-
(Германия), iThemba. LABS (ЮАР) и другие), отли-
холей [19].
чающихся типом сорбента (TiO2, SiO2, CeO2, SnO2)
и составом элюента (0.05-1 M HCl). В генераторе
Производство галлия-68 в радиоизотопном
ЗАО «Циклотрон» сорбентом служит TiO2, элюен-
генераторе 68Ge/68Ga
том - 0.1 М HCl, активность 68Ge 3.7 ГБк, эффек-
тивность элюирования более 70%.
Несомненным преимуществом
68Ga (T1/2
Номинальная активность большинства коммер-
67.71 мин) перед 18F является возможность его по-
чески доступных генераторов составляет
1.85-
лучения в изотопном генераторе 68Ge/68Ga, где ма-
3.7 ГБк (50-100 мКи) германия-68 [23, 30], актив-
теринским радионуклидом является долгоживущий
ность может быть увеличена до 4.04 ГБк (109 мКи)
68Ge (T1/2 = 270.8 сут). 68Ge путем электронного
без потери качества элюата [31]. Предварительным
захвата распадается до 68Ga и далее до стабильно-
этапом является очистка элюата, обеспечиваю-
го 68Zn [6]. Срок использования такого генератора
щая минимальный «проскок» материнского 68Ge
составляет около года, а оптимальное соотношение
(<0.001%) и удаление примесных количеств катио-
периодов полураспада материнского и дочернего
нов металлов (Fe3+, Al3+, Cu2+, Zn2+ и In3+), конкури-
радионуклидов позволяет элюировать 68Ga два-три
рующих с 68Ga3+, а также концентрирование элюата
раза в день (каждые 4 ч, в среднем 2-3 клинических
для получения 68Ga высокой обьемной активности
РАДИОХИМИЯ том 65 № 2 2023
ФТОР-18 ИЛИ ГАЛЛИЙ-68
133
[22, 25, 32]. Для этого используют различные при-
тивности радионуклида по сравнению с изотопным
емы, включая фракционирование, использование
генератором, и практически все мировые произво-
катионообменных или анионообменных картрид-
дители циклотронов уже имеют в своем арсенале
жей и их комбинации, варьирование концентрации
мишени для рутиного производства 68Ga. Облучение
соляной кислоты или использование в качестве
раствора [68Zn]Zn(NO3)2 (0.6-1.7 M в азотной кис-
элюата смеси HCl/EtOH. Помимо очистки элюата
лоте 0.01-0.3 M) в водной мишени циклотрона то-
синтез РФЛП на основе галлия-68 включает клю-
ком пучка 30-45 мкA в течение 30-60 мин позволяет
чевую стадию комплексообразования (при нагре-
нарабатывать до 5 ГБк радионуклида [43, 44]. Этот
вании или комнатной температуре) с лигандом в
метод является наиболее удобным для рутинного
присутствии буфера (ацетат натрия, HEPES и др.)
применения, поскольку он практически идентичнен
и очистку методом твердофазной экстракции на
хорошо знакомому ПЭТ радиохимикам процессу
одноразовых картриджах. Несмотря на относитель-
производства фтора-18 в водной мишени циклотро-
но простую процедуру синтеза, для минимизации
на. Обычно 68Ga выделяют из облученного раство-
радиационной нагрузки на оператора необходимы
ра методом твердофазной экстракции с использова-
автоматизированные модули синтеза, примеры ко-
нием двух типов одноразовых картриджей. Процесс
торых приведены в работах [24, 33, 34]. В РНЦРХТ
выделения легко адаптируется к любым, в том чис-
(Санкт-Петербург) разработан автоматизирован-
ле и кассетным, модулям синтеза, как, например,
ный модуль [35], обеспечивающий как очистку
GE FASTlab Developer [39]. Перспективным являет-
элюата одновременно из двух генераторов, так и
ся и предложенный недавно метод выделения 68Ga
проведение синтеза РФЛП, что позволяет снизить
методом жидкостной экстракции, позволяющим
стоимость клинической дозы и справляться с пото-
извлекать дорогостоящий обогащенный цинк-68 в
ком пациентов.
режиме непрерывного потока [45]. Более высокие
активности галлия-68 (370 ГБк на конец облучения
C недавнего времени стали доступными и гене-
током пучка 80 мкA в течение 102 мин и 175 ГБк по-
раторы «фармацевтического качества», одобренные
сле очистки) получают облучением твердой мише-
FDA - GalliaPharm R (Eckert & Ziegler AG, Герма-
ни из 68Zn, нанесенного электроплатинированием
ния) и GalliAd R (IRE Elit, Бельгия), в которых не
на металлическую подложку [42]. Этот метод вклю-
требуется предварительная очистка элюата. В этом
чает ряд технически сложных и трудоемких этапов,
случае синтез РФЛП можно проводить из набо-
начиная с изготовления самой мишени, ее доставки
ров реагентов (kit labeling), в состав которых вхо-
в горячую камеру, растворения мишени и выделе-
дит предшественник, буфер и стабилизирующий
ния галлия-68, однако эти задачи успешно решают-
агент [36-38]. Несмотря на существенно более вы-
ся с помощью автоматизированных линий доставки
сокую стоимость таких генераторов, их использо-
и кассетных модулей синтеза [42]. Производимый
вание полностью соответствует требованиям GMP
в мишени циклотрона радионуклид может постав-
(Good Manufacturing Practice), что важно для клини-
ляться либо в виде [68Ga]GaCl3 как активной фар-
ческого применения.
мацевтической субстанции, либо в форме готовых к
иньекции РФЛП, таких как [68Ga]DOTA-TATE или
Циклотронные методы производства галлия-68
[68Ga]PSMA-11. Следует учитывать и образование
до 1-2% радионуклидных примесей 66Ga и 67Ga, со-
Растущий спрос на ПЭТ исследования с гал-
держание которых зависит от состава мишени и ус-
лием-68 в концепции тераностики существенно
ловий облучения. Галлий-67 образуется по реакции
опережает возможности производства и постав-
68Zn(p,2n)67Ga, и его содержание можно уменьшить
ки генераторов. Это стимулировало развитие ци-
путем снижения энергии протонов с помощью де-
клотронных методов получения 68Ga по ядерной
градера
[40]. Галлий-66 образуется по реакции
реакции 68Zn(p,n)68Ga, реализуемой при облучении
66Zn(p,n)66Ga, поскольку 68Zn неизбежно содержит
водной [39] или твердой [40-42] мишени циклотро-
примесь 66Zn. В целом производство 68Ga в мишени
на протонами средних энергий. Циклотронные ме-
циклотрона не только сложнее, но и дороже, чем в
тоды позволяют нарабатывать гораздо большие ак-
изотопном генераторе. Однако с учетом большого
РАДИОХИМИЯ том 65 № 2 2023
134
КРАСИКОВА
OH
1. [18 F]F , K222 /K2CO3,
NH
polar aprotic solvents, T
ɋ
O
RLG
18F
[18F]RF
HO
2. Hydrolysis
HO O
HO
LG=OTf,OTs,ONs, sulfate
18F
OH
[18F]FDG
[18F]FLT
NO2
OH
COOH
N
18F
N
18F
NH2
H
O
HO
18F
[18F]FET
H
HO
[18F]FMISO
[18F]FES
Схема 1. Нуклеофильный синтез РФЛП методом прямого алифатического радиофторирования.
количества установленных в мире, в том числе и в
опухолей, таких как 3'-дезокси-3'-[18F]фтортимидин
России, ПЭТ циклотронов и возможности получе-
([18F]FLT, оценка пролиферации), [18F]фторомизо-
ния мультидозовых количеств РФЛП циклотронное
нидазол ([18F]FMISO, гипоксические состояния),
производство вполне перспективно. Все аспекты
O-2'-[18F]фторэтил-L-тирозин
([18F]FET, метабо-
производства 68Ga в различных мишенях и методы
лизм аминокислот),
16α-[18F]фтор-17β-эстрадиол
выделения радионуклида, а также методы контроля
([18F]FES, эстроген-позитивные опухоли груди),
качества и особенности регистрации РФЛП рассмо-
структуры которых показаны на схеме 1, и многих
трены в обзорах [23, 46].
других РФЛП на основе простых молекул [2]. Для
использования в реакциях нуклеофильного фто-
рирования [18F]фторид сорбируют на одноразовом
РАДИОФАРМПРЕПАРАТЫ НА ОСНОВЕ
анионообменном картридже и элюируют раство-
ФТОРА-18 И ГАЛЛИЯ-68
рами различного состава, содержащими межфаз-
ный катализатор (МФК), обеспечивающий перевод
Нуклеофильный синтез РФЛП на основе фтора-18
фтора из сильно сольватированной формы в фор-
му активированного комплекса. В качестве МФК
Большинство клинически значимых РФЛП,
используют краун-эфиры или криптанды в комби-
включая
[18F]FDG, получают методом прямого
нации с различными основаниями, а также соли
алифатического нуклеофильного замещения «ухо-
тетрабутил- или тетраэтил-аммония; чаще всего
дящей» группы (Leaving Group - LG, схема 1) в
аминополиэфир криптофикс (4,7,13,16,20,24-гекса-
молекуле предшественника сходной структуры ак-
окса-1,10-диазабицикло[8.8.8]гексакозан, или К222)
и карбонат калия (К222/K2CO3). При этом именно
тивированным
[18F]фторидом. Функциональные
группы с подвижными атомами водорода должны
выбор МФК играет определяющую роль в дости-
быть при этом защищены для предотвращения ата-
жении высокой эффективности радиофторирования
[47, 48].
ки нуклеофила в нежелательное положение. Защит-
ные группы удаляют путем гидролиза, после чего
В отличие от большинства простых молекул
целевой продукт выделяют из реакционной смеси
жесткие щелочные условия непригодны для введе-
методами полупрепаративной ВЭЖХ или более
ния метки фтор-18 в сложные биологически актив-
эффективным методом твердофазной экстракции.
ные молекулы (пептиды, протеины); для этой цели
Этот подход использован при рутинном производ-
используют процессы конъюгации радиоактивных
стве ряда радиотрейсеров для ПЭТ исследований
синтонов (получение которых является первым эта-
РАДИОХИМИЯ том 65 № 2 2023
ФТОР-18 ИЛИ ГАЛЛИЙ-68
135
пом радиохимического синтеза) с целевой молеку-
онкологии трудно переоценить. Кроме того, ПЭТ
лой, протекающие в более мягких условиях [4]. Эти
исследования с [18F]FDG проводят для оценки жиз-
«непрямые» методы синтеза требуют длительного
неспособности миокарда, нарушений метаболизма
времени и плохо поддаются автоматизации, что яв-
глюкозы при болезнях Паркинсона и Альцгеймера
лялось основным препятствием к внедрению мече-
и др. Разработка простого и эффективного метода
ных фтором-18 пептидов и других сложных моле-
синтеза [18F]FDG реакцией прямого алифатическо-
кул в клинические ПЭТ исследования. Огромный
го нуклеофильного замещения трифлатной группы
успех в ПЭТ диагностике опухолей с мечеными
в молекуле трифлата маннозы с последующим ги-
галлием-68 производными октреотида и другими
дролизом [1] и его автоматизация в современных
пептидами дал мощный толчок разработке прин-
кассетных модулях обеспечили широкую доступ-
ципиально новых и простых для применения мето-
ность радиотрейсера, применяемого в более 80%
дов получения меченых фторированных аналогов,
всех ПЭТ исследований [50].
которые будут рассмотрены далее в применении к
Важнейшую группу радиoтрейсеров метабо-
конкретным классам РФЛП.
лизма составляют меченные фтором-18 аналоги
аминокислот [51, 52], которые отличаются высокой
Радиотрейсеры метаболизма
специфичностью в отношении злокачественных но-
вообразований мозга, где использование [18F]ФДГ
ограничено ввиду высокого накопления глюкозы в
Фтор-18. Важнейшим преимуществом метода
сером веществе. Наибольшее применение получил
ПЭТ является возможность оценки нарушения про-
фторэтилированный аналог тирозина - О-(2'-[18F]
цессов метаболизма при различных патологиях, пре-
фторэтил)-L-тирозин ([18F]FET), который по ту-
жде всего при опухолевом процессе. В настоящее
моротропным характеристикам проявляет огром-
время разработан целый арсенал радиотрейсеров
ное сходство с L-[11C-метил]метионином ([11C]
на основе карбогидратов (сахаров), аминокислот,
МЕТ) - «золотым стандартом» диагностики цере-
нуклеотидов, производных холина, по накоплению
бральных опухолей, но отличается более простым
которых в неоплазме можно проследить различные
транспортным механизмом в опухолевые клетки
метаболические процессы [49]. Более половины
[53, 54]. Благодаря разработкам эффективного ав-
этих агентов содержат фтор-18, который, в отличие
томатизированного синтеза [18F]FET производится
от 15О, 13N и 11C, не входит в число элементов-ор-
в мультидозовых количествах, что в сочетании с
ганогенов. Введение 18F в структуру молекул осу-
большим периодом полураспада 18F (109 мин про-
ществляется путем замещения атома водорода или
тив 20.4 мин для 11С) дает возможность поставки в
гидроксильной группы с близкими ван-дер-вааль-
центры, не имеющие циклотрона.
совыми радиусами, что приводит к минимальным
структурным изменениям, но существенно влияет
Галлий-68. Немногочисленные попытки получе-
на метаболизм. Так, фторированный аналог глюко-
ния метаболических радиотрейсеров, содержащих
зы - [18F]FDG - подобно глюкозе фосфорилируется
галлий-68, за счет введения изотопа через различ-
гексокиназой, однако на этом процесс метаболизма
ные хелаторы не привели к желаемым результатам.
обрывается из-за наличия фтора в молекуле, и [18F]
Так, в 2012 г. в качестве альтернативы [18F]FDG
FDG удерживается в клетке (концепция «блокиро-
был синтезирован [68Ga]DOTA-Ga - производное
ванного метаболизма»). Злокачественные клетки
1,4,7,10-тетраазациклододекан-1,4,7,10-тетраук-
характеризуются более активными процессами гли-
сусной кислоты-глюкозамина, где введение метки
колиза, что обусловлено повышенным уровнем бел-
осуществлялось через наиболее распространенный
ков, транспортирующих глюкозу (Глут1 и Глут2), и,
в химии галлия-68 хелатор DOTA [55]. Однако ав-
в большей степени, увеличением активности гексо-
торы ограничились исследованием нового ради-
киназы в неоплазме. На этом основано ПЭТ иссле-
отрейсера на модели эпителиальной карциномы
дование с [18F]FDG в онкодиагностике (выявление
мышей, и работы не нашли продолжения. В синтезе
первичных опухолей и метастазов, определение
галлийсодержащего конъюгата с L-тирозином в ка-
стадии опухоли, оценка эффективности терапии
честве хелатирующего агента впервые была приме-
и др.), информативность и значимость которого для
нена 1,4,7,10-тетраазациклододекан-1,7-диуксусная
РАДИОХИМИЯ том 65 № 2 2023
136
КРАСИКОВА
O
O
O
O
N
N
N
N
O
O
O
68Ga
O
68Ga
O
O
N
PO3H2
N
N
N
N
PO3H2
NH
NH
N
PO3H2
OH
O
O
O
O
PO3H2
[68Ga]Ga-DOTA-BPAMD
[68Ga]Ga-DOTAZOL
Схема 2. Структурные формулы меченых галлием-68 радиотрейсеров для диагностики метастазов слелета.
кислота (DO2A) [56]. Несмотря на высокий радио-
воды-18О в мишени циклотрона, уже получается в
химический выход и высокое накопление получен-
форме [18F]фторида. Показано, что [18F]NaF связы-
ного [68Ga]Ga-DO2A-(OBu-L-tyr)2 в клетках глиоб-
вается с гидроксиапатитом (HАp) - основным ком-
ластомы, дальнейшие исследования нового агента
понентом неорганического матрикса кости - путем
не проводились. Этот же хелатор использован и в
замены гидроксила в решетке HАp, и его накопле-
синтезе коньюгатов галлия-68 с аланином [57]. Хотя
ние отражает изменение метаболической активно-
ПЭТ исследования на сканере для малых животных
сти костной ткани в результате опухолевой инвазии.
на модели мышей с привитым раком прямой кишки
Для этой цели также используется и [18F]ФДГ, од-
указывали на накопление нового радиотрейсера в
нако чувствительность ПЭТ исследования сильно
опухоли, подтвердить механизм его переноса в опу-
зависит от типа опухоли, служащей источником
холь белками-транспортерами аланина не удалось,
метастазов [62]. Сравнительное исследование трех
и работы не были продолжены. Очевидно, что ис-
РФЛП - [18F]NaF, [18F]FDG и [99mTc]Tc-MDP - под-
пользование хелатора для введения 68Ga кардиналь-
твердило преимущества [18F]NaF, такие как более
но меняет биохимическое поведение аминокисло-
высокая чувствительность и специфичность в вы-
ты.
явлении очагов поражения костной ткани [62, 63].
Галлий-68. В качестве альтернативы циклотрон-
Радиотрейсеры для визуализации
ному фтору-18 разработан ряд РФЛП, главным
метастазов скелета
образом бисфосфонатов, меченных галлием-68
[64, 65], подробно рассмотренных в обзоре [66].
Фтор-18. Важнейшей задачей радионуклидной
В отличие от 99mTc, для введения 68Ga в молеку-
диагностики является визуализация метастазов ске-
лы бисфосфонатов используют макроциклические
лета, образуюшихся на поздних стадиях большин-
хелаторы, такие как DOTA (1,4,7,10-тетраазаци-
ства онкологических заболеваний и являющихся
клододекан-N,N',N'',N'''-тетрауксусная
кислота),
основной причиной ухудшения качетва жизни паци-
NOTA (1,4,7-триазациклононан-1,4,7-триуксусная
ентов. Базовым диагностическим методом является
кислота) и другие. Из серии полученных на осно-
планарная остеосцинтиграфия (или реже ОФЭКТ) с
ве DOTA радиотрейсеров на основе α-H-бисфос-
РФЛП на основе фосфонатов (метилендифосфоната
фонатов наиболее перспективным является 68Ga-
и гидроксиметилендифосфоната), меченных техне-
DOTA-BPAMD (4-{[бис(фосфонометил))карбамоил]
цием-99m [58, 59]. Преимуществом метода является
метил}-7,10-бис(карбокси-метил)-1,4,7,10-тетра-
доступность радионуклида из недорогого генерато-
азациклододец-1-ил)-ацетат) (схема 2). По спец-
ра 99Mo/99mTc и простой способ получения РФЛП
ифичности 68Ga-DOTA-BPAMD не уступает [18F]
из наборов реагентов. Тем не менее, «золотым стан-
NaF [67], а предложенный недавно метод синтеза
дартом» для диагностики костных метастазов по
из лиофилизованных наборов реагентов [68] от-
праву считается [18F]NaF [60], предложенный еще
крывает возможности широкого применения ра-
в 1960-е годы [61]. Синтез [18F]NaF требует мини-
диотрейсера в клинике. Получение 177Lu-BPAMD
мальных затрат времени и оборудования, поскольку
[69] открывает возможности радиотерпаии костных
радионуклид, генерируемый в результате облучения
метастазов в рамках концепции тераностики. Пер-
РАДИОХИМИЯ том 65 № 2 2023
ФТОР-18 ИЛИ ГАЛЛИЙ-68
137
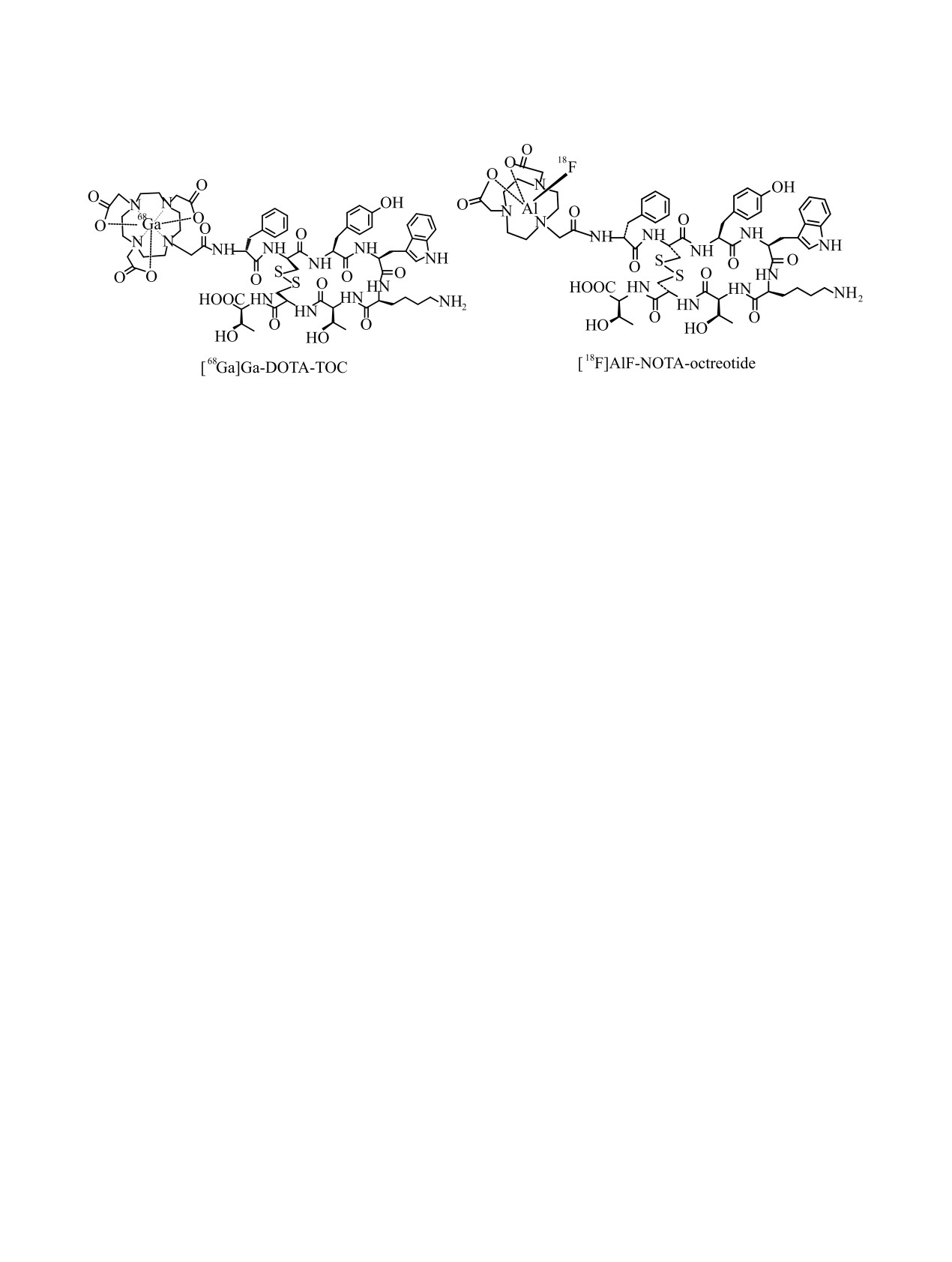
Схема 3. Структурные формулы производных октреотида, меченных галлием-68 и фтором-18, для ПЭТ
диагностики НЭО.
спективным РФЛП на основе бисфосфонатов яв-
ифичность на экспериментальной модели костной
ляется 68Ga-NO2APBP [70], где в качестве хелатора
патологии [73].
выступает NOTA - девятичленный хелатор, обра-
зующий более стабильные комплексы с 68Ga, чем
Радиотрейсеры для диагностики
DOTA, а рекция комплексообразования протекает
нейроэндокринных опухолей (НЭО)
при комнатной температуре. ПЭТ-КТ исследование
пациентов продемострировало сходную эффектив-
Галлий-68. Быстрое развитие ПЭТ/КТ диагно-
ность 68Ga-NO2APBP и [18F]NaF [65] в выявлении
стики с 68Ga связано прежде всего с разработками
очагов метастазирования, тогда как не все из них
DOTA-конъюгированых пептидов
- синтетиче-
четко визуализировались при стандартном ОФЭКТ
ских аналогов соматостатина (октретиода - ОС),
исследовании с [99mTc]MDP.
предложенных более 20 лет назад для диагностики
Другую группу РФЛП на основе α-ОН-бис-
нейроэндокринных опухолей (НЭО) [74, 75]. Oтли-
фосфонатов представляют меченые
68Ga азот-
чительной особенностью НЭО, чаще всего обнару-
содержащие фосфоновые кислоты памидроната
живаемых в желудочно-кишечном или респиратор-
(68Ga-DOTAPAM) и золедроната
(68Ga-DOTAZOL)
ном тракте, является гиперэкспрессия рецепторов
(схема 2, справа) [64]. Благодаря дополнительной
соматостатина (sst) различных типов (sst1, sst2A,
-ОН группе они отличаются более высоким нако-
sst2B, sst3, sst4, sst5). Рецепторы соматостатина
плением в костной ткани по сравнению с «клас-
являются идеальной мишенью как для радиоди-
сическими» α-Н-бисфосфонатами, такими как
агностических, так и для радиотерапевтических
68Ga-DOTA-BPAMD [64]. Однако сложный синтез
РФЛП ([90Y]Y-DOTATOC и [177Lu]Lu-DOTATATE),
68Ga-DOTAZOL, включающий стадию очистки ме-
тодом полупрепаративной ВЭЖХ и последующей
что обеспечивает персонализированный подход
к лечению НЭО в рамках концепции радиотера-
очистки на картриджах [71], тормозит внедрение
радиотрейсера в клиническую практику. В целом
ностики. В настоящее время наибольшее приме-
число клинических ПЭТ исследований с остеотроп-
неине получили три радиотрейсера этой группы
ными РФЛП на основе 68Ga пока невелико в сравне-
- [68Ga]Ga-DOTA-D-Phe1-Tyr3-octreotide ([68Ga]Ga-
нии с [18F]NaF и [18F]FDG. В России также ведутся
DOTATOC) (схема 3), [68Ga]Ga-DOTA-D-Phe1-Tyr3-
работы по созданию новых меченых галлием-68
octreotate ([68Ga]Ga-DOTATATE) и [68Ga]Ga-DOTA-
остеотропных препаратов на основе аминодифос-
D-Phe1-Nal3-octreotide
([68Ga]Ga-DOTANOC). В
фоных кислот [72], а также предложен новый РФЛП
структуре этих меченых пептидов можно выделить
на основе оксабифора (оксабис(этиленнитрило)
активную часть (вектор), которая связываются с ssrt
тетраметиленфосфоновой кислоты)
(«Оксабигал,
рецептором (TOC, TATE, NOC), хелатор (DOTA) и
68Ga») [59], продемострировавший высокую спец-
сам радионуклид 68Ga (схема 3, слева).
РАДИОХИМИЯ том 65 № 2 2023
138
КРАСИКОВА
Данные РФЛП - агонисты соматостатиновых ре-
(1,4,7-триазациклононан-N-глутаминовая кисло-
цепторов (ssrt 2, 3 и 5) - рекомендованы в качестве
та-N',N''-диуксусная кислота), а также гибридные
«золотого стандарта» для диагностики НЭО: ха-
(ациклические и циклические) - DATA5m (6-пен-
рактеризации первичной опухоли, оценки степени
тановая кислота-6-(амино)метил-1,4-диазепинтри-
ее распространенности и других критериев отбора
ацетат) [83]. Существенно, что выбор хелатора не
пациентов для пептид-рецепторной радиотерапии
только позволяет изменять условия синтеза (хела-
(ПРРТ) [76, 77]. Несмотря на различия в аффинности
тирование с DATA протекает в отличие от DОTA
к различным подтипам соматостатиновых рецепто-
быстро и при комнатной температуре), но влияет
ров, высокая чувствительность ПЭТ (>95%) в вы-
и на аффинность радиотрейсера к определенному
явлении нейроэндокринных неоплазий различных
подтипу рецептора. Oбзоры DOTA-конъюгирован-
локализаций отмечается для любого из DOTA-конъ-
ных и других пептидов, меченных 68Ga и содержа-
югированных пептидов, а качество диагностики
щих различные БХА, можно найти в работах [22,
существенно выше по сравнению с традиционным
82].
ОФЭКТ радиотрейсером - [111In]In-DTPA-октрео-
Фтор-18. Что касается меченных фтором-18
тидом (Октреосканом) [78]. Благодаря разработке
агентов для виуализации НЭО, традиционно для
лицензированных наборов реагентов (reagents kits)
этой цели используются «малые молекулы» - [18F]
для [68Ga]Ga-DOTATOC (SomakitTOC) и [68Ga]Ga-
FDG и 6-L-[18F]FDOPA, и с недавнего времени ме-
DOTATATE (NETSpot) синтез этих РФЛП являет-
ченый фтором-18 аналог мета-иодбензилгуаниди-
ся простым и удобным и протекает практически с
на - [18F]F-MFBG. Несмотря на то, что высокодиф-
количественным радиохимическим выходом. При
ференцированные НЭО характеризуются низкой
использовании генераторов галлия-68 «фармацев-
скоростью метаболизма глюкозы, было показано,
тического качества» (Eckert & Ziegler GalliaPharm,
что накопление [18F]FDG в опухоли хорошо кор-
IRE ELiT Galli Eo), не требующих дополнительной
релирует с Ki-67 (индексом пролиферации) и ука-
очистки элюата, и набора реагентов производство
зывает на плохой прогноз лечения [84]. Однако
РФЛП не требует квалифицированных радиохи-
наиболее эффективно использование [18F]FDG для
миков. За последние годы в этой области отмечен
визуализации недифференцированных форм НЭО
огромный прогресс: созданы наборы реагентов для
высокой степени злокачественности [85] c высокой
синтеза различных классов радиотрейсеров, мечен-
скоростью гликолиза. Для редко встречающихся
ных галлием-68, обзор которых можно найти в не-
НЭО, таких, как медуллярная карцинома щито-
давних работах [36-38].
видной железы, нейробластома, феохромоцитома
В дополнение к агонистам соматостатиновых ре-
(группа хромафинных опухолей надпочечников),
цепторов было предложено использовать ssrt2 ан-
в качестве приоритетного РФЛП в Европейских
тагонисты, такие, как [68Ga]Ga-DOTA-JR11 [79], с
рекомендациях [77] предлагается использование
более высокой чувствительностью при выявлении
6-L-[18F]FDOPA - меченного фтором-18 аналога
НЭО и высоким отношением опухоль-ткань, од-
аминокислоты L-2,4-дигидроксифенилаланина
нако работ по их клиническому применению пока
(DOPA), широко известного радиотрейсера для
немного. Следует отметить, что DOTA-коньюгиро-
оценки плотности дофаминергических термина-
ванные аналоги соматостатина, в частности, [68Ga]
лов при болезни Паркинсона [19, 86]. Хромафин-
Ga-DOTATATE, с высокой аффинностью к ssrt2
ные опухоли характеризуются повышенной вы-
применяют в диагностике церебральных менин-
работкой катехоламинов, в частности, дофамина,
гиом [80], в кардиодиагностике для визуализации
и в малой степени экспрессией рецепторов сома-
нестабильных атеросклеротических бляшек [81] и
тостатина. 6-L-[18F]FDOPA попадает в нейроэн-
других видах диагностики.
докринные клетки с помощью аминокислотного
Наряду с DOTA в синтезе различных пептид-
транспортера (LAT1/CD98), где метаболизируется
ных и других РФЛП используются и другие
декарбоксилазой ароматических аминокислот в ме-
хелаторы
[82], в числе наиболее известных
ченый фтордофамин (6-L-[18F]FDA), накапливаю-
циклические БХА - NOTA (1,4,7-триазацикло-
щийся в неоплазме. В целом ПЭТ с 6-L-[18F]FDOPA
нонан-1,4,7-триуксусная кислота) и NODAGA
обеспечивает более контрастные изображения по
РАДИОХИМИЯ том 65 № 2 2023
ФТОР-18 ИЛИ ГАЛЛИЙ-68
139
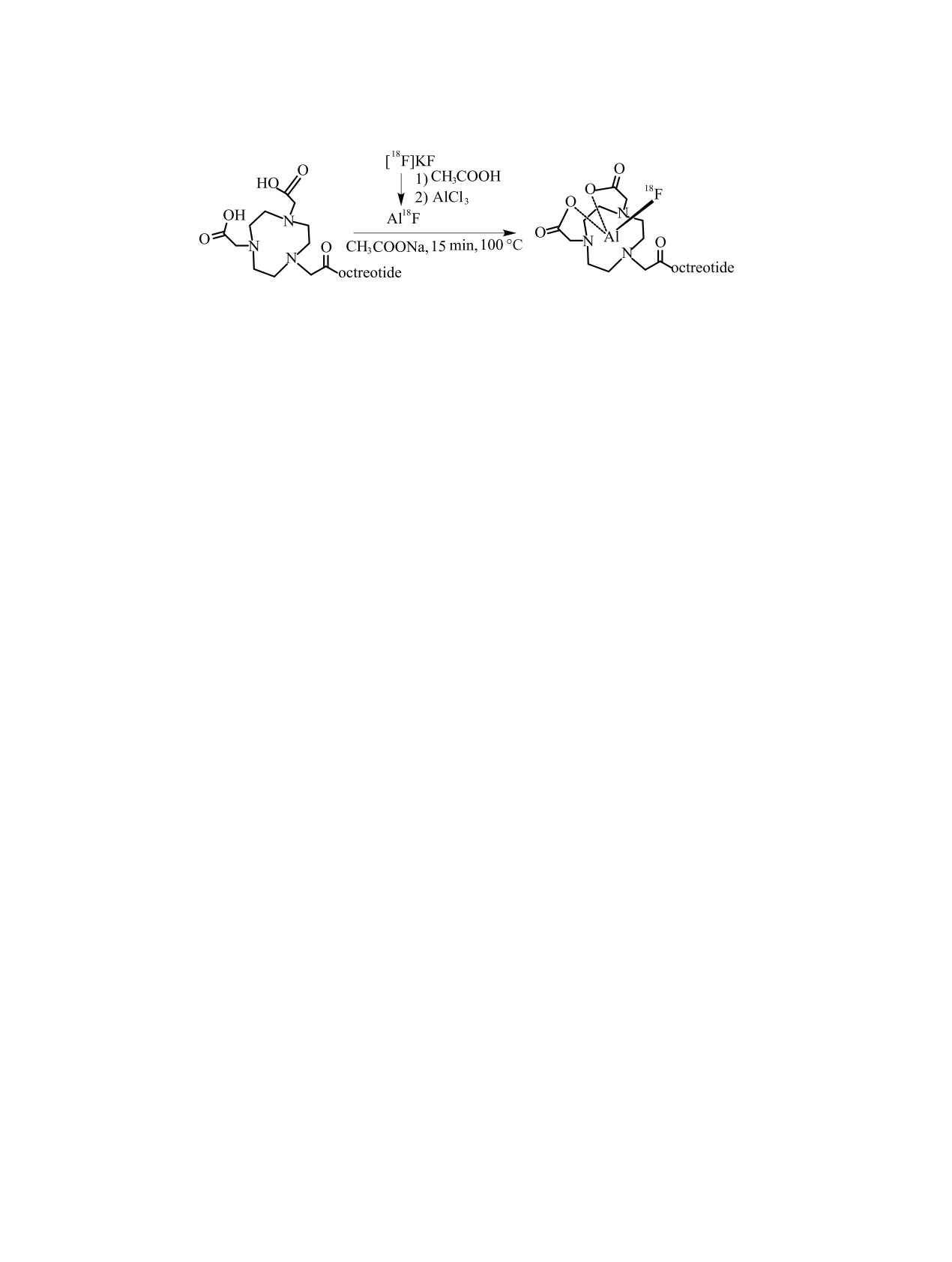
Схема 4. Радиохимический синтез [18F]AlF-NOTA-ОС [99].
сравнению с [68Ga]Ga-DOTATATE [87], однако во-
in-vivo стабильностью, и метод был быстро при-
прос о возможности использования полученных
менен к синтезу различных классов РФЛП (см. об-
данных для отбора пациентов на радиотерапию или
зор [94]), включая производное октреотида [18F]
при оценке ее эффективности остается дискусси-
SiTATE [95]. Автоматизированный синтез на кассет-
онным [88]. Кроме того, в отличие от [18F]FDG и
ной платформе Scintomics GRP™ обеспечивает по-
других РФЛП (схема 1), синтез 6-L-[18F]FDOPA ну-
лучение [18F]SiTATE с более чем 50%-ным радиохи-
клеофильным методом до сих пор остается доста-
мическим выходом (без поправки на радиоактивный
точно сложным для применения в рутинном произ-
распад), что более чем достаточно для рутинного
применения [96]. Несмотря на то, что по диагности-
водстве.
ческим качествам [18F]SiTATE сравним или даже
Поскольку лидирующую роль в диагностике
превосходит
[68Ga]Ga-DOTATATE, радиотрейсер
большинства НЭО сохраняют пептид рецептор-
не получил широкого применения в ПЭТ исследо-
ные РФЛП, прежде всего DOTA-конъюгаты ок-
ваниях. Это обусловлено созданием в 2010 г. [97]
треотида [89], в течение ряда лет ведется поиск
альтернативного метода введения фтора-18 в мо-
подходов к синтезу соответствующих радиотрей-
лекулы путем хелатирования катиона монофторида
серов на основе фтора-18, подробно рассмотрен-
алюминия - ([18F]AlF2+) - в 1,4,7-триазациклоло-
ных в обзоре [90]. Первые производные октреоти-
нан-1,4,7-триуксусную кислоту (NOTA)-окреотид
да, меченные фтором-18, Gluc-Lys([18F]FP)-TOCA
с образованием [18F]AlF-NOTA-октреотида ([18F]
(Nα-(1-деокси-D-фруктозил)-Nε-(2-[18F]фторпро-
AlF-NOTA-ОС) (схема 3, справа). Метод отлича-
пионил)-Lys(0)-Tyr(3)-октреотат) с высокой аффин-
ется исключительной простотой (схема 4): сор-
ностью к ssrt2, были получены уже в 2003 г [91].
бированный на анионообменном картридже [18F]
Авторы использовали классический радиохими-
фторид элюируют водным раствором NaCl непо-
ческий подход для введения фтора-18 через про-
средственно в реакционный сосуд, содержащий
стетическую группу
4-нитрофенил-2-[18F]фтор-
AlCl3, NOTA-прекурсор и ацетатный буфер. Смесь
пропионата - реакционноспособного агента для
нагревают в течение 10-15 мин при 100°С, после
N-ацилирования производного октреотида. Однако
чего радиотрейсер выделяют очисткой на одноразо-
ввиду сложного радиохимического синтеза и не-
вом обращенно-фазовом картридже. Такой подход
обходимости очистки методом полупрепаративной
легко поддается автоматизации, в том числе и на
ВЭЖХ радиотрейсер не был внедрен в клиниче-
кассетном модуле синтеза Trasis AllInInOne с ради-
скую практику.
охимическим выходом около 26% (с поправкой на
В 2006 г. был предложен принципиально новый
радиоактивный распад) [98]. В синтезе используют
подход к введению фтора-18 в сложные молекулы
очень малые количества AlCl3·6H2O, что является
через использование кремний-фторидного акцеп-
критичным; после оптимизации (27 мкл раствора
тора (silicon fluoride acceptor (SiFA)), получаемо-
4 мМ хлорида алюминия) радиохимический вы-
го прямым нуклеофильным методом (изотопным
ход [18F]AlF-NOTA-ОС был увеличен до 58% [99] с
обменом) в присутствии криптофикса при комнат-
использованием того же самого кассетного модуля
ной температуре и не требующим удаления следов
синтеза.
воды перед радиофторированем [92, 93]. Связь Si-F
Сравнительные ПЭТ исследования пациентов
в [18F]SiFA отличается исключительно высокой
с [18F]AlF-NOTA-ОС и [68Ga]Ga-DOTATATE под-
РАДИОХИМИЯ том 65 № 2 2023
140
КРАСИКОВА
доменами. В 2012 г. группой ученых из Гейдель-
берга (Германия) [104] был разработан радиотрей-
-
сер [68Ga]Ga-Glu-urea-Lys(Ahx)-HBED-CC ([68Ga]
Ga-DKFZ-11] или ([68Ga]Ga-PSMA-11) (схема 5),
являющийся ингибитором ПСМА, связывающимся
с экстрацеллюлярным доменом. В рекордные сро-
ки [68Ga]Ga-PSMA-11 прошел путь от разработки и
первых исследований на пациентах [105] до клини-
ческого применения. Реакция хелатирования ради-
онуклида с предшественником HBED-CC-PSMA-11
(5 мкг) протекает при комнатной температуре в
Схема 5. Структурная формула
течение 15 мин, для синтеза радиотрейсера име-
[68Ga]Ga-PSMA-HBED-CC ([68Ga]Ga-PSMA-11).
ются и наборы реагентов [38, 106]. Мультицентро-
вое исследование подтвердило исключительные
твердили сходство в накопленни двух РФЛП в высо-
диагностические свойства [68Ga]Ga-PSMA-11 для
ко дифференцированных НЭО, экспрессирующих
выявления как первичных опухолевых очагов, так
ssrt2, но более высоким отношением опухоль/окру-
и единичных, находящихся в лимфоузлах, и мно-
жающая ткань для [18F]AlF-NOTA-ОС [100-102].
жественных метастазов скелета, а также рецидива
Следует принимать во внимание то, что протокол
РПЖ при очень низких (0.2 нг/мл) уровнях ПСА, что
ПЭТ исследования с [18F]AlF-NOTA-ОС предусма-
невозможно с классическим РФЛП для ПЭТ - [18F]
тривает начало сканирования через 120 мин после
фторметилхолином. По данным ПЭТ-КТ исследова-
иньекции, тогда как для [68Ga]Ga-DOTATATE это
ния 1007 пациентов, частота обнаружения биохими-
время составляет 45-60 мин. Поскольку катион [18F]
ческого рецидива достигала 79.5% [107].В рамках
AlF2+ может рассматриваться как «псевдометалл»,
концепции тераностики получен и радиотерапев-
замещающий галлий-68 и другие радиометаллы в
тический агент
[177Lu]-PSMA-17, содержащий
структуре БХА, этот подход к радиофторированию
DOTA для хелатирования радиометалла, успешно
был быстро применен не только к [18F]AlF-NOTA-
применяемый для радиотерапии пациентов с ка-
ОС, но и синтезу многих важнейших РФЛП на ос-
страционно-резистентным неоперабельным раком
нове 68Ga (см. обзоры [10, 103]).
предстательной железы (КРРПЖ) с метастазом в
кости, резистентным к гормональной и химиоте-
рапии. Кроме того, для целей диагностики и тера-
Радиотрейсеры для диагностики рака
пии был разработан DOTAGA-коньюгированный
предстательной железы (РПЖ)
радиотрейсер DOTAGa-(D-I-Tyr)FK(Sub-Lys-Urea-
Glu) (PSMA I&T, от «Imaging and therapy»), где
Галлий-68. Революционным этапом радиофар-
DOTAGA - 1,4,7,10-тетраазациклододекан-1-(глу-
мацевтики галлия-68 было создание радиотрей-
таминивая кислота)-4,7,10-триуксусная кислота)
серов, специфичных к простат-специфическому
[108]. Подробное обсуждение этапов разработки
мембранному антигену (ПСМА) (prostate specific
и клинического применения меченных галлием-68
membrane antigen, PSMA). Молекула ПСМА, экс-
PSMA агентов можно найти в обзорах [109, 110].
прессируемая в эпителии выводных канальцев тка-
Фтор-18. Традиционно для ПЭТ диагностики
ни предстательной железы (а также в проксималь-
РПЖ используются меченые фтором-18 производные
ных канальцах почек, в слюнных, слезных железах,
холина, главным образом [18F]фторметилхолин [111],
печени, селезенке, тонкой кишке и симпатических
а также синтетическая аминокислота фторцикло-
ганглиях), оказалась удобной мишенью для ви-
вин, [18F]FACBC (анти-1-амино-3-18F-фторцикло-
зуализации РПЖ. Она представляет собой инте-
бутан-1-карбоновая кислота) [112]. Однако с появ-
грированный мембранный протеин, состоящий из
лением меченых галлием-68 ингибиторов PSMA,
750 аминокислот (100-120 кДа) с интрацеллюляр-
[68Ga]Ga-PSMA-11 - золотого стандарта для ПЭТ
ным, интрамембранным и экстрацеллюлярным
диагностики и мониторинга радиотерапии РПЖ -
РАДИОХИМИЯ том 65 № 2 2023
ФТОР-18 ИЛИ ГАЛЛИЙ-68
141
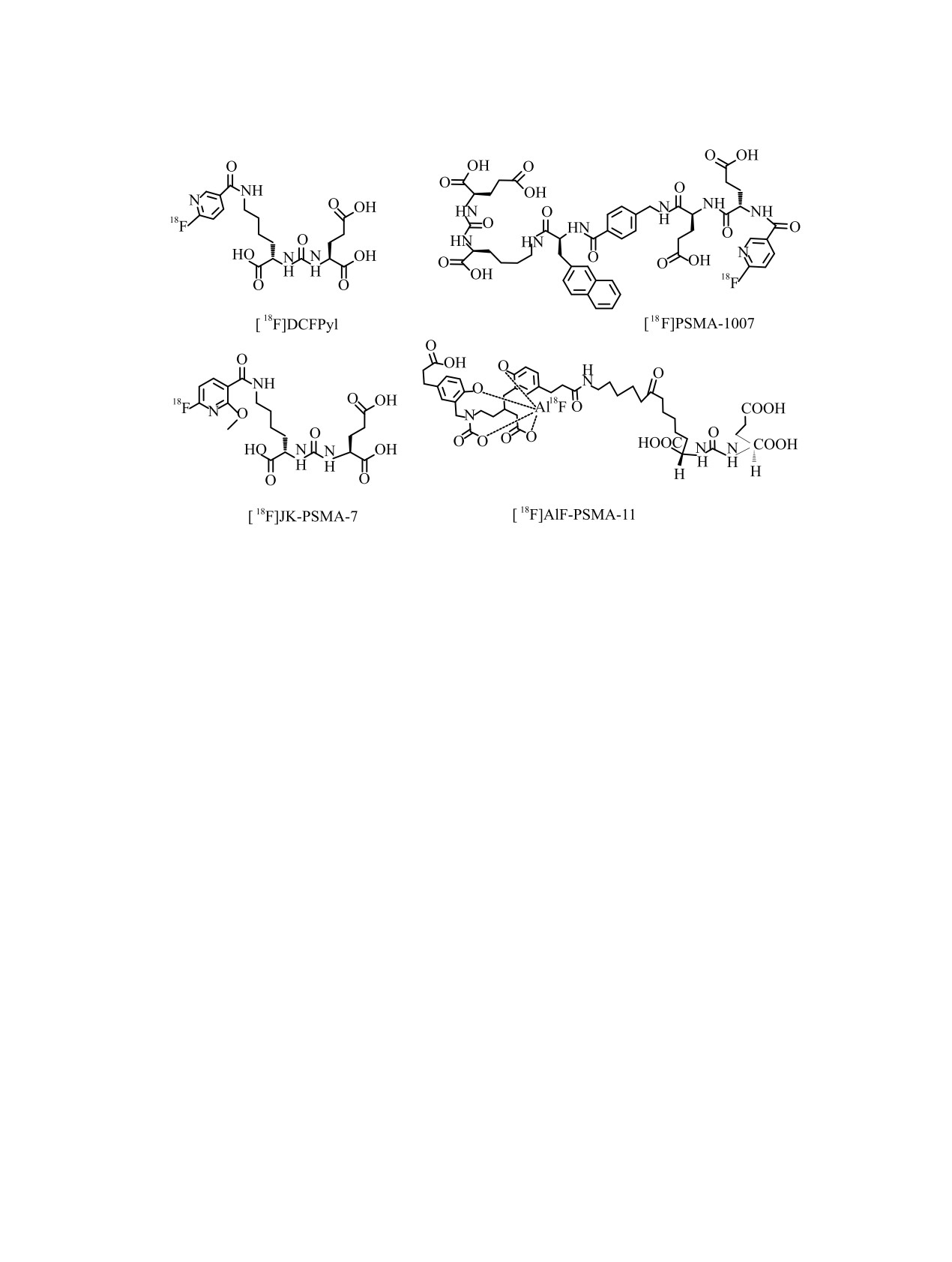
Схема 6. Структурные формулы меченных фтором-18 PSMA-агентов для диагностики РПЖ.
за достаточно короткий период были разработаны
Сравнительное исследование пациентов с био-
и PSMA агенты на основе фтора-18 [113, 114]. Так,
химическим рецидивом РПЖ показало, что [18F]
в последних европейских рекомендациях по PSMA
DCFPyL выявляет больше метастаз (lesions), чем
[68Ga]Ga-PSMA-11 [119]. Клиничесские испытания
диагностике РПЖ [115] кроме двух вышеупомя-
группы 135 пациентов с рецидивом, но очень низким
нутых РФЛП на основе галлия-68 представлены и
уровнем ПСА (0.5-1 нг) показали 78%-ную выявля-
три меченных фтором-18 агента [18F]DCFPyL, [18F]
емость [120], что существенно выше по сравнению
PSMA-1007 и [18F]-rhPSMA-7 (схема 6), которые бу-
с [68Ga]Ga-PSMA-11 (57%) [120]. Это указывает
дут рассмотрены ниже.
на высокую чувствительность и перспективность
Разработки первых PSMA радиотрейсеров, ме-
применения [18F]DCFPyL. Добавлением одной ме-
ченных фтором-18, были начаты уже в 2008 г. в
токси группы в положение 2 пиридинового кольца
университете Джона Хопкинса, Балтимор, США.
получен [18F]JK-PSMA-7 (схема 6) [121], преиму-
Наиболее перспективным оказался [18F]DCFPyL с
ществом которого является высокое накопление в
высокой аффинностью к PSMA (Ki 1.1 нм) [116],
неоплазме, что дает возможность детектирования
малых очагов метастазов при биохимическом реци-
но достаточно сложным радиохимическим синте-
диве КРРПЖ с низким уровнем ПСА [122]. Однако
зом. Было показано, что ПЭТ с [18F]DCFPyL по-
сложный двухстадийный синтез с очисткой полу-
зволяет эффективно выявлять метастазы РПЖ в
препаративной ВЭЖХ снижает интерес к его кли-
лимфатические узлы, и, благодаря быстрому вы-
ническому использованию.
ведению из кровяного русла, даже те, которые на-
Радиотрейсером, занявшим прочное место в кли-
ходятся в непосредственной близости от кровенос-
нической практике, является [18F]PSMA-1007 [123],
ных сосудов в области малого таза [117]. Широкое
близкий по структуре тераностическому агенту
признание радиотрейсера началось лишь после
PSMA-617 (схема 6). Синтез [18F]PSMA-1007 вклю-
разработки синтеза [18F]DCFPyL методом прямого
чает всего одну стадию (прямое ароматическое
нуклеофильного радиофторирования (схема 7) и его
нуклеофильное радиофторирование коммерчески
автоматизации [118], обеспечившим приемлемый
доступного предшественника) с очисткой радио-
РХВ 23% (против 2.3% в работе [116]).
трейсера методом твердофазной экстракции; он
РАДИОХИМИЯ том 65 № 2 2023
142
КРАСИКОВА
O
O
TFA
NH
NH
18F
COOtBu
Me3N
N
COOtBu
N
-
Activated 18F
O
O
tBuO
N
N
OtBu
tBuO
N
N
OtBu
0.5 ml CH3CN,
H
H
H
H
60
ɋ
10 min
O
O
O
O
O
NH
1) 1 mL of CH3 CN,
O
OH
18F
N
2) 1.5 mL HCl (10 N), 40ɋ
5 min
3) 2 mL NaOAc buffer (0.1 M) pH 5.8
O
4) HPLC purification
HO N
N
OH
H
H
O
O
[18F]DCFPyL
Схема 7. Синтез [18F]DCFPyL методом прямого нуклеофильного радиофторирования [118].
автоматизирован на практически всех известных
ный PSMA ингибитор, [18F]rhPSMA-7, состоящий
модулях синтеза РФЛП для ПЭТ, включая кассет-
из хелатора DOTAGA и включающий сайт распоз-
ные [124]. Радиохимический выход варьирует в
навания PSMA на основе EuE с дополнительным
зависимости от типа модуля и в среднем состав-
свободным карбоксилатом лизина (схема 8) [127].
ляет 50-55% при времени синтеза 35 мин. Полу-
В качестве радиоактивной метки может быть неза-
чение [18F]F-PSMA-1007 в отсутствие циклотрона
висимо выбран либо фтор-18, либо галлий-68, что
(с использованием поставляемого
[18F]фторида)
позволяет гибко управлять потоком пациентов. Мо-
описано в работе [125]. Радиохимический выход
лекула [18F]rhPSMA-7 содержит SiFA-акцептор для
составил 47.8 ± 8.9% (n = 30, без поправки на рас-
введения фтора-18 реакцией изотопного обмена,
пад) на модуле кассетного типа AllInOne, TRASIS-
протекающего в присутствии криптофикса в каче-
SA, Бельгия, что позволило получить 18 ГБк [18F]
стве МФК и щавелевой кислоты в качестве осно-
F-PSMA-1007. ПЭТ исследованиям с [18F]PSMA-
вания; радиохимический выход в автоматизирован-
1007 посвящено огромное множество работ, в том
ном синтезе превышает 50% [128]. Радиотрейсер
числе и сравнению как с [18F]DCFPyL, так и [68Ga]
демонстрирует отличные диагностические харак-
Ga-PSMA-11, результаты которых подробно обсуж-
теристики, но немногочисленные результаты ПЭТ
даются в обзоре [113]. В целом все три радиотрей-
исследований пациентов получены пока только его
сера обеспечивают высокое качество диагностики
разработчиками [129].
РПЖ; основные различия заключаются в накопле-
Среди меченых фтором-18 PSMA-агентов, на-
нии в «нетаргетных» органах и тканях и в выводя-
ходящихся в стадии доклинических испытаний
щих путях. Так, преимуществом [18F]PSMA-1007
(см. обзоры [113, 114]), следует отметить [18F]AlF-
является низкое удерживание в мочевыводящей
PSMA-11 [130], который получают простым и удоб-
системе, что важно для визуализации метастазов в
ным путем хелатирования катиона монофторида
близлежащих областях [126]. Ввиду медленной ки-
алюминия [18F]AlF2+ хелатором HBED-CC [131].
нетики накопления [18F]DCFPyL и [18F]PSMA-1007
В целом выбор PSMA агента для клинических
сканирование необходимо начинать на 120 мин по-
ПЭТ исследований РПЖ зависит не только от его
сле инъекции РФЛП, что неудобно для пациентов.
туморотропных характеристик, но и от сложности
Последний из РФЛП, перечисленный в Европей-
производства, стоимости клинической дозы и ло-
ских рекомендациях [115], представляет собой не-
гистики, особенно при большом потоке пациентов.
давно разработанный немецкими учеными гибрид-
Стоимость производства РФЛП зависит от многих
РАДИОХИМИЯ том 65 № 2 2023
ФТОР-18 ИЛИ ГАЛЛИЙ-68
143
O
O
H
HN
N
HO
OH
O
HO O
O OH
O
OH
NH
O
O
H
H
O O
O
N
N
N
N
H
H
N N
OH
O
O
HN
O
Ga3+
O
O
N N
O
O
18
Si
F
Схема 8. Структурная формула [18F]rhPSMA-7.
факторов и сильно отличается у различных про-
представляет собой универсальную мишень для
изводителей. В качестве примера можно привести
визуализации микроокружения практически лю-
данные работы [132], где рассчитана стоимость еди-
бой опухоли. Это было подтверждено уже в первых
ничного ПЭТ/КТ исследования с [18F]PSMA-1007:
ПЭТ исследованиях пациентов с [68Ga]Ga-FAPI-02
30 евро (вводимая активность 259 МБк) и ПЭТ/
и 04 (радионуклид коньюгирован в DOTA), где вы-
КТ исследования с [68Ga]Ga-PSMA-11: 275 Евро в
сокое накопление радиотрейсера детектировано в
первые 7 недель работы генератора или 583 Евро
28 типах опухолей [135, 136]. На основании этих и
в последние 7 недель работы генератора (вводимая
последующих работ многими авторами высказыва-
доза 154 МБк). Столь высокая стоимость [68Ga]Ga-
лась идея о том, что [68Ga]Ga-FAPI может заменить
PSMA-11 обусловлена огромной ценой генераторов
[18F]FDG как универсального ПЭТ радиотрейсера
«фармацевтического качества» на Западе; в России
для онкодиагностики, в особенности для опухолей с
цена «обнинского» генератора существенно ниже.
низкой скоростью гликолиза [137]. На основе [68Ga]
Кроме того, при расчете стоимости циклотронных
Ga-FAPI той же группой были получены и другие
РФЛП должны учитываться и капитальные вложе-
агенты, [68Ga]Ga-FAPI-46 (схема 9, вверху) и [68Ga]
ния в циклотрон и инфраструктуру.
Ga-FAPI-74. Для целей радиотерапии используется
тераностическая пара [90Y/68Ga]Y/Ga-FAPI, где ра-
Туморотропные РФЛП на основе
дионуклид хелатирован с DOTA [138]. В то же вре-
FAPI - ингибитора белка активации
мя в [68Ga]Ga-FAPI-74 радионуклид конъюгирован
фибробластов (FAP)
с NOTA - БХА, способным хелатировать и фтор-18
+ [10]. Хелатирование гал-
в виде катиона [18F]AlF2
В 2019 г. группой ученых из Гейдельберга (Гер-
лия-68 с NOTA протекает в течение 15 мин при ком-
мания) предложен принципиально новый класс
натной температуре, после чего [68Ga]Ga-FAPI-74
РФЛП для ПЭТ-КТ диагностики опухолей на осно-
выделают очисткой на картриджах [139]. Синтез
ве ингибитора белка активации фибропластов FAP
[18F]AlF-FAPI-74 проводят по стандартной техноло-
(fibroblast activation protein) [68Ga]Ga-FAPI [133].
гии через образование [18F]AlF+ в присутсвии хло-
FAP экспрессируется в фибробластах, которые сами
рида алюминия (схема 9, внизу); радиохимический
по себе не являются злокачественными, но состав-
выход составляет 38% [140]. Оба радиотрейсера
ляют микроокружение любой опухоли и участву-
обеспечивают высококонтрастные ПЭТ изобра-
ют в процессах, способствующих развитию рака:
ремоделировании экстацеллюлярного матрикса,
жения опухолей легких, а возможность получения
ангиогенезе, иммуносупрессии, резистентности к
одного и того же РФЛП с двумя радионуклидамии
химиотерапии [134]. Поскольку FAP практически
позволяет гибко планировать график ПЭТ исследо-
отсутствует в большинстве органов в норме, он
ваний при большом потоке пациентов [139].
РАДИОХИМИЯ том 65 № 2 2023
144
КРАСИКОВА
HOOC
N
HOOC
N
COOH
COOH
N
NC
O
N
NC
O
H
O
68 Ga3+
H
O
68GaCl 3,
95 oC
N
N
N NN
N
N N N
N
aq. ascorbic acid
N N
F
HOOC
F
N NHOOC
F
pH= 4.5 / 20 min
F
N
N
[18 F]F, AlCl3
HOOC
HOOC
NC O
O
DMSO, NaOAc NC O
O
N
N
18F
H
O
pH 3.9
H
O
Al
N
N
N
N
N
N
N
N N N
O
Sodium ascorbate
N
O N
HOOC95 oC, 15 min
COOH
N
N
Схема 9. Радиохимический синтез [68Ga]Ga-FAPI-46 (вверху) и [18F]AlF-FAPI-74 (внизу).
Персепективы применения и разработки новых
КОНФЛИКТ ИНТЕРЕСОВ
меченых фтором-18 FAPI-агентов подробно обсуж-
даются в обзоре [141].
Авторы заявляют об отсутствии конфликта ин-
тересов.
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
Таким образом, использование двух конкури-
рующих радионуклидов - фтора-18 и галлия-68 -
1.
Hamacher K., Coenen H.H., Stöcklin G. // J. Nucl. Med.
предоставляет огромные возможности для ПЭТ
1986. Vol. 27, N 2. P. 235-238.
диагностики различных заболеваний, прежде всего
2.
Coenen H.H., Ermert J. // Clin. Transl. Imaging. 2018.
онкологических, с использованием широкого спек-
Vol. 6. P. 169-193.
тра РФЛП. Тенденциями последних лет является
3.
Coenen H.H., Elsinga P.H., Iwata R., Kilbourn M.R.,
более широкое использование циклотронных мето-
Pillai M.R., Rajan M.G., Wagner H.N. Jr., Zaknun J.J. //
дов производства 68Ga, традиционно получаемого
Nucl. Med. Biol. 2010. Vol. 37. P. 727-740.
из изотопного генератора, а также синтез ключевых
4.
Van der Born D., Pees A., Poot A.J., Orru R.V.A.,
РФЛП с применением наборов реагентов. Благода-
Windhorst A.D., Vugts D.J. // Chem. Soc. Rev. 2017.
ря разработке новых подходов к радиофторирова-
Vol. 46, N 15. P. 4709-4773.
нию для большинства радиотрейсеров на основе
5.
Sahnoun S., Conen P., Mottaghy F.M. // Eur. J. Nucl.
галллия-68 получены альтернативные РФЛП, ме-
Med. Mol. Imaging. 2020. Vol. 47. P. 2944-2946.
ченные фтором-18, производимые в мультидозо-
6.
Sanchez-Crespo A.// Appl. Radiat. Isot. 2013. Vol. 76.
вых количествах. Гибкое использование генератора
P. 55-62.
галлия и циклотрона для производства идентичных
7.
Tan T.H., Boey C.Y., Lee B.N. // Nucl. Med. Mol.
туморотропных РФЛП на основе 68Ga и 18F в рамках
Imaging. 2018. Vol. 52, N 2. P. 119-124.
одного ПЭТ центра или клиники является наиболее
8.
Afshar-Oromieh A., Avtzi E., Giesel F.L., Holland-
эффективным как с точки зрения стоимости клини-
Letz T., Linhart H.G., Eder M., Eisenhut M., Boxler S.,
ческой дозы, так и доступа большего количества па-
Hadaschik B.A., Kratochwil C., Weichert W., Kopka K.,
циентов к современным ПЭТ технологиям.
Debus J., Haberkorn U. // Eur. J. Nucl. Med. Mol.
Imaging. 2015. Vol. 42. P. 197-209.
ФОНДОВАЯ ПОДДЕРЖКА
9.
Zhao L., Chen J., Pang Y., Fu K., Shang Q., Wu H.,
Sun L., Lin Q., Chen H. // Theranostics. 2022. Vol. 12,
Работа выполнена в рамках Государственного
N 4. P. 1557-1569.
задания Министерства образования и науки РФ для
10. Archibald S.J., Allott L. // EJNMMI Radiopharm. Chem.
ИМЧ РАН.
2021. Vol. 6, N 1. P. 30.
РАДИОХИМИЯ том 65 № 2 2023
ФТОР-18 ИЛИ ГАЛЛИЙ-68
145
11. Turner J.H. // Br. J. Radiol. 2018. Vol. 91, N 1091.
30. Amor-Coarasa A., Schoendorf M., Meckel M.,
Article 20170893.
Vallabhajosula S., Babich J.W. // J. Nucl. Med. 2016.
Vol. 57, N 9. P. 1402-1405.
12. Красикова Р.Н. // Радиохимия. 2019. Т. 61, N 6.
С. 453-463.
31. Waterhouse N.N., Amor-Coarasa A., Nikolopoulou A.,
Babich J.W. // EJNMMI Radiopharm. Chem. 2020.
13. Krasikova R.N., Aliev R.A., Kalmykov S.N. // Mendeleev
Vol. 5, N 1. P. 5.
Comm. 2016. Vol. 26. P. 85-94.
32. Larenkov A.A., Bruskin A.B., Kodina G.E. // J. Radioanal.
14. Eberl S., Eriksson T., Svedberg O., Norling J.,
Nucl. Chem. 2015. Vol. 305, N 1. P. 147.
Henderson D., Lam P., Fulham M. // Appl. Radiat. Isot.
2012. Vol. 70, N 6. P. 922-930.
33. Boschi S., Lodi F., Malizia C., Cicoria G., Marengo M. //
Appl. Radiat. Isot. 2013. Vol. 76. P. 38-45.
15. Krasikova R. // Curr. Org. Chem. 2013. Vol. 17. P. 2097-
2107.
34. Yüksel D., Uğur A. // J. Label. Compds. Radiopharm.
2022. Vol. 65. N 10-11. P. 272-279.
16. Barnes C., Nair M., Aboagye E.O., Archibald S.J.,
Allott L. // React. Chem. Eng. 2022. Vol. 7. P. 2265-
2279.
36. Chastel A., Vimont D., Claverol S., Zerna M., Bodin S.,
17. Hess E., Blessing G., Coenen H.H., Qaim S.M. // Appl.
Berndt M., Chaignepain S., Hindié E., Morgat C. //
Radiat. Isot. 2000. Vol. 52, N 6. P. 1431-1440.
Pharmaceutics. 2021. Vol. 13, N 8. P. 1160.
18. Krasikova R.N. // Molecules. 2020. Vol. 25, N 19.
37. Satpati D. // Bioconjugate Chem. 2021. Vol. 32. P. 430-
P. 4365.
447.
19. Taïeb D., Imperiale A., Pacak K. // Eur. J. Nucl. Med.
38. Lepareur N. // Front. Med. (Lausanne). 2022. Vol. 9.
Mol. Imaging. 2016. Vol. 43. P. 1187-1189.
Article 12050.
doi: 10.3389/fmed.2022.812050.
20. Greene M.W., Tucker W.D. // Int. J. Appl. Radiat. Isot.
1961. Vol. 12. P. 62-63.
39. Rodnick M.E., Sollert C., Stark D., Clark M., Katsifis A.,
Hockley B.G., Parr D.C., Frigell J., Henderson B.D.,
21. Ларенков А.А., Кодина Г.Е., Брускин А.Б. // Мед.
Abghari-Gerst M., Piert M.R., Fulham M.J., Eberl S.,
радиология и радиац. безопасн. 2011. Т. 560, № 5.
Gagnon K., Scott P.J.H. // EJNMMI Radiopharm. Chem.
С. 56-73.
2020. Vol. 5, N 1. P. 25.
22. Velikyan I. // Molecules. 2015. Vol. 20. P. 12913-12943.
40. Nelson B.J.B., Wilson J., Richter S., Duke M.J.M.,
23. Rösch F. // Appl. Radiat. Isot. 2013. Vol. 76. P. 24-30.
Wuest M., Wuest F. // Nucl. Med. Biol. 2020. Vol. 80-81.
24. Кодина Г.Е., Красикова Р.Н. Методы получения ра-
P. 24-31.
диофармацевтических препаратов и радионуклид-
41. Thisgaard H., Kumlin J., Langkjær N., Chua J., Hook B.,
ных генераторов для ядерной медицины. М.: МЭИ,
Jensen M., Kassaian A., Zeisler S., Borjian S., Cross M.,
2014.
Schaffer P., Dam J.H. // EJNMMI Radiopharm. Chem.
25. Nelson B.J.B., Andersson J.D., Wuest F.,
2021. Vol. 6, N 1. P. 1.
Spreckelmeyer S. // EJNMMI Radiopharm. Chem. 2022.
42. Svedjehed J, Pärnaste M, Gagnon K. // Nucl. Med. Biol.
Vol. 7, N 1. P. 27.
2022. Vol. 104-105. P. 1-10.
26. Кодина Г.Е., Козлова М.Д., Краснов Н.Н., Мали-
43. Riga S., Cicoria G., Pancaldi D., Zagni F., Vichi S.,
нин А.Б., Севастьянов Ю.Г, Севастьянова А.С.,
Dassenno M., Mora L., Lodi F., Morigi M.P.,
Разбаш А.А., Шарыгин Л.М.. Патент РФ № 2126271.
Marengo M. // Phys. Med. 2018. Vol. 55. P. 116-126.
Приоритет от 14.05.1998; рег. 20.02.1999 // Б.И. 1999.
№ 5.
44. Pandey M.K., DeGrado T.R. // Curr. Radiopharm. 2021.
Vol. 14. P. 325-339.
27. Razbash A.A., Sevastianov Yu.G., Krasnov N.N.,
Leonov A.I., Pavlekhin V.E. Proc. 5th Int. Conf. on
45. Zhuravlev F., Gulzar A., Falborg L. // Molecules. 2022.
Vol. 27, N 23. P. 8377.
Isotopes 5ICI, Brussels, Belgium. Bologna: Medimond,
2005. P. 147-151.
46. Becker K.V., Chernysheva M., Barnhart T.E., Gagnon K.,
Engle J.W. // Curr. Radiopharm. 2021. Vol. 14, N 4.
28. Razbash A., Sevastianov Yu., Larenkov A., Bruskin A.,
P. 315-324.
Kodina G. // World J. Nucl. Med. 2013. Vol. 12, N 1.
P. 87-94.
47. Bratteby K., Shalgunov V., Herth M. // ChemMedChem.
2021. Vol. 16. P. 2612-2622.
29. Zhernosekov K.P., Filosofov D.V., Baum R.P., Aschoff P.,
Bihl H., Razbash A.A., Jahn M., Jennewein M., Rösch F. //
48. Krasikova R.N., Orlovskaya V.V. // Appl. Sci. 2022.
J. Nucl. Med. 2007. Vol. 48, N 10. P. 1741-1748.
Vol. 12, N 1. P. 321.
РАДИОХИМИЯ том 65 № 2 2023
146
КРАСИКОВА
49. Lewis D.Y., Soloviev D., Brindle K.M. // Cancer J. 2015.
67. Fellner M., Baum R.P., Kubicek V., Hermann P., Lukes I.,
Vol. 21. P. 129-136.
Prasad V., Rosch F. // Eur. J. Nucl. Med. Mol. Imaging.
2010. Vol. 37, N 4. P. 834.
50. Peterson T.E., Manning H.C. // J. Nucl. Med. Technol.
2009. Vol. 37. P. 151-161.
68. Guleria M., Das T., Amirdhanayagam J., Shinto A.S.,
Kamaleshwaran K.Km., Pandian A., Sarma H.D.,
51. Орловская В.В., Федорова О.С., Красикова Р.Н. //
Dash A. // Cancer Biother. Radiopharm. 2019. Vol. 34,
Изв. АН. Сер. хим. 2015. №. 7. С. 1519-1535.
N 2. P. 67-75.
52. Werner JM., Lohmann P., Fink G.R., Langen K.J.,
69. Meckel M., Nauth A., Timpe J., Zhernosekov K.,
Galldiks N. // Molecules. 2020. Vol. 25, N 6. P. 1471.
Puranik A.D., Baum R.P., Rösch F. // Cancer Biother.
53. Langen K.J., Stoffels G., Filss K., Heinzel A.,
Radiopharm. 2015. Vol. 30. P. 94-99.
Stegmayr K., Lohmann P., Willuweit A., Neumaier B.,
70. Holub J., Meckel M., Kubíček V., Rösch F., Hermann P. //
Mottaghy F.M., Galldiks M. // Methods. 2017. Vol. 130.
Contrast Media Mol. Imaging. 2015. Vol. 10. P. 122-
P. 124-134.
134.
54. Скворцова Т.Ю., Савинцева Ж.И., Захс Д.В., Тю-
71. Meisenheimer M., Kürpig S., Essler M., Eppard E. //
рин Р.В., Гурчин А.Ф., Холявин А.И., Трофимо-
Molecules. 2020. Vol. 25, N 13. P. 2988.
ва Т.Н. // Лучевая диагностика и терапия. 2021.Т. 12.
72. Митрофанов Ю.А., Марук А.Я., Ларенков А.А., Коди-
С. 49-58.
на Г.Е., Лунёв А.С., Лунёва К.А., Клементьева О.Е.,
55. Yang Z., Xiong C., Zhang R. Zhu H, Li C. // Am. J. Nucl.
Цебрикова Г.С., Баулин В.Е., Рагулин В.В., Цивад-
Med. Mol. Imaging. 2012. Vol. 2, N 4. P. 499-507.
зе А.Ю. // ЖОХ. 2020. Т. 90, N 3. С. 409-417.
56. Burchardt C., Riss P.J., Zoller F., Maschauer S.,
73. Лунёв А.С., Клементьева О.Е., Лунёва К.А., Жу-
Prante O., Kuwert T., Roesch F. // Bioorg. Med. Chem.
кова М.В., Малышева А.О. // Саратов. научно-мед.
Lett. 2009. Vol. 19, N 13. P. 3498-3501.
журн. 2017. Т. 13, N 4. С. 886-891.
74. Breeman W.A., de Blois E., Sze Chan H., Konijnenberg M.,
57. Shetty D., Jeong J.M., Ju C.H. Lee Y.S., Jeong S.Y.,
Kwekkeboom D.J., Krenning E.P. // Semin. Nucl. Med.
Choi J.Y., Yang B.Y., Lee D.S., Chung J.K., Lee M.C. //
2011. Vol. 41, N 4. P. 314-321.
Nucl. Med. Biol. 2010. Vol. 37, N 8. P. 893-902.
75. Gabriel M., Decristoforo C., Kendler D., Dobro-
58. Ogawa K., Saji H. // Int. J. Mol. Imaging. 2011. Vol.
zemsky G., Heute D., Uprimny C., Kovacs P., Von Gug-
2011. Article 537687.
genberg E., Bale R., Virgolini I.J. // J. Nucl. Med. 2007.
59. Кодина Г.Е., Малышева А.О., Клементьева О.Е. //
Vol. 48, N 4. P. 508-518.
Изв. АН. Сер. хим. 2016. Т. 65, N 2. С. 350-362.
76. Hennrich U., Benešová M. // Pharmaceuticals. 2000.
60. Araz M., Aras G., Küçük Ö.N. // J. Bone Oncol. 2015.
Vol. 13, N 3. P. 38.
Vol. 4, N 3. P. 92-97.
77. Bozkurt M.F., Virgolini I., Balogova S., Beheshti M.,
61. Blau M., Nagler W., Bender M.A. // J. Nucl. Med. 1962.
Rubello D., Decristoforo C., Ambrosini V., Kjaer A.,
Vol. 3. P. 332-334.
Delgado-Bolton R., Kunikowska J., Oyen W.J.G.,
Chiti A., Giammarile F., Sundin A., Fanti S. // Eur. J.
62. Dadgar H., Norouzbeigi N., Jokar N., Zareizadeh J.,
Nucl. Med. Mol. Imaging. 2017. Vol. 44, N 9. P. 1588-
Gholamrezanezhad A., Ahmadzadehfar H., Abba-
1601.
szadeh M., Assadi M. // World J. Nucl. Med. 2022.
Vol. 21, N 1. P. 1-8.
78. Buchmann I., Henze M., Engelbrecht S., Eisenhut M.,
Runz A., Schäfer M. // Eur. J. Nucl. Med. Mol. Imaging.
63. Ota N., Kato K., Iwano S., Ito S., Abe S., Fujita N. // Br.
2007. Vol. 34, N 10. P. 1617-1626.
J. Radiol. 2014. Vol. 87. Article 20130444.
79. Krebs S., Pandit-Taskar N., Reidy D., Beattie B.J.,
64. Meckel M., Bergmann R., Miederer M., Roesch F. //
Lyashchenko S.K., Lewis J.S., Bodei L., Weber W.A.,
EJNMMI Radiopharm. Chem. 2017. Vol. 1, N 1. P. 14.
O’Donoghue J.A. // Eur. J. Nucl. Med. Mol. Imaging.
65. Passah A., Tripathi M., Ballal S., Yadav M.P., Kumar R.,
2019. Vol. 46, N 3. P. 677-685.
Roesch F., Meckel M., Sarathi Chakraborty P., Bal C. //
80. Ivanidze J., Roytman M., Lin E., Magge R.S., Pisapia D.J.,
Eur. J. Nucl. Med. Mol. Imaging. 2017. Vol. 44. P. 41-
Liechty B., Karakatsanis N., Ramakrishna R., Knisely J.,
49.
Schwartz T.H., Osborne J.R., Pannullo S.C.
// J.
66. Тищенко В.К., Петриев В.М., Завестовская И.Н.,
Neuroimaging. 2019. Vol. 29, N 5. P. 650-656.
Иванов С.А., Каприн А.Д. // Радиация и риск. 2020.
81. Wan M.Y.S., Endozo R., Michopoulou S., Shortman R.,
Т. 29, N 1. С. 102-119.
Rodriguez-Justo M., Menezes L., Yusuf S., Richards T.,
РАДИОХИМИЯ том 65 № 2 2023
ФТОР-18 ИЛИ ГАЛЛИЙ-68
147
Wild D., Waser B., Reubi J.C., Groves A. // J. Nucl. Med.
95. Lindner S., Simmet M., Gildehaus F.J., Jurkschat K.,
2017. Vol. 58, N 5. P. 774-780.
Wängler C., Wängler B., Bartenstein P., Schirrmacher R.,
Ilhan H. // Nucl. Med. Biol. 2020. Vol. 88-89. P. 86-95.
82. Spang P., Herrmann C., Roesch F. // Sem. Nucl. Med.
2016. Vol. 46, N 5. P. 373-394.
96. Wängler C., Beyer L, Bartenstein P., Wängler B.,
Schirrmacher R., Lindner S. // EJNMMI Radiopharm.
83. Seemann J., Waldron B., Parker D., Roesch F. //
Chem. 2022. Vol. 7. N 1. P. 22.
EJNMMI Radiopharm. Chem. 2017. Vol. 1, N 1. P. 4.
97. Laverman P., McBride W.J., Sharkey R.M., Eek A.,
84. Bucau M., Laurent-Bellue A., Poté N., Hentic O., Cros J.,
Joosten L., Oyen W.J., Goldenberg D.M., Boer-
Mikail N., Rebours V., Ruszniewski P., Lebtahi R.,
man O.C. // J. Nucl. Med. 2010. Vol. 51. P. 454-461.
Couvelard A. // Neuroendocrinology. 2018. Vol. 106,
98. Tshibangu T., Cawthorne C., Serdons K., Pauwels E.,
N 3. P. 274-282.
Gsell W., Bormans G., Deroose C.M., Cleeren F. //
85. Panagiotidis E., Alshammari A., Michopoulou S.,
EJNMMI Radiopharm. Chem. 2020. Vol. 5. P. 4.
Skoura E., Naik K., Maragkoudakis E., Mohma-
99. Yu Q., Tan X., Li D., Shi B., Wu F., Xu D., Xue W.,
duvesh M., Al-Harbi M., Belda M., Caplin M.E.,
Wan Z. // J. Radioanal. Nucl. Chem. 2021. Vol. 328.
Toumpanakis C., Bomanji J. // J. Nucl. Med. 2017.
P. 825-833.
Vol. 58, N 1. P. 91-96.
100. Pauwels E., Cleeren F., Tshibangu T., Koole M.,
86. Garnett E.S., Firnau G., Nahmias C. // Nature. 1983.
Serdons K., Dekervel J., Van Cutsem E., Verslype C.,
Vol. 305. P. 137-138.
Van Laere K., Bormans G. // Eur. J. Nucl. Med. Mol.
87. Putzer D., Gabriel M., Kendler D., Henninger B.,
Imaging. 2019. Vol. 46. P. 2398-2399.
Knoflach M., Kroiss A., Vonguggenberg E., Warwitz B.,
101. Pauwels E., Cleeren F., Tshibangu T., Koole M.,
Virgolini I.J. // Q. J. Nucl. Med. Mol. Imaging. 2010.
Serdons K., Dekervel J., Van Cutsem E., Verslype C.,
Vol. 54, N 1. P. 68-75.
Van Laere K., Bormans G. // Eur. J. Nucl. Med. Mol.
Imaging. 2020. Vol. 47. P. 3033-3046.
88. Veenstra E.B., Brouwers A.H., de Groot D.J.A.,
Hofland J., Walenkamp A.M.E., Brabander T.,
102. Hou J., Long T., He Z., Zhou M., Yang N., Chen D.,
Zandee W.T., Noordzij W. // Eur. J. Hybrid Imaging.
Zeng S., Hu S. // EJNMMI Res. 2021. Vol. 11. P. 55.
2022. Vol. 6, N 1. P. 12.
103. Fersing C., Bouhlel A., Cantelli C., Garrigue P.,
89. Patel M., Tena I., Jha A., Taieb D., Pacak K. // Front.
Lisowski V., Guillet B. // Molecules. 2019. Vol. 24,
Endocrinol. 2021. Vol. 29, N 12. Article 625312.
N 16. P. 2866.
104. Eder M., Schäfer M., Bauder-Wüst U., Hull W.E.,
90. Waldmann C.M., Stuparu A.D., van Dam R.M.,
Wängler C., Mier W., Haberkorn U., Eisenhut M. //
Slavik R. // Theranostics. 2019. Vol. 9, N 5. P. 1336-
Bioconjugate Chem. 2012. Vol. 23, N 4. P. 688-697.
1347.
105. Afshar-Oromieh A., Malcher M., Eder M., Eisenhut M.,
91. Wester H.J., Schottelius M., Scheidhauer K.,
Linhart B., Hadaschik T., Holland-Letz F., Giesel C.,
Meisetschläger G., Herz M., Rau F.C., Reubi J.C.,
Kratochwil S., Haufe U., Haberkorn C., Zechmann C. //
Schwaiger M. // Eur. J. Nucl. Med. Mol. Imaging. 2003.
Eur. J. Nucl. Med. Mol. Imaging. 2013. Vol. 40. P. 486-
Vol. 30. P. 117-122.
495.
92. Schirrmacher R., Bradtmöller G., Schirrmacher E.,
106. Kurash M.M., Gill R., Khairulin M., Harbosh H.,
Thews O., Tillmanns J., Siessmeier T., Buchholz H.G.,
Keidar Z. // Sci. Rep. 2020. Vol. 10, N 1. Article 3109.
Bartenstein P., Wängler B., Niemeyer C.M.,
107. Afshar-Oromieh A., Holland-Letz T., Giesel F.L.,
Jurkschat K. // Angew. Chem. Int. Ed. Engl.
2006.
Kratochwil C., Mier W., Haufe S., Debus N., Eder M.,
Vol. 45, N 36. P. 6047-6050.
Eisenhut M., Schäfer M., Neels O., Hohenfellner M.,
93. Mu L., Höhne A., Schubiger P.A., Ametamey S.M.,
Kopka K., Kauczor H.U., Debus J., Haberkorn U. //
Graham K., Cyr J.E., Dinkelborg L., Stellfeld T.,
Eur. J. Nucl. Med. Mol. Imaging. 2017. Vol. 44, N 8.
Srinivasan A., Voigtmann U., Klar U. // Angew. Chem.
P. 1258-1268.
Int. Ed. Engl. 2008. Vol. 47, N 26. P.4922-4925.
108. Weineisen M., Schottelius M., Simecek J., Baum R.P.,
94. Gower-Fry L., Kronemann T., Dorian A., Pu Y.,
Yildiz A., Beykan S., Kulkarni H.R., Lassmann M.,
Jaworski C., Wängler C., Bartenstein P., Beyer L.,
Klette I., Eiber M., Schwaiger M., Wester H.J. // J.
Lindner S., Jurkschat K., Wängler B., Bailey J.J.,
Nucl. Med. 2015. Vol. 56, N 8. P. 1169-1176.
Schirrmacher R.
// Pharmaceuticals (Basel).
2021.
109. Ларенков А.А., Кодина Г.Е. // Мед. радиология и ра-
Vol. 20, N 14. P. 701.
диац. безопасн. 2017. Т. 62, № 6. С. 58-73.
РАДИОХИМИЯ том 65 № 2 2023
148
КРАСИКОВА
110. Rowe S.P., Gorin M.A., Allaf M.E., Pienta K.J.,
122. Dietlein F., Hohberg M., Kobe C., Zlatopolskiy B.D.,
Tran P.T., Pomper M.., Ross A.E., Cho S.Y. // Prostate
Krapf P., Endepols H., Täger P., Hammes J., Heiden-
Cancer Prostatic Dis. 2016. Vol. 19. P. 223-230.
reich A., Neumaier B., Drzezga A., Dietlein M. // J.
Nucl. Med. 2020. Vol. 61, N 2. P. 202-209.
111. Urso L., Rocca G.C., Borgia F., Lancia F., Malorgio A.,
Gagliano M., Zanetto M., Uccelli L., Cittanti C.,
123. Giesel F.L., Cardinale J., Schäfer M., Neels O.,
Ippolito C., Evangelista L., Bartolomei M. // Bio-
Benešová M., Mier W., Haberkorn U., Kopka K.,
medicines. 2022. Vol. 10, N 10. P. 2463.
Kratochwil C. // Eur. J. Nucl. Med. Mol. Imaging. 2016.
Vol. 43, N 10. P. 1929-1930.
112. Bach-Gansmo T., Nanni C., Nieh P.T., Zanoni L.,
Bogsrud T.V., Sletten H., Korsan K.A., Kieboom J.,
124. Cardinale J., Martin R., Remde Y., Schäfer M.,
Hienzsch A., Hübner S., Zerges A.M., Marx H.,
Tade F.I., Odewole O., Chau A., Ward P.,
Hesse R., Weber K., Smits R., Hoepping A., Müller M.,
Goodman M.M., Fanti S., Schuster D.M., Willoch F. //
Neels O.C., Kopka K. // Pharmaceuticals (Basel). 2017.
J. Urol. 2017. Vol. 197, N 3. Pt 1. P. 676-683.
Vol. 10, N 4. P. 77.
113. Werner R.A., Derlin T., Lapa C., Sheikbahaei S.,
125. Di Iorio V., Boschi S., Sarnelli A., Cuni C., Bianchini D.,
Higuchi T., Giesel F.L., Behr S., Drzezga A., Kimura H.,
Monti M., Gorgoni G., Paganelli G., Matteucci F.,
Buck A.K., Bengel F.M., Pomper M.G., Gorin M.A.,
Masini C. // Pharmaceuticals (Basel). 2021. Vol. 14,
Rowe S.P. // Theranostics. 2020. Vol. 10, N 1. P. 1-16.
N 7. P. 599.
114. Piron S., Verhoeven J., Vanhove C., De Vos F. // Nucl.
126. Giesel F.L., Knorr K., Spohn F., Will L., Maurer T.,
Med. Biol. 2022. Vol. 106-107. P. 29-51.
Flechsig P., Neels O., Schiller K., Amaral H., Weber W.A.,
115. Fendler W.P., Eiber M., Beheshti M., Bomanji J.,
Haberkorn U., Schwaiger M., Kratochwil C., Choyke P.,
Calais J., Ceci F., Cho S.Y., Fanti S., Giesel F.L.,
Kramer V., Kopka K., Eiber M. // J. Nucl. Med. 2019.
Goffin K., Haberkorn U., Jacene H., Koo P.J.,
Vol. 60, N 3. P. 362-368.
Kopka K., Krause B.J., Lindenberg L., Marcus C.,
127. Wurzer A., Di Carlo D., Schmidt A., Beck R., Eiber M.,
Mottaghy F.M., Oprea-Lager D.E., Osborne J.R.,
Schwaiger M., Wester H.-J. // J. Nucl. Med. 2020.
Piert M., Rowe S.P., Schöder H., Wan S., Wester H.J.,
Vol. 61. P. 735-742.
Hope T.A., Herrmann K.
// Eur. J. Nucl. Med. Mol.
128. Wurzer A., Di Carlo D., Herz M., Richter A., Robu S.,
Imaging. 2023. Vol. 50, N 5. P. 1466-1486..
Schirrmacher R., Mascarin A., Weber W., Eiber M.,
Schwaiger M., Wester H.J. // EJNMMI Radiopharm.
116. Chen Y., Pullambhatla M., Foss C.A., Byun Y.,
Chem. 2021. Vol. 6, N 1. P. 4.
Nimmagadda S., Senthamizhchelvan S., Sgouros G.,
129. Oh S.W., Wurzer A., Teoh E.J., Oh S., Langbein T.,
Mease R.C., Pomper M.G. // Clin. Cancer. Res. 2011.
Krönke M., Herz M., Kropf S., Wester H.J., Weber W.A.,
Vol. 17, N 24. P. 7645-7653.
Eiber M. // J. Nucl. Med. 2020. Vol. 61, N 5. P. 702-
117. Szabo Z., Mena E., Rowe S.P. // Mol. Imaging Biol.
709.
2015. Vol. 17. P. 565-574.
130. Malik N., Baur B., Winter G., Reske S.N., Beer A.J.,
118. Bouvet V., Wuest M., Jans H-S., Janzen N., Genady A.R.,
Solbach C. // Mol Imaging Biol. 2015. Vol. 17, N 6.
Valliant J.F., Francois Benard F., Wuest F. // Eur. J.
P. 777-785.
Nucl. Med. Mol. Imaging Res. 2016. Vol. 6. P. 40.
131. Antuganov D.O., Nadporojskii M.A., Kondraten-
119. Dietlein M., Kobe C., Kuhnert G., Stockter S., Fischer T.,
ko Yu.A. // Mendeleev Commun. 2022. Vol. 32. P. 408-
Schomäcker K., Schmidt M., Dietlein F., Zlatopols-
415.
kiy B.D., Krapf P., Richarz R., Stephan Neubauer S.,
132. Maisto C., Aurilio M., Morisco A., de Marino R.,
Drzezga A., Neumaier B. // Mol. Imaging Biol. 2015.
Buonanno Recchimuzzo M.J., Carideo L., D’Ambro-
Vol. 17. P. 575-584.
sio L., Di Gennaro F., Esposito A., Gaballo P. et al. //
120. Rousseau E., Wilson D., Lacroix-Poisson F., Krauze A.,
Molecules. 2022. Vol. 27, N 12. P. 3862.
Chi K., Gleave M., McKenzie M., Tyldesley S.,
133. Loktev A., Lindner T., Mier W., Debus J., Altmann A.,
Goldenberg S.L., Bénard F. // J. Nucl. Med. 2019.
Jäger D., Giesel F., Kratochwil C., Barthe P., Rou-
Vol. 60, N 11. P. 1587-1593.
mestand C., Haberkorn U. // J. Nucl. Med.
2018.
121. Zlatopolskiy B.D., Endepols H., Krapf P., Guliyev M.,
Vol. 59. P. 1423-1429.
Urusova E.A., Richarz R., Hohberg M,, Dietlein M.,
134. Zhao L., Chen J., Pang Y., Fu K., Shang Q., Wu H.,
Drzezga A., Neumaier B. // J. Nucl. Med. 2019. Vol. 60,
Sun L., Lin Q., Chen H. // Theranostics. 2022. Vol. 12,
N 6. P. 817-823.
N 4. P. 1557-1569.
РАДИОХИМИЯ том 65 № 2 2023
ФТОР-18 ИЛИ ГАЛЛИЙ-68
149
135. Giesel F.L., Kratochwil C., Lindner T., Marschalek M.M.,
138. Nader M., Valla D.F., Vriamont C., Masset J., Pacelli A.,
Loktev A., Lehnert W., Debus J., Jäger D., Flechsig P.,
Herrmann K., Zarrad F. // Nucl. Med. Biol. 2022.
Vol. 110-111. P. 37-44.
Altmann A., Mier W., Haberkorn U. // J. Nucl. Med.
139. Giesel F.L., Adeberg S., Syed M., Lindner T., Jiménez-
2019. Vol. 60, N 3. P. 386-392.
Franco L.D., Mavriopoulou E., Staudinger F., Tonndorf-
136. Kratochwil C., Flechsig P., Lindner T., Abderrahim L.,
Martini E., Regnery S., Rieken S. et al. // J. Nucl. Med.
Altmann A., Mier W., Adeberg S., Rathke H., Röhrich M.,
2021. Vol. 62, N 2. P. 201-207.
Winter H., Plinkert P.K., Marme F., Lang M.,
140. Naka S., Watabe T., Lindner T., Cardinale J.,
Kauczor H.U., Jäger D., Debus J., Haberkorn U.,
Kurimoto K., Moore M., Tatsumi M., Mori Y.,
Shimosegawa E., Valla F. Jr., Kato H., Giesel F.L. //
Giesel F.L. // J. Nucl. Med. 2019. Vol. 60, N 6. P. 801-
EJNMMI Radiopharm. Chem. 2021. Vol. 6, N 1. P. 28.
805.
141. Lindner T., Altmann A., Giesel F., Kratochwil C.,
137. Hicks R.J., Roselt P.J., Kallur K.G., Tothill R.W.,
Kleist C., Krämer S., Mier W., Cardinale J.,
Mileshkin L. // J. Nucl. Med. 2021. Vol. 62, N 3. P. 296-
Kauczor H.U., Jäger D., Debus J., Haberkorn U. //
302.
EJNMMI Radiopharm. Chem. 2021. Vol. 6, N 1. P. 26.
РАДИОХИМИЯ том 65 № 2 2023