РАДИОХИМИЯ, 2023, том 65, № 1, с. 70-82
УДК 544.58:544.344:544.723
СТАТИКА И КИНЕТИКА СОРБЦИИ ИОНОВ La(III),
Ce(III), U(VI) НАНОСТРУКТУРИРОВАННЫМ
КОМПОЗИТОМ Al2O3||C
© 2023 г. Е. В. Поляков*, И. В. Волков, В. Н. Красильников, А. А. Иошин
Институт химии твердого тела Уральского отделения РАН,
620990, Екатеринбург, ул. Первомайская, д. 91
*e-mail: polyakov@ihim.uran.ru
Поступила в редакцию 25.07.2022, после доработки 19.10.2022, принята к публикации 26.10.2022
Исследованы сорбционные свойства нового композита Al2O3||C. Особенностью его макроскопической
морфологии и структуры является сформированное в инертной атмосфере аморфное состояние оксида
алюминия в химическом контакте с поверхностью графеноподобного углерода. Это определяет высо-
кую химическую активность в водной среде композита на основе оксида алюминия (ОАК), сравнимую
с активностью α-Al2O3 или гиббсита Al(OH)3. Сорбционные свойства полученного композита по отно-
шению к ионам La(III), Ce(III), U(VI) описаны в рамках модели поверхностного комплексообразования.
Совпадение вычисленных из сорбционного эксперимента и литературных данных по величинам пер-
вой константы гидролиза катионов La(III), Ce(III), U(VI) доказывает адекватность выбранной сорбци-
онной модели. Из модельного описания следует, что сорбционная активность композита вызвана более
высокой константой (K1a) кислотной диссоциации -ОН+surf-групп (pK1a = 3.9) поверхности аморфного
ОАК и сортовыми коэффициентами распределения отдельных гидроксокомплексов исследованных ка-
тионов. Сорбция ионов композитом в растворе гуминовых кислот (ГК) полностью определяется па-
раллельно протекающей реакцией конкурентной сорбции протонированных анионов ГК поверхностью
аморфного ОАК в диапазоне концентрации ГК 10-200 мг/л. Al2O3||C является эффективным сорбентом
микроколичеств La(III), Ce(III), U(VI), их химических аналогов, а также гуминовой кислоты в природ-
ных и технологических растворах с низким солевым фоном.
Ключевые слова: Al2O3||C, композит, Al(III) оксиды, ионы La(III), Ce(III), U(VI), сорбция, статика, ки-
нетика, гуминовые кислоты.
DOI: 10.31857/S0033831123010100, EDN: OHQPIA
ВВЕДЕНИЕ
ных данных по свойствам полученных в послед-
нее десятилетие неорганических наноматериалов
Наличие тяжелых металлов и радионуклидов в
показывает стремление к созданию экономичных
загрязненных водах является экологической про-
и экологически приемлемых материалов для удале-
блемой в связи с их высокой и долгосрочной ток-
ния ионов тяжелых металлов и радионуклидов из
сичностью. Примеси радиоактивных элементов в
водных объектов природной среды с высоким ко-
промышленных сточных водах наносят непоправи-
эффициентом распределения. Это наноматериалы
мый ущерб почве, растениям и животным. Для ре-
и композиты из оксидов железа, марганца, цинка,
шения этой проблемы привлекают новые и все бо-
титана в виде частиц разной формы, углеродные
лее совершенные методы очистки сточных вод, что
наноструктуры с сильно развитой поверхностью,
требует дополнительных финансовых затрат. Сорб-
оксидно-углеродные нанокомпозиты, а также по-
ционные методы являются наиболее удобными при
лимерные органические наноадсорбенты. Отмечен
удалении тяжелых металлов и радионуклидов из
интерес к использованию композитных сорбентов,
водных сред. Они применимы в широком диапазоне
полученных обработкой наночастиц диоксида ти-
кислотности и при достаточно низких концентра-
тана растворами гуминовых кислот в целях увели-
циях элементов-загрязнителей. Обзор литератур-
чения разнообразия функциональных групп на его
70
СТАТИКА И КИНЕТИКА СОРБЦИИ ИОНОВ La(III), Ce(III), U(VI)
71
поверхности. В качестве существенного недостатка
нанодисперсных сорбентов для очистки водных рас-
нанодисперсных сорбентов авторы работы [1] выде-
творов от ионов тяжелых металлов: Cr(VI), Pb(II),
ляют нестабильность таких материалов, их стрем-
Cd(II), Ni(II), Eu(III), Cm(III), U(VI) и др. [12-17].
ление к агрегированию, коагуляции с потерей пре-
С появлением технологически доступных способов
имуществ по удельной поверхности и активности.
синтеза ультрадисперсных графеноподобных форм
Применение наночастиц в качестве фильтрующей
углерода возникло стремление объединить положи-
среды ставит очень высокие требования к аппара-
тельные свойства оксида алюминия и углерода в од-
турно-технологическому оформлению сорбционно-
ном материале условного состава Al2O3||C [18-20].
го процесса как в статике, так и при динамическом
В сравнении с нанодисперсным оксидом алюминия
режиме сорбции. Поэтому развитие неорганиче-
оксидно-углеродные нанокомпозиты могут иметь
ских сорбционных приложений всегда связывают
микронные размеры зерна и лучшие фильтрацион-
с созданием гранулированных материалов, которое
ные характеристики при сохранении сорбционной
позволяет сочетать сорбционную специфичность
активность к ионам токсичных и радиоактивных
с улучшенными гидродинамическими и диффузи-
элементов в водных растворах. Вместе с тем, син-
онными характеристиками материалов [2]. Несмо-
тез таких материалов обычно представляет собой
тря на интенсивный поиск новых сорбционных
длительный многостадийный процесс, неблаго-
материалов, основные тенденции в развитии не-
приятный для крупномасштабного производства.
органических сорбентов говорят о существовании
В работах [21, 22] нами представлен новый способ
устойчивого научного и технологического интереса
синтеза композитного материалов Al2O3||C, преи-
к четырем основным группам адсорбционных мате-
муществами которого являются технологическая
риалов. Среди них активированный уголь, цеолиты,
простота, экономичность и возможность масшта-
силикагели и оксид алюминия [3]. Оксид/гидроксид
бирования. Сорбционные характеристики таких на-
алюминия обладает амфотерными свойствами, что
нокомпозитов по отношению к ионам лантанидов и
позволяет применять его для выделения из раство-
актинидов показали существенные преимущества в
ров как катионов, так и анионов. Высокие значения
сравнении с ранее синтезированными оксидными и
удельной поверхности и сродства к ионам As(III/V),
углеродными сорбентами [18-20].
P(V), Se(IV/VI), F-, U(VI), низкая цена и простота
Описание механизмов сорбции гидратирован-
применения делает оксид алюминия одним из при-
ных оксидов/гидроксидов алюминия на молекуляр-
влекательных сорбентов в своем классе для вы-
ном уровне основано на представлениях о поверх-
деления вредных элементов из воды [4], а также
ностной протолитической диссоциации связанных
иммобилизации делящихся материалов для после-
с металл-оксидной решеткой молекул воды и со-
дующей долговременной выдержки [5]. В обзоре
вместном участии двух фундаментальных механиз-
[6] изложены результаты исследования сорбентов
мов в межфазном распределение сорбируемых ио-
на основе нанодисперсных форм оксида алюминия,
нов: гетерогенного ионообменного взаимодействия
оценен потенциал и перспективы их использова-
и поверхностного комплексообразования ол-, оксо-,
ния для очистки воды от различных загрязнителей,
гидроксо- и гидроксониевых групп с отдельными
приведена информация о составе, условиях синтеза
ионно-молекулярными формами сорбата [23-30].
сорбентов и механизмах сорбции большой группы
Адсорбционное поведение оксидов/гидроксидов
катионов и анионов. Причем авторы работы [6] ак-
алюминия носит сложный характер, зависит от по-
центируют внимание на отсутствии в настоящее
верхностных характеристик адсорбента, состава и
время обобщающих представлений о реакционной
ионной силы электролита, а также физико-хими-
способности существующих наноразмерных форм
ческих форм состояния сорбируемых ионов [31].
оксида алюминия. Свежие примеры применения и
Применение экспериментальных методов сорбции
исследования нанодисперсного оксида алюминия
совместно с термодинамическим и квантово-хими-
в качестве сорбента можно найти в работах [7-10].
ческим моделированием взаимодействий катионов
Активированный уголь, известный как универ-
сорбата с гидроксилированной поверхностью окси-
сальный адсорбент газов [11], по настоящее время
да алюминия позволило детализировать информа-
используют в качестве структурного мотива ряда
цию о равновесных механизмах сорбции отдельных
РАДИОХИМИЯ том 65 № 1 2023
72
ПОЛЯКОВ и др.
композита. Дополнительный практический интерес
представляла оценки влияния гуминовых кислот,
как возможных естественных примесей в очища-
емой воде, на механизм и равновесные характери-
стики сорбции выбранных лантаноидов и актинои-
дов нано-композитом Al2O3||C.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез сорбента. Синтез композита Al2O3||C
проводили термическим разложением прекурсора,
который получали термообработкой раствора ни-
трата алюминия Al(NO3)3·9H2O в этиленгликоле
[21, 22]. Образовавшийся гомогенный раствор на-
Рис. 1. СЭМ-изображение морфологии образца компози-
гревали при 120°C до образования объемной вязкой
та Al2O3||C, синтезированного нагреванием прекурсора в
атмосфере гелия при 700°C. На вставке показан фрагмент
массы и далее белого порошка (прекурсора). Ком-
ПЭМ-изображения наночастиц композита, цена деления
позит общего состава Al2O3||C получали нагревом
10 нм.
прекурсора в атмосфере гелия при 700°C в течение
1 ч. Согласно данным элементного и термограви-
химических форм катионов поверхностью Al2O3
метрического анализа, полученный композит со-
и вероятных способах координации сорбирован-
держит 23.6 мас% свободного углерода. Анализ
ных гидратированных катионов с гидроксильным
порошка композита Al2O3||C методом сканирующей
окружением поверхности оксигидратной матри-
электронной микроскопии показал, что он состоит
цы. Расчетными методами показано, что с энерге-
из сферических агрегатов с размером 100-150 нм
тической точки зрения более вероятна адсорбция
(рис. 1). По данным просвечивающей электронной
внутрисферных комплексов катионов в сравнении
микроскопии (ПЭМ) высокого разрешения, эти
с внешнесферными. Установлено изменение крат-
агрегаты собраны из однородных частиц без выра-
ности связи катион-кислород в присутствии катио-
женных границ раздела фаз (рис. 1, вставка).
нов-конкурентов, степень их воздействия на состав
Сорбционные эксперименты. Статику и кине-
сорбционных комплексов Eu(III), Cm(III) [32-36]. В
тику сорбции ионов La(III), Ce(III), U(VI) прово-
отличие от индивидуальных оксидных и углерод-
дили с образцами рентгеноаморфного композита,
ных фаз, сведения о механизмах проявления сорб-
нагретого в атмосфере гелия до 700°C в течение
ционной активности композитов Al2O3||C немного-
1 ч. Подготовленный таким образом материал имел
численны и касаются лишь композитов с углеродом
удельную поверхность (по данным адсорбции азо-
в форме окисленного графена и углеродных нано-
та) 90.0 м2/г. Сорбционную активность синтезиро-
трубок [19, 37, 38]. Поскольку именно композиты
ванного материала исследовали методом ограничен-
обладают повышенной сорбционной активностью,
ного объема по отношению к ионам Ce(III), La(III),
представляло интерес установить элементы меха-
U(VI), химические свойства которых позволяли
низма, которые могут являться причинами повыше-
имитировать условия выделения микроколичеств
ния химической активности синтезированных нами
ионов актиноидов в радиоактивных технологиче-
оксидно-углеродных сорбентов [22].
ских и природных растворах низкой активности.
Целью исследования являлось получение экс-
Рабочие растворы готовили из реактивов квали-
периментальных данных, характеризующих ста-
фикации ос.ч. UO2(CH3COO)2·2H2O, LaCl3·7H2O,
тику и кинетику сорбционного поведения оксид-
CeCl3·6H2O, использовали аналитически чистую
но-углеродного сорбента Al2O3||C по отношению к
азотную кислоту. Деионизированную воду поуча-
катионам Ce(III) и La(III), U(VI) и установление с
ли на установке Millipore Simplicity. Электролитом
их помощью элементов механизма сорбции катио-
служил раствор 0.01 М аналитически чистого NaCl.
нов поверхностными функциональными группами
Исходные концентрации La(III) и Ce(III) составля-
РАДИОХИМИЯ том 65 № 1 2023
СТАТИКА И КИНЕТИКА СОРБЦИИ ИОНОВ La(III), Ce(III), U(VI)
73
ли 0.015 ммоль/л, U(VI) - 0.001 ммоль/л. Растворы
экспериментов время, необходимое для дости-
с сорбентом Al2O3||C массой 50 мг выдерживали в
жения эмпирического равновесия и параметры
пробирках из полиэтилена высокого давления ем-
формальной кинетики растворения композита
костью 75 мл в течение заданного времени при пе-
Al2O3||C (рис. 2, 3).
риодическом перемешивании. Кинетику сорбции
Термодинамическое моделирование. Экспери-
исследовали в пробирках с одинаковым составом
ментальные данные в виде зависимости общего ко-
раствора и концентрацией сорбента. Через заданные
эффициента распределения (Kd) катиона от показа-
промежутки времени сорбент и электролит разде-
телей состава раствора сравнивали с результатами
ляли фильтрацией, осадок на беззольных фильтрах
термодинамического моделирования (программа
с сорбентом высушивали, сжигали в муфельной
HSC Chemistry v. 8, MathCad v.15) растворимости
печи на воздухе, остатки растворяли в 0.1 М HNO3.
отдельных фаз Al2O3-Al(OH)3-AlOOH, полей пре-
Затем измеряли содержание исследуемого катиона
обладания отдельных комплексных ионов в коорди-
в фильтратах и в полученных от растворения сор-
натах С/С0-рН с учетом табулированных термоди-
бента растворах. Третью серию растворов получали
намических данных, рис. 4 [40, 41]. Сорбционные
после десорбции катионов сорбата со стенок про-
равновесия с участием композита зависят от хими-
бирок 5 M HCl. Эта серия характеризовала возмож-
ческой устойчивости составляющих его фаз окси-
ный побочный процесс сорбции катиона стенками
дов/гидроксидов Al(III). Чтобы установить закон
пробирки. Таким образом, контролировали баланс
распределения, сорбционное сродство и емкость
массы определяемого катиона в каждой серии экс-
композита Al2O3||C к отдельным ионам La(III),
периментов. Статика сорбции отличалась от кине-
Ce(III) и U(VI), были получены изотермы сорбции
тических экспериментов тем, что каждый раствор
в области рН, в которой растворимостью композита
в серии выдерживали 4-5 сут при перемешивании
в закрытых пробирках, исключавших испарение
можно пренебречь (С/С0 ≈ 0), рис. 4, 5.
электролита. Далее сорбент отделяли с помощью
бумажного фильтра и промывали дистиллирован-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
ной водой. Температуру растворов поддерживали
на уровне 23°C с помощью термостата. Беззоль-
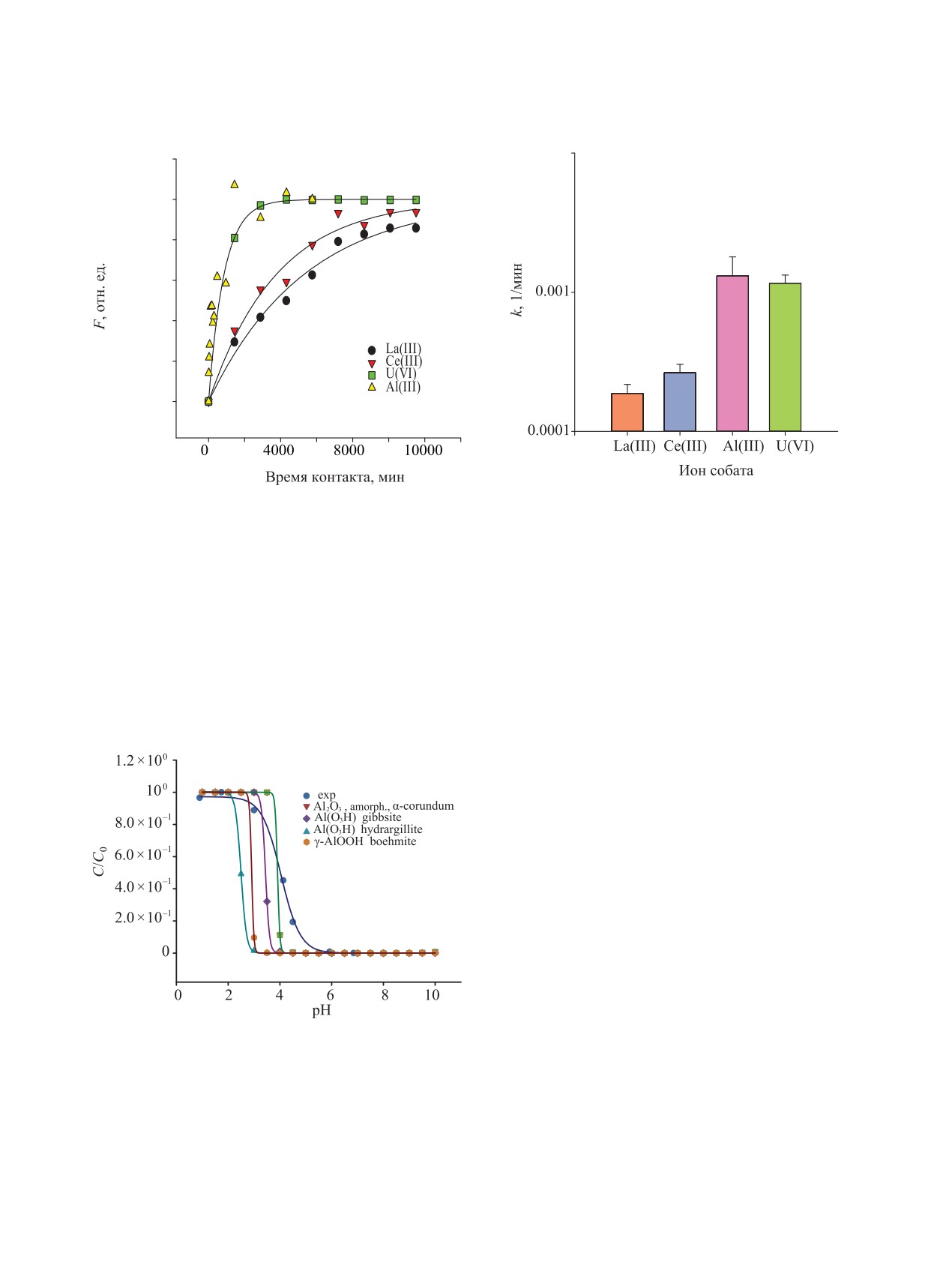
Из сравнения экспериментальной раствори-
ные фильтры с сорбентом высушивали, сжигали в
мости композита по ионам Al(III) с термодинами-
муфельной печи на воздухе, остатки растворяли в
ческой растворимостью известных фаз оксидов и
0.1 М HNO3. Возможные потери микроэлементов
гидроксидов алюминия видно, что растворимость
контролировали в смывах со стенок полиэтилено-
исследуемого рентгеноаморфного композита по ио-
вых пробирок раствором 5 M HCl. В полученных
нам Al(III) наиболее близка к α-Al2O3 и аморфному
растворах, а также в фильтратах измеряли концен-
Al(OH)3 (рис. 4). Это не противоречит полученным
трацию (Х, мг/л) La(III), Ce(III) и U(VI) с помо-
ранее данным КР-спектроскопии композита [21].
щью масс-спектрометра Elan 9000 (Perkin Elmer).
Особенности кинетики сорбции микроэлементов
Концентрацию Al(III) в растворах (С, мг/л) изме-
композитом в условиях химической растворимости
ряли методом атомно-эмиссионной спектрометрии
оксида алюминия (рис. 2) показывают, что процесс
(Optima 8000, Perkin Elmer). Полученные модель-
установления равновесия в растворе протекает в
ные изотермы сорбции микроэлементов анализи-
две стадии. На первой стадии (отмечено замкнутой
ровали как функцию рН, концентрации сорбента
линией на рис. 2, время контакта - менее 1500 мин)
(отношения массы сорбента к объему раствора) и
растворение оксида сопровождается сильным изме-
концентрации гуминовых кислот (ГК) в растворе.
нением рН раствора из-за перехода в раствор ионов
ГК готовили путем растворения навески реактива
Al(III) и некоторой десорбции первоначально сор-
(Sigma-Aldrich [39]) в щелочном растворе фоново-
бированных ионов La(III), Ce(III). На второй ста-
го электролита с последующей нейтрализацией го-
дии (время контакта - более 1500 мин) растворение
могенного раствора до заданного значения рН. Для
прекращается, устанавливается постоянное значе-
корректного описания сорбционных равновесий
ние рН (5.5-5.9) и скорость переноса ионов La(III),
мы предварительно установили из кинетических
Ce(III), U(VI) в композит следует закону формаль-
РАДИОХИМИЯ том 65 № 1 2023
74
ПОЛЯКОВ и др.
2.5 × 10-1
2.0 × 10-1
1.5 × 10-1
10-1
5.0 × 10-2
0
7 × 10-1
6 × 10-1
5 × 10-1
4 × 10-1
3 × 10-1
2 × 10-1
10-1
0
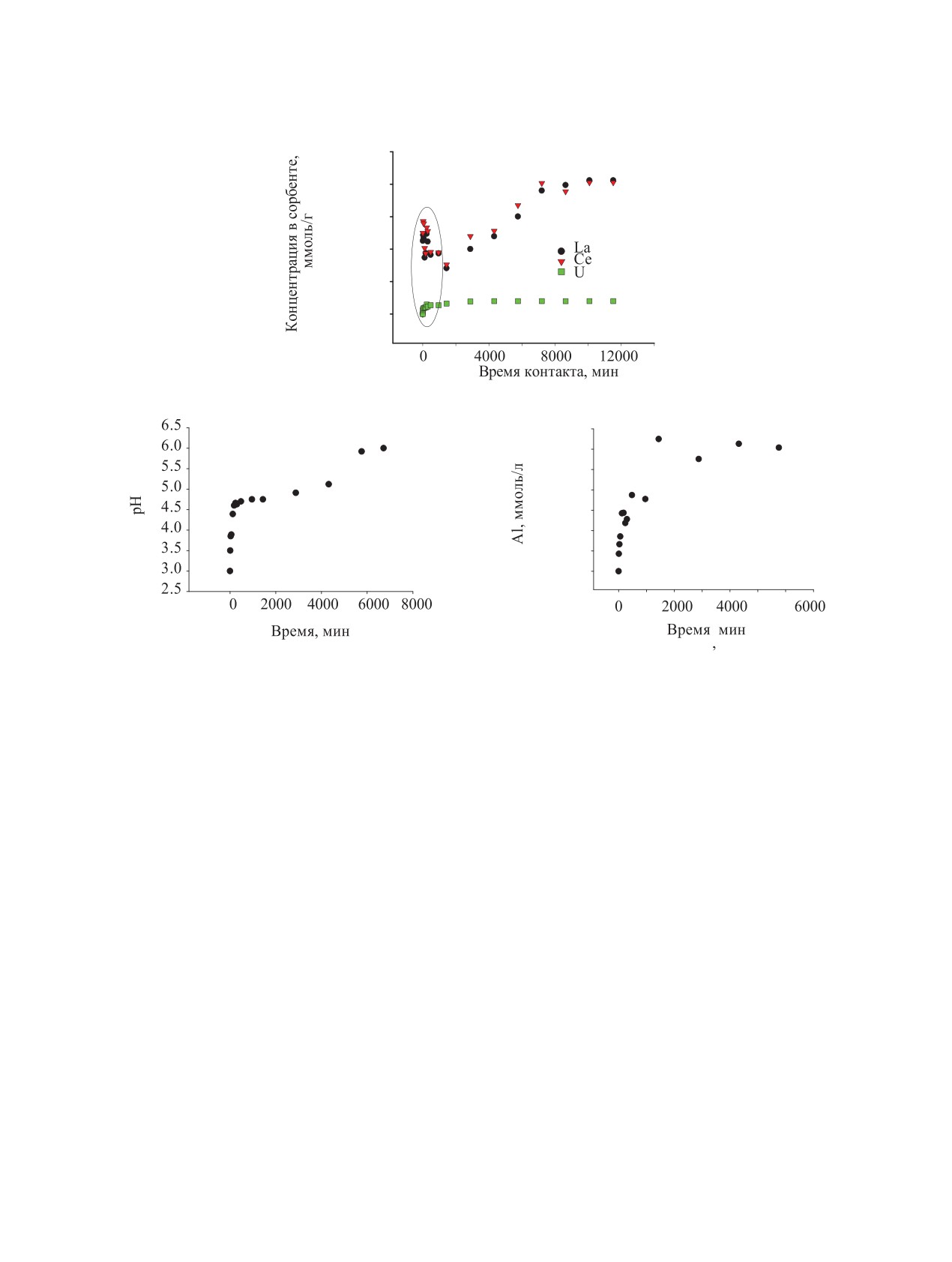
Рис. 2. Зависимость сорбции La(III), Ce(III), U(VI) из раствора NaNO3 композитом Al2O3||C от времени контакта фаз. Для
сравнения приведено изменение кислотности и концентрации Al(III) в растворе в процессе сорбции (рН 3-6). Масса сорбен-
та 50 мг, объем раствора 60 мл, T = 23°С. Выделена область концентрации, связанная с частичным растворением сорбента
в начальный момент времени.
ной кинетики необратимой реакции 1-го порядка по
ем кинетического равновесия между отдельными
ионам сорбата, рис. 3. Найденные для ионов La(III),
химическими формами катиона сорбата в процес-
Ce(III) коэффициенты скорости сорбции почти на
се установления общего сорбционного равнове-
порядок ниже скорости накопления ионов U(VI)
сия [25]. Кинетический анализ такого механизма
в композите и скорости выделения ионов Al(III) в
при наличии различных независимых маршрутов
раствор за счет растворения оксидного компонента
переноса микрокомпонента из раствора в сорбент
композита. Полученные данные были использованы
показал [42], что перегибы на изотермах статики
для учета ограниченной растворимости композита,
и кинетики сорбции вызваны установлением ква-
т.е. изменения его массы в равновесном растворе,
зистационарного состояния в таких системах за
при интерпретации данных по кинетике и равно-
счет сочетания быстрых и медленных химических
весной статике сорбции катионов в области рН < 6.
реакций по отдельным сорбционным маршрутам.
Стадийный характер сорбции проявляется в
Причиной появления квазистационарного состо-
форме изотерм S([m]), (S = 1 - X/X0), где X, X0 -
яния в процессе сорбции может быть также изме-
равновесная и начальная концентрации (моль/л)
нение рН раствора в результате ограниченного по
сорбируемого катиона, в условиях переменного от-
времени химического или коллоидно-химического
ношения массы композита к объему раствора [m].
растворения сорбента (оксида алюминия), а также
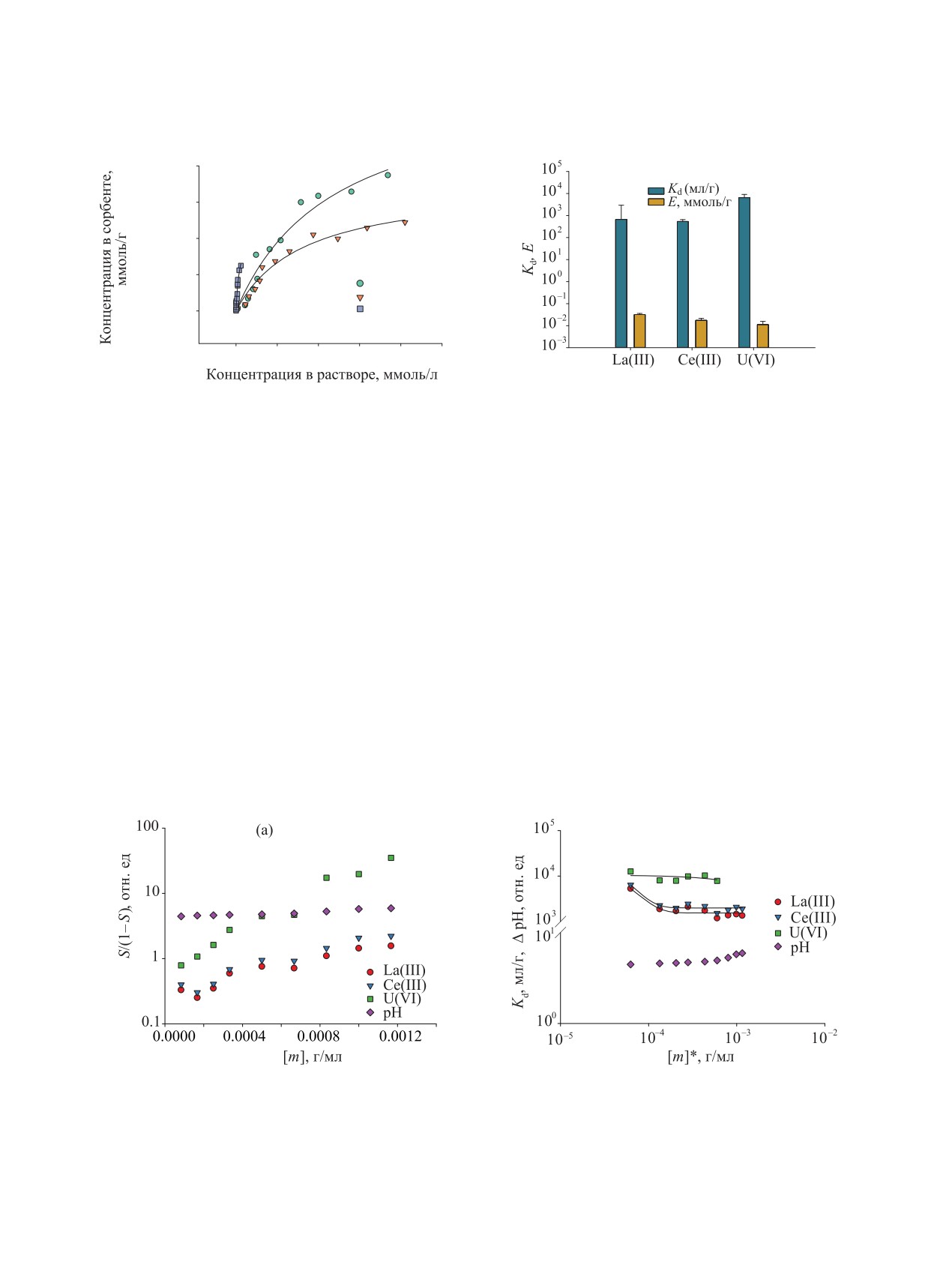
Экспериментальные изотермы [S/(1 - S)]-[m] имеют
замедленное восстановление концентрации сорб-
нелинейный характер (рис. 6). Появление перегиба
ционных комплексов при обновлении поверхности
на изотермах этого типа связывают с отсутстви-
сорбента [43]. Изменение рН действительно наблю-
РАДИОХИМИЯ том 65 № 1 2023
СТАТИКА И КИНЕТИКА СОРБЦИИ ИОНОВ La(III), Ce(III), U(VI)
75
(а)
0.01
(б)
1.2 × 100
100
8 × 10-1
6 × 10-1
4 × 10-1
2 × 10-1
0
Рис. 3. (а) - сорбция катионов в координатах реакции псевдо-первого порядка (F - степень превращения при времени кон-
такта t > 1500 мин, линии - результат аппроксимации); (б) - коэффициент k, характеризующий скорость сорбции La(III),
Ce(III), U(VI) или растворения композита Al2O3||C [по ионам Al(III)] в сопоставимых условиях статики сорбции. Масса сор-
бента 50 мг, объем раствора 60 мл. Начальная концентрация компонентов (моль/л): La(III), Ce(III) 1.5 × 10-5, U(VI) 1.0 × 10-6,
Al(III) 1.20 × 10-3; рН 5.5-6.0; T = 23°С.
дается в процессе сорбции в исследуемой системе
ионов Al(III) в растворе (мг/л), рис. 4. Вычисление
(рис. 6, а). Чтобы учесть связанное с ним измене-
истинного равновесного отношения массы компо-
нием массы сорбента при построении зависимости
зита (m*) к объему раствора (v), [m]* = m*/v = [m]
общего коэффициента распределения (Kd), сорбци-
(1 - C/C0), проводили с использованием экспе-
онной емкости композита (Е, ммоль/г) от [m] и дру-
риментально найденной кривой растворимости
гих параметров состава раствора и сорбента, мы ис-
С/С0-рН. Полученные с учетом растворимости ком-
пользовали эмпирическую зависимость (C/C0-pH),
позита изотермы сорбции (рис. 6, б) показывают,
где C, C0 - текущая и равновесная концентрации
что в выбранном диапазоне [m]* и рН межфазное
распределение каждого из катионов подчиняется
закону Генри, Kd не зависит от [m]*, и форма изо-
терм соответствует модели Ленгмюра для энерге-
тически однородного сорбента (рис. 5). Различие
в начальной концентрации La(III), Ce(III) и U(VI)
объясняет некоторый рост Kd при уменьшении мас-
сы сорбента в диапазоне [m]* < 10-4 г/мл (рис. 6).
Для более детального описания сорбционных рав-
новесий в системах композит Al2O3||C-катионы
La(III), Ce(III), U(VI) мы использовали область кон-
центраций микроэлементов (рис. 5), для которой
выполнялся закон Генри (X ≤ 1.5 × 10-5 моль/л).
Непосредственную информацию о химическом
Рис. 4. Диаграмма растворимости оксидов и гидроксидов
характере взаимодействия ионов La(III), Ce(III)
Al(III) в условиях сорбционного эксперимента, по дан-
и U(VI) с сорбционными центрами композита
ным термодинамического моделирования. Точки - дан-
Al2O3||C содержат данные о влиянии рН на Kd ка-
ные эксперимента; C, C0 - текущая и максимальная рав-
тионов в растворе. Композит состоит из двух сор-
новесные концентрации ионов Al(II) в растворе (мг/л),
масса композита Al2O3||C m = 50 мг, объем раствора v =
бционно-активных фаз [17, 44]. Одна из них - на-
60 мл, T = 23°С [40, 41].
нодисперсный гидратированный оксид α-Al2O3
РАДИОХИМИЯ том 65 № 1 2023
76
ПОЛЯКОВ и др.
(а)
(б)
2 × 10-2
1.5 × 10-2
10-2
5 × 10-3
La
Ce
0
U
0.00
0.02
0.04
0.06
0.08
0.10
Рис. 5. (а) - изотермы сорбции La(III), Ce(III), U(VI) композитом Al2O3||C, электролит 0.01 M NaCl, pH 5.0-5.5, T = 23°С.
Параметры изотермы Ленгмюра сорбции ионов La(III), Ce(III), U(VI) композитом Al2O3||C при рН 5.5-5.9, T = 23°С. (б) - Kd,
E - коэффициент распределения и сорбционная емкость композита. Пояснения в тексте.
и/или аморфный Al(OH)3, другая - аморфный гра-
положительный заряд, одноименный с зарядом сор-
феноподобный углерод. Согласно диаграмме рас-
бируемых катионов [45, 46].
творимости композита (рис. 4), графеноподобный
Примеры изотерм сорбции ионов La(III), Ce(III),
углерод проявляет свои индивидуальные свойства
U(VI) композитом Al2O3||C в зависимости от рН
при рН < 3, где гидроксид алюминия неустойчив и
приведены на рис. 7 и 8. Изотермы в логарифмиче-
ских координатах представляют собой сигмаобраз-
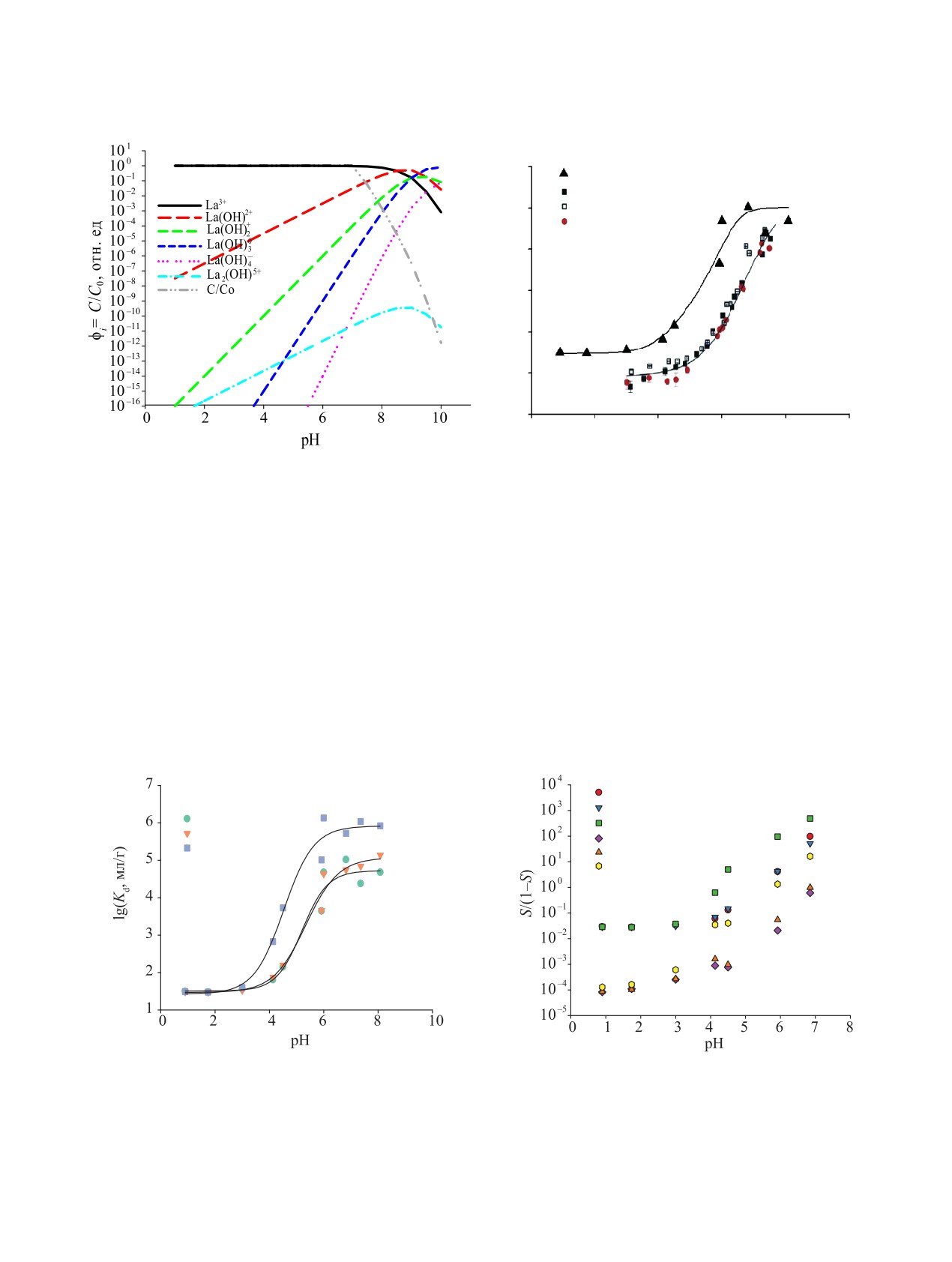
полностью растворяется. На рис. 7 в качестве при-
ные кривые, переход которых из области низких
мера показано изменение состава разносорбирую-
Kd в область насыщения расположен в диапазоне
щихся ионов La(III), определяющее форму изотер-
рН 5-8, включающем область точки нулевого заря-
мы Kd-рН сорбции La(III) композитом. Видно, что в
да α-Al2O3 [28, 31, 36]. Отметим, что для чистых ок-
области рН < 4 в растворе преобладают ионы La3+ и
сидных фаз область постоянного Kd при рН < 4 от-
La(OH)2+ и характерный для их взаимодействия с
сутствует, поскольку в ней фаза α-Al2O3/аморфный
композитом Kd ~101.5 мл/г не зависит от рН. Наблю-
Al(OH)3 термодинамически неустойчива (рис. 4).
даемое поведение характерно для аморфного угле-
Анализ полученных изотерм мы выполнили,
рода и родственных графеноподобных углеродных
используя представления о поверхностном ком-
материалов, поверхность которых при рН < 4 имеет
плексообразовании ионов сорбата с одной или
(б)
Рис. 6. (а) - изотермы сорбции (S) микроэлементов композитом Al2O3||C в зависимости от [m] без учета изменения массы m
сорбента ([m] = m/v) вследствие его частичного растворения и изменения рН. (б) - изменение Kd сорбции ионов La(III), Ce(III),
U(VI) в зависимости от действительного отношения массы m* композита к объему раствора (v), [m]* = m*/v. рН 4.5-5.9, T =
23°С.
РАДИОХИМИЯ том 65 № 1 2023
СТАТИКА И КИНЕТИКА СОРБЦИИ ИОНОВ La(III), Ce(III), U(VI)
77
(а)
(б)
6
Al2O3||C-La(III)
1E-5 M Eu
5E-6 M Eu
5
5E-6 M Eu + 5E-6 M Y
4
3
2
1
0
0
2
4
6
8
10
pH
Рис. 7. (а) - диаграмма состояния ионов La(III) в растворе, построенная по термодинамическим данным [41, 47, 48].
(б) - изотермы сорбции микроколичеств ионов La(III) композитом Al2O3||C. Отношение массы к объему [m] = 0.93 мг/мл,
концентрация NaCl 0.01 М, T = 23°С. Время сорбции 4 сут. Линия - результат применения модели (3): сорбируются части-
цы M3+, M(OH)2+ и M(OH)+. Для сравнения приведены изотермы [36] сорбции Eu(III), Y(III) осадком α-Al2O3, [m] = 5 мг/мл.
двумя типами ОН-групп поверхностных моле-
стояния поверхностных атомов гидратированного
кул воды оксида алюминия [29, 30]. Зависимость
оксида γ-Al2O3, выполненная методом рентгенов-
поверхностного заряда от рН единообразна для
ской фотоэлектронной спектроскопии (XPS), пока-
всех кристаллических форм оксида алюминия: в
зывает [38], что присутствие в спектрах O1s кисло-
кислой области ниже рН изоэлектрической точ-
рода широкой линии, состоящей из пиков при 532.2,
ки (α-Al2O3 8.4-9.4, γ-Al2O3 7.8-9.7 [31, 47]) про-
531.6 и 530.7 эВ, можно приписать к состоянию
исходит адсорбция протонов, частичная анионная
кислорода связей Al-O-, Al-OH0 и Al-OH+ молекул
компенсация поверхностного заряда и параллельно
химически сорбированной воды [38]. Считается,
протекает частичное растворение поверхности ок-
что химическое взаимодействие гидроксилирован-
сида алюминия. Интерпретация электронного со-
ной поверхности оксида алюминия (плоскости 100,
(а)
(б)
La(Al2O3)
Ce(Al2O3)
La(III)
Ce(III)
U(Al2O3)
U(VI)
La(wall)
U(wall)
Рис. 8. (а) - зависимость Kd La(III), Ce(III), U(VI) от рН при сорбции композитом Al2O3||C. Объем раствора 75 мл, масса
сорбента 70 мг, NaCl 0.01 М, T = 23°С. Время сорбции 4 сут. Линии - результат моделирования сорбции по механизму по-
верхностного комплексообразования с участием ионных частиц растворе M(z), M(OH)(z-1) и M(OH)(z-2), M = La(III), Ce(III),
U(VI). При вычислении Kd учитывали зависимость растворимости оксида алюминия от рН. (б) - оценка влияния сорбции
стенкой реактора (wall) на параметры изотерм сорбции La, Ce, U композитом Al2O3||C.
РАДИОХИМИЯ том 65 № 1 2023
78
ПОЛЯКОВ и др.
110) осуществляется через координацию акваком-
плексов OH-группами. Так, результаты экспери-
ментального анализа и компьютерного моделиро-
вания состояния гидроксилированной поверхности
и механизма взаимодействия гидроксильных групп
оксида алюминия на примере взаимодействия с ио-
нами UO22+ подтверждают, что взаимодействие ка-
тионов происходит с одной, или двумя типами ОН-
групп путем замещения внутрисферных молекул
воды. Наиболее общим [27, 31, 47-49] считается
механизм поверхностного комплексообразования c
группой Al-OH по реакции
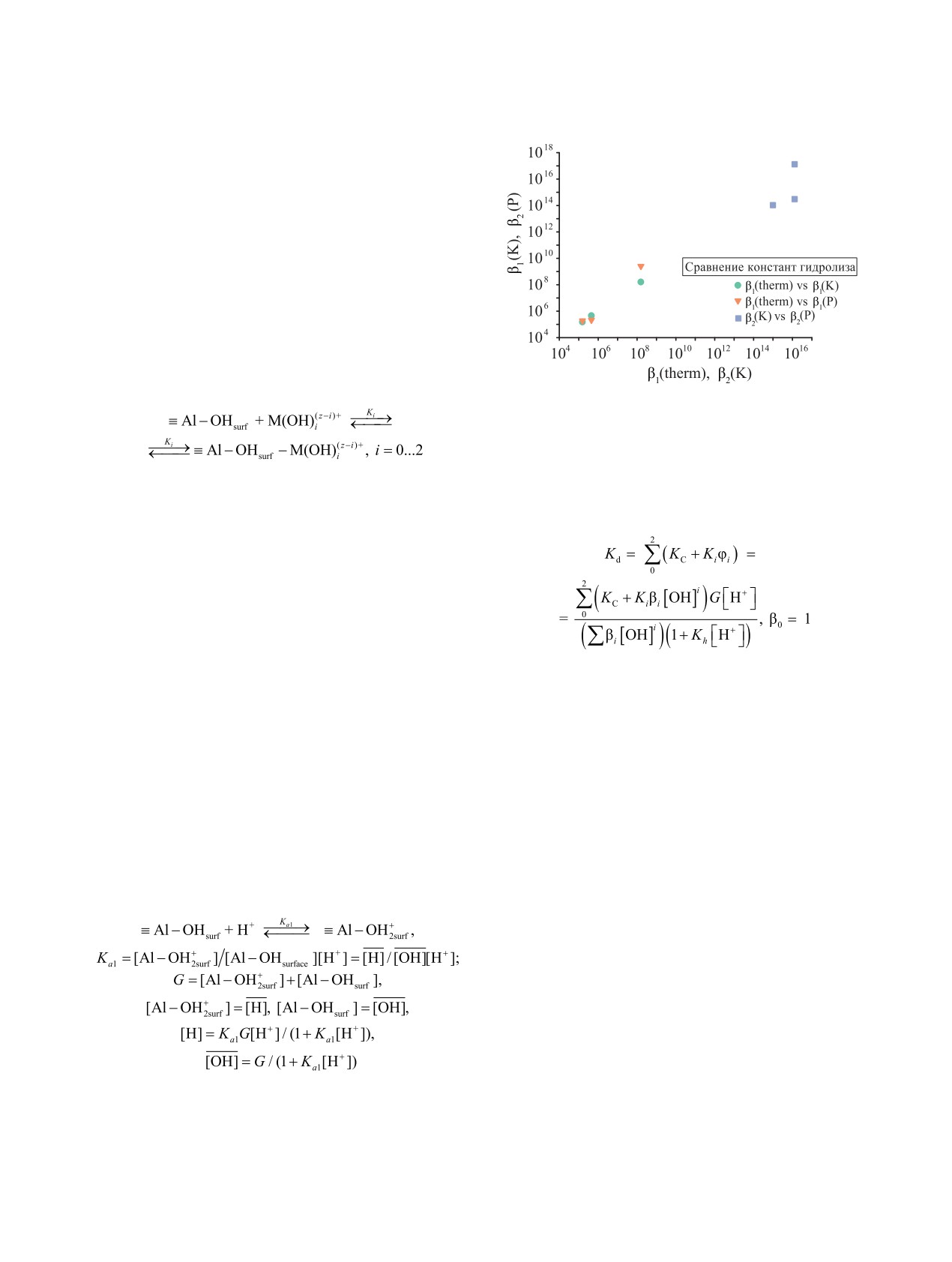
Рис. 9. Сравнение результатов расчета первой констан-
ты устойчивости β1(K) гидроксокомплексов La(III),
Ce(III), U(VI) по модели и данных литературы [41, 47,
,
(1)
48] (β1(therm)). Для сравнения приведены вычисленные
значения второй константы гидролиза β2 из данных по
означает одну или две
сорбции композитом (K) и стенкой полиэтиленового ре-
в которой символ Al-OHsurf
актора (Р), табл. 1.
концевые группы гидроксильных ионов, связанных
с атомом алюминия поверхности. В области рН
ниже изоэлектрической точки поверхность имеет
положительный заряд из-за адсорбции протонов и
частичного растворения поверхности оксида алю-
миния по гетерогенным реакциям (2) [29, 30].
,
(3)
Этой интерпретации мы придерживались при
анализе экспериментальных изотерм сорбции
где [H+] - концентрация водородных ионов в рас-
La(III), Ce(III), U(VI). Рис. 7, а показывает, что в об-
творе сорбата, G - сорбционная емкость композита
ласти рН < 3, в которой оксид алюминия сорбента
Al2O3||C, KC - предполагаемый коэффициент рас-
Al2O3||C растворяется нацело, коэффициент распре-
пределения аква-ионов микрокомпонента на угле-
деления сохраняется постоянным за счет неспеци-
роде композита, Ki - сортовые коэффициенты рас-
фической сорбции аква-ионов поверхностью амор-
пределения, ϕi - мольные доли комплексных ионов
фного графеноподобного углерода [45, 46]. Так как
сорбата-микрокомпонента в растворе, βi - констан-
углерод композита, согласно данным КР-спектро-
ты устойчивости i-го гидроксокомплекса. Общей
скопии [21], не имеет поверхностных протонных
проблемой регрессионного анализа эмпирических
групп, способных к обмену, в модели (2) соответ-
данных в форме рациональных функций является
ствующий коэффициент распределения KC принят
накопление погрешности по результатам косвен-
постоянным и не зависящим от рН раствора.
ных измерений. Это приводит к большим абсолют-
ным погрешностям оцениваемых параметров [50].
Для вычисления коэффициентов при уравнении (3)
мы использовали логарифмическое преобразование
независимой X = -lg[H+] и зависимой Y = lgKd пе-
ременных для снижения дисперсии оцениваемых
коэффициентов нелинейного уравнения [51]. Точеч-
ные оценки коэффициентов модели (1)-(3), найден-
(2)
ные нелинейным методом наименьших квадратов,
Уравнение для брутто-коэффициента распреде-
приведены в табл. 1.
ления (Kd) реакций сорбции гидроксокомплексов в
Вычисленные параметры сорбции рассматри-
диапазоне рН 2-8 запишем в виде [25, 42]
ваемых катионов по модели (2)-(3) позволили ко-
РАДИОХИМИЯ том 65 № 1 2023
СТАТИКА И КИНЕТИКА СОРБЦИИ ИОНОВ La(III), Ce(III), U(VI)
79
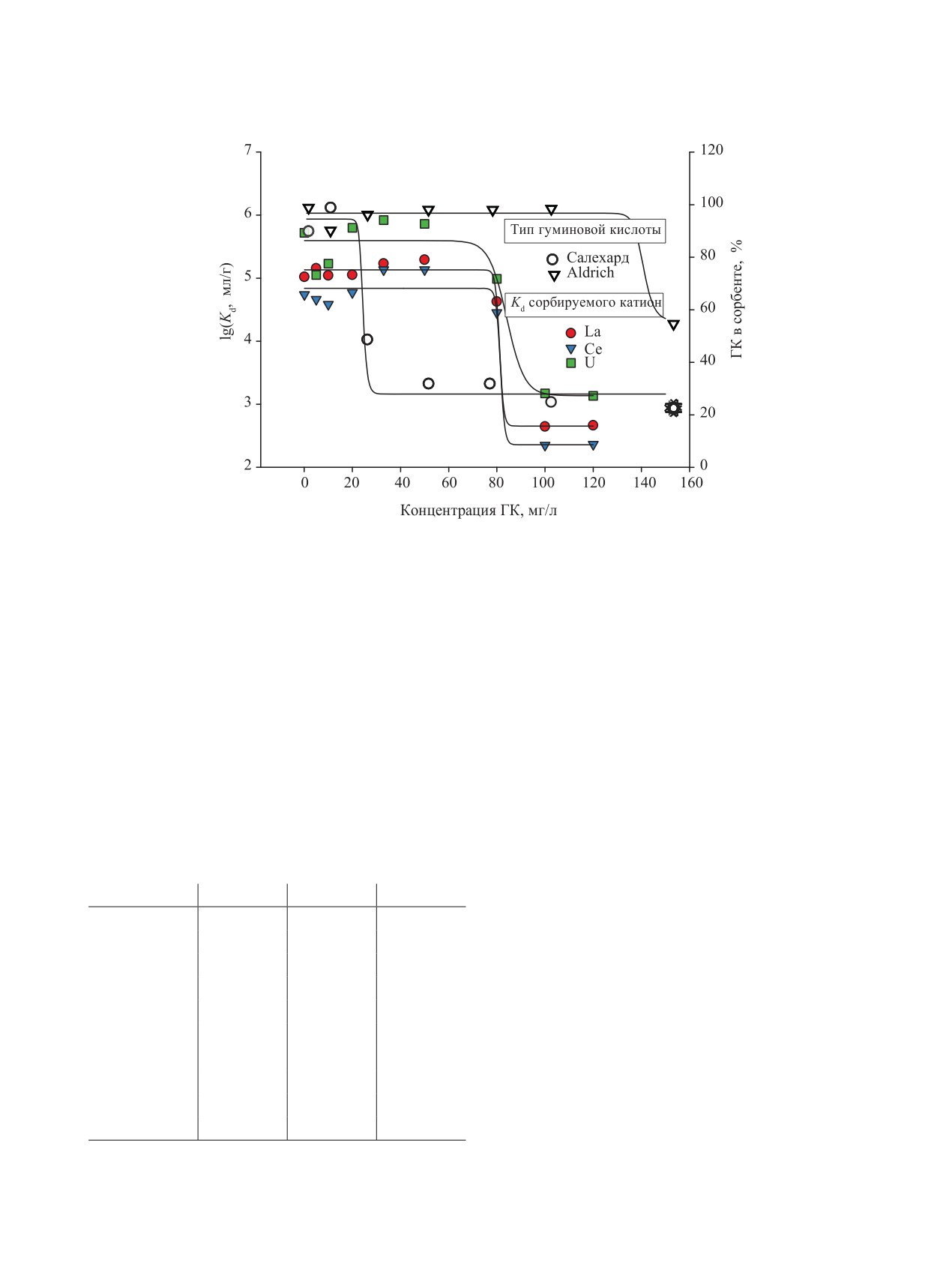
Рис. 10. Изотермы сорбции La(III), Ce(III), U(VI) композитом, характеризующие влияние реактивной ГК на сорбцию
катионов в диапазоне рН 6-9, T = 23°С. Линии на рисунке показывают тенденцию изменения Kd. Приведены данные
по сорбции ГК композитом (%) в зависимости от концентрации ГК в растворе с рН 7.0-8.5, приготовленном из двух
источников - природной ГК из района Салехарда [66] и реактива Sigma-Aldrich [39].
личественно описать экспериментальные данные
ри. Изотермы сорбции, приведенные на рис. 6, 8, 9,
lgKd-pH (рис. 8) и получить оценку первых кон-
отражают равновесное состояние исследуемой сор-
стант устойчивости гидроксокомплексов La(III),
бционной системы [42, 54]. Относительно высокое
Ce(III), U(VI). Они оказались близкими к термоди-
значение найденной константы Ka1 кислотной дис-
намическим данным [41, 52, 53], табл. 1 и рис. 9.
социации поверхностных (-ОН+surf-групп по (2)),
Совпадение найденных из эксперимента и термо-
lgKa1 = 3.9 pK, является, как нам кажется, одной
динамических оценок значений тех же величин
из основных причин высокого значения коэффици-
показало, что модель (1)-(3) адекватно отражает
ента распределения при сорбции ионов La, Ce, U
распределение исследуемых ионов в области Ген-
композитом в диапазоне рН 5-8, рис. 8. Вычислен-
ная величина Ka1 на три порядка меньше значения
Таблица 1. МНК-оценка параметров уравнения (3),
полученная из данных по сорбции La(III), Ce(III), константы диссоциации корунда (lgKa1 = 6.85 [35])
U(VI) композитом Al2O3
||C в области рН 1-8, T = 23°С. и практически совпадает с константой кислотной
Размерность всех значений - отн. ед. Пояснения в тексте. диссоциации TiO2 (lgKa1 = 3.52 [35]), что согласует-
Параметры (3)
La(III)
Ce(III)
U(VI)
ся с высоким сорбционным сродством оксониевых
KC
0.88
0.81
0.73
групп гидратированного оксида титана [55].
K1
1.70 × 10-4
1.90 × 10-4
450
В процессах межфазного распределения ми-
4
K2
2.7 ×103
2. 1 × 103
2.9 × 10
кроколичеств гидролизованных ионов изучаемая
G
29.7
29.7
39.0
система всегда погружена в присутствующую
Ka1
2.1 × 10-5
2.1 × 10-5
3.6 × 10-4
межфазную область раствор-стенка реактора [25,
56, 57]. Участие микроэлемента в распределении
β1(K)
1.50 × 105
4.50 × 105
1.60 × 108
между раствором и стенкой не только может быть
β2(K)
9.90 × 1014
1.30 × 1016
1.30 × 1016
источником искажений при исследовании основ-
β1(P)
1.90 ×105
2.10 × 105
2.60 × 109
ного процесса, но и содержит дополнительную
β2(P)
1.10 × 1014
3.00 × 1014
1.30 × 1017
информацию о механизмах сорбции. На рис. 8, б
β1 (therm)
1.60 × 105
4.50 × 105
1.60 × 108
приведены данные по сорбции ионов La(III),
РАДИОХИМИЯ том 65 № 1 2023
80
ПОЛЯКОВ и др.
Ce(III), U(VI) материалом стенки реактора из по-
превышает единиц процентов от массопереноса
лиэтилена высокого давления в условиях экспери-
между раствором и композитом.
мента рис. 8, а. Известно, что полиэтилен в про-
Присутствие в растворе гуминовых кислот (ГК)
цессе эксплуатации в водных растворах покрыт
влияет как на состояние поверхностных сорбцион-
поверхностными гидроксильными и карбониль-
ных центров оксидов алюминия, так и на состояние
ными группами (альдегиды, кетоны), молекулами
ионов РЗМ, U(VI) в растворе [62-65]. При сравне-
адсорбированной воды [58, 59]. Гидроксильные
нии результатов сорбции микроэлементов в раство-
группы способны проявлять сорбционные свой-
рах с низкой и высокой концентрацией ГК можно
ства по отношению к катионам при рН 2-10 [57].
видеть, что в области концентрации ГК 0-50 мг/л
Поверхностные
(-С-ОНsurf) группы полиэтиле-
при рН 6-9 Kd не зависит от рН, рис. 10. Причиной
на взаимодействуют с катионами La(III) и Се(III)
этого является способность оксидов алюминия реа-
в растворе с образованием хелатных комплек-
гировать с непротонированными макромолекулами
сов [60, 61], причем изотермы сорбции [57] име-
ГК в области рН ниже изоэлектрической точки ок-
ют вид, подобный полученным нами данным для
сида (для α-Al2O3 рН 8.4-9.4).
системы La, Ce, U-композит Al2O3||C, рис. 8, а, б.
Способность поверхностных гидроксильных
Представляя сорбционное взаимодействие с
групп композита из оксида алюминия и графена к
(-С-ОНsurf) группами окисленного полиэтилена в
сорбции ГК приводит к тому, что возникающая в
виде
результате этого низкая равновесная концентра-
ция ГК в растворе оказывается недостаточной для
образования гуматных комплексов ионами La(III),
,
(4)
Ce(III), U(VI) с их последующим взаимодействием
можно сформировать уравнение изотермы сорбции
с оксидом алюминия. Схожий эффект влияния ГК
(без учета кислотной диссоциации поверхностных
на коэффициент распределения Eu(III) для оксида
ОН-групп):
алюминия в условиях ~95%-ной сорбции гумино-
вой кислоты осадком описан в работе [63]. Согласно
полученным нами данным (рис. 10), молекулы ГК
(Sigma-Aldrich) [39] практически полностью пере-
ходят в композит в области рН 7-9 при начальной
концентрации менее 100 мг/л. Только при концен-
трации ГК более 100 мг/л завершается насыщение
поверхности композита, и остаточная концентрация
где M(surf) - масса микроэлемента, сорбированно-
ГК в растворе становится достаточной для образо-
го поверхностью; X, v - равновесная концентрация
вания гуматных комплексов ионами La(III), Ce(III),
микроэлемента в растворе и объем раствора; KP -
U(VI), что приводит к резкому снижению Kd на бо-
коэффициент распределения иона микроэлемента
лее чем два порядка величины. Комплексообразова-
между поверхностью полиэтилена и раствором;
ние с участием ГК природного происхождения [66]
[m]P - отношение сорбционной поверхности по-
начинает сказываться при значительно меньших
лиэтилена к объему раствора; GP - сорбционная
концентрациях - ~10-20 мг/л, рис. 10. Из получен-
емкость поверхности полиэтилена. В табл. 1 при-
ных данных невозможно сделать вывод о том, ка-
ведены значения вычисленных по уравнениям (4)-
кой из компонентов композита - оксид алюминия,
(5) первой и второй констант гидролиза катионов
многослойный графен или обе эти фазы - являет-
La(III), Ce(III), U(VI) из данных по сорбции ионов
ся источником высокого сродства к анионно-моле-
стенкой полиэтиленового реактора. Как видно из
кулярным формам ГК (согласно полученной нами
рис. 9, наблюдается согласие в описании сорбци-
изотерме, взаимодействие композит-ГК описывает-
онных процессов (1), (4) в обеих исследуемых под-
ся изотермой Ленгмюра и характеризуется высоки-
системах, хотя вклад массопереноса от побочного
ми значениями Kd и сорбционной емкости в области
процесса сорбции катионов стенкой реактора не
рН > 7). Ответ на вопрос о причинах и механизме
РАДИОХИМИЯ том 65 № 1 2023
СТАТИКА И КИНЕТИКА СОРБЦИИ ИОНОВ La(III), Ce(III), U(VI)
81
взаимодействия ГК с композитом Al2O3||C нуждает-
СПИСОК ЛИТЕРАТУРЫ
ся в дальнейших исследованиях.
1.
Raya P.Z., Shipley H.J. // RSC Adv. 2015. Vol. 5. P. 9885.
2.
Сенявин М.М. Ионный обмен. М.: Наука,
1981.
ЗАКЛЮЧЕНИЕ
C. 1-271.
3.
Yang R.T. Adsorbents: Fundamentals and Applications.
Исследованы сорбционные свойства композита
Chapter 6: Silica Gel, MCM, and Activated Alumina.
Al2O3||C, особенностью макроскопической структу-
Wiley, 2003.
ры которого является сформированное в инертной
4.
Kumar E., Bhatnagar A., Hogland W., Marques M.,
Sillanpää M. // Chem. Eng. J. 2014. Vol. 241. P. 443.
атмосфере аморфное состояние оксида алюминия
5.
Kulemin V.V., Krasavina E.P., Gorbacheva M.P.,
в графеноподобном углероде. Показано, что иссле-
Rumer I.A., Bessonov A.A., Krapukhin V.B.,
дованный композит демонстрирует высокую хими-
Kulyukhin S.A. // Radiochemistry. 2021. Vol. 63, N 5.
ческую активность в водной среде, сравнимую с
P. 651.
таковой для α-Al2O3 или кристаллического Al(OH)3
6.
Islam Md.A., Morton D.W., Johnson B.B., Prama-
(гиббсита). Описание сорбционных свойств компо-
nik B.K., Mainali B., Angove M.J. // J. Environ. Chem.
зита Al2O3||C по отношению к ионам La(III), Ce(III),
Eng. 2018. Vol. 6. P. 6853.
U(VI) проведено в рамках модели поверхностного
7.
Poursani A.S., Nilchi A., Hassani A.H., Shariat M.,
Nouri J. // Int. J. Environ. Sci. Technol. 2015. Vol. 12.
комплексообразования. Совпадение вычисленных
P. 2003.
из сорбционного эксперимента и литературных
8.
Tabesh S., Davar F., Loghman-Estarki M.R. // J. Alloys
данных по величинам первой константы гидролиза
Compd. 2018. Vol. 730. P. 441.
катионов La(III), Ce(III), U(VI) доказывает адекват-
9.
Yu J., Bai H., Wang J., Li Z., Jiao C., Liu Q., Zhanga M.,
ность выбранной сорбционной модели. Сорбцион-
Liu L. // New J. Chem. 2013. Vol. 37. P. 366.
ная активность композита вызвана более высокими
10. Huang S., Pang H., Li L., Jiang S., Wen T., Zhuang L.,
значениями константы (Ka1) кислотной диссоциа-
Hu B., Wang X. // Chem. Eng. J. 2018. Vol. 353. P. 157.
ции -ОН+surf-групп на его поверхности (pKa1 = 3.9)
11. Фигуровский А.Н. Очерк развития русского проти-
и сортовых коэффициентов распределения отдель-
вогаза во время империалистической войны 1914-
1918 гг. М.: Изд-во АН СССР, 1942.
ных гидроксокомплексов сорбируемых катионов
12. Wei X., Huang T., Yang J.H., Zhang N., Wang Y.,
металлов. Сорбция катионов La(III), Ce(III), U(VI)
Zhou Z.W. // J. Hazard. Mater. 2017. Vol. 335. P. 28.
композитом в растворе гуминовой кислоты пол-
13. Erto A., Giraldo L., Lancia A., Moreno-Pirajan J.C. //
ностью определяется параллельно протекающей
Water Air Soil Pollut. 2013. Vol. 224, N 1531. P. 1.
реакцией конкурентной сорбции ее протонирован-
14. Abdel Salam O.E., Reiad N.A., ElShafei M.M. // J. Adv.
ных анионов поверхностью аморфного композита
Res. 2011. Vol. 2. P. 297.
Al2O3||C. Композит является эффективным сор-
15. Salam M.A. // Int. J. Environ. Sci. Technol. 2013. Vol. 10.
бентом микроколичеств La(III), Ce(III), U(VI), их
P. 677.
химических аналогов, а также гуминовых кислот в
16. Yamaguchi D., Furukawa K., Takasuga M.,
Watanabe K. // Sci. Rep. 2014. Vol. 4, N 6053. P. 1.
природных и технологических растворах с низким
17. Krasil’nikov V.N., Linnikov O.D., Gyrdasova О.I.,
солевым фоном.
Rodina I.V., Tyutyunnik А.P., Baklanova I.V.,
Polyakov E.V., Khlebnikov N.А., Tarakina N.V. // Solid
ФОНДОВАЯ ПОДДЕРЖКА
State Sci. 2020. Vol. 108. Article 106429.
18. Yang W., Tang Q., Wei J., Ran Y., Chai L., Wang H. //
Данная работа выполнена по планам фунда-
Appl. Surf. Sci. 2016. Vol. 396. P. 215.
ментальных исследований института, тема НИР
19. Chen H., Luo J., Wang X., Liang X., Zhao Y., Yang C.,
Baikenov M.I., Su X. // Micropor. Mesopor. Mater. 2018.
№ АААА-А19-119031890028-0.
Vol. 255. P. 69.
20. Yao W., Wang X., Liang Y., Yu S., Gu P., Sun Y, Xu C.,
КОНФЛИКТ ИНТЕРЕСОВ
Chen J., Hayat T., Alsaedi A., Wang X. // Chem. Eng.
2018. Vol. 332. P. 775.
Авторы заявляют об отсутствии конфликта ин-
21. Krasil’nikov V.N., Baklanova I.V., Polyakov E.V.,
тересов.
Volkov I.V., Khlebnikov A.N., Tyutyunnik A.P.,
РАДИОХИМИЯ том 65 № 1 2023
82
ПОЛЯКОВ и др.
Tarakina N.V. // Inorg. Chem. Commun. 2022. Vol. 138.
ра / Под ред. Ю.В. Егорова. Екатеринбург: УрО РАН,
Article 109313.
2003. 279 c.
22. Поляков Е.В., Красильников В.Н., Волков И.В. Патент
43. Roelofs F., Vogelsberger W. // J. Colloid Interface Sci.
РФ № 2774876. Приоритет от 12.08.2021. Опублико-
2006. Vol. 303. P. 450.
вано 23.06.2022. Бюл. № 18.
44. Ramirez-Garcia J.J., Solache-Rios M., Jimenez-Reyes M.,
23. Kolarik Z. // Coll. Czech. Chem. Commun.
1962.
Rojas-Hernandez A. // J. Solution Chem. 2003. Vol. 32.
Vol. 27, N 4. P. 938.
P. 879.
24. Kolarik Z., Szlaur J. // Coll. Czech. Chem. Commun.
45. Sis H., Birinci M. // Colloids Surf. A: Physicochem. Eng.
1963. Vol. 28. P. 2818.
Aspects. 2009. Vol. 341. P. 60.
25. Егоров Ю.В. Статика сорбции микрокомпонентов
46. Wu S.F., Yanagisawa K., Nishizawa T. // Carbon. 2001.
оксигидратами. М.: Атомиздат, 1975. C. 1-200.
Vol. 39. P. 1537.
26. Adsorption from Aqueous Solutions: Proc. Symp. Held
47. Huang Sh., Pang H., Li L., Jiang Sh., Wang X. // Chem.
March 24-27, 1980, as a Satellite Symp. to the Meet. of
Eng. J. 2018. Vol. 3531. P. 157.
the American Chemical Society Division of Colloid and
48. Marmier N., Dumonceau J., Fromage F. // J. Contam.
Surface Chemistry, Houston, Texas / Ed. P.D. Tewari.
Hydrol. 1997. Vol. 26. P. 159.
New York: Plenum, 1980. P. 1-248.
49. Tan X., Ren X., Li J., Wang X. // RSC Adv. 2013. Vol. 3.
27. Bolt G.H., De Beodt M.F., Hayes M.H.B., McBride M.B.
P. 19551.
Interactions at the Soil Colloid-Soil Solution Interface /
50. Janossy L. Theory and Practice of the Evaluation of
Eds M.F. De Beodt, M.H.B. Hayes, M.B. McBride.
Measurements. Budapest: Oxford Univ. Press, 1965.
Ghent: Springer, 1991.
462 p.
28. Kupcik T., Rabung Th., Lützenkirchen J., Finck N.,
51. Polyakov E.V. // Radiochemistry. 2018. Vol. 60. P. 177.
Geckeis H., Fanghänel Th. // J. Colloid Interface Sci.
52. Ramirez-Garcia J.J., Solache-Rios M., Jimenez-
2016. Vol. 461. P. 215.
Reyes M., Rojas-Hernandez A. // J. Solution Chem.
29. Davis J.A., James R.O., Leckie J.O. // J. Colloid Interface
2003. Vol. 32, N 10. P. 879.
Sci. 1978. Vol. 63, N 3. P. 480.
53. Bentouhami E., Bouet G.M., Meullemeestre J.,
30. Davis J.A., Leckie J.O. // J. Colloid Interface Sci. 1978.
Vierling F., Khan M.A. // C. R. Chim. 2004. Vol. 7, N 5.
Vol. 67, N 1. P. 90.
P. 537.
31. Kasprzyk-Hordern B. // Adv. Colloid Interface Sci.
54. Polyakov E.V., Egorov Yu.V., Ilves G.N. // Czech. J. Phys.
2004. Vol. 110. P. 19.
1999. Vol. 49. Suppl. 1. P. 773.
32. Yoshida T., Yamaguci T., Iida Y., Nakayama Sh. // J.
55. Василевский В.А., Бетенеков Н.Д., Егоров Ю.В., Де-
Nucl. Sci. Technol. 2003. Vol. 40, N 9. P. 672.
нисова Т.А. // Радиохимия. 1984. Т. 26, № 4. C. 432.
33. Moskaleva L.V., Nasluzov V.A., Rosch N. // Langmuir.
56. Старик И.Е. Основы радиохимии. Л.: Наука, 1964.
2006. Vol. 22. P. 2141.
647 с.
34. Tan X., Ren X., Li J., Wang X. // RSC Adv. 2013. Vol. 3,
57. Benes P., Majer V. Trace Chemistry of Aqueous Solution.
N 42. P. 19551.
Prague: Academia, 1980. 290 p.
35. Virtanen S., Bok F., Ikeda-Ohno A., Rossberg A.,
58. Whelton A.J., Dietrich A.M. // Polym. Degrad. Stab.
Lützenkirchen J., Rabung T., Lehto J., Huittinen N. // J.
2009. Vol. 94. P. 1163.
Colloid Interface Sci. 2016. Vol. 483. P. 334.
59. Karlsson K., Smith G.D., Gedde U.W. // Polym. Eng.
36. Virtanen S., Meriläinen S., Eibl M., Rabung T., Lehto J.,
Sci. 1992. Vol. 32, N 10. P. 649.
Huittinen N. // Appl. Geochem. 2018. Vol. 92. P. 71.
60. Terada S., Ueda N., Kondo K., Takemoto K. // Kobunshi
37. Sankararamakrishnan N., Jaiswal M., Verma N. //
Chem. Eng. J. 2014. Vol. 235. P. 1.
Kagaku. 1972. Vol. 29, N 327. P. 500.
61. Ogiwara Y., Kubota Н. // J. Polym. Sci. Part A1. 1969.
38. Zhang L., Li Y., Guo H., Zhang H., Zhang N., Hayat T.,
Sun Y. // Environ. Pollut. 2019. Vol. 248. P. 332.
Vol. 7, N 8. P. 2087-2095.
39. Humic Acid, Technical. CAS no. 1415-93-6. Aldrich.
62. Wang X., Li J., Dai S., Hayat T., Alsaedi A., Wang X. //
Material no. SKU 53680-10G.
Chem. Eng. J. 2015. Vol. 273. P. 588.
40. Кумок В.Н., Кулешова О.М., Карабин Л.А. Равно-
63. Wang X., Chen Zh., Tan X., Hayat T., Ahmad B., Dai S.,
весия растворимости. Новосибирск: Наука,
1983.
Wang X. // Chem. Eng. J. 2016. Vol. 287. P. 313.
276 c.
64. Zhiwei N., Qiaohui F., Wenhua W., Junzheng X., Lei Ch.,
41. Kotrly S., Sucha L. Handbook of Chemical Equilibria in
Wangsuo W. // Appl. Radiat. Isot. 2009. Vol. 67. P. 1582.
Analytical Chemistry. New York: Horwood, 1985.
65. Volkov I.V., Polyakov E.V. // Radiochemistry.
2020.
42. Поляков Е.В. Реакции ионно-коллоидных форм ми-
Vol. 62. P. 141.
крокомпонентов и радионуклидов в водных раство-
66. Polyakov E.V. // Radiochemistry. 2007. Vol. 49. P. 432.
РАДИОХИМИЯ том 65 № 1 2023