РАДИОХИМИЯ, 2023, том 65, № 1, с. 47-53
УДК: 542.61
ВЛИЯНИЕ ПРИРОДЫ РАЗБАВИТЕЛЯ
НА ЭКСТРАКЦИЮ Eu(III), Am(III) И
Cm(III) N,N,Nꞌ,Nꞌ-ТЕТРАБУТИЛДИГЛИКОЛЬАМИДОМ
ИЗ АЗОТНОКИСЛЫХ РАСТВОРОВ
© 2023 г. В. Э. Шаров*, Г. В. Костикова
Институт физической химии и электрохимии им. А.Н. Фрумкина РАН,
119991, Москва, Ленинский пр., д. 31, корп. 4
*e-mail: sharov.vladislav.4444@gmail.com
Поступила в редакцию 20.10.2022, после доработки 20.12.2022, принята к публикации 23.12.2022
Изучена экстракция азотной кислоты, индикаторных количеств 152Eu(III), 241Am(III) и 244Cm(III)
N,N,N',Nꞌ-тетрабутилдигликольамидом в четырех разбавителях: смеси н-додекана с деканолом-1
(объемное отношение 90 : 10), бензоле, тетрахлорметане и м-трифторметилнитробензоле. Для всех
исследованных разбавителей коэффициенты распределения металлов увеличиваются с ростом концен-
трации HNO3 в равновесной водной фазе. Степень извлечения металла в экстракт увеличивается в ряду
Cm(III) < Am(III) < Eu(III) и снижается в ряду разбавителей: F-3 > DD+Dec-1 > CCl4 > PhH. Найдены
условия разделения пар Eu(III)/Am(III) и Am(III)/Cm(III). Показано увеличение тепловых эффектов ре-
акций экстракции при переходе от An(III) к Eu(III) для всех рассмотренных разбавителей.
Ключевые слова: экстракция, N,N,Nꞌ,Nꞌ-тетрабутилдигликольамид, европий, америций, кюрий.
DOI: 10.31857/S0033831123010070, EDN: OHILQS
Организация замкнутого ядерного топливного
[5; 6], основным недостатком которого является
цикла требует решения проблемы глубокого фрак-
склонность к агрегации и, следовательно, образова-
ционирования отработавшего ядерного топлива
нию третьей фазы [7; 8]. Этого минуса лишен диг-
(ОЯТ). Разработаны и хорошо отработаны про-
ликольамид с более короткими заместителями при
мышленные процессы выделения таких макро-
амидном фрагменте - N,N,Nꞌ,Nꞌ-тетрабутилдигли-
компонентов, как U и Pu, чего нельзя сказать про
кольамид (TBDGA). Уменьшение липофильности
лантаниды и минорные актиниды [1]. Химическая
при переходе от TODGA к TBDGA приводит к неко-
схожесть соединений указанных элементов не по-
торому росту растворимости экстрагента в водной
зволяет использовать методы, основанные на осаж-
фазе, что, однако, не является критичным для про-
дении. Выходом из положения может служить при-
ведения экстракции [9]. Снижение стерических
менение жидкостной экстракции. К сожалению,
затруднений при координации металла с лигандом
традиционные экстрагенты, такие как три-н-бутил-
при уменьшении длины алкильных заместителей
фосфат (TBP), три-н-октилфосфиноксид (TOPO) и
приводит к лучшей экстракционной способности
ди-2-этилгексилфосфорная кислота (D2EHPA), не
TBDGA по сравнению с TODGA [10]. Ранние иссле-
обладают нужной селективностью для разделения
дования [11, 12] показали, что экстракционные си-
Ln(III) и An(III) [2]. Более перспективны амидные
стемы с TBDGA в смеси предельного углеводорода
экстрагенты. В последнее время внимание исследо-
с добавкой высокомолекулярного спирта обладают
вателей все больше привлекают диамиды диглико-
недостаточно высокими коэффициентами разделе-
левой кислоты [3], обладающие высокой селектив-
ния пары Am(III)/Cm(III). Однако есть основания
ностью к Ln(III) и An(III) [4]. Наиболее изученным
полагать, что использование других разбавителей
представителем данной группы соединений явля-
может повысить селективность данного процесса.
ется N,N,Nꞌ,Nꞌ-тетраоктилдигликольамид (TODGA)
С учетом вышесказанного нами было исследовано
47
48
ШАРОВ, КОСТИКОВА
влияние разбавителей на количественные и термо-
ма-бета-альфа спектрометра-радиометра МКГБ-01
динамические характеристики процесса экстрак-
производства Scientific Technical Centre RADEK Ltd.
ции Eu(III), Am(III) и Cm(III) TBDGA из азотнокис-
на основе 51×51 мм NaI-детектора. Время измере-
лых сред.
ния проб выбирали таким образом, чтобы погреш-
ность радиометрических измерений не превышала
10%. Измеряли активность исходной водной, рав-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
новесной водной и равновесной органической фаз.
Правильность измерений контролировали по схо-
Синтез TBDGA проводили, исходя из ангидрида
димости материального баланса активности исход-
дигликолевой кислоты. На первом этапе проводили
ной водной и сумм активностей равновесных фаз.
его гидролиз, затем получали дихлорангидрид диг-
Значение D определяли как отношение активности
ликолевой кислоты по методике, приведенной в ра-
равновесной органической фазы к активности рав-
боте [13], из него далее реакцией с дибутиламином
новесной водной фазы.
получали целевое соединение [14].
В качестве разбавителей использовали н-доде-
Зависимость коэффициентов распределения
кан, деканол-1, бензол, м-трифторметилнитробен-
Eu, Am и Cm от температуры определяли, проводя
зол квалификации ч. Остальные реактивы исполь-
экстракцию в стеклянной термостатируемой ячей-
зовали квалификации х.ч. и о.с.ч. и не подвергали
ке при перемешивании фаз на магнитной мешалке
дополнительной очистке.
Stegler HS.
Для приготовления азотнокислых растворов за-
данной концентрации использовали HNO3 квали-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
фикации о.с.ч. Концентрацию HNO3 определяли
методом кислотно-основного титрования раство-
Экстракция HNO3 TBDGA в различных
ром 0.1 М NaOH с индикатором бромфеноловым
разбавителях
синим.
В литературе отсутствуют данные об экстракции
При изучении экстракционного распределения
азотной кислоты TBDGA. Исследование систем с
индикаторных количеств элементов в качестве ис-
TODGA в н-додекане показывает наличие сверхсте-
ходных соединений использовали азотнокислые
хиометрической экстракции кислоты при высоких
растворы, содержащие 241Am(III), 152-154Eu(III) и
концентрациях последней (>5 M) в равновесной
244Cm (III). Далее готовили растворы азотной кис-
водной фазе [15].
лоты заданной концентрации, в которые вводили
радиоактивную метку, перемешивали и использова-
Прежде всего была исследована экстракция
ли в качестве исходных водных фаз.
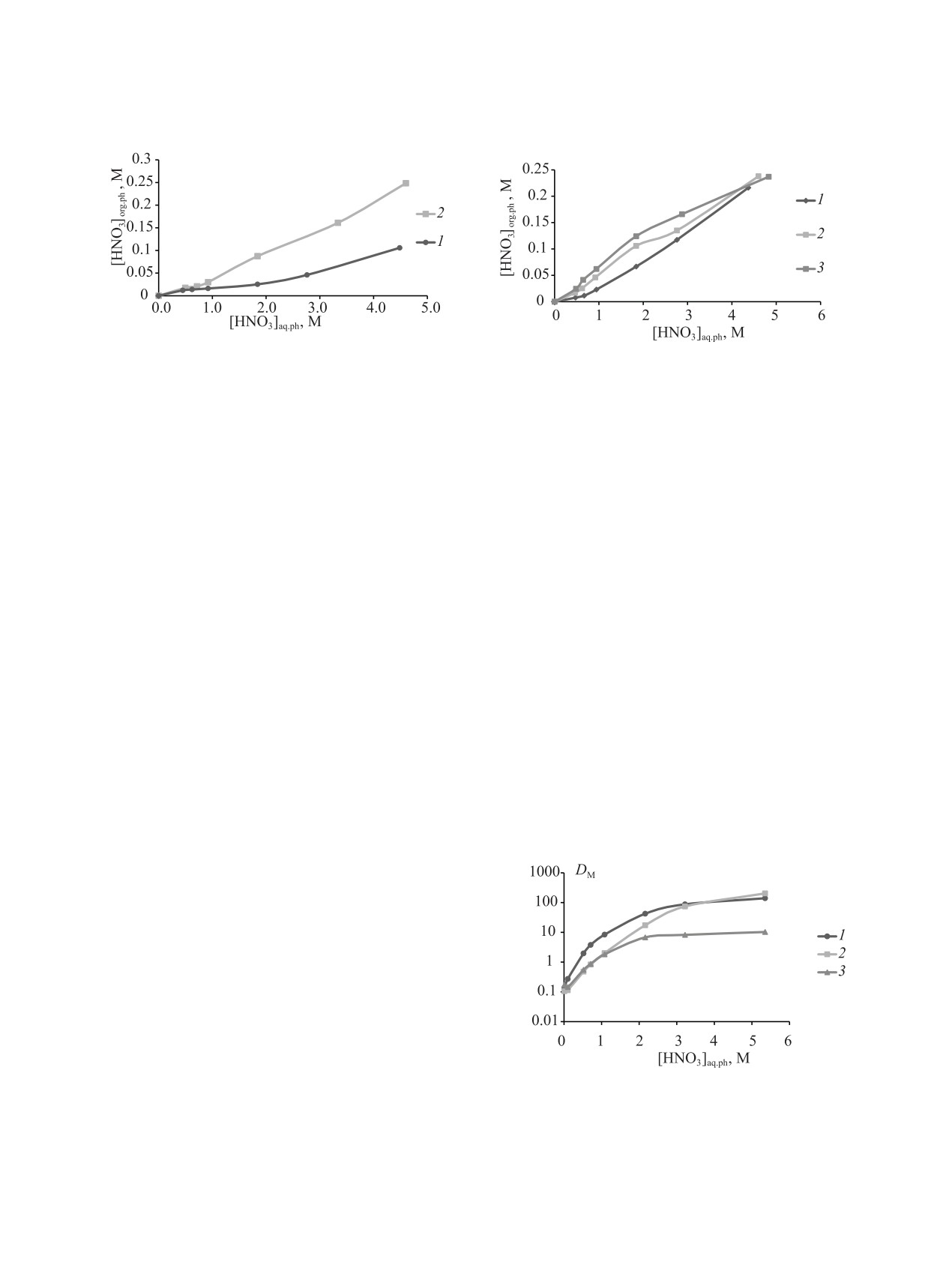
HNO3 TBDGA в смеси н-додекан-деканол-1 (объ-
емное отношение 90 : 10, DD + Dec-1). Известно,
Экстракцию индикаторных количеств элемен-
что спирты способны сами экстрагировать кисло-
тов проводили в стеклянных делительных ворон-
ты, поэтому отдельно была исследована экстракция
ках объемом 10 мл при соотношении объемов фаз
HNO3 указанной смесью («холостая» экстракция)
1 : 1, комнатной температуре (22 ± 2°С) и интен-
(рис. 1).
сивном перемешивании. Время перемешивания,
необходимое для установления равновесия, равное
Для других исследованных разбавителей, таких
3 мин, определяли на основании предварительного
как бензол (PhH), CCl4 и м-трифторметилнитробен-
кинетического эксперимента. После расслаивания
зол (F-3), холостая экстракция оказалась незначи-
фаз в течение 10-15 мин в стеклянной делительной
тельной. На рис. 2 представлены изотермы экстрак-
воронке органическую и водную фазу разделяли и
ции азотной кислоты TBDGA в указанных разбави-
измеряли их γ-счет.
телях.
Коэффициенты распределения металлов (D)
Для систем с TODGA в н-додекане ранее было
рассчитывали на основании радиометрического
установлено, что при экстракции HNO3 образуется
определения проб (по 0.5 мл) равновесных водной
соединение, в котором на одну молекулу лиганда
и органической фаз γ-метрически при помощи гам-
приходится одна молекула кислоты [7]. В случае
РАДИОХИМИЯ том 65 № 1 2023
ВЛИЯНИЕ ПРИРОДЫ Р
АЗБАВИТЕЛЯ НА ЭКСТРАКЦИЮ Eu(III), Am(III)
49
Рис. 1. Изотермы экстракции HNO3 смесью додекан–
деканол-1 (объемное отношение 90 : 10): 1 - «холо-
Рис. 2. Изотермы экстракции HNO3 TBDGA в бензоле (1),
стая» экстракция (органическая фаза без TBDGA), 2 -
CCl4 (2) и F-3 (3) ([TBDGA]org.ph = 0.1 M).
[TBDGA]org.ph = 0.1 M.
TBDGA для всех разбавителей наблюдается сверх-
трагируемости всех трех металлов. Коэффициен-
стехиометрическая экстракция HNO3 при высокой
ты распределения металлов увеличиваются в ряду:
ее концентрации в равновесной водной фазе.
Cm(III) < Am(III) < Eu(III). Для концентрации
Переход кислоты в равновесную органическую
HNO3, равной 1 M (табл. 1), наблюдается разде-
фазу увеличивается в ряду DD + Dec-1 < PhH <
ление пары Eu(III)/Am(III), что говорит о возмож-
CCl4 < F-3. Наблюдается существенный рост экс-
ности использования данной системы в процессах
трагируемости HNO3 при ее концентрации свыше
разделения Ln(III)/An(III). При [HNO3]aq.ph > 2 M
1 М.
все три металла практически полностью перехо-
дят в органическую фазу. Интересно, что в случае
Экстракция индикаторных количеств 152Eu(III),
TODGA [10] коэффициенты распределения Am(III)
241Am(III) и 244Cm(III) TBDGA в различных
и Cm(III) непрерывно растут с увеличением кон-
разбавителях из азотнокислых растворов
центрации HNO3 в равновесной водной фазе. Такое
Для TBDGA систематические данные о зави-
же поведение Am(III) характерно для экстракции
симости экстракции Eu(III), Am(III) и Cm(III) из
его
дибутил-N,N-диэтилкарбамоилфосфонатом
азотнокислых растворов от природы разбавителя в
(DBDECP) и дибутил-N,N-диэтилкарбамоилметил-
литературе отсутствуют. Подобные данные имеют-
фосфонатом (DBDECMP) [19].
ся для экстракции некоторых Ln(III) TBDGA из со-
Для зависимостей D Eu(III), Am(III) и Cm(III)
лянокислых сред [16; 17] и Ln(III) и An(III) TODGA
при экстракции TBDGA в F-3 наблюдается макси-
из HNO3 [18].
мум (рис. 4) при [HNO3]aq.ph ~3 M, что, по-видимо-
Для TODGA наблюдается уменьшение коэффи-
циентов распределения Am(III) в следующем ряду
разбавителей: нитробензол > н-додекан > бензол >
CCl4 [6]. Для TBDGA в октаноле-1 наблюдается
увеличение экстрагируемости с увеличением кон-
центрации HNO3 в равновесной водной фазе [11],
при этом для Ln(III) характерно более высокое из-
влечение в органическую фазу, чем для An(III).
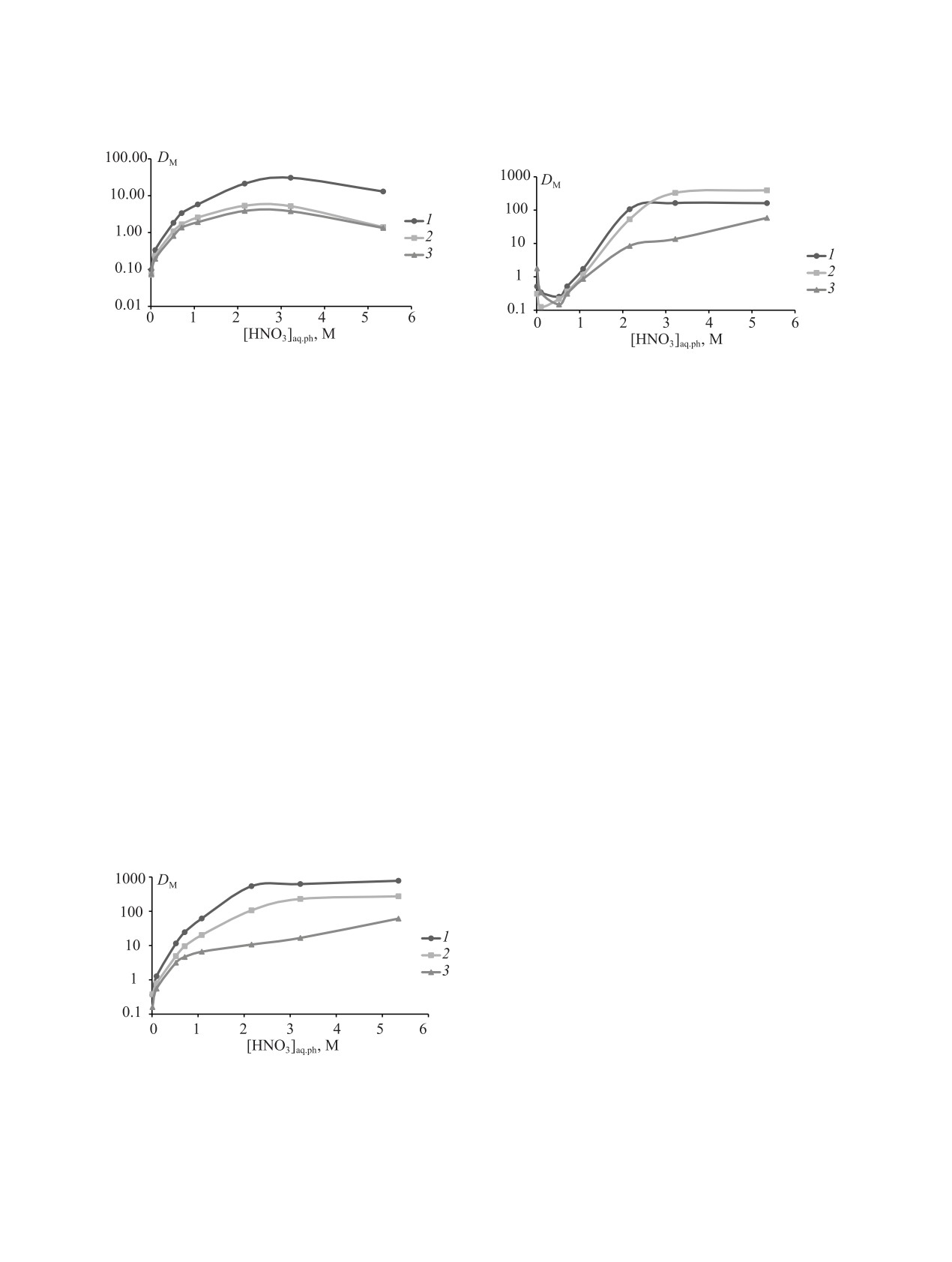
Исследование зависимости коэффициентов
распределения Eu(III), Am(III) и Cm(III) при экс-
тракции TBDGA в DD + Dec-1 из азотнокислых
Рис.
3. Зависимость коэффициентов распределения
растворов от концентрации кислоты в равновес-
Eu(III) (1), Am(III) (2) и Cm(III) (3) от концентрации
ной водной фазе показывает (рис. 3), что с увели-
HNO3 в равновесной водной фазе при экстракции 0.02 М
чением последней наблюдается увеличение экс-
TBDGA в DD + Dec-1 (индикаторные количества).
РАДИОХИМИЯ том 65 № 1 2023
50
ШАРОВ, КОСТИКОВА
Рис.
4. Зависимость коэффициентов распределения
Рис.
5. Зависимость коэффициентов распределения
Eu(III) (1), Am(III) (2) и Cm(III) (3) от концентрации
Eu(III) (1), Am(III) (2) и Cm(III) (3) от концентрации
HNO3 в равновесной водной фазе при экстракции 0.01 М
HNO3 в равновесной водной фазе при экстракции 0.1 М
TBDGA в F-3 (индикаторные количества).
TBDGA в PhH (индикаторные количества).
му, связано с конкурирующей экстракцией азотной
ванных соединений. Порядок экстрагируемости
кислоты. Для всех элементов наблюдались доста-
остается тем же: Eu(III) > Am(III) > Cm(III). При
точно высокие D. Причина такого эффекта заключа-
высоких концентрациях HNO3 зависимости вы-
ется в дополнительной сольватации образующихся
ходят на плато, что связано с конкурирующей
комплексных соединений NO2-группами разбавите-
экстракцией кислоты. Интересно, что различие
ля. Такой вывод можно сделать, сопоставив полу-
в экстракции частично гидролизованных соеди-
нений приводит к высоким коэффициентам раз-
ченные данные с опубликованными ранее для си-
деления пары Am(III)/Cm(III) в области низких
стем с TODGA, в которых высокие D сочетаются
концентраций кислоты (табл. 1). Cледует отме-
с соотношением металл : лиганд в экстрагируемом
тить, что для TBDGA в бензоле и толуоле харак-
соединении, равным 1 : 2 [20]. Порядок экстраги-
терны значительно более высокие коэффициенты
руемости остается таким же, как и в случае DD +
распределения Eu(III), Am(III) и Cm(III), чем для
Dec-1. Коэффициенты разделения при экстракции
TODGA и N,N,Nꞌ,Nꞌ-тетрагексилдигликольамида
TBDGA в F-3 приведены в табл. 2.
(THDGA) [21].
На графиках зависимостей D Eu(III), Am(III) и
При использовании в качестве разбавителя CCl4
Cm(III) от [HNO3]aq.ph при их экстракции TBDGA в
в области значительных концентраций азотной кис-
PhH (рис. 5) в области низких концентраций кисло-
лоты наблюдается существенное различие в экс-
ты (0.01-0.5 М) наблюдаются перегибы, связанные,
тракции рассматриваемых металлов. Графики зави-
по-видимому, с экстракцией частично гидролизо-
симостей D Eu(III), Am(III) и Cm(III) от [HNO3]aq.ph
так же, как и при использовании смеси DD + Dec-1
и PhH, выходят на плато при высоких концентра-
циях кислоты в равновесной водной фазе (рис. 6).
Порядок экстрагируемости остается таким же, как
и в случае остальных разбавителей. Коэффициенты
разделения при экстракции TBDGA в CCl4 приве-
дены в табл. 2. Следует отметить, что для TBDGA
в тетрахлорметане коэффициенты распределения
рассматриваемых металлов выше, чем для TBDGA
в бензоле, хотя в случае как TODGA [20], так и
TBP [22] наблюдается обратная зависимость.
Рис.
6. Зависимость коэффициентов распределения
Таким образом, наблюдается увеличение экстра-
Eu(III) (1), Am(III) (2) и Cm(III) (3) от концентрации
HNO3 в равновесной водной фазе при экстракции 0.1 М
гируемости исследуемых металлов в следующем
TBDGA в CCl4 (индикаторные количества).
ряду разбавителей: PhH < CCl4 < DD + Dec-1 < F-3.
РАДИОХИМИЯ том 65 № 1 2023
ВЛИЯНИЕ ПРИРОДЫ Р
АЗБАВИТЕЛЯ НА ЭКСТРАКЦИЮ Eu(III), Am(III)
51
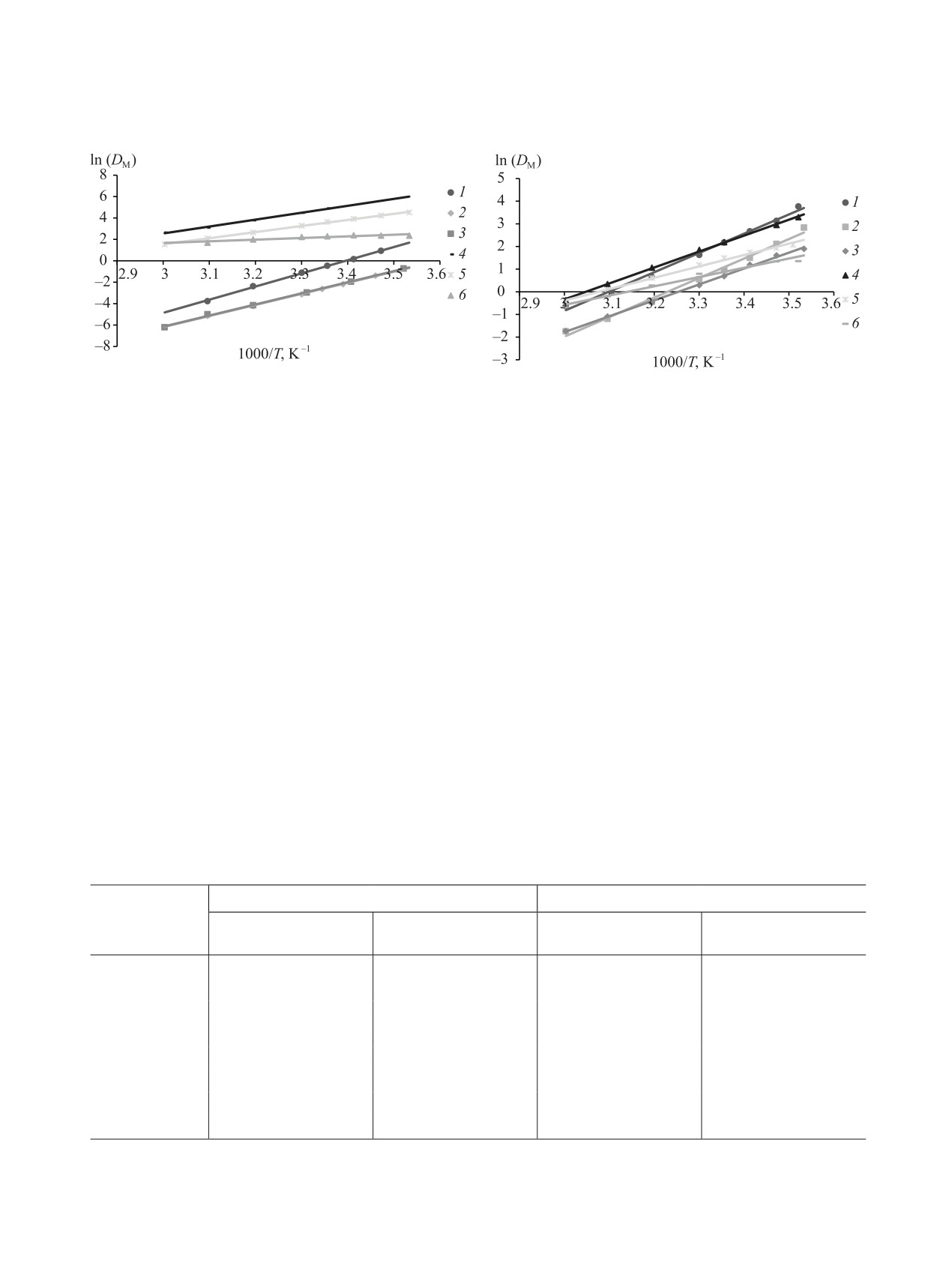
Рис. 7. Зависимость ln(DM) Eu(III) (1), Am(III) (2) и
Рис. 8. Зависимость ln(DM) Eu(III) (1), Am(III) (2) и
Cm(III) (3) от 1/T при их экстракции 0.02 M TBDGA в
Cm(III) (3) от 1/T при их экстракции 0.1 M TBDGA в PhH
DD + Dec-1 и Eu(III) (4), Am(III) (5) и Cm(III) (6) при
и Eu(III) (4), Am(III) (5) и Cm(III) (6) 0.01 M TBDGA в F-3,
экстракции 0.1 М TBDGA в CCl4, [HNO3]aq.ph =1 M (ин-
[HNO3]aq.ph = 1 M (индикаторные количества).
дикаторные количества).
Это хорошо согласуется с результатами, получен-
ции HNO3. В области высоких концентраций HNO3
ными для TODGA [6] и для TBDGA при экстрак-
увеличение содержания кислоты в водной фазе не
ции из HCl [16]. Худшая экстракция Eu(III) и An(III)
приводит к существенному увеличению перехода
при использовании в качестве разбавителей PhH и
металлов в органическую фазу вследствие конкури-
CCl4 связана с сольватацией данными соединени-
рующей экстракции.
ями активных групп экстрагента, что уменьшает
Увеличение перехода металла в экстракт для
доступность последних. В системах с F-3 высокие
всех разбавителей наблюдается в ряду: Cm(III) <
D связаны, по-видимому, с дополнительной сольва-
Am(III) < Eu(III). Для систем с DD + Dec-1 найде-
тацией катиона металла NO2-группами. Во всех
ны условия разделения пары Eu(III)/Am(III), а для
случаях наблюдается резкий рост D при концентра-
систем с PhH - пары Am(III)/Cm(III). Необходимо
ции HNO3 в равновесной водной фазе выше 0.7 М.
отметить, что при высоких концентрациях HNO3 в
Сопоставление изотерм экстракции HNO3 с зави-
симостями коэффициентов распределения метал-
равновесной водной фазе наблюдаются высокие ко-
лов от ее концентрации в равновесной водной фазе
эффициенты разделения как Eu(III) и Am(III), так и
позволяет отметить резкое увеличение экстрагиру-
Am(III) и Cm(III), однако процесс разделения в ука-
емости Eu(III), Am(III) и Cm(III) с началом экстрак-
занных условиях организовать невозможно вслед-
Таблица 1. Коэффициенты разделения (β) пар Eu(III)/Am(III) и Am(III)/Cm(III) при их экстракции 0.02 M TBDGA в
DD + Dec-1 и 0.1 M TBDGA в PhH из HNO3
0.02 M TBDGA-DD + Dec-1
0.1 M TBDGA-PhH
[HNO3], М
β Eu/Am
β Am/Cm
β Eu/Am
β Am/Cm
(β Am/Eu)
(β Cm/Am)
(β Am/Eu)
(β Cm/Am)
0.01
1.31
(1.63)
1.65
(5.76)
0.10
2.39
(1.28)
2.73
(2.77)
0.52
4.09
(1.15)
1.17
1.47
0.71
4.56
(1.05)
1.41
1.17
1.08
4.19
1.10
1.53
1.30
2.16
2.45
2.56
2.00
6.27
3.22
1.18
8.98
(2.00)
24.2
5.35
(1.45)
19.8
(2.44)
6.67
РАДИОХИМИЯ том 65 № 1 2023
52
ШАРОВ, КОСТИКОВА
Таблица 2. Коэффициенты разделения (β) пар Eu(III)/
Таблица 3. Энтальпии экстракции Eu(III), Am(III) и
Am(III) и Am(III)/Cm(III) при экстракции их 0.1 M
Cm(III) TBDGA в различных разбавителях из 1 М HNO3
TBDGA в CCl4 и 0.01 M TBDGA в F-3 из HNO3
M
Разбавитель
tg α
R2
∆H, кДж/моль
0.1 M TBDGA-CCl4
0.01 M TBDGA-F-3
Eu
DD + Dec-1
12.3
0.9984
-102
[HNO3],
β Am/Cm
β Eu/Am
β Am/Cm
М β Eu/Am
PhH
8.51
0.9943
-70.7
(β Am/Eu)
(β Cm/Am)
(β Am/Eu)
(β Cm/Am)
CCl4
6.46
0.9962
-53.7
0.01
(1.05)
2.36
1.35
(1.05)
F-3
7.04
0.9988
-58.5
0.10
1.62
1.42
1.43
1.20
Am
DD + Dec-1
10.37
0.9983
-86.2
0.52
2.35
1.55
1.70
1.34
PhH
8.61
0.9922
-71.5
0.71
2.56
2.06
2.01
1.23
CCl4
5.68
0.9987
-47.2
1.08
3.04
3.05
2.26
1.34
F-3
5.02
0.9947
-41.7
2.16
5.08
9.93
3.97
1.38
Cm
DD + Dec-1
10.3
0.9988
-85.9
PhH
7.02
0.9982
-58.3
3.22
2.72
13.7
5.91
1.37
CCl4
1.53
0.8518
-12.7
5.35
2.84
4.45
9.23
1.06
F-3
4.84
0.9986
-40.2
ствие высокой степени извлечения всех металлов в
Значения энтальпий экстракции возрастают в ряду:
экстракт.
CCl4 < F-3 < PhH < DD + Dec-1. Схожая зависи-
мость наблюдается для солянокислых сред [14, 15],
Температурные зависимости коэффициентов
но для азотнокислых сред тепловые эффекты суще-
распределения индикаторных количеств 152Eu(III),
ственно выше. Рассчитанные значения энтальпий
241Am(III) и 244Cm(III) при их экстракции TBDGA в
экстракции металлов схожи с таковыми для экс-
различных разбавителях
тракционных систем при использовании в качестве
экстрагента растворов TODGA в предельных угле-
Систематические данные о зависимости экстрак-
водородах [23]. Для Am(III) и Cm(III) полученные
значения близки во всех случаях, кроме систем с
ции Ln(III) и An(III) TBDGA в различных разбави-
CCl4. Экстракция же Eu(III) характеризуется значи-
телях из азотнокислых растворов от температуры
тельно более высокими тепловыми эффектами.
в литературе отсутствуют. Аналогичные результа-
ты имеются для солянокислых сред [16; 17]. Для
TODGA в предельных углеводородах и их смесях с
ЗАКЛЮЧЕНИЕ
высокомолекулярными спиртами тепловые эффек-
Изучена зависимость экстракции Eu(III), Am(III)
ты экстракции из HNO3 уменьшаются в следующем
и Cm(III) TBDGA из азотнокислых растворов от
ряду: An(III) > An(IV) ~ An(VI) [23-25].
природы разбавителя. D металлов увеличивают-
Зависимости D Eu(III), Am(III) и Cm(III) от тем-
ся в ряду: PhH < CCl4 < DD + Dec-1 < F-3. Во всех
пературы при экстракции их TBDGA в DD+Dec-1,
исследованных разбавителях наблюдается следую-
CCl4 (рис. 7), PhH и F-3 (рис. 8) линеаризовались в
щий порядок экстрагируемости: Eu(III) > Am(III) >
координатах ln(DM) - 1/T. Тангенсы углов наклона
Cm(III). Системы с DD + Dec-1 подходят для разде-
полученных прямых позволили рассчитать энталь-
ления пары Eu(III)/Am(III), а различие в экстракции
пии экстракции для всех исследованных систем
частично гидролизованных форм америция и кю-
(табл. 3).
рия TBDGA в PhH можно использовать для разделе-
Приведенные выше данные показывают, что
ния пары Am(III)/Cm(III). Все реакции экстракции
экстракция исследуемых металлов TBDGA харак-
оказались экзотермичны и имели высокие значения
теризуется значительными тепловыми эффектами.
энтальпии.
РАДИОХИМИЯ том 65 № 1 2023
ВЛИЯНИЕ ПРИРОДЫ Р
АЗБАВИТЕЛЯ НА ЭКСТРАКЦИЮ Eu(III), Am(III)
53
ФОНДОВАЯ ПОДДЕРЖКА
11. Mincher M.E., Quach D.L., Liao Y.J., Mincher B.J.,
Wai C.M. // Solvent Extr. Ion Exch. 2012. Vol. 30, N 7.
Работа выполнена при частичном финансиро-
P. 735-747.
12. Gujar R.B., Ansari S.A., Mohapatra P.K., Leoncini A.,
вании Министерства науки и высшего образова-
Verboom W. // J. Radioanal. Nucl. Chem. 2016. Vol. 309.
ния Российской Федерации в рамках госзадания
P. 819-825.
ИФХЭ РАН на 2022 год с использованием оборудо-
13. Yan M., Cao S., Zhu S. Patent CN 113861063A. Dec. 31,
вания ЦКП ИФХЭ РАН.
2021.
14. Chapron S., Marie C., Arrachart G., Miguirditchian M.,
КОНФЛИКТ ИНТЕРЕСОВ
Pellet-Rostaing S. // Solvent Extr. Ion Exch.
2015.
Vol. 33, N 3. P. 236-248.
Авторы заявляют об отсутствии конфликта ин-
15. Rama Swami K., Venkatesan K.A., Antony M.P. / /Ind.
тересов.
Eng. Chem. Res. 2018. Vol. 57, N 40. P. 13490-13497.
16. Cui Y., Yang J., Yang G., Xia G., Nie Y., Sun G. //
Hydrometallurgy. 2012. Vols. 121-124. P. 16-21.
СПИСОК ЛИТЕРАТУРЫ
17. Yang J.H., Cui Y., Sun G.X., Nie Y., Xia G.M.,
Zheng G.X. // Journal Serb. Chem. Soc. 2013. Vol. 78,
1.
Salvatores M., Palmiotti G. // Prog. Particle Nucl. Phys.
N 1. P. 93-100.
2011. Vol. 66, N 1. P. 144-166.
18. Chen Z., Yang X., Song L., Wang X., Xiao Q., Xu H.,
2.
Leoncini A., Huskens J., Verboom W. // Chem. Soc. Rev.
Feng Q., Ding S. // Inorg. Chim. Acta. 2020. Vol. 513.
2017. Vol. 46, N 23. P. 7229-7273.
Article 119928.
3.
Matveev P., Mohapatra P.K., Kalmykov S.N., Petrov V. / /
19. Burger L.L.// General Electric Co. Hanford Atomic
Solvent Extr. Ion Exch. 2021. Vol. 39, N 7. P. 679-713.
Products Operation, Richland, Washington,
1962.
4.
Sasaki Y., Sugo Y., Suzuki S., Tachimori S. // Solvent
N HW-SA-2796.
Extr. Ion Exch. 2001. Vol. 19, N 1. P. 91-103.
20. Panja S., Mohapatra P.K., Tripathi S.C., Gandhi P.M.,
5.
Mowafy E.A., Aly H.F. // Solvent Extr. Ion Exch. 2007.
Janardan P. // J. Membr. Sci. 2012. Vols. 403-404.
Vol. 25, N 2. P. 205-224.
P. 71-77.
6.
Ansari S.A., Pathak P.N., Manchanda V.K., Husain M.,
21. Mowafy E.A., Mohamed D. // Sep. Purif. Technol. 2014.
Prasad A.K., Parmar V.S. // Solvent Extr. Ion Exch.
Vol. 128. P. 18-24.
2005. Vol. 23, N 4. P. 463-479.
7.
Yaita T., Herlinger A.W., Thiyagarajan P., Jensen M.P. //
22. Siekierski S. // J. Inorg. Nucl. Chem. 1962. Vol. 24, N 2.
Solvent Extr. Ion Exch. 2004. Vol. 22, N 4. P. 553-571.
P. 205-214.
8.
Nave S., Modolo G., Madic C., Testard F. // Solvent Extr.
23. Arisaka M., Kimura T. // Solvent Extr. Ion Exch. 2011.
Ion Exch. 2004. Vol. 22, N 4. P. 527-551.
Vol. 29, N 1. P. 72-85.
9.
Sasaki Y., Kimura T., Oguma K. // J. Ion Exch. 2007.
24. Gujar R.B., Dhekane G.B., Mohapatra P.K.
//
Vol. 18, N 4. P. 354-359.
Radiochim. Acta. 2013. Vol. 101, N 11. P. 719-724.
10. Sasaki Y., Sugo Y., Tachimori S. // Int. Conf. «Scientific
25. Gujar R.B., Pathak P.N., Dhekane G.B., Mohapat-
Research on the Back-End of the Fuel Cycle for the
ra P.K. // Solvent Extr. Ion Exch. 2014. Vol. 32, N 6.
21 Century» Atalante 2000. P. 6.
P. 637-649.
РАДИОХИМИЯ том 65 № 1 2023