РАДИОХИМИЯ, 2023, том 65, № 1, с. 41-46
УДК 542.61 : 546.65/66
ЭКСТРАКЦИЯ АКТИНИДОВ И ЛАНТАНИДОВ ИЗ
АЗОТНОКИСЛЫХ РАСТВОРОВ КОМПЛЕКСАМИ
КАРБАМОИЛМЕТИЛФОСФИНОКСИДОВ С
БИС[(ТРИФТОРМЕТИЛ)СУЛЬФОНИЛ]ИМИДОМ
© 2023 г. А. Н. Туранова, В. К. Карандашевб, *, Г. В. Костиковав, А. М. Федосеевв
а Институт физики твердого тела им. Ю. А. Осипьяна РАН,
142432, Черноголовка Московской обл., ул. Академика Осипьяна, д. 2
б Институт проблем технологии микроэлектроники и особо чистых материалов РАН,
142432, Черноголовка Московской обл., ул. Академика Осипьяна, д. 6
в Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119991, Москва, Ленинский пр., д. 31, корп. 4
* e-mail: karan@iptm.ru
Поступила в редакцию 22.07.2022, после доработки 31.08.2022, принята к публикации 05.09.2022
Исследована экстракция U(VI), Th(IV), Am(III) и лантанидов(III) растворами комплексов карбамоилме-
тилфосфиноксидов с фенильными (Ph2Bu2) и бутильными (Bu2Et2) заместителями при атоме фосфора
с бис[(трифторметил)сульфонил]имидом (HTf2N). Установлено, что ионы актинидов и лантанидов(III)
экстрагируются растворами таких комплексов из азотнокислых растворов по катионообменному меха-
низму. При экстракции Ln(III) из растворов 3 моль/л HNO3 величины DLn в системе с Ph2Bu2-HTf2N бо-
лее чем на два порядка выше, чем при экстракции раствором Ph2Bu2. Раствор комплекса Ph2Bu2-HTf2N
экстрагирует Th(IV), U(VI), Am(III) и Ln(III) из азотнокислых растворов значительно более эффектив-
но, чем Bu2Et2-HTf2N.
Ключевые слова: экстракция, уран(VI), торий(IV), америций(III), лантаниды(III), азотная кислота,
карбамоилметилфосфиноксиды, бис[(трифторметил)сульфонил]имид.
DOI: 10.31857/S0033831123010069, EDN: OHCICE
Бидентатные нейтральные фосфорорганические
в присутствии CnmimTf2N сопровождается перехо-
соединения, в частности, карбамоилметилфосфи-
дом катионов Cnmim+ в водную фазу [16], что при-
ноксиды (КМФО), обладают высокой экстракци-
водит к загрязнению рафинатов экстракционных
онной способностью по отношению к актинидам
систем. Снижению таких загрязнений способствует
и лантанидам(III) в азотнокислых средах и исполь-
увеличение длины углеводородного радикала кати-
зуются в процессах переработки отработанного
она Cnmim+, однако это приводит к значительному
ядерного топлива [1-4]. Экстракционная способ-
снижению эффективности экстракции ионов метал-
ность этих соединений в азотнокислых средах зна-
лов в системах с ИЖ [17].
чительно возрастает в присутствии хлорированно-
Известно, что КМФО образуют комплексы с
го дикарболлида кобальта (ХДК) [5-7] или ионных
сильными кислотами. Комплексы с азотной кисло-
жидкостей (ИЖ) - бис[(трифторметил)сульфонил]
той эффективно экстрагируют актиниды и ланта-
имидов метилалкилимидазолиев (CnmimTf2N) [8-
ниды(III) из азотнокислых растворов в отсутствие
14] - в органической фазе или перхлорат-ионов в
органических растворителей [18, 19]. Повышение
водной [7, 15].
эффективности экстракции ионов металлов из рас-
Процесс катионообменной экстракции ионов
творов хлорной кислоты связывают с образованием
актинидов и Ln(III) нейтральными экстрагентами комплексов КМФО с HClO4, которые экстрагиру-
41
42
ТУРАНОВ и др.
ют ионы металлов по катионообменному механиз-
из Ln(III), U(VI) и Th(IV) составляла 2 × 10- моль/л,
му [7].
концентрация азотной кислоты в водной фазе ва-
рьировалась в интервале 0.3-5.0 моль/л.
Бис[(трифторметил)сульфонил]имид
(CF3SO2)2NH (HTf2N) является сильной кисло-
Содержание Ln(III), U(VI) и Th(IV) в исходных
той [20] и образует гидрофобные комплексы с рядом
и равновесных водных растворах определяли ме-
нейтральных экстрагентов в процессе экстракции
тодом масс-спектрометрии с ионизацией пробы в
ионов актинидов и Ln(III) из азотнокислых раство-
индуктивно связанной плазме с использованием
ров нейтральными экстрагентами в присутствии
масс-спектрометра X-7 (Thermo Electron, США).
CnmimTf2N в органической фазе [21]. Представляет
Содержание элементов в органической фазе опре-
интерес рассмотреть возможность использования
деляли по разнице концентраций в водном растворе
таких комплексов в качестве экстрагентов для из-
до и после экстракции. Коэффициенты распределе-
влечения ионов металлов из азотнокислых раство-
ния элементов (D) рассчитывали как отношение их
ров, что позволило бы исключить присутствие ка-
концентраций в равновесных фазах. Погрешность
тионов Cnmim+ в экстракционных системах.
определения D не превышала 10%. Коэффициен-
ты распределения 241Am(III) определяли как от-
Цель данной работы - исследование экстракции
ношение γ-активности аликвот равновесных орга-
ионов актинидов и Ln(III) из азотнокислых раство-
нической и водной фазах. Концентрацию HNO3 в
ров растворами комплексов КМФО Ph2Bu2 и Bu2Et2,
равновесных водных фаз определяли потенциоме-
отличающимися природой заместителей при атоме
трическим титрованием раствором NaOH.
фосфора, с HTf2N в органических растворителях.
При исследовании экстракции HTf2N ее концен-
трацию в равновесной органической фазе опреде-
Ph2P(O)CH2C(O)NBu2
Bu2P(O)CH2C(O)NEt2
ляли по разнице концентраций H+ и Tf2N- в водном
Ph2Bu2
Bu2Et2
растворе до и после экстракции потенциометри-
ческим титрованием раствором NaOH и методом
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ICP-AES соответственно. Параллельно определяли
содержание HTf2N в органической фазе при экс-
тракции кислоты чистым дихлорэтаном (холостой
КМФО Ph2Bu2 и Bu2Et2 синтезированы в Ин-
опыт). Результаты холостого опыта учитывали при
ституте физиологически активных веществ РАН
расчете общей концентрации комплексов HTf2N с
по известной методике [22].
Водный раствор
экстрагентами в органической фазе.
HTf2N готовили путем пропускания раствора ли-
тиевой соли бис[(трифторметил)сульфонил]имида
(LiTf2N) (Sigma-Aldrich) через колонку катионита
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
КУ-2. Комплексы КМФО-HTf2N получали взаи-
модействием растворов КМФО в дихлорэтане с
Данные по распределению HTf2N между ее во-
раствором 0.5 моль/л HTf2N. Органическую фазу
дными растворами и растворами КМФО Ph2Bu2 и
отделяли и удаляли органический растворитель в
Bu2Et2 в дихлорэтане (рис. 1) указывают на то, что
вакууме. Полученные продукты анализировали на
в исследованном диапазоне концентрации HTf2N в
содержание фосфора и серы атомно-эмиссионным
органическую фазу переходят комплексы экстра-
гента (L) с одной молекулой HTf2N. Процесс экс-
методом с ионизацией пробы в индуктивно связан-
ной плазме (ICP-AES) с использованием спектро-
тракции HTf2N может быть описан уравнением
метра iCAP-6500 Duo (Thermo Scientific, США).
H+(в) + Tf2N-(в) + L(o) ↔ LHTf2N(o),
(1)
Соотношение КМФО : HTf2N составляло 1 : 1 ± 0.1.
где символами (в) и (о) обозначены компонен-
Методика проведения экстракции Ln(III),
ты водной и органической фаз соответственно.
Am(III), U(VI) и Th(IV) описана в предыдущих ра-
Концентрационные константы экстракции HTf2N
ботах [10-12]. В качестве органических раствори-
(KHTf
) выражаются как
2
N
телей использовали 1,2-дихлорэтан, нитробензол и
о-ксилол марки х.ч. Исходная концентрация каждого
KHTf
N
= [LHTf2N]/([L][H+][Tf2N- ]),
(2)
2
РАДИОХИМИЯ том 65 № 1 2023
ЭКСТР
АКЦИЯ АКТИНИДОВ И ЛАНТАНИДОВ
43
где [L] - равновесная концентрация свободного экс-
трагента в органической фазе. Значения KHTf2N для
КМФО Ph2Bu2 и Bu2Et2 в дихлорэтане, рассчитан-
ные по данным рис. 1, составляют (3.35 ± 0.35) × 103
и (1.21 ± 0.15) × 104 соответственно. Экстракцион-
ная способность исследованных КМФО реагентов
по отношению к HTf2N и устойчивость образуемых
комплексов возрастают в ряду Ph2Bu2 < Bu2Et2 по
мере снижения электроотрицательности заместите-
лей при атоме фосфора. В такой же последователь-
ности возрастает экстракционная способность этих
КМФО по отношению к HNO3 [23]. Строение ком-
плексов LHTf2N требует дополнительного изуче-
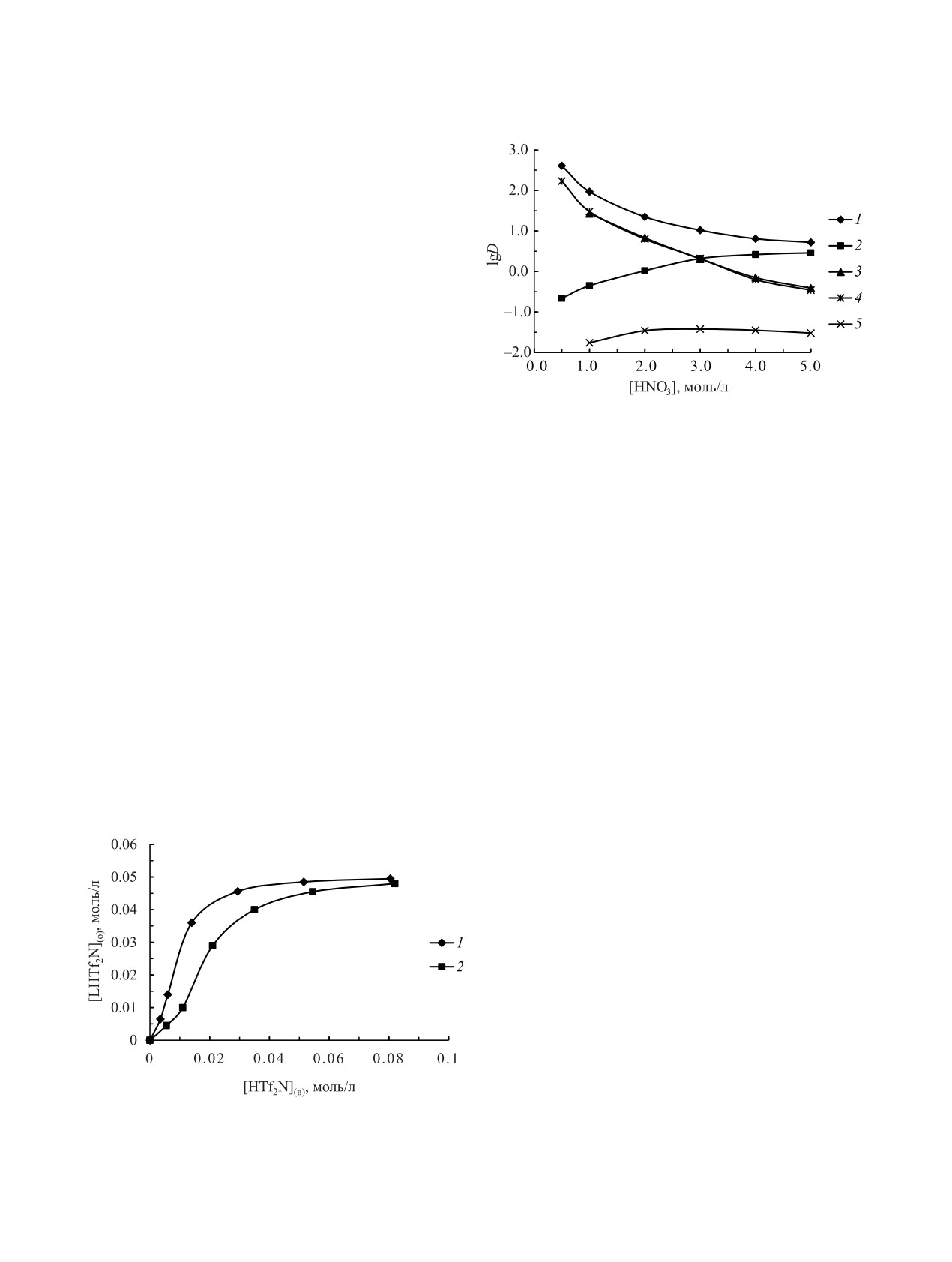
Рис. 2. Зависимость коэффициентов распределения
ния. Можно предположить, что они представляют
U(VI) (1, 2), Am(III) (3) и Eu(III) (4, 5) от концентра-
собой ионные пары LH+Tf2N-, как комплексы про-
ции HNO3 в водной фазе при экстракции растворами
тонированных КМФО или замещенных диоксидов
0.002 (1, 2) и 0.01 (3-5) моль/л КМФО Ph2Bu2 (2, 5) и ком-
плекса Ph2Bu2-HTf2N (1, 3, 4) в дихлорэтане.
метилендифосфинов с гидрофобными анионами
ХДК- и ClO– [24-26].
из растворов 3 моль/л HNO3 величины DLn в систе-
Исследование влияния концентрации HNO3 в
ме с Ph2Bu2-HTf2N более чем на два порядка выше,
равновесной водной фазе на эффективность экс-
чем при экстракции раствором Ph2Bu2 (рис. 3).
тракции ионов металлов растворами комплекса
Можно предположить, что это связано с вхождени-
Ph2Bu2-HTf2N в дихлорэтане показало, что зна-
ем гидрофобных анионов Tf2N- в состав экстраги-
чения D уменьшаются с ростом [HNO3] (рис. 1).
руемых комплексов, что приводит к увеличению их
Такой характер зависимости D-[HNO3] указывает
гидрофобности по сравнению с сольватированны-
на катионообменный механизм экстракции ионов
ми нитратами Ln(III), экстрагируемыми раствора-
металлов растворами Ph2Bu2-HTf2N в дихлорэ-
ми КМФО Ph2Bu2 в дихлорэтане. При экстракции
тане. Из данных рис.
2 видно, что растворы
из раствора 3 моль/л HNO3 величины DLn(Ph2Bu2-
Ph2Bu2-HTf2N в дихлорэтане экстрагируют ионы
HTf2N)/DLn(Ph2Bu2) увеличиваются в ряду Ln(III)
металлов значительно более эффективно, чем рас-
от 214 для La до 1150 для Lu (рис. 3) по мере умень-
творы Ph2Bu2 в дихлорэтане. При этом отношение
шения ионных радиусов ионов Ln3+ и увеличения
D(Ph2Bu2-HTf2N)/D(Ph2Bu2) уменьшается с ростом
их энергии гидратации. По-видимому, замещение в
[HNO3] (рис. 2). Однако даже при экстракции Ln(III)
экстрагируемом комплексе анионов NO3- на более
гидрофобные Tf2N- оказывает большее влияние на
экстракцию более гидратированных ионов Ln(III).
Это приводит к снижению фактора разделения
La/Lu (βLa/Lu = DLa/DLu) от 32.3 при экстракции рас-
твором КМФО Ph2Bu2 в дихлорэтане до 2.8 при
экстракции комплексом Ph2Bu2-HTf2N (рис. 3).
Величины lgDLn при экстракции Ln(III) из рас-
творов 3 моль/л HNO3 растворами 0.05 моль/л
Ph2Bu2-HTf2N в дихлорэтане сопоставимы с ве-
личинами lgDLn при экстракции раствором, содер-
жащим 0.05 моль/л Ph2Bu2 и C4mimTf2N [10]. При
этом в системе с Ph2Bu2-HTf2N устраняется пере-
ход катиона ИЖ в водную фазу.
Рис. 1. Экстракция HTf2N растворами 0.05 моль/л КМФО
Эффективность экстракции ионов Ln(III) рас-
Bu2Et2 (1) и Ph2Bu2 (2) в дихлорэтане.
творами Ph2Bu2-HTf2N значительно выше, чем
РАДИОХИМИЯ том 65 № 1 2023
44
ТУРАНОВ и др.
Рис. 3. Коэффициенты распределения Ln(III) при экстракции из раствора 3 моль/л HNO3 растворами 0.05 моль/л КМФО
Ph2Bu2 (3), Bu2Et2 (4) и комплексов Ph2Bu2-HTf2N (1) и Bu2Et2-HTf2N (2) в дихлорэтане.
Bu2Et2-HTf2N (рис. 3), что связано с проявлением
к заметному изменению DLn в процессе экстракции
эффекта «аномального арильного упрочнения» экс-
растворами Ph2Bu2-HTf2N и Bu2Et2-HTf2N. Можно
трагируемых комплексов [27].
предположить, что ионы NO– не участвуют в обра-
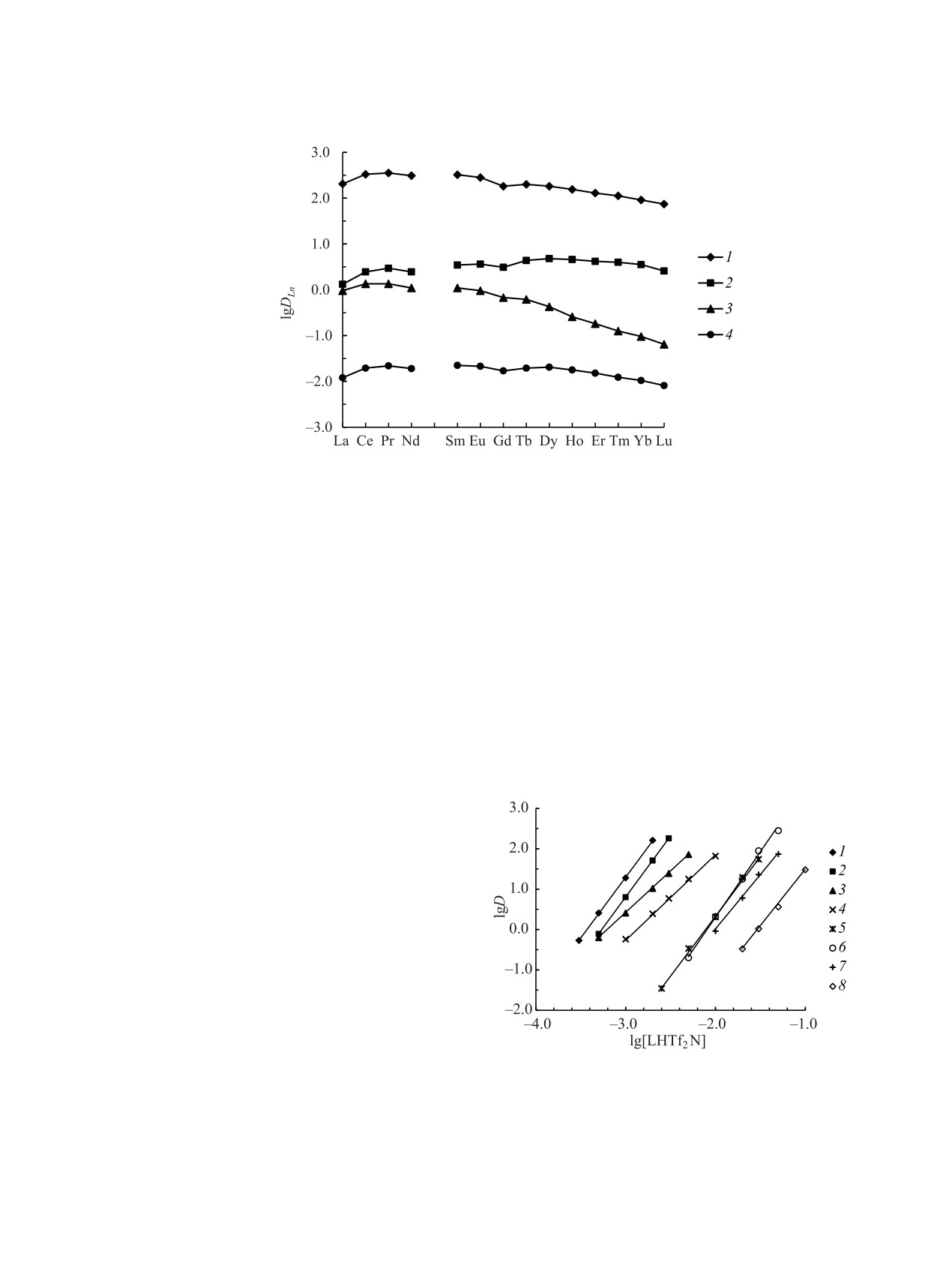
Методом сдвига равновесия определены сте-
зовании экстрагируемых комплексов в этих услови-
хиометрические соотношения Mn+ : L в комплек-
ях.
сах, экстрагируемых растворами Ph2Bu2-HTf2N и
Следует отметить, что растворы Ph2Bu2-HTf2N
Bu2Et2-HTf2N из растворов 3 моль/л HNO3. При
эффективно экстрагируют ионы Ln(III) из раство-
экстракции Am(III), Ln(III) и Th(IV) угловой наклон
зависимостей lgD-lg[LHTf2N] близок к 3 (рис. 4),
ров других минеральных кислот. При экстракции
что соответствует переходу этих ионов в органи-
раствором 0.03 моль/л Ph2Bu2-HTf2N в дихлорэта-
ческую фазу в виде трисольватов. Угловой наклон
не из растворов 3 моль/л H3PO4, HCl, H2SO4 и HNO3
зависимостей lgDU-lg[LHTf2N] близок к 2 (рис. 4),
величины lgDEu составляют 3.17, 2.43, 2.30 и 1.95,
что указывает на экстракцию ионов U(VI) из азот-
соответственно.
нокислых растворов в дисольватов. Ранее было по-
казано, что КМФО Ph2Bu2 экстрагирует U(VI) из
азотнокислых растворов в виде смеси моно- и ди-
сольватов [28], а Am(III) и Ln(III) - в основном в
виде дисольватов [23, 29]. Увеличение сольватного
числа в комплексах, экстрагируемых в системах с
LHTf2N, может быть связано со слабой координа-
ционной способностью анионов Tf2N- [30]. Эти
анионы находятся, по-видимому, во внешней ко-
ординационной сфере экстрагируемого комплекса,
тогда как в системах с КМФО ионы U(VI) и Ln(III)
экстрагируются в виде координационно-сольвати-
рованных нитратов, в которых ионы NO– участвуют
в координации ионов UO2+ и Ln3+ [31].
Рис. 4. Зависимость коэффициентов распределения
Th(IV) (1, 2), U(VI) (3, 4), Am(III) (5) и Eu(III) (6-8) от
При постоянной кислотности водной фазы
концентрации комплексов Ph2Bu2-HTf2N (1, 3, 5-7) и
(0.5 М HNO3) увеличение концентрации ионов NO– ,
Bu2Et2-HTf2N (2, 4, 8) в дихлорэтане при экстракции из
вводимых в виде NH4NO3, до 4 моль/л не приводит
раствора 3 моль/л HNO3.
РАДИОХИМИЯ том 65 № 1 2023
ЭКСТР
АКЦИЯ АКТИНИДОВ И ЛАНТАНИДОВ
45
Экстракция ионов Am(III) и Ln(III) из азотно-
растворов по катионообменному механизму. При
кислых растворов растворами LHTf2N может быть
экстракции Ln(III) из растворов 3 моль/л HNO3 зна-
описана уравнением
ченияDLn в системе с Ph2Bu2-HTf2N более чем на
два порядка выше, чем при экстракции раствором
M3+(в) + 3LHTf2N(о) ↔ ML3(Tf2N)3(о) + 3H+(в),
(2)
Ph2Bu2. Комплекс на основе КМФО с фенильными
а константа катионообменной экстракции может
заместителями при фосфорильной группе экстраги-
быть выражена как
рует Th(IV), U(VI), Am(III) и Ln(III) из азотнокис-
лых растворов значительно более эффективно, чем
Kex = DM[LHTf2N]3[H+]-3.
(3)
на основе его бутилзамещенного аналога.
Ранее было показано, что комплексы Ln(III) та-
кой же стехиометрии экстрагируются растворами
ФОНДОВАЯ ПОДДЕРЖКА
КМФО в дихлорэтане из растворов, содержащих
ионы Tf2N- [32]. При этом устойчивость комплек-
Работа выполнена в рамках Государственного за-
сов LnL3(Tf2N)3 определяется величиной константы
дания 2022 г. ИФТТ РАН, ИПТМ РАН и ИФХЭ РАН.
экстракции в такой системе
ꞌ = DLn[Tf2N-]3[L]-3.
(4)
КОНФЛИКТ ИНТЕРЕСОВ
Взаимосвязь между Kex и Kexꞌ может быть выра-
жена как
Авторы заявляют об отсутствии конфликта ин-
тересов.
Kex = KexꞌKHTf
-3.
(5)
2
N
Из этого выражения следует, что эффективность
СПИСОК ЛИТЕРАТУРЫ
экстракции ионов металлов растворами комплек-
сов LHTf2N возрастает с увеличением устойчиво-
1.
Myasoedov B.F., Kalmykov S.N. // Mendeleev Commun.
сти комплексов LnL3(Tf2N)3 и снижается с увели-
2015. Vol. 25, N 5. P. 319.
чением устойчивости LHTf2N. Большое различие
между величинами DLn при экстракции растворами
2.
Horwitz E.P., Martin K.A., Diamond H., Kaplan L. //
комплексов Ph2Bu2-HTf2N и Bu2Et2-HTf2N из рас-
Solvent Extr. Ion Exch. 1986. Vol. 4, N 3. P. 449.
творов 3 моль/л HNO3 (рис. 3) связано в большей
степени не с различием в устойчивости комплексов
3.
Чмутова М.К., Литвина М.Н., Прибылова Г.А.
LnL3(Tf2N)3 в системах с Ph2Bu2 и Bu2Et2 [32], а с
Иванова Л.А., Смирнов И.В., Шадрин А.Ю, Мясое-
более высокой устойчивостью комплекса Bu2Et2-
дов Б.Ф. // Радиохимия. 1999. Т. 41, № 4. С. 331.
HTf2N:
4.
Аляпышев М.Ю., Бабаин В.А., Устынюк Ю.А. // Успехи
химии. 2016. Т. 85, № 9. С. 943-961; Alyapyshev M Yu.,
DLn(Ph2Bu2-HTf2N)/DLn(Bu2Et2-HTf2N) =
Babain V.A., Ustynyuk Yu.A. // Russ. Chem. Rev. 2016.
ꞌ(Bu2Et2)][KHTf
(Bu2Et2)/
2N
Vol. 85, N 9. P. 943.
/KHTf
N
(Ph2Bu2)]3.
(6)
2
Природа органического растворителя суще-
5.
Romanovskiy V.N., Smirnov V.I., Babain V.A., Todd T.A.,
ственно влияет на экстракцию ионов металлов
Herbst R.S., Law J.D., Brewer K.N. // Solvent Extr. Ion
растворами LHTf2N. При экстракции растворами
Exch. 2001. Vol. 19, N 1. P. 1.
0.01 моль/л Ph2Bu2-HTf2N из растворов 3 моль/л
6.
Rais J., Tachimori S. // J. Radioanal. Nucl. Chem. Lett.
HNO3 значения lgDEu возрастают ряду о-ксилол
1994. Vol. 188, N 2. P. 157.
(-0.02) < дихлорэтан (0.32) < нитробензол (2.13) по
7.
Смирнов И.В. // Радиохимия. 2007. Т. 49, № 1. С. 40.
мере увеличения полярности органического раство-
8.
Белова В.В.
// Радиохимия.
2021. Т.
63. С.
3;
рителя.
Belova V.V. // Radiochemistry. 2021. V. 63. P. 1.
Представленные данные показали, что ионы ак-
тинидов и лантанидов(III) экстрагируются раство-
9.
Atanassova M. // J. Mol. Liq. 2021. Vol. 343. 117530.
рами комплексов КМФО с HTf2N из азотнокислых
РАДИОХИМИЯ том 65 № 1 2023
46
ТУРАНОВ и др.
10. Туранов А.Н., Карандашев В.К., Яркевич А.Н. // Ра-
22. Туранов А.Н., Карандашев В.К., Харитонов А.В.,
диохимия. 2013. Т. 55, № 4. С. 314; Turanov, A.N.,
Лежнев А.Н., Сафронова З.В., Яркевич А.Н., Цвет-
Karandashev, V.K., Yarkevich, A.N. // Radiochemistry.
ков Е.Н. // ЖОХ. 1999. Т. 69, № 7. С. 1109; Turanov A.N.,
2013. Vol. 55, N 4. P. 382.
Karandashev V.K., Kharitonov A.N., Lezhnev A.N.,
Safronova Z.V., Yarkevich A.N. Tsvetkov E.N. // Russ. J.
11. Туранов А.Н., Карандашев В.К., Яркевич А.Н. // Ра-
Gen. Chem. 1999. Vol. 69, N 7. P. 1068.
диохимия. 2022. Т. 64, № 2. С. 164; Turanov, A.N.,
23. Чмутова М.К., Иванова Л.А., Кочеткова Н.Е., Не-
Karandashev, V.K., Yarkevich, A.N. // Radiochemistry.
2022. Vol. 64, N 2. P. 163.
стерова Н.П., Мясоедов Б.Ф., Розен А.М. // Радиохи-
мия. 1995. Т. 37, № 5. С. 422.
12. Turanov A.N., Karandashev V.K., Sharova E.V.,
24. Стоянов Е.С., Воробьева Т.П., Смирнов И.В. // ЖСХ.
Genkina G.K., Artyushin O.I., Baimukhanova A.
//
2003. Т. 44, № 3. С. 414.
Radiochim. Acta. 2018. Vol. 106. P. 355.
25. Stoyanov E.S., Smirnov I.V., Fedotov M.A. // J. Phys.
13. Прибылова Г.А., Смирнов И.В., Новиков А.П. // Ради-
Chem. A. 2006. Vol. 110. P. 9505.
охимия. 2012. Т. 54, № 5. С. 435.
26. Stoyanov E.S., Smirnov I.V. // J. Mol. Struct.
2005.
14. Pribilova G., Smirnov I., Novikov A. // J. Radioanal.
Nucl. Chem. 2012. Vol. 295. P. 83.
Vol. 740. P. 9.
15. Chmutova M.K., Litvina M.N., Nesterova N.P.,
27. Розен А.М., Крупнов Б. В. // Успехи химии. 1996.
Myasoedov B.F., Kabachnik M.I. // Solvent Extr. Ion
Т.65, № 11. С. 1052-1079; Rozen A.M., Krupnov B.V. //
Exch. 1992. Vol. 10. P. 439.
Russ. Chem. Rev. 1996. Vol. 65, N 11. P. 973.
16. Gaillard C., Boltoeva M., Billard I., Georg S., Mazan V.,
Ouadi A., Ternova D., Henning C. // ChemPhysChem.
28. Чмутова М.К., Литвина М.Н., Прибылова Г.А.,
2015. Vol. 16. P. 2653.
Иванова Л.А., Смирнов И.В., Шадрин А.Ю., Мясое-
дов Б.Ф. // Радиохимия. 1999. Т. 41, № 4. С. 331.
17. Sun T., Zhang Y., Wu Q., Chen J., Xia L., Xu C. // Solvent
Extr. Ion Exch. 2017. Vol. 35. P. 408.
29. Литвина М.Н., Чмутова М.К., Мясоедов Б.Ф., Ка-
бачник М.И. // Радиохимия. 1996. Т. 38, № 6. С. 525.
18. Чмутова М.К., Куляко Ю.М., Литвина М.Н., Мали-
30. Binnemans K. // Chem. Rev. 2007. Vol. 107. P. 2593.
ков Д.А., Мясоедов Б.Ф. // Радиохимия. 1998. Т. 40,
№ 3. С. 241.
31. Шарова Е.В., Артюшин О.И., Нелюбина Ю.В., Лы-
19. Куляко Ю.М., Самсонов М.Д., Литвина М.Н., Чму-
сенко К.А., Пасечник М.П., Одинец И. Л. // Изв. АН.
това М.К., Мясоедов Б.Ф. // Радиохимия. 2002. Т. 44,
Сер. хим. 2008. N 9. С. 1856.
№ 3. С. 235.
32. Туранов А.Н., Карандашев В.К., Яркевич А.Н. // Ра-
20. Katsuta S., Watanabe Y., Araki Y., Kudo Y. // ACS Sust.
Chem. Eng. 2016. Vol. 4. P. 564.
диохимия. 2018. Т. 60, № 2. С. 153; Turanov, A.N.,
Karandashev, V.K., Yarkevich, A.N. // Radiochemistry.
21. Turanov A.N., Karandashev V.K., Baulin V.E. // Solvent
Extr. Ion Exch. 2012. Vol. 30, N 3. P. 244.
2018. Vol. 60, N 2. P. 170-176.
РАДИОХИМИЯ том 65 № 1 2023