РАДИОХИМИЯ, 2023, том 65, № 1, с. 17-22
УДК 539.26:(546.791.6+546.798.21+546.798.22)
КОМПЛЕКСЫ An(VI) С АНИОНАМИ ФУМАРОВОЙ
КИСЛОТЫ
© 2023 г. М. С. Григорьева, И. А. Чарушниковаа,*, А. М. Федосеева
а Институт физической химии и электрохимии им. А.Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4
*e-mail:charushnikovai@ipc.rssi.ru
Поступила в редакцию 23.05.2022, после доработки 05.07.2022, принята к публикации 12.07.2022
Синтезированы и структурно охарактеризованы фумараты An(VI): дигидраты общего состава
[AnO2(C4H2O4)(H2O)2] (An = U, Np, Pu) и моногидрат [UO2(C4H2O4)H2O]. Дигидраты имеют цепочечное
строение, координационный полиэдр (КП) атомов An(VI) -искаженная гексагональная бипирамида.
Фумарат-ионы связаны с двумя катионами AnO22+ с образованием четырехчленных металлоциклов.
Структура моногидрата каркасная, КП атома урана(VI) - пентагональная бипирамида. Фумарат-
ион является мостиковым лигандом, координированным к четырем катионам UO22+ монодентатным
способом. В дигидратах [AnO2(C4H2O4)(H2O)2] актинидное сжатие проявляется в уменьшении
межатомного расстояния в группах AnO2 и в уменьшении объема полиэдров Вороного-Дирихле по
ряду U(VI)-Np(VI)-Pu(VI).
Ключевые слова: уран(VI), нептуний(VI), плутоний(VI), фумараты, синтез, кристаллическая структура.
DOI: 10.31857/S0033831123010021, EDN: OGDZEC
Работы по синтезу и изучению строения и
которого получены при комнатной температуре.
свойств соединений f-элементов с анионами
Позже в работе
[12] было описано строение
карбоновых кислот необходимы для углубления
комплекса U(IV) с фумарат- и формиат-ионами
наших знаний химии этих металлов и для
состава U6O4(OH)4(fum)5(form)2(H2O)2·3DMF, где
разработки
возможных
технологических
DMF = N,N-диметилформамид. Было исследовано
процессов. В отличие от монокарбоновых кислот
также термическое поведение моногидрата
дикарбоновые кислоты существенно реже являются
фумарата уранила [UO2(C4H2O4)H2O], который был
предметом исследований в системах с актинидами.
выделен в виде порошка [13], однако структура его
Комплексы на основе предельных и непредельных
не была определена.
дикарбоновых кислот в подавляющем большинстве
В литературе отсутствуют данные о строении
изучены для уранила [1-7]. Определенный интерес
фумаратов других трансурановых элементов
вызывает исследование актинидных комплексов
в степени окисления
+6. В настоящей работе
с непредельными дикарбоновыми кислотами -
синтезированы изоструктурные дигидраты урана,
фумаровой и ее цис-изомером
- малеиновой.
нептуния и плутония [AnO2(C4H2O4)(H2O)2] (I) и
С малеат-ионами изучены следующие соединения:
моногидрат [UO2(C4H2O4)H2O] (II), определена их
K[UO2(C4H2O4)(C4H3O4)] включающий в себя
структура.
одно- и двухзарядный анионы [8], два комплекса
(NH4)2[UO2(C4H2O4)2] и Cs2[(UO2)3(C4H2O4)4]·2H2O
[9]. Также исследовано строение двойной соли
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
малеиновой кислоты с Np(V) и Co(NH3)3+ состава
Co(NH3)6[NpO2(C4H3O4)2(H2O)3](C4H3O4)2·H2O
Синтез проводили с использованием в качестве
[10]. С фумарат-ионом был выделен и структурно
исходных материалов UO3 марки х.ч., NpO3∙2H2O
охарактеризован дигидрат состава [UO2(C4H2O4)
и PuO2(OH)2·xH2O (x ≈ 2) [14], приготовленных
(H2O)2]
[11], экспериментальные данные для озонированием водной суспензии гексагидрата
17
18
ГРИГОРЬЕВ и др.
Таблица 1. Кристаллографические данные и характеристики рентгеноструктурных экспериментов
Соединение
Ia [11]
Ia
Ib
Ic
II
Эмпирическая формула
C4H6O8U
C4H6O8U
C4H6NpO8
C4H6O8Pu
C4H4O7U
Молекулярная масса
420.12
420.12
419.09
421.14
402.10
Размеры кристалла, мм3
0.10 0.08 0.08
0.12 0.10 0.03
0.10 0.08 0.06
0.18 0.16 0.06
Температура, K
Комнатная
100(2)
100(2)
100(2)
100(2)
θmax, град
25
35
35
35
35
Сингония
Моноклинная
Моноклинная
Моноклинная
Моноклинная
Ромбическая
Пространственная
P21/n
P21/n
P21/n
P21/n
Pbcn
группа
Параметры ячейки:
a, Å
5.571(2)
5.5468(3)
5.5104(3)
5.4812(1)
7.8816(6)
b, Å
7.502(2)
7.5048(3)
7.5438(5)
7.5703(2)
9.5899(7)
с, Å
9.952(3)
9.8264(4)
9.9131(6)
9.9833(2)
9.9899(7)
β, град
98.6(3)
98.259(3)
99.235(1)
99.884(2)
90
Объем ячейки, Å3, Z
411.25, 2
404.81(3), 2
406.74(4), 2
408.102(16), 2
755.07(10), 4
ρвыч, г/см3
3.39
3.447
3.422
3.451
3.537
μ(MoKα), мм-1
18.88
19.28
8.29
8.57
20.66
Число измеренных/
862
6431/1765
6886/1775
6368/1781
11882/1656
независимых отражений
Число независимых
555 [I > 3(I)]
1213
1309
1123
1172
отражений с I > 2(I)
Число уточняемых
68
68
68
60
параметров
R(F), wR(F2)
0.0235
0.0170, 0.0344
0.0131, 0.0260
0.0239, 0.0551
0.0207, 0.0509
[I > 2(I)]
R(F), wR(F2) [все
0.0331, 0.0383
0.0223, 0.0289
0.0479, 0.0634
0.0342, 0.571
данные]
GOOF
1.030
1.036
1.003
1.029
Δρmax и Δρmin, e Å-3
1.390, -1.152
0.668, -0.769
3.013, -2.986
4.154, -2.585
оксалата четырехвалентного нептуния и плутония.
выделяются
[NpO2(C4H2O4)(H2O)2] (Ib) в виде
Навеску UO3, NpO3∙2H2O и PuO2(OH)2·xH2O в
серо-зеленых и
[PuO2(C4H2O4)(H2O)2] (Ic) в
5-10 мг растворяли в насыщенном водном растворе
виде коричневато-зеленоватых призматических
эквивалентного количества фумаровой кислоты
кристаллов, устойчивых в сухом виде.
марки ч.д.а. при перемешивании магнитной
Рентгенодифракционные
эксперименты
мешалкой при комнатной температуре. Полученные
проведены на автоматическом четырехкружном
растворы оставляли для медленного испарения в
дифрактометре
с
двумерным детектором
закрытых флаконах при комнатной температуре и в
Bruker Kappa Apex II (излучение MoKα).
холодильнике при 6-8°С. В случае урана образуются
Параметры элементарных ячеек уточнены по
светло-желтые призматические кристаллы: при
всему массиву данных. В экспериментальные
пониженной температуре
[UO2(C4H2O4)(H2O)2]
интенсивности введены поправки на поглощение
(Ia), при комнатной
[UO2(C4H2O4)H2O] (II).
с помощью программы SADABS [15]. Структуры
В случае нептуния и плутония при комнатной
расшифрованы прямым методом (SHELXS97 [16])
температуре происходит восстановление до Np(V)
и уточнены полноматричным методом наименьших
и Pu(IV) соответственно, о чем свидетельствует
квадратов (SHELXL-2018
[17]) по F2 по всем
изменение цвета реакционной смеси и выделение
данным в анизотропном приближении для всех
мелкокристаллического продукта в случае
неводородных атомов. Атомы H молекул воды
плутония.
При пониженной температуре
локализованы из разностных Фурье-синтезов, их
РАДИОХИМИЯ том 65 № 1 2023
КОМПЛЕКСЫ
An(VI) С АНИОНАМИ ФУМАРОВОЙ КИСЛОТЫ
19
О(1wa)
O(3)
О(2b)
C(1)
О(1a)
O(3c)
C(2)
C(2b)
О(2a)
C(1b)
Np(1)
C(1c)
О(2)
C(1a)
C(2c)
O(3b)
О(1)
C(2a)
O(2c)
О(1w) О(3a)
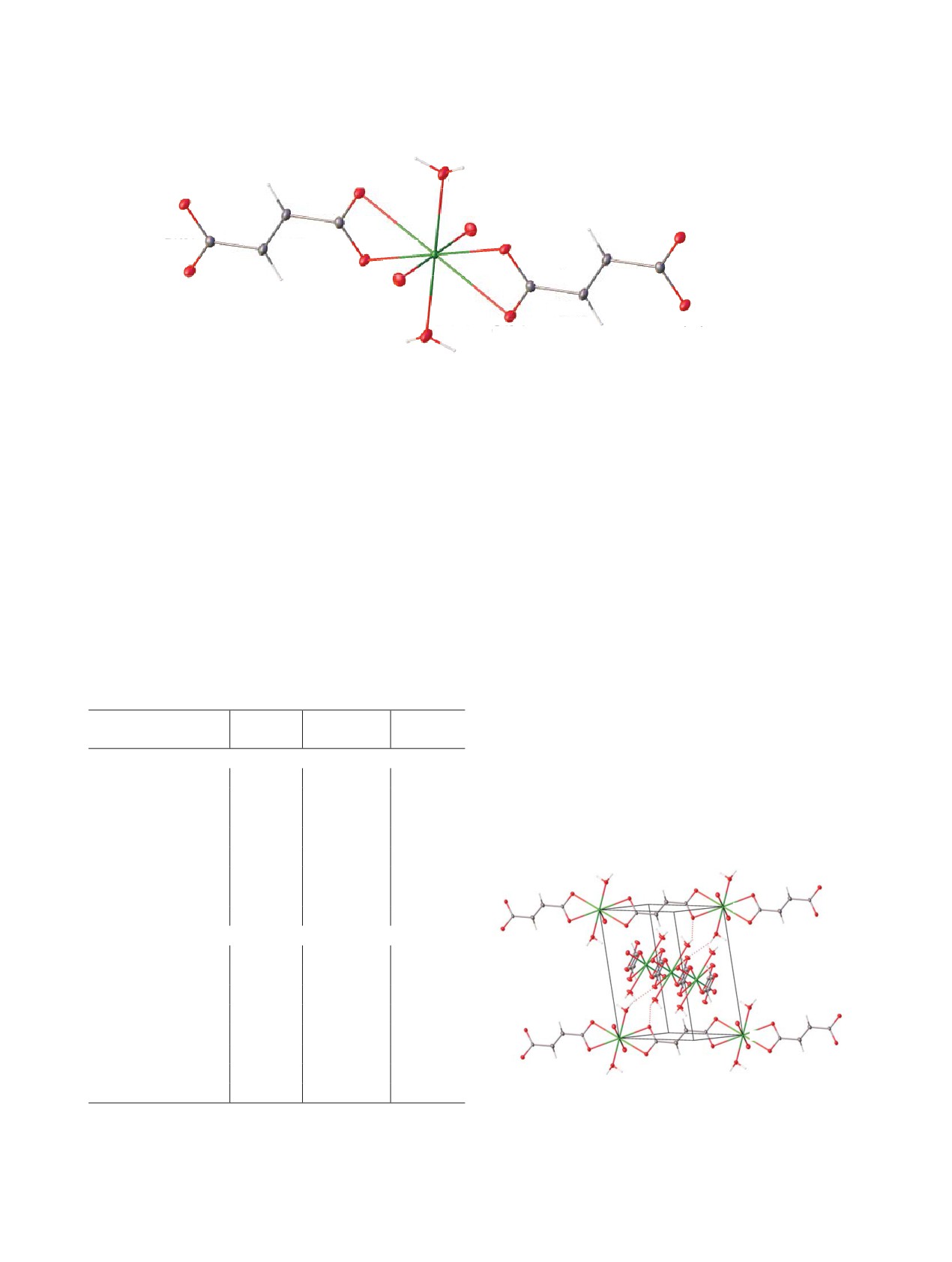
Рис. 1. Фрагмент структуры [NpO2(C4H2O4)(H2O)2] (Ib). Операции симметрии: a - (1 - x, 1 - y, 1 - z), b - (-x, 2 - y, 1 - z),
c - (x + 1, y - 1, z).
позиции уточнены с UН = 1.5Uэкв(O) и ограничением
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИE
расстояний O-H и углов H-O-H. Атомы H фумарат-
ионов введены на геометрически рассчитанные
Структура дигидратов [AnO2(C4H2O4)(H2O)2] (I)
позиции с UН = 1.2Uэкв(С).
относится к типу цепочечных. Атомы An(1) =
U(1) (Ia), Np(1) (Ib), Pu(1) (Ic) находятся в центрах
Основные кристаллографические данные и
инверсии (позиция 2a), имеют координационное
характеристики рентгеноструктурного экспери-
окружение в виде искаженных гексагональных
мента приведены в табл.
1. Длины связей и
бипирамид AnO8 с «ильными» атомами кислорода в
валентные углы в структурах приведены в табл. 2, 3.
апикальных позициях. Экваториальные плоскости
Координаты атомов депонированы в Кембриджский
бипирамид формируют четыре атома кислорода
центр кристаллографических данных, депозиты
от двух фумарат-ионов и атомы кислорода двух
CCDC 2171198-2171201.
молекул воды. Окружение центрального атома
представлено на примере Np(VI) (рис. 1), длины
Таблица 2. Длины связей (Å) и валентные углы (град) в
связей внутри координационного полиэдра (КП)
структуре I а
атомов An(VI) приведены в табл. 2. Анион C4H2O42-
Ia
Ic
Связь, угол
Ib (An=Np)
выступает как мостиковый лиганд, связывая
(An=U)
(An=Pu)
Длины связей
катионы AnO2+ в бесконечные электронейтральные
An(1)=O(1)
1.764(2)
1.7493(16)
1.736(4)
цепочки, показанные на примере плутонивого
An(1)-O(2)
2.424(2)
2.4261(14)
2.431(3)
дигидрата
(рис. 2).
В структуре дигидрата
An(1)-O(3)
2.568(2)
2.5708(15)
2.565(4)
цепочки укладываются в слои, параллельные
An(1)-O(1w)
2.457(2)
2.4546(17)
2.440(4)
плоскости (001). При этом в одном слое они
C(1)-O(2)
1.275(4)
1.271(3)
1.267(6)
C(1)-O(3)
1.259(4)
1.264(3)
1.267(5)
C(1)-C(2)
1.475(4)
1.476(3)
1.492(7)
b
0
C(2)-C(2b)
1.338(5)
1.331(4)
1.317(9)
a
Валентные углы
O(1)=An(1)=O(1a)
180.0
180.0
180.0
O(2)-An(1)-O(3)
51.87(7)
51.93(5)
51.90(11)
O(2)-An(1)-O(1w)
64.06(8)
64.21(5)
64.50(12)
O(3)-An(1)-O(1wa)
64.97(7)
64.80(5)
64.59(12)
O(2)-C(1)-O(3)
119.3(3)
119.60(18)
119.6(4)
c
O(2)-C(1)-C(2)
119.3(3)
119.25(18)
119.4(4)
O(3)-C(1)-C(2)
121.4(3)
121.15(19)
121.0(4)
C(1)-C(2)-C(2b)
120.2(4)
120.8(3)
119.4(6)
Рис.
2. Электронейтральные цепочки в структуре
а Операции симметрии: a - (1 - x, 1 - y, 1 - z), b - (-x, 2 - y,
[PuO2(C4H2O4)(H2O)2] (Ic). Пунктирными линиями
1 - z).
показаны водородные связи.
РАДИОХИМИЯ том 65 № 1 2023
20
ГРИГОРЬЕВ и др.
с участием молекулы координационно связанной
воды дополнительно объединяют фрагменты
структуры вдоль направления [100].
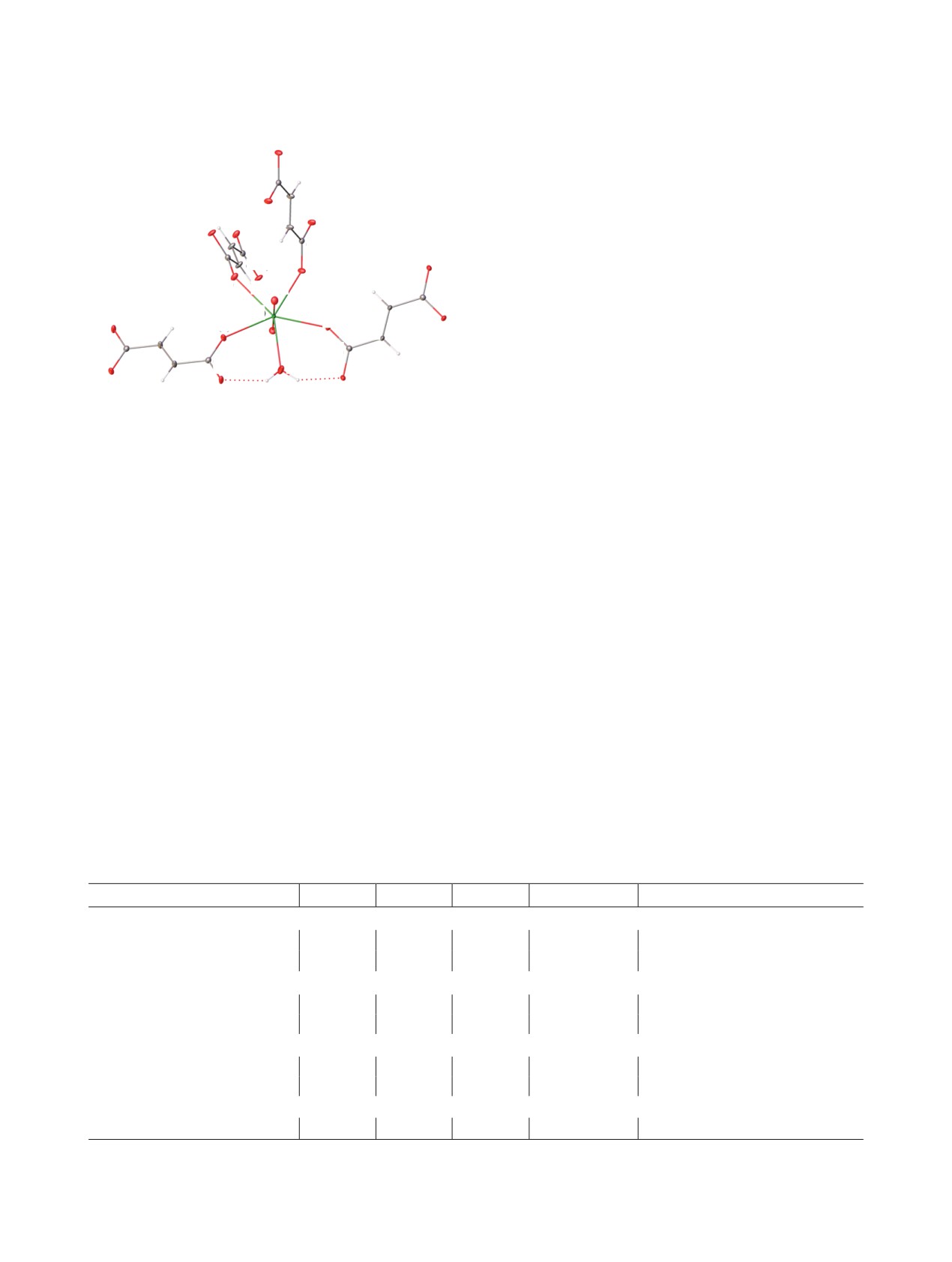
C(2c)
В соединениях со структурой I по ряду
O(2c)
O(2b)
U(VI)-Np(VI)-Pu(VI) актинидное сжатие в
C(1c)
C(1b)
экваториальных
плоскостях
гексагональных
C(2b) O(3c)
бипирамид не проявляется. Однако налицо
O(3b)
O(1a)
тенденция к уменьшению межатомного расстояния
U(1)
O(2a)
в группах AnO2 (табл. 2). Это хорошо согласуется
O(2)
C(2a)
O(1)
с данными работы [18], в которой рассмотрено
C(2)
C(1a)
C(1)
O(1w)
актинидное сжатие в кислородосодержащих
O(3a)
соединениях An(VI). В соединениях с КП AnO8 в
O(3)
ряду U-Np-Pu происходит уменьшение (примерно
O] (II).
Рис. 3. Фрагмент структуры [UO2(C4H2O4)H2
на 0.01 Å на каждом шаге) длины связей An=O в
Пунктирными линиями показаны водородные связи.
диоксокатионах AnO22+. Уменьшение длины связей
Операции симметрии: a - (1 - x, y, 1/2 - z), b - (1/2 - x, y +
1/2, z), c - (x + 1/2, y + 1/2, 1/2 - z).
An=O в диоксокатионах должно сопровождаться
закономерным уменьшением объема полиэдров
вытянуты вдоль направления [110], в соседнем
Вороного-Дирихле. Объем полиэдров Вороного-
через половину трансляции c слое они вытянуты
Дирихле для атомов An(VI) равен: 9.45 Å3 (для Ia),
вдоль направления [1-10]. Водородные связи,
9.38 Å3 (для Ib) и 9.26 Å3 (для Ic) [19]. Для атома
образованные
молекулами
координационно
урана в соединении II объем полиэдра Вороного-
связанной воды, объединяют цепочки из соседних
Дирихле равен 9.17 Å3. Это полностью согласуется
слоев (табл. 3). Акцепторами протонов выступают
с величинами 9.4(2) для КП UO8 и 9.2(1) для КП
атомы карбоксилатных групп анионов.
UO7, приведенными в работе [20], где рассмотрены
Структура моногидрата [UO2(C4H2O4)(H2O)] (II)
особенности стереохимии U(VI) в структурах
относится к типу каркасных. Атом U(1) находится
кристаллов.
в частной позиции 4с на оси 2, имеет кислородное
Как отмечалось выше, экспериментальные
окружение в виде искаженной пентагональной
данные для дигидрата Ia впервые были получены
бипирамиды UO7. Экваториальную плоскость
при комнатной температуре [11], в табл. 1 приведены
бипирамиды формируют атомы кислорода четырех
параметры ячейки для этого соединения. Сравнение
фумарат-ионов и молекулы воды (рис. 3). Длины
параметров ячейки для уранильного дигидрата,
связей внутри КП приведены в табл. 4. Фумарат-ион
полученных при комнатной температуре и 100 К,
является мостиковым лигандом, связывая четыре
показало, что параметр b не меняется. Наблюдается
катиона UO22+ в каркас (рис. 4). Водородные связи
незначительное уменьшение параметра а (~0.02 Å)
Таблица 3. Водородные связи в структурах
D-H···A
D-H, Å
H···A, Å
D···A, Å
D-H···A, град
Операция симметрии для A
[UO2(C4H2O4)(H2O)2] (Ia)
O(1w)-H(1)···O(3)
0.829(18)
2.20(3)
2.969(3)
154(4)
x - 1/2, -y + 3/2, z - 1/2
O(1w)-H(2)···O(2)
0.816(18)
1.98(2)
2.778(3)
167(4)
-x + 1/2, y - 1/2, -z + 1/2
[NpO2(C4H2O4)(H2O)2] (Ib)
O(1w)-H(1)···O(3)
0.822(17)
2.112(19)
2.913(2)
165(3)
x - 1/2, -y + 3/2, z - 1/2
O(1w)-H(2)···O(2)
0.835(17)
1.96(2)
2.771(2)
163(3)
-x + 1/2, y - 1/2, -z + 1/2
[PuO2(C4H2O4)(H2O)2] (Ic)
O(1w)-H(1)···O(3)
0.856(19)
2.11(4)
2.899(5)
153(7)
x - 1/2, -y + 3/2, z - 1/2
O(1w)-H(2)···O(2)
0.865(19)
1.99(4)
2.766(5)
148(5)
-x + 1/2, y - 1/2, -z + 1/2
[UO2(C4H2O4)(H2O)] (II)
O(1w)-H(1)···O(3)
0.832(17)
2.013(10)
2.720(2)
142(3)
1 - x, y, 1/2 - z
РАДИОХИМИЯ том 65 № 1 2023
КОМПЛЕКСЫ
An(VI) С АНИОНАМИ ФУМАРОВОЙ КИСЛОТЫ
21
0
a
c
Рис. 4. Кристаллическая упаковка [UO2(C4H2O4)H2O] (II), проекция вдоль направления [010]. Пунктирными линиями
показаны водородные связи.
и угловой характеристики (~0.3°). При понижении
прочную координационную связь и участвует
температуры происходит заметное уменьшение
в более прочной водородной связи (табл.
3).
параметра с (~0.13 Å). Такое изменение полностью
В структуре моногидрата II тетрадентатно-
согласуется со строением. Цепочки в слоях
мостиковый фумарат-ион связывается с четырьмя
вытянуты вдоль диагоналей [110] и [1-10]. Такое
катионами UO2+ монодентатным способом, в
расположение жестких лигандов с двойной связью
пентагональной бипирамиде UO7 налицо другая
C=C обеспечивает неизменность параметров a
картина. Координационная связь с атомом О(3)
и b, но между слоями расстояние сокращается с
слабее, чем с атомом О(2) (табл. 4), но при этом
уменьшением амплитуд температурных смещений
атом О(2) не задействован в водородном связывании
атомов. Соответственно уменьшается и параметр с.
(табл. 3).
Рассмотрим
особенности
строения
В табл.
5
приведены геометрические
координационного окружения атомов An(VI)
характеристики составных частей структур:
в соединениях I и II. В структуре дигидратов
максимальное отклонение атомов кислорода от
I карбоксилатные группы COO фумарат-иона
среднеквадратичной экваториальной плоскости
координированы к катионам AnO2+ бидентатно-
бипирамид AnO8 (I) и UO7 (II) (Δэкв., Å), отклонение
циклическим
способом
с
образованием
атомов кислорода и углерода от среднеквадратичной
четырехчленного металлоцикла. В экваториальной
плоскости фумарат-ионов (Δанион, Å). Угловые
плоскости бипирамид AnO8 длины связей An-O
характеристики
представлены
разворотом
с атомами кислорода фумарат-иона сильно
карбоксилатных групп относительно углеродного
различаются (табл. 2). Обращает на себя внимание
скелета фумарат-ионов (φ1, град) и диэдрическими
тот факт, что атом кислорода О(2) образует более
углами между экваториальными плоскостями
Таблица 4. Длины связей (d, Å) и валентные углы (ω, град)
бипирамид и плоскостями анионов (φ2, град).
в структуре IIа
Фумарат-ионы в структурах I и II имеют плоское
Связь
d
Угол
ω
строение. В структуре I разворот карбоксилатных
U(1)=O(1)
1.761(2)
O(1)=U(1)=O(1a)
178.06(12)
групп относительно плоского углеводородного
U(1)-O(2)
2.354(2)
O(2)-U(1)-O(3b)
72.07(7)
скелета не превышает 9°, в структуре II группы СОО
U(1)-O(3b)
2.412(2)
O(3b)-U(1)-O(3c)
73.05(10)
развенуты на ~3°. Этим фумарат-ион отличается
U(1)-O(1w)
2.440(4)
O(2)-U(1)-O(1w)
71.42(5)
от своего цис-изомера - малеат-иона, у которого
C(1)-O(2)
1.260(3)
O(2)-C(1)-O(3)
122.3(3)
разворот может достигать ~90° [9].
C(1)-O(3)
1.274(3)
O(2)-C(1)-C(2)
118.8(2)
C(1)-C(2)
1.476(4)
O(3)-C(1)-C(2)
119.0(2)
Таким образом, исследовано строение
C(2)-C(2d)
1.332(5)
C(1)-C(2)-C(2d)
121.3(3)
дигидратов фумаратов An(VI) общего состава
[AnO2(C4H2O4)(H2O)2] (An = U, Np, Pu) (I) и
аОперации симметрии: a - (1 - x, y, 1/2 - z), b - (1/2 - x,
моногидрата [UO2(C4H2O4)H2O] (II). Переход от
y + 1/2, z), c - (x + 1/2, y + 1/2, 1/2 - z), d - (-x, 1 - y, -z).
РАДИОХИМИЯ том 65 № 1 2023
22
ГРИГОРЬЕВ и др.
Таблица 5. Отклонение (Δ, Å) атомов от среднеквадратичной экваториальной плоскости КП AnO8 (I) и UO7 (II) и
фумарат-ионов C4H2O2-
Соединение
Δэкв, Å
Δанион, Å
φ1, град
φ2, град
Операции симметрии
Ia
±0.146(2)
±0.058(3)
7.5(7)
15.2(1)
Ib
±0.148(1)
±0.058(2)
7.6(5)
15.0(1)
Ic
±0.151(2)
±0.070(5)
9(1)
15.1(2)
II
±0.019(2)
±0.021(3)
2.8(7)
24.28(8)
24.28(8)
1 + x, 1 - y, 1/2 + z
66.90(4)
1/2 + x, 3/2 - y, -z
66.90(4)
1/2 - x, 3/2 - y, 1/2 + z
дигидратов к моногидрату сопровождается как
5.
Kim J.-Y., Norquist A.J., O’Hare D. // Dalton Trans.
изменением КП атома An(VI) и типа координации
2003. P. 2813-2814.
6.
Чарушникова И.А., Федосеев А.М., Бессонов А.А. //
фумарат-иона, так и изменением типа структуры.
Радиохимия. 2019. Т. 61, № 2. С. 100-107.
В соединениях со структурой I актинидное
7.
Чарушникова И.А., Федосеев А.М., Буданцева Н.А.,
сжатие проявляется в уменьшении межатомного
Полякова И.Н., Муази Ф. // Координац. химия. 2007.
расстояния в группировках AnO2 и в уменьшении
Т. 33, № 1. С. 63-69.
объема полиэдров Вороного-Дирихле по ряду
8.
Bombieri G., Benetollo F., Rojas R.M., De Paz M.L. // J.
U(VI)-Np(VI)-Pu(VI).
Inorg. Nucl. Chem. 1981. Vol. 43, N 12. P. 3203-3207.
9.
Savchenkov A.V., Grigoriev M.S., Udivankin P.A.,
Pushkin D.V., Serezhkina L.B. // Polyhedron.
2017.
БЛАГОДАРНОСТИ
Vol. 127. P. 331-336.
10. Чарушникова И.А., Крот Н.Н., Старикова И.А. //
Рентгенодифракционные эксперименты выпол-
Радиохимия. 2004. Т. 46, № 6. C. 521-523.
11. Bombieri G., Benetollo F., Rojas R.M., De Paz M.L.,
нены в Центре коллективного пользования физиче-
Del Pra A. // Inorg. Chim. Acta. 1982. Vol. 61. P. 149-
скими методами исследования ИФХЭ РАН.
154.
12. Falaise С., Volkringer C., Loiseau T. // Cryst. Growth
КОНФЛИКТ ИНТЕРЕСОВ
Des. 2013. Vol. 13. P. 3225-3231.
13. Rojas R. M., De Paz M. L., Vila E. // J. Therm. Anal.
Авторы заявляют об отсутствии конфликта
1985. Vol. 30. P. 83-96.
интересов.
14. Федосеев А.М., Гоголев А.В., Шилов В.П.
//
Радиохимия. 2017. Т. 59, № 6. С. 502-509.
15. Sheldrick G.M. SADABS. Madison, Wisconsin (USA):
СПИСОК ЛИТЕРАТУРЫ
Bruker AXS, 2008.
16. Sheldrick G.M. // Acta Crystallogr., Sect. A.
2008.
1.
Loiseau T., Mihalcea I., Henry N., Volkringer C. //
Vol. 64, N 1. P. 112-122.
Coord. Chem. Rev. 2014. Vol. 266-267. P. 69-109.
17. Sheldrick G.M. // Acta Crystallogr., Sect. C.
2015.
2.
Borkowski L.A., Cahill C.L. // Cryst. Growth Des. 2006.
Vol. 71, N 1. P. 3-8.
Vol. 6, N 10. P. 2241-2247.
18. Сережкин В.Н., Савченков А.В., Сидоренко Г.В.,
3.
Сережкина Л.Б., Новиков С.А., Григорьев М.С.,
Сережкина Л.Б. // Радиохимия. 2019. Т. 61, № 4.
Колотилина М.А., Сережкин В.Н. // Радиохимия.
С. 297-307.
2016. Т. 58, № 5. С. 390-394.
19. Blatov V.A., Shevchenko A.P., Proserpio D.M. // Cryst.
4.
Сережкина Л.Б., Григорьев М.С., Новиков С.А.,
Growth Des. 2014. Vol. 14, N 7. P. 3576-3586.
Колотилина М.А., Сережкин В.Н. // Радиохимия.
20. Сережкин В.Н., Карасев М.О., Сережкина Л.Б. //
2017. Т. 59, № 1. С. 34-38.
Радиохимия. 2013. Т. 55, № 2. С. 97-105.
РАДИОХИМИЯ том 65 № 1 2023