РАДИОХИМИЯ, 2022, том 64, № 4, с. 377-381
УДК 546.798.21
ВОССТАНОВЛЕНИЕ NP(VI) ДИФОРМИЛГИДРАЗИНОМ
В РАСТВОРАХ ХЛОРНОЙ КИСЛОТЫ
© 2022 г. В. П. Шилов*, А. М. Федосеев**
Институт физической химии и электрохимии им. А.Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4
e-mail: * ShilovV@ipc.rssi.ru; ** fedosseev@ipc.rssi.ru
Поступила в редакцию 30.06.2021, после доработки 17.11.2021, принята к публикации 24.11.2021
Спектрофотометрическим методом изучена стехиометрия реакции Np(VI) c диформилгидразином
N2H2(CHO)2, ДФГ, в растворах 0.01 и 0.1 моль/л HClO4. При избытке Np(VI) 1 моль ДФГ восстанав-
ливает 4.4 моля Np(VI) до Np(V). В растворах 0.1-1.0 моль/л HClO4 (ионную силу I = 1.0 поддержи-
вали добавлением LiClO4), содержащих 5-50 ммоль/л ДФГ, при 20-45°С Np(VI) c концентрацией
0.6-2.1 ммоль/л восстанавливается по закону скорости первого порядка. Порядок скорости реакции
составляет 1 по ДФГ и -1 по ионам Н+. Активированный комплекс образуется с потерей 1 иона Н+.
Энергия активации равна 67 ± 3 кДж/моль.
Ключевые слова: нептуний(VI), хлорная кислота, диформилгидразин, стехиометрия, кинетика.
DOI: 10.31857/S0033831122040050, EDN: FRPICE
Переработку отработавшего ядерного топлива
твора Np(VI) и его стандартизацию выполняли по
(cмешанный нитрид урана и плутония) реактора
методикам, изложенным в работе [2]. Запасной
на быстрых нейтронах предполагается осущест-
раствор диформилгидразина в воде готовили по
влять экстракционными методами. Аффинаж урана
навеске препарата, поставленного Acros Organics.
планируется проводить экстракционно-хромато-
HClO4 и LiClO4 были квалификации х.ч. LiClO4 для
графически, и для удаления примесей нептуния и
дополнительной очистки перекристаллизовывали
технеция из раствора нитрата уранила намечается
из воды и сушили на воздухе при 190°С. Для приго-
восстанавливать их диформилгидразином, ДФГ,
товления запасных и рабочих растворов использо-
до неэкстрагируемых соединений. Кинетика вос-
вали дважды дистиллированную воду. Концентра-
становления Np(VI) диформилгидразином в рас-
цию HClO4 определяли титрованием стандартным
творах азотной кислоты изучена в работе [1]. Было
раствором NaOH. Раствор LiClO4 готовили по наве-
найдено, что порядок скорости реакции по Np(VI)
ске безводного препарата.
равен 1, порядки по ДФГ и HNO3 составляют 1.3 и
Опыты проводили по следующей методике.
-1.55 соответственно. Эти величины были получе-
Для определения стехиометрии реакции в кварце-
ны при переменной ионной силе, поэтому делать
вую кювету (l = 1 см) с приклеенной крышкой и
выводы о механизме реакции затруднительно.
пробкой из фторопласта помещали 3 мл раствoра
В данной работе исследована стехиометрия и
Np(VI) в 0.01 или 0.1 моль/л HClO4 и регистриро-
кинетика реакции нептуния(VI) c ДФГ в растворах
вали спектр поглощения в диапазоне 950-1000 нм
хлорной кислоты при постоянной ионной силе и на-
с помощью спектрофотометра Shimadzu PC 100
мечен механизм процесса.
(Япония) или СФ-46 ЛОМО (Россия). Затем вноси-
ли аликвоту раствора N2H2(CHO)2 и периодически
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
измеряли оптическую плотность при длине волны
980.2 (Shimadzu) или 980.4 нм (СФ-46), отвечаю-
Препарат 237Np очищали от примесей методом
щую главной полосе поглощения Np(V). При изуче-
анионного обмена. Приготовление запасного рас- нии кинетики реакции кювету с раствором HClO4,
377
378
ШИЛОВ, ФЕДОСЕЕВ
Таблица 1. Определение стехиометрии реакции нептуний(VI) + N2H2(CHO)2
[HClO4],
[Np(VI)],
[N2H2(CHO)2],
[Np(V)],
[Np(VI)]/[N2H2(CHO)2]
∆[Np)VI)]/∆[N2H2(CHO)2]
моль/л
ммоль/л
ммоль/л
ммоль/л
0.01
3.5
0.446
7.86
1.976
4.44
0.01
3.5
0.445
7.86
1.864
4.19
0.01
3.5
0.428
8.18
1.999
4.67
0.1
4.0
0.468
8.55
2.050
4.38
0.1
4.0
0.468
8.55
1.989
4.25
Среднее
4.4 ± 0.2
LiClO4 и N2H2(CHO)2 помещали в термостатиро-
силе I = 1.0, которую поддерживали добавлением
ванную ячейку в кюветном отделении спектрофо-
LiClO4. Стехиометрия реакции позволяла прово-
тометра, выдерживали 7-10 мин, вносили аликвоту
дить исследования при концентрациях ДФГ, лишь в
запасного раствора Np(VI) и следили за накоплени-
3-5 раз превышающих концентрацию Np(VI).
ем Np(V).
Кинетические кривые накопления Np(V) почти
соответствуют кинетическим кривым реакций, про-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
текающих по закону скорости первого порядка. В
координатах время-lg(D∞ - D) начальные участки
Стехиометрия реакции была изучена при 25°С.
кривых спрямляются, но через 5-7 мин наблюдает-
В растворе 0.01 или 0.1 моль/л HClO4, содержа-
ся резкое отклонение этих линий в сторону оси аб-
щем
3.5-4 ммоль/л Np(VI), после добавления
сцисс, т.е. реакция ускоряется. Отсюда следует, что
N2H2(CHO)2 до 0.4-0.5 ммоль/л сразу же началось
молекула ДФГ, попадая в кислый раствор, активи-
накопление Np(V). По начальной скорости рассчи-
руется, по-видимому переходит из одной конформа-
тывали бимолекулярную константу скорости ре-
ции в другую, при этом образуется более прочный
акции и оценивали время завершения реакции на
комплекс с ионом NpO2+. Поэтому были выполне-
99.9%. Оно должно составлять 0.3 и 3 ч. Для полной
ны опыты, в которых смесь HClO4 и ДФГ выдержи-
уверенности, что реакция закончилась, растворы
вали 1, 2 и 20 ч, а затем вносили аликвоту раствора
выдерживали 5-6 ч. Концентрацию Np(V) рассчи-
Np(VI). Во всех случаях кинетическая зависимость
тывали с использованием молярного коэффициента
в полулогарифмических координатах оставалась
погашения ε = 400 л·моль-1·см-1. Результаты пока-
прямой от начала до завершения реакции на 95%.
заны в табл. 1. В 5 опытах было получено отноше-
Двухчасовая выдержка обеспечивала максималь-
ние ∆[Np(VI)]/∆[N2H2(CHO)2] = 4.4 ± 0.2.
ную скорость реакции. Все последующие опыты
Гидразин в кислой среде существует в виде ка-
выполняли с выдержкой 2 ч. При необходимости ра-
тиона. Можно предположить, что и ДФГ в раство-
ботать с растворами, содержащими менее 1 моль/л
ре HClO4 присоединяет протон. Поэтому между
HClO4, выдерживали 2 ч смесь ДФГ и 1 моль/л
Np(VI) и ДФГ протекают следующие реакции:
HClO4 и затем добавляли воду или раствор LiClO4.
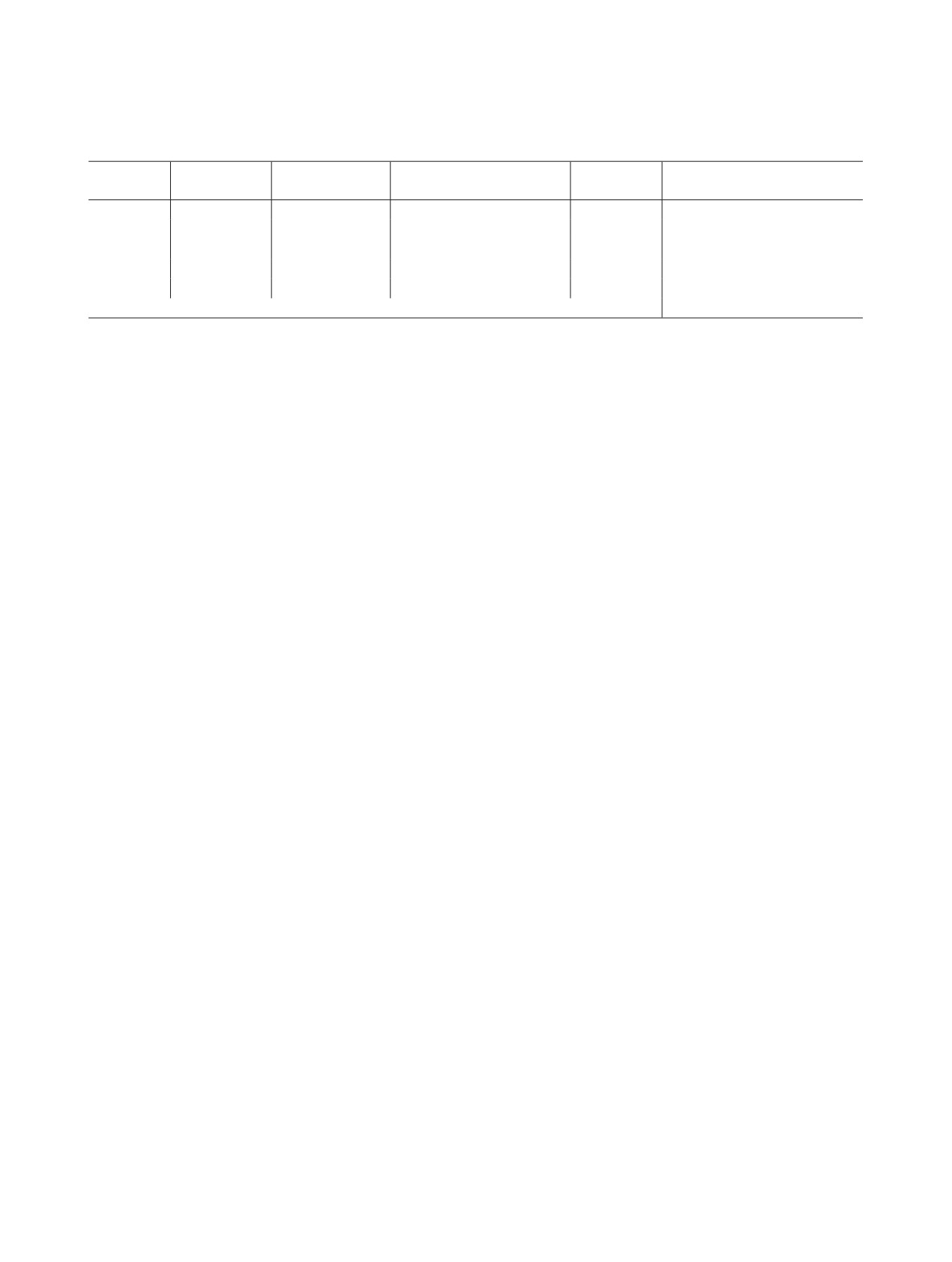
На рис. 1 приведены кинетические зависимости в
NpO2+ + N2H3(CHO)+ → NpO+ + R1,
(1)
полулогарифмических координатах для раствора
NpO22+ + R1 → NpO+ + R2,
(2)
1 моль/л HCLO4, содержащего 50 ммоль/л ДФГ и
NpO22+ + R2 → NpO+ + R3,
(3)
0.65, 1.15 и 1.65 ммоль/л Np(VI), при 24.5°С.
NpO22+ + R3 → NpO+ + R4,
(4)
Кинетические зависимости прямолинейны,
NpO2+ + R4 → NpO+ + продукты.
(5)
что свидетельствует о первом порядке реакции по
Np(VI). Кинетическое уравнение может быть пред-
Кроме того, на каком-то этапе радикалы гидро-
ставлено в виде
лизуются и вступают во взаимодействие между со-
бой.
-d[Np(VI)]/dt = kꞌ[Np(VI)] = kꞌ([Np(V)]∞ - [Np(V)]),
(6)
Кинетику реакции Np(VI) + N2H3(CHO)+ изуча-
где kꞌ - константа скорости первого порядка. В ин-
ли в растворах 0.1-1.0 моль/л HClO4 при ионной
тегральной форме после замены [Np(V)] на пропор-
РАДИОХИМИЯ том 64 № 4 2022
ВОССТАНОВЛЕНИЕ NP(VI) ДИФОРМИЛГИДР
АЗИНОМ
379
Таблица 2. Влияние условий на бимолекулярную констан-
Бимолекулярная константа скорости k в изучен-
ту скорости реакции Np(VI) + N2H2(CHO)2. I = 1.0 моль/л,
ном диапазоне концентраций N2H2(CHO)2 остается
[Np(VI)] = 1 ммоль/л, [N2H2(CHO)2] = 5 ммоль/л
постоянной. Методом стационарных концентраций
T, °C
[HClO4], моль/л
k, л·моль-1·с-1
можно показать, что k = nk1, n - число реакций,
20.5
1.0
0.133
включая медленную реакцию (1) и последующие
25
1.0
0.202
быстрые реакции радикалов с Np(VI), k1 - констан-
0.5
0.427
та скорости реакции (1). В табл. 2 представлены
0.2
1.01
значения k в различных условиях.
0.1
2.05
Из данных, представленных в таблице, видно,
30
1.0
0.313
что восстановление Np(VI) замедляется с ростом
35
1.0
0.490
концентрации HClO4. На рис. 2 приведена зависи-
40
1.0
0.733
мость k от [H+] в логарифмических координатах.
45
1.0
1.098
При 25°С экспериментальные точки лежат вблизи
прямой с угловым коэффициентом -1.0. Отсюда
циональную ей величину D уравнение (6) транс-
следует, что восстановление Np(VI) протекает че-
формируется в выражение
рез образование активированного комплекса (АК)
2.303lg(D∞ - D) = -kꞌ t + const,
(7)
с отщеплением одного протона, вероятно в стадии,
предшествующей возникновению активированного
здесь D и D∞ - текущая и конечная оптическая плот-
комплекса:
ность раствора.
N2H3(CHO)+ = N2H2(CHO)2 + H+,
Константа скорости первого порядка увеличи-
NpO2+ + N2H2(CHO)2 → АК,
вается пропорционально концентрации ДФГ. Это
АК → NpO+ + R1.
видно на примере растворов 1 моль/л HClO4, содер-
Механизм реакции с участием гидролизован-
жащих 1 ммоль/л Np(VI) и 5-50 ммоль/л ДФГ, при
ного Np(VI), как это постулировано для объясне-
25°С.
ния результатов реакции Np(VI) + N2H+ в растворе
HClO4 [3], маловероятен. Константа гидролиза
[ДФГ], ммоль/л
5
10
20
50
kꞌ × 103, c-1
0.995
2.20
4.26
9.85
NpO22+ + H2O = NpO2OH+ + H+.
k, л·моль-1·с-1
0.20
0.22
0.21
0.20
K = [NpO2OH+][H+]/[NpO2+]. В растворе 1 моль/л
Поэтому кинетическое уравнение выглядит сле-
NaClO4 методом потенциометрии найдено lgK =
дующим образом:
-5.19 [4]. Эта величина согласуется со значением
-d[Np(VI)]/dt = k[Np(VI)][N2H2(CHO)2].
(8)
lgK = -5.45, измеренным методом импульсного ра-
3
2
1
Рис. 1. Кинетические кривые восстановления Np(VI)
Рис. 2. Влияние концентрации ионов Н+ на константу
диформилгидразином в растворе 1 моль/л HClO4 +
скорости восстановления Np(VI) диформилгидразином в
50 ммоль/л ДФГ. T = 24.5oC. [Np(VI)], ммоль/л: 1 - 0.6,
2 - 1.15, 3 - 1.65.
растворе с ионой силой 1.0 при 25°С.
РАДИОХИМИЯ том 64 № 4 2022
380
ШИЛОВ, ФЕДОСЕЕВ
Таблица 3. Кинетические параметры реакций Np(VI) с производными гидразина в растворе азотной кислоты при
I = 2 моль/л и 25°С
Реагент
m
n
k, л·моль-1·с-1; k0, c-1
E, кДж/моль
Ссылка
Гидразин
1
-1.25
0.23
70.3
[7]
Метилгидразин
1
-1
0.88
58.6
[8]
1,2-Диметилгидразин
1
-1
0.72
43.2
[9]
1,1-Диметилгидразин, I = 1.0
1
-1
0.78
43.2
[10]
Этилгидразин
1
-1
0.54
61.5
[11]
Изопропилгидразин
1
-0.9
0.32
65.4
[12]
трет-Бутилгидразин
0.9
-1
0.086
61.3
[13]
Формилгидразин
1
-1
0.132
85.2
[14]
Диформилгидразин, I = 1.0
1
-1
0.186
[10]
Ацетилгидразин
1
-1
0.13
76.5
[14]
2-Оксиэтилгидразин
1
-1
5
56.7
[15]
диолиза [5]. Если в скорость-определяющей стадии
ных частиц. В данном случае NpO22+ контактирует
взаимодействуют NpO2OH+ и ДФГ,
с неподеленной парой электронов атома азота в мо-
NpO2OH+ + ДФГ + H+ = NpO+ + R1 + H2O,
лекуле ДФГ.
то скорость реакции описывается уравнением
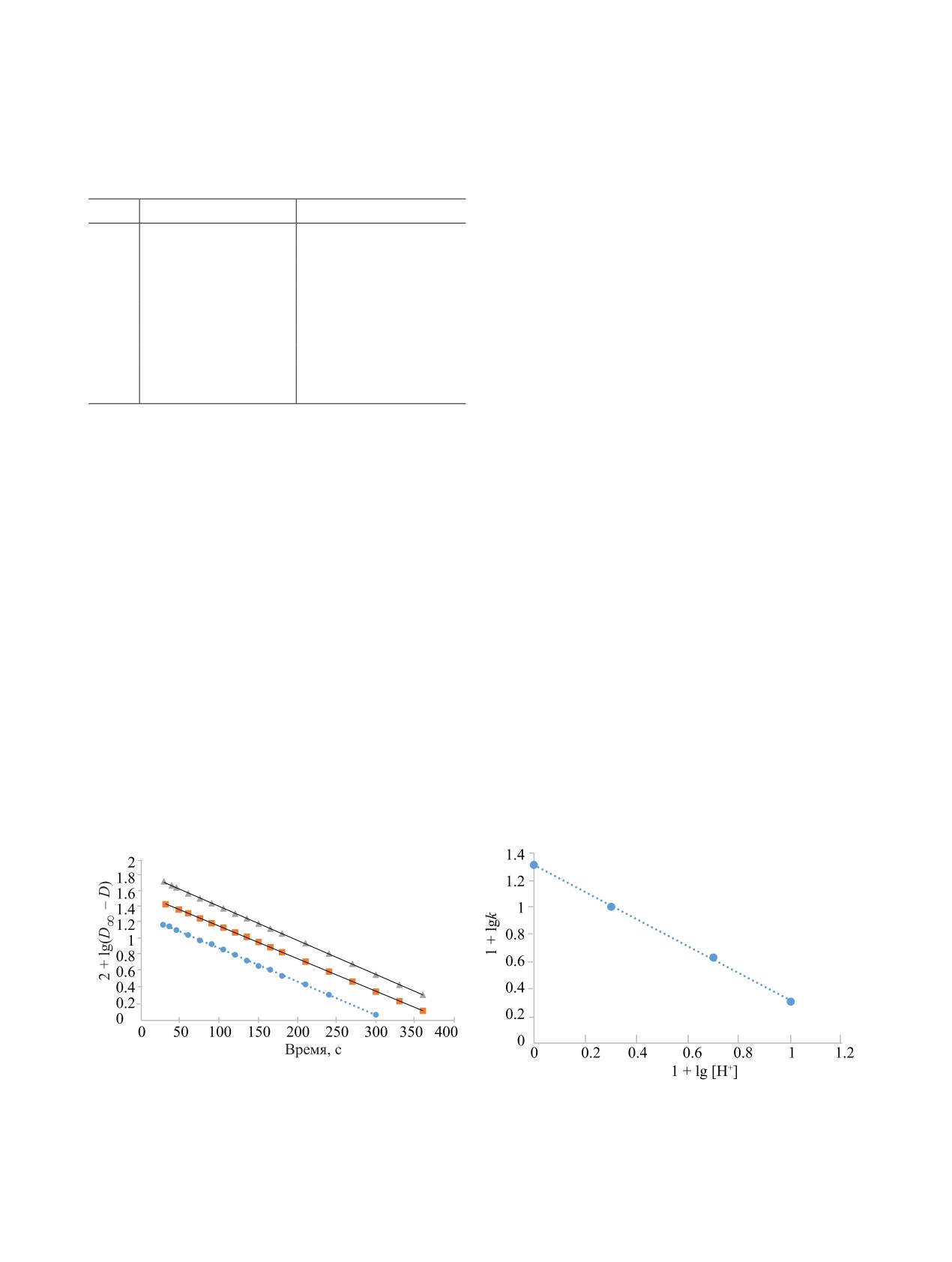
На рис. 3 показана температурная зависимость
k в координатах Аррениуса. Энергия активации со-
-d[Np(VI)]/dt = k2[NpO2OH+][ДФГ].
ставляет 67 ± 3 кДж/моль.
Концентрацию NpO2OH+ находим по соотноше-
Скорость процесса восстановления Np(VI) ди-
нию
формилгидразином передается следующим кинети-
[Np(VI)] = [NpO2+] + [NpO2OH+].
ческим уравнением, включающим всех участников:
Так как
[NpO2+] =
[NpO2OH+][H+]/K, то
-d[Np(VI)]/dt = k0[Np(VI)[N2H2(CHO)2][H+]-1.
(9)
[Np(VI)] = [NpO2OH+] + [NpO2OH+][H+]/K. В рас-
В растворе 1 моль/л HClO4 значение k0 численно
творе 1 моль/л HClO4 концентрация гидролизован-
равно k, т.е. 0.2, но размерность с-1.
ной формы [NpO2OH+] = [Np(VI)]/(1 + [H+]/K) =
Сравним стехиометрию реакций Np(VI) с гидра-
[Np(VI)]/(1 + 105.19 ) = [Np(VI)] × 6.5 × 10-6. Кинети-
зином и c ДФГ. В растворе 1 моль/л HClO4 при не-
ческое уравнение имеет вид
+]
достатке гидразина отношение ∆[Np(VI)]/∆[N2H5
-d[Np(VI)]/dt = k2[Np(VI)]·6.5 × 10-6[ДФГ] =
растет от 1 до 1.7 при увеличении [Np(VI)]/[N2H+] от
= k[Np(VI)][ДФГ].
1.2 до 11.5 [3]. Таким образом, при равных концен-
Отсюда k2·6.5 × 10-6 = 0.2 и k2 = 3 × 104 л·моль-1·с-1.
Эта величина превышает бимолекулярную констан-
ту скорости для реакции
NpO2+ + PuO+ = NpO+ + PuO2+,
равную 2.4 × 103 л·моль-1·с-1 [6]. Причем между
реагирующими частицами возникает катион-кати-
онный комплекс, что ускоряет реакцию. Такие ком-
плексы известны для U(V) + U(VI), Np(V) + U(VI).
Изменение ионной силы влияет на скорость
реaкции Np(VI) + ДФГ. В растворе 0.1 моль/л HClO4
k = 2.90 л·моль-1·с-1, в растворе 0.1 моль/л HClO4 +
0.9 моль/л LiClO4 k = 2.05 л·моль-1·с-1. Уменьшение
Рис. 3. Зависимость логарифма константы скорости вос-
скорости реакции с ростом ионной силы характер-
становления Np(VI) от обратной температуры в растворе
1 моль/л HClO4.
но для взаимодействия противоположно заряжен-
РАДИОХИМИЯ том 64 № 4 2022
ВОССТАНОВЛЕНИЕ NP(VI) ДИФОРМИЛГИДР
АЗИНОМ
381
трациях реагентов или при избытке гидразина 1 ион
Это не соответствует действительности. Однако в
N2H+ восстанавливает 1 ион Np(VI), но 1 молекула
работе [1] опыты проводились без поддержания по-
ДФГ восстанавливает 4.4 иона Np(VI). В растворе
стоянной ионной силы, поэтому приведенные там
1 моль/л HClO4 при 25°С константа скорости реак-
константы следует рассматривать как «кажущиеся»
ции Np(VI) с гидразином k = 0.2 л·моль-1·с-1 [3], т.е.
величины, недостаточно строгие, чтобы делать за-
одинаковая с константой скорости Np(VI) с ДФГ.
ключение о механизме реакций.
Но в случае ДФГ вслед за первой медленной ста-
дией идут быстрые реакции. Выше отмечалось, что
КОНФЛИКТ ИНТЕРЕСОВ
k = nk1, поэтому k1 = k/4.4 = 0.045 л·моль-1·с-1. От-
сюда следует, что реакция (1) более медленная, чем
Авторы заявляют об отсутствии конфликта ин-
реакция Np(VI) c N2H+.
тересов.
Поиск бессолевых реагентов для экстракцион-
ной переработки облученного ядерного топлива
СПИСОК ЛИТЕРАТУРЫ
вынуждает исследовать различные соединения, в
том числе органические замещенные гидразина.
1.
Двоеглазов К.Н., Павлюкевич Е.Ю., Митрикас П.В. //
Основа поиска - изучение кинетики восстановле-
Радиохимия. 2018. Т. 60, № 6. С. 498.
ния Np(VI) и Pu(IV) в растворах азотной и хлорной
2.
Шилов В.П., Федосеев А.М. // Радиохимия. 2015.
кислот. Установлено, что кинетика большинства ре-
Т. 57, № 3. С. 218.
акций Np(VI) с производными гидразина описыва-
3.
Колтунов В.С., Тихонов М.Ф. // Радиохимия. 1973.
ется уравнением
Т. 16, № 1. С. 84-90.
-d[Np(VI)]/dt = k[Np(VI)][Red]m =
4.
Cassol A., Magon L., Tomat G., Portanova R. // Inorg.
= k0[Np(VI)][Red]m[H+]n.
Chem. 1972. Vol. 11, N 3. P. 515-519.
При [HNO3] = 1 моль/л k и k0 численно равны,
5.
Schmidt K.H., Gordon S., Thompson M., Sullivan J.C.,
Mulac W.A. // Radiat. Phys. Chem. 1983. Vol. 21, N 3.
но отличаются размерностью. В табл. 3 даны кине-
P. 321-328.
тические параметры, т.е. m, n, k, энергия активации
6.
Fulton R.B., Newton T.W. // J. Phys. Chem. 1970. Vol. 74,
E реакций Np(VI) с производными гидразина в рас-
N 8. P. 1661-1669.
творах HNO3.
7.
Колтунов В.С., Тихонов М.Ф. // Радиохимия. 1973.
Из приведенных в табл. 3 данных следует, что
Т. 15, № 2. С. 194.
порядок скорости реакции по восстановителю ра-
8.
Колтунов В.С., Баранов С.М., Жарова Т.П.
//
вен 1, порядок относительно ионов Н+ равен или
Радиохимия. 1987. Т. 29, № 2. С. 155.
близок к -1. Одинаковая зависимость константы
9.
Колтунов В.С., Баранов С.М., Тихонов М.Ф.
//
скорости от концентраций реагентов позволяет
Радиохимия. 1989. Т. 31, № 2. С. 28.
сделать вывод об одинаковом механизме реакций,
10.
Taylor R.J., May I., Koltunov V.S., Baranov S.M.,
включающем участие в медленной стадии незаря-
Marcheno V.I., Mezhov E.A., Zhuavleva G.I.,
женных форм производных гидразина. Эти формы
Savilova O.A. // Radiochim. Acta. 1998. Vol. 81, N 3.
образуются в быстрой предварительной стадии де-
P. 149.
протонирования.
11.
Колтунов В.С., Баранов С.М., Тихонов М.Ф.
//
В работе [13] рассмотрены общие закономерно-
Радиохимия. 1989. Т. 31, № 1. С. 45-50.
сти реакций окисления замещенных гидразинов.
12.
Баранов С.М., Колтунов В.С., Жарова Т.П.
//
Отмечается, что реакционная способность опреде-
Радиохимия. 1993. Т. 35, № 3. С. 20-24.
ляется, с одной стороны, основностью гидразинов,
13.
Колтунов В.С., Баранов С.М., Жарова Т.П.
//
с другой - индукционным эффектом радикалов-за-
Радиохимия. 1993. Т. 35, № 3. С. 25-30.
местителей (индукционными константами Тафта).
14.
Колтунов В.С., Баранов С.М., Тихонов М.Ф. Жаро-
В работе [1] на основании полученных порядков
ва Т.П. // Радиохимия. 1989. Т. 31, № 2. С. 34.
скорости реакции относительно реагентов сделан
15.
Баранов С.М., Колтунов В.С. // Радиохимия. 1991.
вывод о протекании двух параллельных реакций.
Т. 33, № 4. С. 58.
РАДИОХИМИЯ том 64 № 4 2022