РАДИОХИМИЯ, 2022, том 64, № 3, с. 297-300
УДК 3.545:543.42
КОНЦЕНТРИРОВАНИЕ И ОПРЕДЕЛЕНИЕ УРАНА(VI)
СОРБЕНТОМ, СОДЕРЖАЩИМ ФРАГМЕНТЫ
п-АМИНОБЕНЗОЙНОЙ КИСЛОТЫ
© 2022 г. Ф. Н. Бахманова
Бакинский государственный университет, пр. Академика Захида Халилова 33,
Баку, AZ1148 Азербайджан
e-mail: fidan_chem@rambler.ru
Поступила в редакцию 12.03.2021, после доработки 09.09.2021, принята к публикации 16.09.2021
Изучены сорбционные и комплексообразующие свойства модифицированного сорбента на основе
сополимера малеинового ангидрида с метакриловой кислотой по отношению к урану(VI) и определены
основные параметры сорбции металла. Основное внимание было уделено изучению влияния на сорбцию
урана рН среды, продолжительности контакта (1-250 мин), ионной силы (0-1.4) и концентрации
металла в растворе. Максимальная степень извлечения урана(VI) сорбентом достигается из растворов
с рН 4. Сорбционное равновесие достигается после 3 ч. При увеличении ионной силы раствора выше
0.6 сорбция металла значительно уменьшалась. С увеличением концентрации урана(VI) в растворе
величина его сорбции увеличивается и при концентрации 8 × 10-3 М достигает максимума: статическая
емкость 539 мг/г. Определены условия десорбции урана(VI) разными минеральными кислотами (HClО4,
H2SО4, HNО3, HCl) после концентрирования на предлагаемом сорбенте. Уран(VI) количественно
десорбируется 2 М HCl. Степень извлечения урана(VI) в оптимальных условиях превышает 95%.
Ключевые слова: сорбция, уран (VI), концентрирование, десорбция, определение.
DOI: 10.31857/S0033831122030133, EDN: FQVRSF
ВВЕДЕНИЕ
некоторых методах сорбция происходит при высо-
кой температуре [19, 20], а при комнатной темпера-
Радиоактивные элементы, в том числе уран, яв-
туре поглощение металла не происходит. Некоторые
ляются весьма нежелательной примесью во многих
из них обладают низкой сорбционной емкостью по
объектах окружающей среды. В связи с токсично-
отношению к урану(VI) [10-20]. Некоторые методы
стью установление его присутствия и количества
применимы только для растворов со слишком малой
является актуальной задачей. Анализ природных
ионной силой [16]. В связи с этим важна разработка
и промышленных объектов с целью извлечения и
новых, простых методик извлечения и определения
определения урана(VI) проводят с использованием
радиоактивных металлов на уровне значительно
различных физико-химических методов: спектро-
ниже предельно допустимой концентрации. В по-
фотометрических 1-5, хроматографических 6-9,
следнее время широко применяют сорбционные ме-
сорбционных [10-20]. Однако возможности вышеу-
тоды 21-28.
казанных методов не всегда позволяют определять
В настоящей работе предложена новая методика
микроколичества токсичных элементов в объектах
сорбционно-спектрофотометрического определе-
различного состава. У некоторых методов чувстви-
тельность мала, некоторые требуют дорогое обо-
ния микроколичеств урана(VI). Предлагаемая мето-
рудование. Большинство сорбентов, используемых для
дика основана на предварительном концентрирова-
концентрирования, имеют определенные недостатки. В
нии урана(VI) из объекта с применением полимер-
297
298
БАХМАНОВА
Таблица 1. Зависимость сорбционной емкости (СЕ) от
Таблица 2. Зависимость сорбционной емкости от ионной
кислотности среды
силы
РH
1
2
3
4
5
6
7
І
0.2
0.4
0.6
0.8
1.0
1.2
1.4
СЕ, мг/г
35
40
60
103
55
42
42
СЕ, мг/г
103
103
103
90
74
51
22
ного хелатного сорбента, содержащего фрагменты
трация урана(VI) определена из градуировочного
п-аминобензойной кислоты (ПАБК).
графика.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Аппаратура. Кислотность раствора контролиро-
При исследовании основное внимание было уде-
вали стеклянным электродом на иономере PHS-25.
лено изучению влияния на сорбцию урана(VI) рН
Оптическую плотность измеряли на фотоколориме-
среды, продолжительности контакта, ионной силы,
тре КФК 2 (l = 1 cм).
концентрации металла в растворе.
Растворы, реагенты, сорбент. Использованы
Влияние кислотности среды на сорбцию.
реактивы квалификации х.ч. Раствор урана(VI)
Установлено, что максимальная степень извлече-
(10-2 М) готовили растворением в дистиллирован-
ния урана(VI) сорбентом достигается из растворов
ной воде точной навески соли UO2(NO3)2·6H2O по
с рН 4. Результаты анализа представлены в табл. 1.
методике 29. Рабочие растворы получали разбав-
При малых значениях рН (1-3) жидкой фазы
лением исходного. Необходимые значения рН под-
низкая степень извлечения может быть связана с
держивали растворами НСl, NaOH и аммиачно-аце-
протонизацией функциональных групп, находя-
татными буферными растворами. Для поддержания
щихся в фазе сорбента и малой степенью набухае-
постоянной ионной силы использовали раствор
мости полимера.
KCl.
При таких значениях рн ионы U(VI) находятся
Определение урана после его предварительного
в виде
[32]. При увеличении рн жидкой фазы
концентрирования проводили спектрофотометри-
(рН 4) степень набухаемость таких полимерных
ческим методом. В качестве спектрофотометриче-
сорбентов увеличивается. Максимальная степень
ского реагента использовали 2,2ꞌ,3,4-тетрагидрок-
извлечения урана сорбентами достигается из рас-
си-3ꞌ-сульфо-5ꞌ-хлоразобензол (ТСХАБ), который
творов с рН 4.
получали азосочетанием диазотированного амина
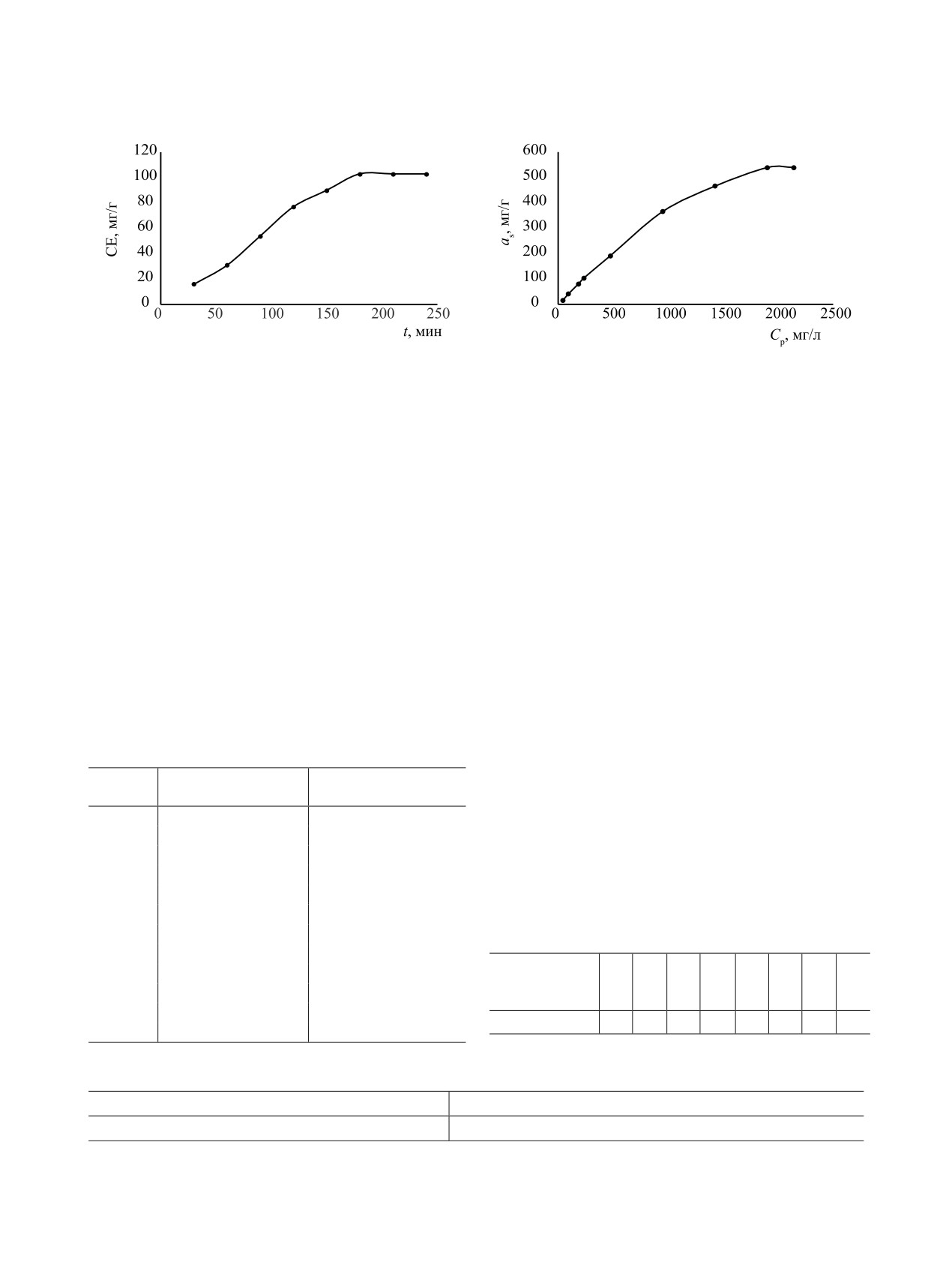
Было исследовано зависимость сорбции от про-
с пирогаллолом в слабокислой среде по методике
должительности контакта. Результаты исследова-
[30].
ния показали, что сорбционное равновесие дости-
В качестве твердой фазы использовали сорбент,
гается после 3 ч контакта сорбента с металлом. Во
содержащий фрагменты п-аминобензойной кисло-
всех дальнейших экспериментах продолжитель-
ты. Он синтезирован по методике [31]. Для при-
ность контакта для установления сорбционного
менения в анализе гранулы сорбента растирали в
равновесия составляла 3 ч (рис. 1).
агатовой ступке и просеивали через сито (0.14 мм).
Влияние ионной силы раствора. Уран (VI) со-
Методика эксперимента. Сорбцию изучали в
рбировали из растворов с ионной силой (І) 0.1-1.4.
статических условиях: в градуированную пробир-
Результаты исследования (табл. 2) показали, что
ку с притертой пробкой вводили раствор урана(VI),
значительное уменьшение сорбции металла наблю-
добавляли аммиачно-ацетатный буферный раствор
далось из растворов с ионной силой более 0.6. Все
для создания необходимой кислотности до объема
дальнейшие исследования проводили в растворах
20 мл. Вносили 0.05 г сорбента, пробирку закры-
вали пробкой на 3 ч, время от времени раствор пе-
с ионной силой, равной 0.6. В растворах ионную
ремешивали путем встряхивания, затем раствор
силу создавали с использованием KCl.
декантировали. Раствор был прозрачным. В элюате
Влияние концентрации урана(VI) на сорбцию.
концентрацию урана(VI) определяли фотометриче-
С увеличением равновесной концентрации урана(VI)
ским методом с использованием ТСХАБ. Концен-
в растворе его сорбция увеличивается и при
РАДИОХИМИЯ том 64 № 3 2022
КОНЦЕНТРИРОВАНИЕ И ОПРЕДЕЛЕНИЕ УР
АНА(VI) СОРБЕНТОМ
299
Рис.
1.
Зависимость сорбционной емкости от
Рис. 2. Изотерма сорбции урана(VI) синтезированным
продолжительности контакта сорбента с раствором.
сорбентом. mсорб = 50 мг, V = 20 мл, pH 4.
концентрации 1904 мг/л становится максимальной:
совсем не изменяется, в последующих циклах
статическая емкость 539 мг/г (рис. 2).
наблюдается небольшое уменьшение сорбционной
Исследована возможность и определены условия
емкости. Результаты анализа показали возможность
десорбции урана(VI) разными минеральными
использования сорбента в 7-8 циклах сорбции/
кислотами (HClО4, H2SО4, HNО3, HCl) после
десорбции.
концентрирования на сорбенте. Показано, что
После определения оптимальных условий
концентрирования разработанный метод успешно
уран(VI) количественно десорбируется 2 М HCl
применен для определения микроколичеств
(табл. 3).
урана(VI) из воды реки Акстафа Газахского
Возможно
многократное
использование
района (Азербайджан) с предварительным
регенерированного сорбента для концентрирования.
концентрированием (табл. 5).
Для регенерации сорбента использовали 2 М HCl.
Выполнение анализа. 3000 мл отфильтрованной
Результаты представлены в табл. 4.
анализируемой пробы доводили до нужного
Из табл. 4 видно, что первые 3 цикла после
значения pH добавлением HNO3 и оставляли на
регенирации сорбционная емкость сорбента
3 ч в круглодонной колбе со 100 мг сорбента.
Сорбированные ионы металла элюировали 30 мл
Таблица 3. Влияние природы и концентрации кислоты
2 М HCl. В элюате концентрацию урана(VI)
на степень десорбции урана(VI) (n = 5)
определяли фотометрическим методом.
Концентрация,
Степень десорбции,
Кислота
моль/л
%
ЗАКЛЮЧЕНИЕ
HCl
0.5
79
1.0
87
2.0
95
Проведенное исследование показало возмож-
HClО4
0.5
77
ность использования матрицы сополимера мале-
1.0
88
2.0
92
Таблица
4. Сорбционная емкость сорбента после
HNО3
0.5
82
регенирации.
1.0
86
Цикл
2.0
90
использования
1-й
2-й
3-й
4-й
5-й
6-й
7-й
8-й
H2SО4
0.5
76
сорбента
1.0
84
СЕ, мг/г
539
539
539
539
535
532
530
530
2.0
89
Таблица 5. Результаты определения урана (VI) в р. Акстафа Газахского района (Азербайджан) (n = 5, Р = 0.95)
Найдено фотометрическим методом, U(VI), мкг/л
Найдено U(VI), мкг/л (ICP-OES thermo ICAP 7400 DUO)
0.29 ± 0.030
0.30 ± 0.033
РАДИОХИМИЯ том 64 № 3 2022
300
БАХМАНОВА
инового ангидрида с метакриловой кислотой, мо-
13. Jie C., Zaijun L., Ming L. // Int. J. Environ. Anal. Chem.
2008. Vol. 88, N 8. P. 583-590.
дифицированной п-аминобензойной кислотой, для
14. Anagnostopoulos V., Symeopoulos B., Bourikas K.,
сорбционно-фотометрического определения ура-
Bekatorou A. // Int. J. Environ. Sci. Technol.
2016.
на(VI). Сорбент, примененный для определения ми-
Vol. 13, N 1. P. 285.
кроколичеств урана(VI), обладает более высокими
15. Shao D., Wang X., Li J., Huang Y., Ren X., Hou G.,
сорбционными свойствами (сорбционная емкость,
Wang X. // Environ. Sci.: Water Res. Technol. 2015.
продолжительность контакта, концентрирование,
Vol. 1, N 2. P. 169.
16. Xiao J., Jing Y., Yao Y., Xie S., Wang X., Shi C., Jia Y. //
влияние ионной силы) по сравнению с известными
J. Radioanal. Nucl. Chem. 2016. Vol. 310, N 3. P. 1001.
в литературе [10-21]. Предлагаемый сорбент мож-
17. Yuan D., Chen L., Xiong X., Yuan L., Liao S., Wang Y. //
но использовать повторно 7-8 циклов.
Chem. Eng. J. 2016. Vol. 285. P. 358.
18. Yuan D., Chen L., Xiong X., Zhang Q., Liao S., Yuan L.,
КОНФЛИКТ ИНТЕРЕСОВ
Wang Y. // J. Radioanal. Nucl. Chem. 2016. Vol. 309,
N 3. P. 1227.
Авторы заявляют об отсутствии конфликта ин-
19. Zhou K., Liu Y., Yang Z., Liu H., Xie T. // J. Taiwan Inst.
Chem. Eng. 2016. Vol. 63. P. 453.
тересов.
20. Hallaji H., Keshtkar A.R., Moosavian M.A. // J. Taiwan
Inst. Chem. Eng. 2015. Vol. 46. P. 109.
СПИСОК ЛИТЕРАТУРЫ
21. Гаджиева С.Р., Бахманова Ф.Н., Алирзаева Э.Н.,
Шамилов Н.Т., Чырагов Ф.М. // Радиохимия. 2018.
1.
Lutfullah, Khan F., Rahman N., Azmib S.N.H. // Indian J.
Т. 60, N 2. С. 175.
Chem. Technol. 2009. Vol. 16. P. 437-441.
22. Басаргин Н.Н., Магеррамов А.М., Гаджиева С.Р.,
2.
Khayatian G, Hassanpoor S, Amir R. J. Azar,
Бахманова Ф.Н., Гамидов С.З., Алиева Т.И., Чыра-
Sajjad Mohebbi. Spectrophotometric Determination
гов Ф.М. // ЖАХ. 2013. Т. 68, № 2. С. 136.
of Trace Amounts of Uranium (VI) using Modified
23. Aliyev E.H., Bahmanova F.N., Hamidov S.Z.,
Magnetic Iron Oxide Nanoparticles in Environmental
Chyragov F.M. // Proc. Univ. Appl. Chem. Biotechnol.
and Biological Samples // J. Braz. Chem. Soc., 2013.
2020. Vol. 10, N 1. P. 107.
Vol. 24, N. 11. p. 1808-1817.
24. Bahmanova F.N., Hajiyeva S.R., Chyragov F.M. // Proc.
3.
Elhefnawy O.A. // Radiochim. Acta. 2017. Vol. 105,
Univ. Appl. Chem. Biotechnol. 2019. Vol. 9, N 2. P. 194.
N 12. P. 993-1004.
25. Maharramov A.M., Hajiyeva S.R., Bahmanova F.N.,
4.
Ozdemir S., Oduncu M.K., Kilinc E., Soylak M. //
Gamidov S.Z., Chyragov F.M. // J. Anal. Chem. 2011.
J Environ Radioact. 2017. Vol. 171. P. 217-225.
Vol. 66, N 5. P. 465.
5.
Thakur R., Tarafder P.K., Jha R.R. // Radiochim. Acta.
26. Бахманова Ф.Н., Гаджиева С.Р., Чырагов Ф.М. //
2019. Vol, 107. N 4. P. 327-337.
Радиохимия. 2019. Т. 61, № 5. C. 420.
6.
Jaison P.G., Telmore V.M., Kumar P., Aggarwal S.K. //
27. Bahmanova F.N. // J. Anal. Chem. 2020. Vol. 75, N 9.
J. Chromatogr. Sci. 2011. Vol. 49, N 9. P. 657-664.
P. 1116.
28. Bahmanova F.N., Hajiyeva S.R., Alirzaeva E.N.,
7.
Saad E.M., Mansour R.A., El-Asmy A., El-Shahawi M.S. //
Shamilov N.T., Chyragov F.M. // J. Chem. Soc. Pak.
Talanta. 2008. Vol. 76, N 5. P. 1041-1046.
2020. Vol. 42, N 3. P. 413-417.
8.
Ahmed S.H. // Nucl. Sci. Sci. J. 2018. Vol. 7. P. 165-
29. Коростелев П.П. Приготовление растворов для хи-
176.
мико-аналитических работ. М.: Наука, 1964. 261 c.
9.
Mirza M.A., Khuhawar M.Y., Arain R., Aziz M.Ch. //
30. Гамбаров Д.Г. Новый класс фотометрических реа-
Arab. J. Chem. 2018. Vol. 11, N 3. P. 305-312.
гентов - азосоединения на основе пирогаллола: Дис.
10. Xiao J., Jing Y., Wang X., Yao Y., Jia Y. // Chem. Select.
… д.х.н. М., 1984. 295 с.
2018. Vol.3, N 43. P. 12346-12356.
31. Mamedova S.Sh., Alieva R.A., Khanlarov T.G.,
11. Kuznetsov V.V., Zemyatova S.V., Kornev K.A. // J. Anal.
Gambarov D.G. // Chem. Chem. Technol. 2004. N 7.
Chem. 2014. Vol. 69, N 2. P. 105-110.
P. 92.
12. Hassan J., Hosseini S.M., Mozaffari S., Jahanparast B.,
32. Назаренко В.А., Антонович В.П., Навская Е.М. Ги-
Karbasi M.H. // J. Braz. Chem. Soc. 2014. Vol. 25, N 6.
дролиз ионов металлов в разбавленных растворах.
P. 1086-1090.
М.: Атомиздат, 1979. 192 с.
РАДИОХИМИЯ том 64 № 3 2022