РАДИОХИМИЯ, 2022, том 64, № 2, с. 184-192
УДК 544.58:544.723:544.43
КИНЕТИКА СОРБЦИИ 60Сo КОМПОЗИТНЫМ
СОРБЕНТОМ ТЕРМОКСИД 35 В ПРИСУТСТВИИ
ГУМИНОВЫХ КИСЛОТ
© 2022 г. Е. В. Поляков*, Е. И. Денисов, И. В. Волков
Институт химии твердого тела УрО РАН, 620990, Екатеринбург, ул. Первомайская, д. 91
*e-mail: Polyakov@ihim.uran.ru
Поступила в редакцию 03.02.2021, после доработки 19.03.2021, принята к публикации 25.03.2021
С использованием метода ограниченного объема с рециркуляцией сорбата исследована кинетика
сорбции микроколичеств ионов Co(II) сорбентом Термоксид 35 в хлоридно-ацетатном растворе с
постоянной ионной силой в отсутствие и в присутствии природных гуминовых кислот (ГК). Получены
детальные данные о сорбции радионуклида 60Со сорбентом в реальном масштабе времени в зависимости
от скорости пропускания раствора через сорбент, рН, температуры и концентрации ГК. Наиболее
статистически точно и адекватно полученные данные описывает смешанно-диффузионная модель
кинетики сорбции Co(II), включающая сменяющие друг друга стадии пленочной и гелевой диффузии
в макро-микропорах зерна сорбента. Коэффициенты скорости пленочной (β, м/с) и гелевой диффузии
(Dg, м2/с) не зависят от рН раствора, концентрации ГК. Среднее значение Dg - (6.0 ± 4.5)× 10-10 м2/с,
энергия активации гелевой диффузии 20.7 ± 10.0 кДж/моль при рН 7.5. Найденные величины близки
параметрам самодиффузии Co2+ в ультраразбавленных водных растворах. Сделан вывод о возможности
эффективной сорбции Co(II) из природных водных растворов сорбентом Термоксид 35 в присутствии
гуминовых кислот.
Ключевые слова: кобальт-60, сорбция, Термоксид 35, гуминовые кислоты
DOI: 10.31857/S0033831122020101, EDN: FOYKEU
Удаление радионуклидов кобальта из водных
ных смол, пригодный для эксплуатации в диапазоне
растворов составляет актуальную задачу перспек-
температур 50-200°C [5].
тивных технологий переработки жидких радиоак-
Эффективность разрабатываемых технологий
тивных растворов АЭС. Демонтаж оборудования,
выделения радионуклидов кобальта во многом за-
строительных конструкций приводит к появлению
висит от знания и учета физико-химических форм
дополнительных жидких радиоактивных отходов
состояния ионов Co(II) в перерабатываемых раство-
после реагентной дезактивации бетонов [1], при-
рах. В природных водных средах основную роль в
чем сложность концентрирования радионуклидов
регулировании химического состава форм перено-
из таких растворов связана с возможностью обра-
са радионуклидов принадлежит гуминовым веще-
зования комплексов с этилендиаминтетрауксусной
ствам, повсеместно присутствующим в природных
кислотой [2]. Одним из известных подходов в де-
водах и оказывающим сильное и даже определяю-
зактивации таких растворов считается извлечение
щее влияние на реакционную способность микроэ-
радионуклидов 60Co соосаждением с гидроксидом
лементов и их радионуклидов, включая ионы Co(II)
железа(III) при комнатной температуре [3]. Эф-
[6-8].
фект очистки еще более возрастает при введении в
очищаемый раствор смеси осадков цианоферратов
Благодаря своей химической стойкости, способ-
железа-калия или никеля-калия, способствующих
ности к регенерации особое место среди применя-
одновременному выделению из солевого раство-
емых оксидных сорбентов занимают материалы на
ра радионуклидов цезия за счет ситового эффекта
основе оксида циркония, в частности сорбенты мар-
и кобальта за счет гидролиза и координационной
ки Термоксид, созданные для выделения и связы-
сополимеризации [4]. Для очистки от радионукли-
вания продуктов деления и активации в высокотем-
дов Co(II) водных сред с низким солесодержанием
пературных режимах сорбции [9, 10]. Термоксид 35
предложен композитный сорбент на основе имид-
(далее T-35) представляет собой композит, основой
184
КИНЕТИКА СОРБЦИИ
60Сo КОМПОЗИТНЫМ СОРБЕНТОМ ТЕРМОКСИД 35
185
которого является пористая матрица гидратирован-
ного оксида циркония марки Т-3. Ее сорбционная
Насос
активность вызвана наличием на поверхности ги-
дратированного оксида химически связанных мо-
лекул воды, ол- и оксо-групп, их способностью к
поверхностному комплексообразованию [11, 12].
Стакан
Колонка
Детектор
ПК
Сорбент Т-35, по данным ИК спектроскопии (ИК
Фурье-спектрометр Vertex 80 (Bruker) в режиме
нарушенного полного внутреннего отражения,
Рис. 1. Блок-схема автоматизированной установки для
приставка MVP-Pro (Harrick)), спектроскопии КР
непрерывного измерения скорости накопления гамма-из-
(рамановский дисперсионный спектрометр InVia
лучающего радионуклида в твердой фазе в режиме огра-
Reflex RENISHAW, λ = 532 нм, Р = 10 мВт), растро-
ниченного объема исследуемого раствора циркуляцион-
вой электронной микроскопии с локальным эле-
ным методом. Стрелками показано направление циркуля-
ции раствора 60Со.
ментным анализом (микроскоп JEOL JED-2300) и
рентгенофазового анализа [13], представляет собой
ский режим, скорость которого зависит от быстро-
фазовую смесь рентгеноаморфного оксида цирко-
ты превращения несорбируемых форм состояния
ния с слабым проявлением уширенных линий те-
Mo(VI) в сорбируемые гидроксоформы. Все стадии
трагональной решетки (~93-95 мас%) и кристалли-
сорбции соответствуют реакции первого порядка
ческой фазы цианоферрата состава K2Ni(Fe(CN)6,
по ионам Mo(VI). Заключительный по времени этап
пространственная группа F-43m (~5-7 мас%). Ча-
сорбции (интервал от 40 мин до 2-3 ч) протекает
стицы K2Ni(Fe(CN)6 со средним размером 8.5 нм
с наименьшей скоростью, наиболее вероятно в ре-
объединены в агрегаты размером 1-5 мкм и рав-
жиме диффузионного торможения ионов Mo(VI) в
номерно распределены по поровому пространству
порах гидроксида титана [18, 19].
матрицы ZrO2 [13], придавая композиту Т-35 высо-
кую специфичность к радионуклидам цезия - Kd >
Целью работы являлась детализация механизма
104 мл/г [14, 15]. Свойства матрицы ZrO2 обеспе-
сорбции микроколичеств ионов Co(II) сорбентом
чивают высокий Kd к ионам Co(II) [13], Eu(III),
Т-35 путем установления параметров кинетики
U(IV,VI), Np(IV,V) (>102 мл/г в области рН > 6) [12,
массопереноса Co(II) в сорбент и оценки влияния
16, 17].
на эти параметры гуминовых кислот (ГК) [13]. Для
детализации изменения концентрации ионов ко-
Поскольку радионуклиды Co(II) вносят суще-
бальта Co(II) в сорбенте со временем контакта фаз
ственный вклад в общую гамма-активность жидких
и достижения максимального подобия условий ста-
радиоактивных отходов, важным представляется
тики и динамики сорбции использовали циркуля-
установить кинетические характеристики сорбции
ционный вариант метода ограниченного объема и
Co(II) на Т-35 как в растворах минеральных кислот,
радиоактивный отметчик 60Co(II) [20].
так и в присутствии гуминовых кислот (ГК). Кине-
тика сорбции ионов Cs(I) двухфазным сорбентом
Т-35 протекает в смешанно-диффузионном режиме
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
и включает относительно быструю стадию пленоч-
ной диффузии и более медленную стадию гелевой
диффузии катионов в поровом пространстве зерна
Кинетические исследования сорбции ионов
сорбента [14]. Не исключено повторение подобного
Co(II) сорбентом Т-35 выполняли методом ограни-
механизма и в случае сорбции микроколичеств ио-
ченного объема в условиях, подробно изложенных
нов Co(II). Склонность к гидролизу ионов Co(II) и
ранее [13]. Основные отличия техники исследова-
наличие высокой удельной поверхности у сорбента
ния кинетики заключались в организации непре-
Т-35 делает возможным сочетание диффузионных
рывного измерения концентрации исследуемого
и химических стадий во внешне- или внутрикине-
радионуклида в сорбенте в замкнутой проточной
тическом режиме сорбционного массопереноса [20,
системе [23] в процессе накопления 60Со(II) [6, 24].
21]. Так, при сорбции Mo(VI) сорбентом Термок-
Для этого использовали автоматизированную уста-
сид Т-5 (гелированный гидроксид титана) скорость
новку, позволявшую контролировать скорость на-
межфазного взаимодействия на начальном этапе
копления кобальта по радионуклиду 60Co непосред-
(до 10 мин) лимитируется пленочной диффузией,
ственно в сорбенте в течение всего эксперимента.
после чего сорбция переходит во внешнекинетиче-
Схема установки представлена на рис. 1.
РАДИОХИМИЯ том 64 № 2 2022
186
ПОЛЯКОВ и др.
Исследуемый раствор термостатировали в реак-
ния; Nф - фоновое значение числа импульсов в том
торе идеального смешения, представлявшем собой
же спектральном диапазоне, установленное по ре-
стакан из стекла с двойными стенками, подключен-
зультатам независимых измерений.
ный к термостату. Сорбент располагался в проточ-
Переход от измеряемых величин I(t) к текущим
ной колонке из стекла внутренним диаметром 4 мм,
значениям сорбции S(t) производили с помощью
на вход которой поступал исследуемый раствор из
вспомогательной переменной G(t), представляю-
термостатированного стакана через силиконовую
щей собой функцию от времени относительной из-
(7/13 мм) трубку. Выходящий раствор опять воз-
меряемой активности 60Со в сорбенте
вращался в стакан. Перистальтический насос Cole
G(t) = I(t)/I(t)max
(2)
Parmer Masterflex l/S допускал регулировку скорости
потока через колонку в пределах 5-50 мл/мин, или
где индекс max характеризует максимальную за-
40-240 мл/(см2·мин), с погрешностью 0.1 мл/мин.
фиксированную скорость счета от радионуклида,
Значения рН исследуемого раствора задавали аце-
измеренную в колонке с сорбентом по окончании
татным буферным раствором NaAc-HAc с общей
кинетического эксперимента (далее - режим изме-
концентрацией 0.28 моль/л и погрешностью зада-
рения в геометрии «сорбент в колонке»). Согласно
ния рН ~0.1 ед. вследствие буферной емкости со-
уравнению баланса активность 60Со в исследуемой
рбента. Концентрация фонового электролита NaCl
закрытой системе, степень сорбции S(t) в произ-
в исследуемом растворе 0.5 моль/л. Температуру в
вольный момент времени эксперимента t по резуль-
зоне колонки поддерживали тем же термостатом.
татам измерения исследуемого раствора в сосуде
Начальные условия сорбционного эксперимента:
«Дента» (далее - режим измерения «по раствору»)
температура в колонке 20°С, скорость исследуемого
определяли из выражения (3)
раствора через колонку с загрузкой сорбента Т-35
15 мл/мин, рН 7.0.
,
(3)
Накопление γ-активности радионуклида 60Со в
в котором J0 и Jt - начальная гамма-активность 60Со
колонке с сорбентом во время эксперимента изме-
и активность, измеренные в режиме «по раствору»
ряли в полуавтоматическом режиме при циркуля-
методом гамма-спектрометрии на момент време-
ционной подаче исследуемого раствора из реакто-
ни t, имп/с. Одновременно с этим измерение актив-
ра в колонку. Время измерения (∆t, с) устанавлива-
ности сорбента в геометрии «сорбент в колонке»
ли: ∆t = 25 в интервале 0-500 с, ∆t = 50 в интервале
применительно к (3) дает следующие соотношения:
500-1000 с и ∆t = 100 в интервале 1000-8000 с.
Начальную J0 и конечную Jt=∞ активности раство-
ра после завершения кинетического эксперимен-
та (t = ∞) измеряли на гамма-спектрометре МКС-
,
(4)
АТ1315 фирмы «Атомтех» со сцинтилляционным
детектором NaI(Tl) 62 × 62 мм в сосуде «Дента».
Равновесное значения сорбции в каждом экспери-
где I0 - исходная (неизвестная) скорость счета ис-
менте S(t = ∞) вычисляли по формуле (3) после из-
следуемого раствора, измеренная в геометрии «со-
мерения раствора в геометрии «Дента» через неде-
рбент в колонке», имп/с; I(t)max - максимальное
лю контакта раствора с сорбентом. Все измерения
значение скорости счета, измеренное в геометрии
проводили на одной и той-же гамма-спектрометри-
«сорбент в колонке» (последняя точка эксперимен-
ческой установке в идентичной геометрии.
та), имп/с; Sp - степень сорбции, измеренная «по
раствору» на момент окончания эксперимента,
Величину сорбции (S) кобальта в сорбционной
когда активность раствора минимальна (Jt = Jmin);
системе по результатам измерения скорости счета
Jt - скорость счета при измерении «по раствору» на
60Со в колонке с сорбентом в спектрометрическом
момент времени t, имп/с, φ - интегральный коэффи-
режиме вычисляли на основе измерения интеграль-
циент пересчета скорости счета при переходе от ге-
ной скорости счета от колонки I(t) на момент време-
ометрии измерения «по раствору» (Jt) к геометрии
ни эксперимента t за время измерения ∆t:
измерения «сорбент в колонке» I(t). Соотношение
I(t) = (Ni- Nф)/∆t
(1)
(4) позволяет находить текущее значения сорбции
где Ni - значение числа импульсов в области фо-
S(t) в геометрии «по раствору» путем измерения
то-пика радионуклида 60Co в диапазоне энергии
активности 60Со в геометрии «сорбент в колонке».
гамма-квантов 1150-1500 кэВ на момент измере-
Для этого использовали вместо неопределенной ве-
РАДИОХИМИЯ том 64 № 2 2022
КИНЕТИКА СОРБЦИИ
60Сo КОМПОЗИТНЫМ СОРБЕНТОМ ТЕРМОКСИД 35
187
(а)
(б)
Время контакта t, с
Время контакта t, с
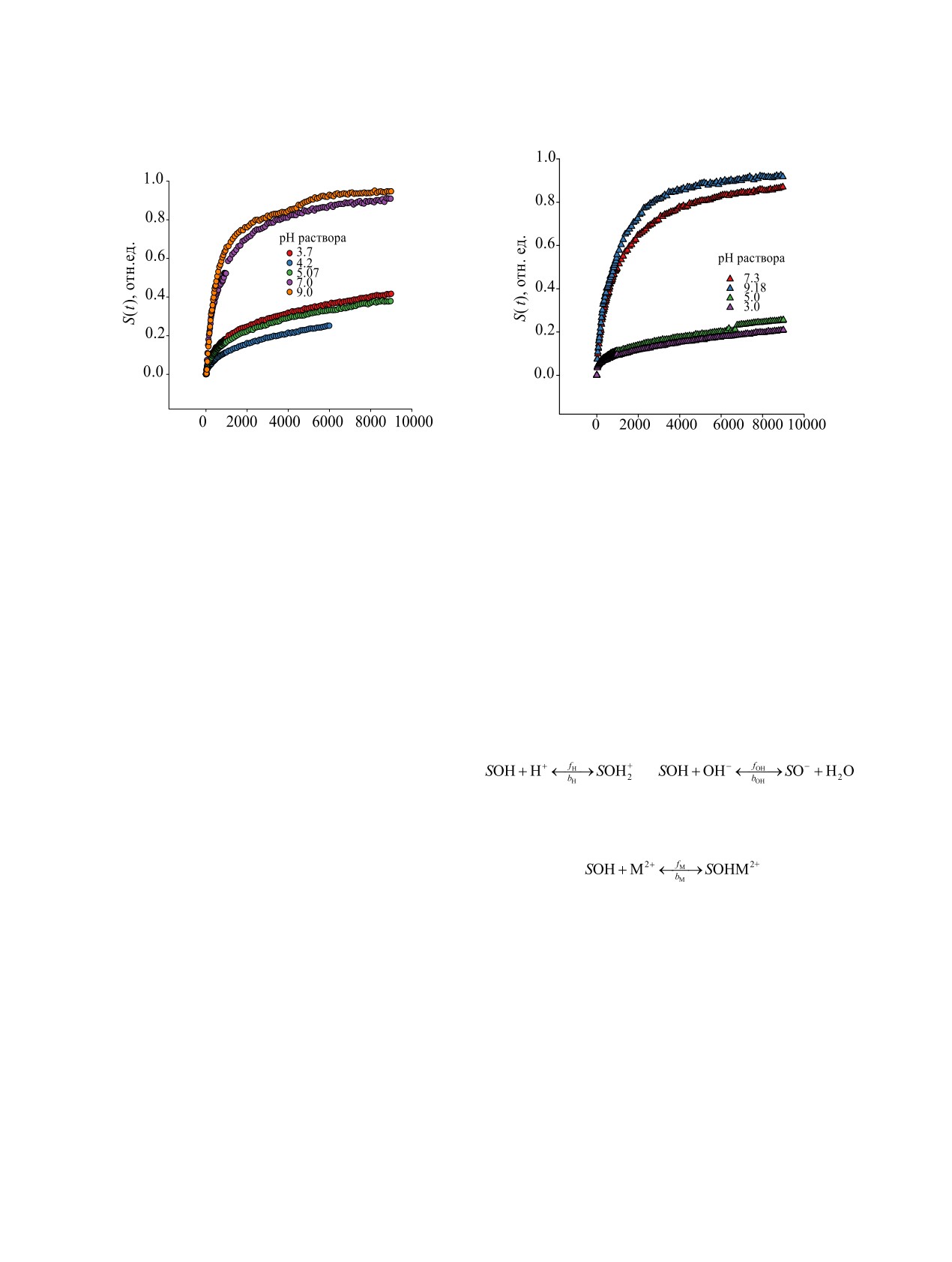
Рис. 2. Пример кинетики сорбции 60Со композитом Т-35 в растворе NaCl-NaAc (а) и NaCl-NaAc-ГК (б) в зависимости от
рН раствора сорбата. Цифры у точек - значения рН. V = 15мл/мин, 20°С.
личины I0 ее значение из данных по сорбции, из-
реакциями гидролиза, скорость которых для d-ка-
меренных в геометрии «по раствору», например, на
тионов имеет порядок ~10-4-10-10 c-1, сравнимый
момент окончания кинетического эксперимента, Sp.
с константами скорости диффузионных процессов
На рис. 2 приведен пример кинетики сорбции Co(II)
в гетерогенных растворах электролитов [29]. По-
сорбентом Т-35 согласно уравнениям (3)-(5) при
верхностное комплексообразование перечисленных
различных равновесных рН исследуемого раствора.
ионных комплексов рассматривают как поверхност-
ный кинетический процесс, протекающий по меха-
низму обратимой реакции первого или второго по-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
рядка относительно ионов сорбата. Существенное
влияние на скорость сорбции способны оказывать
Равновесная сорбция ионных и молекулярных
также константы скорости прямой (f) и обратной (b)
частиц Co(II) сорбентом Т-35 определяется их хи-
реакции диссоциации поверхностных молекул H2O
мическим взаимодействием с поверхностными со-
и OH [20]
рбционными центрами гидратированного оксида
циркония по механизму поверхностного комплек-
,
сообразования [12, 13, 25, 26]. Стадиями, лимити-
а также конcтанты прямой и обратной реакций по-
рующими сорбционный процесс, в общем случае
верхностного комплексообразования с катионом
могут быть (I) внешняя химическая кинетика пе-
рестройки равновесного состава комплексов Co(II)
М2+, например
в процессе их взаимодействия с поверхностными
ол- и оксо-группами матрицы - оксида циркония,
(II) диффузионные торможения в пленке жидкости
Например, сорбция Co2+ на поверхности TiO2, по
на поверхности гранулы сорбента (пленочная диф-
данным работ [20, 21], характеризуется порядком
фузия), (III) диффузия во внутрипоровом простран-
констант скорости fH ~ 105 л/(моль·c), bH ~ 101 c-1,
стве ионита (гелевая диффузия), (IV) объемная
fCo ~ 101 л/(моль·c), bCo ~ 104 л/(моль·c). Очевидно,
диффузия в фазе оксида циркония [22]. Согласно
это быстро протекающие реакции, и они не могут
химическому составу раствора, в области рН 2-10
являться скорость-определяющими в сравнении с
реакциями обмена координированной воды и ги-
частицы Co(II) представлены в растворе аква-иона-
ми Co2+ и гидроксокомплексами Co(OH)+, Co(OH)0,
дролиза катионов сорбата во внешнем растворе.
Co(OH)3-, а также частицами состава CoAc+, CoCl+
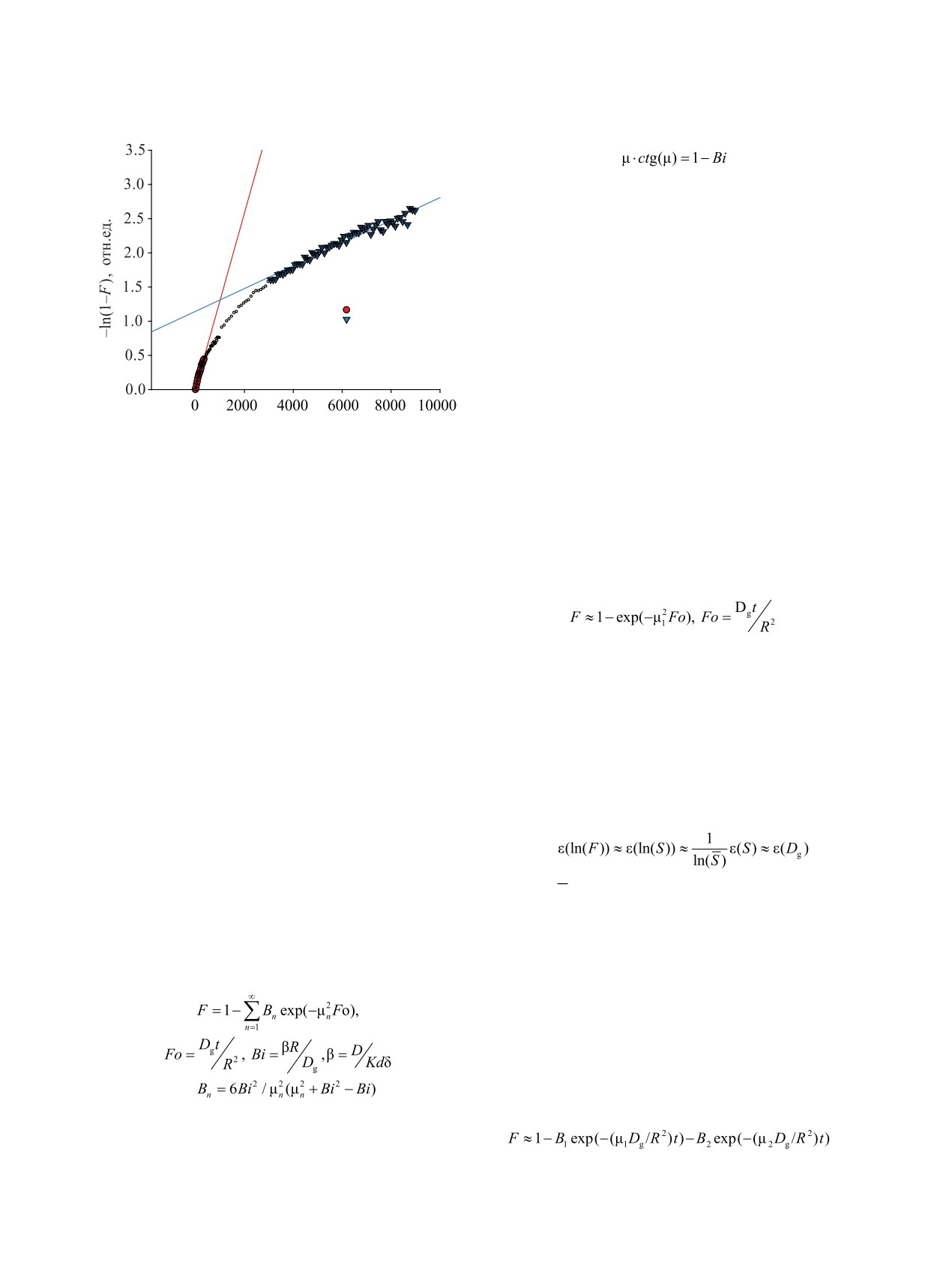
Вид полученных кинетических кривых сорбции
[13, 27, 28]. Химические реакции между этими ча-
с использование безразмерного параметра степени
стицами в объеме раствора могут контролироваться
превращения F = S(t)/S(t = ∞) показывает, что на на-
относительно медленными реакциями замещения
чальном этапе (F ≤ 0.35) соблюдается пропорцио-
молекул воды во внутренней сфере комплексов и
нальность ln(1 - F) ~ t и аппроксимирующая прямая
РАДИОХИМИЯ том 64 № 2 2022
188
ПОЛЯКОВ и др.
,
Bi - критерий Био, Fo - критерий гомохромности
Фурье, Dg - коэффициент гелевой диффузии ионов,
м2/с, β (м/c) - коэффициент пленочной диффузии
(массопереноса ионов в слое электролита (δ) во-
круг гранулы сорбента), связанный с коэффициен-
том диффузии ионов в растворе электролита D и
коэффициентом распределения Co(II), Kd (г/г), по
F<0.35
F>0.6
уравнению (5), R - средний радиус зерна сорбента.
Аналогичный по форме вид имеет уравнение сме-
шанно-диффузионной кинетики сорбции из ограни-
ченного объема [31]. Авторами выбрана модель сме-
шанно-диффузионной кинетики, одним из условий
точного решения диффузионного уравнения в кото-
Время контакта, с
рой является требование постоянства концентрации
кобальта в объеме жидкой фазы. В использованной
Рис. 3. Пример описания кинетики сорбции 60Со компо-
зитом Т-35 приближенными уравнениями диффузион-
экспериментальной схеме это условие строго не вы-
ной кинетики: пленочная диффузия (F < 0.35), гелевая
полняется. Вместе с тем, смешанно-диффузионная
диффузия (F > 0.60). Раствор NaCl-NaAc, рН 7.0-7.3,
модель сорбции в шар предполагает, что для оцен-
V = 15 мл/мин, 20°С. Линии на рисунке - регрессионные
ки коэффициента диффузии при сорбции из ограни-
уравнения -ln(1 - F) = a + bt для случая пленочной и ге-
ченного объема используют участок кинетической
левой диффузии
кривой, в котором при больших временах сорбции
выходит из начала координат. Это характерно как
соблюдается зависимость вида [22]
для внешнекинетического режима сорбции, так и
для внешнедиффузионного массопереноса. На за-
вершающем этапе сорбции, когда F > 0.6, линей-
Относительная погрешность определения Dg,
ный характер зависимости ln(1 - F)~t рассматрива-
вызванная изменением концентрации кобальта в
ют как признак внутридиффузионного торможения
растворе сорбата в условиях эксперимента, ε(Dg),
[22] (рис. 3). Таким образом, полученные кинетиче-
на конечной стадии сорбции (>4000 мин) связана с
ские кривые имеют признаки смешанно-диффузи-
относительной погрешностью приближения о по-
онного режима перенос сорбата с выравниванием
стоянной концентрации сорбата в растворе, а зна-
концентрации сорбируемых ионов на границе зерна
чит и постоянства степени завершенности процесса
сорбента на начальном этапе и более медленного
F, ε(F). Выражение для накопления погрешности
внутридиффузионного переноса ионов в порах или
результатов косвенных измерений в этом случае
межзеренном пространстве сорбента на заключи-
имеет вид
тельных этапах сорбции [22]. В этом наблюдаемая
кинетика массопереноса Co(II) в сорбенте Т-35 по-
добна поведению ионов Cs(I) [14, 15].
Здесь S - среднее значение сорбции в диапазо-
Для описания зависимостей F-t в случае сме-
не t = 4000-9000 мин, рис. 2. Оценка дает интервал
шанной пленочной-гелевой диффузионной кинети-
относительной погрешности ε(Dg) при использова-
ки в приближении постоянства концентрации сор-
нии приближенного уравнения (5) ~0.1-0.7 для об-
бата на поверхности зерна сорбента мы использо-
ласти рН 3-9.
вали уравнение [22, 30] вида:
С учетом этого искомые оценки параметров (Dg,
β) находили по следующему алгоритму приближен-
ного решения (5) для случая диффузии в шар [22,
30]. Методом регрессионного анализа вычисляли
коэффициенты B1,2 и μ1,2, используя приближение
(5)
двух первых членов быстро сходящегося бесконеч-
ного ряда (5):
в котором μn - корни характеристического уравне-
ния
(6)
РАДИОХИМИЯ том 64 № 2 2022
КИНЕТИКА СОРБЦИИ
60Сo КОМПОЗИТНЫМ СОРБЕНТОМ ТЕРМОКСИД 35
189
Время контакта, с
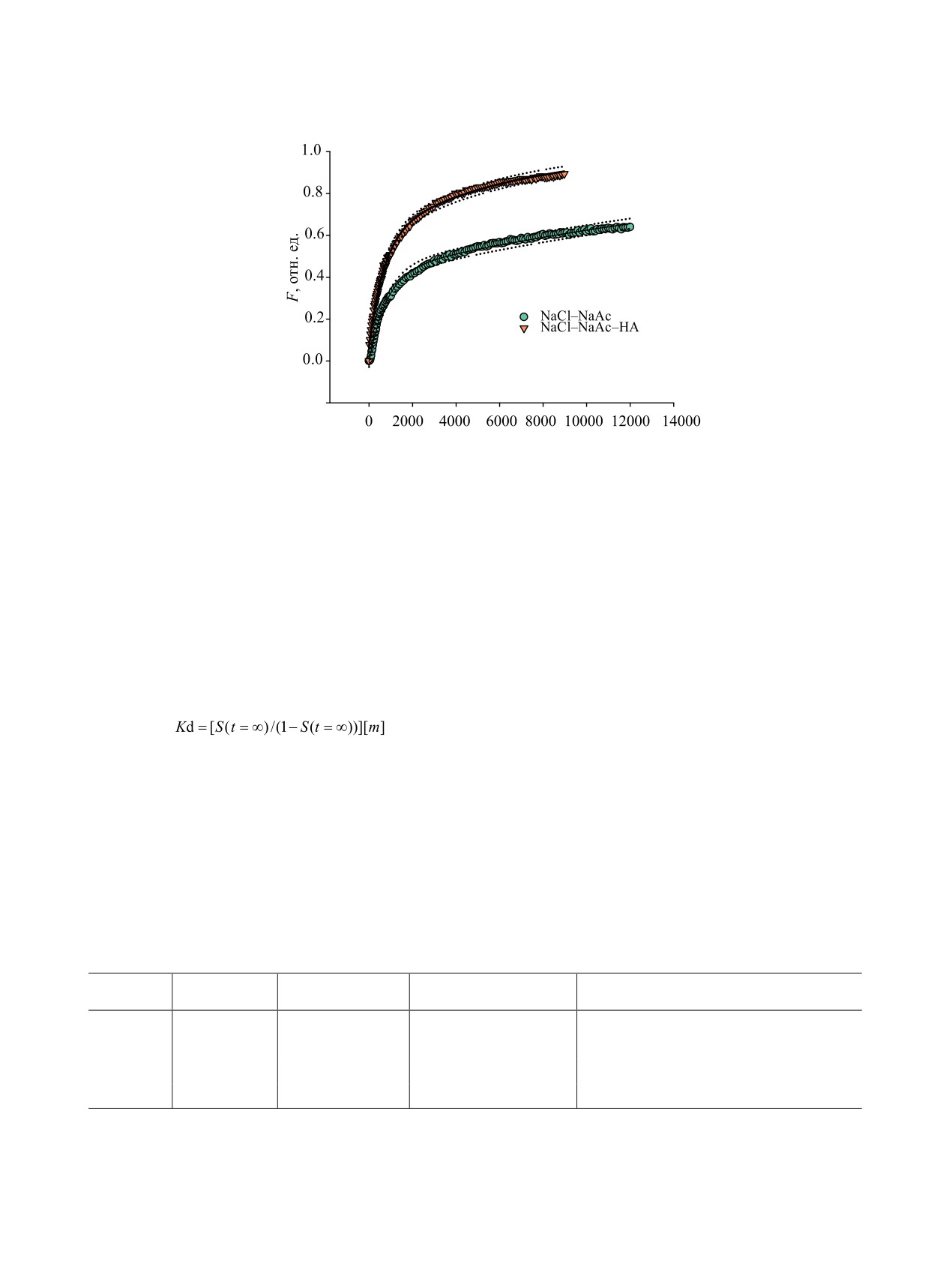
Рис. 4. Пример описания кинетики сорбции Co(II) сорбентом Т-35 в растворе NaCl-NaAc и том же растворе в присутствии
гуминовых киcлот (HA, 10 мг/л). Линия - регрессия по уравнению (6), пунктирная линия - границы 95%-ного доверитель-
ного интервала регрессии. pH 7.0-7.6, V = 15 мл/мин, 20°С.
Используя найденные коэффициенты под зна-
вых кислот и при концентрации гуминовых кислот
ком экспоненты, вычисляли их отношение, μ1/μ2, по
10.0 мг/л.
ним из таблиц находили величину критерия Био Bi
Пунктиром на рис. 4 показаны границы довери-
и соответствующее ему значение коэффициента μ1
тельного интервала найденных уравнений регрес-
в уравнении (6) [30]. Затем вычисляли коэффициен-
сии F-t. Статистические показатели оценки кине-
ты пленочной β и гелевой (Dg) диффузии по уравне-
тики сорбции Co(II) сорбентом T-35 в циркуляцион-
нию (5). Коэффициент распределения Kd находили
ном режиме ограниченного объема по модели сме-
из равновесных значений сорбции кинетических
шанной диффузии (5), соответствующие условиям
рис. 4, приведены в табл. 1. Видно, что уравнение
экспериментов по раствору [13], S(t = ∞):
(5) с удовлетворительной точностью описывает экс-
,
(7)
периментальные зависимости в области F < 0.4-0.8.
где [m] - отношение массы сорбента m к массе рас-
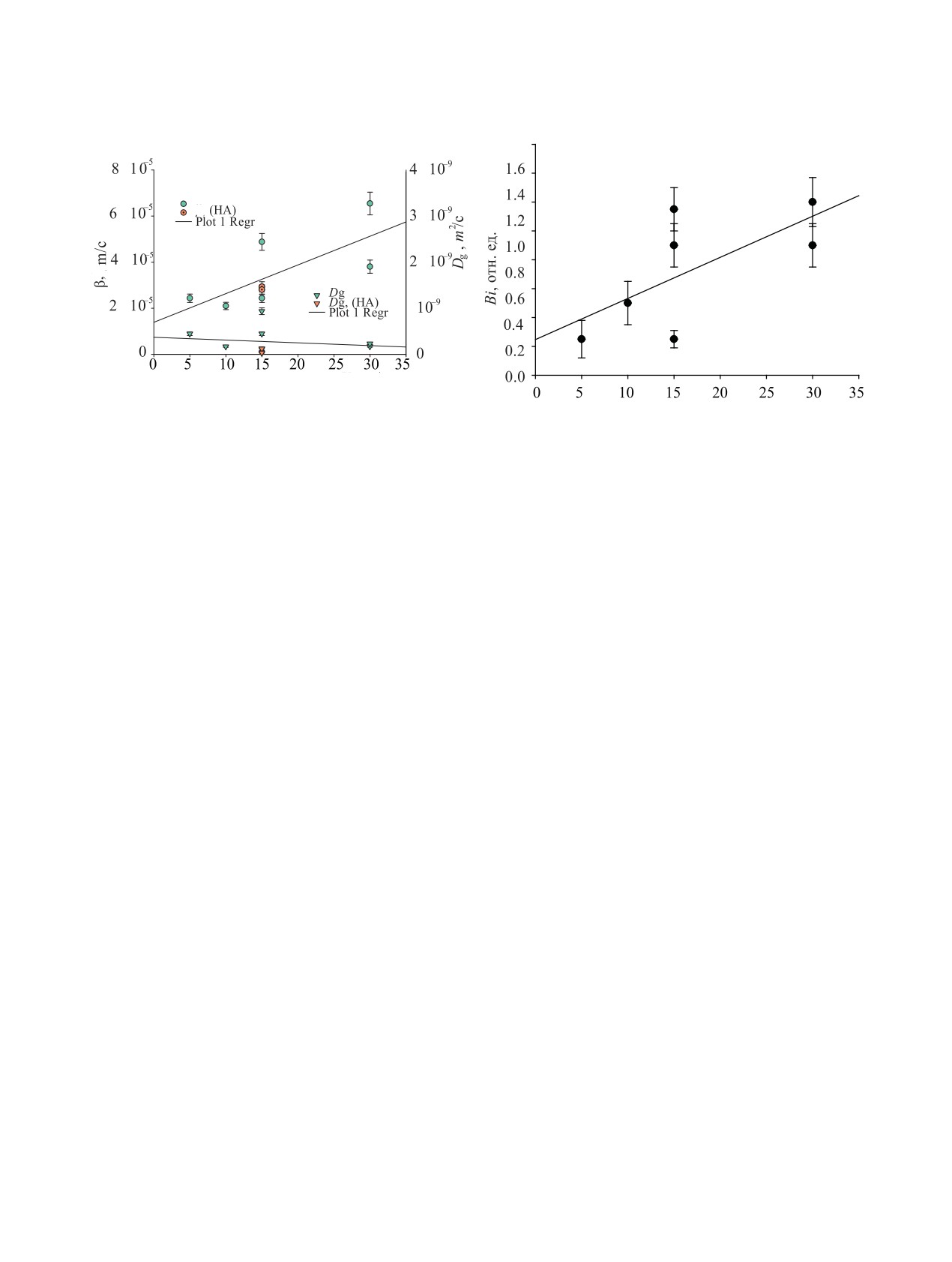
Вклад пленочной (β) и гелевой диффузии (Dg)
твора v, г/г. Дисперсионный анализ коэффициентов
в кинетику сорбции ионов Co(II) сорбентом Т-35
регрессионной модели (5) показал, что увеличение
по-разному зависит от времени контакта раствор-
числа слагаемых n до трех не приводит к значимому
сорбент, как видно из зависимости этих коэффици-
росту точности оцениваемых параметров критерия
ентов от скорости потока исследуемого раствора
Bi. На рис. 4 приведен пример описания экспери-
через сорбент V (рис. 5).
ментальной зависимости сорбции 60Co(II) Т-35 от
С ростом скорости потока коэффициент пленоч-
времени из исследуемых растворов без гумино- ной диффузии увеличивается, что в рамках пленоч-
Таблица 1. Пример описания кинетики сорбции Co(II) сорбентом T-35 в режиме ограниченного объема по модели
смешанной диффузии (5). Масса раствора v = 100 г, масса сорбента m = 1.0 г, [m] = m/v = 0.01 г/г, рН 7.0-7.3, скорость
протекания раствора через колонку сорбента V = 15 мл/мин, температура 20°Са
Стандартная
Параметр
Значение
t-Критерий Стьюдента
95%-ный интервал значений параметра
погрешность
B1
0.55
0.02
41
0.53-0.60
μ1
1.7 × 10-3
7 × 10-5
24
0.001-0.002
B2
0.40
0.02
28
0.37-0.45
μ2
2.1 × 10-4
8 × 10-6
26
0.0001-0.0002
а Коэффициент детерминации R2 с учетом степеней свободы (115) 0.996, стандартная погрешность уравнения регрессии (5) 0.015,
F-отношение 9700.
РАДИОХИМИЯ том 64 № 2 2022
190
ПОЛЯКОВ и др.
×
×
β
×
β,
×
×
×
×
Скорость потока V, мл/мин
Скорость потока V, мл/мин
Рис. 5. Зависимость параметров приближенного урав-
нения (6) кинетики смешанной диффузии сорбции 60Со
Рис. 6. Зависимость величины критерия Био (Bi) от ско-
сорбентом Т-35 от скорости потока через сорбент (V), рН
рости потока через сорбент (V), вычисленная по уравне-
7.0-7.5, 20°С.
нию (5). рН 7.0-7.3, 20°С.
ной модели диффузии является следствием умень-
величина для ионов кобальта, по нашим данным,
шения толщины пограничного слоя электролита
равна 4.0. Это вызвано тем, что при внешнедиффу-
(δ) вокруг зерна сорбента. Величина коэффициента
зионном переносе в поровом пространстве сорбен-
гелевой диффузии в тех же условиях практически
та ионы Cs(I) взаимодействуют преимущественно с
не изменяется. Средние значения найденной вели-
фазой цианоферрата никеля-калия [15], а ионно-мо-
чины Dg = (6.0 ± 4.5)× 10-10 м2/с и измеренной по
лекулярные комплексы Co(II) - с ZrO2 [13]. Весьма
температурной зависимости Dg-1/T энергии акти-
высокий Kd у Т-35 для ионов цезия приводит к тому,
вации гелевой диффузии 20.7 ± 10.0 кДж/моль для
что хотя скорость сорбции определяется диффузией
диапазона рН 3-5 близки к коэффициенту самодиф-
в поровом растворе Т-35, наблюдаемый коэффици-
фузии и энергии активации Co2+ в ультраразбав-
ент диффузии Cs(I) здесь существенно ниже, чем в
ленных растворах (6.5 × 10-10 м2/с и 19.7-20.8 кДж/
свободном электролите [15].
моль соответственно) [32-33], но превышают эти
На рис. 5 приведены значения коэффициентов
значения для двухзарядных катионов в сульфока-
массопереноса β и Dg, полученные из данных по
тионитах [34] и карбоксильных катионитах [35].
сорбции Co(II) в присутствии гуминовых кислот.
Из данных по низкотемпературной сорбции азо-
Видно, что в пределах погрешности эти значения
та сорбентом следует [13], что удельный объем и
не отличаются от аналогичных коэффициентов мас-
удельная площадь поверхности Т-35, относимая к
сопереноса ионов кобальта. Такое возможно, когда
микропорам размерами менее 25 Å, составляет ме-
гуматный комплекс Co(OH)A [13] является кинети-
нее 30% от общей величины удельного объема пор
чески лабильным.
и площади поверхности пор. Более 60% объема
порового пространства относится к порам с разме-
Величина критерия Bi характеризует конкурент-
ный вклад пленочной и гелевой диффузии в сме-
рами 25-462 Å. Это, вместе с высоким значением
Dg показывает, что электролит, находящийся в по-
шанно-диффузионный массоперенос. Считается,
ровом пространстве, препятствует взаимодействию
что для области сорбции Генри при Bi > 20 преоб-
диффундирующих ионов со стенками пор фазовых
ладает внутренняя диффузия, при Bi < 1 массопере-
составляющих сорбента Т-35 в отличие от условий
нос протекает в режиме пленочной диффузии, а в
диффузии Co(II) в порах сульфакатионитов. Разли-
промежуточной области 1 < Bi < 5 вклады от внеш-
чие в величине коэффициента гелевой диффузии Dg
ней и внутренней диффузии соизмеримы [22]. Как
у сорбента Т-35 для ионов Cs(I) [15] и ионов Co(II)
видно из рис. 5 и 6, увеличение скорости пропуска-
по данным настоящей работы связаны, по нашему
ния раствора сопровождается как ростом коэффи-
мнению, с различием в механизмах сорбции этих
циента пленочной диффузии β, так и увеличением
ионов и в величинах Kd. Так, при рН 7.8, для кото-
критерия Bi. Это вызвано уменьшением толщины
рого получены экспериментальные данные в работе
диффузионного пограничного слоя δ с ростом ско-
[15], lgKd [мл/г] ионов цезия составляет 5.6, а та же
рости раствора и вместе с численными значения-
РАДИОХИМИЯ том 64 № 2 2022
КИНЕТИКА СОРБЦИИ
60Сo КОМПОЗИТНЫМ СОРБЕНТОМ ТЕРМОКСИД 35
191
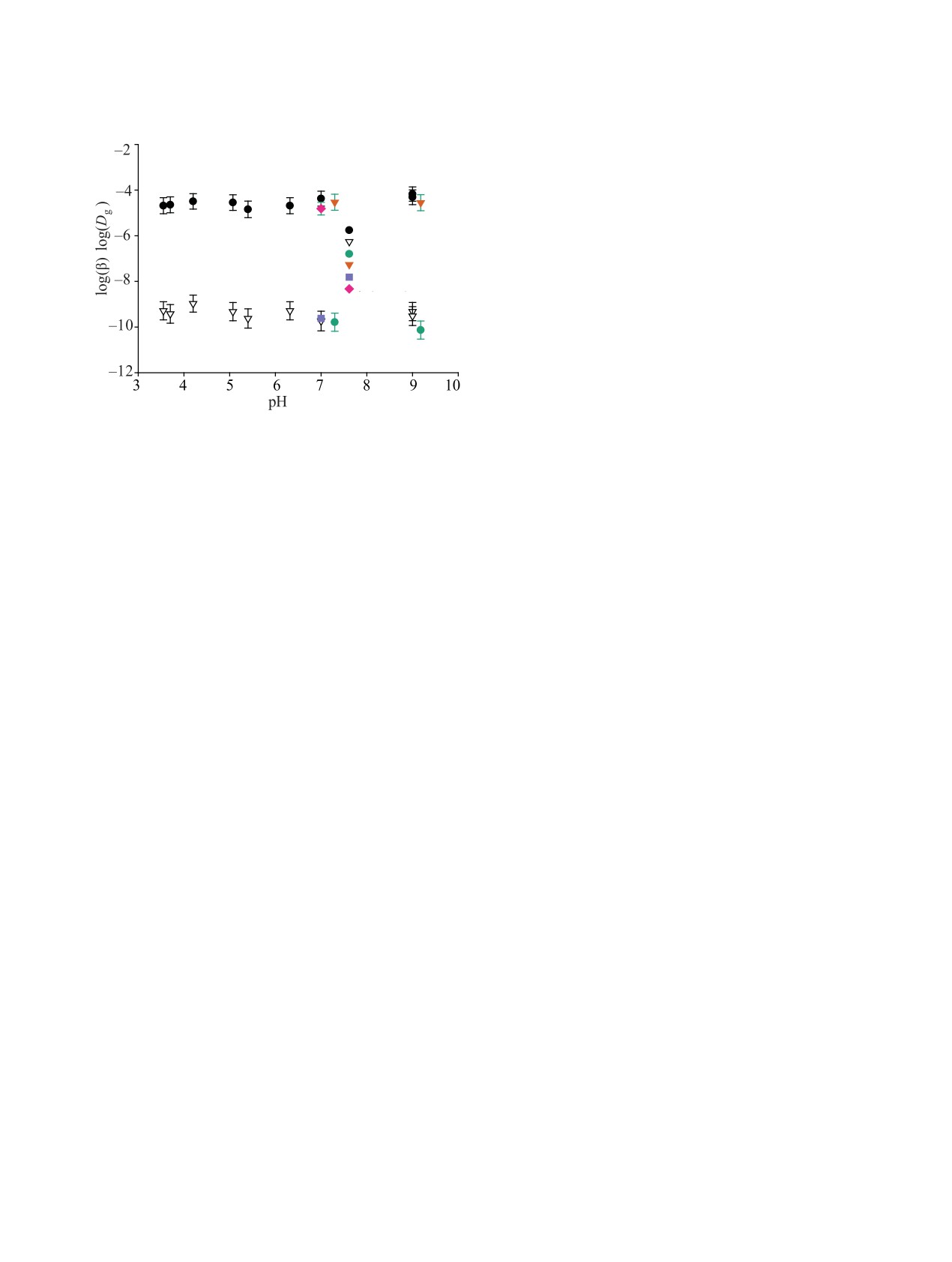
и гелевой диффузии ионов Co(II) в порах сорбента
Т-35 на заключительной наблюдаемой стадии со-
рбции. Коэффициент пленочной диффузии, как и
толщина слоя пленки, зависит от скорости пропу-
β
скания раствора через сорбент. Коэффициент геле-
Dg
Dg (ГК)
вой диффузии характеризует массоперенос ионов в
β (ГК)
растворе электролита, находящемся в переходных
Dg (K&M)
β (K&M)
порах сорбента. Установлено, что присутствие гу-
миновых кислот на уровне 10 мг/л статистически
значимо не влияет на скорость смешанно-диффузи-
онного переноса Co(II) в сорбент Т-35. Полученные
данные показывают, что композитный сорбент Т-35
может применяться для эффективного извлечения
ионов Co(II) из водных растворов в присутствии гу-
Рис. 7. Зависимость коэффициентов пленочной (β, м/с)
миновых кислот с точки зрения как Kd, так и скоро-
и гелевой диффузии (Dg, м2/с) от рН исследуемого рас-
сти реализации сорбции в динамическом режиме.
твора. V = 15 мл/мин, 20°С. K&M - результаты оценки
по теории [36].
ФОНДОВАЯ ПОДДЕРЖКА
ми найденных параметров диффузии (Dg и β) под-
Работа выполнена по планам фундаментальных
тверждает правильность отнесения наблюдаемого
исследования ИХТТ УрО РАН.
сорбционного процесса к смешанно-диффузион-
ному механизму. На диффузионный характер сор-
бционного массопереноса Co(II) в исследованной
КОНФЛИКТ ИНТЕРЕСОВ
системе указывает также отсутствие зависимости
коэффициентов массопереноса β и Dg от рН, ожида-
Авторы заявляют об отсутствии конфликта ин-
емое для кинетического режима сорбции (рис. 7).
Условием реализации диффузионных механизмов
тересов.
является большая удельная поверхность и доля по-
рового пространства сорбента Т-35 с диаметром
СПИСОК ЛИТЕРАТУРЫ
более 3 нм. Для независимой проверки изложенных
выше выводов мы воспользовались теорией при-
ближенного анализа кинетики смешанно-диффу-
1.
Николаев А.Н. Оценка возможности дезактивации
зионных сорбционных процессов [36, 37]. Пример
бетона от 137Сs и 60Со реагентным выщелачиванием:
результата расчетов β и Dg, выполненных по этой
Дис. … к.х.н. М.: МосНПО Радон, 2011. С. 70.
методике для рН 6 и скорости потока раствора через
2.
Ремез В.П., Иошин А.А., Ташлыков О.Л., Щекле-
колонку с сорбентом Т-35 V = 15 мл/мин, приведен
ин С.Е. // Молодежный научный семинар «Реакторы
на рис. 7. Видно, что найденные оценки коэффици-
на быстрых нейтронах и соответствующие топлив-
ные циклы». Екатеринбург: УрФУ, 2017. C. 46.
ентов пленочной и гелевой диффузии согласуются с
полученными нами данными.
3.
Локшин Э.П., Иваненко В.И., Корнейков Р.И. // Атом.
энергия. 2011. T. 110, № 5. C. 285.
В целом совокупность данных по кинетике со-
4.
Кулюхин С.А., Коновалова Р.А., Горбачева М.П., Ру-
рбции микроколичеств ионов Co(II) в хлоридно-а-
мер И.А., Красавина Е.П., Мизина Л.В. Патент RU
цететном растворе сорбентом Т-35 показывает, что
2497213. 2013.
смешанно-диффузионная модель кинетики сорб-
5.
Муратов О.Э., Степанов И.К., Царева С.М. // Эко-
ции Co(II) описывает совокупность полученных
логия пром. производства. 2012. Т. 3. С. 30.
данных наиболее адекватно с физико-химической и
статистической точек зрения. По результатам оцен-
6.
Поляков Е.В. Реакции ионно-коллоидных форм ми-
крокомпонентов и радионуклидов в водных раство-
ки влияния скорости протекания раствора через со-
рах. Екатеринбург: ИХТТ УрО РАН, 2003. 279 с.
рбент, рН, концентрации ГК и температуры на сор-
бцию Co(II) гранулами сорбента можно заключить,
7.
Volkov I.V., Polyakov E.V. // Radiochemistry.
2020.
что кинетика сорбции контролируется сочетанием
Vol. 62. P. 141.
пленочной диффузии на начальном этапе процесса
РАДИОХИМИЯ том 64 № 2 2022
192
ПОЛЯКОВ и др.
8.
Zong P., Guo Zh., He Ch., Zhao Y., Liu Sh., Wang H.,
22. Кокотов Ю.А., Пасечник В.А. Равновесие и кинетика
Pan H. // J. Radioanal. Nucl. Chem. 2012. Vol. 293.
ионного обмена. Л.: Химия, 1970. 336 c.
P. 289.
23. Rouquerol J., Rouquerol F., Sing K.S.W., Maurin G.,
9.
Шарыгин Л.М. Термостойкие неорганические сор-
Rouquerol J., Llewellyn F.P. Adsorption at the Liquid-
бенты. Екатеринбург: ИХТТ УрО РАН, 2012. 304 c.
Solid Interface: Thermodynamics and Methodology;
Adsorption by Powders and Porous Solids. Principles,
10. Производственно-научная
фирма
«Термок-
Methodology and Applications. Marseille, France:
сид».
Elsevier, 2012, P. 106.
tehnologicheskih-vod-aes-i-drugih-predpriyatii-
atomnoi-otrasli/ (дата посещения 24 апреля 2020 г.).
24. Поляков Е.В., Нистель И.Г. // Радиохимия. 1985.
T. 27, № 5. С. 604.
11. Плетнев Р.Н., Золотухина Л.В., Губанов В.А. ЯМР в
соединениях переменного состава. М.: Наука, 1983.
25. Ali M.M.S., Sami M., El Sayed A.A. // J. Radioanal. Nucl.
167 c.
Chem. 2020. Vol. 324. P. 189.
12. Eibl M., Virtanen S., Pischel F., Bok F., Lönnrot S.,
26. Печенюк С.И. // Вестн. ЮУрГУ. Сер.: Химия. 2013.
Shawd S., Huittinen N. // Appl. Surf. Sci. 2019. Vol. 487.
T .5, № 2. С. 26.
P. 1316.
27. Kotrly S., Sucha L. Handbook of Chemical Equilibria
13. Поляков Е.В., Денисов Е.И., Волков И.В. // Радиохи-
in Analytical Chemistry. Chichester, England: Wiley,
мия. 2021. T. 63, № 6. C. 545-552.
1985. 252 p.
28. Migdisov A.A., Zizin D., Williamson-Jones A.E. //
14. Voronina A.V., Nogovitsyna E.V. // Radiochemistry.
Geochim. Cosmochim. Acta. 2011. Vol. 75, N
14.
2015. Vol. 57, N 1. P. 79.
P. 4065.
15. Ноговицина Е.В. Получение и свойства поверхност-
29. Басоло Ф., Пирсон Р. Механизмы неорганических
но-модифицированных сорбентов для извлечения
реакций. М.: Мир, 1971. С. 149.
цезия. Радиохимии и приклодной экологии: Дис. …
к.х.н. Екатеринубрг: УрФУ, 2011. 169 с.
30. Лыков А.В. Теория теплопроводности. М.: Высш.
шк., 1967. 600 с.
16. Коршунов И.А., Черноруков Н.Г., Прокофьева Т.В. //
Радиохимия. 1976. Т.18, № 1. С. 5.
31. Аксельруд Г.А. // ЖФХ. 1959. Т. 33, № 10. С. 2317.
17. Головин Ю.И., Кузнецов Д.Г., Васюков В.М., Шу-
32. Patil S.F., Rajurkar N.S., Borhade A.V. // J. Radioanal.
клинов А.В., Коренков В.В., Григорьев И.П., Столя-
Nucl. Chem. 1990. Vol. 140, N 1. P. 31.
ров А.А. // Вестн. ТГУ. 2013. Т. 18, № 6. С. 3150.
33. Patil S.F., Patil P.R.S. // J. Radioanal. Nucl. Chem. 2000.
18. Yiacoumi S., Tien C. Kinetics of Metal Ion Adsorption
Vol. 245, N 3. P. 645.
from Aqueous Solutions: Models, Algorithms, and
34. Grossbach R. Austauschadsorption in Theorie und
Applications. New York: Springer, 1995.
Praxis. Berlin: Akademie, 1957. S. 276-290.
19. De Boodt M.F., Hayes M.H.B., McBride M.B.
35. Бобкова Л.А., Жаркова В.В., Козик В.В. // Изв. Томск.
Interactions at the Soil Colloid-Soil Solution Interface/
политехн. ун-та. Химия. 2014. T. 324, № 3. С. 74.
Ed. G.H. Belt. Belgium: Springer, 1986.
36. Кузьминых В.А., Мелешко В.П. // ЖФХ. 1980. Т. 54,
20. Денисов Е.И., Бетенеков Н.Д. // Радиохимия. 2018.
№ 8. С. 2063.
Т. 60, № 1. С. 27.
37. Кузьминых В.А. Смешаннодиффузионная кинетика
21. Бетенеков Н.Д., Денисов Е.И. // Радиохимия. 2016.
ионного обмена: Автореф. дис. … к.х.н. Воронеж:
Т. 58, № 2. C. 540.
ВГУ, 1999. 24 с.
РАДИОХИМИЯ том 64 № 2 2022