РАДИОХИМИЯ, 2022, том 64, № 2, с. 143-149
УДК 546.798.21: 546.171.53
ИЗУЧЕНИЕ КИНЕТИКИ ВОССТАНОВЛЕНИЯ Np(V)
КАРБОГИДРАЗИДОМ, КАТАЛИЗИРУЕМОГО Tc(VII), В
ПРИСУТСТВИИ U(VI)
© 2022 г. К. Н. Двоеглазова,*, Е. Ю. Павлюкевича, Е. Д. Филимоноваа, В. Н. Алексеенкоб
а Высокотехнологический научно-исследовательский институт
неорганических материалов им. акад. А.А. Бочвара,
123098, Москва, ул. Рогова, д. 5а
б Горно химический комбинат,
660049, Железногорск Красноярского края, ул. Ленина, д. 53
*e-mail: KNDvoeglazov@bochvar.ru
Поступила в редакцию 25.01.2021, после доработки 21.02.2021, принята к публикации 25.02.2021
Спектрофотометрическим методом изучена кинетика восстановления Np(V) карбогидразидом в
азотнокислой среде в присутствии ионов Tc(VII) и U(VI). Восстановленная форма Np(IV) неустойчива
во времени, наблюдается обратное окисление, ускоряющееся при увеличении концентрации ионов
Tc(VII) и температуры. Скорость стадии восстановления существенно выше скорости обратного
окисления. Найдены порядки обеих стадий реакции по всем компонентам.
Ключевые слова: нептуний, растворы, восстановление, карбогидразид, катализ, технеций, уран,
кинетика, механизм.
DOI: 10.31857/S0033831122020046, EDN: FOBCPA
ВВЕДЕНИЕ
чивы к воздействию азотной и азотистой кислот,
они частично окисляются и тем самым оказывают
В ходе экстракционной переработки ОЯТ на вос-
каталитическое влияние как на разложение восста-
становительную реэкстракцию нептуний поступает
новителя, так и на образование восстановленных
в шестивалентном состоянии. Одним из восстано-
форм актинидов (Pu(III), Np(V), Np(IV)).
вителей, предлагаемых для проведения совместной
Каталитическое действие Tc при восстановле-
реэкстракции плутония и нептуния [1], является
нии Pu(IV) гидразином описано в работе [7], окси-
карбогидразид (КГ), CO(N2H3)2. При взаимодей-
этилгидразином - в работе [8] и диформилгидрази-
ствии с карбогидразидом Np(VI) быстро восстанав-
ном - в работе [9]. Влияние Тс на восстановление
ливается до Np(V) [2]. Дальнейшее восстановление
Np(V) гидразином описано в работе [7]. В связи с
Np(V) до Np(IV) протекает со значительно меньшей
этим нельзя исключить подобное влияние на вос-
скоростью. Скорость этой реакции изучена при
становление Np(V) карбогидразидом. Определение
70°С в работе [3]. Ионы Pu катализируют реакцию
условий возможного влияния на получение Np(IV)
восстановления ионов Np(V) карбогидразидом.
важно с технологической точки зрения, так как его
Установлено, что скорость реакции восстановления
образование может уменьшить долю реэкстракции
Np(V) пропорциональна концентрации КГ в степе-
Np и, следовательно, снизить очистку экстракта
ни 0.85, азотной кислоты в степени 1.3, Np(VI) в
урана от нептуния.
степени 1.8.
При взаимодействии с большинством органиче-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ских производных гидразина Tc(VII) восстанавли-
вается до малоэкстрагируемых форм Tc(IV, V) [4-
Оборудование, реактивы, методы анализа.
6], которые при реэкстракции переходят в водную
За изменением валентных форм нептуния следили
фазу. В связи с тем, что данные формы Тс неустой-
спектрофотометрическим методом на спектрофото-
143
144
ДВОЕГЛАЗОВ и др.
Таблица 1. Коэффициенты экстинкции (, л·моль-1·см-1) Np(IV) и Np(V), соответствующие длинам волн 617 и
701 нм, при 65°С и различной концентрации реагентов
Np(IV)
Np(V)
[HNO3], моль/л
[КГ], моль/л
(617 нм)
(701 нм)
(617 нм)
(701 нм)
3.0
0
1.7
28.9
11.4
0.1
3.0
0.086
1.8
29.3
-
-
2.7
0.231
2.0
29.6
-
-
2.0
0
1.6
28.6
12.3
0.5
1.95
0.086
1.8
28.8
-
-
1.85
0.231
2.0
29.1
-
-
0.95
0
2.1
28.8
13.0
0.7
0.95
0.086
2.1
28.7
-
-
0.95
0.231
2.3
28.3
-
-
метре Lambda 465 (Perkin Elmer) под управлением
коэффициенты экстинкции Np(IV) и Np(V) с уче-
персонального компьютера.
том влияния концентрации азотной кислоты и КГ.
Результаты определения коэффициентов экстинк-
Запасной раствор нептуния готовили раство-
ции представлены в табл. 1. Видно, что наблюда-
рением навески NpO2 в 7 моль/л HNO3 при кипя-
ется слабая тенденция увеличения коэффициента
чении. Далее проводили сорбционную очистку на
экстинкции при росте концентрации КГ при кон-
анионите ВП-1 АП и упаривание полученного де-
центрации азотной кислоты от 1.8 до 3.0 моль/л.
сорбата с целью окисления нетуния до шестива-
лентного состояния.
Расчет концентраций валентных форм произво-
дили по закону Бугера-Ламберта-Бера с учетом су-
Запасной раствор пертехнетата аммония готови-
перпозиции их поглощения при длинах волн 617 и
ли растворением его навески в дистиллированной
701 нм:
воде. Концентрацию Тс в запасном растворе опре-
деляли спектрофотометрическим методом по зна-
,
(1)
чению оптической плотности при длине волны 288
,
(2)
нм, где расположен характеристический пик ионов
TcO–.
где e - коэффициент экстинкции, С - концентрация,
Запасной раствор КГ готовили растворением в
l - длина оптического пути, D - оптическая плот-
1 моль/л HNO3 навески препарата с массовой до-
ность.
лей основного продукта 97% производства Acros
Методика эксперимента. В оптическую кюве-
Organics (США). Концентрацию КГ в запасном рас-
ту вносили последовательно все растворы, кроме
творе определяли титрованием 0.1 н. раствором ни-
восстановителя. Размещали кювету с раствором в
трита натрия в среде 4 моль/л HCl. Приготовленный
термостатируемом кюветном отделении спектро-
раствор КГ хранили в темном прохладном месте и
фотометра. Выдерживали для нагревания не менее
использовали на протяжении не более 14 календар-
15 мин. Добавляли аликвоту восстановителя, пере-
ных дней.
мешивали не более 30 с и начинали автоматическую
В работе использовали азотную кислоту марки
запись спектров в диапазоне длин волн от 350 до
ос.ч., которую дополнительно очищали дистилля-
1100 нм через определенные промежутки времени.
цией. Концентрацию кислоты в запасном растворе
устанавливали титрованием аликвоты этого раство-
РЕЗУЛЬТАТЫ
ра 0.1 н. щелочью с использованием автоматическо-
го титратора АТП-02, в рабочих растворах, содер-
В связи с тем, что в нашем предыдущем иссле-
жащих уран и нептуний, - потенциометрическим
довании [3] было показано, что при комнатной тем-
титрованием в среде оксалата аммония.
пературе восстановление Np(V) с помощью КГ про-
Для определения концентрации валентных форм
исходит медленно, для наблюдения за изменением
нептуния в исследуемых растворах были найдены
концентрации в практически приемлемое время все
РАДИОХИМИЯ том 64 № 2 2022
ИЗУЧЕНИЕ КИНЕТИКИ ВОССТАНОВЛЕНИЯ Np(V) КАРБОГИДР
АЗИДОМ
145
0.5
При добавлении к раствору Np(V) нитрата ура-
7
нила скорость восстановления значительно возрас-
0.4
тает, при этом наблюдается полное восстановление
6
Np(V) до Np(IV). При внесении в раствор пертех-
0.3
нетата аммония до 100 мг/л (по Tc) также наблю-
дается ускорение реакции восстановления, но при
5
0.2
этом восстановление проходит не до конца, а через
4
минимум, и затем наблюдается обратное окисление
0.1
3
Np(IV). Описанное изменение концентрации Np(V)
2
1
графически представлено на рис. 2.
0
550
600
650
700
750
800
850
Восстановление Np(V) в присутствии ионов Тс
Длина волны, нм
сопровождается значительным газовыделением, ко-
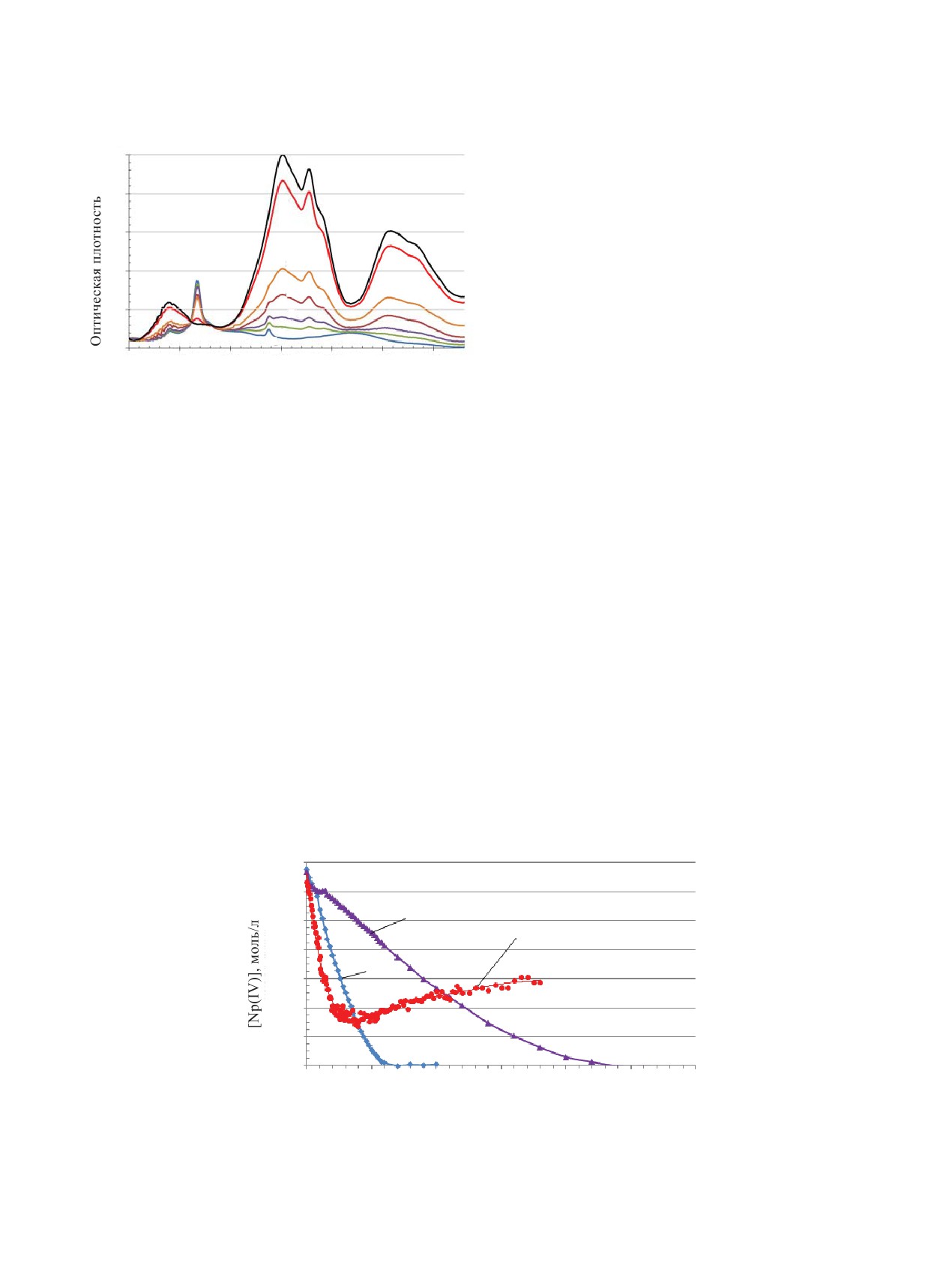
Рис.
1. Изменение спектров при
[U
]
=
20 г/л,
торое проявляется на кинетических кривых в виде
] = 3 моль/л, [КГ] = 0.3 моль/л
[Np] = 0.014 моль/л, [HNO3
разброса значений концентрации Np(V) (кривая 3,
и 68°С во времени: 1 - 10 с, 2 - 3 мин, 3 - 5 мин, 4 -
рис. 2). Особенно это заметно в точке перегиба кон-
10 мин, 5 - 15 мин, 6 - 40 мин, 7 - 96 мин.
центрации Np(V). Таким образом, можно сделать
эксперименты проводили при температуре от 40 до
вывод, что ионы Tc(VII) и U(VI) катализируют ре-
68°С.
акцию восстановления Np(V) карбогидразидом в
При добавлении КГ к раствору Np(V) происхо-
разной степени.
дит изменение спектра: значения оптической плот-
Общее поведение Np(V) в исследуемой системе
ности при 617 и 980 нм, где находятся характеристи-
похоже на его поведение в присутствии гидразина,
которое изучено в работе [7]. Отличие заключается
ческие пики Np(V), постепенно уменьшаются, а в
в скорости обратного окисления. В присутствии КГ
области 650-850 нм появляются пики, характерные
обратное окисление Np(IV) значительно медленнее
для Np(IV) (рис. 1). В связи с тем, что основной пик
и не доходит до конца во всех исследованных усло-
Np(V) при 980 нм имеет высокий коэффициент экс-
виях.
тинкции (250-300), а пик Np(IV) при 701 нм имеет
Рассмотрим более подробно влияние всех ком-
коэффициент экстинкции от 28 до 32 л·моль-1·см-1,
понентов на скорость восстановления Np(V) карбо-
то одновременно наблюдать за изменением этих пи-
гидразидом.
ков невозможно. Поэтому за одновременным изме-
Как было уже отмечено выше, добавление ионов
нением концентрации Np(V) и Np(IV) следили по
уранила ускоряет реакцию восстановления Np(V)
изменению оптической плотности при 617 и 701 нм
карбогидразидом. Без нитрата уранила время
соответственно.
«полуреакции» (восстановление на 50%) составляет
0.014
0.012
1
0.010
3
0.008
2
0.006
0.004
0.002
0.000
0
50
100
150
200
250
300
Время, мин
Рис. 2. Изменение концентрации Np(V) во времени при [Np]0 = 0.014 моль/л, [КГ] = 0.3 моль/л, [HNO3] =3.0 моль/л и 68°C:
1 - без добавок, 2 - в присутствии [U] = 30 г/л, 3 - в присутствии [Тс] = 100 мг/л.
РАДИОХИМИЯ том 64 № 2 2022
146
ДВОЕГЛАЗОВ и др.
0.014
-4.5
3
0.012
0.010
-5.5
0.008
3
4
2
-6.5
0.006
4
5
0.004
6
-7.5
0.002
1
0.000
5
0
40
80
120
160
200
-8.5
Время, мин
0
10
20
30
40
50
60
Время, мин
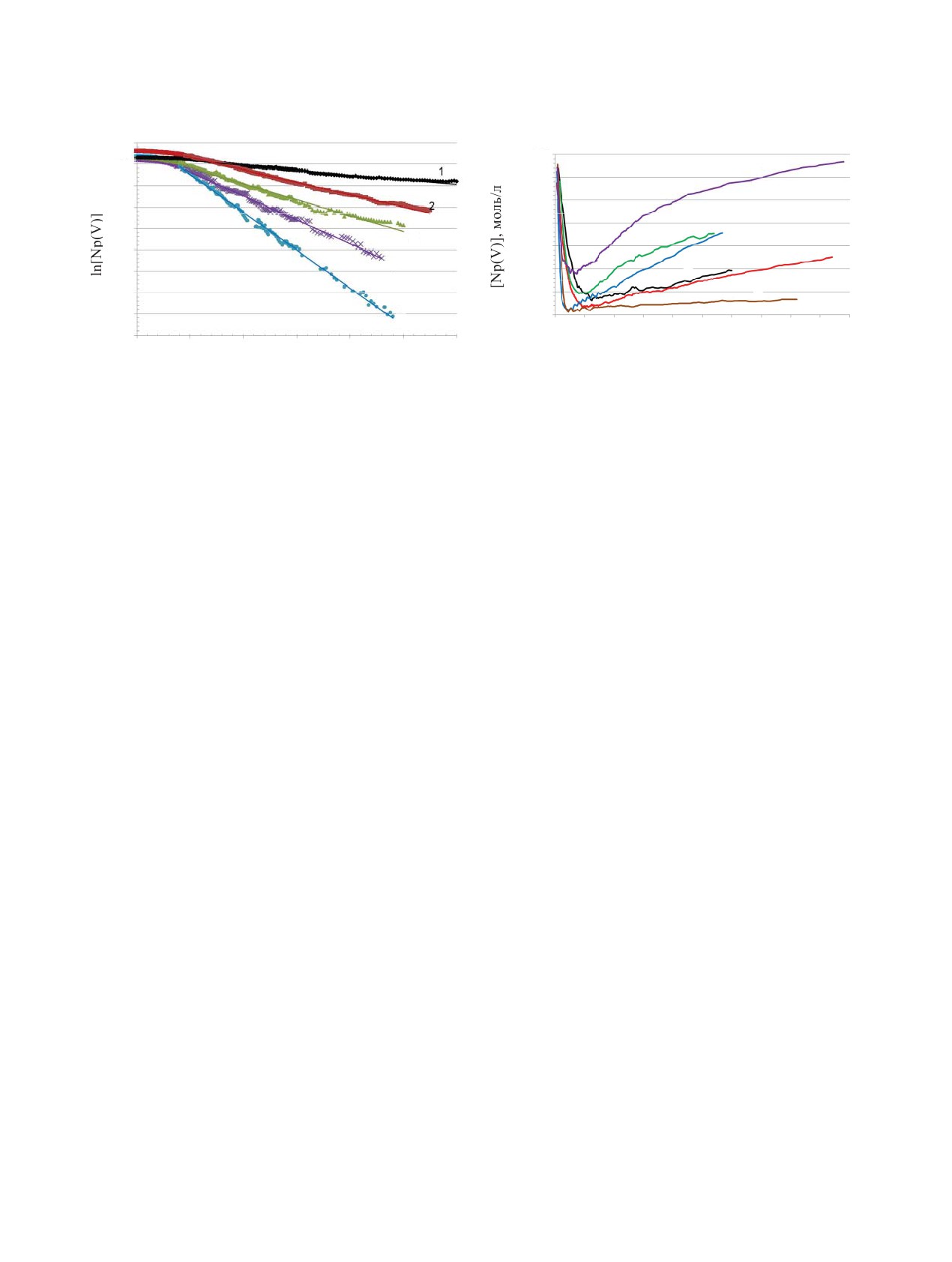
Рис. 4. Изменение концентрации [Np(V)] во времени
Рис.
3. Зависимость ln[Np(V)] от времени при
при [Np]0 = 0.014 моль/л, [Тс] = 100 мг/л, [U] = 20 г/л,
[HNO3] = 1 моль/л, [СO(N2H3)2] = 0.3 моль/л, [U] = 20 г/л,
[КГ] = 0.3 моль/л, 68.0°C и различной концентрации
40°С и различной концентрации технеция, мг/л: 1 - 50,
азотной кислоты [HNO3], моль/л: 1 - 0.7, 2 - 1.0, 3 - 1.5,
2 - 100, 3 - 150, 4 - 200, 5 - 300.
1 - 2.0, 5 - 2.5, 6 - 3.0.
80 мин (рис. 2), а в присутствии 30 гU/л - 22 мин, т.е.
ты для всех выполненных экспериментов (табл. 2).
время «полуреакции» уменьшается почти в 4 раза.
Из значений констант скорости графическим путем
Однако, при дальнейшем изменении концентрации
определен порядок реакции по всем компонентам.
U(VI) от
20 до
40 г/л время
«полуреакции»
Порядок реакции для константы скорости восста-
изменяется менее значительно, от 20 до 11 мин.
новления (k1) по Тс оказался равен 0.35.
В отсутствии технеция кинетические кривые
При уменьшении концентрации азотной кисло-
убыли концентрации Np(V) не описываются ни
ты наблюдается более продолжительный индукци-
уравнением нулевого порядка, ни уравнением пер-
онный период в появлении Np(IV), а скорость вос-
вого порядка, наблюдается изменение порядка во
становления уменьшается (рис. 4). Скорость стадии
времени. Начальная часть кинетической кривой, до
обратного окисления изменяется по более сложной
восстановления на 30-40%, описывается линейной
зависимости. При увеличении концентрации кисло-
функцией, т.е. нулевым порядком, а остальная часть
ты от 0.7 до 1.5 моль/л скорость увеличивается, а
кривой описывается уравнением первого порядка
затем замедляется. Наиболее вероятно это связано
вплоть до 95%-ного восстановления. Отсюда следу-
с образованием менее реакционноспособных ком-
ет вывод, что восстановление происходит по двум
плексов Np4+ с нитрат-ионами [10]. Второй при-
параллельным путям с близкими скоростями.
чиной может быть уменьшение доли гидролизо-
ванных ионов Np(OH)3+, которые являются более
При добавлении ионов Тс(VII) вид кинетической
реакционноспособными по сравнению с акваионом
кривой сильно изменяется. В начальный момент
Np4+ [11].
времени наблюдается индукционный период, после
которого скорость восстановления увеличивается.
Из рис. 5 видно, что порядок реакции для k1 по
При увеличении концентрации Тс(VII) наблюдает-
азотной кислоте изменяется в исследованном диа-
ся небольшое ускорение как стадии восстановле-
пазоне. При [HNO3] от 1.0 до 1.5 моль/л порядок
ния, так и стадии окисления, однако на время ин-
реакции равен -2.3, в диапазоне от 1.5 до 3.0 моль/л
дукционного периода это не влияет. Кинетические
порядок равен -1. Это возможно при изменении ме-
кривые как Np(V), так и Np(IV) до точки переги-
ханизма реакции или при существенном изменении
скорости одной из параллельных реакций в зависи-
ба описываются уравнением первого порядка, что
видно при преобразовании кривых в полулогариф-
мости от концентрации кислоты.
мических координатах ln[Np(V)]-время (рис. 3).
При увеличении концентрации карбогидразида
Из тангенса угла наклона полученных линейных
скорость восстановления увеличивается, наблю-
зависимостей (без учета индукционного периода)
даемая скорость обратного окисления остается
находили константу первого порядка относительно
постоянной, что видно из наклонов кинетических
нептуния. Подобным образом рассчитали констан-
кривых. Это приводит к выводу, что на этой стадии
РАДИОХИМИЯ том 64 № 2 2022
ИЗУЧЕНИЕ КИНЕТИКИ ВОССТАНОВЛЕНИЯ Np(V) КАРБОГИДР
АЗИДОМ
147
Таблица 2. Условия экспериментов и рассчитанные значения констант скорости
[Np], моль/л
[КГ], моль/л
[U], г/л
[Tc], мг/л
[HNO3], моль/л
T, °C
k1, мин-1
k2, мин-1
0.014
0.3
20
0
3
58.6
-
-
0.014
0.3
25
0
3
68
0.0453
-
0.014
0.3
35
0
3
68
0.0569
-
0.014
0.3
40
0
3
68
0.063
-
0.014
0.3
20
0
3
68
0.0378
-
0.014
0.3
20
50
3
68
0.0831
0.00117
0.014
0.3
20
100
3
68
0.116
0.0101
0.014
0.3
20
74
3
68
0.0952
0.00103
0.014
0.3
0
100
3
68
0.0582
0.00245
0.014
0.4
20
100
3
68
0.195
0.00215
0.014
0.2
20
100
3
68
0.0901
0.00187
0.014
0.1
20
100
3
68
0.0338
0.00183
0.014
0.3
20
100
2
68
0.185
0.00783
0.014
0.3
20
100
1.5
68
0.249
0.0167
0.014
0.3
20
100
2.5
68
0.169
0.00295
0.014
0.15
20
100
3
68
0.0568
0.0017
0.014
0.25
20
100
3
68
0.105
0.00172
0.014
0.3
20
30
3
68
0.0751
0.0002
0.0105
0.3
20
100
1
68
0.528
0.00741
0.014
0.3
20
100
1
68
0.526
0.0077
0.014
0.3
20
100
1.2
68
0.45
0.00744
0.014
0.3
20
100
1
60
0.282
0.00188
0.014
0.3
20
100
1
55
0.2
0.000888
0.014
0.3
20
100
1
50
0.1079
-
0.014
0.3
20
100
1
40
0.0284
-
0.014
0.3
20
300
1
40
0.0917
-
0.014
0.3
20
200
1
40
0.0548
-
0.014
0.3
20
50
1
40
0.0116
-
0.014
0.3
20
150
1
40
0.029
-
0.014
0.3
60
100
1
40
0.0604
-
0.014
0.3
40
100
1
40
0.041
-
либо карбогидразид не участвует в реакциях, либо
Для уточнения влияния технеция на скорость
его влияние несущественно. Порядок реакции ста-
реакции восстановления Np(V) проведена до-
дии восстановления Np(V) не меняется во всем ис-
полнительная серия экспериментов при 40°С и
следованном диапазоне и равен 1.2.
[HNO3] = 1 моль/л. Результаты расчета констант
Зависимость скорости реакции от концентрации
скорости k2 представлены в табл. 2. Видно, что
урана определяли при температуре 40°С и концен-
влияние Тс при этих условиях более сильное,
чем при концентрации азотной кислоты 3 моль/л.
трации азотной кислоты 1 моль/л. Из табл. 2 видно,
Порядок реакции по Тс оказался равен 1.
что с увеличением концентрации ионов урана(VI)
константа скорости k1 увеличивается. Порядок
В соответствии с полученными порядка-
по урану для k1 оказался равным 0.67.
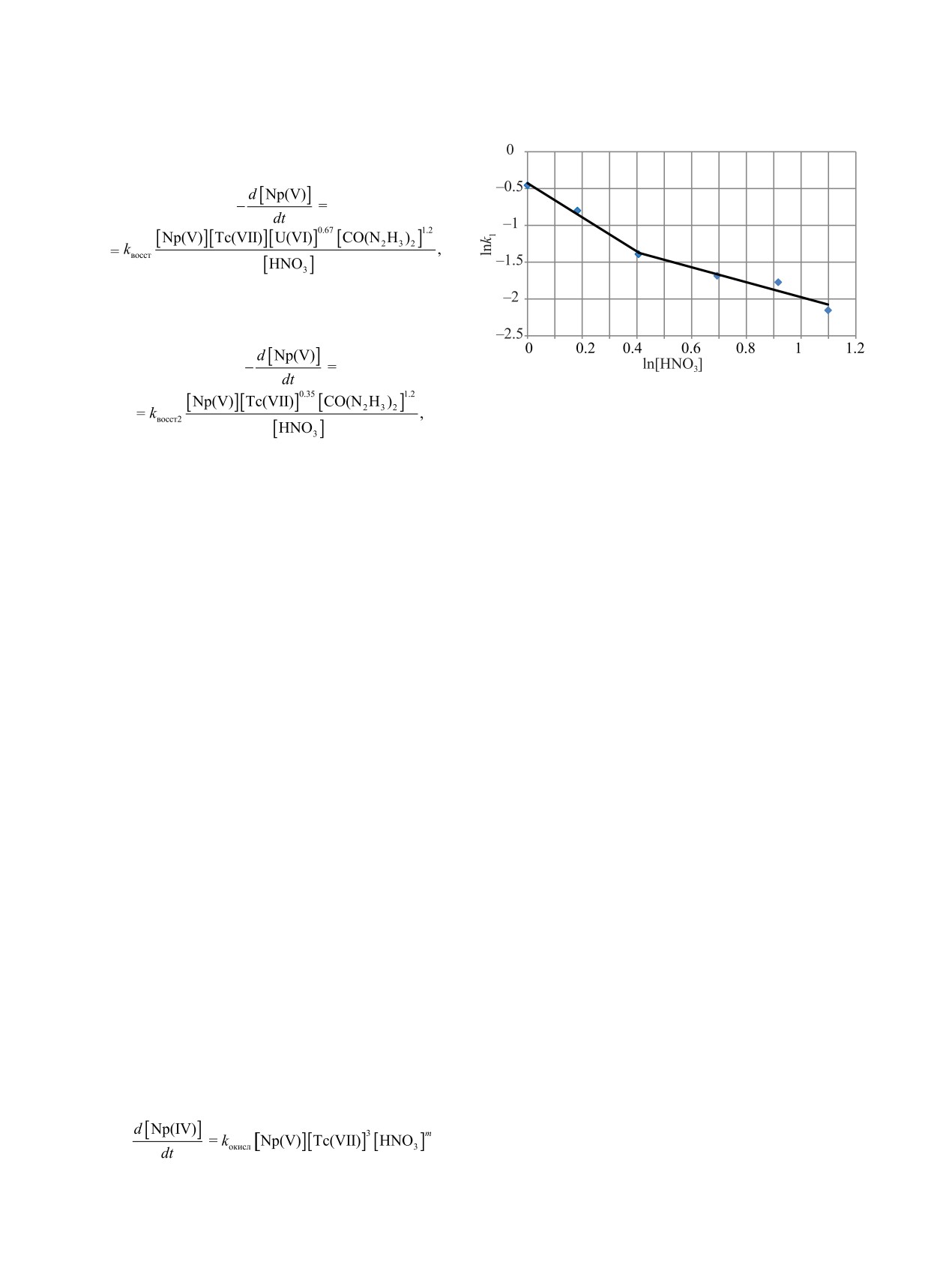
ми уравнение скорости стадии восстановления
РАДИОХИМИЯ том 64 № 2 2022
148
ДВОЕГЛАЗОВ и др.
Np(V) в исследованной системе запишется в
виде
(3)
2.3
где kвосст = (1.06 ± 0.24)×104 л0.57/(мин∙моль0.57) при
68°С в диапазоне концентрации кислоты от 1 до
1.5 моль/л,
Рис. 5. Зависимость lnk1 от ln[HNO3] при [КГ] = 0.3 моль/л,
[U] = 20 г/л, [Тс(VII)] = 100 мг/л и 68°C.
(4)
где kокисл - обобщенная константа скорости окис-
ления Np(V). Энергия активации оценена равной
где kвосст2 = (17.8 ± 1.8) моль0.55/(л0.55∙мин) при 68°С,
155 кДж/моль.
[U(VI)] = 20 г/л в диапазоне концентрации кислоты
от 1.5 до 3.0 моль/л.
ОБСУЖДЕНИЕ
Энергию активации определяли графическим
путем в координатах lnk1-1/T. Из тангенса угла
Как видно из полученных зависимостей, реакция
наклона прямой рассчитывали энергию актива-
каталитического восстановления Np(V) и последу-
ции, которая для стадии восстановления равна
ющего окисления Np(IV) характеризуется сложным
87.8 кДж/моль.
поведением. Следовательно, в системе имеется не-
В связи с тем, что стадия обратного окисле-
сколько скорость-определяющих реакций, на кото-
ния Np(IV) в некоторых экспериментах проходит
рые разнонаправлено влияют изменяемые параме-
с низкой скоростью, не во всех экспериментах
тры, прежде всего концентрация азотной кислоты
возможно достоверно определить константу ско-
и технеция.
рости. Расчет константы скорости k2 проводили
графическим путем в координатах ln([Np]0 -
На стадии восстановления Np(V) наиболее веро-
[Np(V)]t)-время. Для расчета учитывали только
ятные следующие реакции:
часть кинетической кривой после стабильного
прямое восстановление Np(V) КГ
роста концентрации Np(V). Результаты расчета
2NpO+ + CO(N2H3)2 + H+ = 3Np4+ + CO2+
представлены в табл. 2. Порядки реакции по ком-
+N2 + NH+ + H2O (медленная);
(6)
понентам рассчитывали аналогично рассчитан-
восстановление Tc(VII) посредством КГ [4]
ным для k1. В результате получено, что порядок
реакции окисления Np(IV) по технецию равен 3.
CO(N2H3)2 + TcO4- = TcO– + CO2+ N2 + …,
(7)
Скорость реакции восстановления не зависит от
CO(N2H3)2 + TcO3- + = TcO2+ + CO2+ N2 + …;
(8)
изменения концентрации карбогидразида. Кон-
параллельная реакция получения Tc(V) [12]
станта скорости окисления k2 сложным образом
зависит от концентрации азотной кислоты. За-
2TcO2+ + TcO4- + 3H2O ↔ 3TcO– + 6H+;
(9)
висимость lnk2-ln[HNO3] не является линейной.
параллельная реакция восстановления Np(V) [7]
В соответствии с полученными зависимостями
уравнение, отвечающее за скорость окисления
2NpO+ + TcO– + 6H+ → 2Np4+ + TcO4- + 3H2O. (10)
Np(IV) в присутствии КГ и ионов технеция, в
В ходе второй части реакции
- окисления
общем виде можно записать так:
Np(IV) - наиболее важными являются реакции:
,
(5)
3Np4+ + TcO– + 3H2O → 3NpO+ + TcO2+ + 6H+,
(11)
РАДИОХИМИЯ том 64 № 2 2022
ИЗУЧЕНИЕ КИНЕТИКИ ВОССТАНОВЛЕНИЯ Np(V) КАРБОГИДР
АЗИДОМ
149
2TcO2+ + 3HNO3 + 3H2O = 2TcO– +
нем 60 г/л. Следовательно, вторая часть процесса -
+ 3HNO2 + 2H+ (медленно),
(12)
окисление Np(IV) - будет происходить с низкой
скоростью и этой стадией можно пренебречь как
CO(N2H3)2 + 2HNO2 = … (очень быстро) [1]. (13)
при выборе режима проведения операции совмест-
При составлении возможных химических реак-
ной реэкстракции плутония и нептуния, так и при
ций, протекающих в исследуемой системе, созна-
ее описании в математической модели экстракци-
тельно не учитывались реакции окисления валент-
онного процесса в целом.
ных форм нептуния и технеция азотистой кисло-
той. Это сделано из условия, что азотистая кислота
КОНФЛИКТ ИНТЕРЕСОВ
очень быстро будет израсходована в соответствии с
реакцией (13).
Авторы заявляют об отсутствии конфликта ин-
Часть из представленных реакций (6)-(12) уже
тересов.
изучена и описана в виде кинетических уравнений.
СПИСОК ЛИТЕРАТУРЫ
В соответствии с представленными уравнени-
ями можно записать систему дифференциальных
1.
Алексеенко В.Н. Карбогидразид: Свойства и приме-
уравнений (изменением концентрации азотной кис-
нение в водно-экстракционной технологии перера-
лоты на этом этапе расчета пренебрегаем, считаем,
ботки облученного ядерного топлива: Автореф. дис.
что это изменение мало)
… к.х.н. М., 2013. 15 с.
-d[Np(V)]/dt = k1[Np(V)][ CO(N2H3)2] +
2.
Завалина О.А., Двоеглазов К.Н., Павлюкевич Е.Ю.,
Степанов С.И. // Радиохимия. 2017. T. 59, № 5.
+ k2[Np(V)][Tc(V)] - k3[Np(IV)][Tc(VII)],
(14)
C. 397-401.
-d[Tc(VII)]/dt = k4[Tc(VII)][CO(N2H3)2] +
3.
Двоеглазов К.Н., Завалина О.А., Павлюкевич Е.Ю.,
+ k5[Tc(VII)][Tc(IV)] + k3[Np(IV)][Tc(VII)] -
Зверев Д.В., Алексеенко В.Н. // Хим. технология.
2020. Т. 21, № 6. С. 275-281.
- 0k6[Tc(IV)][HNO3].
(15)
4. Zavalina O., Dvoeglazov K. // Book of Abstracts.
Проведена попытка решить систему дифферен-
Third Int. Conf. on Radiation and Applications in
циальных уравнений (14)-(15) путем подбора не-
Various Fields of Research, RAD
2015, Budva,
известных констант реакций из условия получения
Montenegro June 8-12, 2015. Электронный ресурс
кинетических кривых расходования Np(V) и полу-
чения Np(IV), наиболее близко описываемых экс-
5.
Garraway J., Wilson P.D. // J. Less-Common Met. 1984.
периментально полученными кинетическими зави-
Vol. 97, N 2. P. 191-203.
симостями. Однако такой методический подход не
6.
Колтунов В.С., Журавлева Г.И., Шаповалов М.П. //
привел к желаемому результату.
Радиохимия. 1993. Т. 35, № 6. C. 43-48.
Подбор возможных окислительно-восстанови-
7.
Марченко В.И., Журавлева Г.И., Двоеглазов К.Н.,
тельных реакций, наиболее адекватно описываю-
Савилова О.А. // Хим. технология. 2008. Т. 9, № 2.
C. 61-67.
щих найденные зависимости, следует продолжить.
8.
Баранов С.М., Колтунов В.С. // Радиохимия. 1991.
С точки зрения применения полученных дан-
Т. 33, № 4. C. 58-66.
ных в технологии переработки ОЯТ следует об-
9.
Volk V., Pavlyukevich E., Dvoeglazov K., Podrezova L.,
ратить внимание на следующие факты. Скорость
Veselov S. // Book of Abstracts. 9th Int. Conference on
окисления Np(IV) во всех исследованных услови-
the Chemistry and Physics of the Actinide Elements
ях, кроме [HNO3] = 1.5 моль/л, довольно низкая.
ACTINIDES 2013. Karlsruhe, Germany, July 21-26,
На операции восстановительной реэкстракции,
2013. P. 1-72.
предлагаемой для МП ОДЭК, рекомендован рас-
10. Zhou X., Ye G., Zhang H., Li L., Luo F., Meng Z. //
твор восстановителя состава [КГ] = 0.5 моль/л и
Radiochim. Acta. 2014. Vol. 102, N1/2. P. 111-116.
[HNO3] = 0.5 моль/л. Температура раствора при
11. Колтунов В.С., Тейлор Р., Марченко В.И.,
реэкстракции 40°С. Продолжительность пребыва-
Савилова О.А., Двоеглазов К.Н., Журавлева Г.И. //
ния раствора в экстракционной колонне составляет
Радиохимия. 2005. Т. 47, № 3. C. 228-233.
ориентировочно 1 ч, а концентрация урана - в сред-
12. Zelverte A. // Rapp. CEA-R-5443. France, 1988. 142 p.
РАДИОХИМИЯ том 64 № 2 2022