РАДИОХИМИЯ, 2021, том 63, № 6, с. 525-532
УДК 544.723.2:546.657+546.795
СОРБЦИЯ NdF3 И ThF4 ИЗ РАСПЛАВА LiF-NaF-KF
© 2021 г. Ю. С. Федоровa, *, В. В. Самонинa, А. С. Зотовa, Е. Д. Хрыловаa,
Е. А. Спиридоноваa, А. Е. Мирославовб, А. А. Акатовa
a Санкт-Петербургский государственный технологический институт (технический университет),
190013, Санкт-Петербург, Московский пр., д. 26
б Радиевый институт им. В. Г. Хлопина, 194021, Санкт-Петербург, 2-й Муринский пр., д. 28
*e-mail: fys54@mail.ru
Поступила в редакцию 30.04.2021, после доработки 23.06.2021, принята к публикации 30.06.2021
Исследована сорбция фторидов неодима и тория активированным углем АГ-3 из расплава фторидов
щелочных металлов LiF-NaF-KF. Изотерма сорбции фторида неодима при температуре 650°С имеет
выраженный выпуклый характер и хорошо описывается уравнением Ленгмюра. Сорбция фторида тория
в тех же условиях протекает существенно слабее, чем фторида неодима, что определяется размерами
фторидных комплексов неодима и тория. Измерена кинетическая зависимость сорбции фторида неодима
при температуре 650°С, которая хорошо описывается уравнением первого порядка для обратимой
реакции, а также температурная зависимость в диапазоне 550-750°С, имеющая максимальное значение
сорбции в диапазоне 600-650°С.
Ключевые слова: фториды, расплавы, щелочные металлы, неодим, торий, сорбция, активированный
уголь.
DOI: 10.31857/S0033831121060046
ВВЕДЕНИЕ
гией 17 МэВ, после чего требуется извлечение
протактиния-233 и последующее накопление ура-
на-233. За счет короткого времени облучения доля
Для стабильного развития атомной энергетики
побочных реакций, приводящих к образованию
перспективны направления на расширение топлив-
урана-232, резко снижается, что в принципе позво-
ной базы и сокращение объемов долгоживущих
ляет получать уран-233 с минимальным содержа-
радионуклидов от переработки ОЯТ, подлежащих
нием урана-232. При таком подходе требуется бы-
геологическому захоронению. Неводные техноло-
строе извлечение протактиния-233. Для подобной
гии, в основе которых лежат процессы, протека-
цели наилучшим бланкетом являются расплавы
ющие в расплавах солей (эвтектики), имеют пер-
фторидов некоторых металлов, например, эвтекти-
спективы для развития указанных направлений.
ка LiF-ThF4.
Расширение топливной базы в перспективе свя-
В последние годы во всем мире возрос интерес
зано с новым подходом к ториевому топливному
циклу с наработкой урана-233, одним из досто-
к использованию расплавов солей применительно
к ториевому топливному циклу. Примером служит
инств которого является незначительное образова-
ние долгоживущих трансплутониевых элементов,
солидный сборник [3], посвященный этой теме.
присутствие которых в отходах требует геологиче-
Другое направление использования расплавов
ского захоронения.
солей связано с разработкой жидкосолевых реак-
Новые концепции по наработке урана-233 свя-
торов для сжигания долгоживущих америция, кю-
заны с использованием гибридного термоядерного
рия и нептуния. Наиболее проработанные подходы
реактора синтез-деление [1, 2]. Суть данного под-
для этой цели основаны на использовании эвтек-
хода в том, что ториевый бланкет кратковременно
тик LiF-NaF-KF [4, 5] и LiF-BeF2 [6-8] с темпера-
облучается высокопоточными нейтронами с энер-
турами плавления около 450°С.
525
526
ФЕДОРОВ и др.
Переработка топливной соли жидкосолевого ре-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
актора - сложный процесс, состоящий из целого
ряда операций (например, подробно приведенных в
Для исследований процессов в расплавах фтори-
работе [7]): обработки фтором с отгонкой шестива-
дов металлов требуется использовать особо чистые
лентных актинидов, восстановительной экстракции
компоненты, поскольку небольшие примеси могут
ТПЭ в жидкий металл, анодного окисления метал-
значительно исказить результаты экспериментов.
лических актинидов и катодного восстановления
Так, для эвтектики фторидов щелочных металлов
важно отсутствие воды, так как в противном слу-
жидкого металла (например, тория или висмута),
чае из фторидов РЗЭ и актинидов, хорошо раство-
анодного окисления лантанидов, осаждения окси-
римых в эвтектике LiF-NaF-KF, образуются ма-
дов и других.
лорастворимые соответствующие оксифториды и
Сорбционные процессы применительно к рас-
HF. Используемые в работе NdF3 и ThF4 не должны
плавам фторидов различных металлов системати-
содержать значимых количеств оксифторидов и ги-
чески практически не изучались, имеется неболь-
дратной воды, поэтому особые требования были к
шое количество работ с использованием цеолитов.
методике получения используемых в работе фтори-
Для переработки расплавов солей с целью очистки
дов.
после извлечения делящихся нуклидов рассматри-
Фторид неодима получали смешением водных
вался процесс ионного обмена на цеолите NaA для
растворов нитрата неодима и фторида натрия (в
хлоридных систем [8, 9] и фторидной эвтектики
мольном соотношении 1 : 3) при перемешивании
LiF-CaF2 [10] в динамических условиях путем про-
без нагревания в течение 2 ч. После выпадения си-
пускания расплава солей через ионообменную ко-
реневого осадка, его промывали, отделяли и суши-
лонку с цеолитом. Данные работы показывают воз-
ли на фильтре Шотта и затем переносили в герме-
можность использования малоизученных методов
тичный бюкс. Непосредственно перед смешением
сорбции для очистки расплавов солей. На практике
с расплавом фторидов щелочных металлов фторид
применяется большое количество различных ти-
неодима сушили в вакууме при температуре 350°С
пов сорбентов, поэтому целесообразно исследовать
в течение 3 ч.
возможность сорбции применительно к фторидным
Для получения фторида тория Th(NO3)4 грели
эвтектикам широко используемых активированных
при 200°С в течение 1 ч, затем при 400°С еще 2 ч.
углей, обладающих в том числе и селективностью
Полученный ThO2 обрабатывали NH4HF2 при вось-
по отношению к катионам тяжелых металлов при
микратном избытке, нагревали до 500°С в течение
сорбции из жидких сред [11].
2 ч [12].
Эвтектика LiF-NaF-KF рассматривается как
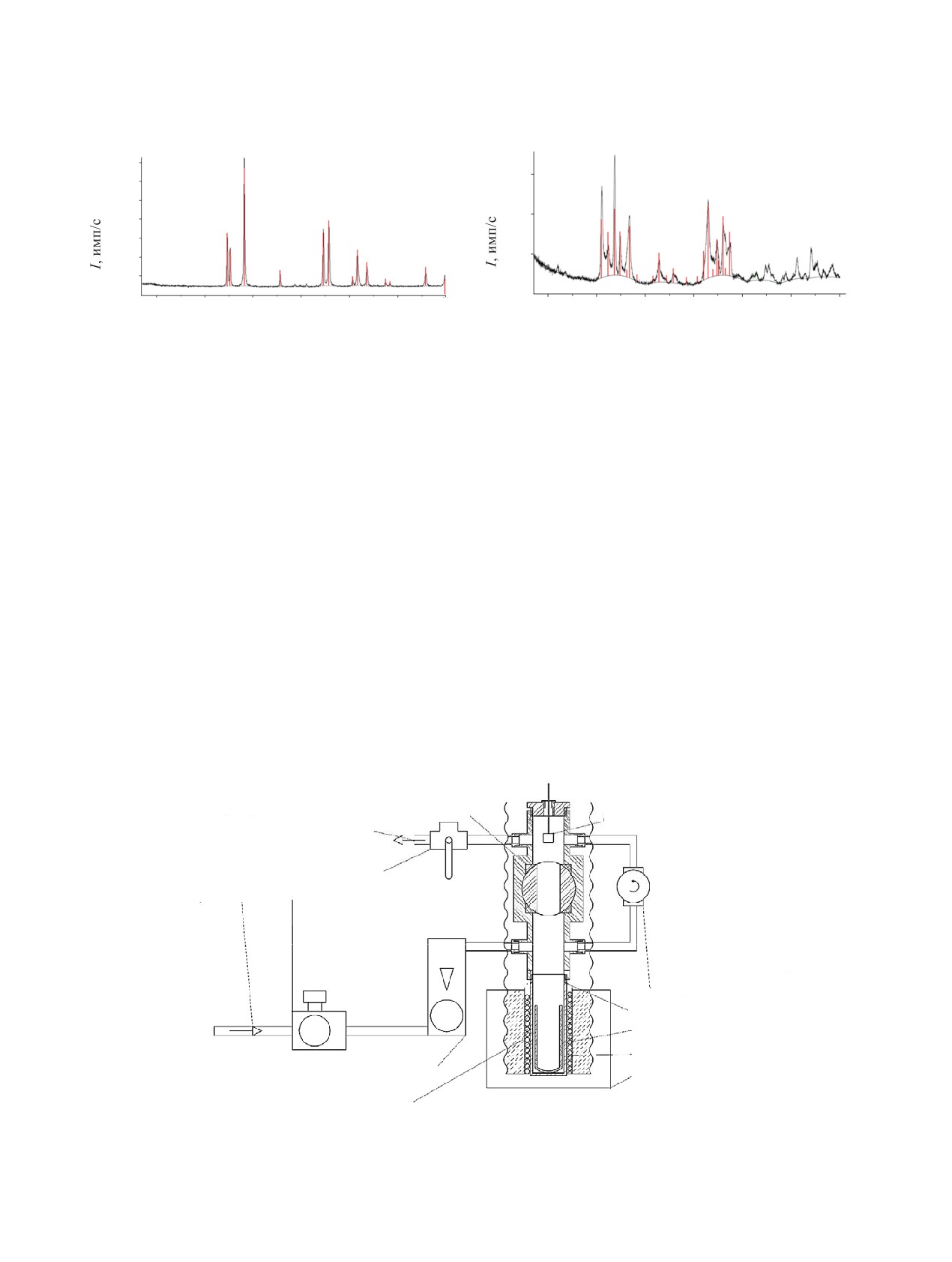
Рентгенофазовый анализ (РФА) выполнялся
одна из возможных составляющих топливной соли
на дифрактометре D2 Phaser фирмы Bruker (Гер-
для жидкосолевых реакторов [4, 5]; также она мо-
мания) с использованием CuKα-излучения. Напря-
жет быть удобной моделью для эвтектики LiF-ThF4
жение рентгеновской трубки составляло 30 кВ,
как жидкосолевого бланкета термоядерного ре-
сила тока - 1 мА, съемку проводили в диапазоне
актора синтез-деление [1, 2]. В последнем случае
углов 2θ = 7°-70° в режиме сканирования с шагом
эвтектика LiF-NaF-KF удобна тем, что можно ис-
0.02° со скоростью 0.5 град/мин. Обработку ре-
следовать сорбцию фторида тория и его влияние на
зультатов проводили с использованием програм-
другие элементы.
мы DIFFRAC.EVA.V5.0 и картотеки PDF-2 ICDD
(NdF3 - PDF 01-078-1859, ThF4 - 00-015-0413).
Целью данной работы является изучение сорбции
NdF3 и ThF4 из расплава эвтектики LiF-NaF-KF с
Результаты рентгенофазового анализа получен-
помощью активированного угля в статических ус-
ного фторида неодима представлены на рис. 1, а
ловиях. Подобные исследования проводятся впер-
фторида тория - на рис. 2. Они указывают на со-
вые и представляют как научный, так и практиче-
ответствие полученных фторидов данным картотек.
ский интерес применительно к задачам очистки
Используемый в работе АГ-3 имел следующие
расплавов солей.
параметры: объем микропор Vми = 0.35 см3/г,
РАДИОХИМИЯ том 63 № 6 2021
СОРБЦИЯ NdF
3
И ThF4 ИЗ РАСПЛАВА LiF-NaF-KF
527
1500
6000
1000
4000
2000
500
0
0
10
20
30
40
50
60
70
10
20
30
40
50
60
70
2θ, град
2θ, град
Рис. 1. Рентгенофазовый анализ синтезированных об-
Рис. 2. Рентгенофазовый анализ синтезированных об-
разцов NdF3. Штрих-линии относятся к библиотечным
разцов ThF4. Штрих-линии относятся к библиотечным
данным.
данным.
объем мезопор Vме = 0.15 см3/г, удельная поверх-
фторид тория и повторно сушили в течение 2 ч под
ность S = 750 м2/г, удельная поверхность мезо-
вакуумом. Опыты проводили в среде аргона при
пор Sме = 20 м2/г. Уголь АГ-3 перед опытом суши-
температурах 550-750°С при 200-кратном избытке
ли при температуре 200°С в течение 2 ч.
эвтектики, содержащей фториды неодима и тория,
по отношению к исследуемым образцам сорбента.
Схема установки для исследования сорбции
Непосредственно сорбцию проводили в тигле (кол-
фторидов неодима и тория активированным углем
бе) из пирографита, который помещали в реактор
АГ-3 в статических условиях из расплава эвтекти-
из стали (марки 3сп), хорошо проводящей тепло.
ки LiF-NaF-KF при температурах 550-750°С пред-
ставлена на рис. 3.
Высушенный активированный уголь помещали
в специальную корзину из металлической меди с
Фториды лития, калия и натрия (ч.д.а.) использо-
отверстиями и опускали в расплав солей. Корзину
вали в мольном соотношении LiF (46.5)-NaF (11.5)-
с активированными углями периодически подвер-
KF (42.0) и перед опытами сушили в течение 3 ч
гали вертикально-поступательному движению для
под вакуумом при температуре 400°С. Качество
перемешивания соли с углем. После извлечения
полученной соли проверяли по точке плавления на
дериватографе, она составила 456°С, что практи-
корзины проводили анализ на содержание Nd(III)
чески соответствует литературным данным [3]. К
или Th(IV) в угле и в солевой эвтектике. Присут-
высушенной соли добавлялся фторид неодима или
ствия заметных количеств эвтектики в порах угля
шаровый клапан
пробоотборник
откачка воздуха вакуумнасосом
кран трехходовой
подача аргона
регулятор давления
мембранный с манометром
дроссель игольчатый
сменный стальной корпус
графитовая колба
обмотка печи
расходомер-регулятор
печь
датчик температуры
Рис. 3. Схема установки для изучения сорбции из расплавов солей.
РАДИОХИМИЯ том 63 № 6 2021
528
ФЕДОРОВ и др.
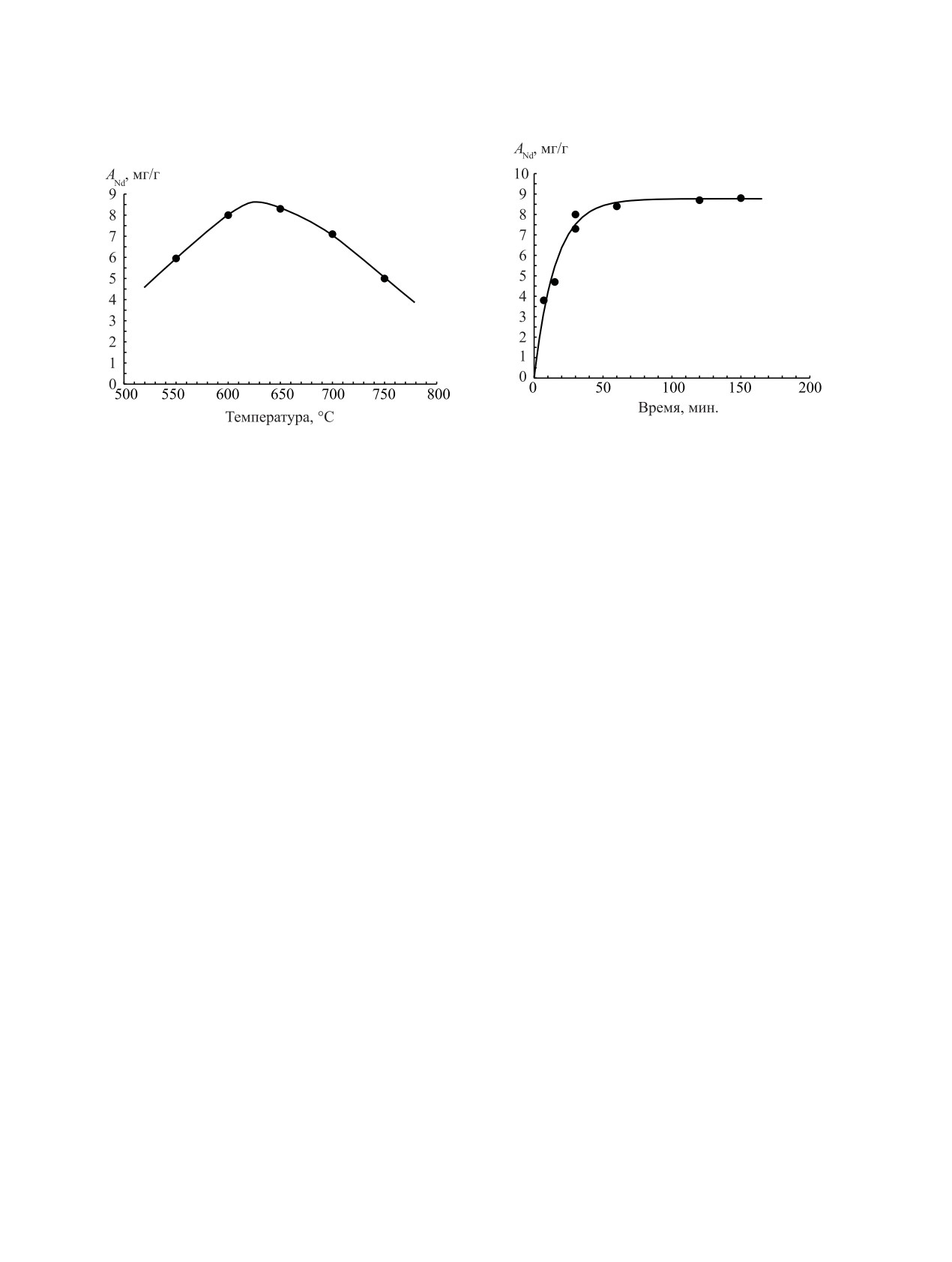
Рис. 5. Кинетика сорбции Nd(III), вводимого в виде NdF3,
Рис. 4. Температурная зависимость сорбционной емкости
углем АГ-3 из расплава фторидов при температуре 650°С.
активированного угля АГ-3 по Nd(III) (ANd, мг/г) из рас-
Точки - эксперимент, сплошная линия - аппроксимация
плава фторидов LiF-NaF-KF. Неодим вводили как NdF3.
экспериментальных точек с использованием кинетиче-
Равновесная концентрация Nd(III) в расплаве фторидов
ского уравнения (2). Равновесная концентрация Nd(III) в
солей составляла 10.5 ± 0.23 мг/г. Время сорбции 1.5 ч.
расплаве фторидов солей 10.5 ± 0.23 мг/г.
не выявлено, так как масса исходной навески АГ-3
ми, расположенными на внутренней поверхности.
до анализа и после его проведения практически не
В качестве сорбента для исследования сорбции
менялась в пределах точности определения (ме-
фторидов неодима и тория из расплава эвтектики
нее 1%); соответственно при расчете количества
LiF-NaF-KF использовали активированный уголь
сорбируемого элемента вклад эвтектики не учиты-
марки АГ-3, характеризующийся наличием микро-
вали. Величину сорбции определяли по отношению
пор и супермикропор [14], которые позволяют сор-
концентрации элемента в угле к массе активирован-
бировать соединения различного размера.
ного угля. Из-за значительного избытка фторидов
Вначале была установлена зависимость величи-
неодима или тория их концентрация в эвтектике
ны сорбции от температуры при постоянной кон-
практически не менялась.
центрации Nd(III) для определения оптимального
Пробы с углем и эвтектики обрабатывали серной
режима сорбции. На рис. 4 представлена темпе-
кислотой для удаления HF и после упаривания раз-
ратурная зависимость сорбционной емкости угля
бавляли водой и анализировали с использованием
АГ-3 в расплаве фторидов щелочных металлов по
арсеназо III в среде соляной кислоты на спектро-
Nd(III), который вводили в эвтектику в виде NdF3.
фотометре ПЭ-5300ВИ на длине волны 650 нм по
Из рис. 4 следует, что максимальная величина сор-
методике [13]. Полноту извлечения исследуемых
бционной емкости находится в диапазоне темпера-
элементов периодически контролировали путем до-
тур 600-650°С.
полнительной обработки исследуемой навески. Не
Затем исследовали кинетику сорбции Nd(III) при
было обнаружено влияния зольных оксидов (SiO2,
его постоянной концентрации в эвтектике, равной
Al2O3, CaO и других) исходного угля АГ-3 на из-
10.5 ± 0.23 мг/г, активированным углем при темпе-
мерения (фоновые значения) по используемой ме-
ратуре 650°С. Результаты приведены на рис. 5. Из
тодике.
рис. 5 следует, что за 30 мин достигается более 90%
РЕЗУЛЬТАТЫ
суммарной емкости при сорбции Nd(III) активиро-
ванным углем, хотя для выхода на полное насыще-
Активированные угли обладают сорбционными
ние требуется около 2 ч.
свойствами, основанными как на физических взаи-
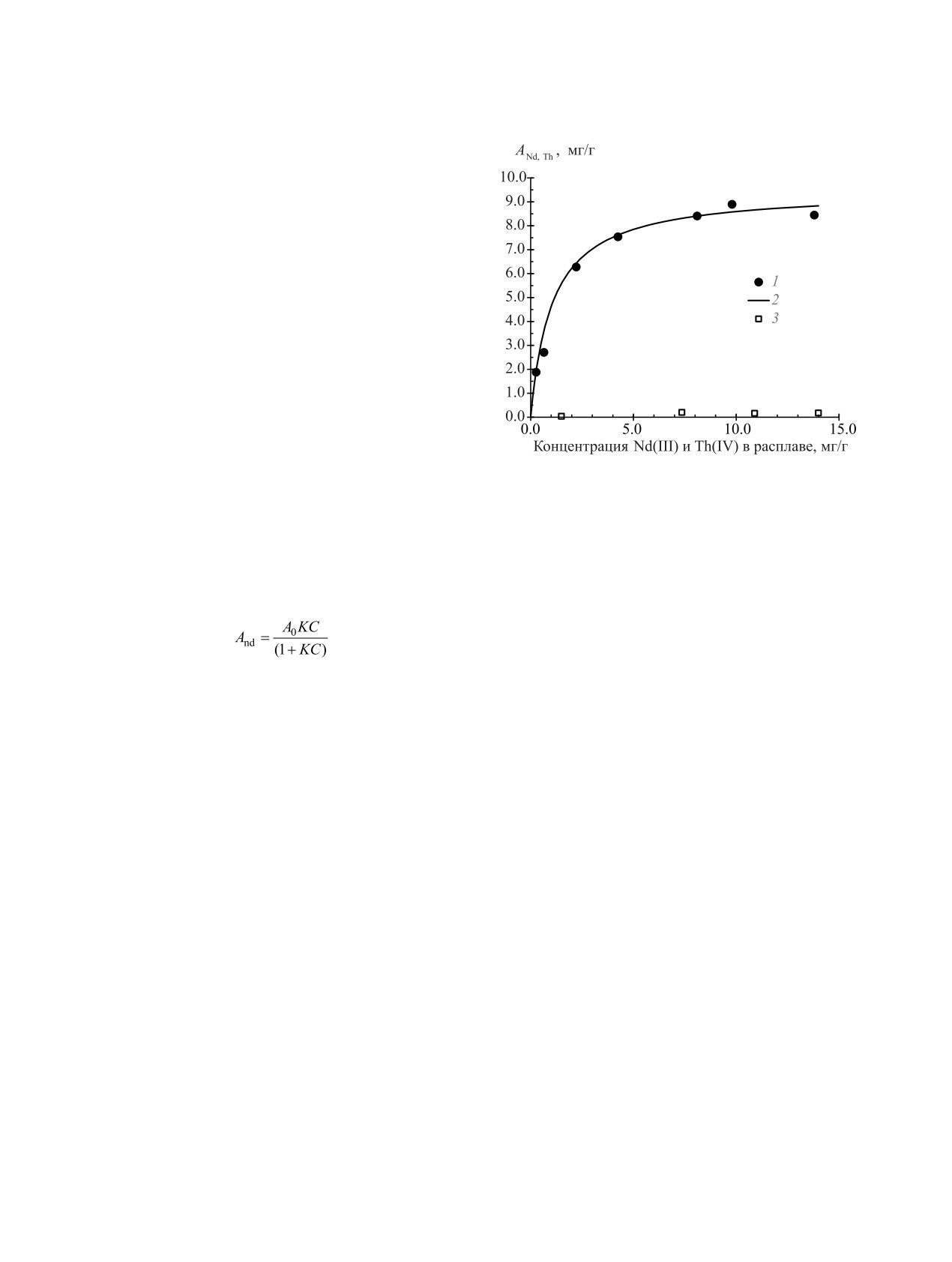
На рис.
6 представлены изотермы сорбции
модействиях в порах, так и на химических реакциях
Nd(III) и Th(IV), вводимых в виде фторидов, при
(хемосорбции) с кислыми или основными оксида-
температуре 650°С и времени сорбции 120 мин.
РАДИОХИМИЯ том 63 № 6 2021
СОРБЦИЯ NdF
3
И ThF4 ИЗ РАСПЛАВА LiF-NaF-KF
529
Изотерма сорбции Nd(III) носит ярко выраженный
выпуклый характер, указывающий на эффектив-
ность извлечения при концентрациях его в расплаве
менее 5 мг/г. Th(IV) сорбируется углем АГ-3 суще-
ственно меньше, его сорбционная емкость состав-
ляет около 0.15-0.20 мг/г при концентрации фтори-
да тория в эвтектике более 10 мг/г, что в 40-50 раз
ниже величины сорбции фторида неодима.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Активированные угли имеют сложное строение
поверхности, на которой формируются двойные
электрические слои, благодаря которым активиро-
ванные угли обладают в том числе ионообменными
свойствами; также активированные угли содержат
Рис. 6. Изотермы сорбции Nd(III) и Th(IV), вводимых
значительное количество кислородсодержащих
в виде NdF3 и ThF4, углем АГ-3 из расплава фторидов
групп: карбоксильных, лактоновых, фенольных, ке-
при температуре
650°С:
1
- Nd(III),
2 (сплошная
тонных и других [15, 16].
линия) - аппроксимация экспериментальных точек с
использованием кинетического уравнения (1), 3 - Th(IV).
Данные изотермы сорбции Nd(III), представлен-
ной на рис. 6, хорошо аппроксимируются по урав-
нению Ленгмюра:
На это же указывает характер температурной за-
висимости сорбционной емкости Nd(III) на рис. 4.
(1)
На первом участке (рис. 4) наблюдается рост вели-
,
чины сорбции Nd(III) с увеличением температуры
где С- текущая концентрация Nd(III) в эвтектике,
до 600°С и образованием сорбционного слоя на
A0 - предельное содержание в сорбенте, K - кон-
поверхности угля. При дальнейшем увеличении
станта. На рис. 6 представлен расчет (линия) по
температуры от 650 до 750°С величина адсорбции
уравнению (1) для A0 = 9.5 мг/г и K = 0.95.
Nd(III) снижается, по-видимому, из-за уменьше-
ния прочности связи сорбируемого компонента с
Примеры описания сорбции катионов тяжелых
поверхностью за счет увеличения кинетической
металлов на активном угле из водных растворов
энергии сорбируемого компонента и значительно-
широко представлены в научно-технической лите-
го увеличения растворимости фторида неодима в
ратуре, например в работах [17, 18]. Также извест-
эвтектике LiF-NaF-KF. Так, растворимость NdF3
но, что активированные угли обладают отрицатель-
составляет 13.3 мол% при 650°С, а при 750°С - уже
ным зарядом на поверхности и благодаря этому со-
36.2 мол% [19]. Снижение величины сорбции с ро-
рбируют многие катионы металлов за счет катион-
стом температуры более 650°С может быть связано
ного обмена, замещая положительный катион, на-
с другими причинами, например, с фторированием
пример, протон [15]. Сходная картина наблюдается
оксифторидов, образуемых при взаимодействии с
при сорбции цеолитом из расплава LiF-CaF2, при
кислородом в составе угля.
этом эффективность процесса возрастает с ростом
заряда катиона в ряду щелочные элементы, ще-
Кинетическая зависимость адсорбции Nd(III)
лочноземельные и редкоземельные элементы [10].
активированным углем АГ-3, представленная на
При этом, как отмечается, может быть реализован
рис. 5, может быть интерпретирована следующим
механизм электростатической адсорбции существу-
образом. Исходя из того, что процесс сорбции но-
ющих в конденсированных фазах комплексов как
сит равновесный характер, реакция обратима. Для
разновидность хемосорбции, характеризующейся
обратимой реакции первого порядка справедливо
не очень высокими значениями энергии адсорбции.
уравнение [18]:
РАДИОХИМИЯ том 63 № 6 2021
530
ФЕДОРОВ и др.
зультатов уже можно сделать некоторые предполо-
(2)
жения о возможных процессах, протекающих при
сорбции Nd(III) и Th(IV) в исследуемой эвтектике.
где K+ и K- - константы прямой и обратной реак-
Активированный уголь (АУ) включает значи-
ции соответственно, t - время, С и C0 - текущая и
тельное количество кислородсодержащих групп
начальная концентрации элемента в растворе со-
[15, 16], которые в принципе могут участвовать
ответственно. Поскольку соотношение расплава,
в образовании соединений типа АУ-O-NdF2 либо
содержащего Nd(III), и активного угля велико и
образовывать несвязанные с углем оксифториды
концентрация Nd(III) в эвтектике в ходе сорбции,
NdOF. Подобные реакции образования различ-
проводимой в статическом режиме, практически не
ных малорастворимых оксифторидов или окси-
меняется, то уравнение (2) можно применить для
дов с NdF3 могут проходить в расплаве эвтектики
описания изменения концентрации неодима в сор-
LiF-NaF-KF, в которой удается отделить Nd(III) из
бенте. Тогда можно предположить, что количество
расплава при добавлении оксида натрия [20] или ок-
активных центров в сорбенте (по-видимому, ато-
сида лития [21, 22]. Природа образуемых при этом
мов кислорода) уменьшается по мере взаимодей-
соединений - оксидов или оксифторидов - остается
ствия и последующего образования оксифторидов
дискуссионной, поскольку образование оксидов в
или оксидов Nd(III), однако при этом происходит
таких условиях некоторыми авторами подвергается
и обратный процесс образования фторидов неоди-
сомнению [22].
ма из оксифторидов (или оксидов) за счет наличия
Наиболее вероятно, что сорбция происходит за
большого избытка фторид-ионов в эвтектике. При
достижении равновесного значения Nd(III) в сор-
счет взаимодействия Nd(III) c активными группа-
ми, содержащими кислород, на поверхности ак-
бенте около 9 мг/г и времени сорбции 50 мин и бо-
лее скорости обеих реакций уравновешивают друг
тивных углей [17], что приводит к образованию
слаборастворимого в эвтектике оксифторида не-
друга. В этом случае C0 будет соответствовать
предельному содержанию неодима в сорбенте или
одима (NdOF) и дальнейшему поглощению его
супермикропорами угля АГ-3 как наиболее круп-
аналогичной величине A0 в уравнении Ленгмюра
ными микропорами. Кристаллы оксифторида нео-
(1), а C - текущей концентрации Nd(III) в сорбен-
дима в зависимости от условий имеют следующие
те; тогда сорбционная емкость (т.е. концентрация
параметры решетки: кубической a = 5.64 Å, тетра-
в АГ-3) Nd(III) в каждый момент времени будет
гональной a = 5.67 Å, с = 5.68 Å или ромбоэдри-
ANd = C0 - C. На рис. 5 представлен расчет (в виде
ческой a = 6.96 Å, α = 33.04° [23]. Максимальные
линии) по уравнению (2) c учетом приведенных
размеры по диагонали (критический диаметр мо-
уточнений для C0 = 9.5 мг/г, K+ = 0.060 и K- =
лекулы) для кубической и тетрагональной решет-
0.0050.
ки составляют около 10 Å, что сопоставимо с раз-
Аппроксимация экспериментальных результа-
мерами микропор, максимальный размер которых
тов сорбции Nd(III) по уравнению Ленгмюра (1)
(супермикропор) составляет по классификации
не может указывать на механизм процесса, одна-
М.М. Дубинина, принятой в нашей стране, 15-
ко при исследовании сорбции это уравнение ока-
16 Å, а по классификации IUPAC - <20 Å.
зывается полезным в качестве первичной оценки.
Обратимость реакции образования оксифто-
Ввиду сложности процессов, протекающих непо-
ридов или оксидов неодима может быть связана с
средственно в расплавах фторидов металлов, и по-
реакцией образования фторида неодима из оксиф-
тенциального влияния активных углей, имеющих
торида при большом избытке фторид-иона, находя-
различные функциональные группы, в данной ра-
щегося в расплаве эвтектики.
боте, в которой впервые представлены подобные
исследования, трудно определить механизм или
Слабая величина поглощения углем АГ-3 Th(IV)
механизмы протекающих сорбционных процессов.
может быть связана с размерами его комплексов.
Исследования по определению механизма сорбции
Фторид неодима в расплаве LiF-NaF-KF образу-
из расплавов солей являются интересной задачей на
ет анионные комплексы NdF3- [24]. Наличие ана-
перспективу. Однако на основании полученных ре-
логичных комплексов LaF63- и CeF63- в расплавах
РАДИОХИМИЯ том 63 № 6 2021
СОРБЦИЯ NdF
3
И ThF4 ИЗ РАСПЛАВА LiF-NaF-KF
531
фторидов щелочных металлов подтверждается из-
ция Nd(III) происходит на активной поверхности
менением химических сдвигов [25] и уменьшени-
микропор активированного угля АГ-3. Более низкая
ем самодиффузии фторид-иона в присутствии лан-
величина сорбции Th(IV), по видимому, связана с
танидов [26]. Фторид тория в расплавах фторидов
большим размером анионных комплексов тория по
щелочных металлов при большем ионном радиусе
сравнению с комплексами неодима, что не позво-
Th4+ (1.05 Å) по сравнению с Nd3+ (0.97 Å) [27, 28]
ляет им проникать в микропоры, и сорбция тория
образует более сложные фторидные комплексы с
происходит на поверхности мезопор.
преобладанием [ThF8]4- [31] по сравнению с ком-
плексами неодима [NdF6]3- [24]. При этом расстоя-
ФОНДОВАЯ ПОДДЕРЖКА
ние между атомами Th и F составляет 2.2 Å [29]. Та-
кой анионный комплекс, имеющий большой отри-
Исследование выполнено при финансовой под-
цательный заряд, должен быть окружен «облаком»
держке Российского фонда фундаментальных ис-
положительно заряженных катионов щелочных
следований в рамках научного проекта РФФИ
металлов эвтектики. По-видимому, из-за больших
№ 19-29-02010\19.
размеров комплексы Th(IV) не могут проникнуть в
микропоры, в которых, как правило, и происходит
КОНФЛИКТ ИНТЕРЕСОВ
основной процесс сорбции.
Фторидные комплексы тория из-за размеров не
Авторы заявляют об отсутствии конфликта ин-
могут проникнуть в микропоры и сорбируются в
тересов.
мезопорах за счет взаимодействия с их активными
группами, количество которых в них существенно
СПИСОК ЛИТЕРАТУРЫ
меньше, чем в микропорах, за счет меньшей по-
верхности мезопор (для АГ-3 - примерно в 40 раз),
1.
Велихов Е.П., Ковальчук М.В., Ильгисонис В.И., Иг-
на которой находятся активные группы. Этим мож-
натьев В.В., Цибульский В.Ф., Андрианова Е.А. //
Энергетическая политика. 2017. № 3. С. 12.
но объяснить значительную разницу (рис. 6) в вели-
чинах сорбционной емкости для фторидов неодима
2.
Velikhov E.P., Kovalchuk M.V., Azitov E.A., Ignatiev V.V.,
Subbotin S.A., Tsibulskiy V.F. // At. Energy.
2013.
и тория.
Vol. 114, N 3. P. 193.
https://doi.org/10.1007/s10512-013-9695-x
ЗАКЛЮЧЕНИЕ
3.
Molten Salt Reactors and Thorium Energy / Ed. T. J.
Dolan. Elsevier, 2017. 815 p.
Разработана и изготовлена установка для про-
4.
Ponomarev L.I., Belonogov M.N., Volkov I.A.,
Simonenko V.A., Sheremet’eva U.F. // At. Energy. 2019.
ведения сорбции элементов из расплавов солей
Vol. 126, N 3. P. 139.
в статических условиях при разных температу-
https://doi.org/10.1007/s10512-019-00528-y
рах. Исследована сорбция Nd(III) и Th(IV), вводи-
5.
Ponomarev L.I., Belonogov M.N., Volkov I.A,
мых в виде NdF3 и ThF4, активированным углем
Simonenko V.A, Sheremet’eva U.F. // At. Energy. 2019.
АГ-3 из расплава фторидов щелочных металлов
Vol. 126, N 3. P. 150.
LiF-NaF-KF. Кинетическая зависимость сорбцион-
https://doi.org/10.1007/s10512-019-00529-x
ной емкости Nd(III) при температуре 650°С хорошо
6.
Ignatiev V.V., Feynberg O.S, Zagnitko A.V,
описывается уравнением первого порядка для об-
Merzlyakov A.V., Surenkov A.I., Panov A.V.,
ратимой реакции, равновесие достигается пример-
Subbotin V.G., Afonichkin V.K., Khokhlov V.A.,
но за 1.5 ч. Наибольшая сорбционная емкость по
Kormilitsyn M.V. // At. Energy. 2012. Vol. 112, N 3.
Nd(III) составляет примерно 8.5 мг/г сорбента в ди-
P. 157.
апазоне температур 600-650°С. Изотерма сорбции
https://doi.org/10.1007/s10512-012-9537-2
Nd(III) имеет выпуклый характер и хорошо описы-
7.
Delpech S., Merle E., Heuer D., Allibert M., Ghetta V.,
вается уравнением Ленгмюра. Извлечение фтори-
Le-Brun C., Doliger X., Picard G. // J. Flourine Chem.
да тория в тех же условиях существенно меньше -
2009. Vol. 130, N 1. P. 11.
около 0.2 мг/г. Сделано предположение, что сорб-
https://doi.org/10.1016/j.jfluchem.2008.07.009
РАДИОХИМИЯ том 63 № 6 2021
532
ФЕДОРОВ и др.
8.
Pereira C., Babcock B.D. // Second Int. Symp. Extraction
19. Lizin A.A., Tomilin S.V., Gnevashov O.E., Gazizov R.K.,
and Processing for the Treatment and Minimization of
Osipenko A.G., Kormilitsyn M.V., Baranov A.A.,
Wastes. Scottsdale, Arizona, Oct. 27-30, 1996. P. 16.
Zaharova L.V., Naumov V.S., Ponomarev L.I. // At.
Energy. 2013. Vol. 115, N 1. P. 11.
Public/28/019/28019520.pdf
https://doi.org/10.1007/s10512-013-9740-9
9.
Кузин М.А., Макаров А.О. // Экология и промышлен-
20. Ponomarev L.I., Fedorov Y.S., Miroslavov A.E.,
ность России. 2014. № 12. С. 8.
Degtyarev A.M. // At. Energy. 2016. Vol. 121, N 1. P. 63.
https://doi.org/10.1007/s10512-016-0162-3
10. Cassayre1 L., Malmbeck R., Harrison M., De
Angelis G., Caravaca C., Bourg S.
// Int. Conf.
21. Мирославов А.Е., Степанова Е.С., Федоров Ю.С.,
Pyroprocessing Research. Fontana, WI, Sept.
26-
Легин Е.К., Хохлов М.Л., Кольцов В.В., Тюпина М.Ю.
29,
Патент RU 2637256C1. 2016 // Б.И. 2017 № 34.
conference/presentations/Tuesday_PM/Cassayre_
22. Rollet A.-L., Veron E., Bessada C. // J. Nucl. Mater.
Pyrochemical%20Separation.pdf
2012. Vol. 429. P. 40.
11. Самонин В.В., Никонова В.Ю., Подвязников М.Л. //
ЖФХ. 2008. Т.82. № 8. С. 1542.
23. Fergus J.W. // Mater. Res. Bull. 1996. Vol. 31, N 11.
12. Руководство по неорганическому синтезу / Под ред.
P. 1317.
Г. Брауэра. М.: Мир, 1985. С. 1225.
https://doi.org/10.1016/0025-5408(96)00138-9
13. Савин С.Б. Органические реагенты группы арсеназо
24. Хохряков А.А., Вершинин А.О., Пайвин А.С., Ли-
III. М.: Атомиздат, 1971. 348 с.
зин А.А. // Расплавы. 2015. № 4. С. 3.
14. Активные угли, эластичные сорбенты, катализаторы,
25. Rollet A.-L., Bessada C., Rakhmatoulline A., Auger Y.,
осушители и химические поглотители на их основе.
Melin P., Gailhanou M., Thiaudière D. // C. R. Chim.
Номенклатурный каталог / Под ред. В.М. Мухина.
2004. Vol. 7. P. 1135.
М.: Руда и металлы, 2003. 278 с.
https://doi.org/10.1016/j.crci.2004.02.021
15. Тарковская И.А. Окисленный уголь. Киев: Наук.
26. Rollet A.-L., Sarou-Kanian V., Bessada C. // Inorg.
думка, 1981. 200 с.
Chem. 2009. Vol. 48. P. 10972.
https://doi.org/10.1021/ic9010086
16. Fuente E., Menéndez J.A., Suarez D., Montes-
Moran M.A. // Langmuir. 2003. Vol. 19. P. 3505.
27. Marsac R., Réal F., Banik N., Pédrot M, Pourret O,
Vallet V. // Dalton Trans. 2017. Vol. 46. P. 13553-13561.
17. Серпионова Е.Н. Промышленная адсорбция газов и
28. Matsumiya M., Matsumoto S., Matsura H.
//
паров. М.: Высш. шк., 1969. 416 с.
Electrochemistry. 2005. Vol. 73, N 8. P. 570-572.
18. Дьяченко А.Н., Шагалов В.В. Химическая кинетика
29. Dai J., Long D., Huai P., Li Q. // J. Mol. Liq. 2015.
гетерогенных процессов. Изд-во Томского политехн.
Vol. 211. P. 747-753.
ун-та, 2014. 96 с.
РАДИОХИМИЯ том 63 № 6 2021