РАДИОХИМИЯ, 2021, том 63, № 5, с. 440-446
УДК 546.799+546,65+621.039.72
ГАЗОФАЗНАЯ КОНВЕРСИЯ
УРАНСОДЕРЖАЩИХ СОЕДИНЕНИЙ Cs И Sr
В НИТРИРУЮЩЕЙ АТМОСФЕРЕ
© 2021 г. С. А. Кулюхин а, *, Ю. М. Неволин а, б, А.А. Бессонов а
а Институт физической химии и электрохимии им. А.Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4,
б Химический факультет Московского государственного университета им. М.В. Ломоносова,
119991, Москва, Ленинские горы, дом 1, стр. 3
*e-mail: kulyukhin@mail.ru
Поступила в редакцию 13.04.2020, после доработки 13.04.2020, принята к публикации 15.09.2020
Изучена газофазная конверсия оксидных систем, содержащих U, Cs, Sr. Показана высокая термиче-
ская стабильность систем вида Cs2U2O7 и (Sr-Cs-U)Oy при нагреве до 1523 К на воздухе. Установлена
возможность эффективной конверсии указанных систем в водорастворимые нитраты металлов при их
нагревании в атмосфере, образующейся в результате испарения 12 моль∙л-1 HNO3.
Ключевые слова: нитрирование, волоксидация, газофазная конверсия, переработка ОЯТ
DOI: 10.31857/S0033831121050038
В настоящее время во многих странах мира в
Так, в работе [9] исследовано объемное окисление
качестве одной из головных операций процесса
«белых включений» на примере интерметаллидов
переработки ОЯТ рассматривается окислительное
U с Pd, Ru и Rh. Установлено, что их нагрев до тем-
охрупчивание (волоксидация
- объемное окис-
пературы 1473 К позволяет провести их объемное
ление) как топлива, так и цирколоевых оболочек
окисление с образованием фазы U3O8.
твэлов [1]. Основные результаты, полученные по
В качестве перспективного продолжения голов-
волоксидации оксидного топлива в различных стра-
ных операций переработки ОЯТ предлагается не
нах мира, представлены в отчете Европейского
растворение волоксидированного ОЯТ в HNO3, а
ядерного агентства за 2018 г [2].
его обработка оксидами азота, в результате которой
Процесс газовой конверсии оксидного топлива
будут образовываться малообводненные водорас-
осуществляют в различных атмосферах [O2, воз-
творимые соединения урана и некоторых продуктов
дух, О3, пары Н2О, смесь (90% воздуха + 10% СО2)]
деления (ПД).
при температуре 570-870 К, в процессе которой
В работах [10-14] исследована газофазная кон-
UO2, UN и UC переходят в U3O8 [3-7]. Основной
версия различных соединений, содержащих U
задачей данной операции является удаление лету-
и ПД [Sr, Mo, Zr, лантаниды (Ln)], в атмосфере
чих продуктов деления (3H, C, РБГ). Показано, что
NOx-H2O(пар)-воздух и HNO3(пар)-воздух. Уста-
в процессе волоксидации оксидного и нитридного
новлено, что в процессе газофазной конверсии
ОЯТ 3Н удаляется более чем на 99.9%. Помимо низ-
U3O8, UN, UC, (U,Nd)Ox, SrUO4, SrO и Ln2O3 полно-
котемпературных процессов (570-870 К) в настоя-
стью переходят в водорастворимые соединения, в то
щее время разрабатываются также высокотемпера-
время как MoO3 и ZrO2 не претерпевает каких-либо
турные процессы волоксидации, проводимые при
изменений. Молибдаты уранила и SrMoO4 лишь
температуре 1270-2070 К [8] и позволяющие уда-
частично переходят в водорастворимые соедине-
лить слаболетучие I, Cs, Mo, Tc, Ru из объема ОЯТ.
ния, т.е. не происходит полного отделения U или Sr
440
ГАЗОФАЗНАЯ КОНВЕРСИЯ УРАНСОДЕРЖАЩИХ СОЕДИНЕНИЙ
441
от Mo. Конверсия смешанных оксидов (U,Ce)Ox в
системах NOx-H2O(пар)-воздух и HNO3(пар)-воз-
100
дух позволяет полностью перевести U в водорас-
творимые соединения, при этом часть Ce остается
90
в фазе осадка CeO2.
Несмотря на многочисленные работы по газо-
80
фазной конверсии ОЯТ в нитрирующей атмосфере,
к настоящему времени не решен вопрос о поведении
70
ураната Cs, а также смешанного ураната Cs и Sr в
ходе конверсии в нитрирующей атмосфере. В связи
60
400
600
800
1000
1200
с этим целью настоящей работы стала проверка воз-
Т, К
можности газофазной конверсии уранатов Cs и Sr в
водорастворимые соединения в атмосфере, образу-
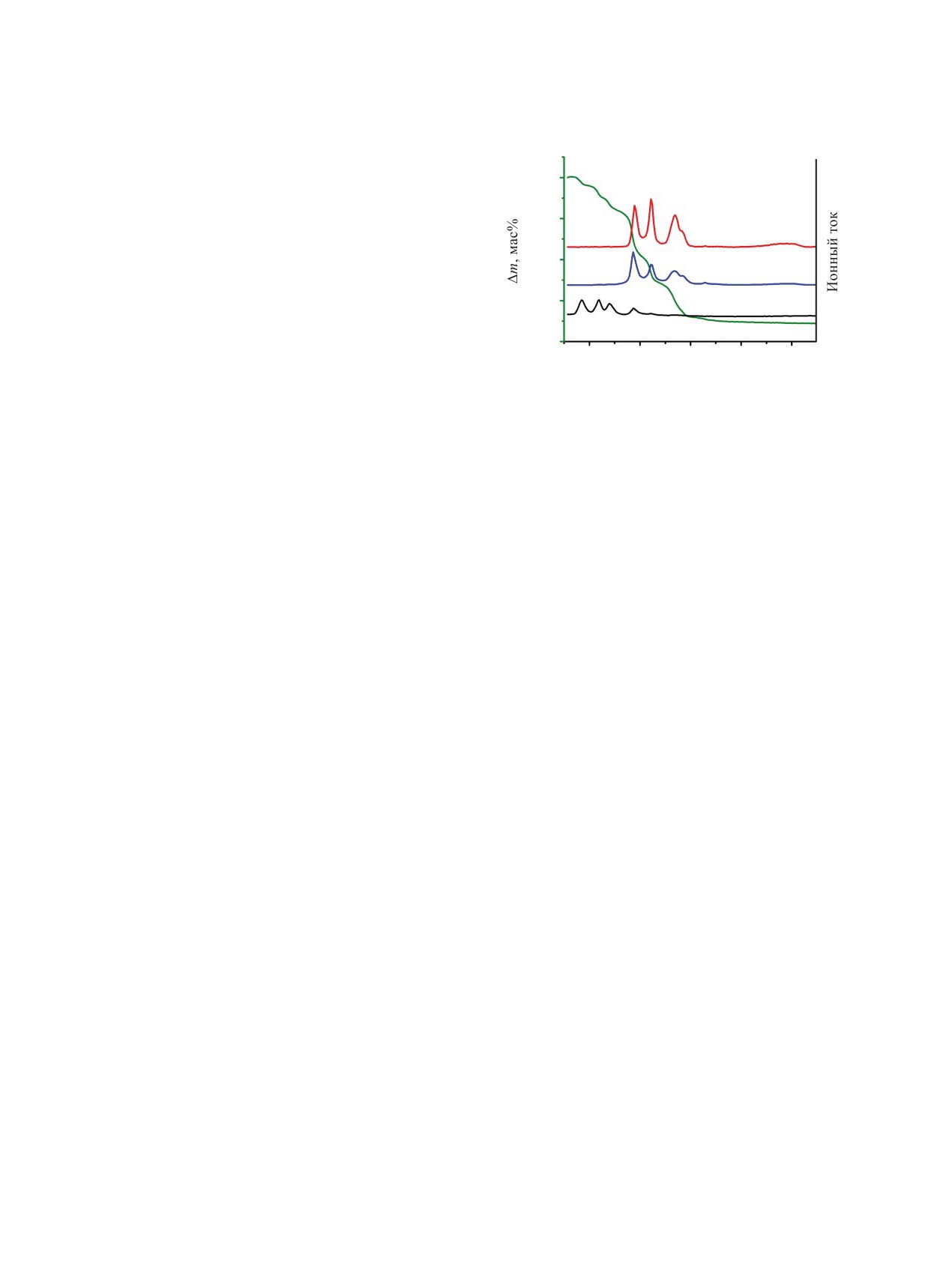
Рис. 1. Данные термогравиметрического анализа смеси
ющейся в результате испарения 12 моль∙л-1 HNO3
CsNO3-Sr(NO3)2-UO2(NO3)2∙6H2O (1 : 1 : 8 по массе) с
одновременной регистрацией масс-спектров газообраз-
(далее - нитрирующая атмосфера).
ных продуктов разложения.
Далее в системе не наблюдается значительного из-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
менения массы и выделения продуктов разложения.
На основании полученных данных для прокали-
В работе использовали CsNO3, Cs2CO3, Sr(NO3)2
вания смесей нитратов при синтезе (SrCs1.1U3.4)Oy
и UO2(NO3)2 ∙6H2O марки х.ч.
была выбрана температура 1073 К. Воздушно-су-
Диуранат цезия Cs2U2O7 синтезировали из γ-UO3
хую смесь нитратов прокаливали на воздухе в те-
и Cs2СO3 в соответствии с методикой, представлен-
чение 4 ч.
ной в работе [15]. Триоксид урана модификации
Первичную идентификацию фазового состава
γ-UO3 получали согласно работе [16].
синтезированных соединений проводили методом
Смешанную оксидную систему брутто-состава
рентгенофазового анализа (РФА) на рентгенов-
(SrCs1.1U3.4)Oy синтезировали путем прокаливания
ских дифрактометрах ADP-10 (Philips) и Empyrean
смеси соответствующих нитратов CsNO3, Sr(NO3)2
(Panalytical) с излучением CuKα и MoKα. При этом
и UO2(NO3)2∙6H2O, взятых в массовом отношении
значения
2θ на представленных дифрактограм-
1 : 1 : 8. Смесь нитратов растворяли в минималь-
мах приведены к длине волны излучения CuKα.
ном количестве воды, после чего раствор упаривали
Часть дифракционных данных была получена
до воздушно-сухого состояния. Полученную смесь
в условиях in situ нагрева в камере печи HTK-1200
перетирали в ступке. Для выбора температуры про-
(Anton Paar).
каливания смеси предварительно было исследова-
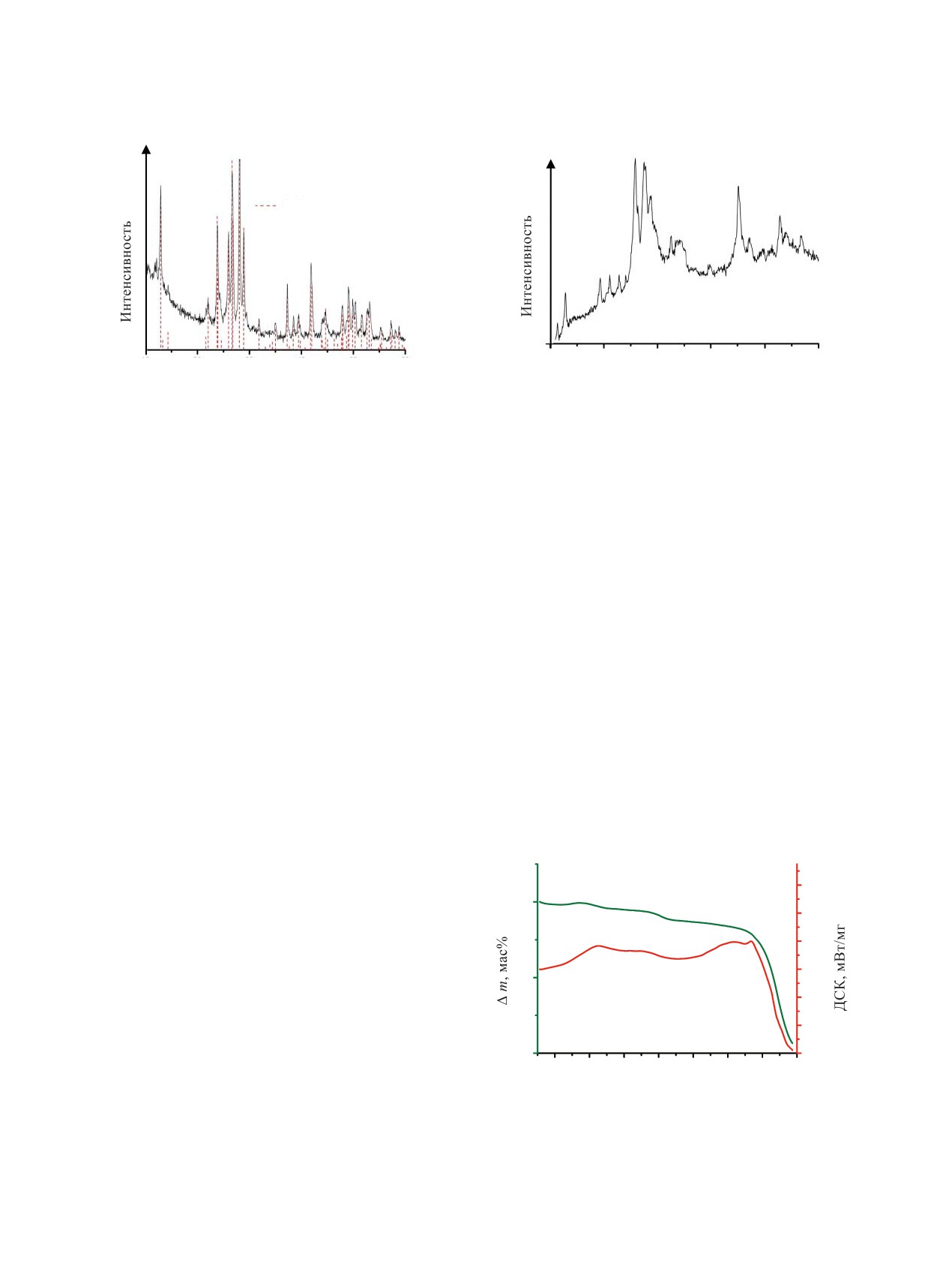
На рис. 2 приведена порошковая дифракто-
но термическое поведение композиции нитратов
грамма синтезированного диураната цезия. Видно,
CsNO3-Sr(NO3)2-UO2(NO3)2∙6H2O в массовом от-
ношении 1 : 1 : 8 (рис. 1). Термический анализ в
что положения основных отражений на ней соот-
работе осуществляли с использованием деривато-
ветствуют заявленной фазе Cs2U2O7. В случае же
графа STA 409 PC/PG (Netzch) с масс-спектроме-
(SrCs1.1U3.4)Oy анализ полученных дифракционных
тром QMS 403 Aëolos Quadro (Netzch) со скоростью
данных (рис. 3) становится заметно более сложной
нагрева 10 К/мин в платиновых тиглях на воздухе.
задачей. При выбранном составе шихты нитра-
Как видно из рис. 1, в смеси нитратов все про-
тов конечное соотношение U : Cs : Sr в оксидной
цессы разложения завершаются до температуры
системе близко к 3 : 1 : 1, что делает возможным
1000 К. По данным масс-спектрометрии газовой
получение различных уранатов цезия и стронция.
фазы, до температуры 523 К из системы удаляется
С учетом разнообразия соединений данного типа
только H2O. В диапазоне температур 523-873 К про-
[18, 19], надежная идентификация фазового состава
исходит одновременное удаление H2O, NO и NO2.
(SrCs1.1U3.4)Oy не представляется возможной.
РАДИОХИМИЯ том 63 № 5 2021
442
КУЛЮХИН и др.
Cs2U2O7
10
20
30
40
50
60
10
20
30
40
50
60
2θ, град
2θ, град
Рис. 2. Порошковая дифрактограмма синтезированного
Рис. 3. Порошковая дифрактограмма синтезированной
Cs2U2O7. Штрих-дифрактограмма сравнения представле-
оксидной системы (SrCs1.1U3.4)Oy.
на для β-Cs2U2O7 [17].
Эксперименты по газофазной конверсии урана-
рах в атмосфере воздуха или вакууме (высокотем-
тов Cs и Sr проводили в нитрирующей атмосфере в
пературная волоксидация). При этом в результате
реакторе, представлявшем собой сосуд с возможно-
отгонки соединений цезия в головной стадии про-
стью работы до давления 10 атм. В объем реактора
цесса переработки возможно образование фазы
помещали образец и 12 моль ∙ л-1 HNO3, при этом
U3O8. В связи с этим предварительно была изучена
образец не контактировал с HNO3, закручивали
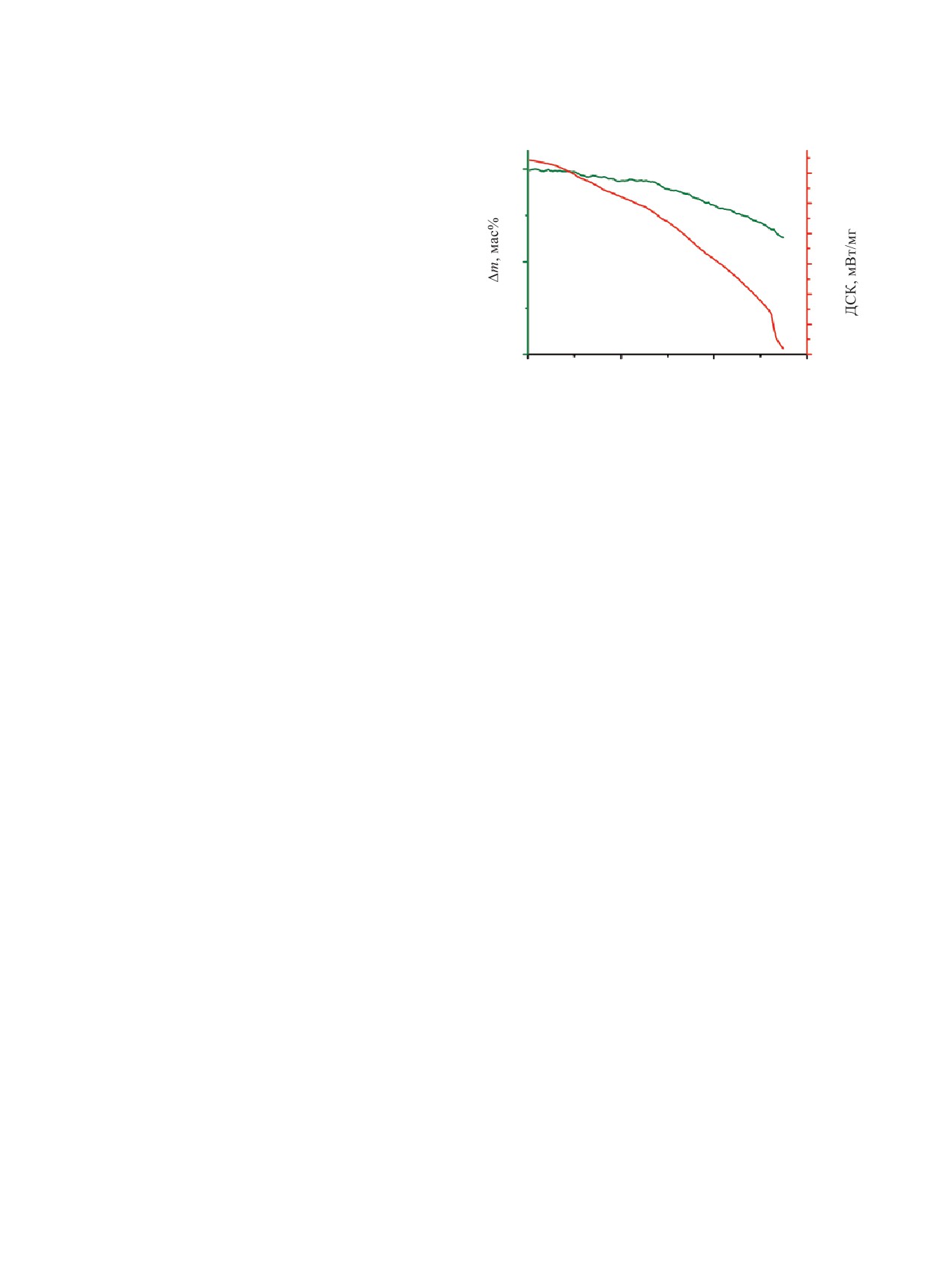
термическая устойчивость Cs2U2O7 на воздухе при
герметичную тефлоновую пробку реактора. Нагрев
нагреве до температуры 1773 К (рис. 4).
сосуда осуществляли с помощью жидкостного тер-
Как видно из рис. 4, практически до 1523 К не
мостата. Конверсию осуществляли при 343-423 К
наблюдается значимого уменьшения массы образ-
и времени экспозиции 1 ч. Расчетное давление в за-
ца. Потеря 5% массы образца в области температур
висимости от температуры составляло 1.5-2.5 атм.
473-1073 К сопровождается небольшим выделени-
После проведения конверсии реактор охлаждали и
ем тепла. Активный процесс разложения Cs2U2O7
извлекали конечный продукт конверсии. Продукты
начинается с температуры 1523 К и сопровождает-
конверсии растворяли в дистиллированной воде,
при этом в случае не полного растворения осадок
ся сильным поглощением тепла. Из данных термо-
отделяли центрифугированием, измеряли pH маточ-
гравиметрического анализа можно сделать вывод о
ных растворов. Содержание Cs, Sr и U в маточных
том, что для получения фазы U3O8, не содержащей
растворах определяли методом МС-ИСП с исполь-
цезия, необходим нагрев Cs2U2O7 на воздухе до
зованием спектрометра Agilent 7500 c (Agilent).
Степень конверсии Cs2U2O7 и (SrCs1.1U3.4)Oy рас-
6
считывали как отношение содержания исследуемо-
100
го металла в растворе к его исходному количеству в
4
образце. Содержание Cs, Sr, U в (SrCs1.1U3.4)Oy рас-
2
считывали исходя из брутто-состава SrCs1.1U3.4O21,
полученного по результатам ТГА измерений смеси
0
90
исходных нитратов
-2
-4
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
80
-6
400
800
1200
1600
Т, К
Конверсия Cs2U2O7 . Одним из возможных пу-
тей газофазной конверсии Cs2U2O7 является его
Рис. 4. Данные термогравиметрического анализа Cs2U2O7
термическое разложение при высоких температу-
в воздушной атмосфере.
РАДИОХИМИЯ том 63 № 5 2021
ГАЗОФАЗНАЯ КОНВЕРСИЯ УРАНСОДЕРЖАЩИХ СОЕДИНЕНИЙ
443
температуры выше 1523 К. Данные ТГА измерений
также подтверждаются РФА продуктов разложения
100
6
Cs2U2O7 на воздухе с in situ нагревом образца. На-
4
грев диаураната цезия до 1473 K на воздухе не при-
2
водит к изменению фазового состава. Полученные
результаты в целом согласуются с данными авторов
95
0
работ [19, 20] о высокой термической стабильно-
-2
сти Cs2U2O7. Таким образом, использование высо-
-4
котемпературной волоксидации ОЯТ в технически
приемлемом интервале температур 1073-1473 К,
90
-6
скорее всего, не приведет к разложению диураната
1200
1400
1600
1800
Т, К
цезия. Это, в свою очередь, является мотивацией к
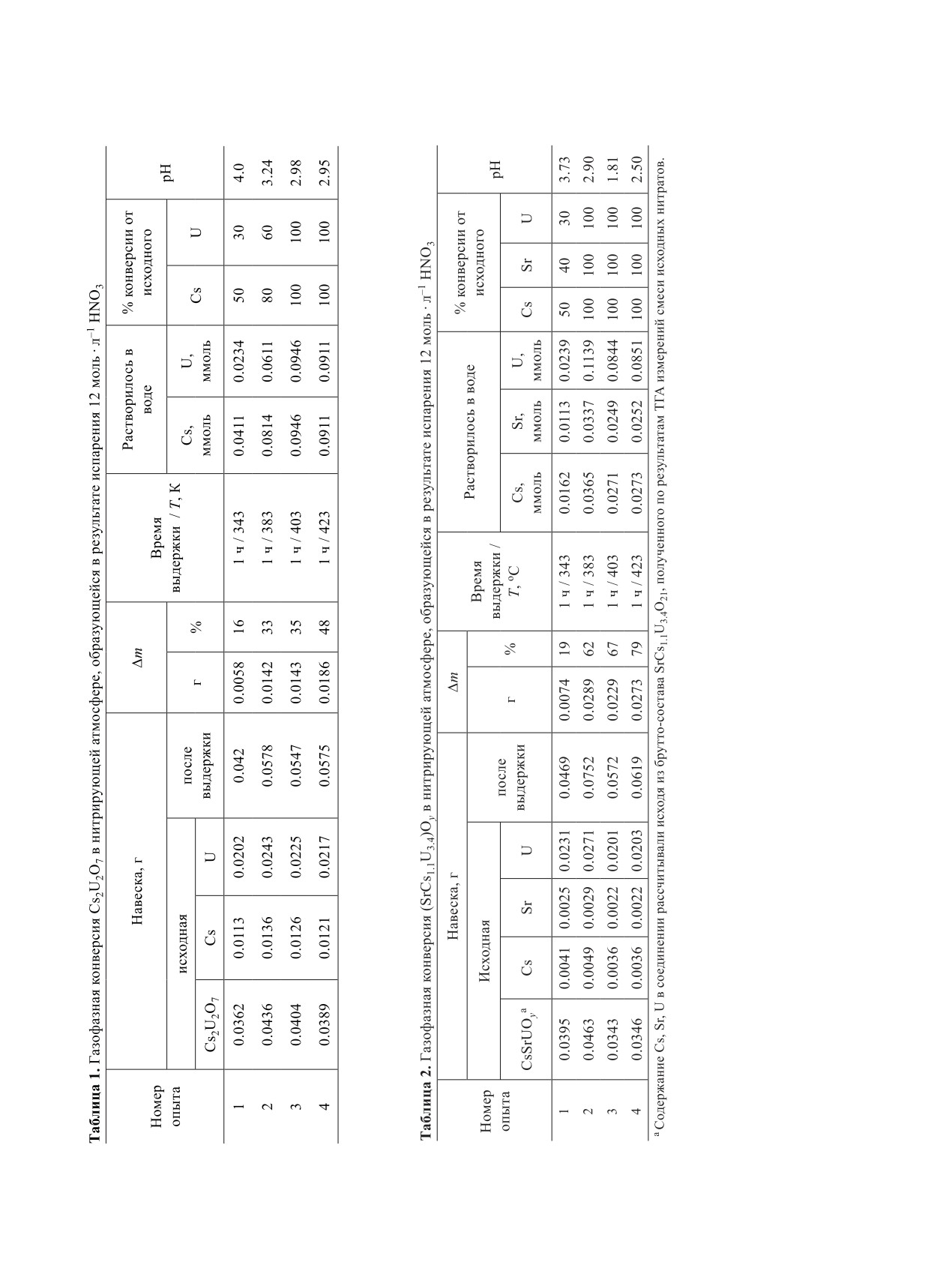
Рис.
5.
Данные термогравиметрического анализа
изучению поведения этого соединения в следую-
(SrCs1.1U3.4)Oy в воздушной атмосфере.
щем за волоксидацией процессе газофазного ни-
трирования.
Cs2U2O7 при более низких температурах (опыты 1 и
Поскольку в процессе испарения 12 моль ∙ л-1
2 табл. 1) приводит к снижению степени конверсии,
HNO3 возможно образование как NO2, так и паров
при этом наблюдается закономерное снижение этой
кислоты, то процесс конверсии Cs2U2O7 в нитриру-
величины с уменьшением температуры процесса. О
ющей атмосфере с образованием водорастворимых
меньшей интенсивности протекания процесса так-
соединений может быть представлен следующими
же свидетельствует уменьшение кислотности рас-
уравнениями:
творов продуктов конверсии.
_____________
Cs2U2O7 + 6NO2 + 3/2O2 + 2nH2O = 2UO2(NO3)2∙nH2O + 2CsNO3 (n = 0, 1, 3 или 6),
(1)
Cs2U2O7 + 4NO2 + O2 + H2O = 2UO2(OH)NO3 + 2CsNO3,
(2)
Cs2U2O7 + 6HNO3 + (2n - 3)H2O = 2UO2(NO3)2∙nH2O + 2CsNO3 (n = 0, 1, 3 или 6),
(3)
Cs2U2O7 + 4HNO3 = 2UO2(OH)NO3 + 2CsNO3 + H2O.
(4)
_____________
Согласно реакциям (1)-(4), процесс конверсии в
Таким образом, газофазная конверсия Cs2U2O7 в
нитрирующей атмосфере должен приводить к изме-
нитрирующей атмосфере, образующейся в резуль-
нению массы образцов. При этом образование но-
тате испарения 12 моль∙л-1 HNO3, при температуре
вых фаз U и Cs может привести к изменению окра-
403 К и выше и давлении газовой фазы 2-2.5 атм
ски образцов. Действительно, в результате процес-
позволяет провести полную конверсию данного со-
са конверсии Cs2U2O7 в нитрирующей атмосфере
единения в водорастворимые нитраты Cs и U.
цвет образца менялся с оранжевого на ярко-желтый.
Конверсия (SrCs1.1U3.4)Oy. Также как и для
Продукты конверсии при этом представляли собой
Cs2U2O7 предварительно была исследована терми-
плавы, растворение которых в воде приводило к
ческая устойчивость (SrCs1.1U3.4)Oy при нагреве на
получению желтых растворов. На основании пред-
воздухе от 1200 до 1773 К (рис. 5).
шествующих исследований можно заключить, что
Первичными данными при этом явились данные
данные продукты представляют собой сольваты,
ТГА для системы исходных нитратов в высокотем-
содержащие нитраты металлов и азотную кислоту.
пературной области. Наблюдаемые в данном случае
Количественные данные, полученные в ходе экспе-
закономерности были аналогичны с вышеописан-
риментов по конверсии Cs2U2O7, представлены в
ными для Cs2U2O7.
табл. 1. Проведение экспериментов при температу-
ре 403-423 К (опыты. 3 и 4 табл. 1) позволило прове-
Значимое разложение в рассматриваемой оксид-
сти полную конверсию Cs2U2O7 в водорастворимые
ной системе SrCs1.1U3.4O21 также начиналось при
нитраты U, Cs. В тоже время газофазная конверсия
температурах выше 1523 К. Таким образом, высо-
РАДИОХИМИЯ том 63 № 5 2021
444
КУЛЮХИН и др.
РАДИОХИМИЯ том 63 № 5 2021
ГАЗОФАЗНАЯ КОНВЕРСИЯ УРАНСОДЕРЖАЩИХ СОЕДИНЕНИЙ
445
котемпературное удаление Cs и Sr из рассматрива-
ФОНДОВАЯ ПОДДЕРЖКА
емой системы в ходе волоксидации будет затруд-
нительно. Данная система, скорее всего, сохранит
Исследование выполнено при финансовой под-
свой состав и будет участвовать в следующем за
держке Российского фонда фундаментальных ис-
волоксидацией процессе газофазной конверсии.
следований в рамках научного проекта № 18-33-
В ходе газофазной конверсии образцов в нитри-
01208 и Министерства науки и высшего образова-
рующей атмосфере наблюдали закономерности,
ния Российской Федерации.
аналогичные вышеописанным для Cs2U2O7. Про-
исходило увеличение массы образцов (табл. 2),
КОНФЛИКТ ИНТЕРЕСОВ
продукты конверсии представляли собой плавы
ярко-желтого цвета. При их растворении получали
желтые растворы, при этом наблюдалось полное
Авторы заявляют об отсутствии конфликта ин-
растворение продуктов конверсии, за исключением
тересов.
эксперимента, проведенного при температуре 343 К
(опыт 1 табл. 2).
СПИСОК ЛИТЕРАТУРЫ
Таким образом, процесс конверсии оксидной си-
стемы (SrCs1.1U3.4)Oy в нитрирующей атмосфере,
1.
Goode J.H. ORNL-TM-3723. USA. 1973. 137 p.
образующейся в результате испарения 12 моль∙л-1
2.
Agency N.E. State-of-the-Art Report on the Progress of
HNO3, при температуре проведения процесса 383 К
Nuclear Fuel Cycle Chemistry. 2018. 299 p.
и выше и давлении газовой фазы 1.5-2.5 атм позво-
3.
Metalidi M.M., Shapovalov S.V., Ismailov R.V.,
ляет эффективно переводить U, Cs и Sr в водорас-
Skriplev M.I., Beznosyuk V.I., Fedorov Y.S.
//
творимые соединения.
Radiochemistry. 2015. Vol. 57, N 1. P. 98.
В заключение следует отметить, что предложен-
4.
Сеелев И.Н., Аксютин П.В., Жабин А.Ю. // IX Рос.
ный подход по газофазной конверсии кислородсо-
конф. по радиохимии с международным участием
держащих соединений U, Sr и Cs в нитрирующей
«Радиохимия 2018»: Тез. докл. СПб., 2018. С. 326.
атмосфере позволяет не только полностью пере-
5.
Сеелев И.Н., Мацеля В.И., Васильев А.В., Кур-
вести исследуемые элементы в водную фазу, но и
ский И.А. // IX Российская конференция по радио-
создать условия для отделения U от Cs и Sr. В зави-
химии с международным участием «Радиохимия
симости от поставленной задачи путем варьирова-
2018»: Тез. докл. СПб., 2018. С. 328.
ния температуры нитрирующей атмосферы можно
6.
Двоеглазов К.Н., Шадрин А.Ю., Медведев М.Н., Ла-
перевести в водорастворимые соединения либо U,
кеев П.В., Зверев Д.В., Макаров А.О., Шудегова О.В.,
Cs и Sr полностью, либо только Cs и Sr, а U оста-
Павлюкевич Е.Ю., Дмитриева О.С. // IX Российская
вить в виде оксида, нерастворимого в воде. Данный
конференция по радиохимии с международным уча-
подход основывается на различной температуре
стием «Радиохимия 2018»: Тез. докл. СПб., 2018.
С. 273.
разложения нитратов U, Cs и Sr [21] и может быть
реализован при температурах процесса конверсии
7.
Двоеглазов К.Н., Шадрин А.Ю., Шудегова О.В., Пав-
люкевич Е.Ю., Богданов А.И., Зверев Д.В. // Вопр.
573 К и более. Практическое осуществление этого
атом. науки и техники. Сер.: Материаловедение и
подхода может стать основой будущих исследова-
новые материалы. 2016. Т. 87, № 4. С. 81.
ний.
8.
Westphal B.R., Bateman K.J., Morgan C.D., Berg J.F.,
Crane P.J., Cummings D.G., Giglio J.J., Huntley M.W.,
БЛАГОДАРНОСТИ
Lind R.P., Sell D.A. // Nucl. Technol. 2008. Vol. 162,
N 2. P. 153.
9.
Неволин Ю.М., Путков А.Е., Кулюхин С.А., Пе-
Часть измерений была выполнена с использова-
тров В.Г., Ширяев А.А., Калмыков С.Н. // IX Россий-
нием оборудования НИЦКП при химическом фа-
ская конференция по радиохимии с международным
культете МГУ им. М.В. Ломоносова и ЦКП ФМИ
участием «Радиохимия 2018»: Тез. докл. СПб., 2018.
ИФХЭ РАН.
С. 305.
РАДИОХИМИЯ том 63 № 5 2021
446
КУЛЮХИН и др.
10. Kulyukhin S.A., Nevolin Y.M., Gorbacheva M.P.,
16. Cordfunke E.H.P., Westrum E.F. // Thermochim. Acta.
Gordeev A.V.
// J. Radioanal. Nucl. Chem.
2017.
1988. Vol. 124. P. 285.
Vol. 311, N 2. P. 1023.
17. JCPDS—Int. Centre for Diffraction Data. PDF 01-081-
11. Kulyukhin S.A., Nevolin Y.M., Gordeev A. V.
//
1215, Cs2U2O7.
Radiochemistry. 2017. Vol. 59, N 3. P. 247.
18. Cordfunke E.H.P., Loopstra B.O. // J. Inorg. Nucl. Chem.
12. Кулюхин С.А., Неволин Ю.М., Калмыков С.Н. // IX
Российская конференция по радиохимии с между-
1967. Vol. 29, N 1. P. 51-57.
народным участием «Радиохимия 2018»: Тез. докл.
19. Fee D.C., Johnson I., Davis S.A., Shinn W.A., Staahl G.E.,
СПб., 2018. С. 413.
Johnson C.E. ANL-76-126. USA, 1977. 36 p.
13. Kulyukhin S.A., Nevolin Y.M., Gordeev A.V.
//
20. Huang J., Yamawaki M., Yamaguchi K., Ono F.,
Radiochemistry. 2019. Vol. 61, N 3. P. 312.
Yasumoto M., Sakurai H., Sugimoto J. // J. Alloys
14. Kulyukhin S.A., Nevolin Y.M., Gordeev A.V.
//
Compd. 1998. Vol. 271-273. P. 625.
Radiochemistry. 2019. Vol, 61. N 1. P. 5.
15. Cordfunke E.H.P., Van Egmond A.B., Van Voorst G. // J.
21. Haynes W.M. CRC Handbook of Chemistry and Physics.
Inorg. Nucl. Chem. 1974. Vol. 37, N 6. P. 1433.
CRC, 2016. 97th Ed. 2652 p.
РАДИОХИМИЯ том 63 № 5 2021