РАДИОХИМИЯ, 2021, том 63, № 2, с. 132-138
УДК 542.61:546.65/66
ЭКСТРАКЦИЯ РЗЭ(III), U(VI) И Th(IV)
ИЗ АЗОТНОКИСЛЫХ РАСТВОРОВ
N-АЛКИЛ(АРИЛ)-
КАРБАМОИЛМЕТИЛФОСФИНОКСИДАМИ
В ПРИСУТСТВИИ ИОННОЙ ЖИДКОСТИ
© 2021 г. А. Н. Туранова,*, В. K. Карандашевб, О. И. Артюшинв,
Е. В. Шаровав, В. А. Хвостиковб
а Институт физики твердого тела РАН, 142432, Черноголовка Московской обл., ул. Акад. Осипьяна, д. 2;
*e-mail: turanov@issp.ac.ru
б Институт проблем технологии микроэлектроники и особо чистых материалов РАН,
142432,Черноголовка Московской обл., ул. Акад. Осипьяна, д. 6
в Институт элементоорганических соединений им. А. Н. Несмеянова РАН, 119334,
Москва, ул. Вавилова, д. 28
Получена 01.09.2019, после доработки 31.10.2019, принята к публикации 05.11.2019
Установлено, что экстракция РЗЭ(III), U(VI) и Th(IV) из азотнокислых растворов N-алкил(арил)кар-
бамоилметилфосфиноксидами Ph2P(O)CH2C(O)NHR (R = C9H19, Ph, CH2Ph) значительно возрастает
в присутствии ионной жидкости - бис[(трифторметил)сульфонил]имида 1-бутил-3-метилимидазолия.
Эффективность экстракции изменяется в широких пределах в зависимости от природы заместителей
при атоме азота. Показано, что в системе с ионной жидкостью Ph2P(O)CH2C(O)NHC9H19 значиельно
превосходит свой N,N-диалкилзамещенный аналог по эффективности экстракции РЗЭ(III) из растворов
HNO3 умеренной концентрации.
Ключевые слова: экстракция, РЗЭ(III), уран(VI), торий(IV), карбамоилметилфосфиноксиды, ионные
жидкости.
DOI: 10.31857/S0033831121020052
Известно, что бидентатные нейтральные фос-
прямым аминированием коммерчески доступного
форорганические соединения, в частности диа-
этилового эфира дифенилфосфорилуксусной кис-
рил(N,N-диалкилкарбамоилметил)фосфиноксиды
лоты соответствующими аминами [4]. Установлено,
(КМФО), обладают высокой комплексообразующей
что по эффективности извлечения Am(III) из азот-
способностью по отношению к актинидам и редко-
нокислых растворов эти соединения не уступают
земельным элементам (РЗЭ) в азотнокислых средах
своим N,N-диалкилзамещенным аналогам, суще-
и используются для извлечения и концентрирования
ственно выигрывая у них в синтетической доступ-
этих элементов в экстракционных [1] и сорбционных
ности [4]. Методами ЯМР 31Р, ИК спектроскопии и
[2] системах. В последнее время все больший инте-
рентгеноструктурного анализа установлено, что в
рес привлекают КМФО, содержащие вторичный
нейтральных условиях N-алкил(арил)карбамоилме-
амидный фрагмент -C(O)NHR [3]. Разработан одно-
тилфосфиноксиды образуют с нитратами РЗЭ(III)
стадийный и дешевый способ получения вторичных
комплексы с соотношением металл : лиганд как
NH-алкиламидов дифенилфосфорилуксусной кис-
1 : 2, так и 1 : 3 с бидентатной координацией фос-
лоты Ph2P(O)CH2C(O)NHAlk (Alk = алкил C2-C12)
форильной и карбонильной групп, в то время как
132
ЭКСТР
АКЦИЯ РЗЭ(III), U(VI) И Th(IV)
133
N,N-диалкилкарбамоилметилфосфорильные сое-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
динения в аналогичных условиях образуют только
комплексы состава 1 : 2 [5]. Такое различие в ко-
Соединения I-III получены известным мето-
ординационных свойствах лигандов может быть
дом [4, 20]. Ионную жидкость бис[(трифторме-
связано с уменьшением стерических препятствий
тил)сульфонил]имид
1-бутил-3-метилимидазолия
в молекуле NH-алкиламидов дифенилфосфорилук-
(bmimTf2N) (Merck), литиевую соль бис[(трифтор-
сусной кислоты по сравнению с их N,N-диалкилза-
метил)сульфонил]имида (LiTf2N) (Sigma-Aldrich)
мещенными аналогами [5].
и 1,2-дихлорэтан марки х.ч. использовали без до-
В последнее время значительно возрос интерес к
полнительной очистки. Растворы экстрагентов и
использованию ионных жидкостей (ИЖ) в экстрак-
bmimTf2N в дихлорэтане готовили по точным на-
ционной практике концентрирования и разделения
вескам.
органических и неорганических соединений в каче-
Распределение ионов РЗЭ(III), U(VI) и Th(IV)
стве не смешивающейся с водой фазы [6-11]. Было
в экстракционных системах изучали на модель-
показано, что экстракция актинидов и РЗЭ(III)
ных растворах
0.1-7.0 моль/л HNO3. Исходная
растворами КМФО в ИЖ - гексафторфосфатах
концентрация каждого из элементов составляла
и бис[(трифторметил)сульфонил]имидах метилал-
2×10-6 моль/л. Опыты по экстракции проводили в
килимидазолия - значительно возрастает по срав-
пробирках с притертыми пробками при температу-
нению с экстракцией растворами КМФО в тради-
ре 22 ± 1°С и соотношении объемов органической и
ционных растворителях [12, 13]. Растворы КМФО в
водной фаз 1 : 1. Контакт фаз осуществляли на ап-
ИЖ эффективно извлекают РЗЭ(III) также и из хло-
парате для перемешивания со скоростью 60 об/ мин
ридных растворов, в то время как в отсутствие ИЖ
в течение 1 ч, что достаточно для установления
растворы этих соединений практически не экстра-
постоянных значений коэффициентов распределе-
гируют РЗЭ(III) [14]. Для эффективного извлечения
ния (D).
РЗЭ(III) [15], а также Am(III) [16-18] из растворов
Содержание РЗЭ(III), U(VI) и Th(IV) в исход-
HNO3 достаточно небольшой концентрации ИЖ в
ных и равновесных водных растворах определяли
органическом растворителе, содержащем КМФО.
методом масс-спектрометрии с ионизацией пробы
Это позволяет рассматривать ИЖ как компонент си-
в индуктивно связанной плазме с использованием
нергетической смеси. Ранее нами исследовано вли-
масс-спектрометра X-7 (Thermo Electron, США)
яние строения КМФО на экстракцию иов металлов
по ранее описанной методике [21]. Содержание
в присутствии ИЖ [19].
элементов в органической фазе определяли после
Цель данной работы - исследование влияния
реэкстракции раствором 0.1 моль/л оксиэтилиден-
строения NH-алкиламидов дифенилфосфорилук-
дифосфоновой кислоты, коэффициенты распреде-
сусной кислоты на их экстракционную способ-
ления элементов рассчитывали как отношение их
ность по отношению к РЗЭ(III), U(VI) и Th(IV) в
концентраций в равновесных фазах. Погрешность
азотнокислых средах в присутствии ИЖ в орга-
определения коэффициентов распределения не пре-
нической фазе. Для этого рассмотрено межфазное
вышала 5%. Концентрацию HNO3 в равновесных
распределение РЗЭ(III), U(VI) и Th(IV) между рас-
водных фазах определяли потенциометрическим
творами HNO3 и органической фазой, содержащей
титрованием раствором NaOH. Концентрацию ио-
бис[(трифторметил)сульфонил]имид 1-бутил-3-ме-
нов Tf2N- в водных растворах определяли атом-
тилимидазолия и соединения I-III, отличающиеся
но-эмиссионным методом с ионизацией пробы в
природой заместителей при атомах азота
индуктивно связанной плазме с использованием
Ph2P(O)CH2C(O)NHR
спектрометра ICAP-61 (Thermo Jarrel Ash, США).
R = C9H19 (I), CH2Ph (II), Ph (III)
Проведено сопоставление эффективности экс-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
тракции ионов металлов этими соединенияим и
КМФО Ph2P(O)CH2C(O)NBu2 (IV) [19] в системах
Предварительно установлено, что растворы
с ИЖ.
bmimTf2N в дихлорэтане не экстрагируют РЗЭ(III),
РАДИОХИМИЯ том 63 № 2 2021
134
ТУРАНОВ и др.
3
3.0
2
1
3
2
2.0
4
1
1
1.0
6
5
2
0
0.0
3
-1
4
-1.0
-2
-0.4
-0.2
0.0
0.2
0.4
0.6
0.8
1.0
-3.5
-3.0
-2.5
-2.0
-1.5
-1.0
lg [HNO3]
lg [L]
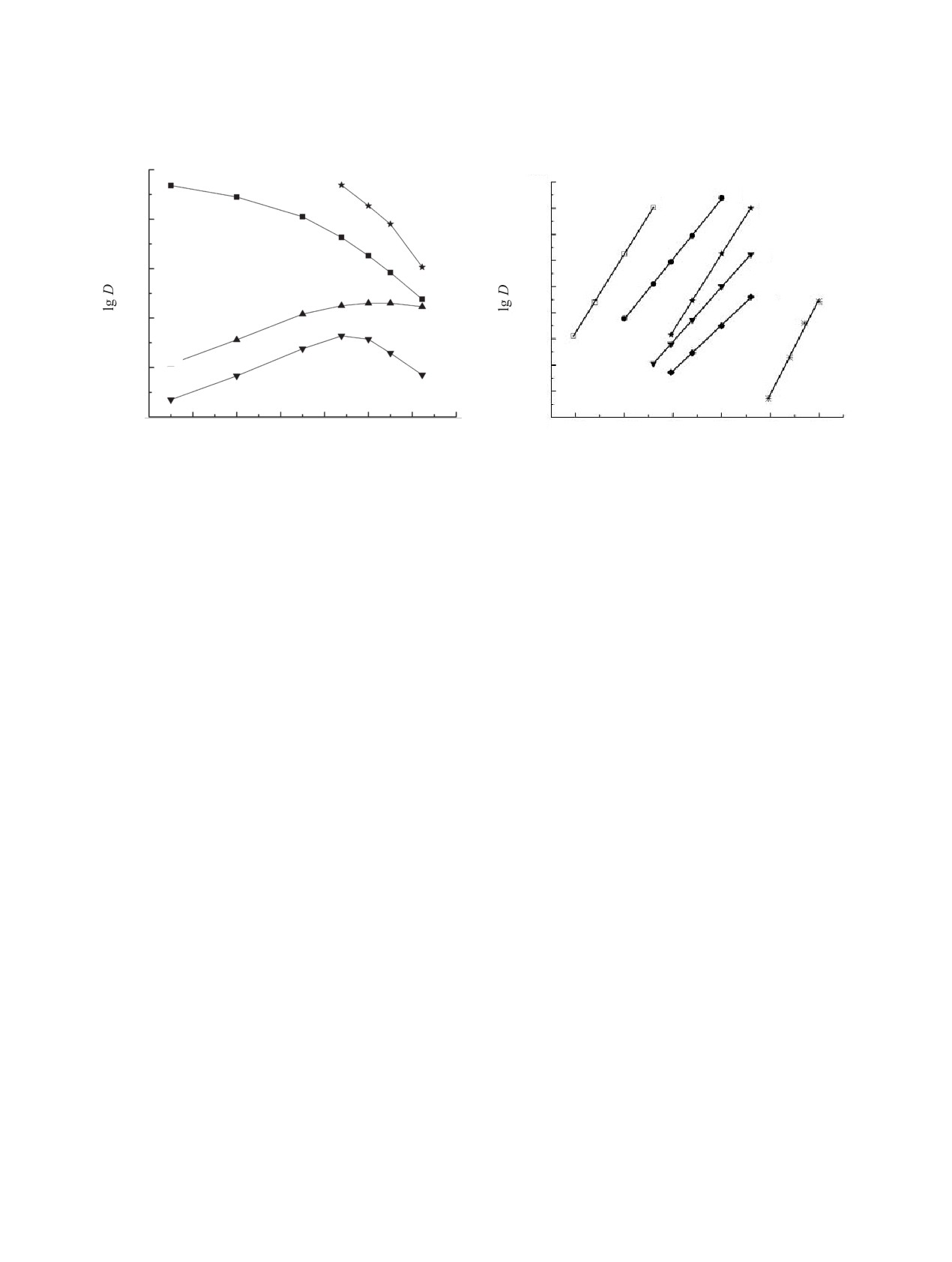
Рис. 1. Зависимость коэффициентов распределения U
Рис. 2. Зависимость коэффициентов распределения
(1, 3) и Eu (2, 4) от концентрации HNO3 в водной фазе
Th (1, 4), U (2, 5) и Eu (3, 6) от концентрации соедине-
при экстракции растворами соединения I в дихлорэтане
ния I в дихлорэтане (4-6) и дихлорэтане, содержащем
(3, 4) и дихлорэтане, содержащем 0.1 моль/л bmimTf2N
0.1 моль/л bmimTf2N (1-3), при экстракции из раство-
(1, 2). Концентрация КМФО I, моль/л: 1-3 - 0.01, 4 - 0.05.
ров 3 моль/л HNO3.
U(VI) и Th(IV) из азотнокислых растворов (величи-
ИЖ при увеличении [HNO3] может быть снижение
ны D не превышают 10-2). Однако при экстракции
концентрации аниона Tf2N- в водной фазе вслед-
этих ионов растворами соединения I в дихлорэтане,
ствие подавления диссоциации HTf2N (Ka = 0.7
содержащем bmimTf2N, происходит значительное
[25]) по мере увеличения кислотности водной фазы,
увеличение извлечения этих элементов в органиче-
а также увеличение концентрации нитратных ком-
скую фазу (рис. 1). Наблюдаемый синергетический
плексов извлекаемых элементов в водной фазе с ро-
эффект, по-видимому, связан с вхождением гидро-
стом концентрации HNO3. Величина синергетиче-
фобных анионов Tf2N- в состав экстрагируемых
ского эффекта S = D/D0 (где D и D0 - коэффициенты
комплексов, приводящим к увеличению их гидро-
распределения в присутствии и в отсутствие ИЖ в
фобности по сравнению с сольватированными ни-
органической фазе) уменьшается с ростом [HNO3],
тратами РЗЭ(III), U(VI) и Th(IV).
однако синергизм наблюдается даже в сильнокис-
Присутствие bmimTf2N в органической фазе су-
лых средах (рис. 1).
щественно изменяет характер зависимости эффек-
Стехиометрическое соотношение металл : экс-
тивности экстракции Eu(III) и U(VI) растворами
трагент в экстрагируемых комплексах определено
соединения I от концентрации HNO3 в водной фазе
методом сдвига равновесия. Полученные данные
(рис. 1). В присутствии ИЖ наблюдается снижение
(рис. 2) показали, что РЗЭ(III) и Th(IV) экстраги-
DEu и DU с ростом [HNO3], которое отмечалось ра-
руются соединением I в присутствии ИЖ в виде
нее и при экстракции растворами КМФО [18, 19]
трисольватов, а U(VI) извлекается в этих условиях
и других нейтральных экстрагентов [22, 23] в ИЖ.
виде смеси ди- и трисольватов. В отсутствие ИЖ
Такой характер зависимости D-[HNO3] может быть
КМФО I извлекает U(VI) из азотнокислых раство-
связан со снижением концентрации свободного экс-
ров в виде комплексов с соотношением U(VI) : I =
трагента в органической фазе вследствие взаимо-
действия КМФО как с HNO3, так и с HTf2N, присут-
1 : 1 и 1 : 2, а Th(IV) - в виде дисольватов (рис. 2).
РЗЭ(III) экстрагируются растворами соединения I
ствующей в равновесной водной фазе вследствие
заметного перехода ионов ИЖ в водную фазу [24].
в дихлорэтане из азотнокислых растворов в виде
Другой причиной снижения DEu и DU в системе с
комплексов 1 : 3 и 1 : 4 [26].
РАДИОХИМИЯ том 63 № 2 2021
ЭКСТР
АКЦИЯ РЗЭ(III), U(VI) И Th(IV)
135
Таблица 1. Концентрационные константы экстракции РЗЭ(III), lgKLn, растворами КМФО I-IV в дихлорэтане из
растворов LiTf2N
РЗЭ
lg KLn(IV) [31]
lg KLn(I)
lg KLn(II)
lg KLn(III)
La
16.70 ± 0.03
15.87 ± 0.03
14.01 ± 0.03
12.43 ± 0.03
Ce
17.05 ± 0.03
16.17 ± 0.03
14.34 ± 0.03
12.82 ± 0.03
Pr
17.19 ± 0.03
16.23 ± 0.04
14.43 ± 0.04
12.95 ± 0.04
Nd
17.16 ± 0.03
16.22 ± 0.04
14.43 ± 0.04
12.96 ± 0.04
Sm
17.24 ± 0.03
16.32 ± 0.04
14.55 ± 0.04
13.11 ± 0.04
Eu
17.14 ± 0.03
16.21 ± 0.03
14.45 ± 0.03
13.03 ± 0.03
Gd
16.83 ± 0.03
15.91 ± 0.05
14.23 ± 0.05
12.79 ± 0.05
Tb
16.61 ± 0.03
15.72 ± 0.03
14.05 ± 0.03
12.63 ± 0.03
Dy
16.32 ± 0.03
15.39 ± 0.04
13.82 ± 0.04
12.40 ± 0.04
Ho
15.96 ± 0.03
15.12 ± 0.03
13.49 ± 0.03
12.10 ± 0.03
Er
15.61 ± 0.03
14.87 ± 0.04
13.31 ± 0.04
11.87 ± 0.04
Tm
15.30 ± 0.03
14.70 ± 0.03
13.03 ± 0.03
11.58 ± 0.03
Yb
15.04 ± 0.03
14.53 ± 0.04
12.86 ± 0.04
11.44 ± 0.04
Lu
14.84 ± 0.03
14.26 ± 0.03
12.69 ± 0.03
11.17 ± 0.03
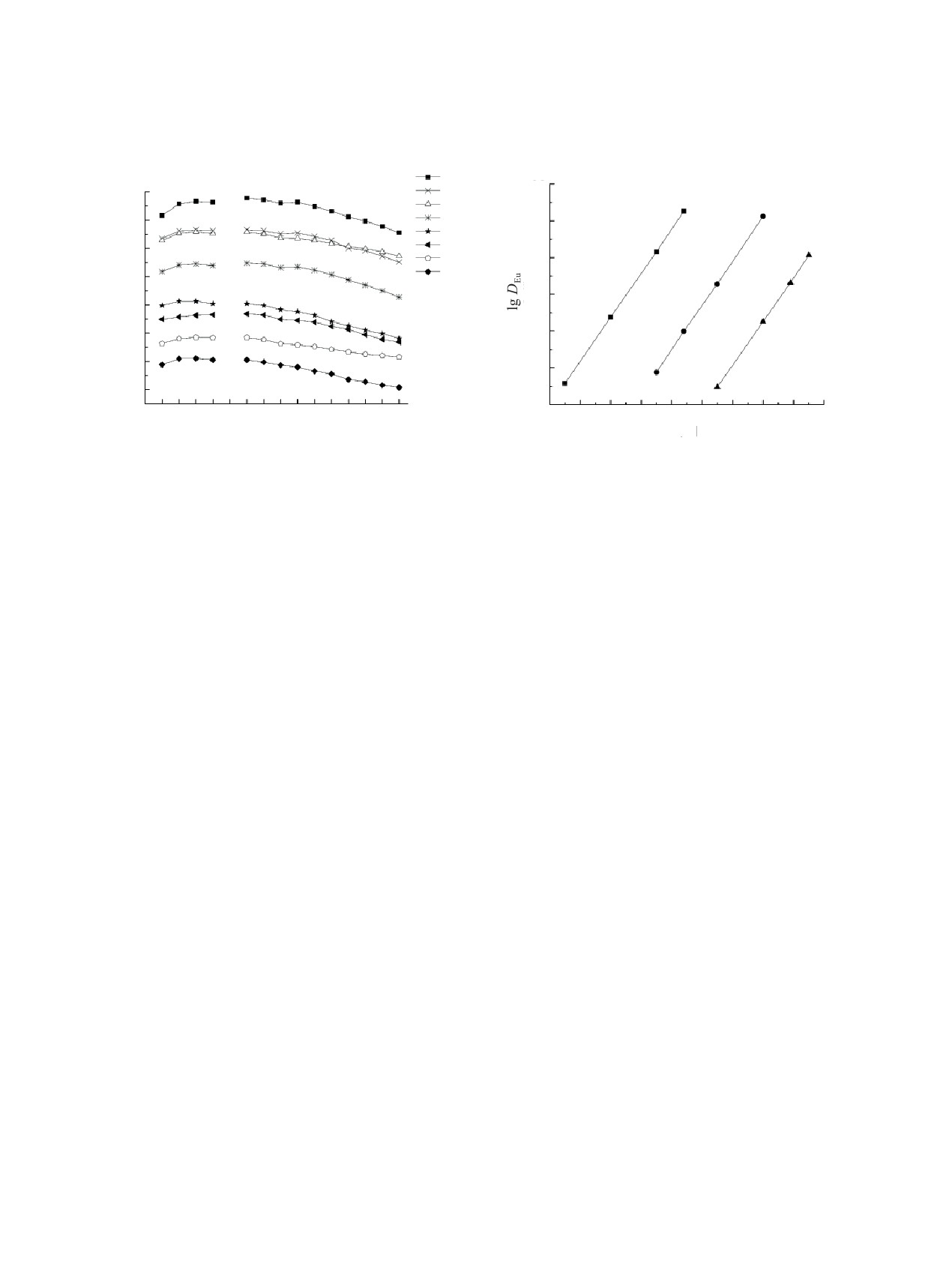
Для сравнения эффективности экстракции
чины таких изменений эффективности экстракции
РЗЭ(III) растворами КМФО I-IV в системе с ИЖ
растворами КМФО в присутствии ИЖ.
определены величины DLn при экстракции из рас-
Процесс экстракции РЗЭ(III) растворами КМФО
твора 3 моль/л HNO3 растворами этих реагентов
(L) в присутствии ИЖ в органической фазе может
в дихлорэтане в присутствии bmimTf2N (рис. 3).
быть описан уравнением
Природа заместителей при атоме азота в молеку-
Ln3+(в) + 3L(о) + 3bmimTf2N(о) ↔
лах КМФО I-III оказывает значительное влияние
↔ LnL3(Tf2N)3(о) + 3bmim+(в),
(1)
на экстракцию РЗЭ(III) этими реагентами в при-
где символы (о) и (в) относятся к компонентам си-
сутствии ИЖ. Увеличение DLn в ряду соединений
стемы в органической и водной фазах соответствен-
III < II < I связано с возрастанием в этом ряду до-
но, а константа экстракции выражена как
норной способности группы С=О молекулы экстра-
гента по мере снижения электроотрицательности
Kex = [LnL3(Tf2N)3](о)[Ln3+]-1(в)[L]-3(о)[bmimTf2N]-3(о)[bmim+]3(в). (2)
заместителя при атоме азота. Такая же зависимость
отмечалась при экстракции РЗЭ(III) из азотнокис-
С учетом распределения ИЖ между фазами
лых растворов растворами соединениний I-III в
bmim+(в) + Tf2N-(в) ↔ bmimTf2N(о), KИЖ,
(3)
дихлорэтане [26], а также при экстракции Am(III)
растворами КМФО Ph2P(O)CH2C(O)NR2 из азотно-
Kex = [LnL3(Tf2N)3](о)[Ln3+]-1(в)[L]-3(о)K
–3[Tf2N-]-3(в) =
кислых растворов [27].
= KLnKИ
-3,
(4)
Ж
Интересно отметить, что в системе без ИЖ со-
единение I несколько уступает по эффективности
где KLn =
[LnL3(Tf2N)3](о)[Ln3+]-1(в)[L]-3(о)[Tf2N-]-3(в) -
экстракции РЗЭ(III) своему N,N-диалкилзамещен-
константа экстракции РЗЭ(III) растворами КМФО в
ному аналогу IV, однако существенно превосходит
дихлорэтане из растворов, содержащих ионы Tf2N-,
его в присутствии ИЖ в органической фазе (рис. 3).
которая характеризует устойчивость комплексов
Соединение II с бензильным заместителем при ато-
LnL3(Tf2N)3. Из этого выражения следует, что уве-
ме азота не уступает соединению IV в присутствии
личению Kex, т.е. увеличению эффективности экс-
ИЖ в органической фазе, хотя раствор КМФО II
тракции ионов металлов растворами нейтральных
в дихлорэтане экстрагирует РЗЭ(III) из раствора
экстрагентов в присутствии ИЖ, способствует уве-
3 моль/л HNO3 значительно менее эффективно, чем
личение координационной способности экстраген-
КМФО IV (рис. 3). Рассмотрим возможные при-
та (рост KLn) и снижение константы распределения
РАДИОХИМИЯ том 63 № 2 2021
136
ТУРАНОВ и др.
lg DLn
1
2
2.0
4
3
I
II
4
3
1.5
5
6
III
2
7
1.0
8
1
0.5
0
-1
0.0
-2
0.5
-3
1.0
La Ce Pr Nd Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
-3.5
-3.0
-2.6
-2.2
-1.8
lg [L]
Рис. 3. Экстракция РЗЭ(III) из растворов 3 моль/л HNO3
растворами 0.05 моль/л соединения I (1, 6), II (2, 7), III
Рис. 4. Зависимость коэффициентов распределения Eu от
(4, 8) и IV (3, 5) [17] в дихлорэтане (5-8) и дихлорэтане,
концентрации соединений I-III в дихлорэтане при экс-
содержащем 0.1 моль/л bmimTf2N (1-4).
тракции из раствора 0.005 моль/л LiTf2N.
ИЖ, например, при увеличении гидрофобности ка-
полученных данных видно, что устойчивость ком-
тионной части ИЖ, что неоднократно подтвержда-
плексов LnL3(Tf2N)3 возрастает в ряду соединений
лось экспериментально [28-30].
III < II < I < IV по мере возрастания в этом ряду
Для определения констант экстракции РЗЭ(III)
донорной способности группы С=О молекулы экс-
трагента. В такой же последовательности изменя-
растворами КМФО I-III в дихлорэтане из раство-
ются эффективность экстракции РЗЭ(III) раство-
ров, содержащих ионы Tf2N-, рассмотрена зависи-
рами КМФО в присутствии ИЖ из нейтральных и
мость DLn от концентрации ионов Tf2N- в водной
слабокислых растворов. Например, при экстракции
фазе при постоянной концентрации КМФО I-III
в органической фазе. Угловой наклон зависимости
РЗЭ(III) из растворов 0.01 моль/л HNO3 растворами
0.005 моль/л КМФО I-IV в дихлорэтане, содержа-
lg DLn-lg [Tf2N-] близок к 3 для всех РЗЭ(III), что
щем 0.01 моль/л ИЖ, величины DEu составляют 9.5,
соответствует экстракции РЗЭ(III) в виде комплек-
1.2, 0.016 и <2 × 10-3 для КМФО IV, I, II и III соот-
сов с стехиометрическим соотношением
ветственно.
Ln : Tf2N- = 1 : 3.
Процесс экстракции РЗЭ(III) растворами КМФО
При этом не наблюдался переход ионов лития
в присутствии ИЖ из кислых растворов сопрово-
в органическую фазу. Стехиометрическое соотно-
ждается взаимодействием КМФО с HNO3 и HTf2N,
что приводит к снижению концентрации свобод-
шение Eu : L в экстрагируемых комплексах, опре-
ного экстрагента в органической фазе. Экстракция
деленное методом разбавления, для соединений
HTf2N растворами КМФО может быть описана
I-III составляет 1 : 3 (рис. 4). Такие же стехиоме-
трические соотношения получены для всех других
уравнением
РЗЭ(III), что соответствует экстракции РЗЭ(III) из
H+ +Tf2N- + L(o) ↔ HTf2NL(o),
(6)
водных растворов, содержащих ионы Tf2N-, рас-
а константа экстракции выражена как
творами КМФО в виде комплексов LnL3(Tf2N)3.
Константы экстракции РЗЭ(III), рассчитанные по
KHTf2N = [HTf2NL]/([L][H+][Tf2N-]).
(7)
уравнению
Концентрационные константы экстракции
KLn = DLn[L]3(о)[Tf2N-]3(в)
(5)
HTf2N растворами КМФО в дихлорэтане рассчита-
(где [L](о) - равновесная концентрация экстраген-
ны исходя из данных по зависимости коэффициента
та в органической фазе), приведены в табл. 1. Из
распределения иона Tf2N- от концентрации экстра-
РАДИОХИМИЯ том 63 № 2 2021
ЭКСТР
АКЦИЯ РЗЭ(III), U(VI) И Th(IV)
137
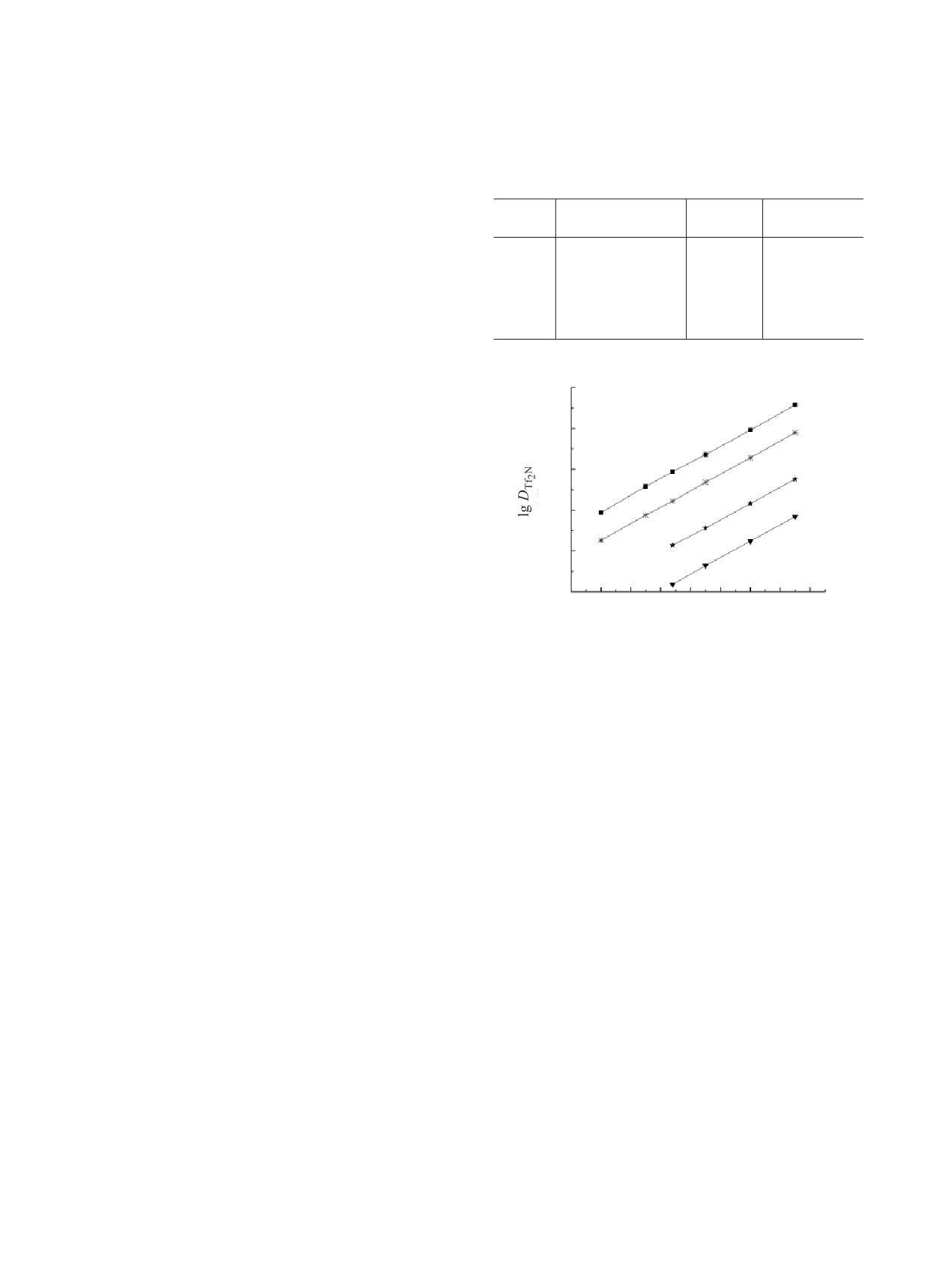
гента в органической фазе (рис. 5). Предваритель-
Таблица 2. Константы экстракции HTf2N (KHTf2N) и
но установлено, что в условиях эксперимента
HNO3 (KHNO3(1), KHNO3(2)) растворами КМФО I-IV в
дихлорэтане
ионы Li+ и Cl- не переходят в органическую фазу.
Значения KHTf2N для соединений I-IV приведены
КМФО
KHTf2N
KHNO3(1)
KHNO3(2)
в табл. 2. Из полученных данных видно, что экс-
IV
(3.02 ± 0.18) × 103
1.01 [27]
0.0339 [27]
тракционная способность КМФО по отношению
к HTf2N возрастает в ряду соединений III < II <
I
(1.40 ± 0.07) × 103
0.52 [26]
0.009 [26]
I < IV по мере увеличения в этом ряду основности
II
380 ± 21
0.29 [26]
0.003 [26]
экстрагента. В такой же последовательности изме-
III
126 ± 6
няются константы экстракции азотной кислоты
(KHNO3(1) и KHNO3(2)) этими соединениями [26, 27].
Зависимость DLn от концентрации компонен-
1.0
тов органической и водной фаз при экстракции
IV
РЗЭ(III) растворами КМФО в присутствии ИЖ из
0.5
I
азотнокислых растворов может быть выражена как
0.0
DLn = KLn[L]3(о) исх f -3[Tf2N-]3(в),
(8)
II
2
-0.5
где f = 1 + KHNO3(1)[H+][NO3-]γ
+ KHNO3(2)[H+]2 ×
III
[NO3-]2γ4 + KHTf2N[H+][Tf2N-]) - поправка на свя-
зывание экстрагента HNO3 и HTf2N. Различие в
-1.0
эффективности экстракции РЗЭ(III) двумя экстра-
-1.5
гентами, например, IV и I в сопоставимых усло-
-3.2
-2.8
-2.4
-2.0
-1.6
виях, выраженное как отношение коэффициентов
lg [L]
распределения DLn(IV)/DLn(I), зависит от устой-
Рис. 5. Зависимость коэффициентов распределения
чивости комплексов LnL3(Tf2N)3, экстракцион-
аниона Tf2N- от концентрации соединений I-IV в
дихлорэтане при экстракции из раствора 0.001 моль/л
ной способности КМФО по отношению к HNO3 и
LiTf2N, содержащего 0.1 моль/л HCl.
HTf2N, а также концентрации HNO3 и ионов Tf2N-
в водной фазе:
тельно возрастает в присутствии ионной жидкости
DLn(IV)/DLn(I) = KLn(IV)KLn(I)-1 f -3(IV) f 3(I).
(9)
bmimTf2N. Экстракционная способность этих сое-
динений изменяется в широких пределах в зависи-
Из этого соотношения следует, что при экстрак-
мости от природы заместителей при атомах азота.
ции РЗЭ(III) из нейтральных и слабокислых рас-
В системе с bmimTf2N эффективность экстракции
творов DLn(IV)/DLn(I) ≈ KLn(IV)KLn(I)-1, т.е. КМФО
РЗЭ(III) из азотнокислых растворов растворами
IV в присутствии ИЖ экстрагирует РЗЭ(III) более
КМФО зависит не только от координационной
эффективно, чем КМФО I. Поскольку КМФО IV
способности этих экстрагентов, но и их способ-
экстрагирует HNO3 и HTf2N в большей степени,
ности экстрагировать HNO3 и HTf2N. Снижение
чем КМФО I, с ростом концентрации HNO3 вели-
соэкстракции этих кислот растворами Ph2P(O)
чина отношения f 3(I)/f 3(IV) сильно уменьшается.
CH2C(O)NHC9H19 приводит к тому, что этот экс-
Это ведет к тому, что КМФО IV в присутствии
трагент в системе с bmimTf2N значиельно превос-
bmimTf2N экстрагирует РЗЭ(III) из растворов
ходит свой N,N-диалкилзамещенный аналог IV по
3 моль/л HNO3 менее эффективно, чем КМФО I
эффективности экстракции РЗЭ(III) из растворов
(рис. 3).
азотной кислоты умеренной концентрации.
Представленные данные показали, что эффек-
тивность экстракции РЗЭ(III), U(VI) и Th(IV) из
ФОНДОВАЯ ПОДДЕРЖКА
азотнокислых растворов растворами N-алкил(а-
рил)карбамоилметилфосфиноксидов
Ph2P(O)
Работа выполнена при финансовой поддержке
CH2C(O)NHR (где R = C9H19, Ph, CH2Ph) значи-
Министерства науки и высшего образования Рос-
РАДИОХИМИЯ том 63 № 2 2021
138
ТУРАНОВ и др.
сийской Федерации в рамках Государственного за-
Anal. Sci. 2003. Vol. 19. P. 1097-1098.
дания 2019 г. ИФТТ РАН, ИПТМ РАН и ИНЭОС
14. Visser A.E., Rogers R.D. // J. Solid State Chem. 2003.
РАН. Полученные в работе вещества были охаракте-
Vol. 171. P. 109-113.
ризованы с использованием научного оборудования
15. Туранов А.Н., Карандашев В.K., Баулин В.Е. // ЖНХ.
Центра исследования строения молекул ИНЭОС
2008. Т. 53, № 6. С. 1045-1050.
РАН.
16. Туранов А.Н., Карандашев В.K., Баулин В.Е. // Ради-
охимия. 2008. Т. 50, № 3. С. 229-235.
КОНФЛИКТ ИНТЕРЕСОВ
17. Pribylova G.A. // J. Radioanal. Nucl. Chem. 2011.
Vol. 288. P. 693-597.
Авторы заявляют об отсутствии конфликта
18. Прибылова Г.А., Смирнов И.В., Новиков А.П. // Ра-
интересов.
диохимия. 2012. Т. 54, № 5. С. 435-438.
19. Pribylova G.A., Smirnov I.V., Novikov A.P.
//
СПИСОК ЛИТЕРАТУРЫ
J. Radioanal. Nucl. Chem. 2013. Vol. 295. P. 83-87.
20. Туранов А.Н., Карандашев В.K., Яркевич А. Н. // Ра-
1. Чмутова М.K., Литвина М.Н., Прибылова Г.А.
диохимия. 2013. Т. 55, № 4. С. 314-318.
и др. // Радиохимия. 1999. Т. 41, № 4. С. 331-335.
21. Артюшин О.И., Шарова Е.В., Одинец И.Л. и др. //
2. Мясоедова Г.В. // Рос. хим. журн. 2005. Т. 49, № 2.
Изв. АН. Сер. хим. 2006. № 8. С. 1387-1394.
С. 72-75.
22. Туранов А.Н., Карандашев В.K., Баулин В.Е., Цвет-
3. Мастрюкова Т.А., Артюшин О.И., Одинец И.Л.,
ков Е.Н. // ЖНХ. 1995. Т. 40, № 11. С. 1926-1930.
Тананаев И.Г. // Рос. хим. журн. 2005. Т. 49, № 2.
23. Turanov A.N., Karandashev V.K., Khvos tikov V.A. //
С. 86-96.
Solvent Extr. Ion Exch. 2017. Vol. 35. P. 461-479.
4. Артюшин О.И., Шарова Е.В., Одинец И.Л. и др. //
24. Turanov A.N., Karandashev V.K., Sharova E.V. et al. //
Изв. АН. Сер. хим. 2004. № 11. С. 2394-2402.
Radiochim. Acta. 2018. Vol. 106. P. 355-362.
5. Шарова Е.В., Артюшин О.И., Нелюбина Ю.В.
25. Gaillard C., Boltoeva M., Billard I. et al.
//
и др. // Изв. АН. Сер. хим. 2008. № 9. С. 1856-1862.
ChemPhysChem. 2015. Vol. 16. P. 2653-2662.
6. Артюшин О.И., Шарова Е.В., Одинец И.Л. и др. //
Изв. АН. Сер. хим. 2006. № 8. С. 1387-1394.
26. Katsuta S., Watanabe Y., Araki Y., Kudo Y.
//
ACS Sustain. Chem. Eng. 2016. Vol. 4. P. 564-571.
7. Visser A.E., Swatloski R.P., Reichert W.M. et al. // Ind.
Eng. Chem. Res. 2000. Vol. 39. P. 3596-3604.
27. Туранов А.Н., Карандашев В.K., Шарова Е.В. и др. //
Цветные металлы. 2012. № 3. С. 51-55.
8. Koel M. // Crit. Rev. Anal. Chem. 2005. Vol. 35. P. 177-
192.
28. Чмутова М.K., Литвина М.Н., Прибылова Г.А.
и др. // Радиохимия. 1995. Т. 37, № 5. С. 430-435.
9. Dietz M. L. // Sep. Sci. Technol. 2006. Vol. 41. P. 2047-2063.
29. Dai S., Ju Y.H., Barnes C.E. // J. Chem. Soc., Dalton
10. Mincher M.E., Quach D.L., Liao Y.J. et al. // Solvent
Trans. 1999. P. 1201-1202.
Extr. Ion Exch. 2012. Vol. 30. P. 735-747.
11. Kubota F., Baba Y., Goto M. // Solvent Extr. Res. Dev.
30. Dietz M.L., Dzielawa J.A. // Chem. Commun. 2001.
Jpn. 2012. Vol. 19. P. 17-28.
P. 2124-2125.
12. Billard I. // Handbook on the Physics and Chemistry
31. Luo H., Dai S., Bonnesen P.V. et al. // Solvent Extr. Ion
of Rare Earths. Ams terdam: Elsevier 2013. Vol. 43.
Exch. 2006. Vol. 24. P. 19-31.
Ch. 256. P. 213-273.
32. Туранов А.Н., Карандашев В.K., Яркевич А.Н. // Ра-
13. Nakashima K., Kubota F., Maruyama T., Goto M. //
диохимия. 2018. Т. 60, № 2. С. 153-158.
РАДИОХИМИЯ том 63 № 2 2021