РАДИОХИМИЯ, 2021, том 63, № 2 с. 110-120
УДК 546.791.6
ПОЛУЧЕНИЕ И ИССЛЕДОВАНИЕ УРАНАТОВ
РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ СОСТАВА
LnU3O10.5∙6H2O (Ln - La, Ce, Pr, Nd, Sm),
LnU6O19.5∙10H2O (Ln - Nd, Sm, Eu, Gd, Tb, Dy)
И LnU2O7.5 (Ln - Dy, Ho, Er, Tm, Yb, Lu)
© 2021 г. Н. Г. Черноруков, О. В. Нипрук*, K. А. Клиньшова,
Г. Н. Черноруков, О. Н. Тумаева
Нижегородский государственный университет им. Н.И. Лобачевского,
603950, Нижний Новгород, пр. Гагарина, д. 23а
* e-mail: nipruk@yandex.ru
Получена 23.10.2019, после доработки 13.12.2019, принята к публикации 18.12.2019
Взаимодействием синтетического скупита UO3∙2.25H2O с водными растворами нитратов La, Ce, Pr, Nd,
Sm, Eu,Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu в гидротермальных условиях при температуре 200°С и различной
кислотности реакционной среды получено 17 неизвестных ранее индивидуальных кристаллических
соединений состава LnU3O10.5·6H2O (Ln - La, Ce, Pr, Nd, Sm), LnU6O19.5·10H2O (Ln - Nd, Sm, Eu, Gd,
Tb, Dy), LnU2O7.5 (Ln - Dy, Ho, Er, Tm, Yb, Lu). Методами химического анализа, рентгенографии, ИК
спектроскопии и термографии установлен их состав и строение, изучены процессы дегидратации и
термораспада. Показано влияние радиусов и электронного строения атомов на состав и строение полу-
ченных соединений.
Ключевые слова: уранаты, редкоземельные элементы, синтез, рентгенография, ИК спектроскопия,
термография.
DOI: 10.31857/S0033831121020027
ВВЕДЕНИЕ
синтезированные уранаты имеют различный со-
став и строение. Наиболее вероятной причиной на-
блюдаемых различий был назван весьма широкий
Уранаты редкоземельных элементов являются
диапазон значений ионных радиусов (могут быть
хорошей экспериментальной базой для установле-
рассмотрены системы других радиусов), которые
ния факторов, определяющих возможность синтеза
изменяются от rион = 0.68 Å для Li до rион = 1.65 Å
соединений заданного состава и строения. Среди
для Cs, определяя тем самым различную форму ко-
таких факторов можно выделить размерные пара-
ординационных полиэдров M(I).
метры атомов редкоземельных элементов в виде
их радиусов, а также вид валентных электронов
Наряду с этим в работах [6-8] на примере ряда
(6s25d14f n) и вакантных электронных орбиталей
уранатов 3d-переходных элементов Mn, Co, Ni, Cu,
типа 6p65dn. Для оценки вклада этих факторов при
Zn в степени окисления +2 было установлено, что
формировании индивидуальных соединений ранее
близость значений ионных радиусов, лежащих в
в условиях гидротермального синтеза были получе-
диапазоне 0.74-0.91 Å, соответствующем октаэдри-
ны уранаты щелочных элементов от лития до цезия
ческой координации, является главной причиной,
[1-5]. При этом было установлено, что при полном
определяющей полное подобие в составе и стро-
подобии вида валентных s-электронов и вакантных
ении уранатов 3d-переходных элементов. Извест-
электронных p- и d-орбиталей щелочных элементов
ны и другие работы [9-11], в которых показано,
110
ПОЛУЧЕНИЕ И ИССЛЕДОВАНИЕ УР
АНАТОВ
111
что фактором, определяющим подобие в составе и
чен их состав и строение, исследованы состояние
строении уранатов, являются геометрические раз-
и роль Н2О в формировании структуры, установ-
меры атомов структурообразующих элементов, а
лены границы размерных параметров атомов РЗЭ
подобие в их электронном строении носит вторич-
(rLn3+/rO2-), величины которых лимитируют возмож-
ный характер.
ность образования уранатов заданного состава и
строения.
Для редкоземельных элементов, включая La и
Ln, характерно одинаково направленное действие
фактора подобия их внешних валентных 6s25d1
ЭКСПЕРИМЕНТАЛНАЯ ЧАСТЬ
электронов и фактора близости размерных пара-
метров (rLn3+), определяющих форму коорди-
Для синтеза соединений LnU3O10.5∙6H2O (Ln -
национных полиэдров РЗЭ. Однако эффект
La, Ce, Pr, Nd, Sm), LnU6O19.5∙10H2O (Ln - Nd, Sm,
Eu, Gd, Tb), LnU2O7.5 (Ln - Dy, Ho, Er, Tm, Yb, Lu)
лантанидного сжатия приводит к уменьшению
использовали аналогичный набор реагентов, вклю-
ионных радиусов от 1.03 Å для La до 0.80 Å для
чающий синтетический аналог минерала скупита
Lu. Различие в радиусах первого и последнего
UO3∙2.25H2O [20] и нитраты редкоземельных эле-
лантанида достигает 22%, и это может прояв-
ментов. Синтез триуранатов проводили при рН <
ляться в составе и строении исследуемых ура-
3, гексауранатов - при рН 3-6.5, диуранатов - при
натов.
рН > 6.5. Для этого в тефлоновую ампулу помещали
Уранаты РЗЭ могут быть отнесены к числу со-
500 мг UO3∙2.25H2O и заливали 100 мл 0.5 моль/л
единений, которые будут иметь важное практиче-
раствора Ln(III). Кислотность реакционной смеси
ское значение. Значительная часть редких земель
регулировали способом приготовления раствора
является продуктами деления урана и в весомых
редкоземельного элемента. Значение рН ≈ 3 созда-
количествах содержится в радиоактивных отхо-
вали растворением Ln(NO3)3 (х.ч.) в воде. Для соз-
дах - продуктах топливного ядерного цикла. Такие
дания рН > 3 оксид Ln2O3 заливали эквивалентным
отходы могут служить источником промышленного
количеством азотной кислоты, выдерживали в те-
получения РЗЭ. Информация об уранатах РЗЭ необ-
чение нескольких часов до установления необходи-
ходима при реализации различных разделительных
мого значения рН, затем полученный раствор отде-
схем в процессах переработки урансодержащих ра-
ляли от нерастворившегося осадка фильтрованием.
диоактивных отходов. Сведения о соединениях ура-
Реакционную смесь переносили в тефлоновую ам-
на(VI) и РЗЭ важны для понимания химизма про-
пулу, которую затем помещали в стальной автоклав
цессов формирования и последующей трансформа-
и выдерживали при 200°С в течение 10 ч. Образо-
ции природных соединений урана в минеральные
вавшийся осадок отфильтровывали, промывали ди-
образования вторичного происхождения, поскольку
стиллированной водой и высушивали на воздухе.
такие процессы протекают и в настоящее время в
Концентрацию урана в полученных образцах
связи с использованием значительного количества
определяли фотометрически по реакции с арсена-
уранового сырья в современных ядерных техноло-
зо III (λmax = 650 нм, рН 3) после их растворения
гиях. Несмотря на большую научную и практиче-
в серной кислоте [21]. Редкоземельные элементы
скую значимость исследованию уранатов редкозе-
в водных растворах определяли фотометрическим
мельных элементов посвящено ограниченное число
титрованием 10-3 моль/л раствором трилона Б в
публикаций, включающих синтез, изучение кри-
присутствии ксиленолового оранжевого. Точку эк-
сталлографических и термических свойств безво-
вивалентности находили графически по пересече-
дных соединений состава Ln6UO12 (Ln - La, Nd, Sm,
нию линейных участков кривых фотометрическо-
Eu, Gd) [12-19]. Информация о кристаллогидратах
го титрования [22]. Измерение оптической плот-
уранатов редкоземельных элементов в литературе
ности проводили на спектрофотометре UV-1650
до проведения наших исследований полностью от-
(Shimadzu). Массовую долю Н2О во всех образцах
сутствовала.
определяли весовым методом после их прокалива-
В нижеследующем сообщении представлены
ния при 600°С в течение 2 ч. Рентгенографические
методики синтеза уранатов РЗЭ от La до Lu, изу-
характеристики образцов измеряли на дифрактоме-
РАДИОХИМИЯ том 63 № 2 2021
112
ЧЕРНОРУКОВ и др.
Таблица 1. Результаты химического анализа уранатов редкоземельных элементов
Ln2O3, мас %
UO3, мас %
H2O, маc %
Соединение
rLn3+, Å
rLn3+/rO2-
вычислено
найдено
вычислено
найдено
вычислено
найдено
LaU3O10.5·6H2O
14.4
14.3
76.0
75.9
9.6
9.5
1.04
0.76
CeU3O10.5·6H2O
14.5
14.4
75.9
75.9
9.6
9.5
1.02
0.75
PrU3O10.5·6H2O
14.6
14.5
75.9
75.8
9.6
9.5
1.00
0.74
NdU3O10.5·6H2O
14.8
14.5
75.7
75.6
9.5
9.4
0.99
0.73
NdU6O19.5·10H2O
8.2
8.1
83.1
83.0
8.7
8.7
SmU3O10.5·6H2O
15.3
15.2
75.2
75.1
9.5
9.4
0.97
0.71
SmU6O19.5·10H2O
8.4
8.4
82.9
82.8
8.7
8.7
EuU6O19.5·10H2O
8.5
8.4
82.8
82.7
8.7
8.6
0.95
0.70
GdU6O19.5·10H2O
8.7
8.7
82.6
82.5
8.7
8.6
0.94
0.69
TbU6O19.5·10H2O
8.8
8.7
82.5
82.5
8.7
8.5
0.89
0.65
DyU6O19.5·10H2O
9.0
8.9
82.4
82.3
8.7
8.6
0.88
0.64
DyU2O7.5
24.6
24.5
75.4
75.3
HoU2O7.5
24.8
24.7
75.2
75.1
0.86
0.63
ErU2O7.5
25.1
25.0
74.9
74.8
0.85
0.62
TmU2O7.5
25.2
25.1
74.8
74.7
0.85
0.62
YbU2O7.5
25.6
25.6
74.4
74.3
0.81
0.60
LuU2O7.5
25.8
25.7
74.2
74.1
0.80
0.59
тре XRD-6000 (Shimadzu). Функциональный состав
причиной формульной аналогии среди уранатов La,
уранатов определяли с помощью ИК спектрометра
Ce, Pr, Nd, Sm следует считать близость ионных ра-
FTIR-8400s (Shimadzu). Термическую устойчивость
диусов La, Ce, Pr, Nd, Sm в границах от 1.03 Å для
изучали методом дифференциальной сканирующей
La до 0.97 Å для Sm, что характерно для семерной и
калориметрии на приборе Labsis фирмы Setaram.
более высокой координации [23] в структуре кисло-
родных полиэдров РЗЭ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Вторая группа уранатов имеет состав
LnU6O19.5∙10H2O и включает производные Nd, Sm,
В табл. 1 приведены результаты химического
Eu, Gd, Tb, Dy, она частично перекрывается с пер-
анализа уранатов РЗЭ. Здесь же представлены зна-
вой группой. Перекрывание первой и второй груп-
чения ионных радиусов РЗЭ по Белову и Бокию
пы уранатов может быть обусловлено практически
для координационного числа 6, а также отношения
совпадающим интервалом rLn3+/rO2-, объединяю-
rLn3+/rO2-, которые могут быть использованы для
щим их координационные возможности. Соедине-
ориентировочной оценки наиболее вероятной фор-
ния второй группы могут быть синтезированы толь-
мы металл-кислородных координационных поли-
ко в слабокислых растворах при рН 36.5. В более
эдров РЗЭ в составе исследуемых уранатов.
кислой среде (рН < 3) образуются уранаты, принад-
лежащие первой группе.
В соответствии с представленными в табл. 1 ре-
зультатами следует ожидать получения трех групп
Третья группа уранатов РЗЭ состава LnU2O7.5
уранатов РЗЭ. K первой группе могут быть отнесе-
объединяет производные Dy, Ho, Er, Tm, Yb, Lu. Она
ны формульные аналоги состава LnU3O10.5∙6H2O.
может быть синтезирована при рН > 6.5 и примени-
Эта группа включает уранаты от лантана до са-
тельно к данному ряду РЗЭ не может быть получена
мария. Для РЗЭ, расположенных в периодической
в виде соединений иного состава и строения.
системе после самария, получить представителей
Влияние кислотности среды на состав образу-
данной группы не удалось. Наиболее вероятной
ющихся соединений является следствием сложных
РАДИОХИМИЯ том 63 № 2 2021
ПОЛУЧЕНИЕ И ИССЛЕДОВАНИЕ УР
АНАТОВ
113
Таблица 2. Рентгенографические характеристики уранатов РЗЭ
LnU3O10.5∙6H2O
La
Ce
Pr
Nd
Sm
d, Å
I, %
d, Å
I, %
d, Å
I, %
d, Å
I, %
d, Å
I, %
7.047
49
7.081
51
7.036
48
7.025
49
7.047
47
6.018
20
6.059
19
6.115
21
5.961
19
6.009
18
3.476
96
3.493
95
3.491
91
3.472
87
3.474
96
3.115
100
3.127
100
3.110
100
3.114
100
3.106
100
2.765
19
2.768
18
2.767
16
2.756
11
2.755
15
2.475
23
2.475
21
2.438
21
2.463
19
2.463
18
2.455
24
2.438
25
2.349
27
2.348
28
2.348
30
2.278
22
2.281
12
2.273
14
2.275
9
2.275
15
2.168
16
2.167
14
2.165
11
2.166
10
2.155
9
2.001
33
2.003
33
2.004
34
2.001
19
2.001
19
1.919
33
1.938
29
1.921
31
1.931
28
1.931
22
1.883
12
1.894
13
1.905
18
1.883
9
1.881
11
LnU6O19.5∙10H2O
Nd
Sm
Eu
Gd
Tb
Dy
d, Å
I, %
d, Å
I, %
d, Å
I, %
d, Å
I, %
d, Å
I, %
d, Å
I, %
7.510
60
7.492
70
7.453
83
7.439
86
7.435
70
7.431
65
6.405
3
6.323
4
6.345
3
6.329
5
6.326
4
6.335
3
6.106
5
6.125
6
6.036
3
6.044
5
6.050
5
6.057
4
5.595
8
5.618
6
5.582
8
5.571
5
5.578
7
5.575
7
4.606
10
4.595
12
4.578
10
4.567
13
4.563
10
4.559
10
4.387
9
4.364
9
4.354
7
4.350
8
4.349
8
4.352
7
3.824
5
3.834
4
3.819
4
3.818
5
3.816
5
3.811
5
3.734
25
3.719
25
3.707
29
3.707
29
3.698
27
3.693
26
3.566
10
3.552
11
3.539
13
3.534
12
3.544
12
3.531
13
3.477
85
3.476
77
3.469
75
3.467
78
3.453
85
3.469
86
3.395
32
3.395
30
3.386
29
3.386
31
3.387
32
3.388
33
3.344
4
3.353
11
3.341
13
3.336
12
3.340
11
3.341
12
3.154
100
3.150
100
3.143
100
3.141
100
3.142
100
3.143
100
2.890
6
2.877
12
2.870
13
2.867
13
2.869
14
2.873
14
2.860
15
2.848
19
2.843
19
2.842
22
2.839
20
2.838
22
2.540
29
2.534
34
2.530
28
2.527
31
2.526
31
2.525
30
2.492
14
2.484
17
2.476
14
2.475
17
2.472
17
2.471
17
2.246
19
2.246
14
2.242
15
2.241
13
2.243
16
2.243
17
2.065
6
2.062
8
2.060
6
2.058
6
2.059
9
2.060
10
1.991
45
1.989
46
1.987
36
1.986
37
1.986
45
1.986
48
1.937
18
1.936
17
1.935
14
1.933
13
1.933
20
1.933
21
1.928
19
1.922
21
1.924
14
1.912
16
1.911
18
1.907
19
1.861
18
1.859
23
1.857
15
1.856
18
1.856
25
1.857
26
РАДИОХИМИЯ том 63 № 2 2021
114
ЧЕРНОРУКОВ и др.
Таблица 2. (Продолжение)
LnU2O7.5
Dy
Ho
Er
Tm
Yb
Lu
d, Å
I, %
d, Å
I, %
d, Å
I, %
d, Å
I, %
d, Å
I, %
d, Å
I, %
4.169
36
4.156
33
4.152
33
4.133
31
4.128
39
4.099
36
3.515
6
3.537
8
3.531
6
3.529
7
3.485
8
3.489
8
3.437
100
3.437
100
3.436
100
3.432
100
3.430
100
3.429
100
3.180
19
3.184
23
3.181
21
3.188
18
3.185
19
3.183
12
2.856
6
3.845
9
2.857
8
2.855
6
2.855
8
2.860
7
2.649
59
2.650
50
2.637
51
2.635
53
2.630
58
2.629
56
2.085
6
2.077
7
2.067
8
2.063
5
2.059
8
2.057
6
1.987
12
1.984
14
1.991
14
1.981
13
1.977
12
1.971
16
1.963
9
1.934
6
1.936
6
1.931
7
1.929
7
1.929
8
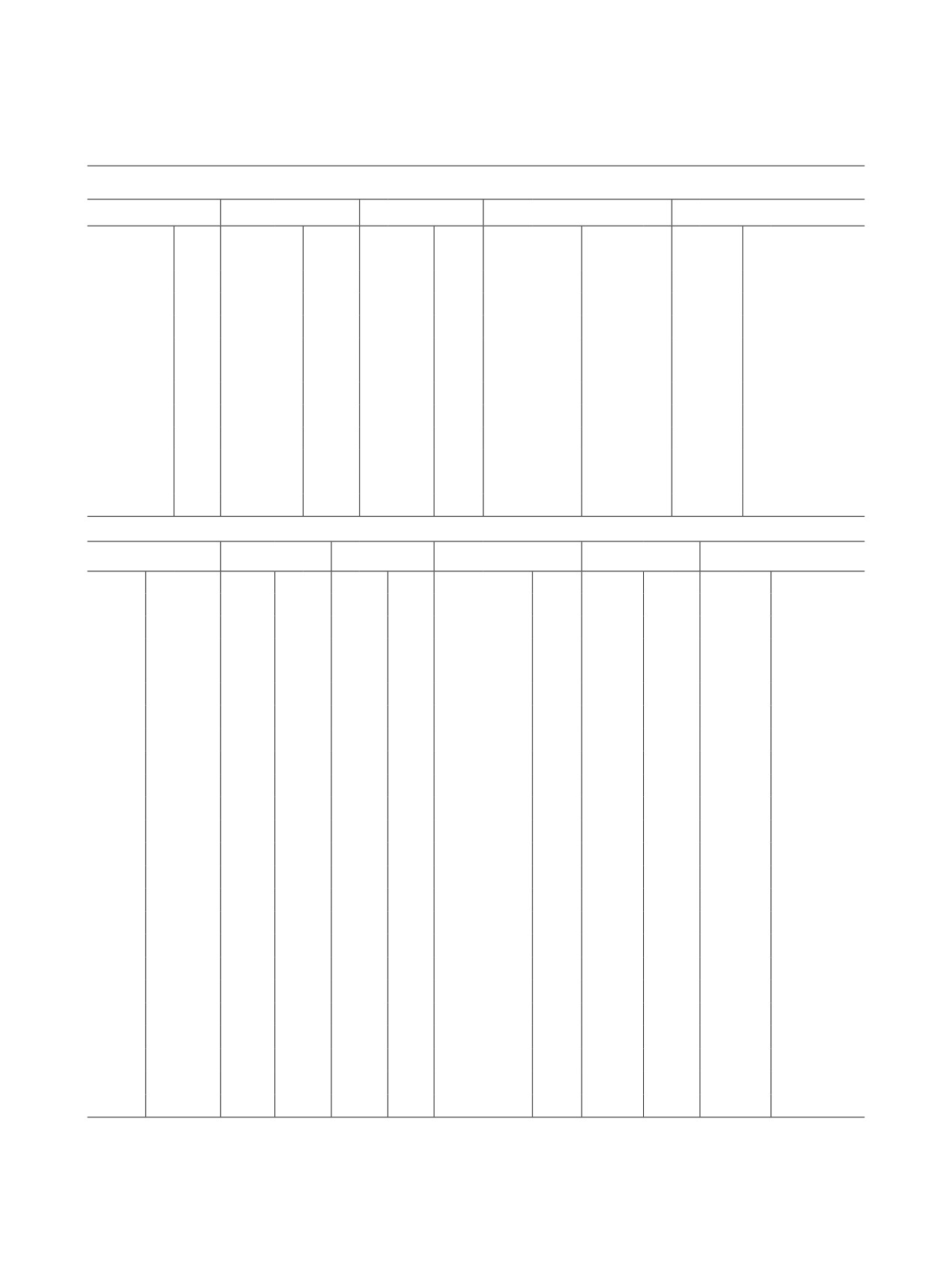
гетерогенных равновесий с участием различных
даже щелочных средах конверсия U(VI) продолжа-
ионных и молекулярных форм урана(VI) в растворе.
ется и приводит к образованию в растворах лишь
Ранее в статьях [24-27] на примере уранофосфатов,
анионных форм урана, исключающих участие ура-
ураноарсенатов, уранованадатов, ураносиликатов
нильных функциональных групп в реакции синтеза.
и ураногерманатов было показано, что химическое
Для установления причин, определяющих воз-
состояние U(VI) в растворах его солей в значитель-
можность отнесения уранатов РЗЭ к группам фор-
ной степени зависит от кислотности реакционной
мульных аналогов, рассмотрим особенности их
среды. Так, в приведенной на рис. 1 диаграмме,
строения.
рассчитанной по методике, изложенной в работах
Приведенные в табл. 2 и на рис. 2 результаты
[25, 26], показано, что в нитратных растворах при
рентгенофазового анализа показывают, что все при-
рН ≤ 3 практически весь уран(VI) находится в виде
надлежащие первой группе уранаты La, Ce, Pr, Nd,
уранильных групп UOδ+, а заряд всех ионных форм
урана(VI) имеет положительное значение. В менее
I
La
кислых средах при 3 < рН < 6.5 заряд ионных и мо-
лекулярных форм U(VI) уменьшается до нулевых и
даже отрицательных значений. В слабощелочных и
Ce
2
1
(UO2)3(OH)7 UO2(OH)4
2+
UO2
+
0.8
(UO2)4(OH)7
Pr
+
(UO2)3(OH)5
0.6
Nd
(UO2)2(OH)22+
0.4
-
(UO2)3(OH)3
0.2
(UO2)2(OH)3-
(UO2)(OH)0
Sm
0
0
2
4
6
8
10
12
14
pH
10
15
20
25
30
35
40
45
50
Рис. 1. Диаграмма состояния U(VI) в водных растворах
2θ, град
(СU = 1 × 10-2 моль/л, - мольная доля соответствующей
формы).
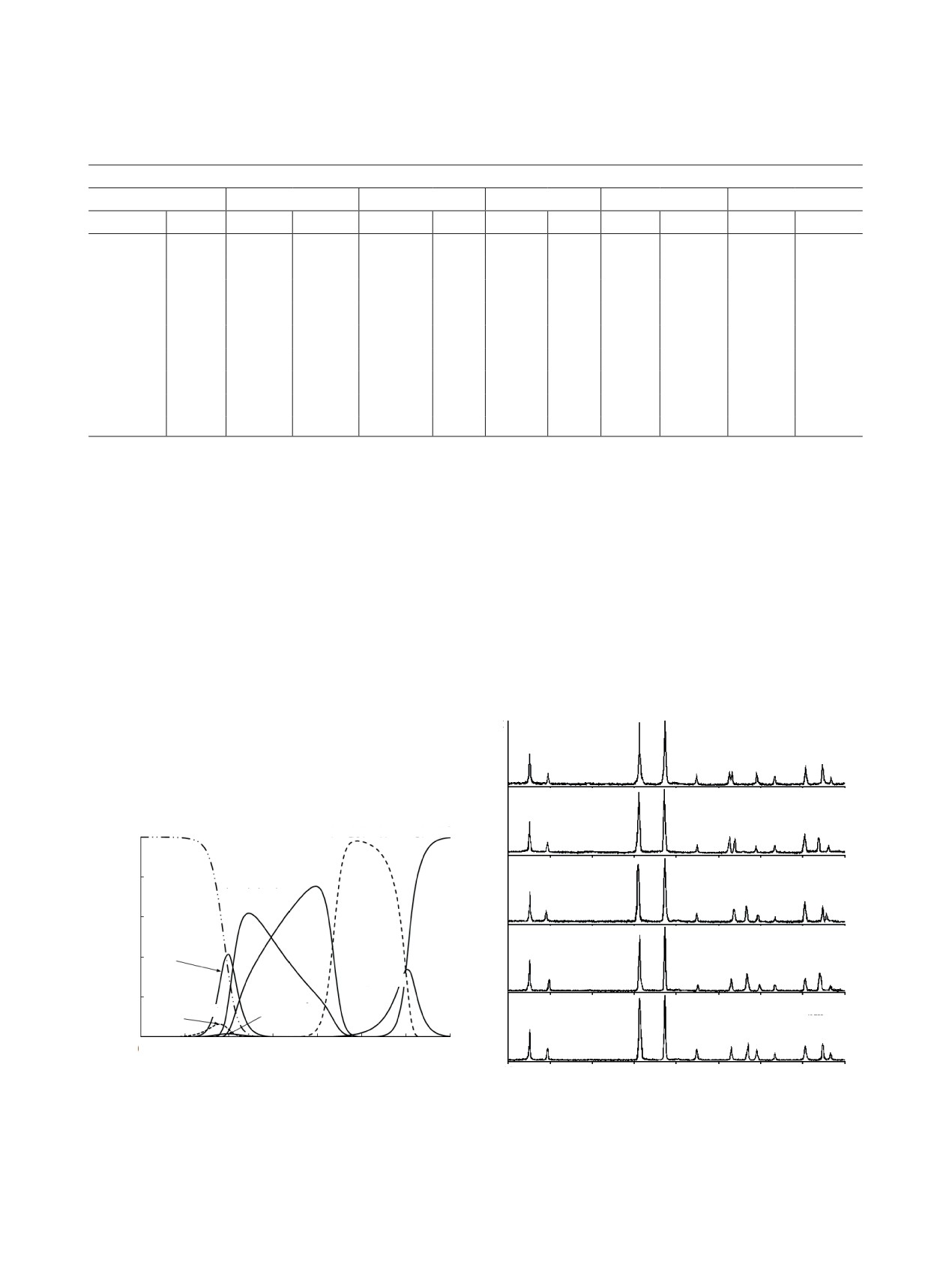
Рис. 2. Рентгенограммы соединений LnU3O10.5∙6H2O.
РАДИОХИМИЯ том 63 № 2 2021
ПОЛУЧЕНИЕ И ИССЛЕДОВАНИЕ УР
АНАТОВ
115
Sm состава LnU3O10.5∙6H2O являются кристалло-
T, °C
графически подобными соединениями. Каждому из
Т
них соответствует сходный по положению на оси
500
ТГ
2θ и относительной интенсивности максимумов
2
отражения набор межплоскостных расстояний с
400
4
индексами hkl. Это позволяет считать, что уранаты
6
данной группы являются полными кристаллогра-
фическими аналогами.
300
8
На каждой из представленных на рис. 2 диф-
10
рактограмм в области малых углов 2θ присутству-
216
200
12
ют весьма интенсивные максимумы отражения,
14
свидетельствующие о слоистом характере струк-
туры. Ниже при анализе данных ИК спектроско-
100
ДТА
16
пии и термографии будет показано, что слои вида
66
[(UO2)3O4.5]δ- или [U3O10.5]
δ- содержат только по-
лиэдры урана, которые объединены в трехмерную
10
20
30
40
50
Время, мин
решетку катионными формами межслоевых атомов
Lnδ+ в форме координационных полиэдров LnOn.
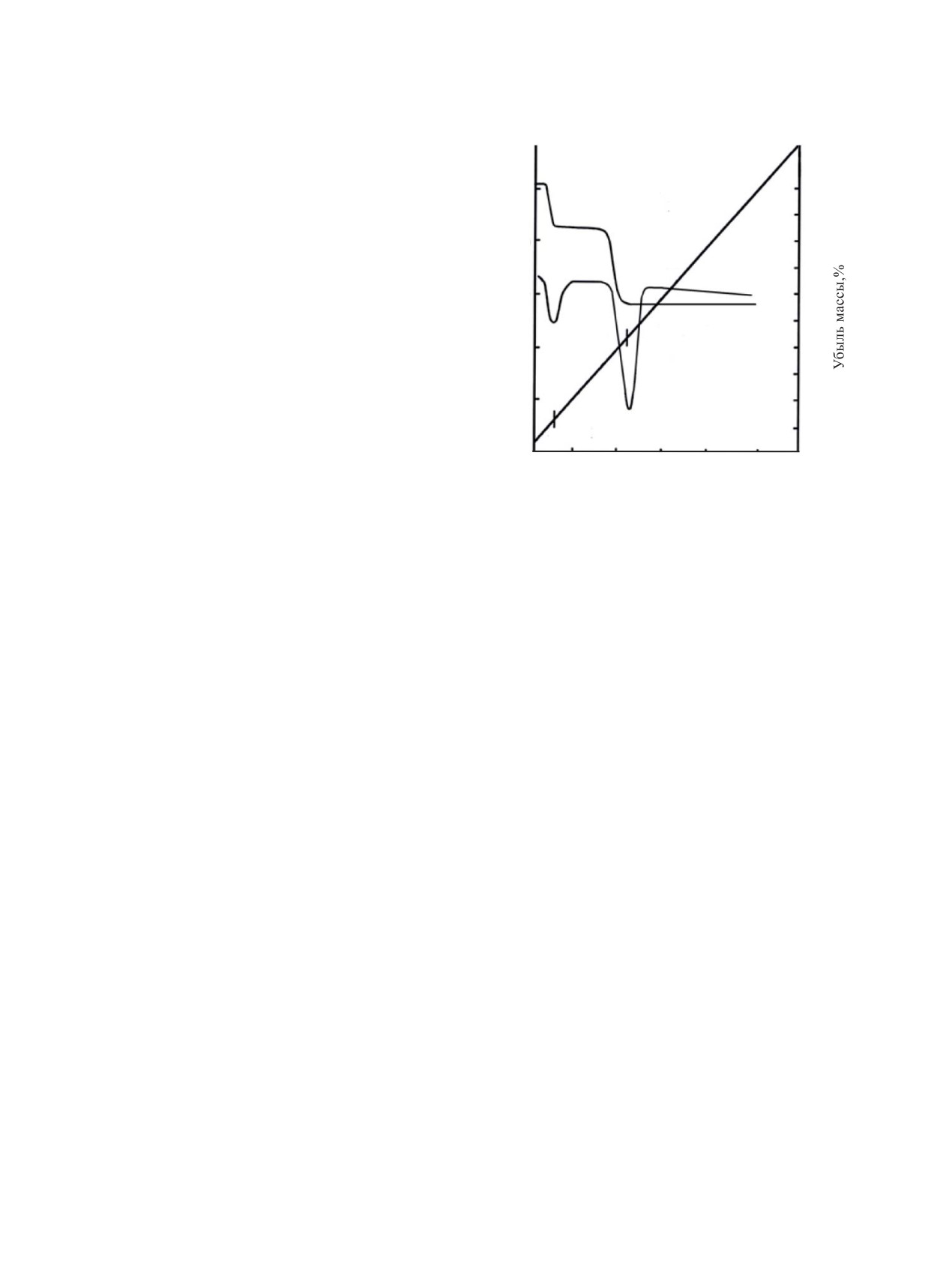
Рис. 3. Термограмма соединения LаU3O10.5∙6H2O.
В качестве многочисленных примеров такого типа
структуры в соединениях U(VI) можно привести
дегидратации в сторону их увеличения от произво-
скупит [20], фосфаты [28], арсенаты [29] и др [30].
дных La к производному Sm. Удаление 2 молекул
Для оценки функционального состава и специ-
Н2О в расчете на формульную единицу соединения
фики строения соединений LnU3O10.5∙6H2O было
проходит одностадийно в соответствии с первым
эндоэффектом на кривой ДТА при 66°С без изме-
выполнено ИК спектроскопическое исследование.
Все представленные в табл. 3 спектральные дан-
нения дифрактограмм. Такое поведение при деги-
ные, относящиеся к соединениям LnU3O10.5∙6H2O,
дратации в совокупности с данными ИК спектро-
достаточно просты и характеристичны. Они содер-
скопии свидетельствует о том, что 2 молекулы Н2О
жат три группы колебательных частот. Среди них
сохраняют колебательную индивидуальность, не
занимают в структуре соединений самостоятель-
колебания уранильного фрагмента UOδ+, представ-
лены в спектре только одной интенсивной полосой
ных кристаллографических позиций, не входят
νas в интервале 865-874 см-1, что может являться
в координационное окружение РЗЭ, выполняют
следствием его линейности и равноплечности. На-
функцию компенсации заряда слоя и удерживают-
личие в спектре колебаний νas(UOδ+) подтверждает,
ся в структуре слабыми Н-связями. Последующие
4 молекулы Н2О образуют координационное окру-
что уран в соединениях LnU3O10.5∙6H2O проявляет
степень окисления +6.
жение РЗЭ, удерживаются в структуре координаци-
онными связями РЗЭ-О и занимают самостоятель-
Колебания Н2О в спектрах триуранатов представ-
ные кристаллографические позиции. Их удаление
лены полосами δ(НОН) в области 1612-1617 см-1 и
вызывает координационную ненасыщенность РЗЭ
интегральными полосами ν(НО-Н) с максимумами
и, как следствие, разрушение кристаллической ре-
в области 3380 - 3388 см-1 без разделения на νas и νs.
шетки триураната до аморфного состояния. Аморф-
Некоторое смещение полосы δ(НОН) в коротковол-
ные продукты термораспада в интервале 600-800°С
новую область и отсутствие разделения ν(НО-Н)
кристаллизуются с образованием полных кристал-
на νas и νs является следствием участия Н2О в об-
лографических аналогов состава LnU3O10.5.
разовании Н-связей. Для установления механизма
дегидратации триуранатов РЗЭ и оценки места Н2О
Рассмотрим далее гексауранаты состава
LnU6O19.5∙10H2O, где Ln - Nd, Sm, Eu, Gd, Tb, Dy,
в их структуре было выполнено термографическое
исследование. На рис. 3 приведена термограмма
отнесенные нами ко второй группе. Выше отмеча-
LаU3O10.5∙6H2O. Термограммы триуранатов Ce, Pr,
лось, что три- и гексауранаты образуют две незави-
Nd, Sm незначительно отличаются температурами
симые группы индивидуальных кристаллических
РАДИОХИМИЯ том 63 № 2 2021
116
ЧЕРНОРУКОВ и др.
I
Nd
T, °C
T
0
500
Sm
400
2
332°C
Eu
300
4
ДТА
200
6
Gd
100
8
ТГ
Tb
196°С
10
10
20
30
40
50
Время, мин
Dy
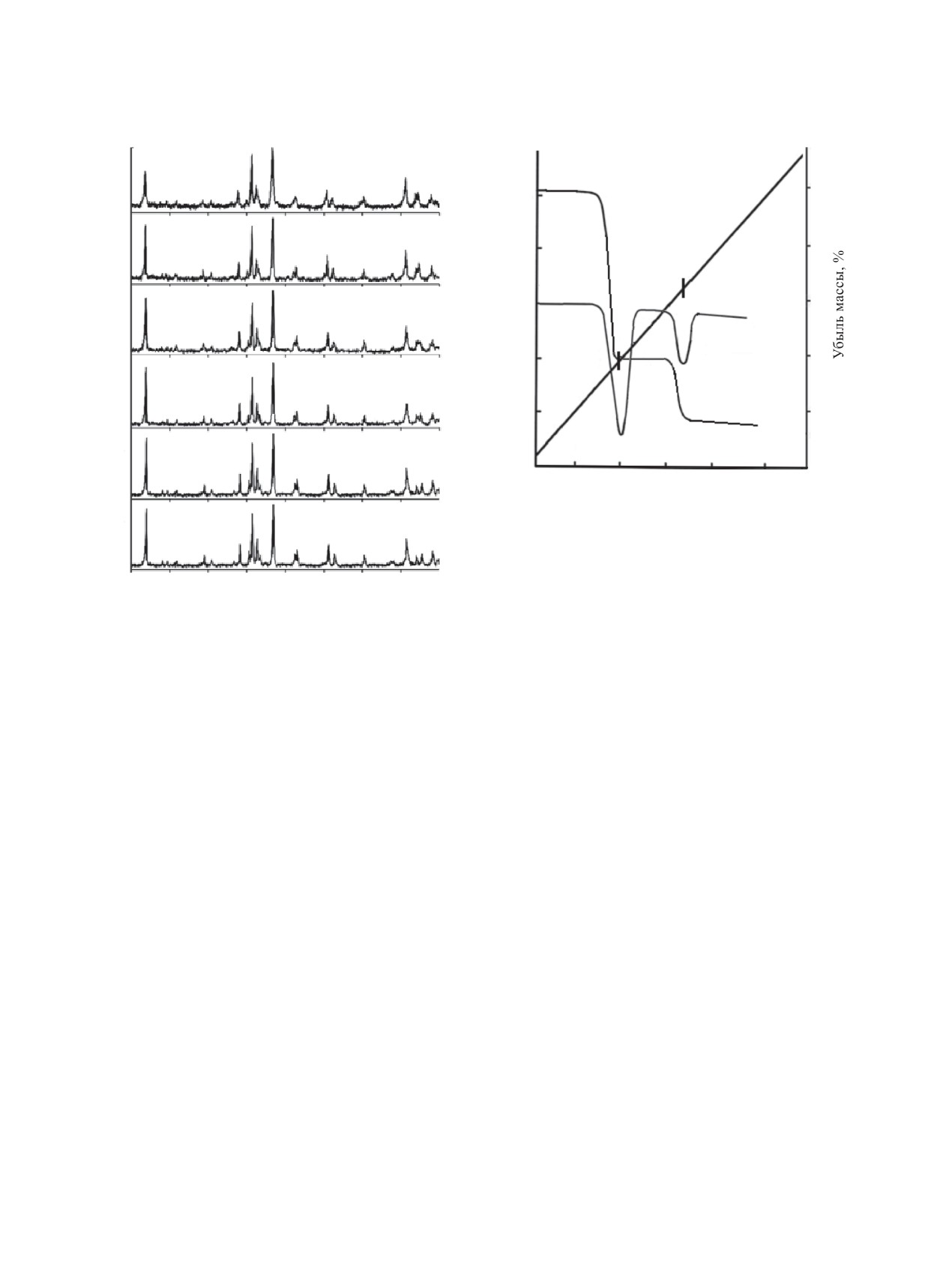
Рис. 5. Термограмма соединения EuU6O19.5∙10H2O.
динационных полиэдров U(VI), Ln и молекул Н2О.
10
15
20
25
30
35
40
45
50
В спектрах хорошо выражены три типа полос по-
2θ, град
глощения. Среди них колебания уранильного фраг-
O.
мента UOδ+, колебания уран-гидроксидных групп
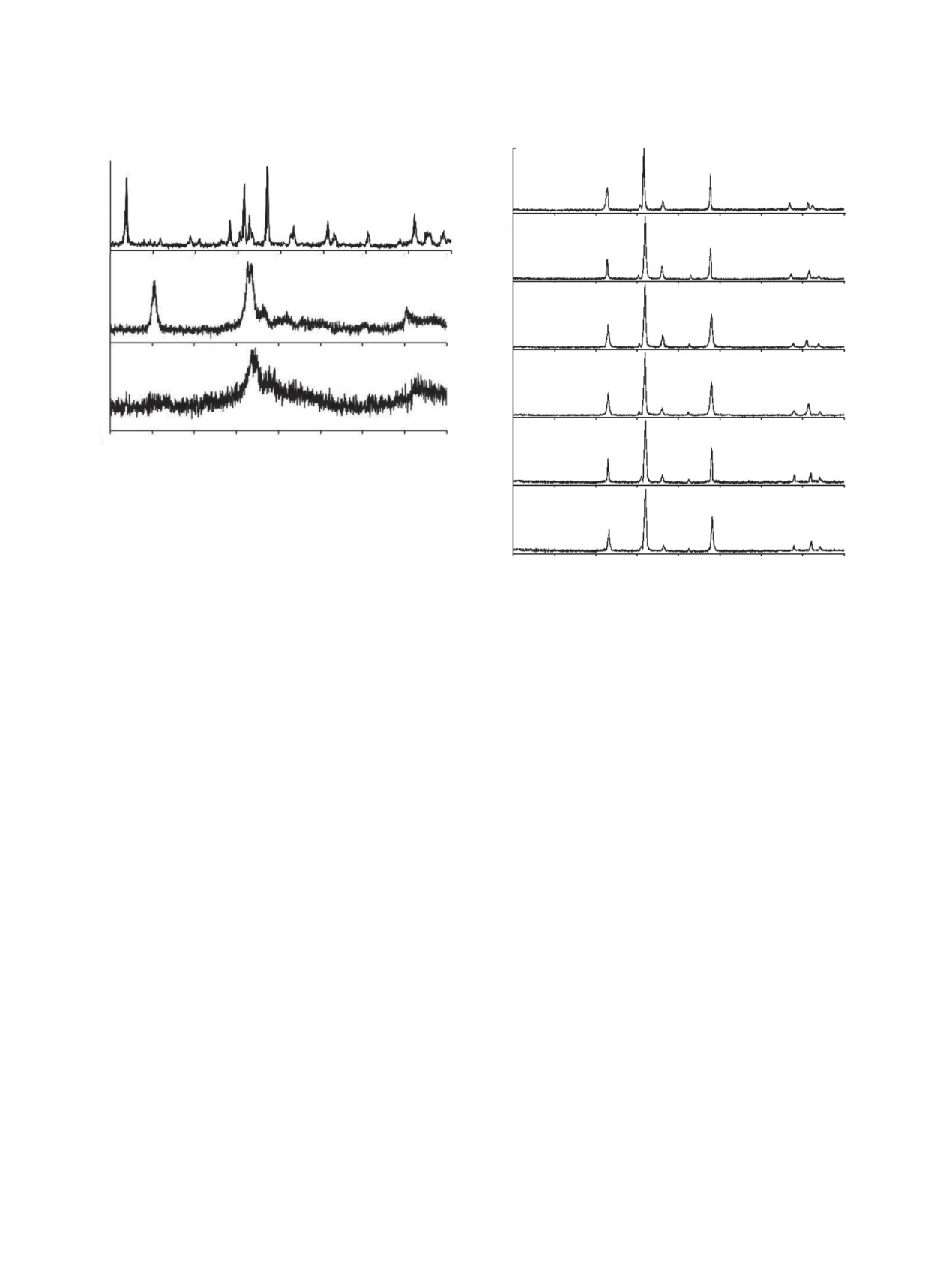
Рис. 4. Рентгенограммы соединений LnU6O19.5∙10H2
UOH и колебания молекулярной Н2О. Колебания
ν(UOδ+) разделены на составляющие νas и νs, что
соединений при участии в синтезах одних и тех
указывает на нелинейную либо неравноплечную
же представителей ряда РЗЭ. Этот результат полу-
конфигурацию уранильного фрагмента UOδ+. При
чен за счет различной кислотности реакционной
среды. Все представленные в табл. 1 соединения
этом для всех гексауранатов положение полос νas и
LnU6O19.5∙10H2O (Ln - Nd, Sm, Eu, Gd, Tb) являют-
νs хорошо согласуется с математической моделью
ся не только формульными, но и кристаллографи-
νs = 0.912νas - 1.04 (см-1), предложенной в работе
ческими аналогами. Рентгенограммы данных сое-
[31]. Полоса δ(Н2О) в спектре каждого гексаурана-
динений содержат наборы максимумов отражения
та смещена в коротковолновую область и находит-
с близкими значениями 2θ и их относительными
ся в интервале 1613-1620 см-1, что, как отмечалось
интенсивностями (табл. 2). На рис. 4 в качестве ил-
выше, является характерным признаком участия
люстрации приведены дифрактограммы всех гекса-
Н2О в образовании Н-связей при сохранении мо-
уранатов. Наличие интенсивных максимумов отра-
лекулярной индивидуальности воды. По этой же
жения в области малых углов 2θ, характерных для
причине колебания νas и νs представлены в спектрах
уранильных соединений, свидетельствует о форми-
интегральными полосами с максимумами в обла-
ровании соединений со слоистым типом структуры.
сти 3471-3475 см-1 наряду с полосами поглоще-
Для оценки функционального состава гексау-
ния, относящимися к ν(Н2О) в молекулярной фор-
ранатов РЗЭ было проведено ИК спектроскопиче-
ме. В ИК спектрах присутствуют полосы в области
ское исследование. В табл. 3 приведено отнесение
3319-3326 см-1, которые могут быть отнесены к ва-
частот. Каждый из спектров содержит одинаковое
лентным колебаниям групп ν(UO-H) в составе по-
число близких по положению и относительной
лиэдров урана. Соответствующие полосы δ(UOH)
интенсивности полос поглощения, что свидетель-
расположены при 961-963 см-1. Это весьма низкие,
ствует об аналогичном характере искажений коор-
но вполне вероятные полосы поглощения при до-
РАДИОХИМИЯ том 63 № 2 2021
ПОЛУЧЕНИЕ И ИССЛЕДОВАНИЕ УР
АНАТОВ
117
Таблица 3. Отнесение полос в ИК спектрах уранатов РЗЭ
Волновое число, см-1
Соединение
ν
(UO2+)
νs(UO2+)
δ(UОН)
ν(UО-Н)
δ(Н2О)
ν(Н2О)
as
LaU3O10.5·6H2O
865 с
1615 с
3388 с
CeU3O10.5·6H2O
874 с
1616 с
3379 с
PrU3O10.5·6H2O
864 с
1614 с
3378 с
NdU3O10.5·6H2O
870 с
1617 с
3376 с
SmU3O10.5·6H2O
868 с
1612 с
3380 с
NdU6O19.5·10H2O
914 c
827 cр
962 сл
3320 пл
1613 с
3473 с
SmU6O19.5·10H2O
914 c
825 cр
963 сл
3319 пл
1620 с
3475 с
EuU6O19.5·10H2O
909 c
824 cр
962 сл
3320 пл
1613 с
3475 с
GdU6O19.5·10H2O
907 c
826 cр
963 сл
3322 пл
1615 с
3472 с
TbU6O19.5·10H2O
906 c
824 cр
962 сл
3324 пл
1617 с
3472 с
DyU6O19.5·10H2O
905 c
825 cр
961 сл
3326 пл
1614 с
3471 с
DyU2O7.5
871 с
HoU2O7.5
869 с
ErU2O7.5
871 с
TmU2O7.5
868 с
YbU2O7.5
870 с
LuU2O7.5
871 с
статочно большой приведенной массе колебатель-
не 3 молекулы Н2О, а эквивалентное им количе-
ного фрагмента UOH.
ство гидроксидных групп в составе соединения
Для оценки состояния и роли Н2О в формиро-
Ln[(UO2)6O4.5(OH)6]. Процесс полной дегидрата-
ции данных соединений завершается в интервале
вании структуры LnU6O19.5∙10H2O было проведе-
температур 302-332°С конденсацией гидроксид-
но термографическое исследование в сочетании
с методом рентгенографии и ИК спектроскопии.
ных групп и образованием аморфной смеси соста-
Термограммы гексауранатов Nd, Sm, Eu, Gd, Tb и
ва Ln2O3∙12UO3.
Dy в целом аналогичны и отличаются лишь тем-
Рассмотрим далее соединения, отнесенные
пературами дегидратации, которые незначитель-
нами к третьей группе производных U(VI) и РЗЭ
но увеличиваются от Nd к Dy. Процесс дегидра-
от Dy до Lu. Характерной особенностью этой
тации протекает в два этапа (кривая ТГ, рис. 5).
группы соединений является близость ионных
Первый эффект на кривой ДТА наблюдается при
радиусов (табл. 1) РЗЭ от 0.88 до 0.80 Å. Соответ-
190-206°С и соответствует удалению 7 из 10 мо-
ствующее им отношение rLn3+/rO2- лежит в узком
лекул Н2О на формульную единицу гексаураната
диапазоне 0.64-0.59, характерном для шестерной
и образованию фазы LnU6O19.5∙3H2O. Удаление
координации. Следует отметить еще одну важную
воды на первом этапе дегидратации приводит к
особенность соединений третьей группы. При осу-
уширению дифракционных максимумов отраже-
ществлении синтеза в гидротермальных условиях
ния и уменьшению их интенсивности (рис. 6). Это
получаемые соединения являются безводными фа-
может указывать на то, что молекулы Н2О удержи-
зами. Это возможно, если U(VI) и Ln в соединении
ваются в структуре гексаураната не только за счет
координационно насыщены и потребность в мо-
Н-связей, но и в результате участия в координаци-
лекулах Н2О как компенсаторе координационной
онном окружении РЗЭ. В ИК спектрах продуктов
емкости отсутствует.
дегидратации состава LnU6O19.5∙3H2O исчезают
полосы ν(Н2О) в интервале 3471-3475 см-1 и по-
В соответствии с представленными в табл. 1
лосы δ(Н2О) при 1613-1620 см-1, но сохраняются
результатами химического анализа все соединения
полосы ν(UO-H) при 3319-3326 см-1 и δ(UOH)
имеют состав LnU2O7.5 и являются формульными
при 961-963 см-1. Такой вид может иметь спектр,
аналогами. Повторные синтезы всех соединений
если в продукте дегидратации будут содержаться
данной группы легко воспроизводимы, и для каж-
РАДИОХИМИЯ том 63 № 2 2021
118
ЧЕРНОРУКОВ и др.
I
I
20°C
Nd
Sm
200°C
Eu
340°C
Gd
Tb
10
15
20
25
30
35
40
45
50
2θ, град
Рис. 6. Рентгенограммы EuU6O19.5∙10H2O и продуктов
его дегидратации при 200 и 340С.
Dy
дого из них характерны близкие значения меж-
10
15
20
25
30
35
40
45
50
плоскостных расстояний и сопоставимые интен-
2θ, град
сивности приведенных в табл. 2 дифракционных
Рис. 7. Рентгенограммы соединений LnU2O7.5.
максимумов. На рис. 7 представлена типичная для
всех диуранатов РЗЭ дифрактограмма диураната
этого типа структуры LnU2O7.5 нами выполнены
гольмия. Судя по отсутствию на дифрактограмме
высокотемпературные рентгеновские измерения в
данного соединения максимумов отражения в об-
широком интервале температур 20-1000°С с ша-
ласти малых углов 2θ, характерных для ураниль-
гом 50°С. В результате установлено, что каждое
ных соединений, слоистый тип структуры диура-
из исследуемых соединений проявляет высокую
ната гольмия и других РЗЭ иттриевой группы не
термическую устойчивость, а их рентгенограммы
реализуется. Вместе с тем, в ИК спектре каждого
содержат полностью идентичные наборы дифрак-
соединения этой группы присутствует единствен-
ционных максимумов отражения до 900°С вклю-
ная полоса поглощения в интервале 868-871 см-1,
чительно. При температуре выше 900-950°С про-
соответствующая антисимметричному валент-
исходит термораспад LnU2O7.5 на кристалличе-
ному колебанию νas группы [O…U…O]δ+ (табл. 3).
ские фазы Ln2O3 и U3O8.
В соответствии с литературными данными [32]
полоса νas(UOδ+) в уран-кислородном полиэдре с
ЗАКЛЮЧЕНИЕ
шестерной координацией U(VI) расположена в об-
ласти 935-940 см-1. Семерная координация приво-
Таким образом, в данном сообщении исследо-
дит к удлинению связей U…O в уранильной груп-
вано 17 неизвестных ранее соединений U(VI) и
пе и понижению волнового числа до 900-915 см-1
редкоземельных элементов. Взаимодействие ура-
[32]. Наблюдаемые нами значения νas(UOδ+) при
на(VI) с РЗЭ от La до Lu приводит к образованию
868-871 см-1 в спектре диуранатов LnU2O7.5 также
трех групп различных по составу и строению ин-
является следствием удлинения связей U…О. Это
приводит к ослаблению роли уранильной группы
дивидуальных кристаллических соединений. В ка-
в формировании слоистого типа структуры. На
ждой группе соединения состава LnU3O10.5∙6H2O
основании изложенного следует считать, что в
(Ln - La, Ce, Pr, Nd, Sm), LnU6O19.5∙10H2O (Ln -
соединениях LnU2O7.5 реализуется не слоистый,
Nd, Sm, Eu, Gd, Tb) и LnU2O7.5 (Ln - Dy, Ho, Er,
а каркасный тип структуры. Для подтверждения
Tm, Yb, Lu) являются полными формульными,
РАДИОХИМИЯ том 63 № 2 2021
ПОЛУЧЕНИЕ И ИССЛЕДОВАНИЕ УР
АНАТОВ
119
кристаллографическими и функциональными
С. 490-493.
аналогами. Внутригрупповое подобие и межгруп-
9. Черноруков Н.Г., Нипрук О.В., Черноруков Г.Н.,
повое различие в составе и строении уранатов
Седелкина О.С. // Радиохимия. 2015. Т. 57, № 4. С.
РЗЭ является примером влияния на структуру
321-323.
соединений так называемого размерного фактора
10. Zhang Y., Aughterson R., Karatchevtseva I., Kong L.,
(rLn3+/rO2-), проявляющегося в РЗЭ в виде ланта-
Tran T.T., Čejka Y., Aharonovich I., Lumpkin G.R. //
нидного сжатия. Уранаты РЗЭ могут быть исполь-
New J. Chem. 2018. Vol. 42, N 15. P. 12386-12393.
зованы как формы химического связывания урана
в природной среде и в различных технологических
11. Черноруков Н.Г., Нипрук О.В., Черноруков Г.Н.,
процессах в виде индивидуальных кристалличе-
Абражеев Р.В., Чаплиёва K.А. // ЖОХ. 2019. Т. 89,
ских соединений.
№ 1. С. 81-86.
ФОНДОВАЯ ПОДДЕРЖКА
12. Hrudananda Jena, Asuvathraman R., Govindan Kutty
K.V. // J. Nucl. Mater. 2000. Vol. 280. P. 312-317.
Исследование выполнено за счет гранта Рос-
13. Krishnaiah M.V., Seenivasan G., Srirama Murti P.,
сийского научного фонда (проект № 19-73-00096).
Mathews C.K. // J. Nucl. Mater. 2002. Vol. 306. P. 10-
14.
КОНФЛИКТ ИНТЕРЕСОВ
14. Venkata Krishnan R., Manikandan P. Hrudananda
Jena, Nagarajan K. // Thermochim. Acta.
2008.
Авторы заявляют об отсутствии конфликта
Vol. 472. P. 95-98.
интересов.
15. Manjulata Sahu, Krishnan K, Saxena MK, Ramakumar
СПИСОК ЛИТЕРАТУРЫ
K.L. // J. Alloys Compds. 2009. Vol. 482. P. 141-146.
1. Черноруков Н.Г., Нипрук О.В., Арова М.И. // ЖНХ.
16. Tang M, Holliday K.S., Jiang C., Valdez J.A.,
2013. Т. 58, № 6. С. 707-709.
Uberuaga B.P., Dickerson P.O., Dickerson R.M.,
Wang Y., Czerwinski K.R., Sickafus K.E. // J. Solid
2. Нипрук О.В., Черноруков Г.Н., Абражеев Р.В., Ко-
State Chem. 2010. Vol. 183, N 4. P. 844-848.
строва Е.Л. // Неорганические материалы. 2017.
Т. 53, № 8. С. 829-833.
17. Venkata Krishnan R., Jena H., Govindan Kutty K.V.,
Nagarajan K. // J. Therm. Anal. Calorim.
2010.
3. Нипрук О.В., Черноруков Н.Г., Кострова Е.Л.,
Vol. 101, N 1. P. 371-377.
Черноруков Г.Н. // Радиохимия. 2015. Т. 57, № 6.
С. 494-497.
18. Krishnan R.V., Babu R., Panneerselvam G.,
4. Черноруков Н.Г., Нипрук О.В., Черноруков Г.Н.,
Ananthasivan K., Antony M.P., Nagarajan K. // Ceram.
Кострова Е.Л., Чаплиева K.А. // Радиохимия. 2015.
Int. 2012. Vol. 38, N 6. P. 5277-5280.
Т. 57, № 5. С. 417-419.
5. Черноруков Н.Г., Нипрук О.В., Кострова Е.Л. //
19. Shukla B., Sanjay Kumar N.R., Sekar M., Chandra
ЖНХ. 2015. Т. 60, № 11. С. 1452-1456.
Shekar N.V., Jena H., Asuvathraman R. // J. Alloys
Compds. 2016. Vol. 672. P. 393-396.
6. Нипрук О.В., Черноруков Н.Г., Чаплиева K.А., Чер-
норуков Г.Н. // Неорганические материалы. 2016.
20. Нипрук О.В., Князев А.В., Черноруков Г.Н., Пыхова
Т. 52, № 5. С. 551-556.
Ю.П. // Радиохимия. 2011. Т. 53, № 2. С. 128-131.
7. Черноруков Н.Г., Нипрук О.В., Князев А.В., Аро-
21. Марков В.К., Верный Е.А., Виноградов А.В. и др.
ва М.И., Чаплиёва K.А. // ЖНХ. 2013. Т. 58, № 1.
Уран. Методы его определения. М.: Атомиздат,
С. 11-16.
1964. 502 с.
8. Нипрук О.В., Черноруков Н.Г., Чаплиева K.А.,
22. Рябчиков Д.И., Рябухин В.А. Аналитическая химия
Черноруков Г.Н. // Радиохимия. 2015. Т. 57, № 6.
РАДИОХИМИЯ том 63 № 2 2021
120
ЧЕРНОРУКОВ и др.
редкоземельных элементов и иттрия. М.: Наука,
27. Нипрук О.В., Черноруков Н.Г., Пыхова Ю.П., Го-
1966. 380 с.
дованова Н.С., Еремина А.А. // Радиохимия. 2011.
Т. 53, № 5. С. 410-415.
23. Урусов В.С. Теоретическая кристаллохимия. М.:
28. Locock A.J., Burn P.C. // Amer. Mineral. 2003.Vol. 88.
Изд-во МГУ, 1987. 275 с.
P. 240-244.
24. Нипрук О.В., Черноруков Н.Г., Захарычева Н.С. //
29. Locock A.J., Burns P.C. // J. Solid State Chem. 2003.
Геохимия. 2018. Т. 56, № 8. С. 798-811.
Vol. 176. P. 18-26.
25. Nipruk O.V., Chernorukov N.G., Zakharycheva N.S.,
30. Krivovichev S., Burns P., Tananaev I. Structural
Kostrova E.L. // J. Radioanal. Nucl. Chem.
2017.
Chemistry of Inorganic Actinide Compounds. Elsevier,
Vol. 311, N 1. P. 519-529.
2007. 504 p.
31. Bagnall K.W., Wakerley M.W. // J. Inorg. Nucl. Chem.
26. Нипрук О.В., Черноруков Н.Г., Еремина А.А., Ко-
1975. Vol. 37. P. 329-330.
строва Е.Л., Чаплиёва K.А. // Радиохимия. 2014.
32. Володько Л.В., Комяк А.И., Умрейко Д.С. Уранило-
Т. 56, № 4. С. 332-338.
вые соединения. Минск: БГУ, 1981. 431 с.
РАДИОХИМИЯ том 63 № 2 2021