РАДИОХИМИЯ, 2021, том 63, № 1, с. 30-36
УДК 542.61:546.65/66
ЭКСТРАКЦИЯ РЗЭ(III), U(VI) И Th(IV)
ИЗ ХЛОРНОКИСЛЫХ РАСТВОРОВ
2,6-БИС(ДИФЕНИЛФОСФОРИЛМЕТИЛ)ПИРИДИН-
N-ОКСИДОМ
© 2021 г. А. Н. Туранова,*, В. К. Карандашевб, В. А. Хвостиковб,
В. Е. Баулинв,г, А. Ю. Цивадзег
а Институт физики твердого тела РАН, 142432, Черноголовка Московской обл., ул. Акад. Осипьяна, д. 2
б Институт проблем технологии микроэлектроники и особо чистых материалов РАН,
142432, Черноголовка Московской обл., ул. Акад. Осипьяна, д. 6
в Институт физиологически активных веществ РАН,
142432, Черноголовка Московской обл., Северный проезд, д. 1
г Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119991, Москва, Ленинский пр., д. 31., корп. 4
*e-mail: turanov@issp.ac.ru
Получена 28.07.2019, после доработки 23.09.2019, принята к публикации 30.09.2019
Изучена экстракция микроколичеств РЗЭ(III), U(VI) и Th(IV) из растворов HClO4 растворами
2,6-бис(дифенилфосфорилметил)пиридин-N-оксида (I) в 1,2-дихлорэтане в зависимости от концен-
трации HClO4 в равновесной водной фазе, определена стехиометрия экстрагируемых комплексов.
Показано, что из разбавленных растворов HClO4 соединение I экстрагирует РЗЭ(III), U(VI) и Th(IV)
значительно более эффективно, чем из растворов HNO3. При увеличении концентрации кислот вели-
чина “перхлоратного” эффекта при экстракции РЗЭ(III) и U(VI) снижается, а Th(IV) экстрагируется
соединением I из растворов HClO4 менее эффективно, чем из растворов HNO3.
Ключевые слова: экстракция, редкоземельные элементы(III), уран(VI), торий(IV), 2,6-бис(дифенил-
фосфорилметил)пиридин-N-оксид
DOI: 10.31857/S0033831121010056
Бидентатные нейтральные фосфороргани-
ны такого “перхлоратного” эффекта обсуждались в
ческие соединения (БНФОС), такие как диоксиды
ряде работ [5, 6, 15, 16]. Этот эффект использован
замещенных алкилендифосфинов (ДОДФ) и ок-
для увеличения эффективности концентрирования
сиды диарил(диалкилкарбамоилметил)фосфинов
U(VI), Am(III) и РЗЭ(III) из растворов азотной и
(КМФО), обладают высокой экстракционной спо-
фосфорной кислот при добавке небольших коли-
собностью по отношению к актинидам и редкозе-
честв HClO4 или перхлоратов щелочных металлов
мельным элементам (РЗЭ) в азотнокислых средах и
в водную фазу [7, 8].
используются для их концентрирования и разделе-
Высокой экстракционной способность по от-
ния в экстракционных [1-3] и сорбционных систе-
ношению к Am(III), U(VI), Th(IV) и РЗЭ(III) в
мах [4]. Было показано, что при переходе от азотно-
азотнокислых и солянокислых средах обладает
кислых к хлорнокислым средам экстракция U(VI),
2,6-бис(дифенилфосфорилметил)пиридин-N-оксид
Am(III) и РЗЭ(III) растворами ДОДФ [5-7], КМФО
(I) [17-19]. Методом рентгеноструктурного анализа
[8-10], другими БНФОС [11], а также замещенны-
установлено, что соединение I является тридентат-
ми дигликольамидами [12, 13] и дипиколинамида-
ным лигандом при комплексообразовании с ионами
ми [14] значительно возрастает. Возможные причи-
РЗЭ(III) и Th(IV) [20]. Тетраалкилзамещенные ана-
30
ЭКСТРАКЦИЯ РЗЭ(III), U(VI) И Th(IV) ИЗ ХЛОРНОКИСЛЫХ РАСТВОРОВ
31
Схема 1
логи соединения I экстрагируют РЗЭ(III) из азотно-
Межфазное распределение ионов U(VI), Th(IV)
кислых растворов значительно менее эффективно
и РЗЭ(III) изучали на модельных растворах 0.003-
[21-23], что указывает на проявление эффекта ано-
6 моль/л HClO4 или 0.01 моль/л NaClO4. Исходная
мального арильного упрочнения экстрагируемых
концентрация ионов U(VI), Th(IV) и каждого из
комплексов (ЭААУ) [24] в системах с этими соеди-
РЗЭ(III) составляла 2 × 10-6 моль/л. Опыты по экс-
нениями. По своей экстракционной способности по
тракции проводили в пробирках с пришлифован-
отношению к Th(IV) и РЗЭ(III) в азотнокислых сре-
ными пробками при комнатной температуре и соот-
дах триоксид I существенно превосходит диоксид
ношении объемов органической и водной фаз 1 : 1.
тетрафенилметилендиоксида IV - один из наиболее
Контакт фаз осуществляли на аппарате для переме-
эффективных экстрагентов актинидов и РЗЭ(III)
шивания со скоростью 60 об/мин в течение 1 ч, что
[19].
достаточно для установления постоянных значений
Влияние аниона ClO– на эффективность экс-
коэффициентов распределения (D).
тракции ионов металлов соединением I ранее не
Концентрацию U(VI), Th(IV) и РЗЭ(III) в ис-
исследовалось. В настоящей работе рассмотрены
ходных и равновесных водных растворах опреде-
некоторые закономерности распределения ионов
ляли методом масс-спектрометрии с ионизацией
U(VI), Th(IV) и РЗЭ(III) между водными раство-
в индуктивно связанной плазме с использованием
рами HClO4 и NaClO4 и растворами триоксида I в
масс-спектрометра X-7 (Thermo Elemental, США)
1,2-дихлорэтане. Для сравнения приведены данные
по ранее описанной методике [28]. Содержание
по экстракции диоксидами II-IV (схема 1).
элементов в органической фазе определяли после
реэкстракции раствором 0.1 моль/л оксиэтилиден-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
дифосфоновой кислоты, которая образует устойчи-
вые комплексы с ионами металлов в водной фазе
Синтез
2,6-бис(дифенилфосфорилметил)пири-
[29]. Коэффициенты распределения элементов
дина (II) описан в работе [25], 2,6-бис(дифенилфос-
(D) рассчитывали как отношение их концентра-
форилметил)пиридин N-оксид (I) получен окисле-
ций в равновесных фазах. Погрешность определе-
нием соединения II пероксидом водорода согласно
ния коэффициентов распределения не превышала
методике [20]. Диоксид тетрафенилметилендифос-
5%. Концентрацию HClO4 в равновесных водных
фина (IV) и 2,6-бис(дифенилфосфорилметил)бензол
фазах определяли потенциометрическим титро-
(III) получены по известным методикам [26, 27].
ванием стандартизированным раствором NaOH.
В экспериментах по экстракции в качестве
Концентрацию ионов ClO– в органической фазе
органического
растворителя
использовали
определяли
экстракционно-фотометрическим
1,2-дихлорэтан х.ч. без дополнительной очистки.
методом с метиленовым синим при λ = 655 нм
Растворы реагентов готовили по точным навескам.
[30] с использованием спектрофотометра UNICO
РАДИОХИМИЯ том 63 № 1 2021
32
ТУРАНОВ и др.
lg DLn
I
3
1
IV
2
0.8
1
0.6
II
0
0.4
III
0.2
-1
-2
0
0
1
2
3
La Cе Pr Nd Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
[HCIO4], моль/л
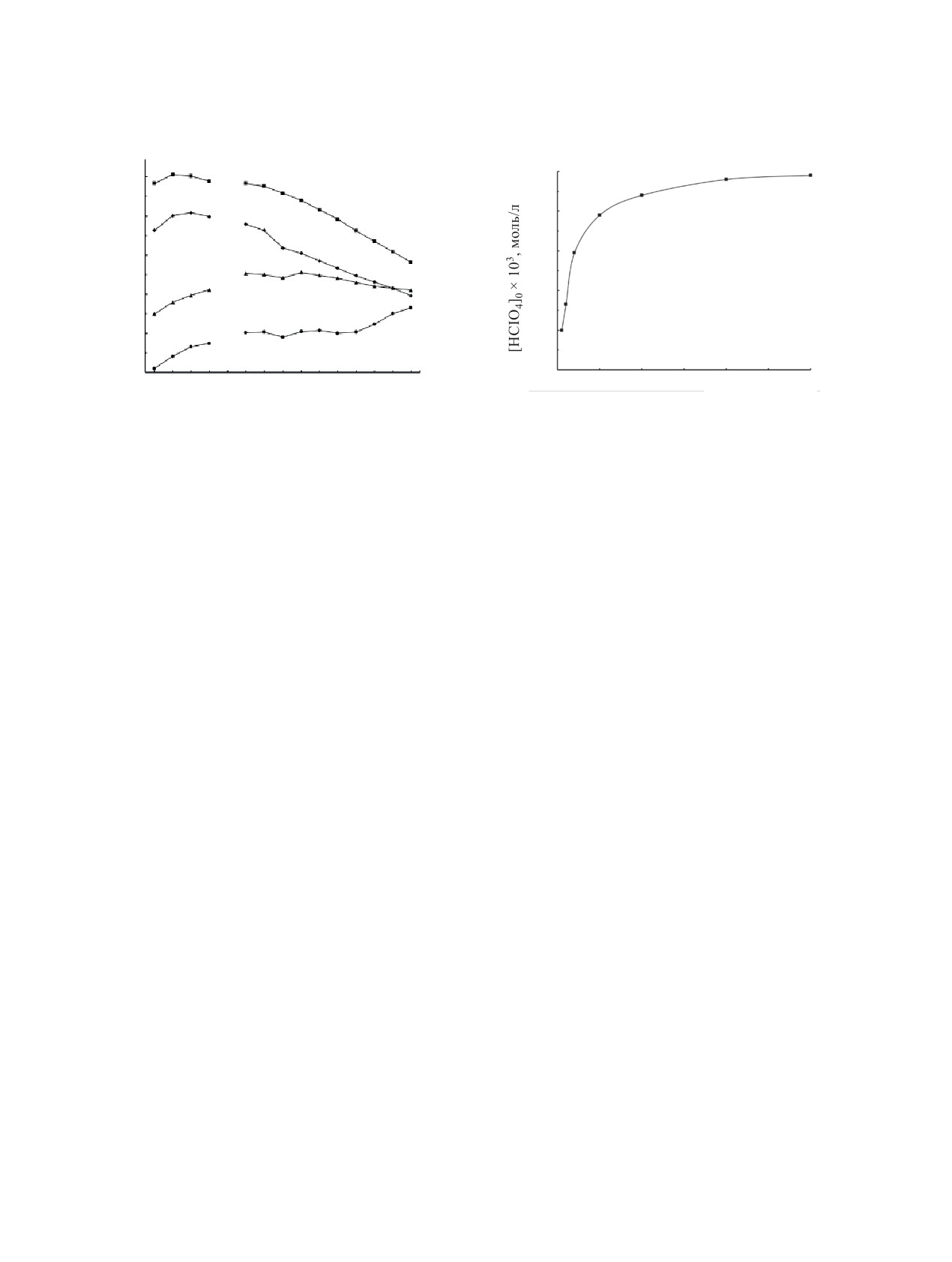
Рис. 1. Экстракция РЗЭ (III) из раствора 0.01 моль/л
NaClO4 растворами
0.001 моль/л соединения I,
0.005 моль/л соединений II и IV и 0.01 моль/л соедине-
Рис. 2. Экстракция HClO4 раствором 0.001 моль/л соеди-
ния III в дихлорэтане. рН 4.1.
нения I в дихлорэтане.
1201 (United Products & Instruments Inc., США).
кулах соединений I-IV заметно влияет на внутри-
Параллельно определяли содержание HClO4 в орга-
групповую селективность экстракции РЗЭ(III) (рис.
нической фазе при экстракции чистым дихлорэта-
1). Для соединений I и IV наблюдается уменьше-
ном (холостой опыт). Результаты холостого опыта
ние DLn по мере увеличения Z. Такой же характер
учитывали при расчете общей концентрации ком-
зависимости lg DLn-Z отмечался при экстракции
плексов экстрагентов с HClO4 в органической фазе.
РЗЭ(III) из нитратных растворов БНФОС с метиле-
новым мостиком между фосфорильными группами
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
[32-34]. Ранее отмечалось, что увеличение дли-
ны алкиленового мостика в молекулах диоксидов
Сопоставлена
эффективность экстракции
Ph2P(O)(CH2)nP(O)Ph2 приводит к инверсии зави-
РЗЭ(III) соединениями I-IV из слабокислых (рН 4.1)
симости lg DLn-Z [35]. Следствием этого является
перхлоратных растворов, когда ограничено влияние
последовательное уменьшение величины фактора
связывания экстрагента в результате соэкстракции
разделения La и Lu (βLa/Lu = DLa/DLu) в ряду этих ди-
HClO4. При экстракции из растворов 0.01 моль/л
оксидов по мере увеличения n [35]. При экстракции
NaClO4 триоксид I значительно превосходит по
диоксидом III наблюдается тенденция увеличения
своей экстракционной способности диоксиды II-
DLn в ряду РЗЭ(III) от La(III) к Lu(III) (рис. 1).
IV (рис.
1).
2,6-Бис(дифенилфосфорилметил)пи-
Поскольку экстракция ионов металлов из рас-
ридин II экстрагирует РЗЭ(III) значительно более
творов кислот нейтральными экстрагентами сопро-
эффективно, чем диоксид III, что указывает на
вождается взаимодействием экстрагента и кислоты,
участие пиридинового атома азота в комплексо-
приводящим к снижению концентрации свободно-
образовании с ионами Ln3+. Участие фосфориль-
го экстрагента в равновесной органической фазе,
ных групп и пиридинового атома азота молекулы
рассмотрено распределение HClO4 между фазами
2,6-бис(дифенилфосфорил)пиридина в комплек-
в процессе экстракции. Из данных, представлен-
сообразовании с ионом La3+ установлено методом
ных на рис. 2, видно, что хлорная кислота образу-
ЯМР [31]. Диоксид IV существенно превосходит
ет с триоксидом I комплекс состава 1 : 1. Отметим,
соединение II по своей экстракционной способ-
что экстракционная способность соединения I по
ности по отношению к легким РЗЭ(III), однако
отношению к HClO4 значительно превышает тако-
различие в экстракционной способности этих сое-
вую оксида дифенил(дибутилкарбамоилметил)фос-
динений, DLn(IV)/DLn(II), снижается по мере увели-
фина (КМФО Ph2Bu2) и диоксида IV: при равной
чения атомного номера (Z) РЗЭ (рис. 1). Структура
кислотности водной фазы концентрация HClO4 в
мостика между фосфорильными группами в моле-
равновесной органической фазе, содержащей со-
РАДИОХИМИЯ том 63 № 1 2021
ЭКСТРАКЦИЯ РЗЭ(III), U(VI) И Th(IV) ИЗ ХЛОРНОКИСЛЫХ РАСТВОРОВ
33
4
lg DLn
lg D
3
3
2
2
2
1
1
3
1
0
1
2
4
-1
6
5
3
0
-2
-3
-2
-1
0
1
-3
-2
-1
0
1
lg [HCIO4]
lg [HCIO4]
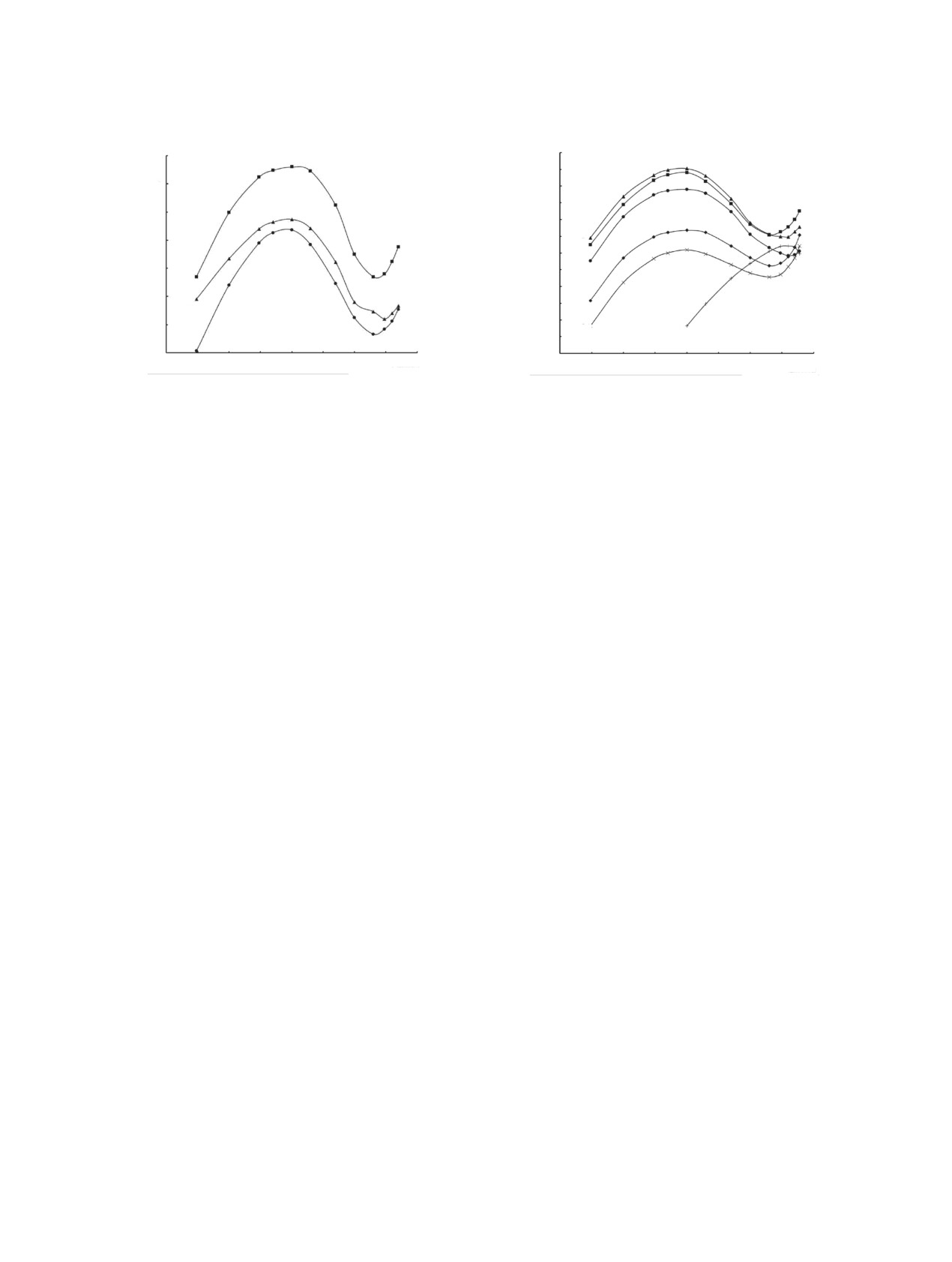
Рис.
4. Зависимость коэффициентов распределения
Рис.
3. Зависимость коэффициентов распределения
Eu(III) (1, 6), Nd(III) (2), Tm(III) (3), Lu(III) (4) и La(III)
Th(IV) (1), U(VI) (2) и Eu(III) (3) от концентрации HClO4
(5) от концентрации HClO4 в равновесной водной фазе
в равновесной водной фазе при экстракции растворами
при экстракции растворами 0.0003 моль/л соединений I
0.0001 моль/л соединения I в дихлорэтане.
(1-5) и IV (6) в дихлорэтане.
единение I, существенно выше, чем при экстрак-
ионами металлов участвуют комплексы триоксида
ции растворами КМФО Ph2Bu2 [9, 36] и диоксида
I с HClO4, концентрация которых в органической
IV [6]. Более высокая экстракционная способность
фазе растет с ростом концентрации HClO4 в водной
2-нонилпиридин-N-оксида по сравнению с триизо-
фазе. Поскольку увеличение [HClO4] в водной фазе
амилфосфиноксидом отмечалась при экстракции
в большей степени влияет на увеличение DLn при
хлорной кислоты растворами этих соединений в
экстракции тяжелых РЗЭ(III), с ростом [HClO4] от
дихлорэтане [37].
0.1 до 6 моль/л величина фактора разделения βLa/Lu
снижается от 63 до 0.6. Эффективность экстракции
Рассмотрено влияние концентрации HClO4 в
U(VI), Th(IV) и РЗЭ(III) соединением I из слабокис-
водной фазе на экстракцию U(VI), Th(IV) и РЗЭ(III)
лых (0.05-0.3 моль/л) растворов HClO4 значительно
растворами реагента I в дихлорэтане. При этом
наблюдаются две области концентрации HClO4,
выше, чем при экстракции из растворов 3 моль/л
HClO4 (рис. 3, 4). Это может связано с более вы-
резко отличающиеся характером зависимости lg D-
сокой устойчивостью комплексов, образуемых в
[HClO4] (рис. 3, 4). В области концентрации HClO4
результате координационной сольватации ионов
от 0.003 до 2 моль/л наблюдаются зависимости
металлов нейтральным лигандом I.
lg D-[HClO4] с максимумами, что связано с выса-
ливающим действием ионов ClO– и связыванием
Отметим, что характер зависимости lg DLn-
экстрагента хлорной кислотой. Влияние послед-
[HClO4] при экстракции растворами триоксида
него фактора особенно заметно проявляется при
I и БНФОС существенно различается: в случае
[HClO4] > 0.1 моль/л. По-видимому, в диапазоне
экстракции Eu(III) раствором диоксида IV наблю-
концентрации HClO4 от 0.003 до 2 моль/л экстрак-
дается увеличение DEu с ростом [HClO4] от 0.1 до
ция U(VI), Th(IV) и РЗЭ(III) осуществляется по
3-4 моль/л, после чего DEu снижается с увеличе-
механизму координационной сольватации ионов
нием [HClO4] (рис. 4). Аналогичные зависимости
металлов нейтральным экстрагентом. Дальнейшее
наблюдались при экстракции Am(III) растворами
увеличение концентрации HClO4 в водной фазе от
диоксида IV [6] или КМФО Ph2Bu2 [9].
2 до 6 моль/л сопровождается ростом коэффициен-
Стехиометрическое соотношение металл : экс-
тов распределения U(VI), Th(IV) и Eu(III)-Lu(III).
трагент в экстрагируемых комплексах определено
При экстракции Nd(III) и La(III) рост DLn наблюда-
методом разбавления. Полученные данные (рис. 5)
ется при [HClO4] выше 3 и 4 моль/л соответственно
показывают, что соединение I экстрагирует РЗЭ(III)
(рис. 4). По-видимому, при экстракции из раство-
и Th(IV) из растворов 0.1 моль/л HClO4 в основном
ров с [HClO4] > 2 моль/л в комплексообразовании с
в форме трисольватов, а U(VI) - в форме моно- и
РАДИОХИМИЯ том 63 № 1 2021
34
ТУРАНОВ и др.
lg D
lg D
3
3
2
2
1
2
3
1
1
1
4
5
0
0
2
5
7
4
6
3
-1
-1
5
4
3
–5
- 4
-3
lg [L]
lg [L]
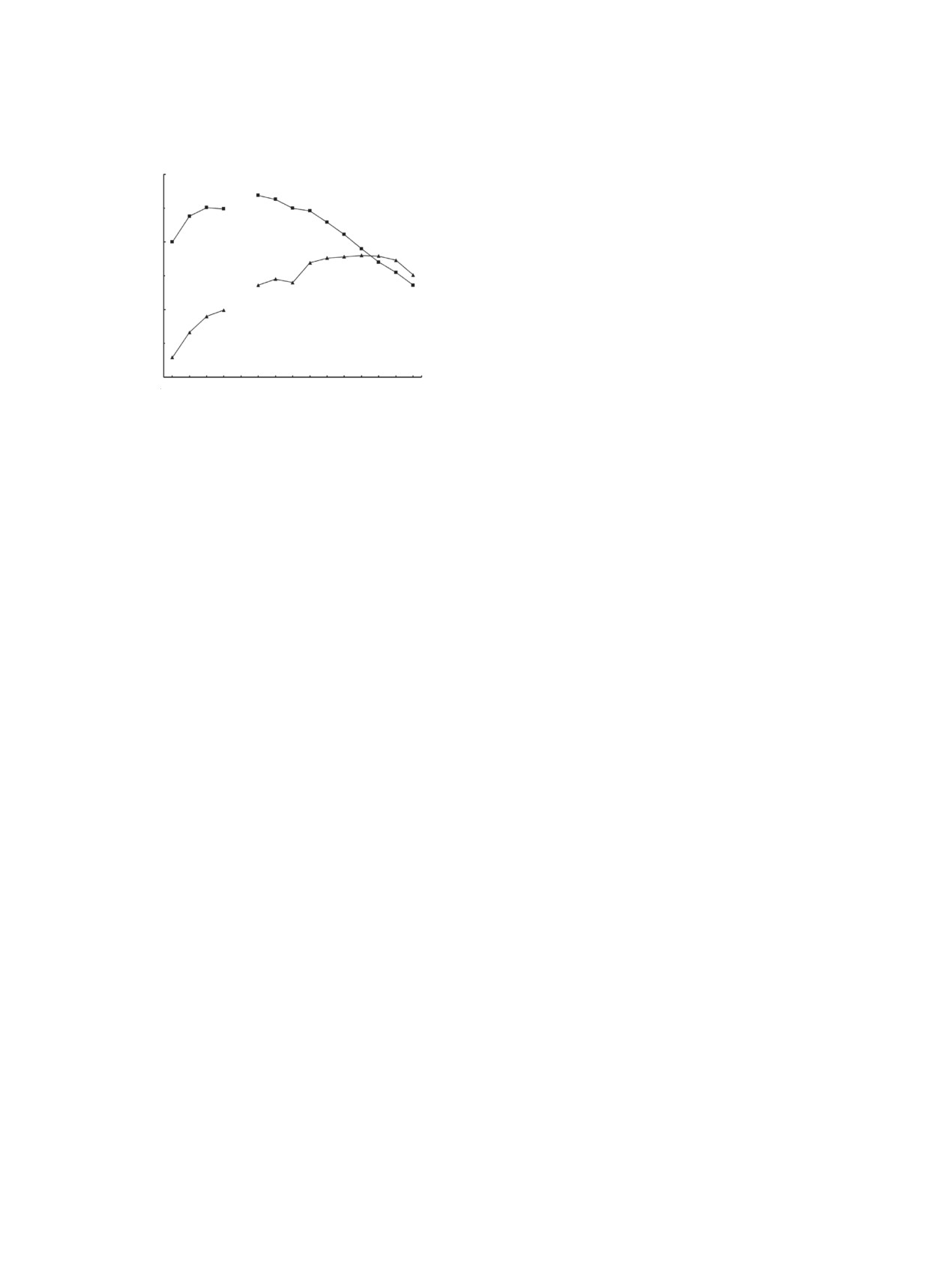
Рис.
5. Зависимость коэффициентов распределения
Th(IV) (1), U(VI) (2), Eu(III) (3), La(III) (4), Ho(III) (5),
Рис.
6. Зависимость коэффициентов распределения
Tm(III) (6) и Lu(III) (7) от концентрации соединения I
Th(IV) (1), U(VI) (2), Eu(III) (3), La(III) (4) и Lu(III) (5) от
в дихлорэтане при экстракции из раствора 0.1 моль/л
концентрации соединения I в дихлорэтане при экстрак-
HClO4.
ции из раствора 3 моль/л HClO4.
дисольватов. Ранее было показано [19], что из азот-
ной способности соединений I и IV проявляется в
нокислых растворов соединение I в дихлорэтане
значительно меньшей степени: DU(I)/DU(IV) = 4.2.
экстрагирует РЗЭ(III) и Th(IV) в виде дисольватов,
Это может быть связано с линейным строением ка-
а U(VI) - в форме моно- и дисольватов. Различие
тиона UO2+, препятствующим его взаимодействию
в стехиометрии комплексов РЗЭ(III) и Th(IV), экс-
со всеми тремя координирующими группами ли-
трагируемых из растворов HClO4 и HNO3, связано
ганда I.
со слабой координирующей способностью ионов
В области умеренной и высокой концентрации
ClO–, что исключает их непосредственную коорди-
HClO4 различие в экстракционной способности со-
нацию с ионами экстрагируемых металлов, в то вре-
единений I и IV по отношению к РЗЭ(III) значитель-
мя как при экстракции из нитратных сред отмечалась
но снижается. При экстракции Eu(III) из раствора
координация ионов NO– с катионами Ln3+ [20].
3 моль/л HClO4 растворами 3 × 10-4 моль/л соедине-
Стехиометрическое соотношение металл : экс-
ний I и IV в дихлорэтане значения lgDEu составляют
трагент в комплексах РЗЭ(III), U(VI) и Th(IV) с три-
1.64 и 1.19 соответственно, а DEu(I)/DEu(IV) = 2.8. В
оксидом I, экстрагируемых из растворов 3 моль/л
аналогичных условиях U(VI) и Th(IV) экстрагиру-
HClO4, близко к 1 : 3 (рис. 6).
ются триоксидом I значительно менее эффективно,
чем диоксидом IV: DU(IV)/DU(I) = 130, а DTh(IV)/
Проведено сопоставление экстракционной спо-
DTh(I) = 8.5.
собность триоксида I и диоксида IV по отноше-
нию к РЗЭ(III), U(VI) и Th(IV). При экстракции
Сопоставление значений DLn при экстракции
Eu(III) из раствора 0.1 моль/л HClO4 растворами 3 ×
РЗЭ(III) триоксидом I из растворов HClO4 и HNO3
10-4 моль/л соединений I и IV в дихлорэтане зна-
[19] показало, что из растворов хлорной кислоты
чения lg DEu составляют 3.4 и -1.15 соответствен-
РЗЭ(III) экстрагируются более эффективно, чем из
но, а величина DEu(I)/DEu(IV) равна 3.5 × 104. При
растворов азотной кислоты. Величина “перхлорат-
экстракции Th(IV) в этих условиях DTh(I)/DTh(IV) =
ного” эффекта, обычно выражаемая как отношение
165. Эти данные указывают на то, что триоксид I
коэффициентов распределения ионов металлов при
существенно превосходит диоксид IV по своей экс-
экстракции из растворов, содержащих ионы ClO4-
тракционной способности по отношению к Th(IV) и
и NO–, в сопоставимых условиях, K(ClO–/NO3-) =
РЗЭ(III). Одной из причин этого может быть увели-
DLn(ClO4-)/DLn(NO–), снижается с ростом концен-
чение в молекуле I числа координирующих групп,
трации соответствующих кислот. Так при экстрак-
принимающих участие в комплексообразовании с
ции Eu(III) растворами триоксида I в дихлорэтане
извлекаемыми ионами. При экстракции U(VI) из
увеличение концентрации кислот от 0.3 до 3 моль/л
раствора 0.1 моль/л HClO4 различие в экстракцион-
сопровождается снижением величины K(ClO4-/NO–)
РАДИОХИМИЯ том 63 № 1 2021
ЭКСТРАКЦИЯ РЗЭ(III), U(VI) И Th(IV) ИЗ ХЛОРНОКИСЛЫХ РАСТВОРОВ
35
мене фенильных радикалов при атоме фосфора на
lg DLn
алкильные или при увеличении длины алкиленово-
2
го мостика между группами Р(О) молекулы ДОДФ,
способствует повышению экстракции HNO3 и
HClO4 [9, 39], что приводит к значительному сни-
1
1
жению величины “перхлоратного” эффекта [7, 16].
Представленные данные показали, что структура
2
фрагмента, соединяющего фосфорильные группы в
0
молекуле экстрагента, оказывает существенное вли-
яние как на экстракционную способность в перхло-
ратных средах, так и на порядок экстрагируемости
-1
в ряду РЗЭ(III). 2,6-Бис(дифенилфосфорилметил)
La Ce Pr Nd Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
пиридин-N-оксид обладает высокой экстракцион-
Рис. 7. Экстракция РЗЭ (III) из растворов 3 моль/л HClO4
ной способностью по отношению к РЗЭ(III), U(VI)
(2) растворами 0.0003 моль/л соеди-
(1) и 3 моль/л HNO3
и Th(IV) в перхлоратных средах. Из слабокислых
нения I в дихлорэтане.
растворов HClO4 триоксид I экстрагирует эти эле-
от 3400 до 16. При экстракции из растворов 3 моль/л
менты значительно более эффективно, чем диоксид
HClO4 и HNO3 значения K(ClO–/NO–)уменьшаются
тетрафенилметилендифосфина.
“Перхлоратный”
эффект в системе с соединением I заметно проявля-
в ряду РЗЭ(III) от 51 для La(III) до 1.3 для Er(III), а
ется при экстракции U(VI), Th(IV) и РЗЭ(III) толь-
Tm(III), Yb(III) и Lu(III) экстрагируются из раство-
ко в области низкой концентрации HClO4 в водной
ра HNO3 даже несколько более эффективно, чем из
фазе. По мере увеличения концентрации кислот ве-
раствора HClO4 (рис. 7). Поскольку стехиометри-
личина “перхлоратного” эффекта снижается, а при
ческое соотношение Ln : I увеличивается от 2 до 3
концентрациях кислот выше 1 моль/л ионы Th(IV)
при переходе от азотнокислых сред к хлорнокис-
экстрагируются соединением I из растворов HClO4
лым, увеличение концентрации экстрагента в ор-
менее эффективно, чем из растворов HNO3, что свя-
ганической фазе приводит к увеличению величины
зано с высокой экстракционной способностью это-
“перхлоратного” эффекта в системе с триоксидом
го соединения по отношению к HClO4.
I. При экстракции Eu(III) и U(VI) раствором 1 ×
10-4 моль/л соединения I в дихлорэтане из раство-
ФОНДОВАЯ ПОДДЕРЖКА
ров 3 моль/л HClO4 и HNO3 величины K(ClO4-/NO–)
составляют 5.5 и 8.7 соответственно. Th(IV) в этих
Работа выполнена в рамках Государственного за-
условиях экстрагируется из раствора HClO4 менее
дания 2019 г. ИФТТ РАН, ИПТМ РАН, ИФАВ РАН и
эффективно, чем из раствора HNO3 [K(ClO4-/NO–) =
ИФХЭ РАН при частичной поддержке Российского
0.02].
фонда фундаментальных исследований (грант 18-
В системах с БНФОС “перхлоратный” эффект
29-24069).
проявляется в значительно большей степени, чем в
КОНФЛИКТ ИНТЕРЕСОВ
системе с триоксидом I: при экстракции Eu(III) рас-
творами КМФО Ph2Bu2 или диоксида IV из раство-
Авторы заявляют об отсутствии конфликта
интересов.
ров 3 моль/л HClO4 и HNO3 величины K(ClO4-/NO–)
составляют 3 × 105 [38] и >1000 [16] соответствен-
СПИСОК ЛИТЕРАТУРЫ
но. Резкое различие в экстракционном поведении
триоксида I и БНФОС в растворах HClO4 может
1. Розен А.М., Волк В.И., Вахрушин А.Ю. и др. //
быть связано с более высокой устойчивостью про-
Радиохимия. 1999. Т. 41, № 3. С. 205-211.
тонированного комплекса, образуемого соединени-
2. Чмутова М.К., Литвина М.Н., Прибылова Г.А. и
ем I, приводящей к более заметному снижению DEu
др. // Радиохимия. 1999. Т. 41, № 4. С. 331-335.
в результате соэкстракции HClO4. Отмечалось, что
3. Мастрюкова Т.А., Артюшин О.И., Одинец И.Л.,
изменение структуры БНФОС, приводящее к уве-
Тананаев И.Г. // Рос. хим. журн. 2005. Т. 49, № 2.
личению основности реагента, например, при за-
С. 86-96.
РАДИОХИМИЯ том 63 № 1 2021
36
ТУРАНОВ и др.
4. Мясоедова Г.В. // Рос. хим. журн. 2005. Т. 49, № 2.
Sep. Sci. Technol. 2012. Vol. 47. P. 2015-2023.
С. 72-75.
23. Rosario-Amorin D., Ouizem S., Dickie D.A. et al. //
5. Mrochek J.E., Banks C.V. // J. Inorg. Nucl. Chem. 1965.
Inorg. Chem. 2013. Vol. 52. P.3063-3083.
Vol. 27. P. 589-601.
24. Розен А.М., Николотова З.И., Карташева Н.А.,
6. Розен А.М., Николотова З.И., Карташева Н.А.,
Юдина К.С. // ДАН СССР. 1975. Т. 222, № 5. С. 1151-
Большакова А.С. // Радиохимия. 1978. Т. 20, № 5.
1154.
С. 725-734.
25. Туранов А.Н., Карандашев В.К., Баулин В.Е. // ЖНХ.
7. Smirnov I.V., Babain V.A., Shadrin A.Yu. et al. // Solvent
1998. Т. 43, № 2. С. 332-338.
Extr. Ion Exch. 2005. Vol. 23. P. 1-21.
26. Чаузов В.А., Студнев Ю.Н., Износткова М.Г.,
8. Чмутова М.К., Юссонуа М., Литвина М.Н. и др. //
Фокин А.В. // ЖОХ. 1987. Т. 57, № 1. С. 54-58.
Радиохимия. 1990. Т. 32, № 4. С. 56-61.
27. Туранов А.Н., Карандашев В.К., Баулин В.Е. и др. //
9. Чмутова М.К., Литвина М.Н., Нестерова Н.П. и др.
ЖНХ. 2015. Т. 60, № 8. С. 1117-1123.
р.// Радиохимия. 1990. Т. 32, N 5. С. 88-95.
28. Туранов А.Н., Карандашев В.К., Баулин В.Е.,
10. Chmutova M.K., Litvina M.N., Nesterova N.P. et al. //
Цветков Е.Н. // ЖНХ. 1995. Т. 40, № 11. С. 1926-
Solvent Extr. Ion Exch. 1992. Vol. 10, N 3. P. 439-458.
1930.
11. Туранов А.Н., Карандашев В.К., Яркевич А.Н.,
29. Nash K.L. // Radiochim. Acta. 1991. Vol. 54. P. 171-179.
Сафронова З.В. // Радиохимия. 2011. Т. 53, № 3.
30. Хольцбехер З., Дивиш Л., Крал М.и др. Органические
С. 225-228.
реагенты в неорганическом анализе. М.: Мир. 1979.
12. Tachimori S., Sasaki Y., Suzuki S.// Solvent Extr. Ion
752 с.
Exch. 2002. Vol. 20. P. 687-699.
31. Matveev P.I., Borisova N.E., Andreadi N.G. et al. //
13. Turanov A.N., Karandashev V.K., Baulin V.E. // Solvent
Dalton Trans. 2019. Vol. 48. P. 2554-2559.
Extr. Ion Exch. 2008. Vol. 26, p. 77-99.
32. Литвина М.Н., Чмутова М.К., Мясоедов Б.Ф.,
14. Аляпышев М.Ю., Бабаин В.А., Антонов Н.Г.,
Кабачник М.И. // Радиохимия. 1996. Т. 38, № 6.
Смирнов И.В. // ЖПХ. 2006. Т. 79, № 11. С. 1827-
С. 525-530.
1835.
33. Туранов А.Н., Карандашев В.К., Баулин В.Е.. //
15. Nash K. // Sep. Sci. Technol. 1999. Vol. 34. P. 911-929.
Радиохимия. 2001. Т. 43, № 1. С. 66-71.
16. Смирнов И.В. // Радиохимия. 2007. Т. 49, № 1. С. 40-
34. Horwitz E.P., Martin K.A., Diamond H., Kaplan L. //
49.
Solvent Extr. Ion Exch. 1986. Vol. 4, N 3. P. 449-494.
17. Bond E.M., Engelhardt U., Deere T.P. et al. // Solvent
35. Turanov A.N., Karandashev V.K., Baulin V.E. et al. //
Extr. Ion Exch. 1997. Vol. 15. P. 381-400.
Solvent Extr. Ion Exch. 2009. Vol. 27, N 4. P. 551-578.
18. Bond E.M., Engelhardt U., Deere T.P. et al. // Solvent
36. Стоянов Е.С., Воробьева Т.П., Смирнов И.В. // ЖСХ.
Extr. Ion Exch. 1998. Vol. 16. P. 967-983.
Т. 44, № 3. С. 414-424.
19. Туранов А.Н., Карандашев В.К., Калашникова И.П. и
37. Торгов В.Г., Николаева И.В., Дроздова М.К. // ЖНХ.
др. // Радиохимия. 2018. Т. 60, № 3. С. 213-216.
1999. Т. 44, № 6. С.1043-1049.
20. Rapko B.M., Duesler E.N., Smith P.H. et al. // Inorg.
38. Туранов А.Н., Карандашев В.К., Баулин В.Е.,
Chem. 1993. Vol. 32. P. 2164-2174.
Баулин Д.В. // Радиохимия. 2019. Т. 61, № 2. С. 117-
21. Nash K.L., Lavallette C., Borkowski M. et. al. // Inorg.
121.
Chem. 2002. Vol. 41. P. 5849-5858.
39. Розен А.М., Беркман З.А., Бертина Л.Э. и др. //
Радиохимия. 1976. Т. 18, № 4. С. 493-501.
22. Sulakova J., Paine R.T., Chakravarty M., Nash K.L. //
РАДИОХИМИЯ том 63 № 1 2021