РАДИОХИМИЯ, 2021, том 63, № 1, с. 23-29
УДК 621.039.3
ОПРЕДЕЛЕНИЕ РАСТВОРИМОСТИ RaF2 В ВОДЕ
© 2021 г. П. С. Буткалюка, И. Л. Буткалюка,*, А. А. Агаповб, А. С. Куприянова, Е. В. Казаковаа
а Научно-исследовательский институт атомных реакторов,
433510, Димитровград Ульяновской обл., Западное шоссе, д. 9
б Димитровградский инженерно-технологический институт Национального исследовательского ядерного
университета «МИФИ»,
433511, Димитровград Ульяновской обл., ул. Куйбышева, д. 294
*e-mail: Butkaluk-IL@yandex.ru
Получена 28.08.2019, после доработки 24.12.2019, принята к публикации 27.12.2019
Определена растворимость фторида радия в воде. Очистку радия проводили хроматографическим
способом с использованием сорбента BioRad AG-50×8 (NH4+) 200-400 меш. Осаждение проводили
добавлением к водному раствору очищенного Ra(NO3)2 спиртового раствора NH4F, полученный осадок
промывали этанолом, высушивали на воздухе. К сухому RaF2 добавляли бидистиллированную воду
и выдерживали 24 ч при термостатировании и перемешивании до наступления равновесия осадок-
раствор. От маточного раствора отбирали аликвоты для альфа-спектрометрического определения
226Ra. Растворимость в воде составила 0.763±0.153 г на 100 г раствора. Дополнительно была оценена
растворимость фторида радия в 96% этиловом спирте - ~7.4×10-5 г на 100 г раствора.
Ключевые слова: фторид радия, растворимость
DOI: 10.31857/S0033831121010044
ВВЕДЕНИЕ
примеры соосаждения очистки актиния методом
соосаждения с фторидом бария [6], авторы данной
В НИИАР разрабатывается технология получе-
работы рассматривали возможность исключения из
ния короткоживущих альфа-излучающих нуклидов
данной методики фторида свинца и использования
путем наработки их материнских изотопов 227Ac
фторида радия в качестве носителя для актиния и
и 228,229Th облучением 226Ra в реакторе СМ [1, 2].
тория.
Вследствие особенности конструкции оболочек ми-
Согласно работе [4], произведение растворимо-
шени в раствор облученного материала в значимых
сти фторида радия при 25°С составляет ~2×10-4,
количествах попадают примеси радиоактивных изо-
данное значение было вычислено из термодинами-
топов хрома, железа и кобальта [3]. Для отделения
ческих данных [7]. Экспериментальных данных о
радия, тория и актиния от указанных примесей ис-
растворимости фторида радия в воде не было найде-
пользуется осаждение их фторидов с использовани-
но. Растворимость фторида бария (как ближайшего
ем фторида свинца в качестве носителя. Фторид то-
аналога фторида радия) в воде составляет 0.1607 г/л
рия имеет низкую растворимость [4], достоверные
при 20°С [8]. Целью работы было эксперименталь-
литературные данные о произведении растворимо-
ное определение растворимости фторида радия в
сти фторида актиния отсутствуют, но известно, что
воде и уточнение его произведения растворимости.
он малорастворим в воде [5]. Согласно полученным
ранее экспериментальным данным, фторид актиния
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
практически количественно соосаждается с фтори-
Материалы и методы
дом свинца при с(Pb(NO3)2) ≥ 100 мг/л и концентра-
ции фторид-ионов, превышающей концентрацию
В работе использовали азотную кислоту квали-
азотной кислоты [3]. Так как в литературе известны фикации ос.ч. 27-5, нитрат бария и фторид аммо-
23
24
БУТКАЛЮК и др.
ния квалификации х.ч., 96% этанол квалификации
но-опасной, то целесообразно проводить работу с
«люкс» ГОСТ 5962-2013.
его миллиграммовыми количествами. При осажде-
Взвешивание аликвот и навесок проводили при
нии, а также промывке осадка неизбежны большие
помощи аналитических весов Sartorius BP 210 S. По-
потери радия вследствие его растворимости в воде.
казания массы записывали с точностью до 0.0001 г,
В спиртовых растворах степень гидратации ионов
уменьшается, что приводит к смещению равнове-
погрешность взвешивания составляла ±0.3 мг.
сия в сторону недиссоциированной формы веще-
Для разделения осадка и раствора использо-
ства, следовательно, растворимость солей в спирто-
вали лабораторную центрифугу периодическо-
вых растворах закономерно уменьшается. Поэтому
го действия ОПн-3.02 с частотой вращения до
решено было проводить осаждение из водно-спир-
3000 об/мин.
тового раствора и промывать осадок фторида радия
Для перемешивания растворов использовали ла-
этанолом. Для отработки методики осаждения фто-
бораторный шейкер с регулятором скорости враще-
рида радия предварительно провели эксперименты
ния LOIP LS-220. Для термостатирования исполь-
с имитатором радия - барием. RaF2 и BaF2 имеют
зовали термостат LOIP LT-200.
кубическую кристаллическую решетку, образованы
Для определения объемной активности гам-
катионами металлов с близким радиусом и одинако-
ма-излучающих радионуклидов 131Ва и 226Ra ис-
вым зарядом, поэтому с позиции электростатических
пользовали гамма-спектрометр SBS-50 с полупро-
взаимодействий данные соли являются аналогами.
водниковым Ge-Li детектором типа ДГДК 150.
Для подтверждения данных о растворимости
Источники для измерения представляли собой рас-
BaF2 был проведен эксперимент по определению
творы объемом 1.00 мл в стеклянных пробирках ди-
растворимости BaF2 в воде. Осадок BaF2 готовили
аметром 12 мм.
двумя способами - осаждением спиртовым и во-
Содержание 226Ra определяли с помощью аль-
дным растворами фторида аммония. 2 г Ba(NO3)2
фа-спектрометра на основе кремниевых PIPS-де-
растворяли в 100 мл бидистиллированной воды,
текторов ПДПА-1К (Институт физико-технических
разделяли раствор на 2 порции по 50 мл. Насыщен-
проблем, Дубна, Россия) и амплитудного анализа-
ный раствор NH4F в этаноле готовили следующим
тора импульсов АЦП-8К-И2. Образцы (источники)
образом. В 150 мл этанола вносили 20 г NH4F, пе-
для измерения активности альфа-излучения 226Ra
ремешивали, выдерживали осадок над раствором в
готовили нанесением 10-25 мкл анализируемо-
течение 24 ч для установления равновесия. Полу-
го раствора на подложку из нержавеющей стали с
ченный маточный раствор фильтровали через бу-
последующим упариванием и прокалкой на элек-
мажный фильтр «синяя лента». К первой порции
троплитке с открытой спиралью для отгонки 222Rn.
раствора Ba(NO3)2 добавляли 100 мл раствора NH4F
Перед измерением альфа-спектра подготовленный
с концентрацией 4 моль/л, ко второй - 150 мл на-
образец выдерживали в течение 1.5 ч, что необходи-
сыщенного раствора NH4F в этаноле, полученного
мо для снижения активности короткоживущих до-
ранее. Выдерживали полученные осадки BaF2 над
черних продуктов распада 222Rn. Для градуировки
маточными растворами в течение 24 ч для установ-
спектрометров использовали образцовые спектро-
ления равновесия, затем осадки промывали тремя
метрические альфа-источники (ОСАИ).
порциями бидистиллированной воды, сушили на
Содержание нерадиоактивных примесей в пре-
воздухе в течение 24 ч. К полученным высушенным
паратах 226Ra(NO3)2 определяли методом атом-
осадкам добавляли 120 мл бидистиллированной
но-эмиссионного анализа с использованием уста-
воды, выдерживали маточный раствор над осад-
новки, представляющей собой искровой источник
ком в течение 24 ч. Осадки отфильтровывали через
возбуждения спектров ИВС-28, смонтированный
бумажный фильтр «синяя лента». По 100 мл полу-
внутри радиационно-защитного бокса, и спектро-
ченных маточных растворов упаривали досуха. По
граф ИСП-1, соединенный с этим источником при
массе полученных сухих остатков определяли рас-
помощи оптического выхода.
творимость BaF2 в воде в обоих случаях.
Определение растворимости фторида бария
Определение растворимости фторида бария
в воде. Так как работа с 226Ra является радиацион-
в этаноле. Для определения растворимости BaF2
РАДИОХИМИЯ том 63 № 1 2021
ОПРЕДЕЛЕНИЕ РАСТВОРИМОСТИ RaF2 В ВОДЕ
25
в этаноле готовили насыщенный раствор BaF2 в
перемешиванием на лабораторном шейкере. Отби-
этаноле, который затем упаривали и определили
рали аликвоты для определения объемной актив-
массу сухого остатка. К 150 мл этанола добавляли
ности 131Ba методом гамма-спектрометрии через
2 г NH4F, перемешивали. Выдерживали в течение
каждый час.
24 ч для установления равновесия осадок-раствор.
Очистка препарата 226Ra. Был проведен экс-
Маточный раствор фильтровали через бумажный
перимент по определению растворимости RaF2 в
фильтр «синяя лента». К 100 мл раствора Ba(NO3)2
воде при термостатировании и перемешивании при
с концентрацией 0.077 моль/л добавляли 150 мл на-
25°С. Исходный препарат 226Ra был взят после ра-
сыщенного раствора NH4F в этаноле, полученного
диохимической переработки облученных радиевых
ранее. Осадок промыли тремя порциями этанола
мишеней [1] и содержал значительные количества
объемом по 20 мл и сушили на воздухе в течение
примесей солей железа, свинца, бария и др. Очист-
24 ч. К просушенному осадку добавляли 1100 мл
ку радия проводили методом катионообменной
этанола, выдерживали раствор над осадком в тече-
хроматографии с использованием сорбента BioRad
ние 24 ч для установления равновесия осадок-рас-
AG-50x8 (NH+) 200-400 меш на самотечной хрома-
твор. Осадок отфильтровывали через бумажный
тографической колонке объемом 2 см3 (высота h =
фильтр «синяя лента». 1000 мл полученного маточ-
55 мм, диаметр d = 7 мм). Предварительно сорбент
ного раствора упаривали досуха. Для определения
замачивали в бидистиллированной воде в течение
массы сухого остатка, полученного в результате
24 ч, затем полученной суспензией заполняли хро-
упаривания этанола, проводили контрольный опыт
матографическую колонку. Колонку промывали
с упариванием 1000 мл этанола и определением
20 к.о. (колоночный объем) бидистиллированной
массы сухого остатка.
воды, затем 10 к.о. 8 моль/л HNO3, затем 20 к.о. би-
Определение кинетики растворения фторида
дистиллированной воды и 10 к.о. ацетатно-аммиач-
бария. Для определения времени, необходимого
ного буферного раствора с pH 4.5 с концентрацией
для наступления равновесия осадок-раствор при
1 моль/л для переведения сорбента в NH+-форму. Во
осаждении BaF2, был проведен эксперимент по
всех хроматографических процессах скорость элю-
определению кинетики растворения BaF2 в биди-
ирования составляла 1 мл/(мин см2). Для контроля
стиллированной воде. 1.0610 г Ba(NO3)2 растворяли
очистки от примесей в раствор радия вводили ра-
в 15 мл бидистиллированной воды, вносили радио-
диоизотопную метку 131Ва. Сорбцию радия прово-
изотопную метку 131Ba. К раствору добавляли 60 мл
дили из аммиачно-ацетатного буферного раствора с
раствора, содержащего 1 г NH4F в этаноле. Выдер-
рH 4.5 с концентрацией 1 моль/л. Затем промывали
живали раствор над осадком в течение 24 ч, осадок
колонку 20 к.о. раствора 0.02 моль/л ЭДТУ (этилен-
центрифугировали в течение 10 мин, промывали
тремя порциями этанола с последующим центрифу-
диаминтетрауксусная кислота) в ацетатно-амми-
гированием осадка, осадок сушили в течение 24 ч.
ачном буферном растворе с pH 4.5 с концентраци-
Затем для полного удаления воды и спирта осадок
ей 1 моль/л. Примеси и радий элюировали 40 к.о.
прокаливали в течение 4 ч при 300°С. Удельная ак-
раствором ЭДТУ с концентрацией 0.02 моль/л с
тивность фторида бария на начало эксперимента
pH 8.0, контрольное элюирование проводили 20 к.о.
составила 9.13×107 Бк/г.
раствором ЭДТУ с концентрацией 0.02 моль/л с
В полипропиленовую пробирку вносили 70 мг
pH 9.5. Элюат собирали фракциями, затем объеди-
BaF2, содержащего радиоизотопную метку 131Ва,
няли фракции, содержащие радий и не содержащие
затем 10 мл бидистиллированной воды с темпе-
131Ва и после корректировки pH буферным раство-
ратурой ~95°С. Продолжали нагрев пробирки на
ром с pH 4.5 проводили дополнительную очистку
водяной бане в течение 4 ч, не доводя раствор до
радия сорбцией на второй колонке объемом 2 см3
кипения, каждый час отбирая аликвоты для опре-
(высота h = 55 мм, диаметр d = 7 мм) с сорбентом
деления объемной активности 131Ba методом гам-
BioRad AG-50×8 (NH+) 200-400 меш. Колонку про-
ма-спектрометрии.
мывали 10 к.о. раствором ЭДТУ с концентрацией
Через 4 ч прекращали нагрев и термостатиро-
0.02 моль/л в ацетатно-аммиачном буферном рас-
вали раствор и осадок при 25°С с одновременным
творе с концентрацией 1 моль/л. Затем промывали
РАДИОХИМИЯ том 63 № 1 2021
26
БУТКАЛЮК и др.
5 к.о. буферным раствором с pH 4.5 и концентра-
раствора массой 0.0568 г, которую после разбавле-
цией 1 моль/л, затем 5 к.о. бидистиллированной
ния HNO3 с концентрацией 1 моль/л до 10.3579 г
воды, примеси элюировали 40 к.о. 0.5 моль/л HNO3.
также использовали для определения активности
Радий элюировали 20 к.о. 8 моль/л HNO3. Элюат
226Ra методом альфа-спектрометрии.
упарили досуха в кварцевом стакане, сухой остаток
растворяли в бидистиллированной воде.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Определение растворимости RaF2 в воде и
Определение растворимости фторида бария
этаноле. Был проведен эксперимент по определе-
в воде. Найденное из первого эксперимента зна-
нию растворимости RaF2 в воде с термостатиро-
чение растворимости BaF2 при 25°C составило
ванием и интенсивным перемешиванием раствора
0.1725 г/100 г, из второго - 0.1739 г/100 г. Полу-
при 25°С. Кроме того, была определена раствори-
ченные значения близки к литературным данным
мость RaF2 в этаноле при той же температуре.
(0.169 г/100 г). Способ получения BaF2 (из водного
Сухой остаток Ra(NO3)2 растворяли в 200 мкл
или спиртового раствора) не влияет на его раство-
бидистиллированной воды, вносили в полиэти-
римость. Следовательно, методику осаждения фто-
леновую пробирку Эппендорфа, содержащую
рида с использованием спиртовых растворов можно
800 мкл насыщенного раствора фторида аммония
рекомендовать для получения RaF2 с целью сниже-
в этаноле. Выдерживали осадок в течение 24 ч для
ния его потерь при осаждении и промывке осадка
кристаллизации RaF2, затем отделили его от рас-
RaF2.
твора центрифугированием. Осадок промывали
Определение растворимости фторида бария в
3 порциями этанола объемом по 0.5 мл. От про-
этаноле. В табл. 1 приведены экспериментальные
мывного спиртового раствора отбирали аликвоту
данные по определению растворимости фторида
массой 0.1019 г, разбавляли бидистиллированной
бария в 96%-ном этаноле. Концентрацию этанола
водой до 0.7253 г и отбирали аликвоту для аль-
определяли по плотности (0.802 при 27°C). Соглас-
фа-спектрометрического анализа. Затем осадок
но полученным экспериментальным, данным мас-
сушили в течение 24 ч на воздухе. В пробирку
са сухого остатка при упаривании 1000 мл этано-
вносили
0.35 мл бидистиллированной воды и
ла составила 0.0059 г, в то время как масса сухого
перемешивали, выдерживали 24 ч для установ-
остатка при упаривании насыщенного спиртового
ления химического равновесия осадок-раствор
раствора BaF2 составила 0.0057 г. Растворимость
при термостатировании при 25°С. Как показали
BaF2 в этаноле настолько низкая, что можно лишь
предварительные эксперименты по установлению
оценить ее значение как не более 0.00009 г (3σ, где
равновесия осадок-раствор, проведенные с BaF2,
σ = 0.0003 г - погрешность определения массы на
равновесие наступает менее, чем за 10 ч выдержки
аналитических весах) на 100 г раствора при 25°С.
маточного раствора над осадком. Поэтому по ана-
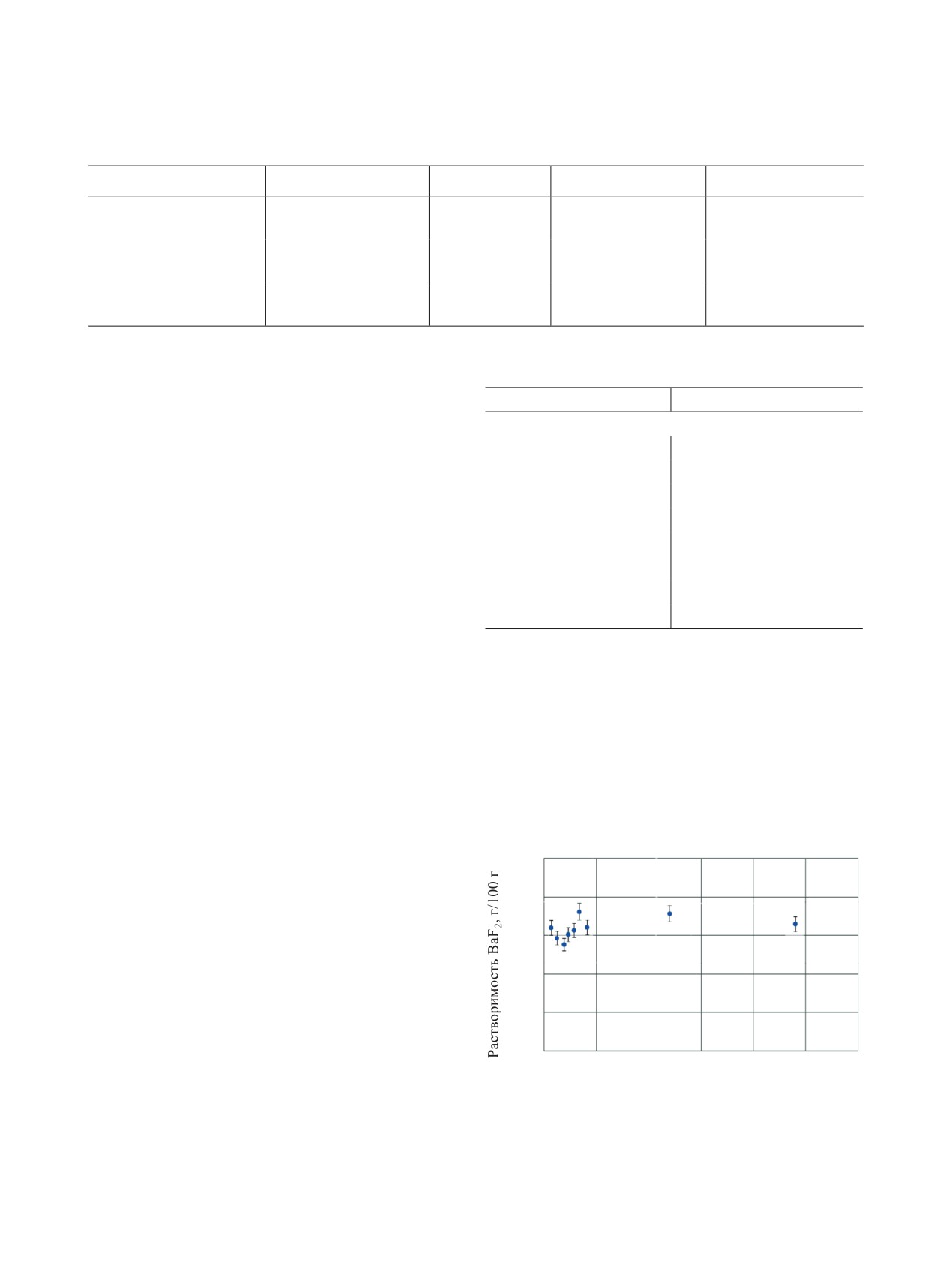
Определение кинетики растворения BaF2. На
логии было принято допущение о том, что равно-
рис. 1 представлена полученная зависимость рас-
весие осадок-раствор для RaF2 наступает менее,
творимости BaF2 в воде в зависимости от времени
чем через 24 ч после выдержки и при этом не про-
выдержки осадка над маточным раствором. Равно-
исходит существенного радиолиза раствора. Более
весие устанавливается менее чем за 10 ч.
длительное выдерживание осадка над раствором
Очистка препарата 226Ra. Характеристики по-
нецелесообразно из-за неизбежного радиолиза
лученного препарата радия определяли методами
осадка и возможного изменения кислотности рас-
альфа-, гамма- и атомно-эмиссионной спектроме-
твора и растворимости RaF2.
трии; они представлены в табл. 2.
Отделяли осадок от раствора центрифугиро-
Согласно результатам атомно-эмиссионной
ванием. От раствора отбирали аликвоту массой
спектрометрии, общее содержание примесей в пре-
0.0444 г, которую после разбавления HNO3 с кон-
парате составило 0.9 мас% относительно радия.
центрацией 1 моль/л до 10.3531 г использовали для
определения активности 226Ra методом альфа-спек-
Определение растворимости RaF2. При вы-
трометрии. Через 4 сут отобрали повторно аликвоту
числении молярных концентраций ионов Ra2+ и F-
РАДИОХИМИЯ том 63 № 1 2021
ОПРЕДЕЛЕНИЕ РАСТВОРИМОСТИ RaF2 В ВОДЕ
27
Таблица 1. Результаты эксперимента по определению растворимости BaF2 в этаноле
Состав раствора
m(пустого стакана), г
V(р-ра), мл
m(стакан+р-р), г
m(сухого остатка), г
Насыщенный BaF2 в
Ниже предела
96.1331
100
172.7021
95%-ном C2H5OH
обнаружения
Насыщенный BaF2 в
195.3489
1000
997.8
0.0057
95%-ном C2H5OH
Контрольный опыт -
193.9410
1000
995.4
0.0059
95%-ный C2H5OH
плотность насыщенного раствора RaF2 была взята
Таблица 2. Характеристики препарата 226Ra
равной ~1.0 г/см3.
m(226Ra), мг
14.45
При вычислении растворимости RaF2 учиты-
Масса примесей, мкг
вали следующие компоненты погрешности: по-
Ba
5.5
грешность отбора аликвот из исходного и разбав-
Ca
44
ленного растворов и разбавления (0.4-1.3%), по-
грешность эталона 226Ra и погрешность обработки
Cr
<5.5
α-спектра 4%. Для снижения случайной погреш-
Fe
<16.5
ности, возникающей за счет статистической при-
Ni
<5.5
роды α-распада, набор спектра проводили до по-
Pb
<16.5
лучения статистики в 105-106 импульсов. Для сни-
Pt
<16.5
жения погрешности отбора аликвот источники для
Si
28
α-спектрометрии готовили весовым методом. При
этом вводили поправку на испарение раствора с
поверхности источника за время взвешивания пу-
сорбцией радионуклида на стенках посуды, поверх-
тем построения градуировочного графика зависи-
ности наконечников пипеток принимали пренебре-
мости массы от времени и экстраполирования его
жимо малыми и не включали в суммарную погреш-
на момент нанесения раствора на источник. При
ность определения. На рис. 2 представлено изобра-
нанесении аликвоты раствора на подготовленную
жение полученного осадка RaF2.
подложку капля занимает большую площадь, в ре-
В результате экспериментов получили данные о
зультате чего начинается интенсивное испарение
растворимости фторида радия, представленные в
азотной кислоты. Таким образом, концентрация
табл. 3.
раствора достаточно быстро меняется, и за вре-
мя стабилизации показаний весов ошибка может
0.25
достигнуть нескольких процентов. Массу аликво-
ты раствора, нанесенную на подложку, определя-
0.20
ли следующим методом: после отбора раствора с
заданным объемом и нанесения его на подложку
0.15
начали отсчет времени по секундомеру, каждые
30 с фиксировали массу аликвоты, по достиже-
0.10
нии 3 мин останавливали секундомер, зависимость
массы раствора от времени аппроксимировали ме-
0.05
тодом наименьших квадратов и определяли массу в
0.00
момент времени t = 0.
0
10
20
30
40
50
60
Суммирование погрешностей отдельных ве-
t, ч
личин проводили по закону сложения ошибок [9].
Рис. 1. Зависимость растворимости фторида бария в
Иные потенциальные погрешности, связанные с
воде от времени контакта фаз.
РАДИОХИМИЯ том 63 № 1 2021
28
БУТКАЛЮК и др.
над осадком RaF2; mα - масса разведенной аликво-
ты для альфа-спектрометрического определения
содержания радия; А - активность радия, опреде-
ленная методом альфа-спектрометрии. При расче-
тах Ks0 (RaF2) приняли допущение, что коэффи-
циент активности для радия равен коэффициенту
активности для бария.
Ионную силу раствора рассчитывали по фор-
муле
Рис. 2. Осадок фторида радия.
n
1
2
I
c
z
,
i i
2
Расчет растворимости фторида радия проводи-
i1
ли по формуле
где сi - концентрация иона, моль/л; zi - заряд иона.
к-та
Коэффициент активности иона рассчитывали
по формуле (уравнение Девис):
где mRa - масса аликвоты раствора над осадком
RaF2, отобранная для определения содержания ра-
дия; mк-та - масса разведенной аликвоты раствора
Таблица 3. Результаты экспериментов по определению
растворимости фторида радия в воде
где A, B, C, δ - коэффициенты (константы), завися-
щие от температуры и состава раствора; I - значе-
Значение при времени
ние ионной силы раствора; z - заряд иона.
выдержки, сут
Параметр
Константу растворимости рассчитывали по
1
4
формуле
T, °C
25
25
K 0= γ(Ba2+)×[Ra2+]×(γ(F-) [F-])2
mRa, г
0.0444
0.0568
mα
0.0199
0.0171
Оцененная из экспериментальных величин рас-
mк-та
10.3531
10.3579
творимость фторида радия в воде как среднее зна-
чение двух точек составила 0.925±0.049 г на 100 г
A, Бк
21890
30267
раствора. В рамках работы было принято допуще-
s(RaF2), г/100 г раствора
0.819±0.043
1.03±0.054
ние о том, что равновесие осадок-раствор насту-
Ионная сила, моль/л
0.079
0.099
пает менее, чем через 24 ч после выдержки маточ-
ного раствора над осадком и что за это время не
γ(Ba2+)
0.37
0.34
происходит существенного радиолиза, способного
γ(F-)
0.78
0.76
повлиять на pH раствора.
Ks0(RaF2)
1.64×10-5
2.87×10-5
Экспериментально определенная раствори-
мость фторида радия в воде значительно выше
Таблица 4. Растворимость фторидов щелочноземель-
растворимости фторида бария, что является ожи-
ных элементов в воде
даемым результатом, так как растворимость фто-
ридов в ряду CaF2, SrF2, BaF2 в воде возрастает.
Соединение
Растворимость, г на 100 г р-ра
В табл. 4 представлены результаты по раствори-
CaF2
0.0016 при 18°С
мости фторидов щелочноземельных элементов в
SrF2
0.012 при 27°С
воде с учетом полученных данных.
BaF2
0.1607 при 20°С
Оценка растворимости RaF2 в этаноле. Со-
RaF2
0.925 (среднее значение) при 25°С
гласно полученным экспериментальным данным,
РАДИОХИМИЯ том 63 № 1 2021
ОПРЕДЕЛЕНИЕ РАСТВОРИМОСТИ RaF2 В ВОДЕ
29
оценочные значения растворимости RaF2 в этано-
янов А.С. // Сб. трудов АО «ГНЦ НИИАР». Дими-
ле при 25°С составили ~7.43×10-5 г на 100 г рас-
тровград: НИИАР, 2018, Вып. 2. С. 80-92.
твора при допущении, что равновесие в системе
2. Кузнецов Р.А., Буткалюк П.С., Тарасов В.А., Бара-
осадок-раствор достигается менее, чем за 24 ч,
нов А.Ю., Буткалюк И.Л., Романов Е.Г., Куприя-
при этом для BaF2 растворимость оценивается как
нов В.Н., Казакова Е.В. // Радиохимия. 2012. Т. 54.
№ 4. С. 352-356.
менее 9×10-5 г на 100 г раствора.
3. Кузнецов Р.А., Буткалюк П.С., Щербакова К.О. //
Научный годовой отчет АО «ГНЦ НИИАР». 2017.
ЗАКЛЮЧЕНИЕ
С. 174-177.
4. Новый справочник химика технолога. Химическое
Проделанные эксперименты показали, что
равновесие. Свойства растворов. СПб.: Профессио-
растворимость фторида радия намного выше
нал, 2004. С. 375.
растворимости фторида бария и составляет
5. Meyer G., Morss L.R. Synthesis of Lanthanide and
~0.925±0.195 г на 100 г раствора при 25°С, тог-
Actinide Compounds. Springer, 2012. 368 p.
да как для фторида бария она составляет 0.16 г
6. Волынский Л.Д., Гарбузов В.М., Цирлин В.А. // Радио-
на 100 г раствора при 20°С. Оцененная раство-
химия. 1987. Т. 29, № 5. С. 660-662.
римость фторида радия в этаноле составляют
7. Кумок В.Н., Кулешова О.М., Карабин Л.А. Произве-
~7.43×10-5 г на 100 г раствора.
дения растворимости. Новосибирск: Наука,
1983.
264 c.
СПИСОК ЛИТЕРАТУРЫ
8. Химическая энциклопедия. М.: Советская энцикло-
педия, 1988. Т. 1. C. 462.
1. Буткалюк П.С., Буткалюк И.Л., Тарасов В.А. Ро-
9. Золотов Ю.А. Основы аналитической химии. М.:
манов Е.Г., Кузнецов Р.А., Куприянов А.В., Купри-
Высш. шк., 2004. Т. 1. С. 38.
РАДИОХИМИЯ том 63 № 1 2021