РАДИОХИМИЯ, 2021, том 63, № 1, с. 13-17
УДК 621.039.7
ПОВЕДЕНИЕ Np(V) В РАСТВОРАХ HCOOH,
СОДЕРЖАЩИХ H2O И HClO4
© 2021 г. В. П. Шилов*, А. В. Гоголев, А. М. Федосеев
Институт физической химии и электрохимии им. А.Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, стр. 4
*e-mail: ShilovV@ipc.rssi.ru
Получена 03.07.2019, после доработки 03.10.2019, принята к публикации 16.10.2019
Методом спектрофотометрии изучена кинетика диспропорционирования Np(V) в растворах HCOOH, со-
держащих H2O и HClO4, при температуре 20-45°С. Скорость реакции на начальном участке описыва-
ется уравнением -d[Np(V)]/dt = k[Np(V)]2. Константа скорости k резко увеличивается с ростом [HClO4]
(порядок n = 3.5) и уменьшением содержания H2O (порядок n = -2.3). Возникающий Np(VI) медленно
восстанавливается до Np(V) муравьиной кислотой. Энергия активации реакции диспропорционирования
54 кДж/моль. Механизм включает отщепление молекулы H2O от иона H+q, присоединение протона к NpO+.
Протонированные ионы Np(V) образуют димер, который является активированным комплексом. Перенос
H в этом комплексе приводит к Np(IV) и Np(VI).
Ключевые слова: нептуний(V), муравьиная кислота, вода, хлорная кислота, диспропорционирование,
кинетика
DOI: 10.31857/S0033831121010020
Исследование поведения нептуния в различных
онирование. Реакция не идет при замене HCl на
степенях окисления в органических и смешанных
HClO4 [1].
растворителях представляет интерес в связи с ис-
В рамках систематических исследований
пользованием экстракции в технологии выделения
реакций актинидов в растворах карбоновых кислот в
актинидов из облученных материалов, с примене-
настоящей работе изучено диспропорционирования
нием таких сред в аналитической практике и при
Np(V) в растворах HCOOH, содержащих H2O и
синтезе некоторых соединений. Одной их ключе-
HClO4.
вых реакций в химии нептуния является реакция
диспропорционирования
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2NpO+ + 4H+ ⇄ Np4+ + NpO22+ + 2H2O.
(1)
Опыты выполняли с
237Np.
Очистку,
получение запасного раствора NpO2ClO4 и его
В зависимости от условий она протекает вправо
стандартизацию проводили по известной методике
либо влево. Увеличение концентрации H+ обеспе-
[2]. В работе использовали HClO4 квалификации
чивает диспропорционирование. Анионы, образу-
х.ч., HCOOH ч.д.а. (99.7% основного вещества).
ющие комплексы с Np4+ и NpO22+, сдвигают рав-
Для приготовления рабочих растворов применяли
новесие вправо. По аналогичной причине реакция
дважды дистиллированную воду. Концентрацию
идет в этом же направлении в слабокислых рас-
HClO4 в исходном растворе определяли
творах. К тем же результатам приводит снижение
титрованием. Содержание H2O и HCOOH в рабочих
содержания H2O. Например, в метанольных рас-
растворах оценивали по расчету.
творах в присутствии 1.5 моль/л HCl нептуний(V)
Методика эксперимента.В термостатированную
устойчив, если концентрация H2O ниже 0.1 мас%.
кварцевую кювету ( l = 1 см) с фторопластовой
Добавление H2O до 1% вызывает диспропорци-
пробкой вносили HCOOH, H2O и HClO4, через
13
14
ШИЛОВ и др.
Таблица 1. Зависимость ε от состава раствора
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
[H2O], моль/л
[HClO4], моль/л
981.4, л/(моль·см)
Опыты показали, что изменение состава рас-
3.5
1.0
481
твора в пределах, указанных в табл. 1, мало влия-
ет на положение максимума полосы поглощения
5.5
1.0
462
Np(V) при 980-982 нм, но несколько отражается
9.5
1.0
430
на величине молярного коэффициента погашения ε
15.4
1.0
376
(T = 24-25°С) в растворах HCOOH (измеренного на
спектрофотометре СФ-46).
15.4
1.99
365
Видно, что увеличение концентрации H2O сни-
15.4
2.98
357
жает величину ε из-за вытеснения водой молекул
15.4
4.97
338
HCOOH из смешанной координационной сферы
Np(V). Подобное явление наблюдали ранее [3]. В
= (650 ± 20) л/(моль‧см), в
безводном метаноле ε977
10 мин добавляли аликвоту раствора Np(V) и
водном растворе ε = 390 л/(моль‧см). Рост концен-
регистрировали спектр поглощения в диапазоне
трации HClO4 также влияет на координационную
340-1300 нм по отношению к кювете сравнения
сферу и снижает вероятность f-f-перехода.
с раствором того же состава, но без Np(V), с
В растворе, содержащем 18 моль/л HCOOH,
помощью спектрофотометра Shimadzu PC
3100
15.4 моль/л H2O и 1 моль/л HClO4, при 25°С на-
(Япония). Кинетические исследования проводили
блюдается медленное исчезновение Np(V). Реакция
по убыли Np(V) и накоплению Np(IV) при
останавливается, когда убыло около 13% Np(V). С
выбранных длинах волн, где расположены главные
ростом концентрации HClO4 и одинаковом содер-
полосы поглощения Np(V) и Np(IV), с помощью
жании H2O скорость исчезновения Np(V) увеличи-
спектрофотометра СФ-46 (ЛОМО, Россия). После
вается, повышается доля прореагировавшего Np(V).
прекращения реакции регистрировали спектр
В растворе 5 моль/л HClO4 в конце реакции остает-
поглощения на спектрофотометре Shimadzu PC
ся около 4% Np(V). На рис. 1 приведены спектры
3100, чтобы оценить содержание Np(VI). Каждый
поглощения раствора с начальной концентрацией
опыт повторяли 1-2 раза.
[Np(V)]0 = 1.80 ммоль/л в разные моменты времени.
Убыль Np(V) сопровождается появлением
D
0.7
Np(IV) и Np(VI), т.е. имеет место реакция (1). По-
этому кинетическое уравнение должно выглядеть
0.6
следующим образом:
0.5
1
-d[Np(V)]/dt = k[Np(V)]2
(2)
0.4
2
или в интегральной форме
0.3
1/[Np(V)] = kt + cons t ,
(3)
0.2
3
где k - константа скорости диспропорционирова-
0.1
3
3
2
2
ния. Кинетика реакции после замены [Np(V)] на
2
3
1
1
пропорциональную величину D = εl[Np(V)] может
0.0
быть представлена в координатах время-1/D.
600
800
1000
1200
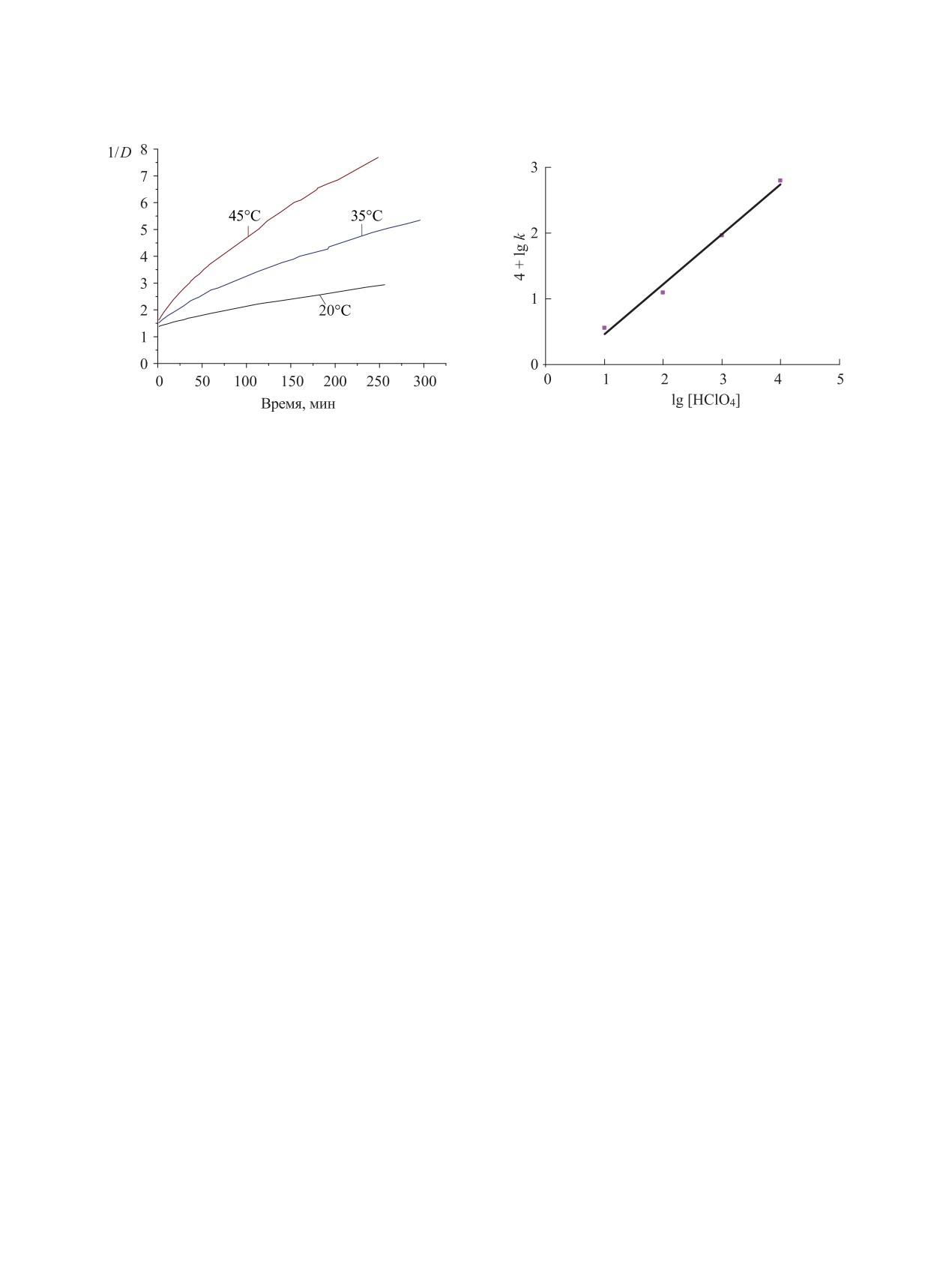
На рис. 2 приведены кинетические кривые ис-
Длина волны, нм
чезновения Np(V) в смешанном растворе HCOOH +
H2O, содержащем 4.97 моль/л HClO4, при темпера-
Рис.
1. Изменение спектра раствора, содержащего
туре 20, 35 и 45°С.
13.1 моль/л HCOOH,
15.44 моль/л H2O,
4.97 моль/л
HClO4 и 1.80 ммоль/л Np(V)0, во времени. Время после
Начальные участки спрямляются, но примерно
смешивания, мин: 1 - 0, 2 - 75, 3 - 337.
через 50 мин (20°С), а при 35 и 45°С раньше, на-
РАДИОХИМИЯ том 63 № 1 2021
ПОВЕДЕНИЕ Np(V) В РАСТВОРАХ HCOOH
15
Рис. 2. Анаморфозы кинетических кривых исчезновения
Рис.
3. Влияние
[HClO4] на константу скорости
Np(V). Концентрация, моль/л: HCOOH 13.1, H2O 15.4,
диспропорционирования в растворах HCOOH,
HClO4 4.97, Np(V) 1.80 × 10-3. T, oC: 1 - 20, 2 - 35, 3 - 45.
содержащих 15.4 моль/л H2O. T = 25.5°C.
блюдается отклонение вниз, т.е. по мере протекания
k = V/[Np(V)]2,
реакции диспропорционирования происходит ее за-
медление. Вызвано это восстановлением Np(VI)
где V - скорость убыли Np(V)
NpO2+ + HCOOH → NpO+ + COOH• + H+ (медленно),
V = ∆D/(εΔt).
(4)
В табл. 2 представлены значения k, полученные
NpO2+ + COOH• → NpO+ + CO2 + H+ (быстро).
(5)
в разных условиях.
Из приведенных в табл. 2 данных следует, что
Уменьшение содержания H2O при сохранении
константа скорости увеличивается с ростом кон-
концентрации HClO4 1 моль/л ускоряет диспропор-
центрации HClO4 и температуры или уменьшением
ционирование и увеличивает долю исчезнувшего
содержания воды. В координатах lg [HClO4]-lg k
Np(V). Например, в растворе 23.6 моль/л HCOOH,
экспериментальные точки лежат вблизи прямой,
3.5 моль/л H2O и 1 моль/л HClO4 через 96 ч остает-
имеющей наклон n = Δlg k/Δ[HClO4] = 3.5 (рис. 3).
ся около 21% Np(V) и никаких следов Np(VI).
Известно, что в растворах HClO4 + NaClO4 (I >
Необходимо отметить, что максимум полосы по-
5 моль/л) в интервале 72-92°С скорость убыли
глощения Np(V) мало зависит от состава раствора.
Np(V) пропорциональна [H+]2 [4]. Более резкая за-
Максимумы полос поглощения Np(IV) и Np(VI) в
висимость k от [HClO4] связана с дополнительным
растворе, содержащем 5 моль/л HClO4, расположе-
влиянием увеличивающейся ионной силы, что ха-
ны почти при длинах волн в чисто хлорнокислых
рактерно для взаимодействия двух одинаково заря-
средах. Снижение концентрации HClO4 и уменьше-
женных частиц.
ние содержания H2O сдвигают полосы вправо.
Влияние свободной воды (ион H+, как видно из
Для нахождения константы скорости диспро-
дальнейшего, отщепляет одну молекулу воды, поэ-
порционирования k использовали начальные участ-
тому принимаем, что он связывает одну молекулу
ки кинетических кривых убыли Np(V). В кювете с
H2O) можно проследить по рис. 4.
длиной оптического слоя l = 1 см и при λ = 981.4
В координатах lg [H2O]свободн - lg k эксперимен-
тальные точки лежат вблизи прямой, наклон ее n =
k = εΔ(D-1)/Δt.
Δlg k/Δ[H2Oсвободн] = -2.3. Найденная зависимость
В некоторых случаях константу скорости
показывает, что реакция протекает с отщеплением
находили по соотношению
2 молекул H2O. Более резкая, чем n = -2, зависи-
РАДИОХИМИЯ том 63 № 1 2021
16
ШИЛОВ и др.
Таблица 2. Влияние состава раствора и температуры на константу скорости диспропорционирования в растворах с
[Np(V)]0 = 1.80 ммоль/л
Концентрация, моль/л
k ×104,
T, °C
HCOOH
H
O
HClO4
л·моль-1·с-1
2
20
13.1
15.4
4.97
504
25.5
17.9
15.5
1.0
3.7
16.7
15.4
1.99
12.6
15.5
15.5
2.98
96.2
13.1
15.4
4.97
649
20.7
9.5
1.0
19/0
22.6
5.5
1.0
69
23.6
3.5
1.0
339
35
13.1
15.4
4.97
1462
45
13.1
15.4
4.97
2618
мость lg k от [H2O]свободн вызвана, вероятно, увели-
шения [H2O]свободн величина k выросла в 3 раза. По-
чением ионной силы раствора с уменьшением [H2O].
этому на резкую зависимость k от [HClO4] влияет
рост ионной силы раствора и снижение концентра-
В некоторых работах, например, [5, 6], предпо-
ции свободной воды.
лагается, что в хлорнокислых растворах Н+ суще-
ствует в виде иона Н5О+. В координатах lg ([H2O]0 -
Из температурной зависимости k в координа-
2[HClO4])-lg k наклон прямой n = -1.87. При испоь-
тах Аррениуса (рис. 5) была оценена энергия ак-
зовании разных моделей для структуры иона Нa+ и,
тивации реакции диспропорционирования Np(V)
следовательно, для концентрации свободной (не-
в растворах HCOOH, содержащих 15.4 моль/л H2O
связанной) воды результат близкий, т.е. скорость-о-
и 4.97 моль/л HClO4. Ее значение составляет 54
пределяющая стадия реакции протекает с отщепле-
3 кДж/моль, что несколько меньше энергии актива-
нием 2 молекул Н2О.
ции в хлорнокислых растворах.
Необходимо отметить, что при исследовании за-
Механизм процесса включает присоединение
висимости k от [HClO4] концентрация свободной
протона к иону NpO+ с одновременным отщепле-
H2O убывала от 14.4 до 10.4 моль/л. С учетом умень-
нием H2O, т.е. существует равновесие
Рис. 4. Влияние свободной воды [H2O]свободн = [H2O]0 -
[HClO4] в растворах, содержащих 1 моль/л HClO4, при
Рис. 5. Зависимость lg k реакции диспропорционирования
25.5°С на константу скорости диспропорционирования
Np(V) в растворе HCOOH, содержащем 15.4 моль/л H2O
Np(V).
и 4.97 моль/л HClO4, от обратной температуры.
РАДИОХИМИЯ том 63 № 1 2021
ПОВЕДЕНИЕ Np(V) В РАСТВОРАХ HCOOH
17
БЛАГОДАРНОСТИ
NpO+aq + H3O+ ↔ NpO2H2+ + H2O.
(6)
Авторы благодарны д. х. н. Г.В. Сидоренко за
Далее образуется катион-катионный комплекс
участие в обсуждении результатов работы и полез-
(Z)
ные советы.
NpO2H2+ + NpO2H2+ ↔ Z.
(7)
КОНФЛИКТ ИНТЕРЕСОВ
В результате термического активирования про-
Авторы заявляют об отсутствии конфликта
исходит перенос атома H в комплексе Z
интересов.
Z → NpO22+ + NpO2+ + H2O,
(8)
СПИСОК ЛИТЕРАТУРЫ
NpO2+ + 2H+ → Np4+ + H2O.
(9)
1. Асланишвили Н.А., Мефодьева М.П., Крот Н.Н. // Ра-
диохимия. 1974. Т. 16, № 6. C 817-822.
В координационной сфере каждого иона имеют-
2. Шилов В. П., Федосеев А. М. // Радиохимия. 2015.
ся молекулы H2O и HCOOH.
Т. 57, N 4. C. 348-351.
Скорость реакции передается уравнением
3. Шилов В.П., Бухтиярова Т.Н. //Радиохимия. 1991.
Т. 33, № 5. С. 87- 91.
-[Np(V)]/dt = k8[Z] = k8K7[NpO2H2+]2
= k8K7(K6[NpO2+][H3O+]/[H2O])2.
4. Колтунов В.С., Тихонов М.Ф. // ЖФХ. 1974. Т. 48,
№ 4. C. 860-864.
Обратная квадратичная зависимость скорости
5. Kazansky V.B. // Top. Catal. 2000. Vol. 11/12. P. 55-60.
реакции от концентрации Н2О близка к эмпириче-
6. Jones D.J., Rosiere J. // J. Mol. Struct. 1989. Vol. 195.
ски найденной зависимости.
P. 283-291.
РАДИОХИМИЯ том 63 № 1 2021