РАДИОХИМИЯ, 2020, том 62, № 6, с. 492-497
УДК 541.11:541.127:542.61
ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ АЗОТНОКИСЛЫХ
РАСТВОРОВ, СОДЕРЖАЩИХ МОНОЭТАНОЛАМИН
© 2020 г. А. С. Емельянова,b, Е. Р. Назинb, Е. В. Беловаа,*, Б. Ф. Мясоедова
а Институт физической химии и электрохимии им. А. Н. Фрумкина РАН,
119071, Москва, Ленинский пр., д. 31, корп. 4
б Научно-технический центр по ядерной и радиационной безопасности,
107140, Москва, ул. Малая Красносельская, д. 2/8, корп. 5
*e-mail: bl174@bk.ru
Получена 23.01.2020, после доработки 23.01.2020, принята к публикации 20.02.2020
Изучена термическая устойчивость азотнокислых (0.8-6.6 моль/л) растворов моноэтаноламина (МЭА) в
диапазоне температур 90-150°С при атмосферном давлении и давлении выше атмосферного (автоклав).
Установлено, что при атмосферном давлении взаимодействие компонентов раствора начинается при
100-105°С и концентрации НNО3 выше 1.4 моль/л, оно сопровождается газовыделением без тепловы-
деления. При нагреве растворов в автоклаве при определенных условиях возникают экзотермические
реакции с газовыделением, интенсивность которых зависит от концентрации компонентов и темпера-
туры. Определены характеристики экзотермических процессов. Показано, что из-за резкого повышения
давления в аппарате в результате экзотермических реакций упаривание азотнокислых растворов с МЭА
может представлять опасность возникновения аварий.
Ключевые слова: моноэтаноламин, азотная кислота, термическая устойчивость, экзотермические ре-
акции, газовыделение
DOI: 10.31857/S0033831120060040
Нагрев растворов азотной кислоты и восстано-
также высокой температурой кипения. Это позво-
вителей представляет потенциальную опасность
ляет провести сравнение с другими похожими по
вследствие возникновения интенсивных экзотер-
строению веществами и исследовать протекание
мических реакций окисления (тепловых взрывов).
химической реакции при атмосферном давлении
Информация о термической стабильности таких
без учета процесса кипения. Цель работы - оценка
растворов при проведении технологических опе-
тепловыделения и объема газообразных продуктов
раций радиохимических предприятий (РХП) пред-
экзотермических процессов в растворах с различ-
ставлена в работе [1]. Для оценки безопасности
ными концентрациями МЭА и НNО3.
операций с азотнокислыми растворами, содержа-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
щими восстановители, необходимы данные об их
термической стабильности: тепловыделение при
Эксперименты проводили с растворами, в ко-
взаимодействии компонентов (Q), температура
торых соотношение компонентов было близким к
начала экзотермической реакции (Тнэ), удельные
стехиометрическому с максимально возможным
объемы газообразных продуктов (Vвзр) в момент
тепло- и газовыделением. Концентрация HNO3
завершения экзотермических реакций.
в растворах составила 0.81, 1.39, 3.12, 4.82 и
6.6 моль/л (табл. 1). Смешивание компонентов про-
В данной работе проблема безопасности опера-
водили при постоянном интенсивном перемешива-
ции упаривания азотнокислых растворов с восста-
нии и охлаждении в интервале температур 5-10°С.
новителями была рассмотрена на примере раство-
ров HNO3, содержащих моноэтаноламин (МЭА).
Процессы газовыделения изучали волюмоме-
Изучение именно МЭА можно объяснить типич-
трическим способом [2] при атмосферном давле-
ным для большинства восстановителей строени-
нии и постоянной скорости нагрева исследуемой
ем (имеется аминная и гидроксильная группы), а
ячейки. Условия: температура термостата 100 и
492
ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ АЗОТНОКИСЛЫХ Р
АСТВОРОВ
493
105°С, выдержка 6 ч, объем образца 5 мл. В ходе
Таблица 1. Исходная концентрации (моль/л) МЭА и
нагрева определяли объем выделяющихся газов и
НNО3
температуру образца. Погрешность метода менее
Концентрация реагентов до термолиза, моль/л
5%.
HNO3
МЭА
Тепловые эффекты реакций в растворе опреде-
0.81 ± 0.01
0.31 ± 0.01
ляли в дифференциально-сканирующем калори-
1.39 ± 0.02
0.52 ± 0.02
метре ДСК-500. Образцы нагревали в герметизи-
3.12 ± 0.03
1.19 ± 0.03
руемых тиглях из нержавеющей стали [3]. Объем
4.82 ± 0.03
1.88 ± 0.03
образца составлял 5 мкл, скорость нагрева 0.5, 1, 2
6.6 ± 0.03
2.5 ± 0.03
и 5 К/мин. Максимальная потеря массы образца не
превышала 0.2 мг, что составляло не более 4 мас%.
выделения газов, объем газообразных продуктов
реакции) при изотермической выдержке представ-
Взаимодействие компонентов растворов при
лены в табл. 2.
давлении выше атмосферного изучали в автоклаве
[4] объемом 300 см3, снабженном датчиком давле-
Скорости выделения газообразных продуктов
ния и предохранительной мембраной. Температуру
при нагреве растворов с концентрацией НNО3 0.81
образца измеряли хромель-копелевой термопарой
и 1.39 моль/л малы, объем незначителен. Вероятно,
в защитном корпусе. Нагревание осуществляли
объем газов, выделившихся в разбавленных рас-
в воздушном термостате с регулируемым нагре-
творах, обусловлен упругостью паров и тепловым
ванием. Объем испытуемого образца составлял
расширением газов в свободном объеме автоклава.
30 см3. Погрешность определения давления менее
На отсутствие взаимодействия между реагентами
0.5%.
указывает и их неизменное содержание в растворе
Анализ составов растворов на содержание МЭА
после эксперимента по сравнению с исходным.
и НNО3 до и после опытов проводили с помощью
Химическое взаимодействие компонентов
кондуктометра Mettler Toledo S230 Seven Compact
в растворе начинается с концентрации НNО3
по методике [5]. В качестве титранта использовали
3.12 моль/л. При увеличении концентрации НNО3
растворы NaOH. Для сравнения рассчитали тепло-
до 4.82 моль/л объем газообразных продуктов
ту реакции и объем газообразных продуктов [6]
увеличивается почти в 2 раза, а скорость их вы-
для варианта полного окисления МЭА до СО2, N2
деления - в 5 раз. Концентрация компонентов для
и Н2Ож согласно уравнению (1)
раствора с содержанием НNО3 3.12 моль/л после
5C2H7NO + 13HNO3 = 9N2 + 10CO2 + 24H2O.
(1)
нагревания уменьшается примерно в 1.3 раза,
а для раствора с концентрацией 4.82 моль/л - в
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
1.6 раза.
Термическая устойчивость при атмосфер-
При температуре 105°С в растворе с концентра-
ном давлении. В экспериментах определяли
цией НNО3 4.82 моль/л взаимодействие компонен-
удельные объемы выделяющихся газов Vг и скоро-
тов протекает более интенсивно, чем при изотер-
сти их выделения W при нагревании азотнокислых
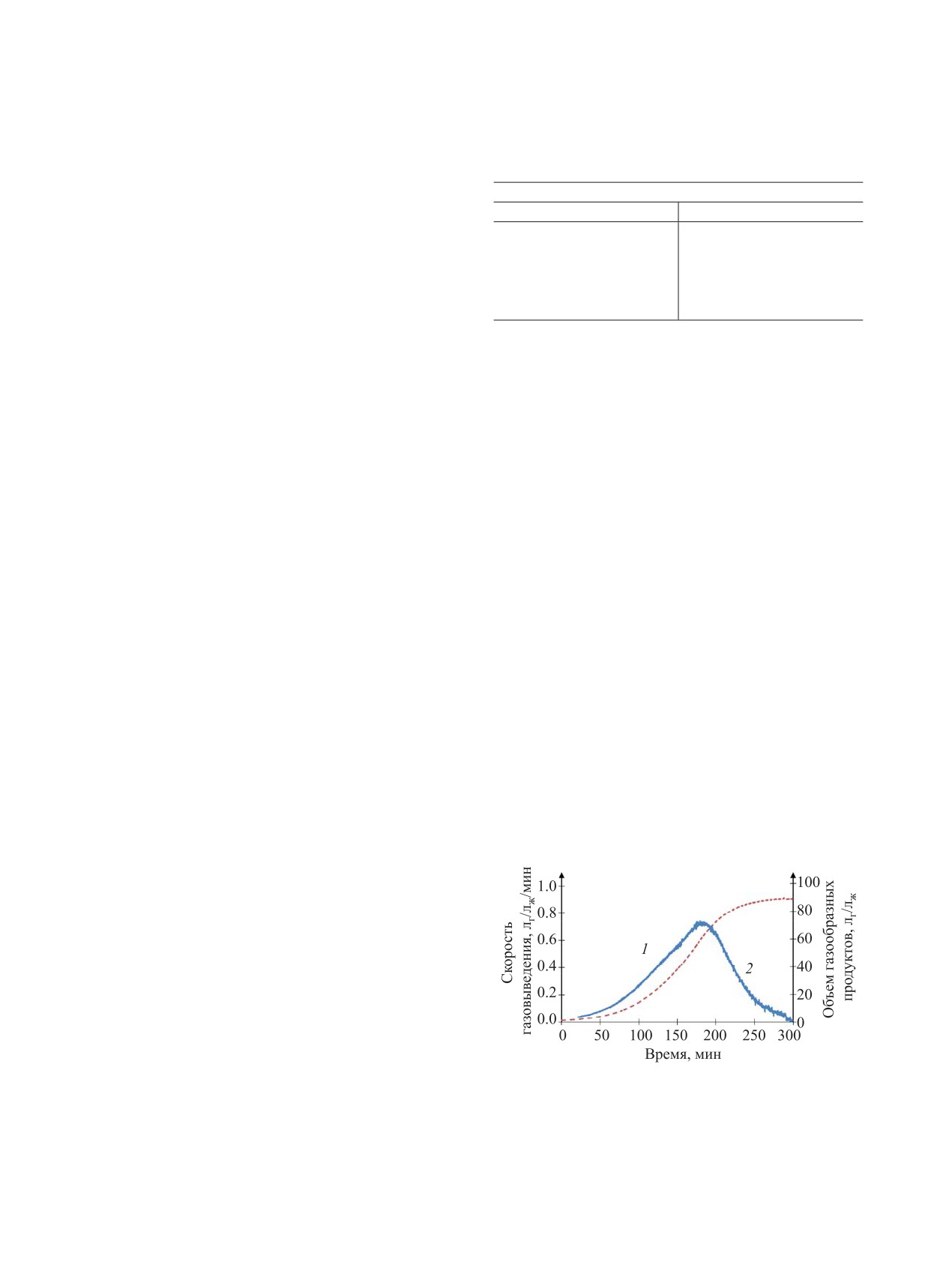
растворов в открытом сосуде. На рис. 1 представ-
лены типичные зависимости объема выделивших-
ся газов и скорости их выделения от температуры.
Как видно из рис. 1, кривая объема газообраз-
ных продуктов имеет S-образную форму, что
свидетельствует об автокаталитической стадии.
Скорость газовыделения характеризуется одним
максимумом. Экзотермических эффектов при на-
гревании растворов в открытом сосуде не зафик-
сировано. За 6-9 ч выдержки удалось определить
точный объем газообразных продуктов только для
Рис. 1. Изменение скорости газовыделения (1) и объе-
раствора с 4.82 моль/л НNО3, для всех остальных
ма газообразных продуктов (2) в растворе 4.82 моль/л
растворов данная характеристика не была полу-
НNО3 и 1.88 моль/л МЭА при температуре нагрева
чена. Характеристики газовыделения (скорость
100°С.
РАДИОХИМИЯ том 62 № 6 2020
494
ЕМЕЛЬЯНОВ и др.
Таблица 2. Значения скорости и объема выделения газообразных продуктов, а также концентрации НNО3 в зависи-
мости от исходной концентрации HNO3 и температуры нагрева
Концентрация НNО3
Концентрация НNО3
Температура
Объем газообразных
Максимальная скорость
в исходных растворах,
в растворах после
нагрева, °С
продуктов, лг/лр
газовыделения лг/(мин∙лр)
моль/л
термолиза, моль/л
0.81
0.76
<4.16
0.01
1.39
1.36
100
<8.6
0.01
3.12
2.53
54.20
0.15
4.82
3.01
90.43
0.75
4.82
2.98
105
96.48
0.87
Таблица 3. Значения тепловых эффектов экзотермической реакции для разной концентрации НNО3, полученные с
использованием ДСК-500 и путем расчета по уравнению (1)
Скорость сканирования,
Теплота экспериментальная,
Теплота расчетная,
Отношение экспериментальной и
К/мин
Дж/г
Дж/г
расчетной теплоты реакции
0.89 моль/л HNO3
1
203.4
385.7
0.53
5
228.4
0.59
1.39 моль/л HNO3
1
439.8
617.0
0.71
2
468.7
0.76
3.12 моль/л HNO3
0.5
1105
1373.5
0.80
1
1102
0.80
4.82 моль/л HNO3
0.5
1267
2014.1
0.63
1
1292
0.64
6.60 моль/л HNO3
0.2
1837
2752.6
0.67
0.5
1855
0.67
мической выдержке при 100°С.
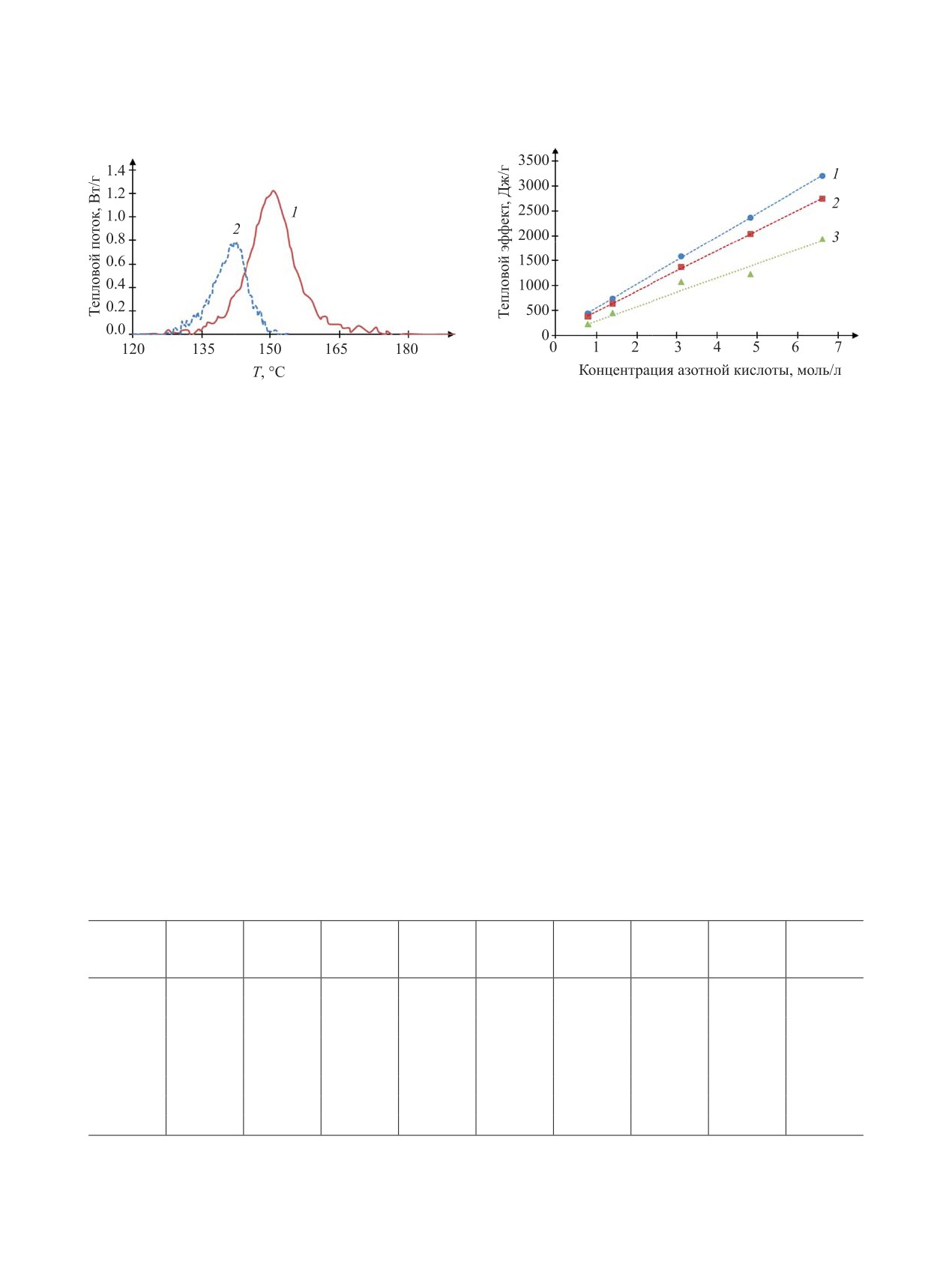
Тепловыделение значительно даже при низких
концентрациях МЭА и HNO3. Соотношение ве-
Термическая устойчивость при давлении
личин расчетного тепловыделения (реакционная
выше атмосферного. Изменение теплового по-
вода находится в жидком и газообразном состоя-
тока от температуры методом ДСК для раствора
нии) и экспериментальных данных продемонстри-
с концентрацией 1.39 моль/л HNO3 представлено
ровано на рис. 3.
на рис. 2. Расхождение фронтов экзотермических
Зависимость экспериментальной величины те-
эффектов (рис. 2) в координатах тепловой поток-
пловыделения от концентрации HNO3 можно ап-
температура доказывает наличие автокаталити-
проксимировать линейной функцией (линия 3 на
ческой стадии. По экспериментальным данным
рис. 3). Взаимодействие компонентов происходит
рассчитано тепловыделение Q при нагревании
не до продуктов полного окисления, что влияет на
растворов со стехиометрическим соотношением
величину теплового эффекта. Расхождение фрон-
компонентов (табл. 3).
тов экзотермических эффектов подтверждает на-
В исследованных растворах не реализуется
личие автокаталитической стадии при взаимодей-
вариант максимального тепловыделения при воз-
ствии МЭА с HNO3.
никновении экзотермической реакции, тепловой
Эксперименты в автоклаве. Дополнительную
эффект находится в интервале 53-80% от макси-
информацию о возникновении и развитии экзотер-
мального (в среднем составляет 68%). Значения
мических процессов в азотнокислых растворах с
тепловых эффектов для каждого раствора при раз-
МЭА представляют эксперименты нагрева при
ных скоростях сканирования мало отличаются (на
давлении выше атмосферного в автоклаве. Изме-
5-8%).
нение температуры растворов и давления при ис-
РАДИОХИМИЯ том 62 № 6 2020
ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ АЗОТНОКИСЛЫХ Р
АСТВОРОВ
495
Рис. 2. Зависимость теплового потока от температуры
Рис. 3. Зависимость величины интегрального тепло-
для раствора 1.39 моль/л HNO3 с 0.52 моль/л МЭА при
выделения от концентрации HNO3 по данным расчетов
скоростях нагрева 1 (1) и 2 К/мин (2).
(1 - H2Oж, 2 - H2Oг) и экспериментов (3).
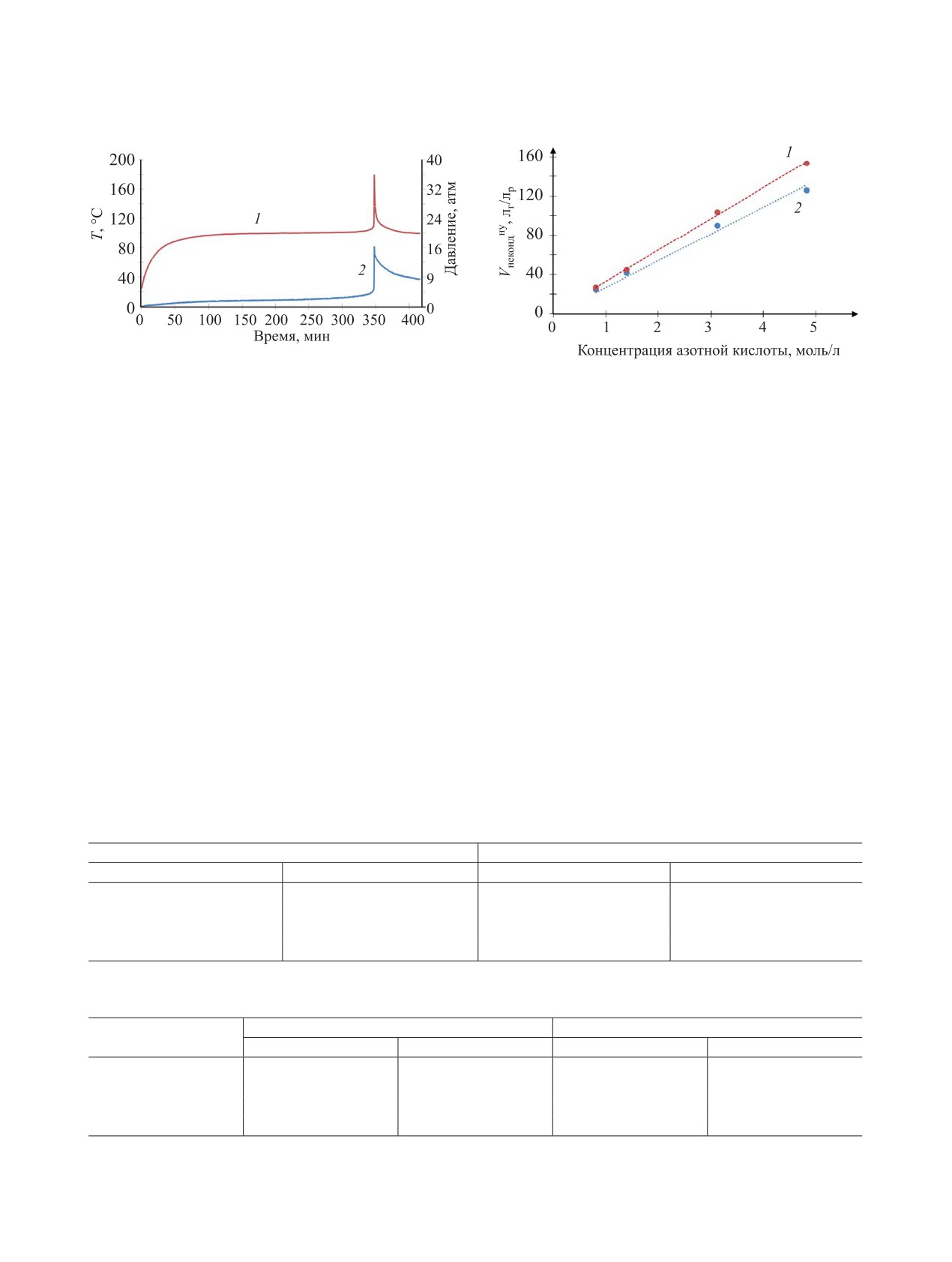
пытаниях в автоклаве представлено на рис. 4 на
личина), объемы неконденсируемых газов, при-
примере раствора с концентрацией 3.12 моль/л
веденные к нормальным условиям, и объемы не-
HNO3.
конденсированных газов (для варианта полного
окисления МЭА).
С определенной температуры начинается бы-
стрый саморазогрев с одновременным интен-
В растворе с концентрацией НNО3 0.81 моль/л
сивным выделением из раствора газообразных
тепловыделение незначительное, и только полови-
продуктов реакции. Экзотермический процесс за-
на величины от максимального давления создано
канчивается за 30-40 с, в результате достигается
за счет химической реакции. С увеличением кон-
максимальная температура смеси и давление га-
центрации НNО3 интенсивность экзотермических
зов. После этого температура раствора падает до
реакций (величина саморазогрева и объем газо-
температуры термостата, а давление уменьшается
образных продуктов) возрастает.
и становится постоянным (рис. 4).
При концентрациях НNО3 3.12-4.82 моль/л
Характеристики экзотермических процессов
удельные объемы газообразных продуктов взрыва
при нагревании в автоклаве (максимальное давле-
увеличиваются в 1.6-1.8 раз при повышении тем-
ние, температура) растворов стехиометрического
пературы термостата от 90-100 до 150°С. При этом
состава представлены в табл. 4. По ним рассчи-
величины саморазогрева для данных растворов
таны объемы газообразных продуктов на момент
близки (как и объемы неконденсируемых газов).
завершения теплового взрыва Vвзр (условная ве-
Данный факт может быть связан с захватом воды
Таблица 4. Экспериментальные значения индукционного периода (τинд, мин), величины разогрева смеси за счет те-
плоты химической реакции (ΔT, °С) и максимального давления газообразных продуктов, а также расчетные данные
по суммарному объему газов и объему неконденсированных газов (лг/лр) согласно уравнению (1)
Vнекондн.у.,
Vнекондн.у,
С(HNO3),
Vвзрыв, лг/
Vвзрыв, лг/
τинд, мин
Тнагр, °С
Тнэ, °С
ΔT, °С
рmax, атм
лг/лр
лг/лр
моль/л
лр (эксп.)
лр (расч.)
(эксп.)
(расч.)
0.81
-
150
150
2
9.4
60.7
60.7
24.8
26.8
1.39
130.8
150
150
33
13.2
77.4
100.4
41.8
44.4
3.12
69.3
150
137
81
30.1
161.4
234.0
91.5
103.4
123.8
110
109
79
16.1
91.3
88.2
4.82
33.3
150
120
94
49.3
253.9
347.1
132.6
153.4
78.6
110
107
100
29.2
154.4
124.8
138.9
100
99
98
28.3
153.1
126.2
393.8
90
90
111
28.5
155.7
119.2
РАДИОХИМИЯ том 62 № 6 2020
496
ЕМЕЛЬЯНОВ и др.
Рис. 4. Зависимость температуры образца (1) и давле-
ния газообразных продуктов (2) в автоклаве (100°С) от
Рис. 5. Зависимость теоретического (1) и эксперимен-
времени для раствора 3.12 моль/л HNO3 с 1.19 моль/л
тального (2) объема неконденсируемых газообразных
МЭА.
продуктов реакции от концентрации НNО3.
в виде аэрозоля и последующим интенсивным ис-
В условиях автоклава после завершения экзо-
парением в результате экзотермической реакции.
термической реакции происходит резкое снижение
Температуры начала экзотермических процес-
концентрации МЭА и НNО3 (практически на поря-
сов Тнэ зависят от концентрации НNО3 в растворе.
док). Можно сделать вывод о практически полном
Для растворов с концентрацией НNО3 от 0.81 до
протекании химической реакции при повышенном
4.82 моль/л они снижаются со 150 до 90°С. Вре-
давлении.
мя достижения Тнэ составляет от десятков минут
Сравнение расчетных величин с эксперимен-
до нескольких часов. Наглядно соотношение экс-
тальными показало, что в экзотермических про-
периментально определенного и расчетного коли-
чества неконденсируемых газов от концентрации
цессах при нагревании растворов выделяется
НNО3 в растворе продемонстрировано на рис. 5.
около 68% тепла от максимальной величины, при
Экспериментальные данные по объему некон-
этом имеется удовлетворительная сходимость
денсируемых газообразных продуктов аппрокси-
расчетных и экспериментальных значений Vг не-
мируются прямой линией (рис. 5) и незначительно
конденсируемых газов (рис. 5). Зависимость Vг
отличаются от расчетных величин, что свиде-
неконденсируемых газов от концентрации НNО3 в
тельствует о близких количествах газообразных
растворе может быть описана уравнением
продуктов реакции. Изменение концентраций ре-
Vг = 28.2С,
(2)
агирующих веществ после термолиза в автоклаве
представлено в табл. 5.
где С - концентрация НNО3, моль/л.
Таблица 5. Концентрации (моль/л) МЭА и НNО3 до и после термолиза в автоклаве
До термолиза
После термолиза
HNO3
МЭА
HNO3
МЭА
0.81 ± 0.01
0.31 ± 0.01
0.07 ± 0.003
0.04 ± 0.001
1.39 ± 0.02
0.52 ± 0.02
0.1 ± 0.01
0.06 ± 0.01
3.12 ± 0.03
1.19 ± 0.03
0.29 ± 0.03
0.16 ± 0.02
4.82 ± 0.03
1.88 ± 0.03
0.63 ± 0.04
0.22 ± 0.02
Таблица 6. Сравнение экспериментальных и расчетных величин тепловыделения (Q) и удельного объема неконден-
сированных газов (Vг)
Q, ккал/кг
Vг, л/л р-ра
НNО3, моль/л
расчет по (3)
эксперимент
расчет по (3)
эксперимент
0.80
60.6
48.5-58.5
29.4
28.3
1.56
115.8
105-112
57.8
55.1
3.01
214.8
238-263
111.5
109
4.36
298
302-308
161.5
136
РАДИОХИМИЯ том 62 № 6 2020
ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ АЗОТНОКИСЛЫХ Р
АСТВОРОВ
497
ной (критической) концентрации NO2. Достиже-
ние этой концентрации зависит от ряда факторов -
концентрации НNО3, температуры (скорости)
нагревания, времени контакта при повышенных
температурах. В открытом сосуде, по-видимому,
критическая концентрация NО2 не достигается, и
окисление идет с газовыделением, но без заметно-
го тепловыделения.
На основании проведенных экспериментов
можно констатировать, что условием возникно-
вения экзотермической реакции в азотнокислых
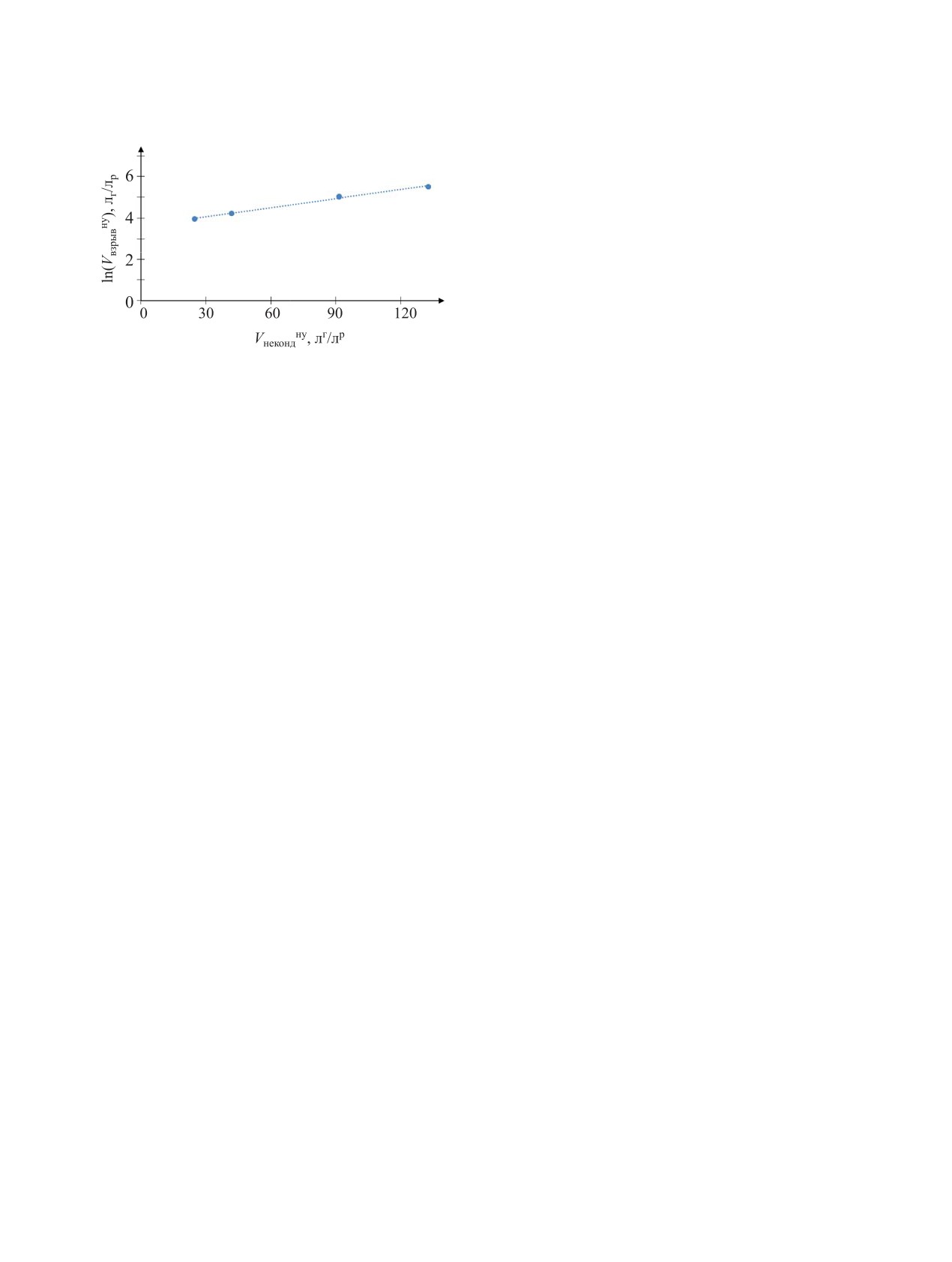
Рис. 6. Зависимость объема продуктов взрыва от объе-
растворах, содержащих МЭА, является их нагрев
ма неконденсированных продуктов.
до определенной температуры при давлении выше
атмосферного. Эти условия выполняются при
Экспериментальные данные свидетельствуют о
проведении операций упаривания, так как темпе-
том, что окисление МЭА в растворах происходит
ратуры упаривания сопоставимы с Тнэ и процесс
не по уравнению (1). Близость расчетных и экс-
проводится при небольшом избыточном давлении.
периментальных данных по Q и Vг достигается в
По результатам проведенных исследований
случае реакции
можно предположить, что уже при относительно
С2Н7ОN + 2.6НNО3 = 2СО + 4.8Н2О + NО2 +1.3N2.
(3)
невысокой степени упаривания азотнокислых рас-
с выделением 203 ккал тепла и 96.3 л газов.
творов с МЭА неизбежно возникнет экзотермиче-
Данные по максимальным величинам Q и Vг
ская реакция. Этому может способствовать и «га-
при 150°С приведены в табл. 6.
зификация» растворов. Интенсивность реакции и
По завершению экзотермической реакции в
количество выделяющихся газообразных продук-
свободный объем аппаратов выделяются газы и
тов определяется концентрациями НNО3 и МЭА.
пары воды, нагретые до максимальной температу-
По концентрации НNО3 в растворе можно прогно-
ры. Именно эта парогазовая смесь воздействует на
зировать максимальные величины давления в ап-
стенки аппарата. Объем ее в момент завершения
парате при упаривании азотнокислых растворов с
экзотермического процесса Vвзр имеет чрезвычай-
МЭА.
но важное значение для оценки взрывобезопасно-
КОНФЛИКТ ИНТЕРЕСОВ
сти.
Авторы заявляют об отсутствии конфликта
Определено, что эта величина линейно связана
интересов.
с расчетной (или экспериментальной) величиной
удельных объемов неконденсируемых газов Vг
СПИСОК ЛИТЕРАТУРЫ
(рис. 6) и ее можно оценить по эмпирическим за-
висимостям
1. Назин Е.Р., Зачиняев Г.М. Пожаровзрывобезопас-
ность технологических процессов радиохимических
lnVвзр = 0.0145Vг + 3.7,
(4)
производств. М.: НТЦЯРБ, 2009. 189 с.
или с учетом (2)
2. Belova E.V., Dzhivanova Z.V., Smirnov A.V., Kady-
lnVвзр = 0.40С + 3.7,
(5)
ko M.I., Stefanovsky S.V. // MRS Adv. 2017. Vol. 2,
где С - концентрация НNО3 в растворе, моль/л.
N 11. P. 627.
3. Емельянов А.С., Родин А.В., Белова Е.В., Виданов В.Л. //
Экзотермические процессы в азотнокислых
Физикохимия поверхности и защита материалов.
растворах с МЭА начинаются после достижения
определенных концентраций продуктов превраще-
2019. Т. 55, № 6. С. 582.
ния МЭА или HNO3 через промежуток времени.
4. Stefanovsky S.V., Skvortsov I.V., Belova E.V., Rodin A.V. //
Можно полагать, что возникновение таких про-
MRS Adv. 2017. Vol. 2, N 12. P. 641.
цессов связано с накоплением NO2, который, со-
5. Худякова Т.А., Крешков А.П. Кондуктометрический
гласно работе [7], активно окисляет органические
метод анализа: Учеб. пособие для вузов. М.: Высш.
вещества. В данных растворах он может образо-
шк., 1975. С. 182.
вываться за счет термического разложения НNО3.
6. Соколов И.П., Емельянов А.С. // Ядерн. и радиац.
Заметная экзотермическая реакция окисления в
безопасность. 2019. № 2 (92). С. 3.
растворах начинается при достижении определен-
7. Титов А.Н. // ЖОХ. 1948. Т. 18, № 3. С. 733.
РАДИОХИМИЯ том 62 № 6 2020