РАДИОХИМИЯ, 2020, том 62, № 2, с. 165-168
УДК 547.455:543.544:4547.455.5
СИНТЕЗ МЕЧЕННОЙ ТРИТИЕМ ДЕЗОКСИГЛЮКОЗЫ
И ЕЁ ПРОИЗВОДНОГО
© 2020 г. Г. В. Сидоров*, Н. Ф. Мясоедов
Институт молекулярной генетики РАН, 123182 Москва, пл. акад. Курчатова, д. 2
* e-mail: sidgv@img.ras.ru
Получена 24.12.2018; после доработки 25.03.2019; принята к публикации 26.03.2019
Изучена реакция твердофазного каталитического гетерогенного изотопного обмена 2-дезокси-D-глюкозы
и её производного - О(6)-(4-бромтиофенил)гуанин-С8-β-D-глюкозы - с тритием. Показано, что прове-
дение реакции твердофазного каталитического изотопного обмена в относительно мягких условиях при
110-120°С дает возможность синтезировать довольно лабильные соединения, меченные тритием, такие
как 2-дезокси-D-глюкоза и О(6)-(4-бромтиофенил)гуанин-С8-β-D-глюкоза. Молярная радиоактивность
полученных соединений составила 6.1 и 7.9 Ки/ммоль соответственно.
Ключевые слова: тритий, изотопный обмен, 2-дезокси-D-глюкоза, О(6)-(4-бромтиофенил)гуа-
нин-С8-β-D-глюкоза
DOI: 10.31857/S0033831120020100
ВВЕДЕНИЕ
является общим методом введения трития в кар-
богидраты, в частности в гексозы. В работе [3]
Для синтеза меченных тритием
2-дезокси-
приведена методика получения меченной тритием
D-глюкозы и её производного - О(6)-(4-бром-
[6-3H]D-глюкозы (18 Ки/моль) восстановлением
тиофенил)гуанин-С8-β-D-глюкозы - изучали вли-
1,2-О-изопропилиден-D-глюкуроно-6,3-лактона
яние температуры и катализаторов на выход и мо-
LiB3H4 (40 Ки/моль) в безводном тетрагидрофура-
лярную радиоактивность в реакции твердофазного
не. Описано получение [3-3H]D-глюкозы восста-
каталитического гетерогенного изотопного обмена
(ТКГИО) с тритием. Ранее нами была изучена ре-
новлением 1,2:5,6-ди-О-изопропилиден-α-D-рибо-
акция ТКГИО с гексозами [1]. Однако для 2-дезок-
гексофурано-3-улозы NaB3H4 в тетрогидрофуране
сигексоз подобные исследования не проводили.
в течение 3 ч [4]. 2-Дезокси-D-[2-3H]глюкоза была
получена восстановлением D-гликала (1,5-анги-
Большинство работ, посвященных введению
дро-2-дезокси-D-арабиногекс-1-енитола), раство-
трития в гексозы, относится к изучению различных
ренного в 1 мл тритиевой воды (50 мКи) с добав-
реакций в растворе. В работе [2] авторами была
лением 0.05 мл концентрированной серной кисло-
исследована подвижность атомов 1-Н углеводов в
реакциях гетерогенного изотопного обмена в фос-
ты. Удельная активность полученного соединения
фатном и боратном буфере и показано, что она из-
составила 24 мКи/моль. Удельная радиоактив-
меняется в ряду 2-дезокси-D-рибоза > 2-дезокси-
ность гексоз, получаемых этими методами, огра-
D-глюкоза > D-глюкозамин > D-галактозамин >
ничена удельной радиоактивностью источников
D-ксилоза > D-рибозо-5-фосфат > D-ликсоза >
трития - тритиевой воды или боргидрида - и ред-
L-арабиноза >D-рибоза >D-галактоза >D-манноза >
ко достигает величин порядка единиц Ки/ммоль.
D-глюкоза > L-фукоза > L-рамноза > D-глюкозо-6-
Была синтезирована 2-дезокси-D-глюкоза [2,6,6'-
фосфат. Авторы полагают, что различная подвиж-
3H] из производных бромдезоксиглюкозы
[4].
ность атомов 1-Н в углеводах объясняется концен-
Cмесь
2-бромпроизводного D-глюкопиранозида
трацией ациклических форм углеводов в растворе.
и D-маннопиранозида восстанавливали в раство-
Восстановление соответствующих предше-
ре метанола в присутствии палладиевого катали-
ственников тритийсодержащим боргидридом
затора в атмосфере газообразного трития. Затем
165
166
СИДОРОВ, МЯСОЕДОВ
Схема 1.
Br
S
O
HO
H
OH
N
N
OH
O
HO
H
O
N
( )8
N
NH2
OH
OH
HO
OH
I
H
II
полученную смесь восстанавливали KB3H4 в рас-
ния термической деструкции соединений в со-
творе трет-бутанола. После гидролиза раствором
став твердой фазы вводили инертный носитель -
1 моль/л HCl была получена 2-дезокси-D-глюкоза с
сульфат бария.
очень высокой удельной активностью 50 Ки/ммоль.
Целью настоящей работы являлось изучение
Методика довольно трудоемка, но позволяет до-
ТКГИО с тритием и синтез меченных тритием
стичь высокой степени включения изотопа. С на-
2-дезокси-D-глюкозы и О(6)-(4-бромтиофенил)-
шей точки зрения универсальным способом вве-
гуанин-С8-β-D-глюкозы с высокой молярной ра-
дения трития в карбогидраты является реакция
диоактивностью.
изотопного обмена без растворителя.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Следует отметить, что термическая устойчи-
Структуры исследуемых соединений приведе-
вость дезоксисахаров существенно ниже ана-
ны на схеме 1.
логичной в случае рибопроизводных. О(6)-(4-
бромтиофенил)гуанин-С8-β-D-глюкоза содержит
Все соединения были коммерческими препа-
атом брома, который в реакции с тритием может
ратами. Применяли катализаторы: А - 10% Pd/
BaSO4 (Fluka), Б - 5% Pd/BaSO4 (Fluka), В - 5%
быть замещен. Селективное введение трития в
Pd/CaCO3 (Aldrich). В качестве инертного носи-
реакции ТКГИО, не затрагивая другие функцио-
теля использовали сульфат бария (удельная по-
нальные группы, было продемонстрировано в ра-
верхность) 19 м2/г. Подготовка реакционной сме-
ботах [5, 6] при синтезе меченных тритием транс-
си аналогична описанной в работе [1]. Поскольку
зеатина и изопентениладенина соответственно.
О(6)-(4-бромтиофенил)гуанин-С8-β-D-глюкоза
С учетом этого изучение реакции ТКГИО с три-
(BTG) нерастворима в воде, нанесение проводили
тием проводили в относительно мягких условиях
из спиртового раствора.
в диапазоне температур 100-140°С. Для сниже-
Радиоактивность измеряли на жидкостном
Таблица 1. Влияние катализаторов и температуры на ре-
сцинтилляционном счетчике Triathler (Финляндия),
акциюТКГИО 2-дезокси-D-глюкозы с тритий-протиевой
используя сцинтилляционную жидкость EcoLM
смесью (1 : 500 по объёму). Продолжительность 20 мин
TM (ICN).
Меченая 2-DG
Пластинки после проведения тонкослойной
Номер
молярная
Катализатор
T, °С
выход,
хроматографии опрыскивали сцинтиллятором и
опыта
активность,
%
просчитывали на сканере по радиоактивности.
Ки/моль
1
A
130
46
19
Величину Rf рассчитывали по отношению време-
2
Б
130
7.0
33
ни детекции «пика» по радиоактивности к вре-
3
В
130
7.0
74
мени сканирования хроматограммы от старта до
4
В
120
15
40
фронта.
5
В
130
5
88
Выделение и очистку 2-дезокси-D-глюкозы про-
6
В
140
<1
217
водили методом ВЭЖХ на колонке Диасфер-110
РАДИОХИМИЯ том 62 № 2 2020
СИНТЕЗ МЕЧЕННОЙ ТРИТИЕМ ДЕЗОКСИГЛЮКОЗЫ
167
1
2
3
4
5
6
7
1
3
5
7
9
11 13 15 17 19 21
Время удерживания, мин
Время удерживания, мин
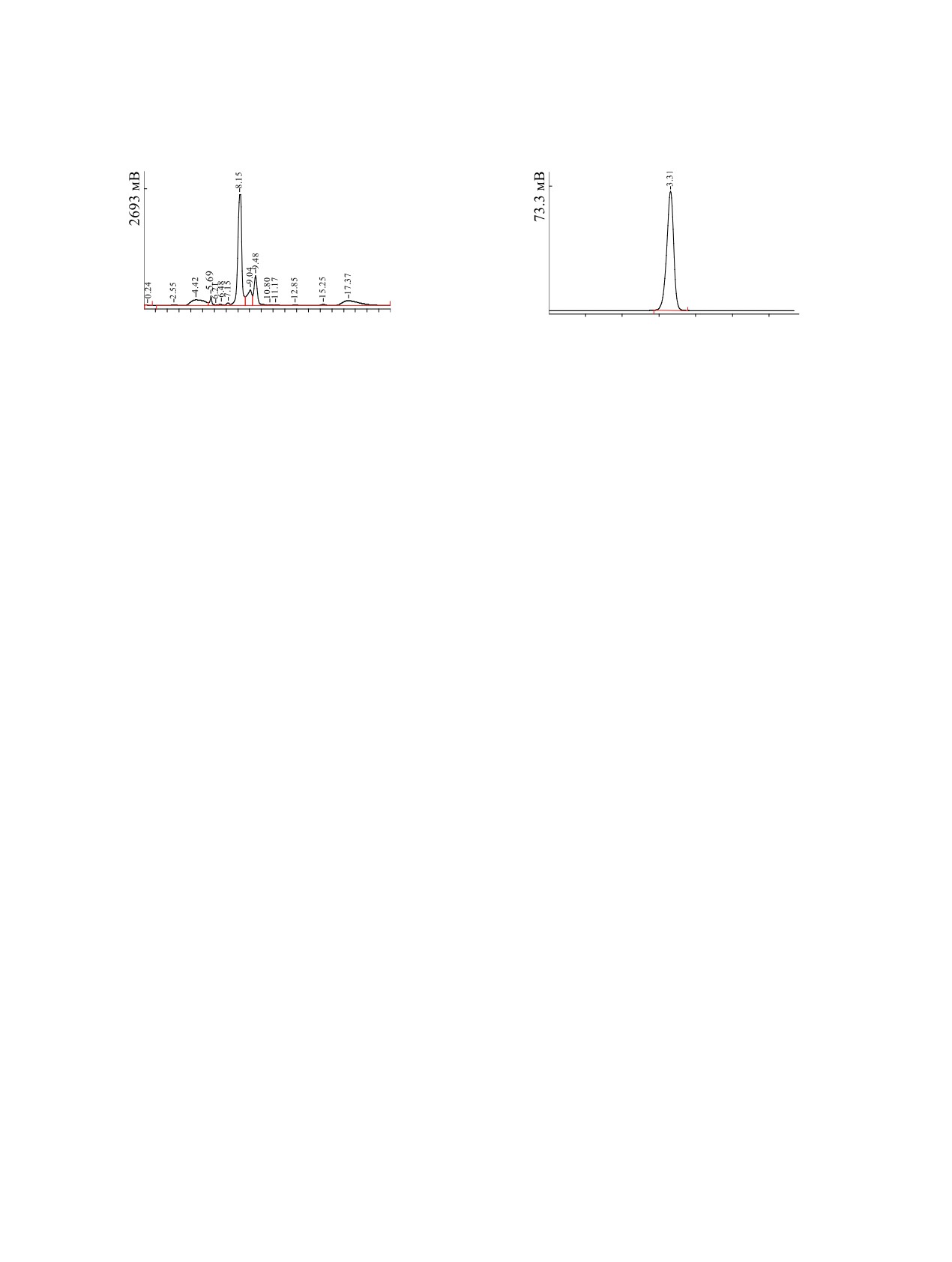
Рис. 1. Кривая элюции при выделении меченной три-
тием 2-дезокси-D-глюкозы из реакционной смеси. Ди-
Рис. 2. Анализ чистоты меченной тритием 2-дезок-
асфер-110 аминдиол, 4.6 × 250 мм, подвижная фаза -
си-D-глюкозы. Silufol, трет-бутанол-ацетон-вода-му-
ацетонитрил-вода (80 : 20 по объёму) 1.0 мл/мин.
равьиная кислота (44 : 44 : 11 : 0.3 по объёму).
аминдиол, 4.6×250 мм, подвижная фаза - ацетони-
Синтез меченых препаратов осуществляли в среде
трил-вода (80 : 20 по объёму), 1.0 мл/мин. Время
трития с концентрацией 90-95%.
удерживания - 5.76 мин. Детектором служил про-
Реакция ТКГИО. В стеклянную ампулу объё-
точный рефрактометр LKB-2142. Анализ прово-
мом 5 см3 помещали твердую смесь, состоящую из
дили методом тонкослойной радиохроматографии
носителя, препарата и катализатора. Ампулу при-
на пластинках Silufol в системе растворителей
соединяли к установке для работы с газообразным
трет-бутанол-ацетон-вода-муравьиная кислота
тритием, вакуумировали и вводили газ до давле-
(44 : 44 : 11 : 0.3 по объёму), Rf = 0.44.
ния 300 мм рт.ст. Ампулу термостатировали при
выбранной температуре, охлаждали и удаляли из
Выделение и очистку BTG проводили на колон-
ампулы избыток непрореагировавшего газа, про-
ке Reprosil-Pur C18 AQ 10 мкм, 250 × 10 мм с пред-
дукты реакции смывали водой (этанолом в случае
колонкой 50 × 10 мм., подвижная фаза ацетони-
BTG), отделяли катализатор центрифугировани-
трил-вода (60 : 40 по объёму), 2.0 мл/мин. Время
ем, растворитель отгоняли в вакууме досуха для
удерживания 8.15 мин. Использовали проточный
очистки от лабильного трития, растворяли продук-
УФ детектор с переменной длиной волны Specra-
ты реакции в подвижной фазе и проводили очистку.
Physics 8480, детекция при 282 нм. Анализ прово-
дили методом тонкослойной радиохроматографии
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
на пластинке с целлюлозой-F (Merck) в системе
В табл. 1 приведены результаты изучения вли-
растворителей бутанол-уксусная кислота-вода
яния катализаторов и температуры на реакцию
(2 : 1 : 1 по объёму), Rf = 0.42.
ТКГИО 2-дезокси-D-глюкозы
(2-DG) с трити-
Изучение реакции ТКГИО проводили в сре-
ем. Из данных табл. 1. видно, что при проведе-
де тритий-протиевой смеси (1 : 200 по объёму).
нии реакции в сравнимых условиях (опыты 1, 2,
Таблица 2. Влияние катализаторов и температуры на реакцию ТКГИО О(6)-(4-бромтиофенил)гуанин-С8-β-D-глю-
козы (BTG) с тритий-протиевой смесью (1 : 200 по объёму)
Номер опыта
T, °С (катализатор)
Молярная активность, Ки/моль
Выход, %
Продолжительность, мин
7
100 (А)
1.4
54
20
8
110 (А)
4.9
23
20
9
120 (А)
2.0
7,3
20
10
140 (А)
3.6
3,0
20
11
110 (Б)
9.6
18
10
12
110 (Б)
13.5
15
20
13
110 (Б)
26
9
30
14
120 (Б)
1.6
2,6
20
15
110 (В)
12.0
3,1
20
РАДИОХИМИЯ том 62 № 2 2020
168
СИДОРОВ, МЯСОЕДОВ
1
3
5
7
9
11 13 15 17 19 21
1
2
3
4
5
6
Время удерживания, мин
Время удерживания, мин
Рис. 3. Кривая элюции при выделении меченной три-
тием О(6)-(4-бромтиофенил)гуанин-С8-β-D-глюкозы
Рис. 4. Анализ чистоты меченной тритием О(6)-(4-
из реакционной смеси. Reprosil-Pur C18 AQ 10 мкм,
бромтиофенил)гуанин-С8-β-D-глюкозы. Целлюлоза-F
250×10 мм с предколонкой 50×10 мм, подвижная фаза -
(Merck). Бутанол-уксусная кислота-вода (2 : 1 : 1 по
ацетонитрил-вода (60 : 40 по объёму), 2.0 мл/мин.
объёму).
3 и 5) наиболее активным является катализатор
(1 : 1) до радиоактивной концентрации 1.0 мКи/мл.
В. Проведение реакции при 120°С позволяет до-
Был получен препарат меченной тритием О(6)-(4-
стичь оптимального соотношения выхода и мо-
бромтиофенил)гуанин-С8-β-D-глюкозы с моляр-
лярной радиоактивности меченной тритием 2-дез-
ной радиоактивностью 7.9 Ки/ммоль. Чистота по-
окси-D-глюкозы.
лученного препарата, определенная методом тон-
В условиях опыта № 4 был проведен пре-
кослойной радиохроматографии, оказалась равной
паративный синтез меченной тритием
2-дез-
более 98% (рис. 4).
окси-D-глюкозы. Кривая элюции при выделении
Таким образом, проведение реакции твердо-
2-дезокси-D-глюкозы из реакционной смеси при-
фазного каталитического изотопного обмена в от-
ведена на рис. 1. Фракции, отвечающие времени
носительно мягких условиях при 110-120°С дало
удерживания 5.76 мин, объединяли, упаривали до-
возможность синтезировать довольно лабильные
суха при 37°С и растворяли в смеси этанол-вода
соединения, меченные тритием, такие как 2-де-
(1 : 1) до радиоактивной концентрации 1.0 мКи/мл.
зокси-D-глюкоза и О(6)-(4-бромтиофенил)гуа-
Был получен препарат меченной тритием 2-де-
нин-С8-β-D-глюкоза. При этом удалось провести
зокси-D-глюкозы с молярной радиоактивностью
реакцию с сохранением атома брома в исходном
6.1 Ки/ммоль. Чистота полученного препарата,
соединении. Молярная радиоактивность получен-
определенная методом тонкослойной радиохрома-
ных соединений оказалась довольно высокой.
тографии, оказалась равной 99.6% (рис. 2).
КОНФЛИКТ ИНТЕРЕСОВ
В табл. 2 приведены результаты изучения вли-
яния катализаторов и температуры на реакцию
Авторы заявляют об отсутствии конфликта
ТКГИО BTG с тритием.
интересов.
Из полученных данных видно, что в сравнимых
СПИСОК ЛИТЕРАТУРЫ
условиях (опыты 8, 11 и 12, 15) наиболее актив-
1. Баитов А.А., Сидоров Г.В., Мясоедов Н.Ф. // Радио-
ными являются катализаторы Б и В. Однако выход
химия. 2010. Т. 52, № 5. С. 469.
целевого соединения выше в случае катализатора
2. Акулов Г.П., Снеткова Е.В., Каюмов В.Г., Камин-
Б. Оптимальными были выбраны условия опыта 12.
ский Ю.Л. // Радиохимия. 1987. Т. 29, № 5. С. 666.
Был проведен препаративный синтез мечен-
3. Isbell H.S., Frush H.L., Moyer J.D. // J. Res. Natl. Bur.
Stand. A: Phys. Chem. 1960. Vol. 64A, N 4. P. 359.
ной тритием BTG с высокопроцентным тритием в
4. Deschams J., Rousseau B., Beaucourt J.P. // J. Label.
условиях опыта 12 (табл. 2). Кривая элюции при
Compd. Radiopharm. 1988. Vol. 25, N 11. P. 1281.
выделении меченной тритием BTG из реакцион-
5. Сидоров Г.В., Мясоедов Н.Ф. // Радиохимия. 2006.
ной смеси приведена на рис. 3. Препарат, отвеча-
Т. 48, № 5. С. 465.
ющий времени удерживания 8.15 мин, упаривали
6. Сидоров Г.В., Мясоедов Н.Ф. // Радиохимия. 2015.
досуха при 37°С и растворяли в смеси этанол-вода
Т. 57, N 1. С. 94.
РАДИОХИМИЯ том 62 № 2 2020